基于金纳米颗粒-适配体缀合物的抗体载体及其制备方法与流程
[0001]
本发明涉及基于金纳米颗粒-适配体缀合物的抗体载体及其制备方法,更具体地,涉及通过将免疫球蛋白g(igg)特异性适配体与金纳米颗粒结合而具有将抗体递送至细胞中的改进能力的抗体载体及其制备方法。
[0002]
本申请要求于2019年6月5日提交的韩国专利申请no.10-2019-0066491的优先权和权益,其公开内容通过引用全部合并于此。
背景技术:
[0003]
抗体是能够最有效地识别异物并与异物结合的生物分子,在过去的40亿年中,它们一直保留在生物体中。抗体是y形免疫球蛋白分子,其特异性识别靶分子即抗原,并以高亲和力与抗原结合,并在脊椎动物免疫系统中起关键作用。通常,抗体从b淋巴细胞分泌或在b淋巴细胞的表面表达,并且具有高个体多样性。由于这种多样性和特异性,抗体可用作病原体或毒素的中和剂,它们是生物体中的靶标物质,募集免疫成分(补体,改善吞噬作用,源自自然杀伤细胞的细胞毒性抗体等),各种诊断程序,或销毁特定目标的治疗。
[0004]
特别地,由于对细胞外或细胞内抗原靶标的高度特异性,单克隆抗体(mab)被批准在世界范围内用于各种疾病的临床使用。自1986年首次批准mab以来,fda已经批准了大约50种mab。医学中使用的基于抗体的疗法可通过干扰蛋白质间相互作用或通过抑制信号转导途径来靶向目标蛋白质。然而,由于这些抗体中的大多数不能递送至靶细胞,因此fda批准的大多数抗体是靶向暴露于细胞表面的受体的抗体。例如,靶向在表面上高表达和暴露的her2受体的曲妥珠单抗(herceptin/herclon)有效地用于治疗her2阳性乳腺癌患者。
[0005]
必须克服其中必须通过与靶细胞中的生物分子缀合将抗体递送至细胞中以用作有效治疗剂的重大问题,并且根据纳米生物技术的发展,已经做出努力以使用各种纳米载体递送抗体进入细胞中。但是,已经使用跨膜肽、透明质酸、壳聚糖、右旋糖酐、多不饱和脂肪酸、树状聚合物和碳纳米管等各种物质将抗体递送到细胞中,但是这些抗体仅递送到体外培养的细胞中,并且对于体内递送没有有效的结果。而且,到目前为止开发出的技术只能通过包装和修饰特异性抗体来用于有限的用途。
[0006]
因此,迫切需要对递送系统进行研究,以将抗体容易且有效地递送至哺乳动物而没有细胞毒性。
[0007]
同时,金纳米颗粒(aunps)是一种新型纳米物质,其被开发为用于诊断的治疗剂和造影剂,目前已广泛用作ct、mri、正电子发射断层扫描(pet)、光声成像(pa)或诊断放射学中的光学相干断层扫描(oct)的造影剂,尤其用作ct的造影剂。由于金(au)的x射线吸收率和分子量均高于常规的碘造影剂,因此金的释放速度较慢,因此成像时间较长;生物相容性较高,因此毒性较低;并且用作造影剂具有较高的适用性,其量比常规ct造影剂少。此外,aunps具有出色的体内稳定性、大表面积(其可用于附着各种分子)的独特特性以及将生物分子(如肽和核酸)递送到细胞中并被用作细胞治疗剂的潜力。
[0008]
属于短长度的低聚物的适配体具有通过形成稳定的三维结构而以高亲和性与目
标物质特异性结合的特性,并且由于可以通过使用化学合成方法以低成本在短时间内大量生产且几乎没有批次间的差异,因此在生产率方面具有优异的优点。另外,适配体对周围的ph和温度具有非常高的稳定性,因此,最近,高度评价了其在环境和医学领域等各种领域中例如用于检测目标物质和开发疾病诊断传感器的适用性。
[0009]
因此,发明人打算开发一种抗体载体,其中适配体结合到具有优异的体内稳定性的aunp上,以有效地递送用于诊断或治疗疾病的抗体。
技术实现要素:
[0010]
【技术问题】
[0011]
在免疫球蛋白中,免疫球蛋白g(igg)最为丰富,发明人对igg的适配体进行了研究,其将应用或者使用在用于分析、开发新药和亲和纯化的潜在应用中,从而开发了一种新型的递送系统以通过结合能够与小鼠igg-fc结构域的共同区域结合的dna适配体和能够与荧光物质(其是异硫氰酸荧光素(fitc))的dna适配体以及金纳米颗粒(aunp)结合,来将抗体递送到细胞中。因此,完成了本发明。
[0012]
因此,本发明涉及提供一种抗体载体,其包含aunp;以及与aunp的表面结合的适配体。
[0013]
本发明还涉及提供一种制备抗体载体的方法,该方法包括将适配体与aunp结合。
[0014]
然而,本发明中要解决的技术问题不限于上述问题,并且本领域普通技术人员将从以下描述中充分理解本文中未描述的其他问题。
[0015]
【技术方案】
[0016]
为了实现上述目的,本发明提供了一种抗体载体,其包含aunp;和
[0017]
与aunp表面结合的适配体。
[0018]
另外,本发明提供了制备抗体载体的方法,该方法包括将适配体与aunp结合。
[0019]
在本发明的一个实施方案中,适配体可以是特异性结合免疫球蛋白g(igg)的fc结构域或荧光材料(异硫氰酸荧光素(fitc))的适配体。
[0020]
在本发明的另一个实施方案中,与igg的fc结构域特异性结合的适配体可以由seq id no:1的碱基序列组成。
[0021]
在本发明的另一个实施方案中,与fitc特异性结合的适配体可以由seq id no:2的碱基序列组成。
[0022]
在本发明的另一实施方案中,抗体载体可以通过将选自由igg、parp1、vp6、nsd2、aurora a、pax5、波形蛋白(vimentin)、rock-1、rock-2、rhoe、p53、mcl-1、p50和braf组成的群组中的一种或多种单克隆抗体与所述适配体结合来制备,并且其可以被递送到细胞中。
[0023]
在本发明的又一实施方案中,aunp的直径可以为10至20nm。
[0024]
在本发明的另一实施方案中,抗体载体可以将抗体递送至选自由细胞核、细胞质和线粒体组成的群组中的一种或多种中。
[0025]
另外,本发明提供了通过将抗体载体与待递送的抗体结合而形成的复合物。
[0026]
另外,本发明提供了用于预防或治疗癌症的药物组合物,其包含通过将抗体载体与待递送的抗体结合而形成的作为活性成分的复合物。
[0027]
另外,本发明提供了一种预防或治疗癌症的方法,该方法包括施用药物组合物,该
药物组合物包含通过将抗体载体与待递送至受试者的抗体结合而形成的复合物。
[0028]
另外,本发明提供了一种药物组合物的用于预防或治疗癌症的用途,该药物组合物包含通过将抗体载体与待递送的抗体结合而形成的复合物,该复合物作为活性成分。
[0029]
另外,本发明提供了通过将抗体载体与待递送的抗体结合而形成的复合物在生产用于预防或治疗癌症的药物中的用途。
[0030]
【有益效果】
[0031]
根据本发明所述的抗体载体通过将免疫球蛋白g(igg)fc结构域特异性适配体或荧光素异硫氰酸酯(fitc)特异性适配体与金纳米颗粒(aunp)结合来制备,并且通过将待递送的抗体与适配体特异性结合而将抗体递送至细胞核、细胞质和线粒体。另外,由于使用具有极低细胞毒性的aunp,因此抗体载体不仅对人体无害,而且还可以通过反射各种波长的光来容易地检测细胞中的位置,因此有望有效地用于诊断或治疗疾病。
附图说明
[0032]
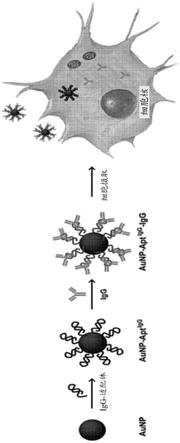
图1是说明根据本发明的一个实施方案的通过将免疫球蛋白g(igg)-fc结构域特异性结合的dna适配体和抗体结合金纳米颗粒(aunp)来制备适配体-aunp-抗体复合物的过程的示意图。
[0033]
图2a是一组共聚焦显微镜图像,其显示了根据本发明实施方案的通过aunp-apt
igg
将抗体递送到hela细胞中的能力。
[0034]
图2b是一组共聚焦显微镜图像,其显示了根据本发明的实施方案的通过aunp-apt
igg
将抗体递送至a549细胞的能力。
[0035]
图3是一组共聚焦显微镜图像,其显示了根据本发明实施方案的通过aunp-apt
fitc
将抗体递送至malme-3m细胞和sk-mel2细胞的能力。
[0036]
图4显示了根据本发明的一个实施方案的在用各种浓度(0、0.88、1.65和3.3nm)的aunp-apt
igg-braf
v600e
处理a2058、malme-3m和sk-mel2细胞并孵育之后测量细胞生存力的结果。
具体实施方式
[0037]
本发明提供了一种抗体载体,其包含金纳米颗粒(aunp);和
[0038]
与aunp的表面结合的适配体。
[0039]
在此使用的“纳米颗粒”包括具有纳米尺寸的直径的各种物质的颗粒,并且纳米颗粒没有特别限制,只要它是纳米尺寸的颗粒即可。
[0040]
本文中使用的“金纳米颗粒”是指具有纳米尺寸直径的金的金属颗粒,并且如此小的颗粒尺寸允许本发明的纳米颗粒渗透到靶细胞(例如人细胞)中,并允许蛋白质载体进入细胞中。
[0041]
aunp容易以稳定颗粒的形式制备,并且根据使用目的可以在0.8至200nm的范围内变化。另外,金可以与各种类型的分子如肽、蛋白质和核酸结合,从而改变其结构,并反射各种波长的光,从而容易地确定细胞中的位置。此外,与锰、铝、镉、铅、汞、钴、镍和铍等重金属不同,aunp对人体无害,使得它们具有很高的生物相容性,并且细胞毒性非常低。另外,当aunp的直径为100nm或以上时,丧失了作为纳米颗粒的特性,并且不具有纳米物质特性的金
表面与诸如硫醇基之类的官能团之间的结合变弱。由于具有在10至20nm之外的直径的aunp诱导细胞毒性,因此在本发明中,aunp优选具有10至20nm的直径,但是本发明不受限于此。
[0042]
本文使用的“适配体”是指寡核苷酸物质,其是具有稳定的三维结构并且能够以高亲和力和特异性结合至靶分子的单链核酸(dna、rna或经修饰的核酸),可以进行化学合成,并且在热量和ph变化方面具有相对灵活的特征。通过称为指数富集配体的系统进化(selex)的方法,可以开发出用于各种感兴趣的目标物质(蛋白质、肽、脂质、无机化合物、低分子有机物质、糖、染色物质、dna、金属离子、细胞、抗生素等)的适配体。
[0043]
在本发明中,适配体可以是与免疫球蛋白g(igg)的fc结构域特异性结合的适配体,其可以由seq id no:1的碱基序列组成,或者可以是与异硫氰酸荧光素(fitc)(其是被附着以标记被递送抗体的荧光物质)特异性结合的适配体,其可以由seq id no:2的碱基序列组成。这里,适配体的两个序列都可以在3'端具有硫醇基的修饰。
[0044]
根据本发明的抗体载体可以通过在与aunp结合的igg fc结构域特异性适配体与待递送的抗体的fc结构域之间的特异性结合而有效地将抗体递送至细胞,并且在此处,抗体载体可以通过将选自由igg、parp1、vp6、nsd2、aurora a、pax5、波形蛋白(vimentin)、rock-1、rock-2、rhoe、p53、mcl-1、p50和braf组成的群组中的一种或多种单克隆抗体与所述适配体结合来将抗体递送到细胞中,但是抗体载体不限于这种类型的抗体。
[0045]
另外,根据本发明的抗体载体可以通过结合aunp的fitc特异性适配体与fitc的特异性结合而将抗体递送到细胞中,所述fitc是用于标记待递送的抗体的荧光材料。在此,当用fitc标记抗体时,对抗体类型没有特别限制,但是根据本发明的示例性实施方案,抗体载体可以特异性地与用于标记igg的fitc结合,从而将igg递送到细胞中。
[0046]
在本发明中,抗体载体可以将抗体递送到细胞中,例如,将抗体递送到选自由细胞核、细胞质和线粒体组成的群组中的一种或多种中。
[0047]
另外,本发明提供了制备抗体载体的方法,该方法包括将适配体与aunp结合。
[0048]
在此,可以通过将与igg的fc结构域特异性结合的适配体与aunp结合或将与fitc特异性结合的适配体与aunp结合来制备抗体载体。
[0049]
另外,本发明提供了通过将抗体载体与待递送的抗体结合而形成的复合物。
[0050]
另外,本发明提供了一种用于预防或治疗癌症的药物组合物,其包含通过将抗体载体与待递送的抗体结合而形成的作为活性成分的复合物。
[0051]
本文中使用的术语“预防”是指通过施用根据本发明的组合物来抑制或延迟癌症的所有作用。
[0052]
本文使用的术语“治疗”是指通过施用根据本发明的组合物来减轻或有益地改变癌症症状的所有作用。
[0053]
本文所用的术语“药物组合物”是为了预防或治疗癌症而制备的,并且可以根据常规方法配制成各种形式。例如,可以将药物组合物配制成口服制剂,例如散剂、颗粒剂、片剂、胶囊剂、混悬剂、乳剂或糖浆剂,并且可以配制成用于皮肤外用的制剂,例如乳膏、凝胶剂、贴剂、喷雾剂、软膏剂、膏药、洗剂、搽剂、糊剂(pasta)或粘膜剂、栓剂或无菌注射液。
[0054]
根据本发明的药物组合物可以进一步包含载体、赋形剂和稀释剂,它们适合并通常用于制备药物组合物。在此,可以在组合物中使用的载体、赋形剂和稀释剂可以包括乳糖、右旋糖、蔗糖、寡糖、山梨糖醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、藻
酸盐、明胶、磷酸钙、钙硅酸盐、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、甲基羟基苯甲酸酯、丙基羟基苯甲酸酯、滑石粉、硬脂酸镁和矿物油。在制备中,可以用常规使用的稀释剂或赋形剂(例如填充剂、增稠剂、粘合剂、润湿剂、崩解剂、表面活性剂)配制组合物。用于口服的固体制剂可以是片剂、丸剂、散剂、颗粒剂或胶囊剂,并且这种固体制剂可以通过将至少一种赋形剂例如淀粉、碳酸钙、蔗糖、乳糖和明胶与有效成分混合来制备。另外,除了简单的赋形剂之外,还可以使用诸如硬脂酸镁和滑石粉之类的润滑剂。作为用于口服的液体制剂,可以使用混悬剂,内部使用的液体,乳剂或糖浆剂,以及常用的简单稀释剂,例如水或液体石蜡,以及各种类型的赋形剂,例如,可以包括润湿剂、甜味剂、香料和防腐剂。肠胃外施用的制剂包括无菌水溶液,非水溶剂,悬浮液,乳剂,冻干剂和栓剂。作为非水溶剂或悬浮液,可以使用丙二醇,聚乙二醇,植物油,如橄榄油,或可注射酯,如油酸乙酯。作为栓剂基质,可以使用witepsol,macrogol,tween 61,可可脂,月桂酸酯或甘油明胶。
[0055]
本发明的药物组合物可以根据所需方法经口或胃肠外(例如静脉内、皮下、腹膜内或局部)施用,并且剂量可以由本领域普通技术人员根据患者的状况和体重、疾病的严重程度、剂型、施用途径和持续时间适当选择。
[0056]
本发明的药物组合物以药学有效量施用。本文所使用的“药学有效量”是指足以以适用于医学治疗的合理的受益/风险比来治疗疾病的量,并且有效剂量可以通过包括患者的疾病类型、严重性、药物活性、对药物的敏感性、施用时间、施用途径和排泄率、治疗持续时间和同时使用的药物在内的参数以及医学领域众所周知的其他参数来确定。本发明的药物组合物可以单独施用或与其他治疗剂组合施用,并且可以与常规治疗剂顺序或同时施用,或以单剂量或多剂量施用。考虑到所有上述参数,重要的是以最小的剂量实现最大的效果而无副作用,并且本领域普通技术人员可以容易地确定这种剂量。该剂量可以一天一次或分多次施用。
[0057]
本文所使用的“癌症”是由具有以下特征的细胞引起的疾病的通用术语:侵略性特征,在该特征中,细胞分裂和生长,而不管正常的生长极限如何;侵袭性特征,在该特征中,细胞穿透到周围组织中;和转移特征,在该特征中,细胞扩散到身体的不同部位。在本发明中,癌症可以是选自由肝癌、乳腺癌、血液癌、前列腺癌、卵巢癌、胰腺癌、胃癌、结肠癌、脑癌、甲状腺癌、膀胱癌、食道癌、子宫颈癌、皮肤癌和肺癌组成的群组中的一种或多种,但本发明不限于此。
[0058]
另外,本发明提供了一种预防或治疗癌症的方法,其包括施用包含通过将抗体载体与待递送至受试者的抗体结合而形成的复合物的药物组合物。
[0059]
另外,本发明提供了药物组合物的用于预防或治疗癌症的用途,该药物组合物包含通过将抗体载体与待递送的抗体结合而形成的作为活性成分的复合物。
[0060]
另外,本发明提供了通过将抗体载体与待递送的抗体结合而形成的复合物在生产用于预防或治疗癌症的药物中的用途。
[0061]
另外,本发明提供了递送抗体的方法,其包括将复合物施用至受试者中。
[0062]
本文使用的术语“受试者”是指需要诊断或治疗疾病的靶标,更具体地说,是指哺乳动物,例如人或非人灵长类动物、小鼠、大鼠、狗、猫、马或牛。
[0063]
本文所用的术语“施用”是指通过合适的方法向受试者提供本发明的复合物。
[0064]
在本发明的一个实施方案中,制备其中igg fc结构域特异性适配体与aunp缀合的
抗体载体(aunp-apt
igg
)和其中fitc特异性适配体与aunp缀合的抗体载体(aunp-apt
fitc
)(参见实施例2),并且作为确认通过aunp-apt
igg
将抗体递送至细胞的能力(参见实施例3)和通过aunp-apt
fitc
将抗体递送至细胞的能力(参见实施例4)的结果,确认通过抗体载体aunp-apt
igg
和aunp-apt
fitc
有效地将抗体递送到细胞中。
[0065]
在本发明的另一个实验实施例中,由于使用aunp-apt
igg-braf
v600e
复合物将braf
v600e
抗体递送至sk-mel2细胞系和braf突变体(braf
v600e
)细胞系a2058和malme-3m中,证实了在人皮肤癌细胞系a2058和malme-3m中的细胞生存力下将,从而表明aunp-适配体-抗体复合物可用作细胞治疗剂(参见实施例5)。
[0066]
在下文中,为了帮助理解本发明,将提出示例性实施例。然而,提供以下实施例仅是为了更容易理解本发明,而不是限制本发明。
[0067]
实施例1.实验方法
[0068]
1-1.哺乳动物细胞培养
[0069]
将人宫颈癌(hela)细胞培养在dulbecco改良的eagle's培养基(dmem)中,并且将人表皮样癌(a549)细胞培养在含有2.5mm n-(2-羟乙基)哌嗪-n'-2-乙磺酸盐(hepes)缓冲液的rpmi-1640培养基中。此外,作为人类黑素瘤细胞的malme-3m和sk-mel-2细胞在rpmi-1640培养基中培养,而a2058细胞在dulbecco改良的eagle's培养基中培养。所有培养基均包含10%的热灭活胎牛血清(caisson,美国)和1%的青霉素-链霉素(welgene,韩国)。
[0070]
1-2.aunp-适配体-抗体复合物的制备
[0071]
为了防止二级结构的形成,将aunp-适配体缀合物在80℃下预孵育5分钟。另外,使aunp-适配体缀合物(aunp-apt
igg
)(1nm)和单克隆抗体在含有5mm mgcl2(ph 7.2)的1
×
pbs中在室温下反应10分钟,然后通过在13,000
×
g下离心除去上清液。由此制备的aunp-apt
igg-抗体复合物用补充有500mm nacl和1m kcl的tbst洗涤。
[0072]
1-3.使用共聚焦显微镜通过aunp-适配体缀合物分析抗体递送能力
[0073]
为了观察抗体向细胞内的递送,将赖氨酸包被的10mm盖玻片上培养的细胞用aunp-适配体-抗体复合物(aunp-apt
igg-抗体复合物)处理,孵育1小时,并用4%的多聚甲醛固定(sigma,美国)。然后,通过激光扫描共聚焦显微镜(carl zeiss zen 2011,德国)检测fitc(490nm激发,525nm发射)和alexa 546(556nm激发,573nm发射)荧光。
[0074]
1-4.细胞生存力测定
[0075]
将细胞系接种在96孔板中,并孵育过夜,以使细胞附着在其上。然后,将细胞用不同浓度(0、0.88、1.65和3.3nm)的aunp-apt
igg-braf
v600e
一起孵育,并测量细胞生存力(yeom,j.h.et al.inhibition of xenograft tumor growth by gold nanoparticle-dna oligonucleotide conjugates-assisted delivery of bax mrna.plos one 8,e75369(2013))。
[0076]
实施例2.使用aunp-适配体缀合物制备抗体载体
[0077]
使用与单克隆抗体的fc结构域结合的适配体来制备抗体载体,其示意图如图1所示。
[0078]
2-1.使用igg适配体制备抗体载体(aunp-apt
igg
)
[0079]
a)dna适配体的预处理
[0080]
为了制备根据本发明的抗体载体,使用了检测单克隆抗体的fc结构域并与之特异
性结合的igg-适配体。更具体地,igg-适配体是其中3’末端被硫醇基修饰的适配体,并且由5
’-
taatacgactcactatagcaatggtacggtacttccccactcaccgggt acctgccgctcccaaaagtgcacgctactttgctaaaaaaaaaaaa-3’(sh)(seq id no:1)的碱基序列组成。将干燥的dna适配体溶解于水中以使其终浓度为100μm,然后将10μl的1n二硫苏糖醇(dtt)添加到50μl的寡核苷酸中,并在室温下反应15分钟。为了除去含有不需要的硫醇分子的dtt,加入50μl乙酸乙酯并搅拌,然后将所得产物离心以除去上清液。将该过程重复三遍。另外,通过etoh沉淀法沉淀适配体。
[0081]
b)aunp与dna适配体的结合
[0082]
通过a)步骤的预处理沉淀的igg-适配体溶解在水中,然后添加到aunp中。在此,作为aunp,使用了从bbi life science(英国)购得的金胶体-15nm(#em.gc15)。
[0083]
具体而言,将适配体添加到2nm aunp(dna:aunp=100:1)中并充分搅拌,然后添加0.5m柠檬酸盐缓冲液(ph 3)并与所得混合物混合以达到最终浓度10mm。在室温下反应3至5分钟后,为了中和金,添加0.5m hepes缓冲液(ph 7.6)至终浓度为30mm,并在室温下反应10分钟。将适配体和金的混合物在约10,000
×
g下离心20分钟并浓缩,然后除去上清液中未反应的寡核苷酸。将该过程重复三遍。将最终的aunp-适配体缀合物分散在5mm hepes缓冲液(ph 7.6)中。
[0084]
2-2.使用fitc适配体制备抗体载体(aunp-apt
fitc
)
[0085]
a)dna适配体的预处理
[0086]
为了制备根据本发明的抗体载体,使用了特异性结合至fitc的异硫氰酸荧光素(fitc)-适配体(fitc-适配体),其广泛用作荧光示踪剂。更具体地,fitc适配体是其中3’端被硫醇基修饰的适配体,并且由5
’-
ggacgg caccacggtcggatccgtgagttgtgacaatttagcgggtggtattaga gcctactgccacagcaataggatcgatacagatctaaaaaaaaaa-3’(sh)(seq id no:2)的碱基序列组成。将干燥的dna适配体溶解于水中以达到100μm的最终浓度,然后将10μl的1n dtt添加到50μl的寡核苷酸中,并在室温下反应15分钟。为了除去含有不需要的硫醇分子的dtt,加入50μl乙酸乙酯并搅拌,然后将所得产物离心以除去上清液。将该过程重复三遍。之后,使用etoh沉淀法沉淀适配体。
[0087]
b)aunp和dna适配体之间的结合
[0088]
通过与实施例2-1的b)步骤中所述相同的方法,将通过a)步骤预处理沉淀的fitc-适配体与aunp结合,从而制备抗体载体(aunp-apt
fitc
)。
[0089]
实施例3.证实通过aunp-apt
igg
将抗体递送到细胞中的能力
[0090]
3-1.共聚焦显微镜
[0091]
使用根据实施例2-1制备的aunp-适配体缀合物,通过实施例1-2中描述的方法,制备aunp-适配体-抗体复合物。随后,hela细胞和a549细胞用aunp-适配体-抗体复合物处理,然后孵育1小时。温育后,将细胞用pbs洗涤,用4%的多聚甲醛固定,并将固定的样品免疫染色且使用共聚焦显微镜观察。
[0092]
3-2.证实通过aunp-apt
igg
将抗体递送到细胞中的能力
[0093]
通过使单克隆抗体parp1、vp6、nsd2、aurora a、pax5、波形蛋白(vimentin)、rock-1、rock-2、rhoe、p53、mcl-1、p50和braf与aunp-apt
igg
反应来制备aunp-适配体-抗体复合物。然后,将复合物用第二抗体mouse-546(红色)标记,并如实施例3-1中所述通过共聚焦显
微镜观察以确认抗体是否被递送到hela和a549细胞中。
[0094]
结果,如图2a和2b所示,证实了抗体被递送到hela(图2a)和a549(图2b)细胞中。
[0095]
实施例4.证实通过aunp-apt
fitc
将抗体递送到细胞中的能力
[0096]
用通过使由实施例2-2中所述的方法制备的适配体-aunp缀合物(aunp-apt
fitc
)与fitc标记的单克隆抗体igg(fitc-igg)反应制备的aunp-适配体-抗体复合物(aunp-apt
fitc-fitc-igg)处理人皮肤癌细胞系(malme-3m和sk-mel2),并且温育1小时,然后通过共聚焦荧光显微镜观察。在这里,使用40倍水浸物镜使细胞可视化。
[0097]
结果,如图3所示,证实fitc-igg(绿色)位于细胞中,表明igg被递送至人皮肤癌细胞系。
[0098]
实施例5.通过aunp-适配体-抗体复合物评估细胞生存力
[0099]
通过实施例1-4中所述的方法测量将aunp-apt
igg-braf
v600e
递送至人皮肤癌细胞系(a2058、sk-mel2和malme-3m)后的细胞生存力。通过使用aunp-apt
igg
将用作治疗人皮肤癌细胞系的靶分子的braf
v600e
抗体递送至braf突变细胞系a2058和malme-3m中,如图4所示,证实了与作为没有突变的皮肤癌细胞系的sk-mel2相比,细胞生存力降低。
[0100]
因此,根据以上结果证实,aunp-适配体-抗体复合物可以用作细胞治疗剂。
[0101]
本领域普通技术人员应该理解,本发明的上述描述是示例性的,并且在不脱离本发明的技术精神或基本特征的情况下,本文公开的示例性实施方案可以容易地修改为其他特定形式。因此,上述示例性实施方案应被解释为说明性的,并且在任何方面均不受限制。
[0102]
【工业适用性】
[0103]
根据本发明的抗体载体可以通过将待递送的抗体特异性结合至适配体而将抗体有效地递送至细胞核、细胞质和线粒体,因此有望有效地用于诊断或治疗疾病。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1