用于治疗雌激素受体阳性乳腺癌的组合疗法的制作方法
用于治疗雌激素受体阳性乳腺癌的组合疗法
发明领域
1.本发明涉及乳腺癌的治疗。
背景技术:
2.在美国,每年有超过20万女性诊断出患有乳腺癌。这些病例中约80%为雌激素受体阳性(er+),其特征为er信号传递的上调。一线疗法包括内分泌疗法,其已引起er+乳腺癌的极大治疗改善。不幸地,经过一段时间,对这些疗法的抗性产生,并且需要开发出其他治疗策略。近来,溴结构域和额外末端(bet)蛋白质brd3和brd4显示与er转录有关(feng等人,2014)。用一些bet抑制剂治疗可抑制er介导的信号传递,提供了一种通过进一步er信号传递抑制来克服内分泌抗性的潜在策略,而与esr1突变状态无关(feng等人,2014;ladd等人,2016;nagarajan等人,2014;sengupta等人,2015)。然而,尚不清楚brd3和/或brd4是否参与对患者中的内分泌疗法的抗药性机制,以及bet抑制剂是否可有效地抑制对cdk4/6抑制剂具有抗性的er+乳腺癌细胞的增殖。cdk4/6抑制剂为一线和二线转移性er+乳腺癌中的照护标准,并且cdk4/6抑制剂与bet抑制剂的组合可能成为对cdk4/6单疗法产生抗性的个体的下一线疗法。
3.然而,目前尚不清楚当向患有er+乳腺癌的个体施用时,哪种bet抑制剂(如果存在)将产生临床益处。也不清楚在乳腺癌的治疗中,哪种bet抑制剂(如果存在)将与其他药物协同组合,例如选择性雌激素受体降解剂(serd)、选择性雌激素受体调节剂(serm)、芳香酶抑制剂(ai)或选择性cdk4/6抑制剂;需要哪种水平的协同作用;和对于每种bet抑制剂,哪种第二治疗剂将为最佳组合搭配物,从而当向患有乳腺癌的患者施用时产生临床益处。除临床益处以外,组合还必须安全并且在有效剂量下具有良好耐受性。目前,无法预测哪种组合将展现出最佳总体概况。
技术实现要素:
4.本发明公开了治疗雌激素受体阳性(er+)乳腺癌的方法,所述方法通过向有需要的个体伴随施用bet溴结构域抑制剂、或bet溴结构域抑制剂的药学上可接受的盐或共晶体,与第二治疗剂。
5.在本发明的一些实施方式中,治疗er+乳腺癌的方法为一种三组合疗法,其包括施用bet溴结构域抑制剂、第二治疗剂与雌激素受体调节剂。
6.在一些实施方式中,bet溴结构域抑制剂与第二治疗剂和任选地与雌激素受体调节剂同时施用。在一些实施方式中,bet溴结构域抑制剂与第二治疗剂和任选地与雌激素受体调节剂依序施用。在一些实施方式中,bet溴结构域抑制剂以单一药物组合物形式与第二治疗剂和任选地与雌激素受体调节剂施用。在一些实施方式中,bet溴结构域抑制剂和第二治疗剂和任选地雌激素受体调节剂以单独组合物形式施用。在一些实施方式中,bet溴结构域抑制剂和第二治疗剂在单一组合物中,并且任选的雌激素受体调节剂在单独组合物中。
7.在一些实施方式中,第二治疗剂为用于治疗乳腺癌的药剂。
8.在一些实施方式中,第二治疗剂为选择性雌激素受体降解剂(serd)或调节剂(serm)。
9.在一些实施方式中,第二治疗剂为选择性cdk4/6抑制剂。
10.在一些实施方式中,bet溴结构域抑制剂为一种式ia或式ib所示的化合物
[0011][0012]
或其立体异构体、互变异构体、药学上可接受的盐或共晶体,
[0013]
其中:
[0014]
环a和环b可任选地经独立地选自以下的基团取代:氢、氘、
‑
nh2、氨基、杂环(c4‑
c6)、碳环(c4‑
c6)、卤素、
‑
cn、
‑
oh、
‑
cf3、烷基(c1‑
c6)、硫代烷基(c1‑
c6)、烯基(c1‑
c6)和烷氧基(c1‑
c6);
[0015]
x选自
‑
nh
‑
、
‑
ch2‑
、
‑
ch2ch2‑
、
‑
ch2ch2ch2‑
、
‑
ch2ch2o
‑
、
‑
ch2ch2nh
‑
、
‑
ch2ch2s
‑
、
‑
c(o)
‑
、
‑
c(o)ch2‑
、
‑
c(o)ch2ch2‑
、
‑
ch2c(o)
‑
、
‑
ch2ch2c(o)
‑
、
‑
c(o)nh
‑
、
‑
c(o)o
‑
、
‑
c(o)s
‑
、
‑
c(o)nhch2‑
、
‑
c(o)och2‑
、
‑
c(o)sch2‑
,其中一个或多个氢可独立地经氘、羟基、甲基、卤素、
‑
cf3、酮置换,并且其中s可氧化成亚砜或砜;
[0016]
r4选自任选地经取代的3元至7元碳环和杂环;和
[0017]
d1选自以下5元单环杂环:
[0018][0019]
其任选地经氢、氘、烷基(c1‑
c4)、烷氧基(c1‑
c4)、氨基、卤素、酰胺、
‑
cf3、
‑
cn、
‑
n3、酮(c1‑
c4)、
‑
s(o)烷基(c1‑
c4)、
‑
so2烷基(c1‑
c4)、
‑
硫代烷基(c1‑
c4)、
‑
cooh和/或酯取代,其中的每一个可任选地经氢、f、cl、br、
‑
oh、
‑
nh2、
‑
nhme、
‑
ome、
‑
sme、氧代基和/或硫基
‑
氧代基取代。
[0020]
在一些实施方式中,bet溴结构域抑制剂为式ia的化合物。在一些实施方式中,式ia的化合物为1
‑
苯甲基
‑6‑
(3,5
‑
二甲基异噁唑
‑4‑
基)
‑
n
‑
甲基
‑
1h
‑
咪唑并[4,5
‑
b]吡啶
‑2‑
胺(化合物i),其具有以下式:
[0021][0022]
在一些实施方式中,bet溴结构域抑制剂为式ia或式ib化合物的药学上可接受的
盐或共晶体。在一些实施方式中,bet溴结构域抑制剂为化合物i的药学上可接受的盐或共晶体。在一些实施方式中,bet溴结构域抑制剂为化合物i的甲磺酸盐/共晶体形式i。
附图说明
[0023]
图1为在wt
‑
mcf7细胞中化合物i与阿贝力布(abemaciclib)的协同组合。ci=0.08
[0024]
图2为在palbo
‑
r
‑
mcf7细胞中化合物i与阿贝力布的协同组合。ci=0.20
[0025]
图3为在zr
‑
75
‑
1细胞中化合物i与阿贝力布的协同组合。ci=0.14
[0026]
图4为在palbo
‑
r zr
‑
75
‑
1细胞中化合物i与阿贝力布的协同组合。ci=0.35
[0027]
图5为在abema
‑
r mcf7细胞中化合物i与阿贝力布的协同组合。ci=0.30
[0028]
图6为在wt
‑
mcf7细胞中化合物i与氟维司群(fulvestrant)的协同组合。ci=0.51。
[0029]
图7展示了化合物i的甲磺酸盐/共晶体的x射线粉末衍射图(xrpd)。
[0030]
图8展示了化合物i的甲磺酸盐/共晶体的差示扫描量热计(dsc)曲线。
[0031]
图9展示了化合物i的甲磺酸盐/共晶体的热解重量分析(tga)。
具体实施方式
[0032]
定义
[0033]
如本文所用,“治疗(treatment/treating)”是指改善疾病或病症,或其至少一个可辨别的症状。在另一实施方式中,“治疗(treatment/treating)”是指改善患者未必能辨别的至少一个可测量的物理参数。在另一实施方式中,“治疗(treatment/treating)”是指在物理上抑制疾病或病症的进展,例如稳定可辨别的症状,或生理上抑制疾病或病症的进展,例如稳定物理参数,或二者兼具。在另一实施方式中,“治疗(treatment/treating)”是指延迟疾病或病症的发作。
[0034]“任选的”或“任选地”意味着随后描述的事件或情况可能发生或可能不发生,并且意味着所述描述包括事件或情况发生的例子和其不发生的例子。举例来说,“任选地经取代的芳基”涵盖下文所定义的“芳基”和“经取代的芳基”。所属领域技术人员应了解,对于含有一个或多个取代基的任何基团,这类基团不打算引入空间上不切实际、合成上不可行和/或本身不稳定的任何取代或取代模式。
[0035]
如本文所用,术语“水合物”是指将化学计量或非化学计量的量的水的晶体形式并入晶体结构中。
[0036]
如本文所用,术语“烯基”是指具有至少一个碳
‑
碳双键的不饱和的直链或分支链烃,例如2至8个碳原子的直链或分支链基团,在本文中称为(c2‑
c8)烯基。示例性烯基包括(但不限于):乙烯基、烯丙基、丁烯基、戊烯基、己烯基、丁二烯基、戊二烯基、己二烯基、2
‑
乙基己烯基、2
‑
丙基
‑2‑
丁烯基和4
‑
(2
‑
甲基
‑3‑
丁烯)
‑
戊烯基。
[0037]
如本文所用,术语“烷氧基”是指连接至氧的烷基(
‑
o
‑
烷基
‑
)。“烷氧基”还包括连接至氧的烯基(“烯基氧基”)或连接至氧的炔基(“炔基氧基”)。示例性烷氧基包括(但不限于):具有1至8个碳原子的烷基、烯基或炔基的基团,在本文中称为(c1‑
c8)烷氧基。示例性烷氧基包括(但不限于)甲氧基和乙氧基。
[0038]
如本文所用,术语“烷基”是指饱和的直链或分支链烃,例如1至8个碳原子的直链
或分支链基团,在本文中称为(c1‑
c8)烷基。示例性烷基包括(但不限于):甲基、乙基、丙基、异丙基、2
‑
甲基
‑1‑
丙基、2
‑
甲基
‑2‑
丙基、2
‑
甲基
‑1‑
丁基、3
‑
甲基
‑1‑
丁基、2
‑
甲基
‑3‑
丁基、2,2
‑
二甲基
‑1‑
丙基、2
‑
甲基
‑1‑
戊基、3
‑
甲基
‑1‑
戊基、4
‑
甲基
‑1‑
戊基、2
‑
甲基
‑2‑
戊基、3
‑
甲基
‑2‑
戊基、4
‑
甲基
‑2‑
戊基、2,2
‑
二甲基
‑1‑
丁基、3,3
‑
二甲基
‑1‑
丁基、2
‑
乙基
‑1‑
丁基、丁基、异丁基、叔丁基、戊基、异戊基、新戊基、己基、庚基和辛基。
[0039]
如本文所用,术语“酰胺”是指
‑
nr
a
c(o)(r
b
)或
‑
c(o)nr
b
r
c
,其中r
a
、r
b
和r
c
各独立地选自:烷基、烯基、炔基、芳基、芳基烷基、环烷基、卤代烷基、杂芳基、杂环基和氢。酰胺可通过碳、氮、r
b
或r
c
连接至另一基团。酰胺还可以是环状的,例如r
b
与r
c
可结合形成3元至8元环,例如5元或6元环。术语“酰胺”涵盖例如以下的基团:磺酰胺、脲、脲基、氨基甲酸酯、氨基甲酸和其环状形式。术语“酰胺”还涵盖连接至羧基的酰胺基(例如
‑
酰胺
‑
cooh或盐,例如
‑
酰胺
‑
coona)、连接至羧基的氨基(例如
‑
氨基
‑
cooh或盐,例如
‑
氨基
‑
coona)。
[0040]
如本文所用,术语“胺”或“氨基”是指
‑
nr
d
r
e
或
‑
n(r
d
)r
e
‑
形式,其中r
d
和r
e
独立地选自:烷基、烯基、炔基、芳基、芳基烷基、氨基甲酸酯、环烷基、卤代烷基、杂芳基、杂环和氢。氨基可通过氮连接至母分子基团。氨基还可以是环状的,例如r
d
与r
e
中的任何两个可结合在一起或与n结合形成3元至12元环(例如吗啉基或哌啶基)。术语氨基还包括任何氨基的对应的季铵盐。示例性氨基包括烷基氨基,其中r
d
或r
e
中的至少一个是烷基。在一些实施方式中,r
d
和r
e
各自可任选地经羟基、卤素、烷氧基、酯或氨基取代。
[0041]
如本文所用,术语“芳基”是指单环、双环或其他多碳环芳环系统。芳基可任选地稠合至选自芳基、环烷基和杂环基的一个或多个环。本公开的芳基可经选自以下的基团取代:烷氧基、芳氧基、烷基、烯基、炔基、酰胺、氨基、芳基、芳基烷基、氨基甲酸酯、羧基、氰基、环烷基、酯、醚、甲酰基、卤素、卤代烷基、杂芳基、杂环基、羟基、酮、硝基、磷酸酯基、硫基、亚磺酰基、磺酰基、磺酸、磺酰胺和硫酮。示例性芳基包括(但不限于):苯基、甲苯基、蒽基、芴基、茚基、薁基和萘基,以及苯并稠合的碳环部分,例如5,6,7,8
‑
四氢萘基。示例性芳基还包括(但不限于):单环芳环系统,其中环包含6个碳原子,在本文中称为“(c6)芳基”。
[0042]
如本文所用,术语“芳基烷基”是指具有至少一个芳基取代基的烷基(例如,
‑
芳基
‑
烷基
‑
)。示例性芳基烷基包括(但不限于):具有单环芳环系统的芳基烷基,其中环包含6个碳原子,在本文中称为“(c6)芳基烷基”。
[0043]
如本文所用,术语“氨基甲酸酯”是指
‑
r
g
oc(o)n(r
h
)
‑
、
‑
r
g
oc(o)n(r
h
)r
i
‑
或
‑
oc(o)nr
h
r
i
形式,其中r
g
、r
h
和r
i
各自独立地选自烷基、烯基、炔基、芳基、芳基烷基、环烷基、卤代烷基、杂芳基、杂环基和氢。示例性氨基甲酸酯包括(但不限于):氨基甲酸芳基酯或氨基甲酸杂芳基酯(例如其中r
g
、r
h
和r
i
中的至少一个独立地选自芳基或杂芳基,例如吡啶、哒嗪、嘧啶和吡嗪)。
[0044]
如本文所用,术语“碳环”是指芳基或环烷基。
[0045]
如本文所用,术语“羧基”是指
‑
cooh或其相应的羧酸盐(例如,
‑
coona)。术语羧基还包括“羧基羰基”,例如连接至羰基的羧基,例如
‑
c(o)
‑
cooh或盐,例如
‑
c(o)
‑
coona。
[0046]
如本文所用,术语“环烷氧基”是指连接至氧的环烷基。
[0047]
如本文所用,术语“环烷基”是指由环烷衍生的3至12个碳或3至8个碳的饱和或不饱和的环状、双环或桥接双环状烃基,在本文中称为“(c3‑
c8)环烷基”。示例性环烷基包括(但不限于):环己烷、环己烯、环戊烷和环戊烯。环烷基可经以下的基团取代:烷氧基、芳氧
基、烷基、烯基、炔基、酰胺、氨基、芳基、芳基烷基、氨基甲酸酯、羧基、氰基、环烷基、酯、醚、甲酰基、卤素、卤代烷基、杂芳基、杂环基、羟基、酮、硝基、磷酸酯、硫基、亚磺酰基、磺酰基、磺酸、磺酰胺和硫酮。环烷基可稠合至其他饱和或不饱和的环烷基、芳基或杂环基。
[0048]
如本文所用,术语“二羧酸”是指含有至少两个羧酸基团的基团,例如饱和和不饱和的烃二羧酸和其盐。示例性二羧酸包括烷基二羧酸。二羧酸可经以下的基团取代:烷氧基、芳氧基、烷基、烯基、炔基、酰胺、氨基、芳基、芳基烷基、氨基甲酸酯、羧基、氰基、环烷基、酯、醚、甲酰基、卤素、卤代烷基、杂芳基、杂环基、氢、羟基、酮、硝基、磷酸酯、硫基、亚磺酰基、磺酰基、磺酸、磺酰胺和硫酮。二羧酸包括(但不限于):丁二酸、戊二酸、己二酸、辛二酸、癸二酸、壬二酸、顺丁烯二酸、邻苯二甲酸、天冬氨酸、谷氨酸、丙二酸、反丁烯二酸、(+)/(
‑
)
‑
苹果酸、(+)/(
‑
)酒石酸、间苯二羧酸和对苯二羧酸。二羧酸进一步包括其羧酸衍生物,例如酸酐、酰亚胺、酰肼(例如丁二酸酐和丁二酰亚胺)。
[0049]
术语“酯”是指结构
‑
c(o)o
‑
、
‑
c(o)o
‑
r
j
‑
、
‑
r
k
c(o)o
‑
r
j
‑
或
‑
r
k
c(o)o
‑
,其中o不结合至氢,并且r
j
和r
k
可独立地选自:烷氧基、芳氧基、烷基、烯基、炔基、酰胺、氨基、芳基、芳基烷基、环烷基、醚、卤代烷基、杂芳基和杂环基。r
k
可为氢,但r
j
不能为氢。酯可为环状的,例如碳原子与r
j
、氧原子与r
k
,或r
j
与r
k
可结合形成3元至12元环。示例性酯包括(但不限于)烷基酯,其中r
j
或r
k
中的至少一个为烷基,例如
‑
o
‑
c(o)
‑
烷基、
‑
c(o)
‑
o
‑
烷基
‑
和
‑
烷基
‑
c(o)
‑
o
‑
烷基
‑
。示例性酯还包括芳基或杂芳基酯,例如其中r
j
或r
k
中的至少一个为杂芳基,例如吡啶、哒嗪、嘧啶和吡嗪,例如烟酸酯。示例性酯还包括具有结构
‑
r
k
c(o)o
‑
的反向酯(reverse ester),其中氧结合至母分子。示例性反向酯包括丁二酸酯、d
‑
精氨酸酯、l
‑
精氨酸酯、l
‑
赖氨酸酯和d
‑
赖氨酸酯。酯还包括羧酸酐和酸卤化物。
[0050]
如本文所用,术语“卤基”或“卤素”是指f、cl、br或i。
[0051]
如本文所用,术语“卤代烷基”是指经一个或多个卤素原子取代的烷基。“卤代烷基”还涵盖经一个或多个卤素原子取代的烯基或炔基。
[0052]
如本文所用,术语“杂芳基”是指含有一个或多个杂原子(例如1至3个杂原子,例如氮、氧和硫)的单环、双环或其他多环芳环系统。杂芳基可经包括以下的一个或多个取代基取代:烷氧基、芳氧基、烷基、烯基、炔基、酰胺、氨基、芳基、芳基烷基、氨基甲酸酯、羧基、氰基、环烷基、酯、醚、甲酰基、卤素、卤代烷基、杂芳基、杂环基、羟基、酮、硝基、磷酸酯、硫基、亚磺酰基、磺酰基、磺酸、磺酰胺和硫酮。杂芳基还可稠合至非芳香环。杂芳基的说明性实例包括(但不限于):吡啶基、哒嗪基、嘧啶基、吡嗪基、三嗪基、吡咯基、吡唑基、咪唑基、(1,2,3)
‑
三唑基和(1,2,4)
‑
三唑基、吡嗪基、嘧啶基、四唑基、呋喃基、噻吩基、异噁唑基、噻唑基、呋喃基、苯基、异噁唑基和噁唑基。示例性杂芳基包括(但不限于)单环芳环,其中环包含2至5个碳原子和1至3个杂原子,在本文中称为“(c2‑
c5)杂芳基”。
[0053]
如本文所用,术语“杂环”、“杂环基”或“杂环”是指饱和或不饱和的3元、4元、5元、6元或7元环,其含有一个、两个或三个独立地选自氮、氧和硫的杂原子。杂环可为芳族(杂芳基)或非芳族。杂环可经包括以下的一个或多个取代基取代:烷氧基、芳氧基、烷基、烯基、炔基、酰胺、氨基、芳基、芳基烷基、氨基甲酸酯、羧基、氰基、环烷基、酯、醚、甲酰基、卤素、卤代烷基、杂芳基、杂环基、羟基、酮、硝基、磷酸酯、硫基、亚磺酰基、磺酰基、磺酸、磺酰胺和硫酮。杂环还包括双环、三环和四环基团,其中以上杂环中的任一个稠合至独立地选自芳基、环烷基和杂环的一个或两个环。示例性杂环包括:吖啶基、苯并咪唑基、苯并呋喃基、苯并噻
唑基、苯并噻吩基、苯并噁唑基、生物素基、啉基、二氢呋喃基、二氢吲哚基、二氢哌喃基、二氢噻吩基、二噻唑基、呋喃基、高哌啶基、咪唑啶基、咪唑啉基、咪唑基、吲哚基、异喹啉基、异噻唑啶基、异噻唑基、异噁唑啶基、异噁唑基、吗啉基、噁二唑基、噁唑啶基、噁唑基、哌嗪基、哌啶基、哌喃基、吡唑啶基、吡嗪基、吡唑基、吡唑啉基、哒嗪基、吡啶基、嘧啶基(pyrimidinyl)、嘧啶基(pyrimidyl)、吡咯烷基、吡咯烷
‑2‑
酮基、吡咯啉基、吡咯基、喹啉基、喹噁啉基(quinoxaloyl)、四氢呋喃基、四氢异喹啉基、四氢哌喃基、四氢喹啉基、四唑基、噻二唑基、噻唑啶基、噻唑基、噻吩基、硫代吗啉基、硫代哌喃基和三唑基。
[0054]
如本文所用,术语“羟基(hydroxy)”和“羟基(hydroxyl)”是指
‑
oh。
[0055]
如本文所用,术语“羟基烷基”是指连接至烷基的羟基。
[0056]
如本文所用,术语“羟基芳基”是指连接至芳基的羟基。
[0057]
如本文所用,术语“酮”是指结构
‑
c(o)
‑
r
n
(例如乙酰基、
‑
c(o)ch3)或
‑
r
n
‑
c(o)
‑
r
o
。酮可通过r
n
或r
o
连接至另一基团。r
n
或r
o
可为烷基、烯基、炔基、环烷基、杂环基或芳基,或r
n
或r
o
可结合形成3元至12元环。
[0058]
如本文所用,术语“苯基”是指6元碳环芳环。苯基还可以稠合至环己烷或环戊烷环。苯基可经包括以下的一个或多个取代基取代:烷氧基、芳氧基、烷基、烯基、炔基、酰胺、氨基、芳基、芳基烷基、氨基甲酸酯、羧基、氰基、环烷基、酯、醚、甲酰基、卤素、卤代烷基、杂芳基、杂环基、羟基、酮、磷酸酯、硫基、亚磺酰基、磺酰基、磺酸、磺酰胺和硫酮。
[0059]
如本文所用,术语“硫代烷基”是指连接至硫的烷基(
‑
s
‑
烷基
‑
)。
[0060]“烷基”、“烯基”、“炔基”、“烷氧基”、“氨基”和“酰胺”基团可任选地经至少一个选自以下的基团取代或间杂有所述基团或由其分支:烷氧基、芳氧基、烷基、烯基、炔基、酰胺、氨基、芳基、芳基烷基、氨基甲酸酯、羰基、羧基、氰基、环烷基、酯、醚、甲酰基、卤素、卤代烷基、杂芳基、杂环基、羟基、酮、磷酸酯、硫基、亚磺酰基、磺酰基、磺酸、磺酰胺、硫酮、脲基和n。取代基可经分支化形成经取代或未经取代的杂环或环烷基。
[0061]
如本文所用,任选地经取代的取代基上的适合的取代是指不会破坏本发明化合物或适用于制备其的中间体的合成或医药效用的基团。适合的取代的实例包括(但不限于):c1‑8烷基、烯基或炔基;c1‑6芳基、c2‑5杂芳基;c
37
环烷基;c1‑8烷氧基;c6芳氧基;
‑
cn;
‑
oh;氧代基;卤基、羧基;氨基,例如
‑
nh(c1‑8烷基)、
‑
n(c1‑8烷基)2、
‑
nh((c6)芳基)或
‑
n((c6)芳基)2;甲酰基;酮,例如
‑
co(c1‑8烷基)、
‑
co((c6芳基)酯,例如
‑
co2(c1‑8烷基)和
‑
co2(c6芳基)。所属领域技术人员可基于本公开化合物的稳定性以及药理学和合成活性容易地选择适合的取代。
[0062]
如本文所用,术语“药学上可接受的组合物”是指一种包含与一种或多种药学上可接受的载体一起调配的至少一种本文所公开的化合物的组合物。
[0063]
如本文所用,术语“药学上可接受的载体”是指与药物施用相容的任何和所有溶剂、分散介质、包衣、等张剂和吸收推迟剂等。这类介质和药剂用于药物活性物质的用途为所属领域中众所周知的。组合物还可含有提供补充、额外或增强治疗功能的其他活性化合物。
[0064]
示例性实施方式
[0065]
如上文所概述,本发明提供了用组合疗法治疗er+乳腺癌的方法,组合疗法包括向有需要的个体施用式ia或式ib的bet溴结构域抑制剂、或其立体异构体、互变异构体、或其
药学上可接受的盐/共晶体,与第二治疗剂:
[0066][0067]
其中:
[0068]
环a和环b可任选地经独立地选自以下的基团取代:氢、氘、
‑
nh2、氨基、杂环(c4‑
c6)、碳环(c4‑
c6)、卤素、
‑
cn、
‑
oh、
‑
cf3、烷基(c1‑
c6)、硫代烷基(c1‑
c6)、烯基(c1‑
c6)和烷氧基(c1‑
c6);
[0069]
x选自
‑
nh
‑
、
‑
ch2‑
、
‑
ch2ch2‑
、
‑
ch2ch2ch2‑
、
‑
ch2ch2o
‑
、
‑
ch2ch2nh
‑
、
‑
ch2ch2s
‑
、
‑
c(o)
‑
、
‑
c(o)ch2‑
、
‑
c(o)ch2ch2‑
、
‑
ch2c(o)
‑
、
‑
ch2ch2c(o)
‑
、
‑
c(o)nh
‑
、
‑
c(o)o
‑
、
‑
c(o)s
‑
、
‑
c(o)nhch2‑
、
‑
c(o)och2‑
、
‑
c(o)sch2‑
,其中一个或多个氢可独立地经氘、羟基、甲基、卤素、
‑
cf3、酮置换,并且其中s可氧化成亚砜或砜;
[0070]
r4选自任选地经取代的3元至7元碳环和杂环;和
[0071]
d1选自以下5元单环杂环:
[0072][0073]
其任选地经氢、氘、烷基(c1‑
c4)、烷氧基(c1‑
c4)、氨基、卤素、酰胺、
‑
cf3、
‑
cn、
‑
n3、酮(c1‑
c4)、
‑
s(o)烷基(c1‑
c4)、
‑
so2烷基(c1‑
c4)、
‑
硫代烷基(c1‑
c4)、
‑
cooh和/或酯取代,其中的每一个可任选地经氢、f、cl、br、
‑
oh、
‑
nh2、
‑
nhme、
‑
ome、
‑
sme、氧代基和/或硫基
‑
氧代基取代。
[0074]
式ia和ib的化合物(包括化合物i)先前已描述于国际专利公开wo 2015/002754中(该专利公开以全文引用的方式并入本文中),并且尤其关于其对式ia和式ib的化合物(包括化合物i)的描述、其合成和其bet溴结构域抑制剂活性的证明。
[0075]
在一些实施方式中,式ia和式ib的bet溴结构域抑制剂选自:
[0076]1‑
苯甲基
‑6‑
(3,5
‑
二甲基异噁唑
‑4‑
基)
‑
n
‑
乙基
‑
1h
‑
咪唑并[4,5
‑
b]吡啶
‑2‑
胺;
[0077]1‑
苯甲基
‑6‑
(3,5
‑
二甲基异噁唑
‑4‑
基)
‑
n
‑
甲基
‑
1h
‑
咪唑并[4,5
‑
b]吡啶
‑2‑
胺;
[0078]
n,1
‑
二苯甲基
‑6‑
(3,5
‑
二甲基异噁唑
‑4‑
基)
‑
1h
‑
咪唑并[4,5
‑
b]吡啶
‑2‑
胺;
[0079]1‑
苯甲基
‑6‑
(3,5
‑
二甲基异噁唑
‑4‑
基)
‑
n
‑
(吡啶
‑3‑
基甲基)
‑
1h
‑
咪唑并[4,5
‑
b]吡啶
‑2‑
胺;
[0080]4‑
(1
‑
苯甲基
‑2‑
(吡咯烷
‑1‑
基)
‑
1h
‑
咪唑并[4,5
‑
b]吡啶
‑6‑
基)
‑
3,5
‑
二甲基异噁唑;
[0081]4‑
(2
‑
(氮杂环丁
‑1‑
基)
‑1‑
(环戊基甲基)
‑
1h
‑
咪唑并[4,5
‑
b]吡啶
‑6‑
基)
‑
3,5
‑
二甲基异噁唑;
[0082]1‑
苯甲基
‑6‑
(3,5
‑
二甲基异噁唑
‑4‑
基)
‑
1h
‑
咪唑并[4,5
‑
b]吡啶
‑2‑
胺;
[0083]1‑
(环戊基甲基)
‑6‑
(3,5
‑
二甲基异噁唑
‑4‑
基)
‑
n
‑
(四氢
‑
2h
‑
哌喃
‑4‑
基)
‑
1h
‑
咪唑并[4,5
‑
b]吡啶
‑2‑
胺;
[0084]4‑
氨基
‑1‑
苯甲基
‑6‑
(3,5
‑
二甲基异噁唑
‑4‑
基)
‑
1h
‑
苯并[d]咪唑
‑
2(3h)
‑
酮;
[0085]4‑
氨基
‑6‑
(3,5
‑
二甲基异噁唑
‑4‑
基)
‑1‑
(4
‑
甲氧基苯甲基)
‑
1h
‑
苯并[d]咪唑
‑
2(3h)
‑
酮;
[0086]4‑
氨基
‑6‑
(3,5
‑
二甲基异噁唑
‑4‑
基)
‑1‑
(1
‑
苯基乙基)
‑
1h
‑
苯并[d]咪唑
‑
2(3h)
‑
酮;
[0087]4‑
氨基
‑1‑
苯甲基
‑6‑
(3,5
‑
二甲基异噁唑
‑4‑
基)
‑3‑
甲基
‑
1h
‑
苯并[d]咪唑
‑
2(3h)
‑
酮;
[0088]
或其药学上可接受的盐或共晶体。
[0089]
在一个实施方式中,本发明提供一种用于治疗er+乳腺癌的方法,所述方法包括向有需要的个体施用一种选自以下的化合物与附带的另一治疗剂:1
‑
苯甲基
‑6‑
(3,5
‑
二甲基异噁唑
‑4‑
基)
‑
n
‑
甲基
‑
1h
‑
咪唑并[4,5
‑
b]吡啶
‑2‑
胺(化合物i)和1
‑
苯甲基
‑6‑
(3,5
‑
二甲基异噁唑
‑4‑
基)
‑
1h
‑
咪唑并[4,5
‑
b]吡啶
‑2‑
胺,和其药学上可接受的盐或共晶体。
[0090]
在一个实施方式中,其中在本发明的方法中施用的bet溴结构域抑制剂为1
‑
苯甲基
‑6‑
(3,5
‑
二甲基异噁唑
‑4‑
基)
‑
n
‑
甲基
‑
1h
‑
咪唑并[4,5
‑
b]吡啶
‑2‑
胺(化合物i)的甲磺酸盐或共晶体。
[0091]
在一个实施方式中,将一种选自以下的化合物与第二治疗剂给药而不会导致血小板减少作为剂量限制性毒性:1
‑
苯甲基
‑6‑
(3,5
‑
二甲基异噁唑
‑4‑
基)
‑
n
‑
甲基
‑
1h
‑
咪唑并[4,5
‑
b]吡啶
‑2‑
胺(化合物i)和1
‑
苯甲基
‑6‑
(3,5
‑
二甲基异噁唑
‑4‑
基)
‑
1h
‑
咪唑并[4,5
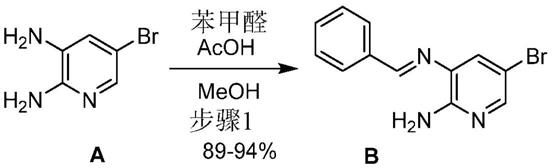
‑
b]吡啶
‑2‑
胺和其药学上可接受的盐/共晶体。
[0092]
在一些实施方式中,在本发明的方法中施用的第二治疗剂为选择性雌激素受体降解剂(serd)。
[0093]
在一些实施方式中,在本发明的方法中施用的第二治疗剂为选择性雌激素受体调节剂(serm)。
[0094]
在一些实施方式中,第二治疗剂为他莫昔芬(tamoxifen)。
[0095]
在一些实施方式中,个体先前已用芳香酶抑制剂治疗。
[0096]
在一些实施方式中,第二治疗剂为氟维司群。
[0097]
在一些实施方式中,第二治疗剂为cdk4/6抑制剂。
[0098]
在一些实施方式中,第二治疗剂选自阿贝力布、利伯西利和帕泊昔布(palbociclib)。
[0099]
在一些实施方式中,第二治疗剂为阿贝力布。
[0100]
在一些实施方式中,个体先前已用乳腺癌疗法治疗。在一些实施方式中,现有乳腺癌疗法为化学疗法。在一些实施方式中,现有乳腺癌疗法为用cdk4/6抑制剂治疗。在一些实施方式中,现有乳腺癌疗法为免疫疗法。
[0101]
在一些实施方式中,个体为人类。
[0102]
在一些实施方式中,本文所述的bet溴结构域抑制剂与第二治疗剂伴随施用。如本文所用,“伴随”意味着将式ia或式ib的bet溴结构域抑制剂与第二治疗剂以数秒(例如15
秒、30秒、45秒、60秒或更低)、若干分钟(例如1分钟、2分钟、5分钟或更低、10分钟或更低、15分钟或更低)或1至12小时的时间间隔施用。当伴随施用时,bet溴结构域抑制剂与其他治疗剂可以两种或更多种施用方式施用,且包含于独立的组合物或剂型中,组合物或剂型可包含于相同包装或不同包装中。
[0103]
参考文献列表
[0104]
chou,t.c.和talalay,p.(2984),quantitative analysis of dose
‑
effect relationships:the combined effects of multiple drugs or enzyme inhibitors.advances in enzyme regulation 22,27
‑
55。
[0105]
feng,q.,zhang,z.,shea,m.j.,creighton,c.j.,coarfa,c.,hilsenbeck,s.g.,lanz,r.,he,b.,wang,l.,fu,x.等人(2014).an epigenomic approach to therapy for tamoxifen
‑
resistant breast cancer.cell res 24,809
‑
819。
[0106]
ladd,b.,mazzola,a.m.,bihani,t.,lai,z.,bradford,j.,collins,m.,barry,e.,goeppert,a.u.,weir,h.m.,hearne,k.等人(2016).effective combination therapies in preclinical endocrine resistant breast cancer models harboring er mutations.oncotarget 7,54120
‑
54136。
[0107]
nagarajan,s.,hossan,t.,alawi,m.,najafova,z.,indenbirken,d.,bedi,u.,taipaleenmaki,h.,ben
‑
batalla,i.,scheller,m.,loges,s.等人(2014).bromodomain protein brd4 is required for estrogen receptor
‑
dependent enhancer activation and gene transcription.cell reports 8,460
‑
469。
[0108]
sengupta,s.,biarnes,m.,clarke,r.和jordan,v.c.(2015).inhibition of bet proteins impairs estrogen
‑
mediated growth and transcription in breast cancers by pausing rna polymerase advancement.breast cancer res treat 150,265
‑
278。
[0109]
实施例
[0110]
由赛默飞世尔科技(thermofisher scientific)获得组织培养基和试剂。由sigma获得氟维司群,由selleckchem获得阿贝力布和帕泊昔布。
[0111]
实施例1:化合物i的合成
[0112]
步骤a:5
‑
溴
‑
n3‑
(苯基亚甲基)吡啶
‑
2,3
‑
二胺(化合物b)的合成
[0113][0114]
将起始物质a溶解于甲醇和乙酸中。将溶液冷却至0℃至5℃且逐滴添加苯甲醛。一旦反应完成,那么逐滴添加处理水和nahco3溶液,保持低温(0℃至5℃)。滤出固体且用甲醇/水(1:1)洗涤,接着干燥,得到产率为94%和纯度为+99%(由hplc测得)的化合物b。1h
‑
nmr(dmso
‑
d6):δ8.75(1h),8.04(2h),7.93(1h),7.65(1h),7.50
‑
7.60(3h)。
[0115]
步骤b:n3‑
苯甲基
‑5‑
溴吡啶
‑
2,3
‑
二胺(化合物c)的合成
[0116][0117]
将化合物b溶解于乙醇中并且逐份添加nahb4,保持温度为15℃与25℃之间。将反应混合物搅拌8至15小时,直至由hplc监测到反应完成。添加hcl溶液,将ph调节为6至7,接着添加处理水,保持温度为15℃至25℃之间。将混合物搅拌1至5小时,过滤并且用乙醇/水混合物洗涤。在约60℃下干燥15至20小时后,得到化合物c。1h
‑
nmr(dmso
‑
d6):d 7.2
‑
7.4(6h),6.55(1h),5.70
‑
5.83(3h),4.30(2h)。
[0118]
步骤c:n3‑
苯甲基
‑5‑
(3,5
‑
二甲基
‑
1,2
‑
噁唑
‑4‑
基)吡啶
‑
2,3
‑
二胺(化合物d)的合成
[0119][0120]
将化合物c、化合物g和磷酸三钾三水合物混合,接着添加1,4
‑
二噁烷和处理水。将所得混合物用氮气彻底吹扫。添加四(三苯基膦)钯(0)并且将混合物加热至≥90℃,直至化合物c与化合物d的比率不超过1%。冷却后,将反应混合物过滤,用1,4
‑
二噁烷洗涤固体且随后浓缩。添加处理水并且搅拌混合物,直至母液中的剩余化合物d的量不超过0.5%。通过过滤分离化合物d且将其用1,4
‑
二噁烷/水和叔丁基甲基醚依序洗涤。将湿滤饼在二氯甲烷和硅胶中混合。搅拌后,将混合物过滤,随后浓缩。将混合物冷却并且添加叔丁基甲基醚。通过过滤分离产物并且干燥,直至二氯甲烷、叔丁基甲基醚和水分含量不超过0.5%。1h
‑
nmr(dmso
‑
d6):δ7.30
‑
7.45(4h),7.20
‑
7.25(2h),6.35(1h),5.65
‑
5.80(3h),4.30
‑
4.40(2h),2.15(3h),1.95(3h)。
[0121]
步骤d:1
‑
苯甲基
‑6‑
(3,5
‑
二甲基
‑
1,2
‑
噁唑
‑4‑
基)
‑
3h
‑
咪唑并[4,5
‑
b]吡啶
‑2‑
酮(化合物e)的合成
[0122][0123]
将羰基二咪唑固体添加至化合物d与二甲基亚砜的搅拌混合物中。加热混合物,直
至化合物d与化合物e的比率为nmt 0.5%。将混合物冷却并且添加处理水历经若干小时。将所得混合物在环境温度下搅拌至少2小时。通过过滤分离产物并且用处理水洗涤。在使用加热和真空干燥之前,二甲基亚砜经检验为nmt 0.5%。当水分含量为nmt 0.5%时,干燥完成,得到化合物e。1h
‑
nmr(dmso
‑
d6):δ11.85(1h),7.90(1h),7.20
‑
7.45(6h),5.05(2h),3.57(3h),2.35(3h),2.15(3h)。
[0124]
步骤e:4
‑
[1
‑
苯甲基
‑2‑
氯
‑
1h
‑
咪唑并[4,5
‑
b]吡啶
‑6‑
基]
‑
3,5
‑
二甲基
‑
1,2
‑
噁唑(化合物f)的合成
[0125][0126]
将化合物e与三氯氧磷混合,并且随后用可逐滴添加的二异丙基乙基胺(dipea)处理。将所得混合物加热若干小时,冷却并且取样检测反应是否完成。如果化合物e与化合物f的比率不超过0.5%,那么反应完成。否则,将反应物再加热一段时间并且如前所述进行取样。反应完成后,将混合物浓缩,随后冷却。添加乙酸乙酯并且将混合物在真空下浓缩若干次。将乙酸乙酯(etoac)添加至浓缩物中,将混合物冷却并且随后添加至碳酸氢钠水溶液。分离有机相且将有机层用碳酸氢钠水溶液洗涤,并且随后用水洗涤。浓缩有机相,添加乙酸乙酯,并且将混合物浓缩以确保水分含量不超过0.2%。将含混合物的乙酸乙酯用碳脱色。将混合物浓缩并且添加正庚烷。通过过滤分离产物并且在真空下干燥。当残余水分、乙酸乙酯和正庚烷不超过0.5%时,干燥完成。1h
‑
nmr(meoh
‑
d4):δ8.40(1h),7.90(1h),7.25
‑
7.45(5h),5.65(2h),2.37(3h),2.22(3h)。
[0127]
步骤f:1
‑
苯甲基
‑6‑
(3,5
‑
二甲基
‑
1,2
‑
噁唑
‑4‑
基)
‑
n
‑
甲基
‑
1h
‑
咪唑并[4,5
‑
b]吡啶
‑2‑
胺(化合物i)的合成
[0128][0129]
将化合物f与甲胺于四氢呋喃(thf)中混合并且在环境温度下搅拌,直至化合物f与化合物i的比率为nmt 0.1%(由hplc测得)。反应完成后,将混合物在真空下浓缩,添加处理水,并且通过过滤分离产物。将滤饼用处理水洗涤。将湿滤饼溶解于盐酸中并且将所得溶液用二氯甲烷洗涤以去除杂质。将水溶液用氢氧化钠溶液中和,且通过过滤分离化合物i,用处理水洗涤并且在真空下干燥。为了去除任何剩余盐酸,必要时可将经干燥的物质溶解于乙醇中,用氢氧化钠于乙醇中的溶液处理,接着添加处理水,以使产物沉淀。通过过滤分离化合物i,用处理水洗涤并且干燥。1h
‑
nmr(dmso
‑
d6):δ7.96(d,1h,j=2.0hz),7.42(d,1h,
j=2.0hz),7.37(q,1h,j=4.2hz),7.32(m,2h),7.26(m,1h),7.24(m,2h),5.30(s,2h),3.00(d,3h,4.5hz),2.34(s,3h),2.16(s,3h).
13
c
‑
nmr(dmso
‑
d6):δ164.8,158.4,157.7,156.0,141.1,136.4,128.6(2c),127.5,127.4,127.2(2c),115.8,114.2(2c),44.5,29.3,11.2,10.3。
[0130]
实施例2:化合物i的结晶甲磺酸盐
[0131]
将约5g化合物i溶解于乙醇(115ml)中并且根据1:1的摩尔比添加甲磺酸于乙醇中的溶液(10ml,158.7mg/ml)。在50℃下将混合物振荡2小时,随后浓缩至一半体积并且搅拌过夜。将所形成的固体(化合物i的甲磺酸盐/共晶体形式i)分离、干燥和表征。
[0132]
化合物i的甲磺酸盐/共晶体形式i还由其他溶剂和溶剂混合物(包括丙酮和乙腈)获得。
[0133]
化合物i的甲磺酸盐/共晶体形式i通过xrpd表征为包含以2θ表示的以下峰:8.4
±
0.2、10.6
±
0.2、11.7
±
0.2、14.5
±
0.2、15.3
±
0.2、16.9
±
0.2、18.2
±
0.2、19.0
±
0.2、19.9
±
0.2、20.5
±
0.2、22.6
±
0.2、23.8
±
0.2、24.5
±
0.2和27.6
±
0.2,其如使用cu
‑
k
α
辐射管在衍射仪上测定(图7)。
[0134]
化合物i的甲磺酸盐/共晶体形式i通过dsc表征为在约207℃的温度下具有吸热峰(图8)。
[0135]
化合物i的甲磺酸盐/共晶体形式i通过tga表征为具有如图9中所示的热分析图,这证实了化合物i的形式i为无水形式。
[0136]
实施例3:通过化合物i与阿贝力布的组合协同抑制er+乳腺癌细胞系生存力
[0137]
将mcf7、palbo
‑
r
‑
mcf7、zr
‑
75
‑
1、abema
‑
r mcf7和palbo
‑
r zr
‑
75
‑
1细胞以每孔7,500个细胞的密度铺板于具有1640
‑
rpmi培养基(含有10%fbs和青霉素/链霉素)的96孔平底板中,并且在37℃、5%co2下培育24小时。将培养基用1640
‑
rpmi培养基置换并且在37℃、5%co2下培育7天,所述1640
‑
rpmi培养基含有10%fbs,且具有恒定比率的化合物i或阿贝力布作为单一药剂,或以四种不同浓度(2
×
ic50,1
×
ic50,0.5
×
ic50,0.25
×
ic50)的两种药物的组合。将细胞如上文所述在第3天或第4天进行再处理。针对每个浓度使用三复孔并且将仅含有具有0.1%dmso的培养基的孔用作对照。为了测量细胞生存力,将100μl以1:100稀释至分析缓冲液(celltiter fluor细胞生存力检定(普洛麦格))中的gf
‑
afc底物添加至各孔中,并且在37℃、5%co2下再培育30至90分钟。在荧光计中读取380nm至400nm激发/505nm发射下的荧光,并且在通过减去空白孔信号校正背景之后,对相对于经dmso处理的细胞的细胞效价百分比进行计算。使用graphpad prism软件计算单一药剂的ic50值。通过使用calcusyn软件(biosoft)基于chou
‑
talalay算法(chou和talalay,1984)计算组合指数(ci)和针对有效剂量(ed)50、75和90的ci值取平均值来进行协同定量。如图1至5中所示,相较于平均ci值为0.08至0.35(视细胞系而定)的任一单一药剂,将化合物i添加至阿贝力布提高了对细胞生存力的抑制。
[0138]
实施例4:通过化合物i与氟维司群的组合协同抑制mcf7细胞生存力
[0139]
将mcf7细胞以每孔7,500个细胞的密度铺板于具有无酚红1640
‑
rpmi培养基(含有10%炭去除fbs和青霉素/链霉素)的96孔平底板,并且在37℃、5%co2下培育24小时。将培养基用无酚红1640
‑
rpmi培养基置换并且在37℃、5%co2下培育7天,所述无酚红1640
‑
rpmi培养基含有10%炭去除fbs和青霉素/链霉素,且具有恒定比率的化合物i或氟维司群作为
单一药剂,或四种不同浓度(2
×
ic50,1
×
ic50,0.5
×
ic50,0.25
×
ic50)的两种药物的组合进行处理。将细胞如上文所述在第3天或第4天进行再处理。针对每个浓度使用三复孔并且将仅含有具有0.1%dmso的培养基的孔用作对照。为了测量细胞生存力,将100μl以1:100稀释至分析缓冲液(celltiter fluor细胞生存力检定(普洛麦格))中的gf
‑
afc底物添加至各孔中,并且在37℃、5%co2下再培育30至90分钟。在荧光计中读取以380nm至400nm激发/505nm发射下的荧光,并且在通过减去空白孔信号校正背景之后,对相对于经dmso处理的细胞的细胞效价百分比进行计算。使用graphpad prism软件计算单一药剂的ic50值。通过使用calcusyn软件(biosoft)基于chou
‑
talalay算法(chou和talalay,1984)计算组合指数(ci)和针对有效剂量(ed)50、75和90的ci值取平均值来进行协同定量。如图6中所示,相较于平均ci值为0.51的任一单一药剂,将化合物i添加至氟维司群提高了对细胞生存力的抑制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1