癌抗原特异性细胞毒性T细胞的制作方法
本发明涉及一种癌抗原特异性细胞毒性t细胞,以及包含该细胞的药物组合物。
背景技术:
:由于cd8+t细胞与树突细胞、cd4+t、nk细胞等其它细胞相比功能相对简单,因而在抗肿瘤免疫治疗中意外的副作用发生的可能性较小。一般来说,mhcⅰ类/肽多聚体用于分离抗原特异性cd8+t细胞,但这种方法的缺点是,由于细胞分离后细胞凋亡导致的细胞死亡率很高,因此需要长期培养才能产生足够数量的抗原特异性cd8+t细胞。因此,需要一种替代标志物,能够通过替换刺激t细胞受体(tcr)的mhc多聚体来分离抗原特异性cd8+t细胞;为此,使用蛋白4-1bb(cd137)。4-1bb是一种可诱导的共刺激分子,在活化的t细胞中表达;特别是,已知通过4-1bb进行刺激不仅可以增强cd8+t细胞的活性,而且可以通过增加抗凋亡分子(如bcl-2、bcl-xl和bfl-1)的表达来抑制活化诱导的细胞死亡(aicd)。本发明人先前公开了使用活化的cd8+t细胞表达4-1bb或使用抗4-1bb抗体或五聚体comp-4-1bbl蛋白分离和增殖抗原特异性cd8+t细胞的方法(韩国注册专利100882445、101103603、101503341)。本说明书的
背景技术:
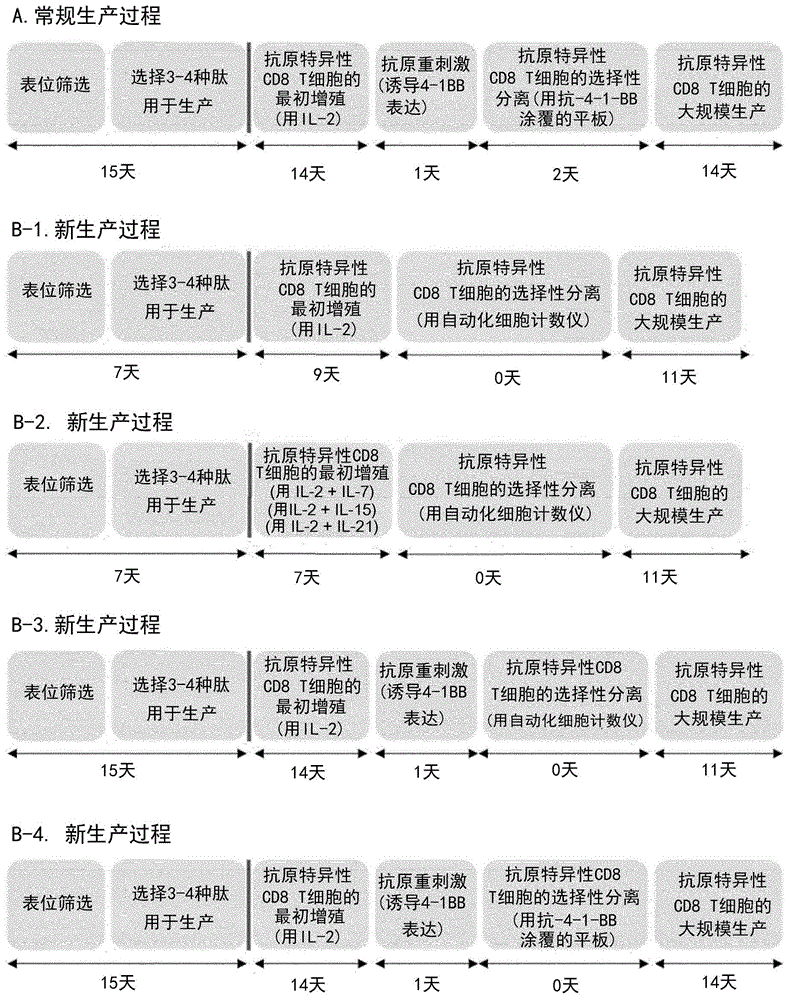
是与上述专利披露的相同的t细胞或其生产方法。这些专利参考文献公开了分离和大规模培养用于以病毒抗原(ebv/lmp2a、cmv/pp65)或自体抗原(wt1、htert、ny-eso-1等)形式的外来抗原的抗原特异性cd8+t细胞的技术。然而,在现有的采用被覆有抗4-1bb抗体的平板分离抗原特异性cd8+t细胞的技术中,分离细胞的纯度随操作人员的技能不同而有很大差异,细胞的培养过程也非常复杂。此外,由于生产过程需要30天或更长时间,因此目前仍然需要尽可能缩短生产用于临床应用的细胞疗法所需的时间。因此,有必要更容易地分离抗原特异性cd8+t细胞,并通过快速大规模增殖这些细胞来缩短整个培养过程。发明详述技术任务本发明旨在提供以高纯度制备的含有cd8+t细胞的药物组合物。此外,本发明的目的是提供一种表位预先筛选方法,用于筛选从癌抗原中衍生的表位,它们是在7天内产生癌抗原特异性cd8+t细胞所必需的,以及一种在20天内选择性分离和大量增殖抗原特异性cd8+t细胞的方法。解决问题的手段1.一种用于预防或治疗癌症的药物组合物,其包含癌抗原特异性细胞毒性t细胞,其中所述药物组合物包含至少约7×106细胞/ml,并且在所述约7×106细胞/ml中,至少约90%为cd8+t细胞,并且所述cd8+t细胞中的至少80%为cd45ro表达细胞,或这些cd8+t细胞中有20%或更少是表达cd45ra的细胞。2.根据第1项所述的用于预防或治疗癌症的药物组合物,其中所述药物组合物通过以下方法生产,所述方法包括:(a)步骤:选择癌症患者血液中存在的癌抗原衍生表位;(b)用该表位和由il-2、il-7、il-15和il-21组成的组中选择的至少一种细胞因子孵育从癌症患者血液中分离的外周血单核细胞(pbmc);(c)从(b)步骤中培养的细胞中选择同时表达cd8和4-1bb的细胞;和(d)用抗cd3抗体和il-2孵育步骤(c)中选出的t细胞。3.根据第1项所述的用于预防或治疗癌症的药物组合物,其中所述癌抗原是从由htert、ny-eso1、mage-a3、wt1和ebv组成的组中选择的至少一种。4.根据第2项所述的用于预防或治疗癌症的药物组合物,其中在步骤(a)或(b)中使用至少2种表位。5.根据第2项所述的用于预防或治疗癌症的药物组合物,其中使用封闭系统流式细胞仪执行步骤(c)。6.一种生产用于预防或治疗癌症的药物组合物的方法,包括:(a)步骤:选择癌症患者血液中存在的癌抗原衍生表位;(b)步骤:用该表位和从由il-2、il-7、il-15和il-21组成的组中选择的至少一种细胞因子孵育从癌症患者血液中分离的外周血单核细胞(pbmc);(c)步骤:从在(b)步骤中培养的细胞中选择同时表达cd8和4-1bb的细胞;和(d)步骤:用抗cd3抗体和il-2孵育在(c)步骤中选择的t细胞;并且其中所述药物组合物包含至少约7x106细胞/ml的癌抗原特异性细胞毒性t细胞,并且这约7x106细胞/ml中至少约90%是cd8+t细胞,并且至少80%的这些cd8+t细胞是表达cd45ro的细胞,或者20%或更少的这些cd8+t细胞是表达cd45ra的细胞。7.根据第6项所述的方法,其中所述癌抗原是从由htert、ny-eso1、mage-a3、wt1和ebv组成的组中选择的至少一种。8.根据第6项所述的方法,其中在步骤(a)或(b)中使用至少2种表位。9.根据第6项所述的方法,其中使用封闭系统流式细胞仪执行步骤(c)。10.一种制备用于预防或治疗癌症的药物组合物的方法,包括:施用用于预防或治疗癌症的药物组合物的步骤,该药物组合物包括药物有效量的癌抗原特异性细胞毒性t细胞;其中,所述药物组合物包括至少约7x106细胞/ml的癌抗原特异性细胞毒t细胞,其中该约7×106细胞/ml中至少约90%为cd8+t细胞,且这些cd8+t细胞中至少80%为表达cd45ro的细胞,或这些cd8+t细胞中的20%或更少为表达cd45ra的细胞。11.根据第10项所述的方法,其中所述药物组合物通过以下方法生产,所述方法包括:(a)步骤:选择癌症患者血液中存在的癌抗原衍生表位;(b)用该表位和从由il-2、il-7、il-15和il-21组成的组中选择的至少一种细胞因子孵育癌症患者血液中分离的外周血单核细胞(pbmc);(c)从(b)步骤中培养的细胞中选择同时表达cd8和4-1bb的细胞;和(d)用抗cd3抗体和il-2孵育(c)步骤中选出的t细胞。12.根据第10项所述的方法,其中所述癌抗原是从由htert、ny-eso1、mage-a3、wt1和ebv组成的组中选择的至少一种。13.根据第11项所述的方法,其中在步骤(a)或(b)中使用至少2种表位。14.根据第11项所述的方法,其中使用封闭系统流式细胞仪执行步骤(c)。发明效果本发明的含cd8+t细胞的药物组合物可包含高纯度的癌抗原特异性cd8+t细胞。本发明的含cd8+t细胞的药物组合物具有卓越的抗癌效果。本发明的含cd8+t细胞的药物组合物具有作为t细胞治疗剂的卓越临床效果。本发明的cd8+t细胞生产方法能够快速而直接地筛选衍生自癌抗原的表位,它们是生产癌抗原特异性cd8+t细胞所需的。本发明的cd8+t细胞生产方法使得选择性分离和大规模培养高纯度的癌抗原特异性cd8+t细胞成为可能。本发明的cd8+t细胞生产方法使快速产生癌抗原特异性cd8+t细胞成为可能。本发明的cd8+t细胞生产方法可应用于gmp过程。本发明的cd8+t细胞生产方法使得选择性分离和大规模培养高纯度的癌抗原特异性cd8+t细胞成为可能。附图简要说明图1示意性地描绘了产生癌抗原特异性cd8+t细胞的过程。图2显示了根据常规方法的表位筛选结果和根据本发明方法的表位筛选结果。图3显示了由抗原特异性cd8+t细胞治疗剂(therapeutic)生产过程和20天过程产生的抗原特异性cd8+t细胞表型的确认结果。图4显示了根据自我评估标准和t细胞治疗产品试验项目进行的试验结果。图5显示了由抗原特异性cd8+t细胞治疗剂生产过程和15天过程产生的抗原特异性cd8+t细胞表型的确认结果。图6显示了根据自我评估标准和t细胞治疗产品试验项目进行的试验结果。图7和图8显示了用自动细胞分选机分离ebv特异性cd8+t细胞并用流式细胞仪对其进行分析的结果。实施本发明的最佳方式本发明涉及一种用于预防或治疗癌症的药物组合物,其包含对癌抗原(例如,ebv、cmv、htert、ny-eso-1、wt1、mage-a3等)具有特异性的高纯度细胞毒性t细胞。此外,在使用癌细胞特异性免疫细胞的癌细胞治疗领域,本发明涉及一种分离和增殖癌抗原特异性细胞毒性t细胞的方法,该方法使得能够在7天内快速筛选产生癌抗原特异性细胞毒性t细胞所需的癌肽(表位);和在20天内快速、简便地分离和大量培养高纯度的抗原特异性cd8+t细胞。本发明的药物组合物包含对癌抗原(例如,ebv、cmv、htert、ny-eso-1、wt1、mage-a3、neo抗原等)具有特异性的细胞毒性t细胞;从初次增殖到完成最终t细胞大规模培养后冷冻所用的时间可为31天;改进的生产工艺也可以是26天,20天或15天。(图1)。本发明的药物组合物可包含65%或更多癌抗原特异性细胞毒性t细胞(例如,cd8+t细胞)。例如,本发明的药物组合物可包含65%、70%、75%、80%、85%、90%、95%或99%或更多的cd8+t细胞。在本发明的一个实施方式中,本发明的药物组合物可以是在10%或更多,或20%或更多的所述cd8+t细胞中表达的一种或多种tcrp型。在本发明的一个实施方式中,表达cd45ro的细胞构成本发明药物组合物的cd8+t细胞的至少60%、至少70%、至少80%、至少90%或至少95%;在本发明的另一个实施方式中,本发明药物组合物的cd8+t细胞的至少80%是表达cd45ro的细胞。在本发明的一个实施方式中,表达cd45ra的细胞占本发明药物组合物的cd8+t细胞的30%或更少、20%或更少、10%或更少、或5%或更少;在本发明的另一实施方式中,本发明药物组合物的cd8+t细胞的20%为表达cd45ra的细胞。本发明的药物组合物可采用以下生产方法制备。本申请的一个方面涉及一种增殖和分离癌抗原特异性cd8+t细胞的方法;该方法的一个实施方式包括:(a)步骤:首先用源自癌抗原的相应肽培养从癌症患者血液中分离的pbmc(外周血单核细胞),和,筛选活化的t细胞以筛选癌抗原cd8+t细胞表位;b)步骤:在包含筛选的表位和从由il-2、il-7、il-15和il-21组成的组中选择的至少一种细胞因子的培养基中培养从癌症患者血液中分离的pbmc,从而在pbmc中诱导4-1bb表达;以及c)步骤,对细胞进行染色,其中用抗-4-1bb抗体和抗cd8抗体诱导所述细胞中4-1bb的表达,然后将其分离。将在下面逐步描述本发明用于筛选抗原表位以产生抗原特异性cd8+t细胞以及分离和增殖抗原特异性cd8+t细胞的方法。在根据本申请的方法中,cd8+细胞表位分选或筛选的步骤旨在增加对癌细胞的亲和力或增加存在于血液中的0.1%或更低的低浓度癌抗原特异性cd8+t细胞的浓度,并且是实现选择性增殖和分离癌抗原特异性cd8+t细胞的第一步。在该步骤中,可使用cd8+细胞能够识别的各种癌抗原(例如ebv、cmv、htert、ny-eso-1、wt1、mage-a3等)源性的表位。然而,这取决于个体患者的情况。换句话说,即使多种癌抗原中相同类型的癌抗原,例如ebv、cmv、htert、ny-eso-1、wt1、mage-a3等,可作为表位的部分取决于每个患者的hla-a类型和状况。因此,即使在相同的癌抗原内,通过表位筛选选择和使用个体癌症患者血液中存在的癌抗原cd8+t细胞表位很重要,因为对于每个癌症患者,可作为抗原表位的肽部分是不同的。一般来说,为了用于制备t细胞治疗剂,选择3-4种类型的肽作为表位。本申请的方法包括从多种癌抗原中选择最适合于在个体中选择和增殖cd8+t细胞的表位;可以使用能够实现此目的的各种癌抗原,包括自体和非自体抗原。例如,来源于患者自身基因的自体癌抗原包括htert(genbank:bac11010.1)、wt1(genbank:aao61088.1)、ny-eso1(genbank:caa05908.1)、mage-a3(ncbi参考序列:np_005353.1)和癌症特异性突变抗原,例如新抗原(neoantigens)、突变的p53、ras等,可包括肿瘤抑制物或促进基因(triggergene),以及外源癌抗原,例如致癌病毒抗原,例如cmv、ebv、hpv等。然而,本申请公开的本发明特征不限于本文,本发明从针对每种类型的癌症具有特异性的各种不同的癌抗原中为每个个体选择最佳表位,并使用它们产生t细胞。已知的自体癌抗原是例如wt1、htert、ny-eso1、间皮素、mage等。例如,htert是一种自体型癌抗原,其是一种在染色体末端合成端粒dna的酶,癌细胞对其过度激活以逃避端粒依赖性细胞死亡,其已知是肺癌、胃癌和胰腺癌等多种实体癌的靶抗原(kimnw,等.science.1994;266:2011-2015);wt1是一种与肾母细胞瘤(wilms)相关的基因,编码一种锌指转录因子,一种参与细胞增殖、分化、凋亡和器官发育的蛋白质,已知是脑脊液癌、肺癌等的靶抗原(callkm等,cell.1990.60:509-520;nakaharay等,braintumorpathol.2004.21:113-6)。此外,前述ny-eso1是癌-睾丸抗原(cta)蛋白,并且已知主要在生殖细胞、肉瘤和包括乳腺癌在内的各种癌细胞中表达(gnjatics等,advcancerres.2006;95:1-30)。mage-a3是一种属于黑色素瘤相关抗原家族的蛋白,其在健康细胞中的功能尚不清楚,但已知其在多种癌细胞,包括肺癌、肉瘤和黑色素瘤中过度表达,并且已被评估为癌症免疫治疗的合适靶抗原(decosterl等人,annoncol.2012年6月;23(6):1387-93)。因此,在本申请的方法中,已知与特定癌症相关的癌抗原可用于产生个体癌抗原cd8+t细胞。此外,已知病毒癌抗原,包括例如ebv、hpv、mc多瘤病毒、hbv、hcv、和cmv;已知艾巴氏(epstein-barr)病毒抗原作为霍奇金淋巴瘤、鼻咽癌、胃癌、伯基特淋巴瘤和nk/t淋巴瘤的靶抗原,而人乳头瘤病毒抗原是子宫癌和头颈癌的靶抗原,而mc多瘤病毒被称为默克尔(merkel)细胞癌的靶抗原。还已知乙型和丙型肝炎病毒是肝癌的靶细胞。作为组织特异性癌抗原,酪氨酸酶、gp100和mnrt-1被称为黑色素瘤靶抗原,psma、pap和psa被称为前列腺癌靶抗原。使用来自癌抗原的两种、三种、四种、五种或更多种肽。特别是,考虑用作为表位的3-4种肽制备t细胞疗法,所使用的来自癌抗原的肽数目至少为4或更多、5或更多、6或更多、7或更多、8或更多、9或更多,或更多,但不限于此,并且鉴于本申请的方法的特征和相关领域的技术,可以留给本领域技术人员来确定。本申请的方法包含的表位筛选步骤与传统表位筛选过程的不同之处在于,在筛选过程中,可通过筛选活化t细胞(例如,4-1bb+cd8+t细胞)的方法来选择表位。例如,在抗原刺激后,选择活化的t细胞,并且可以通过检测所存在的活化t细胞(例如,4-1bb+cd8+t细胞)的存在和量来选择能够诱导此类细胞的抗原表位。可使用自动细胞分选机筛选活化的t细胞(例如,4-1bb+cd8+t细胞)。自动细胞分选机可用于gmp法。例如,它可以是封闭系统自动细胞分选机,对外部环境封闭。在下一步中,通过在包含所选表位和细胞因子的组合的培养基中培养这些pbmc,在从癌症患者血液中分离的pbmc中诱导4-1bb表达。由于癌抗原特异性cd8+t细胞在血液中以低浓度(0.1%或更低的浓度)存在,因而通过向从血液中分离的pbmc中添加一种或多种细胞因子和3-4种肽(通过表位筛选选择),然后孵育7至9天,可以使对癌抗原衍生的肽具有特异性的cd8+t细胞增殖,并诱导4-1bb表达(图1,b-1,b-2)。因此,总孵育期可减少到29天或更短、26天或更短、20天或更短、18天或更短,特别是15天。在根据本申请的一个实施方式中,细胞因子可以是从il-2、il-7、il-15和il-21的组中选择的任何一种。在另一实施方式中,细胞因子可以是从il-2、il-7、il-15和il-21组中选择的至少两种的组合。例如,细胞因子可以是il-2和il-7、il-2和il-15、il-2和il-21、il-7和il-15、il-7和il-21或il-15和il-21的组合。常规癌抗原特异性cd8+t细胞的增殖在培养14天内进行,在培养的第14天,需另再活化24小时,以诱导抗原特异性cd8+t细胞4-1bb表达。在本实施例中,本申请的步骤b)可在7、8、9、10、11、12、13或14天期间进行。鉴于本申请的目的,在根据本申请的方法的第一和第二步骤中使用的外周血单核细胞(pbmc)来自同一患者。可以使用本领域已知的方法从全血分离pbmc。在第三步中,使用抗-4-1bb抗体和抗cd8抗体染色后,分离经诱导以具有4-1bb表达的抗原特异性细胞。可使用例如自动细胞分选机进行分离。使用自动细胞分选机分离抗原特异性4-1bb+cd8+t细胞可改善使用被覆有4-1bb抗体的平板的传统方法所引起的若干问题,例如纯度和工作难度。利用4-1bb蛋白,在用使用抗cd8抗体和4-1bb抗体对仅在抗原刺激的cd8+t细胞表面表达并与荧光标记剂偶联的标志物染色后,可有效分离同时具有两种荧光的抗原特异性cd8+t细胞。如上所述,使用自动细胞分选机选择表达4-1bb+的cd8+t细胞的制备方法可用于制备对诸如ebv、htert、ny-eso-1、wt1和mage-a3等癌抗原具有特异性的cd8+t细胞。如上所述,通过使用自动细胞分选机选择表达4-1bb+的cd8+t细胞的方法制备的药物组合物可包括至少90%的癌抗原特异性细胞毒性t细胞(例如,90%、91%、92%、93%、94%、95%、96%、97%、98%或99%)。通过使用如上所述的自动细胞分选机选择表达4-1bb+的cd8+t细胞的制备方法制备的药物组合物(例如,包含对bv、cmv、htert、ny-eso-1、wt1或mage-a3具有特异性的细胞毒性t细胞的组合物)具有高纯度的癌抗原特异性细胞毒性t细胞,并且因此具有作为t细胞治疗剂的优越临床疗效(例如抗癌疗效等)。在上述筛选步骤中使用的自动细胞分选机可以用于gmp法。例如,可以是封闭系统自动细胞分选机。根据本申请的方法还包括大量增殖这些分离的4-1bb+cd8+t细胞的步骤。大规模增殖步骤可包括在包含il-2、抗cd3抗体和自体血浆(autologousplasma)的培养基中培养分离的癌抗原特异性cd8+t细胞和经辐照的同种异体pbmc的步骤。在一个实施方式中,4-1bb+cd8+t细胞(5x105-3x106细胞)、分离于1l培养容器(培养袋或g-rex装置)中的经辐射的同种异体pbmc(1x108-3x108细胞)、1000u/mlil-2和30ng抗cd3mab经混合并以7到11天的常规间隔添加到培养基中,然后对细胞进行大规模培养,以使其稳定增殖到超过1x109个细胞/升的水平,在这个水平上可以对癌症患者给药。包含根据本发明的癌抗原特异性细胞毒性t细胞的用于癌症预防或治疗的药物组合物可包含约1x106细胞/ml或更多、约2x106细胞/ml或更多、约3x106细胞/ml或更多、约4x106细胞/ml或更多,约5x106细胞/ml或以上,约6x106细胞/ml或以上,约7x106细胞/ml或以上,约8x106细胞/ml或以上,约9x106细胞/ml或以上,约1x107细胞/ml或以上,约2x107细胞/ml或以上,约3x107细胞/ml或以上,约4x107细胞/ml或以上,约5x107细胞/ml或以上,约6x107细胞/ml或以上,约7x107细胞/ml或以上,约8x107细胞/ml或以上,约9x107细胞/ml或以上,约1x108细胞/ml或以上,约2x108细胞/ml或以上,约3x108细胞/ml或以上,约4x108细胞/ml或以上,约5x108细胞/ml或以上,约6x108细胞/ml或以上,约7x108细胞/ml或以上,约8x108细胞/ml或以上,或约9x108细胞/ml或以上,但本领域普通技术人员能够在可获得相同效果的范围内调节细胞毒性t细胞的浓度。另外,在包含在本发明的药物组合物中的细胞中,约90%或更多是cd8+t细胞。癌抗原至少是从oy-tes-1、htert、ny-eso1、mage-a3、wt1、psma、tarp、间皮素、酪氨酸酶、gp100、mnrt-1、pap、psa、cmv、hcv、hbv、mc多瘤病毒、hpv和ebv组中选择的至少一种。本发明公开的“组合物”是指根据本发明的细胞毒性t细胞作为活性成分和非活性成分(例如天然或人工运载体、标记物或检测物),以及活性成分(例如佐剂、稀释剂、偶联剂、稳定剂、缓冲剂、盐、亲脂性溶剂和防腐剂)的组合,且包括药学上可接受的载体。运载体还可包括药物学上的赋形剂和额外的蛋白质、肽、氨基酸、脂类和糖类(例如单糖;二糖;三糖;四糖;寡聚糖;醛糖醇、醛酸、糖源多糖(如酯化糖或糖聚合物等),单独或组合时,在1至99.99wt%或体积%下。蛋白质赋形剂包括例如人血清白蛋白、重组人白蛋白、明胶、酪蛋白等,但不限于此。可起缓冲作用的代表性氨基酸组分包括例如丙氨酸、精氨酸、甘氨酸、甜菜碱、组氨酸、谷氨酸、天冬氨酸、半胱氨酸、赖氨酸、亮氨酸、异亮氨酸、缬氨酸、甲硫氨酸、苯丙氨酸、阿斯巴甜等,但不限于此。碳水化合物赋形剂还包括例如,单糖,如果糖、麦芽糖、半乳糖、葡萄糖、d-甘露糖、山梨糖;二糖,如乳糖、蔗糖、海藻糖、纤维二糖;多糖,如棉籽糖、麦芽糊精、葡聚糖和淀粉;以及醛糖,如甘露醇、木糖醇、麦芽糖醇、乳糖醇、山梨醇等,和肌醇;但不限于此。本领域技术人员将能够通过本领域已知的方法来配制本发明的药物组合物。例如,根据需要,可以与水或其它药学上可接受的液体以注射无菌溶液或悬浮液的形式胃肠外使用。例如,可适当地与药学上可接受的运载体或介质组合,特别是无菌水或盐溶液、植物油、乳化剂、悬浮剂、表面活性剂、稳定剂、赋形剂、运载体、防腐剂、粘合剂等;可按公认的药剂学规范要求的单位剂型混合配制。配方中使用的活性成分量可获得指示范围内的合适剂量。此外,注射用无菌组合物可使用赋形剂液体(例如注射用蒸馏水)根据常规配制规程调配。对于注射用水溶液,可使用例如生理盐水的组合;等渗溶液,包括葡萄糖或其他辅助剂,例如d-山梨醇、d-甘露糖、d-甘露醇、氯化钠和合适的助溶剂,例如醇,尤其是乙醇和多元醇,例如丙二醇、聚乙二醇和非离子表面活性剂,例如聚山梨酯80(tm)、hco-50。油性液体包括例如芝麻油和豆油,并且可与苯甲酸苄酯和苯甲醇组合作为溶解助剂。注射制剂可例如通过静脉注射、动脉内注射、选择性动脉内注射、肌肉内注射、腹膜内注射、皮下注射、脑室内注射、颅内注射、髓内注射等给药;然而,优选地,通过静脉内注射给药。本发明的组合物包含药物有效量的t细胞。有效量可由本领域普通技术人员基于本说明书中的公开内容容易地确定。一般而言,通过首先施用低浓度的活性成分,然后逐渐增加浓度来确定药物有效量,直到在没有任何副作用的情况下在对象中获得所需效果(例如,与癌症相关的症状减轻或消除)。例如,在goodman和gilman的《治疗剂的药理学基础》(pharmacologicalbasisoftherapeutics),goodman等编,第11版,麦格劳·希尔公司(mcgraw-hill)2005和《雷明顿:药学的科学与实践》(thescienceandpracticeofpharmacy),第20版和第21版,gennaro和费城科学大学编,lww出版公司(lippencottwilliamsandwilkins)(2003年和2005年)中描述了确定用于施用根据本发明的组合物的给药的适当剂量或施用间隔的方法。根据本发明的组合物的给药方法可以基于各种因素来确定,例如对象的癌症类型、年龄、体重、性别、医疗状况、疾病的严重程度、给药途径和其他单独给药的药物。因此,尽管给药方法变化很大,但是可以根据常用方法来确定。对对象施用的根据本发明的组合物的量可由多种因素确定,例如施用方法、对象的健康状况、体重和医疗建议;所有这些因素均在本领域普通技术人员的知识范围内。包含根据本发明的癌抗原特异性细胞毒性t细胞的用于癌症预防或治疗的药物组合物可包含约1x106细胞/ml或更多、约2x106细胞/ml或更多、约3x106细胞/ml或更多、约4x106细胞/ml或更多,约5x106细胞/ml或更多,约6x106细胞/ml或更多,约7x106细胞/ml或更多,约8x106细胞/ml或更多,约9x106细胞/ml或更多,约1x107细胞/ml或更多,约2x107细胞/ml或更多,约3x107细胞/ml或更多,约4x107细胞/ml或更多,约5x107细胞/ml或更多,约6x107细胞/ml或更多,约7x107细胞/ml或更多,约8x107细胞/ml或更多,约9x107细胞/ml或更多,约1x108细胞/ml或更多,约2x108细胞/ml或更多,约3x108细胞/ml或更多,约4x108细胞/ml或更多,约5x108细胞/ml或更多,约6x108细胞/ml或更多,约7x108细胞/ml或更多,约8x108细胞/ml或更多,或约9x108细胞/ml或更多,但本领域普通技术人员能够在可获得相同效果的范围内调节细胞毒性t细胞的浓度。其也可与以下物质组合:缓冲剂,例如磷酸盐缓冲溶液或醋酸钠缓冲溶液;镇痛剂,例如盐酸普鲁卡因;稳定剂,例如苯甲醇、苯酚和抗氧化剂。制备的注射溶液通常装入合适的安瓿中。悬浮液和乳液可包含例如天然树胶、琼脂、海藻酸钠、果胶、甲基纤维素、羧甲基纤维素或聚乙烯醇作为运载体。用于肌肉内注射的悬液或溶液与活性化合物一起包括医药上可接受的载体,例如无菌水、橄榄油、油酸乙酯、二醇(例如丙二醇),以及(如有必要)适量的盐酸利多卡因。包含本发明的细胞毒性t细胞的药物组合物可例如通过静脉注射(丸剂注射)或连续输注给对象。例如,根据本发明的药物组合物可在1小时或更短时间内、至少1小时、至少2小时、至少3小时、至少4小时、至少8小时、至少5小时至少12小时,至少1天,至少2天,至少3天,至少4天,至少5天,至少6天,至少7天,至少2周,至少3周,至少4周,至少1个月,至少3个月,至少6个月,或按照临床判断确定的间隔连续或以指定时间间隔施用至少1次、至少2次、至少3次、至少4次或至少5次。可注射制剂可以安瓿形式或具有多剂量容器的单位剂型配制。然而,本领域的普通技术人员将理解,根据本发明的药物组合物的剂量可取决于各种因素,例如对象的年龄、体重、身高、性别、一般医疗状况和先前的治疗史。在本发明中,术语“癌症”是指由异常、不受控制的细胞生长引起的众多疾病或紊乱中的任何一种。可能致癌的细胞称为癌细胞,具有不受控制的增殖、永生、转移潜能、快速生长和增殖等独特的类型特征。通常,癌细胞可能以肿瘤的形式存在,但这种细胞可能在哺乳动物中单独存在,也可能是非肿瘤细胞,如白血病细胞。癌症可通过以下检测:通过检测肿瘤存在的临床或放射学方法;通过检测肿瘤细胞或通过活检等方式获得的其他生物样本;通过检测癌症血液标志物,如ca125、pap、psa、cea、afp、hcg、ca19-9、ca15-3、ca27-29、ldh和nse;或通过检测癌症标志物基因型,如tp53和atm。然而,上述方法的阴性发现并不一定意味着非癌症诊断:例如,一个被发现已经从癌症中完全康复的对象可能仍然患有癌症,正如复发所证实的那样。在本说明书中,术语“约”是指本领域常用的范围,例如,在平均值的2个标准偏差内。“约”可理解为在所示值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%,或0.01%之内。如本文所用,术语“抗癌”包括“预防”和“治疗”;“预防”是指通过施用包含本发明抗体的组合物抑制或延缓癌症的任何行为,“治疗”是指通过施用本发明抗体改善或有益地改变癌症症状的任何行为。下面,参照以下实施例详细说明本发明。这些实施例旨在更具体地说明本发明,并且它们不限制本发明的范围。实践实施例1:癌抗原的选择及cd8+t细胞表位筛选ebv(艾巴氏病毒)是儿童时期最常见、最普遍的传染病,通常不会引起症状,但大多数人都存在免疫记忆。ebv也是多种ebv阳性肿瘤的病因之一。因此,使用ebv抗原作为可在健康个体和癌症患者中诱导免疫应答的代表抗原如下进行患者特异性表位筛选。ebv氨基酸序列采用传统算法(ctlprid:http://www.imtech.res.in/raghava/ctlbri/,netctl:http://www.cbs.dtu.dk/services/netctl/,syfpeiti:http://www.syfpeiti.de/)分析,用于确定被预测为是cd8+t细胞表位的氨基酸序列,并对所选表位肽进行化学合成(菲特伦株式会社;www.peptron.com),用于表位筛选。从ebv抗原中选择的cd8+t细胞表位如下表1所示。[表1]使用表1中选择的ebvcd8+t细胞表位,按照图1中描述的步骤(a:常规表位筛选方法总共15天;b:根据本申请表位筛选方法总共7天)筛选具有高t细胞反应性的表位。具体而言,使用ebv阳性健康个体供体的外周血单核细胞(pbmc)进行ebvcd8+t细胞表位筛选。pbmc从外周血中分离并清洗后,以1x106细胞/ml悬浮在ctl(细胞毒性t淋巴细胞)培养基(rpmi1640培养基+4mml-谷氨酰胺+12.5mmhepes+50μm2-巯基乙醇+3%自体血浆)中,将各1ml等份装入14ml圆试管。然后将所选择的表位肽分别以浓度为2μg/ml添加到相应试管中,并在co2培养箱中培养。然后,在根据本申请的方法中,在培养的第二天,向每管添加1ml包含100u/mlil-2的ctl培养基。在培养的第7天从每个试管中收集培养肉汤,并根据制造商的方法使用流式细胞仪珠阵列(bd生物科学公司)分析ifn-γ的量。在常规表位筛选方法中,在培养的第7、9、11和13天移出1ml培养基,然后添加1ml包含100u/mlil-2的ctl培养基。在培养的第14天,将rpmi1640培养基添加到每个试管中,并且通过在1400rpm下离心5分钟洗涤细胞3次。将洗涤后的细胞悬浮于1mlctl培养基中后,以2μg/ml添加相同的表位肽并孵育。24小时后,从各管收获细胞,用抗cd8-pe-cy5和抗4-1bb-pe抗体(bd生物科学公司)染色,用于流式细胞术,分析表达4-1bb的cd8+t的比例,以分析活化了cd8+t细胞的表位肽。在常规表位筛选方法中,发现在cd8+t细胞中强烈诱导4-1bb表达的抗原表位是编号为1、3、9、11、13和14的抗原表位(图2a)。在根据本申请的表位筛选方法的情况下,第7天,来自培养基的ifn-γ的量表明培养肉汤中表位肽1、9、11、13的强烈生成(图2b)。结果表明,根据本申请的表位筛选方法中通过ifn-γ生成量选择的癌抗原表位与通过常规cd8+t细胞中4-1bb表达分析选择的癌抗原表位相似。这些结果表明,根据本申请的方法能够在不超过7天的短时间内筛选生产t细胞治疗剂所需的癌抗原表位,同时也使得该过程比传统方法更简单,并且将时间从15天减少到7天,减少了50%以上。常规方法在15天过程中选出增加表达4-1bb的cd8+t细胞的至多4个抗原表位;本申请的方法在7天过程中基于ifn-γ的生产选择了多达4个抗原表位。这两种方法选择了相似的抗原表位,但最重要的是,根据本申请的方法不仅解决了常规方法中15天筛选的问题,而且更准确,因为它测量了目前正在增殖的抗原特异性cd8+t细胞产生的ifn-γ。使用选定表位进行t细胞增殖的实践实例如图5和6所示。实践实施例2:按本申请方法(20天过程)进行抗原特异性细胞治疗剂的中试生产大多数人在生长过程中感染cmv(巨细胞病毒),形成t细胞的免疫记忆,具有很强的抗原性,从而诱导抗原特异性cd8+t细胞增殖;业已开发出用于检测抗原特异性cd8+t细胞的i型mhc的五聚体,并已上市。因此,使用cmv阳性健康个体的血液,根据图3中描述的步骤进行抗原特异性cd8+t细胞治疗剂的测试。t细胞治疗的产生包括增殖、分离,和大规模培养对表位肽具有特异性的cd8+t细胞;具体实验方法及结果如下。2-1.抗原特异性cd8+t细胞的增殖如下所示从cmv阳性健康个体的血液中分离pbmc。将7ml血液缓慢地流入15ml锥形管中,该锥形管中装有7mlficoll-泛影钠(ficoll-hypaque)并覆盖在ficoll溶液的顶部。试管在室温下以2000rpm离心20分钟,仅收集、洗涤位于ficoll和血浆之间的白细胞层,用于pbmc。然后从pbmc层上方的浅黄色层中分离出自体血浆,使用滤膜过滤,然后使用。然后将分离的pbmc以1x106细胞/ml悬浮于ctl培养基(rpmi1640培养基+4mml-谷氨酰胺+12.5mmhepes+50μm2-巯基乙醇+3%自体血浆)中,并以2μl/ml添加cmv肽(nlvpmvatv,cmv/pp65495-504,菲特伦株式会社(peptronltd.))以达到2μg/ml的浓度。然后将这些细胞悬浮液以1ml的量等分置于14ml圆管中,并在co2培养箱中开始培养。在培养的第二天,向每个试管中添加含有100u/mlil-2(阿地白介素(proleukin),诺华(novatis))+3%自体血浆的1mlctl培养基。培养7天后,去除1ml上清培养基,加入含有100u/mlil-2+3%自体血浆的ctl培养基,再培养2天。2-2.抗原特异性cd8+t细胞的选择性分离培养第9天,收集培养液中的pbmc,并用磷酸缓冲盐水(pbs)洗涤两次。洗涤后的pbmc在4℃下用抗4-1bb抗体和抗cd8抗体染色30分钟,然后用pbs洗涤两次。染色后,使用自动细胞分选机(制造商和型号名称1:美天旎生物技术有限公司(miltenyibio-tec),tyto;制造商和型号名称2:bd生物科学公司(bdbiosciences),bdfacsaria)分离洗涤的pbmc,并用rpmi1640培养基洗涤两次。随后,使用自动细胞计数仪(eve自动化细胞计数仪,nanoentek)对细胞进行计数,并使用alys505n培养基(株式会社细胞科学研究所(cellscience&technologyinst.,inc.))以5x105细胞/ml的水平悬浮细胞,然后进行下一步。2-3.抗原特异性cd8+t细胞的大规模培养从200ml健康献血者血液中分离出pbmc,以1x107细胞/ml悬浮,然后以3000拉德辐射诱导细胞死亡,然后添加可提供诱导t细胞增殖所需的共刺激的培养添加剂。向50ml锥形管中添加在实践实施例2-1中分离的5×105抗原特异性cd8+t细胞和1×108经辐照的同种异体pbmc,随后添加高达50ml的alys505n培养基,其包含1000u/mlil-2、30ng/ml抗cd3单克隆抗体(bd生物科学公司)和3%自体血浆。将50ml细胞悬液注入1l培养容器(1l培养袋(nipro)或1lg-rex装置(wilson-wolf)),然后在co2培养箱中培养。在培养的第3天,在1l培养容器中另注射含有1000u/mlil-2、3%自体血浆的150mlalys505n培养基。在培养的第6天,在1l培养容器中另注射含有1000u/mlil-2、3%自体血浆的300mlalys505n培养基。在培养的第9天,在1l培养容器中另注射含有1000u/mlil-2、3%自体血浆的500mlalys505n培养基。在培养第11天,收集1l培养容器中的所有细胞,用生理盐水注射液洗涤三次,然后悬浮在含5%白蛋白的生理盐水注射液中,以使最终的t细胞治疗剂带电(charge)。因此,在20天的过程中产生的抗原特异性cd8+t细胞被发现是具有cd3+、cd8+、cd45ro+、cd45ra-、cd62l-(cd62l+;约7.4%)、ccr7-和cd27-(cd27+;约7.5%)表型的cmv特异性cd8+t细胞(图3)。最终产物按照现行有效的t细胞治疗成品评价标准(食品药品安全部《t细胞治疗成品临床试验自我评价标准》)进行分析。评价标准的检测项目如表2所示,即:1)细胞总数检测:检测所产生的t细胞是否符合成品评价标准。2)细胞活力:检测产生的t细胞治疗剂的活力是否高于评价标准水平的70%。3)确认检测:测试成品的cd8+t细胞比率是否至少为65%。检测cd45ra以考察产生的t细胞是否具有原始cd8+t表型,检测cd45ro以考察产生的t细胞是否具有效应/记忆cd8+t表型。4)纯度检测:剩余物检测,用于确定cd57中存在多少衰老的cd8+t细胞;pd-1中存在多少无功能的cd8+t细胞(耗尽的cd8+t);抗cd3中,成品中剩余多少用于大规模生产的抗体。5)细胞功能测试:tcrvβ分型检测引入用于产生细胞的抗原表位的具有特定tcr类型的cd8+t细胞是否以至少20%的水平产生;ifn-γ产量和lamp1表达检测有多少cd8+t细胞具有抗原特异性作用机制。[表2]分析证实,生产的t细胞治疗剂符合食品和药物管理局批准的t细胞治疗自我评估标准和测试项目(图4)。此外,比较根据常规生产工艺(使用涂有抗-4-1bb抗体的平板的细胞分离工艺)生产的t细胞治疗剂的质量和使用如上所述本申请的自动细胞分选机的细胞分离工艺,根据表2中给出的测试项目和测试标准,表明尽管两种工艺中产生的t细胞疗法都适合进行临床试验(图4),但根据本申请的方法生产的t细胞治疗剂的总细胞计数、纯度和活力均更加卓越。特别是,根据本申请的工艺生产的大部分cd8+t细胞治疗剂纯度为至少95%。这些结果表明,根据本申请的方法能够在比常规方法更短的时间内直接快速地产生高纯度的t细胞。实践实施例3:根据本申请方法的ebv特异性cd8+t细胞治疗剂的中试生产(20天过程)3-1.ebv特异性cd8+t细胞的增殖从ebv阳性健康个体的血液中分离pbmc,在实施例2第2-1项的过程中,使用ebv肽代替cmv肽,并通过实践实施例1的过程选择所使用的ebv肽。3-2.ebv特异性cd8+t细胞的选择性分离以相同的方式执行实践实施例2的过程2-2,但使用bd生物科学公司的facsmelody作为自动细胞分选机,使用逻辑生物系统有限公司(logosbiosystems)的luna-fl作为自动细胞计数仪。3-3.抗原特异性cd8+t细胞的大规模培养辐射健康供体血液诱导细胞死亡,分离pbmc,以1×107细胞/ml悬浮并冷冻。经辐照的pbmc(同种异体pbmc)用作培养添加剂,以提供诱导t细胞增殖所需的共刺激。然后从pbmc层上方的浅黄色层中分离出同种血浆,使用滤膜过滤,然后使用。在50ml试管中,将选择性分离的ebv肽特异性cd8+t细胞和以200倍分离细胞计数制备的经辐照同种异体pbmc悬浮在30ml含有3%同种血浆(alloplasma)的alys505n培养基中。加入1000iu/ml的il-2和30ng/ml的抗cd3抗体。然后将30ml细胞悬浮液置于75t培养瓶中,并在co2培养箱中开始培养。在培养的第3天,将含有1000iu/mlil-2、3%同种血浆的20mlalys505n培养基添加到75t培养瓶中。在培养的第5至15天,每隔2至3天,添加等量的alys505n培养基(包含1000iu/mlil-2,3%同种血浆)。培养第15天收集所有培养细胞。如上所述,在20天的过程中,5名供体产生的ebv特异性cd8+t细胞的确认和纯度测试结果(见表2)证实满足表2所示的所有标准。[表3]此外,功效试验结果如下表所示,均符合表2的评估标准。[表4]供体lamp-1:cd8(%)(>10%)ifn-g:cd8(%)(>10%)129.548.4213.5312.88315.1518.75430.2048.02535.0619.94实践实施例4:根据本申请方法的ebv特异性cd8+t细胞治疗剂的中试生产(26天过程)4-1.ebv特异性cd8+t细胞的增殖实践实施例3的过程3-1以相同方式进行。4-2.ebv特异性cd8+t细胞的选择性分离在培养第14天,收获培养物中的pbmc并在rpmi培养基中洗涤。用自动细胞计数仪(逻辑生物系统有限公司,luna-fl)计数清洗后的pbmc,并将细胞悬浮在ctl培养基中,以2×106细胞/ml培养细胞。将3%的自体血浆和100iu/ml的il-2加入悬浮细胞的ctl培养基中,然后将以2×106个细胞/ml悬浮的细胞置于24孔板的每个孔中。在培养的第一天添加htert、wt1、ny-eso-1肽以达到2μg/ml的浓度,并在co2培养箱中培养。在培养第15天,收获培养物中的pbmc并在rpmi培养基中洗涤。洗涤后的pbmc在4℃下用抗4-1bb抗体和抗cd8抗体染色30分钟,然后用rpmi培养基洗涤两次。染色后,使用自动细胞分选机(bd生物科学公司,facsmelody)从表达4-1bb和cd8的细胞中选择性分离洗涤的pbmc。用rpmi培养基洗涤选择性分离的细胞,用自动细胞计数仪计数。用alys505n培养基悬浮分离的细胞,然后进行下一步。在供体5的例子中,使用对应于ebv5的肽以相同方式执行实践实施例4的过程4-1;使用pe-mhci型五聚体(普罗伊缪因有限公司(proimmune),a*02:01flyallalll)对通过自动细胞分选机分离的cd8+4-1bb+细胞进行染色,并使用流式细胞仪(bd生物科学公司,facscelesta)进行分析。结果表明,96.9%的细胞为ebv特异性cd8+t细胞。(图7和图8)。4-3.抗原特异性cd8+t细胞的大规模培养辐照健康供体血液诱导细胞死亡,分离pbmc,以1×107细胞/ml悬浮并冷冻储藏。经辐照的pbmc(同种异体pbmc)用作培养添加剂,以提供诱导t细胞增殖所需的共刺激。然后从pbmc层上方的浅黄色层中分离出同种血浆,使用滤膜过滤,然后使用。在50ml试管中,将选择性分离的ebv肽特异性cd8+t细胞和以200倍分离细胞计数制备的经辐照同种异体pbmc悬浮在30ml含有3%同种血浆(alloplasma)的alys505n培养基中。加入1000iu/ml的il-2和30ng/ml的抗cd3抗体。然后将30ml细胞悬浮液置于75t培养瓶中,并在co2培养箱中开始培养。在培养的第3天,将含有1000iu/mlil-2、3%同种血浆的20mlalys505n培养基添加到75t培养瓶中。在培养的第5至11天,每隔2至3天,添加等量的alys505n培养基(包含1000iu/mlil-2,3%同种血浆)。培养第11天收集所有培养细胞。如上所述,在26天的过程中,5名供体产生的抗原特异性cd8+t细胞的确认和纯度测试结果(见下表5)证实满足表2所示的所有标准。[表5]此外,功效试验结果证实满足表2的功效试验标准,如下表6所示。[表6]供体lamp-1(%)(>10%)ifn-g(%)(>10%)522.2824.19610.0717.10实践实施例5:根据本申请方法的ebv特异性cd8+t细胞治疗剂的中试生产(29天过程)5-1.ebv特异性cd8+t细胞的增殖实践实施例4的过程4-1以相同方式进行。5-2.ebv特异性cd8+t细胞的选择性分离实践实施例4的过程4-2以相同方式进行。5-3.ebv特异性cd8+t细胞的大规模培养以相同方式进行实施例4的过程4-3,但不同的是,每隔2-3天,直到培养的第14天而不是第11天,以相同的量添加包含1000iu/mlil-2和3%同种血浆的alys505n培养基,并且在培养的第14天,收集所有培养的细胞。如上所述,在29天的过程中,7名供体产生的抗原特异性cd8+t细胞的确认和纯度测试结果(见下表7)证实满足表2所示的所有标准。[表7]此外,功效试验结果证实满足表2的功效试验标准,如下表8所示。[表8]供体lamp-1(%)(>10%)ifn-g(%)(>10%)721.5044.81为了确认大规模培养产生的细胞的抗原特异性,使用pe-mhci型五聚体(普罗伊缪因有限公司,a*02:01flyalalll)和apc-mhci型五聚体(普罗伊缪因有限公司,a*02:01llwtlvvl)对用ebv肽5产生的供体7的细胞进行细胞表面染色,证实92.6%为ebv#5特异性cd8+t细胞。(图8)。实践实施例6:按本申请方法(15天过程)进行抗原特异性cd8+t细胞治疗剂的中试生产与实践实施例3的20天过程的区别如下。在20天的过程中,在il-2的存在下进行原代增殖的培养,但是在15天的过程中,cd8+t细胞在细胞因子的组合(例如,il-2+il-21)的存在下增殖。在大规模培养的情况下,在20天的过程中,使用5x105抗原特异性cd8+t细胞和1x108经辐照同种异体pbmc,但在15天的过程中,使用1.5x106cd8+t细胞和3×108同种异体pbmc。另外,总培养肉汤在1l时相同,但过程中添加的培养肉汤量不同。因此,根据图5所述步骤,使用ebv阳性健康个体的血液进行抗原特异性t细胞治疗剂的测试生产。具体实验方法和结果如下所述。6-1.抗原特异性cd8+t细胞的增殖如下所示从ebv阳性健康个体的血液中分离pbmc。将7ml血液缓慢地流入15ml锥形管中,该锥形管中装有7mlficoll-泛影钠并覆盖在ficoll溶液的顶部。试管在室温下以2000rpm离心20分钟,仅收集、洗涤位于ficoll和血浆之间的白细胞层,用于pbmc。然后从pbmc层上方的浅黄色层中分离出自体血浆,使用滤膜过滤,然后使用。接下来,将分离的pbmc以1x106细胞/ml悬浮于ctl培养基(rpmi1640培养基+4mml-谷氨酰胺+12.5mmhepes+50μm2-巯基乙醇+3%自体血浆)中,分别加入ebv肽((ebvlmp2a-iglgtlgaai,ebvlmp2a-9slgglltmv,ebvlmp2a-11tygpvfmsl,ebvlmp2a-13pylfwlaai,keppetron)至2μg/ml浓度。然后将这些细胞悬浮液以1ml的量等分置于14ml圆管中,并在co2培养箱中开始培养。在培养的第二天,向每个试管中添加1ml含有100u/mlil-2(阿地白介素,诺华)+10u/mlil-21(美天旎生物技术有限公司)+3%自体血浆的ctl培养基,并再培养5天。6-2.抗原特异性cd8+t细胞的选择性分离培养第7天,收集培养液中的pbmc,并用磷酸缓冲盐水(pbs)洗涤两次。洗涤后的pbmc在4℃下用抗4-1bb抗体和抗cd8抗体染色30分钟,然后用pbs洗涤两次。染色后,使用自动细胞分选机(美天旎生物技术有限公司,tyto;制造商和型号名称2:bd生物科学公司,bdfacsaria)分离洗涤的pbmc,并用rpmi1640培养基洗涤两次。使用自动细胞计数器(eve自动化细胞计数仪,nanoentek)对细胞进行计数,并使用alys505n培养基(株式会社细胞科学研究所(csti))以5x105细胞/ml的水平悬浮细胞。6-3.抗原特异性cd8+t细胞的大规模培养从300ml健康献血者血液中分离出pbmc,以1x107细胞/ml悬浮,然后以3000拉德辐射诱导细胞死亡,然后添加可提供诱导t细胞增殖所需的共刺激的培养添加剂。将1.5×106分离的抗原特异性cd8+t细胞和3×108经辐照的同种异体pbmc、1000u/mlil-2、30ng/ml抗cd3单抗(bd生物科学公司)和3%自体血浆加入200mlalys505n培养基中。将200ml细胞悬液注入1l培养容器(1l培养袋(nipro)或1lg-rex装置(wilson-wolf)),然后在co2培养箱中培养。在培养的第3天,在1l培养容器中另注射含有1000u/mlil-2、3%自体血浆的300mlalys505n培养基。在培养的第6天,在1l培养容器中另注射含有1000u/mlil-2、3%自体血浆的500mlalys505n培养基,再培养2天。在培养第8天,收集1l培养容器中的所有细胞,用生理盐水注射液洗涤三次,然后悬浮在含5%白蛋白的生理盐水注射液中,使最终的t细胞治疗剂带电。然后检查t细胞治疗剂的质量。因此,在15天的过程中产生的抗原特异性cd8+t细胞如图5所示被发现是具有cd3+、cd8+、cd45ro+、cd45ra-、cd62l-(cd62l+;约7.4%)、ccr7-和cd27-(cd27+;约6.5%)表型的高纯度抗原特异性cd8+t细胞。如表2所示,当根据细胞治疗成品评估标准对成品进行分析时,确认生产出符合评估标准的t细胞治疗产品,如图6所示。实践实施例7:ebv衍生的抗原特异性cd8+t细胞(ebvint细胞)成品药毒性试验结果鼠源性ctl治疗组和安慰剂组的重复剂量毒性试验结果如下。1)实验期间未观察到动物死亡或总体症状。2)体重、食物和水摄取、眼部检查、尿液分析、血液学检查结果均无变化。3)血液生化试验和器官重量测定结果,未观察到由于测试物质引起的变化。4)在尸检和组织病理学检查中,测试物没有改变。因此,c57bl/6n系雌性和雄性小鼠在3周内重复静脉注射4次鼠源性ctl,在死亡率、总体症状、体重变化、食物和水摄取、眼部检查、尿液分析、血液学和血清化学检查、尸检发现、器官重量和组织病理学等方面均未引起任何毒理学效应结果。因此,在这些测试条件下,在雄性和雌性动物中发现试验物质的无毒量(noael:未观察到不良反应水平)为6x106个细胞/头,并且未观察到靶器官。实践实施例8:ebvint细胞成品药物分布检测结果施用ebvint细胞成品后,在体内验证其分布。施用cd8t细胞的第10天是施用cd8t细胞反应最有效的时间;当施用0.7倍cd8+t细胞时,仅在一些小鼠(雄性#3,雌性#8)的次级淋巴器官中检测到较低的比例(小于0.1-0.2%)。当施用7倍cd8+t细胞时,在大多数次级淋巴器官(腹股沟、腋窝、颈部、肠系膜ln和脾脏)中检测到约1-5%的cd8+t细胞。在其他器官中,仅在肺中检测到0.5-7%的cd8+t细胞;在肾、骨髓、脑、肝、胸腺、心脏和睾丸/卵巢性器官中未检测到cd8+t细胞。cd8+t细胞给药的第30天是施用的cd8+t细胞应答形成免疫记忆的时间,表现出活跃功能的cd8+t细胞减少,只剩下一些负责免疫记忆的记忆性t细胞。当施用3.32x105cd8+t细胞时,所有小鼠中均未检测到cd8+t细胞。当施用3.32×106个cd8+t细胞时,仅在雄性#1-5活小鼠的次级淋巴器官(腹股沟、腋窝、颈部、肠系膜淋巴结和脾脏)中检测到2%左右的给予的cd8+t细胞;在其他器官如肾脏、骨髓、脑、肝、肺、胸腺、心脏和睾丸/卵巢性器官中未检测到cd8+t细胞。因此,确定大多数抗原特异性cd8+t细胞迁移到次级淋巴器官,聚积和增殖,并且施用到普通器官的癌抗原特异性cd8+t细胞不显示聚积或增殖。例如,为了构建权利要求的目的,并不打算以比其文字更窄的方式来解释下面陈述的权利要求,因此也不打算将说明书中的示例性实施例读入权利要求。因此,应当理解,本发明是通过说明而不是通过限制权利要求的范围来描述的。因此,本发明仅受所附权利要求的限制。本申请中引用的所有出版物、已授权专利、专利申请、书籍和期刊文章均通过引用整体并入本申请。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1