产生异源二聚体抗体的方法与流程
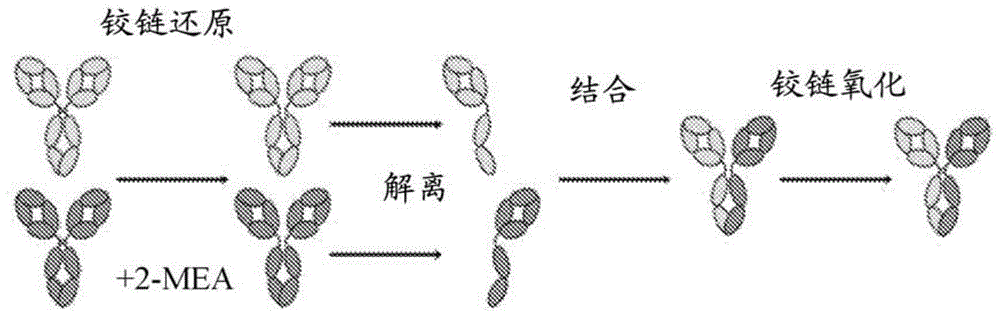
对相关申请的交叉引用本申请要求于2018年12月18日提交的美国临时申请序列号62/781,180的权益,其全部内容通过引用并入本文。发明领域本发明涉及产生异源二聚体抗体的方法。序列表本申请包含通过efs-web提交的序列表,其全部内容通过引用并入本文。ascii文本文件创建于2019年12月10日,命名为jbi6029wopct1_st25.txt,大小为21千字节。发明背景单克隆抗体已证明成功作为治疗分子,特别是在治疗癌症中。预期双特异性抗体增加单克隆抗体疗法的效力和功效,因为它们可用于将药物或有毒化合物导向靶细胞,将效应机制重新导向疾病相关位置或增加对肿瘤细胞的特异性,例如通过与肿瘤细胞上表达的一个或多个靶分子结合实现。此外,通过将两种单克隆抗体的特异性组合成一个,双特异性抗体可能潜在地参与一大批作用机制。已描述了不同形式的双特异性抗体和产生它们的方法,但是存在通过优化制造方法以大规模产生双特异性抗体的挑战。发明简述本发明提供了产生异源二聚体抗体的方法,其包括:提供包含含有第一ch3区的免疫球蛋白的第一fc区的第一同源二聚体抗体和包含含有第二ch3区的免疫球蛋白的第二fc区的第二同源二聚体抗体,其中第一ch3区和第二ch3区的氨基酸序列不同,并且使得第一ch3区和第二ch3区之间的异源二聚体相互作用比第一ch3区之间的同源二聚体相互作用或第二ch3区之间的同源二聚体相互作用更强;将第一同源二聚体抗体和第二同源二聚体抗体组合成混合物;以及在还原剂和环境溶氧(do2)存在下温育混合物以产生异源二聚体抗体,其中该方法在产生异源二聚体抗体期间缺乏以下一个或多个步骤:测量混合物中的百分比(%)do2,控制混合物中的%do2,或将氧添加到混合物中。本发明还提供了产生异源二聚体抗体的方法,其包括:提供包含含有第一ch3区的免疫球蛋白的第一fc区的第一同源聚合体抗体和包含含有第二ch3区的免疫球蛋白的第二fc区的第二同源聚合体抗体,其中第一ch3区和第二ch3区的氨基酸序列不同,并且使得第一ch3区和第二ch3区之间的异源二聚体相互作用比第一ch3区之间的同源二聚体相互作用或第二ch3区之间的同源二聚体相互作用更强;将第一同源二聚体抗体和第二同源二聚体抗体组合成混合物;在还原剂存在下温育混合物;以及去除还原剂以产生异源二聚体抗体,其中在还原剂存在下温育混合物的步骤期间,在去除还原剂以产生异源二聚体抗体的步骤期间,或在还原剂存在下温育混合物和去除还原剂以产生异源二聚体抗体的步骤期间,将百分比(%)溶氧(do2)控制为约30%或更低。附图简述图1示出fab-臂交换的总结。图2示出使用fab-臂交换制造双特异性抗体期间还原和超滤/渗滤(uf/df)期间的过程步骤。图3示出硫醇-二硫化物交换反应的分子细节。图4示出可以在2-mea存在下fab-臂交换期间发生的反应总结。图5示出uf/df设置和do2和ph传感器位置的草图,其中rmv=相对毫伏。图6示出uf/df期间在低do2条件下制造双特异性抗体a期间的渗余物、渗透物和入口管线中测量的uf/df期间的百分比(%)do2。a.s.:空气饱和。图7示出uf/df期间在低do2条件下制造双特异性抗体b期间的渗余物、渗透物和入口管线中测量的uf/df期间的百分比(%)do2。a.s.:空气饱和。图8示出在低do2条件(低do还原)或环境do2(靶还原)下还原期间随时间的百分比(%)do2。a.s.:空气饱和。发明详述定义在本说明书中引用的所有出版物,包括但不限于专利和专利申请,通过引用如同完全阐述一样并入本文。应当理解,本文使用的术语仅用于描述特定实施方案,而不意图是限制性的。除非另外定义,本文使用的所有技术和科学术语具有本发明所属领域的普通技术人员通常理解的相同含义。尽管可在用于测试本发明的实践中使用与本文所述的方法和材料类似或等同的任何方法和材料,但是本文描述了示例性材料和方法。在描述和要求保护本发明时,将使用以下术语。除非内容另有明确说明,如在本说明书和所附权利要求书中所使用的,单数形式“一个”,“一种”和“所述”包括复数提及物。因此,例如,提及“细胞”包括两个或更多个细胞的组合等。过渡术语“包括”、“基本上由……组成”和“由……组成”旨在意味着其在专利语言中普遍接受的含义;也就是说,(i)“包括”与“包含”,“含有”或“特征在于”是同义词,其为包含在内或开放式的,并且不排除额外未指定的元素或方法步骤;(ii)“由……组成”不包括未在权利要求中指明的任何元素、步骤或成分;(iii)“基本上由……组成”限制权利要求的范围到指明的材料或步骤“以及不实质上影响要求保护发明的基本且新颖的特征的那些”。根据短语“包括”(或其等同物)描述的实施方案也提供根据“由……组成”和“基本上由……组成”的独立描述者作为实施方案。“抗体”是指具有通过二硫键相互连接的两条重链(hc)和两条轻链(lc)的免疫球蛋白分子。每条重链由重链可变区(vh)和重链恒定区构成,重链恒定区分为ch1区,铰链区,ch2区和ch3区。每条轻链由轻链可变区(vl)和轻链恒定区(cl)构成。vh和vl可进一步细分为称为互补决定区(cdr)的高变区,其散布有框架区(fr)。每个vh和vl由三个cdr和四个fr区段构成,按以下顺序从氨基端至羧基端排列:fr1,cdr1,fr2,cdr2,fr3,cdr3和fr4。抗体包括单克隆抗体,包括鼠的,人的,人源化的和嵌合的抗体,双特异性或多特异性抗体。“互补决定区(cdr)”是结合抗原的抗体区。vh中有三个cdr(hcdr1,hcdr2,hcdr3),并且vl中有三个cdr(lcdr1,lcdr2,lcdr3)。cdr可使用各种描绘定义,如kabat(wuetal.(1970)jexpmed132:211-50)(kabatetal.,sequencesofproteinsofimmunologicalinterest,5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md.,1991),chothia(chothiaetal.(1987)jmolbiol196:901-17),imgt(lefrancetal.(2003)devcompimmunol27:55-77)和abm(martinandthornton(1996)jbmolbiol263:800-15)。描述了各种描绘和可变区编号之间的对应关系(参见,例如lefrancetal.(2003)devcompimmunol27:55-77;honeggerandpluckthun,jmolbiol(2001)309:657-70;internationalimmunogenetics(imgt)数据库;环球网资源,http://www_imgt_org)。可获得的程序,如uclbusinessplc的abysis可用于描绘cdr。除非在说明书中另有明确说明,术语“cdr”,“hcdr1”,“hcdr2”,“hcdr3”,“lcdr1”,“lcdr2”和“lcdr3”包括由上文描述的任何方法,kabat,chothia,imgt或abm定义的cdr。根据重链恒定区氨基酸序列,免疫球蛋白可归入五大类:iga,igd,ige,igg和igm。iga和igg进一步细分为同种型iga1,iga2,igg1,igg2,igg3和igg4。任何脊椎动物物种的抗体轻链可以基于其恒定域的氨基酸序列归入两个明显不同的类型之一,即kappa(κ)和lambda(λ)。“抗原结合片段”是指免疫球蛋白分子中保留亲代全长抗体的抗原结合特性的部分。示例性抗原结合片段是重链互补决定区(hcdr)1,2和/或3,轻链互补决定区(lcdr)1,2和/或3,vh,vl,vh和vl,fab,f(ab')2,fd和fv片段以及由一个vh域或一个vl域组成的域抗体(dab)。vh和vl域可通过合成接头连接在一起形成各种类型的单链抗体设计,其中vh/vl域在分子内配对,或者在通过分开链表达vh和vl域的那些情况下在分子间配对,以形成单价抗原结合位点,例如单链fv(scfv)或双体抗体(diabody);例如在国际专利公开号wo1998/44001,国际专利公开号wo1988/01649;国际专利公开号wo1994/13804;国际专利公开号wo1992/01047中所述。“单克隆抗体”是指从基本上同质的抗体分子群体获得的抗体,即除了可能的公知的改变如从抗体重链中除去c末端赖氨酸或翻译后修饰如氨基酸异构化或脱酰胺化,甲硫氨酸氧化或天冬酰胺或谷氨酰胺脱酰胺化之外,构成群体的个别抗体是相同的。单克隆抗体通常结合一个抗原性表位。双特异性单克隆抗体结合两个不同的抗原性表位。单克隆抗体可在抗体群体内具有异质糖基化。单克隆抗体可以是单特异性或多特异性,例如双特异性,单价,二价或多价的。“fab-臂”是指抗体的一个重链-轻链对。“同源二聚化”是指具有相同ch3氨基酸序列的两条重链的相互作用。“同源二聚体”是指具有两条重链的抗体,所述两条重链具有相同的ch3区氨基酸序列。“异源二聚化”是指具有不同ch3氨基酸序列的两条重链的相互作用。“异源二聚体”是指具有两条重链的抗体,所述两条重链的氨基酸序列在ch3区中有一个或多个氨基酸不同。“fc区”或“fc域”是指包含铰链区的至少一部分,ch2区和ch3区的抗体区域。可通过用木瓜蛋白酶或胃蛋白酶消化抗体来生成fc区,其中fc区是由此获得的片段,其包括免疫球蛋白的一个或两个ch2-ch3区和铰链区的一部分。抗体重链的恒定域定义了抗体同种型,如igg1,igg2,igg3,igg4,iga1,iga2,ige。fc区介导抗体与细胞表面fc受体和补体系统的蛋白质的效应物功能。“ch1区”或“ch1域”是指免疫球蛋白的ch1区。人igg1抗体的ch1区对应于氨基酸残基118-215。然而,ch1区也可以是如本文所述的任何其他抗体同种型。“ch2区”或“ch2域”是指免疫球蛋白的ch2区。人igg1抗体的ch2区对应于氨基酸残基231-340。然而,ch2区也可以是如本文所述的任何其他抗体同种型。“ch3区”或“ch3域”是指免疫球蛋白的ch3区。人igg1抗体的ch3区对应于氨基酸残基341-446。然而,ch3区也可以是如本文所述的任何其他抗体同种型。“铰链”或“铰链区”是指免疫球蛋白的铰链区。人igg1抗体的铰链区通常对应于根据eu编号系统的氨基酸216-230。还认为“铰链”包括称为上和下铰链区的附加残基,例如从氨基酸残基216至239。“混合物”是指两种或更多种抗体的水溶液。“还原剂”是指能够还原抗体的铰链区中链间二硫键的试剂。“符合gmp的条件”是指根据fda强制执行的良好制造规范(cgmp)规定下制造。cgmp提供了确保适当设计,监控和控制制造工艺和设施的系统。遵守cgmp规定通过要求药品制造商充分控制制造操作来确保药品的特性、强度、质量和纯度。这包括建立强大的质量管理系统,获得适当质量的原材料,建立强大的操作程序,检测和调查产品质量偏差,以及维护可靠的测试实验室。制药公司的这种正式控制系统在充分投入实践时有助于预防污染、混合、偏差、失败和错误的情况。这确保了药品符合其质量标准。“原料药”或“ds”是指意图用于制造药物(药用)产品,并且当用于生产药物时成为药物产品的活性成分的任何物质或物质的混合物。这些物质意图在诊断、治愈、缓解、治疗或预防疾病中提供药理活性或其他直接效应,或影响身体的结构或功能。“药物产品”或“dp”是指成品剂型,例如,含有活性药物成分(如,原料药)的片剂、胶囊或溶液,通常但不一定与非活性成分结合。“参考产品”是指与生物仿制药产品比较的经批准的生物产品。参考产品尤其基于安全性和有效性数据的完整补充批准,并在美国、欧洲或日本中的至少一个获得批准。(经批准的参考产品/生物药物)的“生物仿制药”是指尽管在临床上非活性组分上有微小差异,但是与参考产品高度相似的生物产品,基于源自以下的数据,生物仿制药与参考产品在安全性、纯度和效力方面在临床上并无有意义的差异:(a)表明尽管在临床上非活性组分上有微小差异,但是生物产品与参考产品高度相似的分析研究;(b)动物研究(包括毒性评估);和/或(c)足以在许可并且意图使用参考产品所针对的且生物仿制药寻求许可所针对的一种或多种合适的使用状况中证明安全性、纯度和效力的一项或多项临床研究(包括评估免疫原性和药代动力学或药效动力学)。生物仿制药可以是可互换的产品,其可在药房无开处方的医疗专业人员干预的情况下代替参考产品。为了满足“可互换性”的额外标准,生物仿制药预期在任何给定患者中产生与参考产品相同的临床结果,如果生物仿制药以多于一次施用于个体,则就生物仿制药和参考产品使用之间的交替或转换的安全性或降低的效力而言,风险不大于在未进行此种交替或转换的情况下使用参考产品的风险。就知道参考产品的机制而言,生物仿制药针对提出的使用状况利用相同的作用机制。在生物仿制药提出的标签中规定、推荐或建议的一种或多种使用状况必须先前已经针对参考产品获得批准。生物仿制药的施用途径、剂型和/或强度必须与参考产品的那些相同,并且生物仿制药必须在符合设计为确保生物仿制药持续为安全、纯净且有力的标准的设施中制造、加工、包装或保存。与参考产品相比时,生物仿制药可包括氨基酸序列中的微小修饰,例如预期不改变生物仿制药性能的n-或c-端截短。参考产品可在美国、欧洲或日本中的至少一个获得批准。“分离的”是指已从产生分子的系统(如,重组细胞)的其他组分中基本上分开和/或纯化的分子的同质群体(如,合成的多核苷酸或蛋白如抗体),以及已进行至少一个纯化或分离步骤的蛋白。“分离的抗体”是指基本上不含其他细胞物质和/或化学物质的抗体,并且包括分离至较高纯度,如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%纯度的抗体。“人源化抗体”是指其中的至少一个cdr衍生自非人类物种且至少一个框架衍生自人免疫球蛋白序列的抗体。人源化抗体可包括框架中的取代,因而框架可以不是表达的人免疫球蛋白或人免疫球蛋白种系基因序列的精确拷贝。“人抗体”是指经过优化以在施用于人受试者时具有最小免疫应答的抗体。人抗体的可变区衍生自人免疫球蛋白序列。如果人抗体含有恒定区或恒定区的一部分,则恒定区也衍生自人免疫球蛋白序列。如果人抗体的可变区获自利用人种系免疫球蛋白或重排的免疫球蛋白基因的系统,则人抗体包含“衍生自”人起源序列的重链和轻链可变区。这种示例性系统是在噬菌体和携带人免疫球蛋白基因座的转基因非人动物如小鼠或大鼠上展示的人免疫球蛋白基因文库。由于用于获得人抗体和人免疫球蛋白基因座的系统之间的差异,引入体细胞突变或在框架或cdr或二者中有意引入取代,与人中表达的免疫球蛋白相比时“人抗体”通常包含氨基酸差异。通常,“人抗体”的氨基酸序列与由人种系免疫球蛋白或重排的免疫球蛋白基因编码的氨基酸序列至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同。在一些情况下,“人抗体”可含有衍生自人框架序列分析的共有框架序列,例如如knappiketal.,(2000)jmolbiol296:57-86所述,或掺入噬菌体上展示的人免疫球蛋白基因文库中的合成hcdr3,例如如shietal.,(2010)jmolbiol397:385-96和wo2009/085462所述。至少一个cdr衍生自非人物种的抗体不包括在“人抗体”的定义中。“重组”是指当将来自不同来源的区段连接以产生重组dna、抗体或蛋白时通过重组手段制备、表达、创建或分离的dna、抗体和其他蛋白。“重组抗体”包括通过重组手段制备、表达、创建或分离的所有抗体,例如从对于人免疫球蛋白基因而言转基因或转染色体的动物(如,小鼠)或由其制备的杂交瘤(以下进一步描述)中分离的抗体,从转化以表达抗体的宿主细胞中分离的抗体,从重组、组合抗体文库分离的抗体和通过涉及将人免疫球蛋白基因序列剪接到其他dna序列的任何其他手段制备、表达、创建或分离的抗体,或利用fab-臂交换体外产生的抗体,如双特异性抗体。“双特异性”是指特异性结合两个不同抗原或同一抗原内两个不同表位的抗体。双特异性抗体可对其他相关抗原具有交叉反应性,或者可结合两个或更多个不同抗原之间共享的表位。“多特异性”是指特异性结合至少两个不同抗原或同一抗原内至少两个不同表位的抗体。多特异性抗体可结合例如两个、三个、四个或五个不同的抗原或同一抗原内的不同表位。“约”表示在由本领域普通技术人员确定的特定值的可接受的误差范围内,这将部分地取决于如何测量或确定该值,即测量系统的局限性。除非在实施例或说明书其他地方在特定测定法、结果或实施方案的上下文中另有明确说明,“约”根据本领域实践意指在一个标准偏差内,或者高达5%的范围,以更大者为准。“变体”是指与参考多肽或参考多核苷酸相差一个或多个修饰,如取代、插入或缺失的多肽或多核苷酸。“突变”是指与参考序列相比时在多肽或多核苷酸序列中工程化改造或天然发生的改变。改变可以是一个或多个氨基酸或多核苷酸的取代、插入或缺失。除非另有明确说明,在整个说明书中抗体恒定区的氨基酸残基编号是根据kabat等(sequencesofproteinsofimmunologicalinterest,5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991))所述的eu索引。抗体恒定链编号可在例如immunogenetics网站、imgt网站资源的imgt科学图表中找到。本文所述的ch3区中的突变表示为第一重链的第一ch3域中的修饰位置/第二重链的第二ch3域中的修饰位置。例如,f405l/k409r是指第一ch3区中的f405l突变和第二ch3区中的k09r突变。l351y_f405a_y407v/t394w是指第一ch3区中的l351y、f40fa和y407v突变和第二ch3区中的t394w突变。d399fhkrq/k409agrh是指d399可被f、h、k、r或q取代,并且k409可被a、g、r或h取代的突变。如表1所示,本文使用常规的单字母和三字母氨基酸代码。表1氨基酸三字母代码单字母代码氨基酸三字母代码单字母代码丙氨酸alaa亮氨酸leul精氨酸argr赖氨酸lysk天冬酰胺asnn甲硫氨酸metm天冬氨酸aspd苯丙氨酸phef半胱氨酸cysc脯氨酸prop谷氨酸glne丝氨酸sers谷氨酰胺gluq苏氨酸thrt甘氨酸glyg色氨酸trpw组氨酸hish酪氨酸tyry异亮氨酸ilei缬氨酸valv本发明的方法本发明提供了利用fab-臂交换产生异源二聚体抗体的方法。本发明至少部分基于以下鉴定:与文献(参见,例如us2014/0303356)中公开的内容相反,在fab-臂交换期间,二硫键在其还原后重新形成以形成稳定的异源二聚体抗体不需要氧,因而为大规模生产异源二聚体抗体(如,双特异性抗体)期间的过程控制提供了替代方法。本发明提供了生产异源二聚体抗体的方法,其包括:提供包含含有第一ch3区的免疫球蛋白的第一fc区的第一同源二聚体抗体和包含含有第二ch3区的免疫球蛋白的第二fc区的第二同源二聚体抗体,其中第一ch3区和第二ch3区的氨基酸序列不同,并且使得第一ch3区和第二ch3区之间的异源二聚体相互作用比第一ch3区之间的同源二聚体相互作用或第二ch3区之间的同源二聚体相互作用更强;将第一同源二聚体抗体和第二同源二聚体抗体组合成混合物;以及在还原剂和环境溶氧(do2)存在下温育混合物以产生异源二聚体抗体,其中该方法在产生异源二聚体抗体期间缺乏一个或多个以下步骤:测量混合物中的百分比(%)do2、控制混合物中的%do2或向混合物加入氧。在一些实施方案中,在产生异源二聚体抗体期间混合物中的%do2为约10%至约90%。在一些实施方案中,在加入变性剂之前,混合物中的%do2为约30%或更多。本发明还提供了产生异源二聚体抗体的方法,其包括:提供包含含有第一ch3区的免疫球蛋白的第一fc区的第一同源二聚体抗体和包含含有第二ch3区的免疫球蛋白的第二fc区的第二同源二聚体抗体,其中第一ch3区和第二ch3区的氨基酸序列不同,并且使得第一ch3区和第二ch3区之间的异源二聚体相互作用比第一ch3区之间的同源二聚体相互作用或第二ch3区之间的同源二聚体相互作用更强;将第一同源二聚体抗体和第二同源二聚体抗体组合成混合物;在还原剂存在下温育混合物;以及去除还原剂以产生异源二聚体抗体,其中在步骤c)、步骤d)或步骤c)和步骤d)两者中将百分比(%)溶氧(do2)控制为约30%或更低。在一些实施方案中,混合物的%do2为约25%或更少、20%或更少、约15%或更少、约10%或更少、约9%或更少、约8%或更少、约7%或更少、约6%或更少、约5%或更少、约4%或更少、约3%或更少、约2%或更少或约1%或更少。在一些实施方案中,通过用惰性气体如氮气覆盖混合物从混合物中置换氧气来控制%do2。溶氧浓度可通过已知方法监测,例如利用溶氧探头。“更强”就第一ch3区和第二ch3区的异源二聚体相互作用而言,可比第一ch3区之间的同源二聚体相互作用或第二ch3区之间的同源二聚体相互作的最强者强超过两倍,例如强超过三倍、强超过四倍或强超过五倍。ch3域相互作用的强度可使用质谱法测量。在示例性测定法中,使用标准分子生物学技术制备包含第一ch3区和第二ch3区或可选择地二者均包含ch2区的构建体。使用10kdamwco旋转过滤柱制备包含第一ch3域、第二ch3域或第一ch3域和第二ch3域的样品,并将缓冲液更换为100mm乙酸铵ph7。将系列稀释样品(20μm-25nm;单体当量)的等分试样(约1μl)加载入镀金硼硅酸盐毛细管中,在lct质谱仪(waters)上进行分析。单体信号ms定义为单体峰面积,作为占谱中所有峰面积的分数(ms/(ms+ds),其中ds=二聚体信号)。平衡时的单体浓度[m]eq定义为ms·[m]0,其中[m]0是就单体而言的总蛋白浓度。平衡时二聚体浓度[d]eq定义为([m]0-[m]eq)/2。然后,从[d]eq相比[m]eq2的图梯度中提取同源二聚体ch3相互作用和异源二聚体ch3相互作用的kd。在一些实施方案中,第一同源二聚体抗体和第二同源二聚体抗体以约1:1的摩尔比组合成混合物。在一些实施方案中,第一同源二聚体抗体和第二同源二聚体抗体以约1.05:1的摩尔比组合成混合物。在一些实施方案中,第一同源二聚体抗体和第二同源二聚体抗体以约1:1.03至约1:2的摩尔比组合成混合物。在一些实施方案中,第一同源二聚体抗体和第二同源二聚体抗体以约1:1.05至1:1.5的摩尔比组合成混合物。在一些实施方案中,第一同源二聚体抗体和第二同源二聚体抗体以约1:1.1至1:1.5的摩尔比组合成混合物。在一些实施方案中,第一同源二聚体抗体和第二同源二聚体抗体以约1:1.1至1:1.4的摩尔比组合成混合物。在一些实施方案中,第一同源二聚体抗体和第二同源二聚体抗体以约1:1.15至1:1.35的摩尔比组合成混合物。在一些实施方案中,第一同源二聚体抗体和第二同源二聚体抗体以约1:1.2至1:1.3的摩尔比组合成混合物。在一些实施方案中,混合物中免疫球蛋白的总浓度为约1g/l至70g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约8g/l至约50g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约8g/l至约13g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约9.0g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约9.5g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约10g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约10.5g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约11.0g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约11.5g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约12.0g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约12.5g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约13.0g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约13.5g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约14.0g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约14.5g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约15.0g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约20.0g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约25.0g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约30.0g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约35.0g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约40.0g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约45.0g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约50.0g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约55.0g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约60.0g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约65.0g/l。在一些实施方案中,混合物中免疫球蛋白的总浓度为约70.0g/l。在一些实施方案中,混合物在还原剂的存在下温育约10分钟或更久。在一些实施方案中,混合物在还原剂存在下温育约10分钟至约30小时。在一些实施方案中,混合物在还原剂存在下温育约10分钟至约24小时。在一些实施方案中,混合物在还原剂存在下温育约15分钟。在一些实施方案中,混合物在还原剂存在下温育约20分钟。在一些实施方案中,混合物在还原剂存在下温育约30分钟。在一些实施方案中,混合物在还原剂存在下温育约40分钟。在一些实施方案中,混合物在还原剂存在下温育约50分钟。在一些实施方案中,混合物在还原剂存在下温育约1小时。在一些实施方案中,将混合物在还原剂存在下温育约2小时。在一些实施方案中,混合物在还原剂存在下温育约3小时。在一些实施方案中,混合物在还原剂存在下温育约4小时。在一些实施方案中,混合物在还原剂存在下温育约4小时。在一些实施方案中,混合物在还原剂存在下温育约5小时。在一些实施方案中,混合物在还原剂存在下温育约6小时。在一些实施方案中,混合物在还原剂存在下温育约7小时。在一些实施方案中,混合物在还原剂存在下温育约8小时。在一些实施方案中,混合物在还原剂存在下温育约9小时。在一些实施方案中,混合物在还原剂存在下温育约10小时。在一些实施方案中,混合物在还原剂存在下温育约11小时。在一些实施方案中,混合物在还原剂存在下温育约12小时。在一些实施方案中,混合物在还原剂存在下温育约13小时。在一些实施方案中,混合物在还原剂存在下温育约14小时。在一些实施方案中,混合物在还原剂存在下温育约15小时。在一些实施方案中,混合物在还原剂存在下温育约16小时。在一些实施方案中,混合物在还原剂存在下温育约17小时。在一些实施方案中,混合物在还原剂存在下温育约18小时。在一些实施方案中,混合物在还原剂存在下温育约19小时。在一些实施方案中,混合物在还原剂存在下温育约20小时。在一些实施方案中,混合物在还原剂存在下温育约21小时。在一些实施方案中,混合物在还原剂存在下温育约22小时。在一些实施方案中,混合物在还原剂存在下温育约23小时。在一些实施方案中,混合物在还原剂存在下温育约24小时。在一些实施方案中,混合物在还原剂存在下温育约25小时。在一些实施方案中,混合物在还原剂存在下温育约26小时。在一些实施方案中,混合物在还原剂存在下温育约27小时。在一些实施方案中,混合物在还原剂存在下温育约28小时。在一些实施方案中,混合物在还原剂存在下温育约29小时。在一些实施方案中,混合物在还原剂存在下温育约30小时。在一些实施方案中,还原剂是2-巯基乙胺(2-mea)。在一些实施方案中,还原剂是2-mea的化学衍生物。在一些实施方案中,还原剂是l-半胱氨酸。在一些实施方案中,还原剂是d-半胱氨酸。在一些实施方案中,还原剂是谷胱甘肽。在一些实施方案中,还原剂是三(2-羧乙基)膦。在一些实施方案中,混合物中还原剂的浓度为约0.1mm至约1m。在一些实施方案中,混合物中还原剂的浓度为约1.0mm至约500mm。在一些实施方案中,混合物中还原剂的浓度为约5.0mm至约100mm。在一些实施方案中,混合物中还原剂的浓度为约10mm。在一些实施方案中,混合物中还原剂的浓度约为约15mm。在一些实施方案中,混合物中还原剂的浓度为约20mm。在一些实施方案中,混合物中还原剂的浓度为约25mm。在一些实施方案中,混合物中还原剂的浓度为约30mm。在一些实施方案中,混合物中还原剂的浓度为约35mm。在一些实施方案中,混合物中还原剂的浓度为约40mm。在一些实施方案中,混合物中还原剂的浓度为约50mm。在一些实施方案中,混合物中还原剂的浓度为约60mm。在一些实施方案中,混合物中还原剂的浓度为约70mm。在一些实施方案中,混合物中还原剂的浓度为约80mm。在一些实施方案中,混合物中还原剂的浓度为约90mm。在一些实施方案中,混合物中还原剂的浓度为约100mm。在一些实施方案中,混合物中2-mea的浓度为约10mm至约100mm。在一些实施方案中,混合物中2-mea的浓度为约20mm至约90mm。在一些实施方案中,混合物中2-mea的浓度为约20mm至约80mm。在一些实施方案中,混合物中2-mea的浓度为约20mm至约70mm。在一些实施方案中,混合物中2-mea的浓度为约20mm至约60mm。在一些实施方案中,混合物中2-mea的浓度为约20mm至约50mm。在一些实施方案中,混合物中2-mea的浓度为约20mm至约40mm。在一些实施方案中,混合物中2-mea的浓度为约20mm。在一些实施方案中,混合物中2-mea的浓度为约25mm。在一些实施方案中,混合物中2-mea的浓度为约30mm。在一些实施方案中,混合物中2-mea的浓度为约35mm。在一些实施方案中,混合物中2-mea的浓度为约40mm。在一些实施方案中,混合物中总免疫球蛋白与总还原剂的质量比为约1.0至约5.0。在一些实施方案中,混合物中总免疫球蛋白与总还原剂的质量比为约1.4至约3.8。在一些实施方案中,混合物中总免疫球蛋白与总还原剂的质量比为约1.4至约3.5。在一些实施方案中,质量比为约1.8至约3.8。在一些实施方案中,质量比为约2.3至约3.0。在一些实施方案中,质量比为约1.6至约2.1。在一些实施方案中,质量比为约1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.0、2.8..3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0。4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9或5.0。“质量比”是指以克/升计的总免疫球蛋白比以克/升计的总还原剂。“总免疫球蛋白”是指在还原步骤开始时混合物中两种亲本抗体的量。在一些实施方案中,混合物包含缓冲液。在一些实施方案中,缓冲液包括乙酸钠缓冲液。在一些实施方案中,缓冲液还包含nacl。在一些实施方案中,缓冲液包含约100mm乙酸钠和约30mmnacl。在一些实施方案中,缓冲液的ph值为约7.3。可使用其他缓冲液,例如1xdulbecco磷酸盐缓冲盐水(dpbs)、磷酸钠缓冲液、磷酸钾缓冲液、tris缓冲液、组氨酸缓冲液或柠檬酸盐缓冲液。在一些实施方案中,该方法还包括从混合物中去除还原剂的步骤。在一些实施方案中,还原剂通过过滤去除。在一些实施方案中,过滤是渗滤。在一些实施方案中,第一同源二聚体抗体和第二同源二聚体抗体是igg1、igg2或igg4同种型。在一些实施方案中,第一同源二聚体抗体和第二同源二聚体抗体是igg1同种型。在一些实施方案中,第一同源体二聚体抗体和第二同源二聚体抗体是igg2同种型。在一些实施方案中,第一同源二聚体抗体和第二同源二聚体抗体是igg4同种型。在一些实施方案中,与seqidno:1的野生型igg1相比时,第一ch3域和第二ch3域包含以下突变:f405l/k409r,t350i_k370t_f405l/k409r,k370w/k409r,d399afghilmnrstvwy/k409r,t366adefghilmqvy/k409r,l368adeghnrstvq/k409agrh,d399fhkrq/k409agrh,f405iklstvw/k409agrh,y407lwq/k409agrh,t366y/f405a,t366w/f405w,f405w/y407a,t394w/y407t,t394s/y407a,t366w/t394s,f405w/t394s,t366w/t366s_l368a_y407v,l351y_f405a_y407v/t394w,t366i_k392m_t394w/f405a_y407v,t366l_k392m_t394w/f405a_y407v,l351y_y407a/t366a_k409f,l351y_y407a/t366v_k409f,y407a/t366a_k409f,t350v_l351y_f405a_y407v/t350v_t366l_k392l_t394w,k409d/d399k,k409e/d399r,k409d_k360d/d399k_e356k,k409d_k360d/d399e_e356k,k409d_k370d/d399k_e357k,k409d_k370d/d399e_e357k,k409d_k392d/d399k_e356k_e357k或k409d_k392d/d399e_e356k_e357k。还可将突变引入seqidno:2的野生型igg2或seqidno:3的野生型igg4,在这种情况下,众所周知,由于野生型igg1、igg2和igg4之间的序列差异,特定突变位点处的野生型残基可能不与igg1的残基对应。例如,igg4突变野生型/f405l_r409k对应于igg1突变f405l/k409r,而igg4突变r409d/d399k对应于igg1突变k409d/d399k。将突变与seqidno:1的参考野生型igg1、seqidno:2的igg2和seqidno:3的igg4进行比较。在一些实施方案中,与seqidno:1的野生型igg1、seqidno:2的野生型igg2、seqidno:3的野生型igg4相比时,第一fc区和/或第二fc区包含调节第一fc区和/或第二fc区与fcγ受体(fcγr)、fcrn或蛋白a结合的一个或多个突变。野生型igg1(seqidno:1)野生型igg2(seqidno:2)野生型igg4(seqidno:3)在一些实施方案中,fcγr是fcγri、fcγriia、fcγriib或fcγriii。在一些实施方案中,调节第一fc区和/或第二fc区与fcγ结合的一个或多个取代是l234a_l235a,f234a_l235a,s228p_f234a_l235a,s228p_l234a_l235a,v234a_g237a_p238s_h268a_v309l_a330s_p331s,v234a_g237a,h268q_v309l_a330s_p331s,s267e_l328f,l234f_l235e_d265a,l234a_l235a_g237a_p238s_h268a_a330s_p331s或s228p_f234a_l235a_g237a_p238s。在一些实施方案中,调节第一fc区和/或第二fc区与fcrn结合的一个或多个取代是m428l_n434s,m252y_s254t_t256e,t250q_m428l,n434a和t307a_e380a_n434a,h435a,p257i_n434h,d376v_n434h,m252y_s254t_t256e_h433k_n434f,t308p_n434a或h435r。在一些实施方案中,调节第一fc区和/或第二fc区与蛋白a结合的一个或多个取代是q311r,q311k,t307p_l309q,t307p_v309q,t307p_l309q_q311r,t307p_v309q_q311r,h435r或h435r_y436f。在一些实施方案中,产生异源二聚体抗体的步骤在符合gmp的条件下进行。在一些实施方案中,产生异源二聚体抗体的步骤在制造包含异源二聚体抗体的原料药期间进行。在一些实施方案中,异源二聚体抗体是双特异性抗体。在一些实施方案中,双特异性抗体结合cd3、bcma或cd123。在一些实施方案中,产生异源二聚体抗体的步骤在制造创新药物产品期间进行。在一些实施方案中,产生异源二聚体抗体的步骤在制造仿制药物产品(genericdrugproduct)期间进行。fab-臂交换和促进异源二聚化的fc区突变异源二聚体抗体可利用fab-臂交换产生,其中一个亲本同源二聚体抗体的一条重链及其连接的轻链(半臂)与另一亲本同源二聚体抗体的一条重链及其连接的轻链交换,以形成由两条重链和两条连接的轻链组成的异源二聚体抗体(vanderneutkolfschotenetal.,(2007)science317:1554-1557)。将两个同源二聚体亲本抗体工程化改造为在其ch3区中具有不对称突变,其在抗体铰链区中的二硫桥还原和重新形成时有利于fab-臂交换和异源二聚体抗体形成。fab-臂交换反应的图示在图1中示出。将还原剂引入两个亲本同源二聚体抗体的混合物后,半臂解离且不对称ch3突变有利于异源二聚体抗体的重新形成。随后半臂之间二硫桥的重新形成使形成的异源二聚体抗体稳定(grameretal.(2013)mabs5:962-973)。在本发明的方法中,可使用促进ch3异源二聚体形成的任何ch3区突变,例如本文所述的那些。在ch3区中进行修饰以促进异源二聚化的几种方法是已知的。通常,在所有这些方法中,第一ch3区和第二ch3区进行互补方式工程化改造,使得每个ch3区(或包含它的重链)不再能与其自身同源二聚化,而是被迫与互补工程化改造的其他ch3区异源二聚化(使得第一和第二ch3区异源二聚化并且在两个第一或两个第二ch3区之间不形成同源二聚体)。有利于fab-臂交换的ch3突变包括突变(genmab)、突出-入-空穴(knob-in-hole)突变(genentech)、静电匹配突变(chugai,amgen,novonordisk,oncomed)、链交换工程化域主体(seedbody)(emdserono)和其他不对称突变(如,zymeworks)。突变(genmab)公开于例如us9,150,663和us2014/0303356中,包括突变f405l/k409r,野生型/f405l_r409k,t350i_k370t_f405l/k409r,k370w/k409r,d399afghilmnrstvwy/k409r,t366adefghilmqvy/k409r,l368adeghnrstvq/k409agrh,d399fhkrq/k409agrh,f405iklstvw/k409agrh和y407lwq/k409agrh。突出-入-空穴公开于例如wo1996/027011中,包括在ch3区界面上的突变,其中将具有小侧链(空穴)的氨基酸引入第一ch3区和具有大侧链(突出)的氨基酸引入第二ch3区,导致第一ch3区和第二ch3区之间的优先相互作用。形成突出和空穴的示例性ch3区突变是t366y/f405a,t366w/f405w,f405w/y407a,t394w/y407t,t394s/y407a,t366w/t394s,f405w/t394s和t366w/t366s_l368a_y407v。可以通过取代第一ch3区上的带正电荷的残基和第二ch3区上的带负电荷的残基通过利用静电相互作用促进重链异源二聚体形成,如us2010/0015133、us2009/0182127、us2010/028637或us2011/012353中所述。可用于促进重链异源二聚化的其它非对称突变是l351y_f405a_y407v/t394w,t366i_k392m_t394w/f405a_y407v,t366l_k392m_t394w/f405a_y407v,l351y_y407a/t366a_k409f,l351y_y407a/t366v_k409f,y407a/t366a_k409f,或t350v_l351y_f405a_y407v/t350v_t366l_k392l_t394w,如us2012/0149876或us2013/0195849中所述。seedbody突变涉及用iga残基取代选择的igg残基以促进重链异源二聚化,如us20070287170中所述。可使用的其它示例性突变是r409d_k370e/d399k_e357k,s354c_t366w/y349c_t366s_l368a_y407v,y349c_t366w/s354c_t366s_l368a_y407v,t366k/l351d,l351k/y349e,l351k/y349d,l351k/l368e,l351y_y407a/t366a_k409f,l351y_y407a/t366v_k409f,k392d/d399k,k392d/e356k、k253e_d282k_k322d/d239k_e240k_k292d、k392d_k409d/d356k_d399k,如wo2007/147901,wo2011/143545,wo2013157954,wo2013096291和us2018/0118849中所述。这些用于fab-臂交换的不同方法可与各种双特异性抗体形式组合,例如涉及vh/vl工程化的那些方法,如vh/vl域交换、ch1/cl域交换、利用wo98050431中所述的共同轻链,或利用栓系的轻链,包括如us9062120中所述的里朝外栓系的轻链。异源二聚体抗体的进一步工程化改造fc工程化除了促进异源二聚化的ch3区突变外,本发明方法中使用的抗体可包含fc区中调节抗体效应物功能或半衰期的突变。此外,本发明方法中使用的抗体可包含调节抗体与蛋白a结合的fc突变,因此促进抗体的纯化。可突变以调节抗体半衰期(如,与fcrn结合)的fc位置包括位置250、252、253、254、256、257、307、376、380、428、434和435。可单独或组合进行的示例性突变是突变t250q、m252y、i253a、s254t、t256e、p257i、t307a、d376v、e380a、m428l、h433k、n434s、n434a、n434h、n434f、h435a和h435r。可以为了增加抗体半衰期而进行的示例性单一或组合突变是突变m428l/n434s、m252y/s254t/t256e、t250q/m428l、n434a和t307a/e380a/n434a。可以为了减少抗体半衰期而进行的示例性单一或组合突变是h435a、p257i/n434h、d376v/n434h、m252y/s254t/t256e/h433k/n434f、t308p/n434a和h435r。可以将突变引入fc区,所述突变减少抗体与活化fcγ受体(fcγr)的结合并降低fc效应物功能,如c1q结合、补体依赖性细胞毒性(cdc)、抗体依赖性细胞介导的细胞毒性(adcc)或吞噬作用(adcp)。可以进行突变以减少抗体与活化fcγr的结合并随后降低效应物功能的fc位置包括位置214、233、234、235、236、237、238、265、267、268、270、295、297、309、327、328、329、330、331和365。可单独或组合进行的示例性突变是igg1、igg2、igg3或igg4中的突变k214t,e233p,l234v,l234a,g236缺失,v234a,f234a,l235a,g237a,p238a,p238s,d265a,s267e,h268a,h268q,q268a,n297a,a327q,p329a,d270a,q295a,v309l,a327s,l328f,a330s和p331s。导致抗体具有降低的adcc的示例性组合突变是igg1上的突变l234a/l235a,igg2上的v234a/g237a/p238s/h268a/v309l/a330s/p331s,igg4上的f234a/l235a,igg4上的s228p/f234a/l235a,所有ig同种型上的n297a,igg2上的v234a/g237a,igg1上的k214t/e233p/l234v/l235a/g236缺失/a327g/p331a/d365e/l358m,igg2上的h268q/v309l/a330s/p331s,igg1上的s267e/l328f,igg1上的l234f/l235e/d265a,igg1上的l234a/l235a/g237a/p238s/h268a/a330s/p331s,igg4上的s228p/f234a/l235a/g237a/p238s,以及igg4上的s228p/f234a/l235a/g236缺失/g237a/p238s。还可使用杂交的igg2/4fc域,例如具有来自igg2的残基117-260和来自igg4的残基261-447的fc。导致抗体具有降低的cdc的示例性突变是k322a突变。众所周知的s228p突变可在igg4抗体中进行,以增强igg4的稳定性。可将突变引入fc区,所述突变增强抗体与fcγ受体(fcγr)的结合并增强fc效应物功能,例如c1q结合、补体依赖性细胞毒性(cdc)、抗体依赖性细胞介导的细胞毒性(adcc)和/或吞噬作用(adcp)。可进行突变以增加抗体与活化fcγr结合并增强抗体效应物功能的fc位置包括位置236、239、243、256、290、292、298、300、305、312、326、330、332、333、334、345、360、339、378、396或430(残基编号根据eu索引)。可单独或组合进行的示例性突变是g236a、s239d、f243l、t256a、k290a、r292p、s298a、y300l、v305l、k326a、a330k、i332e、e333a、k334a、a339t和p396l。导致具有增加的adcc或adcp的抗体的示例性组合是igg1上的s239d/i332e、s298a/e333a/k334a、f243l/r292p/y300l、f243l/r292p/y300l/p396l、f243l/r292p/y300l/v305i/p396l和g236a/s239d/i332e。可进行突变以增强抗体的cdc的fc位置包括位置267、268、324、326、333、345和430。可单独或组合进行的示例性突变是s267e、f1268f、s324t、k326a、k326w、e333a、e345k、e345q、e345r、e345y、e430s、e430f和e430t。导致抗体cdc增加的示例性组合突变是igg1的k326a/e333a、k326w/e333a、h268f/s324t、s267e/h268f、s267e/s324t和s267e/h268f/s324t。“抗体依赖性细胞毒性”、“抗体依赖性细胞介导的细胞毒性”或“adcc”是诱导细胞死亡的机制,其依赖于经由效应细胞上表达的fcγ受体(fcγr),抗体包被的靶细胞与具有裂解活性的效应细胞,如自然杀伤细胞(nk)、单核细胞、巨噬细胞和嗜中性粒细胞的相互作用。例如,nk细胞表达fcγriiia,而单核细胞表达fcγri、fcγrii和fcγriiia。抗体的adcc活性可使用体外测定法利用表达抗体结合的蛋白质的细胞作为靶细胞和nk细胞作为效应细胞来评估。细胞溶解可通过释放来自裂解细胞的标记物(如,放射性底物、荧光染料或天然细胞内蛋白)来检测。在示例性测定法中,以1个靶细胞比4个效应细胞的比例使用靶细胞。将靶细胞用batda预先标记并与效应细胞和测试抗体组合。将样品温育2小时,并通过测量释放到上清液中的batda来测量细胞裂解。将数据相对于使用0.67%tritonx-100(sigmaaldrich)得到的最大细胞毒性和通过在不存在任何抗体的情况下从靶细胞自发释放batda确定的最小对照标准化。“抗体依赖性细胞吞噬作用”(“adcp”)是指通过吞噬细胞如巨噬细胞或树突细胞的内在化来消除抗体包被的靶细胞的机制。adcp可通过使用单核细胞衍生的巨噬细胞作为效应细胞和表达抗体结合的蛋白质的细胞作为靶细胞来评估,所述靶细胞还被工程化改造为表达gfp或其他标记分子。在示例性测定法中,效应物:靶细胞比可以是例如4:1。效应细胞可在有或没有本发明的抗体的情况下与靶细胞一起温育4小时。温育后,可使用accutase分离细胞。巨噬细胞可用与荧光标记物偶联的抗cd11b和抗cd14抗体进行鉴定,并且可使用标准方法基于cd11+cd14+巨噬细胞中的%gfp荧光来确定百分比吞噬。“补体依赖性细胞毒性”或“cdc”是指诱导细胞死亡的机制,其中靶物结合的抗体的fc效应物域结合并激活补体成分c1q,这继而激活补体级联,导致靶细胞死亡。补体的激活也可导致靶细胞表面上补体成分的沉积,所述补体成分通过结合白细胞上的补体受体(如,cr3)促进cdc。细胞的cdc可例如通过以下来测量:将daudi细胞以1×105个细胞/孔(50μl/孔)接种在rpmi-b(补充有1%bsa的rpmi)中,以0-100μg/ml的终浓度向孔中加入50μl测试抗体,于室温下温育反应15分钟,向孔中加入11μl合并人血清,并于37℃温育反应45分钟。可使用标准方法将百分比(%)裂解细胞作为facs测定法中%碘化丙啶染色细胞检测。抗体与fcγr或fcrn的结合可使用流式细胞术对工程化改造为表达各个受体的细胞进行评估。在示例性结合测定法中,将2x105个细胞/孔接种在96孔板中,并于4℃在bsa染色缓冲液(bdbiosciences,sanjose,usa)中封闭30分钟。将细胞与测试抗体在冰上于4℃温育1.5小时。用bsa染色缓冲液洗涤两次后,将细胞与r-pe标记的抗人igg二抗(jacksonimmunoresearchlaboratories)于4℃温育45分钟。将细胞在染色缓冲液中洗涤两次,然后重悬于150μl含有1:200稀释的draq7存活/死亡染色剂的染色缓冲液(cellsignalingtechnology,danvers,usa)中。通过miltenyimacsquant流式细胞仪分别使用b2和b4通道(miltenyibiotec,auburn,usa)检测染色细胞的pe和draq7信号。在draq7排除上门控活细胞,并确定收集到的至少10,000个存活事件的几何平均荧光信号。将flowjo软件(treestar)用于分析。数据绘制为抗体浓度的对数相比于平均荧光信号。进行非线性回归分析。“增强”或“增强的”是指与无突变的亲本抗体相比时,本发明的具有fc区中的至少一个突变的抗体的效应物功能(如,adcc、cdc和/或adcp)增强或与fcγ受体(fcγr)或fcrn的结合增强。“增强的”可以是约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或更多的增强,或统计上显著的增强。“降低”或“降低的”是指与无突变的亲本抗体相比时,本发明的具有fc区中的至少一个突变的抗体的效应物功能(如,adcc、cdc和/或adcp)降低或与fcγ受体(fcγr)或fcrn的结合降低。“降低的”可以是约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或更多的降低,或统计上显著的降低。“调节”是指与无突变的亲本抗体相比时,本发明的具有fc区中的至少一个突变的抗体的效应物功能(如,adcc、cdc和/或adcp)增强或降低或者与fcγ受体(fcγr)或fcrn的结合增强或降低。可将调节抗体与蛋白a结合的突变引入本发明方法中使用的抗体。全长双特异性治疗性抗体的生产和纯化需要将双特异性抗体与过量亲本和/或中间分子有效分离。因此,以不对称方式(如,仅在一条重链中)具有调节蛋白a结合的fc突变的双特异性抗体可以从亲本抗体中基于它们从蛋白a亲和柱的差异洗脱概况纯化。可以引入以调节蛋白a结合本发明方法中使用的抗体的示例性突变是q311r、q311k、t307p_l309q、t307p_v309q、t307p_l309q_q311r、t307p_v309q_q311r、h435r或h435r_y436f。糖工程化本发明方法中使用的抗体诱导adcc的能力可通过工程化改造它们的寡糖组分来增强。人igg1在asn297处是n-糖基化的,大部分聚糖为公知的双触角g0、g0f、g1、g1f、g2或g2f形式。由非工程化cho细胞产生的抗体通常具有约至少85%的聚糖岩藻糖含量。从连接到fc区的双触角复合型寡糖中去除核心岩藻糖可通过改善的fcγriiia结合增强抗体的adcc,而不会改变抗原结合或cdc活性。此类mab可使用报道为导致携带双触角复合体型fc寡糖的相对较高的去岩藻糖基化抗体的成功表达的不同方法来获得,如控制培养物渗透压(osmolality)、应用变体cho系lec13作为宿主细胞系、应用变体cho系eb66作为宿主细胞系,应用大鼠杂交瘤细胞系yb2/0作为宿主细胞系,引入特异性针对α1,6-岩藻糖基转移酶(fut8)基因的小干扰rna,或共表达β-1,4-n-乙酰氨基葡萄糖基转移酶iii和高尔基体α-甘露糖苷酶ii或有效的α-甘露糖苷酶i抑制剂kifunensine。本发明方法中使用的异源二聚体抗体可具有双触角聚糖结构,其中岩藻糖含量为约0%至约15%,例如15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0%。本发明方法中使用的异源二聚体抗体可具有双触角聚糖结构,其中岩藻糖含量为约50%、40%、45%、40%、35%、30%、25%、20%、15%、14%、13%、12%、11%10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0%。“岩藻糖含量”是指糖链内asn297处岩藻糖单糖的含量。岩藻糖的相对量是相对于所有糖结构的含有岩藻糖的结构的百分比。这些可通过多种方法进行表征和量化,例如:1)使用经n-糖苷酶f处理的样品的maldi-tof(如,复合、杂合和寡和高甘露糖的结构);2)通过酶促释放asn297聚糖,随后衍生化并通过利用荧光检测的hplc(uplc)和/或hplc-ms(uplc-ms)检测/定量;3)天然或还原的mab的完整蛋白分析,有或没有用endos或其他酶处理asn297聚糖,所述其他酶在第一和第二glcnac单糖之间切割,使岩藻糖附着于第一glcnac;4)通过酶促消化(如,胰蛋白酶或内肽酶lys-c)将mab消化为组成肽,然后通过hplc-ms(uplc-ms)进行分离、检测和定量;或5)通过用pngasef在asn297处进行特异性酶促去糖基化从mab蛋白中分离mab寡糖。释放的寡糖可用荧光团标记,通过各种互补技术分离并且鉴定,所述互补技术允许通过比较实验质量与理论质量通过基质辅助激光解吸电离(maldi)质谱法精细表征聚糖结构,通过离子交换hplc(glycosepc)确定唾液酸化程度,通过正相hplc(glycosepn)根据亲水性标准分离和定量寡糖形式,以及通过高效毛细管电泳-激光诱导荧光(hpce-lif)分离和定量寡糖。“低岩藻糖”或“低岩藻糖含量”是指具有约0%-15%的岩藻糖含量的抗体。“正常岩藻糖”或“正常岩藻糖含量”是指具有约超过50%,通常约超过60%、70%、80%或超过85%的岩藻糖含量的抗体。本发明方法中使用的异源二聚体抗体可通过诸如糖基化、异构化、去糖基化或非天然存在的共价修饰如添加聚乙二醇部分(聚乙二醇化)和脂化等过程进行翻译后修饰。这种修饰可在体内或体外发生。例如,本发明方法中使用的异源二聚体抗体可与聚乙二醇(peg化)缀合以改善其药代动力学概况。缀合可通过本领域技术人员已知的技术进行。已显示治疗性抗体与peg的缀合可增强药效学,而不干扰功能。c-末端赖氨酸在制造期间可部分去除本发明方法中使用的异源二聚体抗体的c端赖氨酸(ctl)。在制造期间,通过控制细胞外zn2+、edta或edta–fe3+的浓度,可将ctl去除控制于低于最大值的水平,如美国专利公开号us20140273092所述。可使用已知方法测量抗体中的ctl含量。本发明方法中使用的异源二聚体抗体可具有约10%至约90%、约20%至约80%、约40%至约70%、约55%至约70%、或约60%的c端赖氨酸含量。本发明方法中使用的异源二聚体抗体可具有约0%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%或100%的c端赖氨酸含量。抗体同种异型本发明方法中使用的异源二聚体抗体可以是任何同种异型的。预计同种异型对fab-臂交换没有影响。治疗性抗体的免疫原性与输注反应风险增加和治疗反应持续时间缩短有关(baertetal.,(2003)nengljmed348:602-08)。治疗性抗体在宿主中诱导免疫反应的程度可部分地由抗体的同种异型决定(stickleretal.,(2011)genesandimmunity12:213-21)。抗体同种异型与抗体恒定区序列中特定位置处的氨基酸序列变异有关。表2显示选择的igg1、igg2和igg4同种异型。表2靶抗原可以使用本发明的方法以使用fab-臂交换产生具有任何特异性的异源二聚体抗体,因为预期制造期间二硫键的还原和重新形成不受抗体vh/vl区的影响,本文也证明了这一点。取决于每个vh/vl对的特异性,异源二聚体抗体可在两个不同表位处结合同一靶抗原,或者可结合两个或更多个靶抗原。当异源二聚体抗体结合两个靶抗原时,靶抗原可位于同一细胞或两个不同细胞上。靶抗原可以是肿瘤相关抗原、在炎症、调节t或b细胞活性中起作用的抗原,或通常是期望调节其生物活性或期望表达靶物的细胞数量减少的任何靶物。本发明方法中使用的异源二聚体抗体可结合的示例性抗原是以下一种或多种:abcf1,acvr1,acvr1b,acvr2,acvr2b,acvrl1,adora2a,聚集蛋白聚糖(aggrecan),agr2,aicda,aif1,aig1,akap1,akap2,albumin,amh,amhr2,angpt1,angpt2,angptl3,angptl4,anpep,apc,apoc1,apoe,ar,azgp1(锌-a-糖蛋白),b7.1,b7.2,bad,baff,bag1,bai1,bcl2,bcl6,bcma,bdnf,blnk,blr1(mdr15),blys,bmp1,bmp2,bmp3b(gdf10),bmp4,bmp6,bmp8,bmpr1a,bmpr1b,bmpr2,bpag1(网蛋白),brca1,btla,c19orf10(il27w),c3,c4a,c5,c5r1,cant1,casp1,casp4,cav1,ccbp2(d6/jab61),ccl1(1-309),ccl11(嗜酸性粒细胞趋化因子(eotaxin)),ccl13(mcp-4),ccl15(mip-1d),ccl16(hcc-4),ccl17(tarc),ccl18(parc),ccl19(mip-3b),ccl2(mcp-1),mcaf,ccl20(mip-3a),ccl21(mip-2),slc,exodus-2,ccl22(mdc/stc-1),ccl23(mpif-1),ccl24(mpif-2/嗜酸性粒细胞趋化因子-2),ccl25(teck),ccl26(嗜酸性粒细胞趋化因子-3),ccl27(ctack/ilc),ccl28,ccl3(mip-1a),ccl4(mip-1b),ccl5(rantes),ccl7(mcp-3),ccl8(mcp-2),ccna1,ccna2,ccnd1,ccne1,ccne2,ccr1(ckr1/hm145),ccr2(mcp-1rb/ra),ccr3(ckr3/cmkbr3),ccr4,ccr5(cmkbr5/chemr13),ccr6(cmkbr6/ckr-l3/strl22/dry6),ccr7(ckr7/ebi1),ccr8(cmkbr8/ter1/ckr-l1),ccr9(gpr-9-6),ccrl1(vshk1),ccrl2(l-ccr),cd123,cd137,cd164,cd16a,cd16b,cd19,cd1c,cd20,cd200,cd-22,cd24,cd28,cd3,cd3ε,cd30,cd32a,cd32b,cd33,cd37,cd38,cd39,cd4,cd40,cd40l,cd44,cd45rb,cd47,cd52,cd69,cd72,cd73,cd74,cd79a,cd79b,cd8,cd80,cd81,cd83,cd86,cd89,cd96,cdh1(e-钙粘蛋白),cdh10,cdh12,cdh13,cdh18,cdh19,cdh20,cdh5,cdh7,cdh8,cdh9,cdk2,cdk3,cdk4,cdk5,cdk6,cdk7,cdk9,cdkn1a(p21wap1/cip1),cdkn1b(p27kip1),cdkn1c,cdkn2a(p16ink4a),cdkn2b,cdkn2c,cdkn3,cebpb,cer1,chga,chgb,几丁质酶,chst10,cklfsf2,cklfsf3,cklfsf4,cklfsf5,cklfsf6,cklfsf7,cklfsf8,cldn3,cldn7(claudin-7),cln3,clu(丛生蛋白),cmklr1,cmkor1(rdc1),cnr1,col18a1,col1a1,col4a3,col6a1,cr2,crp,csf1(m-csf),csf2(gm-csf),csf3(gcsf),ctla4,ctnnb1(b-连环蛋白),ctsb(组织蛋白酶b),cx3cl1(scyd1),cx3cr1(v28),cxcl1(gro1),cxcl10(ip-10),cxcl11(i-tac/ip-9),cxcl12(sdf1),cxcl13,cxcl14,cxcl16,cxcl2(gro2),cxcl3(gro3),cxcl5(ena-78/lix),cxcl6(gcp-2),cxcl9(mig),cxcr3(gpr9/ckr-l2),cxcr4,cxcr6(tymstr/strl33/bonzo),cyb5,cyc1,cysltr1,dab2ip,des,dkfzp451j0118,dnam-1,dncl1,dpp4,e2f1,ecgf1,edg1,efna1,efna3,efnb2,egf,egfr,elac2,eng,eno1,eno2,eno3,ephb4,epo,erbb2(her-2),ereg,erk8,esr1,esr2,f3(tf),fadd,fasl,fasn,fcer1a,fcer2,fcgr3a,fgf,fgf1(afgf),fgf10,fgf11,fgf12,fgf12b,fgf13,fgf14,fgf16,fgf17,fgf18,fgf19,fgf2(bfgf),fgf20,fgf21,fgf22,fgf23,fgf3(int-2),fgf4(hst),fgf5,fgf6(hst-2),fgf7(kgf),fgf8,fgf9,fgfr,fgfr3,figf(vegfd),fil1(epsilon),fil1(zeta),flj12584,flj25530,flrt1(粘连蛋白),flt1,fos,fosl1(fra-1),fy(darc),gabrp(gabaa),gageb1,gagec1,galnac4s-6st,gata3,gdf5,gfi1,ggt1,gitr,gitrl,gm-csf,gnas1,gnrh1,gpr2(ccr10),gpr31,gpr44,gpr81(fksg80),grcc10(c10),grp,gsn(gelsolin),gstp1,havcr2,hdac4,hdac5,hdac7a,hdac9,hgf,hif1a,hip1,组胺和组胺受体,hla,hla-a,hla-dra,hm74,hmox1,humcyt2a,hvem,iceberg,icos,icosl,ido,id2,ifn-a,ifna1,ifna2,ifna4,ifna5,ifna6,ifna7,ifnb1,ifnγ,ifnw1,igbp1,igf1,igf1r,igf2,igfbp2,igfbp3,igfbp6,il-1,il10,il10ra,il10rb,il11,il11ra,il-12,il12a,il12b,il12rb1,il12rb2,il13,il13ra1,il13ra2,il14,il15,il15ra,il16,il17,il17b,il17c,il17r,il18,il18bp,il18r1,il18rap,il19,il1a,il1b,il1f10,il1f5,il1f6,il1f7,il1f8,il1f9,il1hy1,il1r1,il1r2,il1rap,il1rapl1,il1rapl2,il1rl1,il1rl2,il1rn,il2,il20,il20ra,il21r,il22,il22r,il22ra2,il23,il24,il25,il26,il27,il28a,il28b,il29,il2ra,il2rb,il2rg,il3,il30,il3ra,il4,il4r,il5,il5ra,il6,il6r,il6st(糖蛋白130),il7,il7r,il8,il8ra,il8rb,il8rb,il9,il9r,ilk,inha,inhba,insl3,insl4,胰岛素,胰岛素受体,irak1,irak2,itga1,itga2,itga3,itga6(a6整合蛋白),itgav,itgb3,itgb4(b4整合蛋白),jag1,jak1,jak3,jun,k6hf,kai1,kdr,kitlg,kir,klf5(gcboxbp),klf6,klk10,klk12,klk13,klk14,klk15,klk3,klk4,klk5,klk6,klk9,krt1,krt19(角蛋白19),krt2a,krthb6(ii型毛发特异性角蛋白),lag-3,lama5,ldl,lep(瘦蛋白),lfa,lingo-p75,lingo-troy,lps,lta(tnf-b),ltb,ltb4r(gpr16),ltb4r2,ltbr,macmarcks,mag或omgp,map2k7(c-jun),mdk,间皮蛋白,c-met,mib1,中期因子,mif,mip-2,mki67(ki-67),mmp2,mmp9,ms4a1,msmb,mt3(金属硫蛋白-iii),mtss1,muc1(粘蛋白),c-myc,myd88,nck2,神经聚糖,nfkb1,nfkb2,ngfb(ngf),ngfr,ngr-lingo,ngr-nogo66(nogo),ngr-p75,ngr-troy,nkg2d,nkp46,nme1(nm23a),nox5,nppb,nr0b1,nr0b2,nr1d1,nr1d2,nr1h2,nr1h3,nr1h4,nrii2,nrii3,nr2c1,nr2c2,nr2e1,nr2e3,nr2f1,nr2f2,nr2f6,nr3c1,nr3c2,nr4a1,nr4a2,nr4a3,nr5a1,nr5a2,nr6a1,nrp1,nrp2,nt5e,ntn4,odz1,oprd1,ox-40,ox-40l,p2rx7,pap,part1,pate,pawr,pca3,pcna,pd-1,pd-l1,pdgfa,pdgfb,pecam1,pf4(cxcl4),pgf,pgr,磷酸蛋白聚糖,pias2,pik3cg,plau(upa),plg,plxdc1,ppbp(cxcl7),ppid,pr1,prkcq,prkd1,prl,proc,prok2,psap,psca,psma,ptafr,pten,ptgs2(cox-2),ptn,rac2(p21rac2),rarb,rgs1,rgs13,rgs3,rnf110(znf144),robo2,ror1,si00a2,scgb1d2(亲脂素b),scgb2a1(乳腺珠蛋白(mammaglobin)2),scgb2a2(乳腺珠蛋白1),scye1(内皮单核细胞激活细胞因子),sdf2,serpina1,serpina3,serpinb5(乳腺丝抑蛋白(maspin)),serpine1(pai-1),serpinf1,shbg,sla2,slc2a2,slc33a1,slc43a1,slit2,spp1,sprr1b(spr1),st6gal1,stab1,stat6,steap,steap2,tb4r2,tbx21,tcp10,tdgf1,tek,tf(转铁蛋白受体),tgfa,tgfb1,tgfb111,tgfb2,tgfb3,tgfbi,tgfbr1,tgfbr2,tgfbr3,th1l,thbs1(血小板反应蛋白-1),thbs2,thbs4,thpo,tie(tie-1),tigit,tim-3,timp3,组织因子,tlr10,tlr2,tlr3,tlr4,tlr5,tlr6,tlr7,tlr8,tlr9,tnf,tnf-a,tnfaip2(b94),tnfaip3,tnfrsf11a,tnfrsf1a,tnfrsf1b,tnfrsf21,tnfrsf5,tnfrsf6(fas),tnfrsf7,tnfrsf8,tnfrsf9,tnfsf10(trail),tnfsf11(trance),tnfsf12(apo3l),tnfsf13(april),tnfsf13b,tnfsf14(hvem-l),tnfsf15(vegi),tnfsf18,tnfsf4(ox40配体),tnfsf5(cd40配体),tnfsf6(fasl),tnfsf7(cd27配体),tnfsf8(cd30配体),tnfsf9(4-1bb配体),tollip,toll-样受体,top2a(拓扑异构酶iia),tp53,tpm1,tpm2,tradd,traf1,traf2,traf3,traf4,traf5,traf6,trem1,trem2,trpc6,tslp,tweak,vegf,vegfb,vegfc,versican,vhlc5,vista,vla-4,xcl1(淋巴细胞趋化因子),xcl2(scm-1b),xcr1(gpr5/ccxcr1),yy1以及zfpm2。在一些实施方案中,在本发明方法中使用的异源二聚体抗体结合cd3。在一些实施方案中,在本发明方法中使用的异源二聚体抗体结合cd3和肿瘤相关抗原(taa)。在一些实施方案中,在本发明方法中使用的异源二聚体抗体结合cd123和cd3两者以及bcma和cd3两者。在一些实施方案中,在本发明方法中使用的异源二聚体抗体结合egfr和c-met。在一些实施方案中,结合egfr和c-met的异源二聚体抗体包含seqidno:4的第一重链(hc1)、seqidno:5的第一轻链(lc1)、seqidno:6的第二重链(hc2)和seqidno:7的第二轻链(lc2)。本发明还提供了通过本发明的方法产生的双特异性抗体。本发明还提供了通过本发明的方法产生的结合egfr和c-met的双特异性抗体。本发明还提供通过本发明的方法产生的结合egfr和c-met的双特异性抗体,其包含seqidno:4的第一重链(hc1)、seqidno:5的第一轻链(lc1)、seqidno:6的第二重链(hc2)和seqidno:7的第二轻链(lc2)。同源二聚体和异源二聚体抗体的产生第一同源二聚体抗体和第二同源二聚体抗体可在培养容器例如生物反应器中一起或分别产生。第一同源二聚体抗体和第二同源二聚体抗体可通过共表达在宿主细胞中表达或通过使用单独的宿主细胞产生各个同源二聚体抗体而产生。在后一种情况下,宿主细胞可以是相同或不同来源的。“宿主细胞”是指已导入有一种或多种表达至少一条抗体重链和一条抗体轻链的载体的细胞。“宿主细胞”不仅指特定的受试细胞,而且还指这种细胞的后代,也指由特定受试细胞产生的稳定细胞系。因为某些修饰可能由于突变或环境影响而在后续世代中发生,所以此类后代可能与亲本细胞不同,但仍包括在本文所用的术语“宿主细胞”的范围内。此类宿主细胞可以是真核细胞、原核细胞、植物细胞或古细菌细胞。大肠杆菌、杆菌如枯草芽孢杆菌和其他肠杆菌科如沙门氏菌属、沙雷氏菌属和各种假单胞菌属物种是原核宿主细胞的示例。其他微生物如酵母也可用于表达。酵母属(如,酿酒酵母)和毕赤酵母属是合适的酵母宿主细胞的示例。示例性真核细胞可以是哺乳动物、昆虫、鸟类或其他动物来源的。哺乳动物真核细胞包括永生化细胞系如杂交瘤或骨髓瘤细胞系如sp2/0(美国典型培养物保藏中心(atcc),manassas,va,crl-1581)、ns0(欧洲动物细胞保藏中心(ecacc),salisbury,wiltshire,uk,ecaccno.85110503)、fo(atcccrl-1646)和ag653(atcccrl-1580)鼠细胞系。示例性的人骨髓瘤细胞系是u266(attccrl-tib-196)。其他有用的细胞系包括源自中国仓鼠卵巢(cho)细胞的那些细胞系,例如chok1sv(lonzabiologics,walkersville,md)、chok2sv(lonza)、cho-k1(atcccrl-61)或dg44。可用于表达一种或多种抗体重链和轻链的示例性载体包括pwlneo、psv2cat、pog44、pxr1、psg(stratagene)psvk3、pbpv、pmsg和psvl(pharmacia)、pee6.4(lonza)和pee12.4(lonza)以及lonzaxceed系统中使用的载体。第一同源二聚体抗体和第二同源二聚体抗体可通过在单独的宿主细胞中表达它们来产生。在这种情况下,可以将第一同源二聚体抗体和第二同源二聚体抗体纯化,之后在还原剂存在下混合它们以启动fab-臂交换。纯化可使用已知方法如蛋白a层析来完成。可选择地,可将含有第一同源二聚体抗体和第二同源二聚体抗体的培养基组合,其中可加入还原剂以启动fab-臂交换。如果第一同源二聚体抗体和第二同源二聚体抗体是通过共表达产生的,则也可使用蛋白a层析来纯化抗体。本文描述了产生异源二聚体抗体的fab-臂交换。优化诸如第一同源二聚体抗体和第二同源二聚体抗体的浓度、还原剂、还原剂的浓度、还原时间、溶氧浓度、进行反应的温度和所用缓冲液的工艺条件,从而以高产率和纯度产生异源二聚体抗体,如本文所述。fab-臂交换后,可进一步纯化产生的异源二聚体抗体。纯化方法包括蛋白a、蛋白g层析、其他亲和层析方式,例如基于抗原结合或与抗独特型抗体结合的亲和层析、硫亲和(thioaffinity)、离子交换、疏水相互作用、羟基磷灰石层析和其他混合模式树脂的组合。其他方法可以使用用例如盐或聚乙二醇的沉淀来获得纯化的异源二聚体抗体。适用于本发明方法过程的设备是已知的。宿主细胞的同源二聚体抗体表达通常可例如在反应容器如生物反应器中进行。还原和氧化步骤可在与表达第一同源二聚体抗体和/或第二同源二聚体抗体的同一生物反应器中进行,或者它可在单独的反应器容器中进行。反应容器和支持过程管道可以是一次性的或可重复使用的,并且由标准材料(塑料、玻璃、不锈钢等)制成。反应容器可配备有混合、喷雾、顶空充气、温度控制和/或用探头监测以进行温度、重量/体积、ph、溶氧(do)和氧化还原电位的测量。所有这些技术在制造工厂的标准单元操作中是通用的并且是本领域技术人员公知的。虽然已经概括地描述了本发明,但本发明的实施方案将在以下实施例中进一步公开,这些实施例不应被解释为限制权利要求书的范围。实施例1.一般方法csds毛细管十二烷基硫酸钠-聚丙烯酰胺凝胶电泳基于分子量分离蛋白。分析采用商业毛细管电泳系统以及在温度控制盒中的熔融二氧化硅毛细管。将测试物品与内部标准品和烷基化试剂混合,加热限定的时间和温度以使蛋白变性。然后通过电压以电动方式注射样品,接着在预定持续时间内通过施加更大的电场进行分析。通过220nm处的吸光度完成检测,并且通过相对于内部标准品后电泳图中的所有其他峰,计算主峰的校正峰面积来确定纯度。iex-hplc通过离子交换高效液相层析(iex-hplc)确定相对于残留亲本同源二聚体抗体的百分比双特异性抗体。离子交换层析通过利用分子上表面电荷的差异来实现分离。iex-hplc使用thermoscientificpropacwcx-10(4mmidx150mm,填充10μm颗粒)进行。使用盐梯度和/或ph梯度解析物质的分离。随着梯度浓度的增加,每种抗体与柱的整体表面相互作用被中和,并在280nm处检测洗脱液。通过比较峰面积计数来测量每种igg的相对量。hic-hplc疏水相互作用层析基于蛋白质的疏水性来分离它们。蛋白质在高盐条件下保留在柱上,并通过降低盐浓度洗脱。高盐缓冲条件由于降低的蛋白质溶剂化作用而暴露疏水区,并促进与hic固定相的结合。将样品注入tosohtskgelbutyl-npr(4.6mmx10cm,2.5um基于无孔树脂的珠)柱并用硫酸铵梯度洗脱。在280nm处监测吸光度,并与参考标准品注射相比鉴定峰。rp-hplc(检测胱胺)反相高效层析基于与固定相介质的疏水结合相互作用来分离流动相中的溶质分子。利用2-mea和氧化二聚体形式胱胺的疏水性差异,通过rp-hplc通过比较测量值与标准曲线来进行解析和定量。采用phenomenexluna18(4.6mmx150mm,3um)柱,使用己烷磺酸盐/乙腈流动相体系,通过增加有机溶剂的步骤梯度来分离这两种物质。通过监测220nm(2-mea)和255nm(胱胺)处的吸光度来检测物质,并且将峰面积与其相对标准曲线进行比较。单特异性物和双特异性物的一般抗体产生方案(以200ml规模完成)和缩放各单特异性抗体从个别的哺乳动物细胞库中解冻,在生物反应器中分别扩增和表达。生产生物反应器补充有富集培养基并在明显细胞死亡之前收获。通过离心和/或过滤收获生物反应器,并通过亲和蛋白a层析分别捕获单特异性抗体。然后将所得捕获的单特异性抗体冷冻储存,直到在fae阶段中组合。实施例2:使用fab-臂交换制造双特异性抗体期间的工艺改进通过在两个同源二聚体亲本抗体的ch3域中引入不对称突变,然后还原和重新形成分子间二硫键,使用fab-臂交换产生双特异性抗体。不对称ch3域突变驱动异源二聚体双特异性抗体相对于同源二聚体亲本抗体的优先形成。为了确保制造期间的过程稳健性,设计实验以了解制造期间各种参数的可能阈值和范围。已显示抗体二硫键重新形成依赖于氧和游离金属的存在,因为edta和无氧条件抑制抗体中半胱氨酸重新氧化形成二硫键(us2014/0303356)。因此,开始研究以调查利用fab-臂交换制造双特异性抗体期间控制溶氧(do2)和金属量的必要性。图2显示通过fab-臂交换制造双特异性抗体期间二硫键还原和重新形成过程中的制造步骤。理论上,用还原剂如2-巯基乙胺(2-mea)还原后的抗体二硫键重新形成可通过多种途径进行。例如,硫醇-二硫化物交换可导致二硫键还原和重新形成。为了进行硫醇-二硫化物交换,还原剂如2-mea需要以其硫醇(rs-)形式进行硫醇-二硫化物交换。图3显示硫醇-二硫化物交换反应的分子细节。为了还原亲本抗体中的二硫键,硫醇根阴离子(在图3中圈出)攻击二硫键的硫原子,置换硫原子之一并与2-mea硫醇根形成新的二硫键。使用以下所示的henderson-hasselbalch方程,2-mea硫醇(sh)和硫醇根阴离子(s-)的比率高度依赖于ph和2-mea硫醇pka。因此,二硫键的还原和总体fab-臂交换在低ph受到抑制,其中2-mea的质子化硫醇形式相对于其去质子化硫醇根阴离子形式是有利的。较高ph时,平衡向硫醇根移动,从而能够还原二硫键和硫醇-二硫化物交换。图4示出在存在2-mea下fab-臂交换期间可发生的反应总结。在fab-臂交换期间,通过缓冲液交换(uf/df期间)去除还原剂(如,2-mea)可使异源二聚体双特异性抗体中的二硫键重新形成,但是多个反应途径允许二硫化物重新形成过程发生。在氧存在下,氧可与质子化的硫醇根反应,促进异源二聚体双特异性抗体中二硫键的重新形成,如图4中的反应2所示。氧的存在也可以消减溶液中残留的2-mea硫醇,形成胱胺二聚体和水,如图4中的反应4所示。因此,在fab-臂交换期间应使用足够高浓度的2-mea,以改善双特异性抗体的效率和产率。然而,在缺乏氧的情况下,硫醇根二硫化物交换和二硫键的重新形成仍然可以是可能的。在氧剥夺的条件下,由于缓冲液交换期间2-mea的浓度降低,抗体硫醇基团和2-氨乙基二硫化物fab中间体可以以相反方向驱动图4的反应1,重新形成双特异性异源二聚体抗体中的二硫键,伴随产生2-mea硫醇盐。由于在缓冲液交换过程期间去除了更多的2-mea,该反应将继续向相反方向推进。实施例3:uf/df期间在低do2条件下制造双特异性抗体a实验方法在该实验中,在还原期间和加入2-mea后长达23小时存在环境do2水平,此后包括氮气覆盖层以使uf/df期间的%do2最小化。该方法反映了还原阶段期间存在氧而在二硫键重新形成期间不存在氧的条件。双特异性抗体a结合bcma和cd3,并且是igg4同种型,其具有两条重链中的s228p、f234a、l235a取代(“paa取代”),一条重链中的位置405处的f和位置409处的r和第二条重链中的位置405处的l和位置409处的k,以驱动异源二聚体形成。亲本抗体命名为p1a-igg4paaf405r409和p2a-igg4paal405k409。从细胞培养生物反应器中收获亲本抗体p1a-igg4paaf405r409和p2a-igg4paal405k409,并通过蛋白a亲和层析纯化。使用p1a-igg4paaf405r409和p2a-igg4paal405k409以操纵摩尔比或1:1.06以有意限制亲本抗体之一制备溶液。然后将混合物调节至ph7.3并使用101mm乙酸钠、105mmtris碱,ph7.3稀释至10.5g/l的总igg浓度。将50mm乙酸钠、800mm2-meaph5.0储备液添加到亲本mab混合物中。uf/df之前的最终还原缓冲液组合物为约100mm乙酸钠、约35mm2-mea、约30mmnaclph7.3。将还原的亲本mab溶液于24℃温育23小时,随后转移到uf/df渗余物容器中。在超滤(uf)和渗滤(df)开始之前,经由容器的顶部空间将氮气覆盖层递送到渗余物容器,以在二硫桥重新形成期间消减do2,并在整个uf和df过程中维持。为了防止通过渗滤缓冲液添加do2,在整个处理中向渗滤缓冲液(100mmtris-乙酸盐、30mmnaclph7.5)喷氮气。使用在线do2传感器验证在uf和df步骤开始之前,渗余物do2已达到低于5%do2的水平并且渗滤缓冲液已达到低于1%do2的水平。在整个uf和df过程中,在uf/df期间测量进料入口、渗余物和渗透物管线中的do2水平,并且都保持于<4%do2。将渗滤缓冲液维持于<1%do2的水平。将uf/df系统维持于54ml/min的错流流速,目标为14.5psi跨膜压力进行11个渗滤体积(dv)。温育后的所有过程均于室温(18-22℃)进行。uf/df完成后,回收的渗余物用1.0m乙酸淬灭并调节至ph5.0,以使进一步的二硫键形成最小化,随后于2-8℃储存。在uf/df完成后没有进行额外的缓冲液回收冲洗,以防止材料因引入额外的渗滤缓冲液而发生任何可能的氧化。uf/df设置装备为在处理过程中3个位置处测量do2。在线监测进料入口、渗余物和渗透物管线的%do2示于图5中。降低do2后,渗透物中的水平保持在5%以下,入口/渗余物中的水平保持在3%以下。表3显示uf/df工艺参数和性能的总结。表3表4显示添加2-mea之前和之后期间离线%do2、ph和电导率测量值的总结。图6显示在渗余物、渗透物和入口管线中测量的uf/df期间的百分比(%)do2。再循环中氮气覆盖渗余物后,随着时间的推移,%do2在渗透物中稳定为3.2%,在渗余物中稳定为1.5%,在进料中稳定为1.4%。将非还原性csds分析用于测量形成的异源二聚体双特异性抗体的二硫键完整性(在非还原性csds上以异源二聚体抗体的%纯度测量)。抗体a的纯度测定为97.59%。该研究表明,还原期间在环境%do2(范围为89-13%)下和低%do2环境(uf/df期间<4%do2)下,形成双特异性抗体a,其具有高水平的二硫键形成(以非还原性csds的%纯度反映)。以前认为需要do2使硫醇氧化成二硫键以稳定双特异性抗体。表4步骤溶氧(%)ph电导率(ms/cm)亲本igg混合物88.14.993.37ph调节的亲本池87.57.354.43稀释的ph调节的亲本池88.97.334.392-mea添加后(t=0)36.96.997.732-mea添加后(t=2hr)18.72-mea添加后(t=23hr)13.2该研究期间存在的氧水平经计算不足以促成uf/df期间硫醇的氧化。下面的计算表明,使用由图4中的反应2表示的反应,需要溶液中do2浓度高于30%才能发生硫醇的氧化。对于该研究,进行了以下假设来计算使存在的抗体量中的所有硫醇氧化的理论百分比do2饱和溶液:·igg溶液:10g/l·摩尔s-s(待还原和氧化的二硫键)/摩尔mab·1/2摩尔o2/摩尔s-s。如果从硫醇生成二硫键需要氧,则参见图4的反应2·空气饱和水中的氧溶解度=7ppm(go2/106g溶液=100%饱和度·mabmw:150kda为了计算当将4个二硫化物/摩尔mab氧化时氧化10mg/ml抗体溶液的%溶解do2浓度和氧化所有硫醇需要的o2:1.(10mgmab/ml溶液)*(摩尔mab/150000gmab)*(2摩尔s-s/摩尔mab)*(1/2摩尔o2/摩尔s-s)*(1000ml/1l)(1g/1000mg)=6.67x10-4摩尔o2/l溶液2.(6.67x10-5摩尔o2/l溶液)*(31.998go2/1摩尔o2)*(1l/1000g)=2.13x10-6go2/g溶液3.(2.13x10-6go2/g溶液)*(106g溶液)=2.13go2/106g溶液=2.13ppm4.空气饱和水约7go2/106g溶液=7ppm5.2.13ppm/7ppm=需要30%o2饱和溶液操作温度下2%do2相当于0.192mg/ml或6.00μm,3%do2相当于0.288mg/l或8.99μm,4%do2相当于0.384mg/l或11.29μm,5%do2相当于0.480mg/ml或14.99μm。30%do2相当于2.88mg/ml或90μm。这表明存在不依赖于氧的化学反应途径,其允许uf/df步骤期间在没有氧的情况下重新形成二硫键。当从溶液中去除2-mea时,图4的反应1的逆反应驱动异源二聚体双特异性抗体中的二硫桥的重新形成是可能的。结论:uf/df期间使do2水平维持于<4%不显著影响二硫键的形成。uf/df完成时,双特异性抗体的纯度>97%。实施例4:uf/df期间以低do2制造双特异性抗体b在该实验中,还原期间和加入2-mea后长达23小时都存在环境do2水平,此后包括氮气覆盖层以使uf/df期间%do2最小化。该方法反映了在还原阶段期间存在氧而在二硫键重新形成期间不存在氧的条件。双特异性抗体b结合cd123和cd3,并且是igg4同种型,具有两条重链中的s228p、f234a、l235a取代(“paa取代”),一条重链中的位置405处的f和位置409处的r,以及在第二条重链中的位置405处的l和位置409处的k,以驱动异源二聚体形成。亲本抗体命名为p1b-igg4paaf405r409和p2b-igg4paal405k409。从细胞培养生物反应器中收获亲本抗体p1b-igg4paaf405r409和p2b-igg4paal405k409,并通过蛋白a亲和层析纯化。制备p1b-igg4paaf405r409和p2b-igg4paal405k409的溶液并将其调节至ph7.3,并使用101mm乙酸钠,105mmtris碱,ph7.3稀释至10.5g/l的总igg浓度。将50mm乙酸钠、800mm2-meaph5.0储备液添加到亲本混合物中。uf/df之前的最终还原缓冲液组合物是约100mm乙酸钠、约35mm2-mea、约30mmnacl,ph7.3。还原的亲本溶液于24℃下温育23小时,随后转移到uf/df渗余物容器中。在超滤(uf)和渗滤(df)开始之前,经由容器的顶部空间将氮气覆盖层递送到渗余物容器中,以在二硫桥重新形成期间消减do2,并在整个uf和df过程中维持。为了防止从渗滤缓冲液中加入do2,在整个处理中向渗滤缓冲液(100mmtris-乙酸盐30mmnaclph7.5)喷氮气。使用在线do2传感器验证在uf和df步骤开始之前,渗余物已达到低于5%do2的水平,并且渗滤缓冲液已达到低于1%的水平。在整个uf和df过程中,测量uf/df期间进料入口、渗余物和渗透物管线中的do2水平,并且均维持在<4%do2。渗滤缓冲液维持在<1%do2的水平。将uf/df系统维持于42ml/min的错流速率,目标为15.0psi跨膜压力进行11个渗滤体积(dv)。温育后的所有过程均于室温(18-22℃)下进行。uf/df完成后,取3ml样品,保持ph7.5未调整,并立即于-70℃储存以防止进一步氧化。用1.0m乙酸淬灭剩余体积的回收的渗余物并调节至ph5.0,以使进一步的二硫键形成最小化。随后将大量材料于-70℃储存。uf/df完成后没有进行额外的缓冲液回收冲洗,以防止材料因引入额外的渗滤缓冲液而发生任何可能的氧化,但是产率低于通常观测到的。uf/df设置装备为在处理过程中3个位置处测量do2。图5显示进料入口、渗余物和渗透物管线中%do2的在线监测。降低do2后,渗透物中的水平保持在5%以下,入口/渗余物中的浓度保持在3%以下。表5显示uf/df过程参数的总结。图7显示渗余物、渗透物和入口管线中测量的uf/df期间%do2。表6显示离线%do2、ph和电导率测量结果的总结。表5最终2-mea浓度(mm)35.0tmp(psi)15.0-16.5错流(ml/min)42-45渗滤浓度(g/l)25.0总渗滤体积(dv)11平均渗透通量(l/m2/hr)17.7负荷比(g/m2)320产率(%)85表6将非还原性csds分析用于测量ph7.5的冷冻样品和ph5.0的大量材料形成的双特异性抗体中的二硫键完整性。ph7.5的双特异性抗体制剂的纯度测量为97.16%,并且ph5.0的抗体制剂的纯度测量为97.27%。该研究表明,还原期间的环境%do2(范围为83-24%)和uf/df期间的低%do2环境(<4%do2)下,形成双特异性抗体b,其具有高水平的二硫键形成。该研究和实施例2中描述的研究都表明,uf/df步骤期间fab-臂交换过程中氧对于二硫桥的重新形成不是必需的。结论:在使用fab-臂交换制造双特异性抗体b的uf/df步骤期间将do2水平维持在<4%不会显著影响二硫键形成。在uf/df完成时,非还原性csds显示%纯度>97%。实施例5:uf/df期间edta存在下低do2中制造双特异性抗体a在制造双特异性抗体期间,有机会将游离金属离子引入制造过程。在通过原材料制备缓冲液和从金属成分中浸出期间,这些游离金属离子可参与fab-臂交换的氧化还原反应。为了研究微量金属在fab-臂交换中的可能影响,研究fab-臂交换过程中的edta添加。edta添加隔离了溶液中可能的游离金属离子,其可催化氧化反应以重新形成二硫键。使用p1a-igg4paaf405r409和p2a-igg4paal405k409以1.05:1.00的摩尔比制备溶液。然后将混合物调节至ph7.3并使用101mm乙酸钠、105mmtris碱,ph7.3稀释至10.5g/l的总igg浓度。将50mm乙酸钠、800mm2-mea,ph5.0储备液添加到亲本mab混合物中。uf/df之前的最终还原缓冲液组合物为约100mm乙酸钠、约35mm2-mea、约30mmnacl,ph7.3。将还原的亲本溶液于24℃温育23.5小时。在温育完成时,将500mmedta,ph8.0储备液添加到还原的亲本混合物至2mmedta的目标以螯合游离金属离子,其在uf/df开始之前会存在于溶液中。还向渗滤缓冲液中加入edta至100mmtris-乙酸盐、30mmnacl、2mmedta,ph7.5的目标。这样做是为了确保uf/df缓冲液交换期间不能引入额外的游离金属离子。在还原步骤期间不添加edta以允许在该步骤期间可能自发发生的任何可能的二硫化物氧化和胱胺形成。随后将含有edta的还原的亲本溶液转移到uf/df渗余物容器中,在uf开始之前,经由容器的顶部空间将氮气覆盖层递送到渗余物容器中,以从渗余物消减do2并在整个uf和df过程中维持。为了防止通过渗滤缓冲液添加do2,在整个处理中向渗滤缓冲液喷氮气。在线do2传感器证实,在uf和df步骤开始之前,渗余物do2水平达到低于2%do2的水平,并且渗滤缓冲液达到低于1%do2的do2水平。在整个uf和df过程中,测量uf/df期间进料入口、渗余物和渗透物管线中的do2水平,并且均维持<4%do2。将渗滤缓冲液维持在<1%do2的水平。将uf/df系统维持58ml/min的交错流速,目标为14.5psi跨膜压力进行11个渗滤体积(dv)。温育后的所有过程均于室温(18-22℃)进行。uf/df完成后,取9ml样品,于ph7.5保持未调整状态,并立即于-70℃储存以防止进一步氧化。剩余体积的回收渗余物用1.0m乙酸淬灭并调节至ph5.0,以使进一步的二硫键形成最小化。随后将ph5.0的整体双特异性抗体样品于-70℃储存。uf/df完成后不进行缓冲液回收冲洗,以防止材料因引入额外的渗滤缓冲液而可能发生氧化。表7总结了uf/df工艺参数和性能。表7最终2-mea浓度(mm)35.0tmp(psi)14.8-15.5错流(ml/min)58渗滤浓度(g/l)25.0总渗滤体积(dvs)11平均渗透通量(l/m2/hr)30.9负荷比(g/m2)318产率(%)n/a将非还原性csds分析用于测量ph7.5的冷冻样品和ph5.0的整体材料的形成的双特异性抗体中的二硫键完整性。ph7.5的双特异性抗体制剂的纯度为97.44%,并且ph5.0的双特异性抗体制剂的纯度测量为97.39%。该研究表明,uf/df期间的低%do2环境和最少可用游离金属离子下形成双特异性抗体a,其具有高水平的二硫键形成。该研究表明,fab-臂交换的uf/df期间可以不需要用于催化氧化反应的游离金属离子。结论:实验结果表明,fab-臂交换中的uf/df之前将edta添加到还原的亲本混合物不影响二硫键形成。uf/df完成时,非还原性csds导致%纯度>97%。实施例6:还原和uf/df期间环境和低do2条件下fab-臂交换的比较该研究设计为评估2-mea还原期间可发生某些do2介导的氧化的假设。对于该研究,fab-臂交换使用亲本抗体p1b-igg4paaf405r409和p2b-igg4paal405k409进行。在溶液中制备p1b-igg4paaf405r409和p2b-igg4paal405k409的混合物并调节至ph7.3,并使用101mm乙酸钠、105mmtris碱、ph7.3稀释至10.5g/l的总igg浓度。将含有亲本抗体的混合物分成两个单独的容器。在一个容器中,经由顶部空间将氮气覆盖层递送到容器中以从亲本混合物消减do2,直到达到%do2<5%。将另一亲本混合物容器保持在环境空气条件下作为还原的对照。将50mm乙酸钠、800mm2-meaph5.0储备液加入各亲本混合物中。uf/df之前的最终还原缓冲液组合物为约100mm乙酸钠、约35mm2-mea、约30mmnacl,ph7.3。两种还原的亲代溶液均于24℃温育24小时,并且测量两个容器的%do2,其结果显示在图8中。在整个温育过程中,将低%do2还原容器保持在氮气覆盖层下,并保持<2%do2达24小时。在保持于环境空气下的容器中,2-mea掺加后%do2最初下降至约40%do2,此后%do2逐渐线性增加回>90%do2。uf/df工艺参数和性能的总结示于表8中。表8最终2-mea浓度(mm)35.0tmp(psi)14.5-16.0错流(ml/min)55渗滤浓度(g/l)25.0总渗滤体积(dvs)12平均渗透通量(l/m2/hr)19.5负荷比(g/m2)251产率(%)n/a在还原期间,通过容器上的采样口从两个容器中获取样品。在每次抽取样品之前冲洗端口,并通过添加10%v/v胱胺的rp-hplc流动相、20mm己烷磺酸盐、ph2.0缓冲液立即淬灭样品,并验证各样品在分析前已还原至ph<5。所有时间点的二硫键完整性通过非还原性csds测定,并且残留2-mea/胱胺浓度通过rp-hplc测定。残留2-mea/胱胺分析需要额外的样品制备,所述分析涉及通过5kda分子量保留过滤器去除抗体。非还原性csds%纯度和残留的2-mea/胱胺结果报告在表9中。24小时还原温育完成时,将低%do2容器转移到uf/df系统。氮气覆盖层继续经由容器的顶部空间递送到渗余物容器,以继续从渗余物中消减do2,并在整个uf和df过程中保持。在整个处理中还对渗滤缓冲液进行了氮气保护,以防止通过缓冲液加入do2。使用在线do2传感器验证在uf和df步骤开始之前,渗余物已达到低于5%do2的水平并且渗滤缓冲液已达到低于1%do2的水平。在整个uf和df过程中,在uf/df期间测量进料入口、渗余物和渗透物管线中的do2水平,并且均维持于<4%do2。将渗滤缓冲液维持于<1%do2的水平。将uf/df系统维持于55ml/min的错流速率,目标为14.5psi的跨膜压力达12个渗滤体积(dv),使用100mmtris-乙酸盐、30mmnacl,ph7.5缓冲液进行。温育后的所有过程均于室温(18-22℃)进行。uf/df完成后,回收的渗余物用1.0m乙酸淬灭并调节至ph5.0,以使进一步的二硫键形成最小化。随后将整体材料于-70℃储存。uf/df完成后不进行额外的缓冲液回收冲洗,以防止材料因引入额外的渗滤缓冲液发生任何可能的氧化。对于低do2%容器和具有环境do2的对照容器,在整个还原和uf/df的不同时间点通过非还原性csds测量二硫化物完整性和通过rp-hplc测量残留的2-mea/半胱胺。表9示出数据总结。在该实验中,仅通过uf/df继续在氧剥夺条件下进行的fab-臂交换反应。对于这两种fab-臂交换条件仅通过还原测量残留的2-mea和胱胺,但是对于氧剥夺条件在uf/df期间,获得样品以通过非还原性csds测量可能的二硫键重新形成。表9*初始t=0样品在亲本混合物的2-mea掺加后立即采集。采用取样时间点确定还原和uf/df期间二硫键的还原和重新形成速率结论:该数据支持还原和uf/df期间没有氧的情况下,不依赖氧的途径介导二硫键形成的假设。在缺剥夺条件下进行fab-臂交换时,在还原过程中观测到最低的胱胺形成和二硫键重新形成。通过在2-mea存在下完成24小时温育,仅观测到1.6mm胱胺和14.74%完整抗体。然而,一旦抗体样品通过uf/df进行处理,随着去除2-mea,渐增水平的二硫键重新形成是明显的。在dv结束时(dv12时),测量ph5.0时形成的双特异性抗体制剂为90.59%的纯度%。在环境do2中,二硫键还原迅速发生,还原开始后30分钟,约86%的亲本抗体被还原。在还原的剩余部分期间观测到二硫键的重新形成,即使在溶液中继续存在残留的2-mea时也是如此。在还原阶段完成时,71%的抗体具有完整的二硫键。还原温育期间胱胺二聚体形成以及渐增水平的双特异性抗体形成,表明氧分别被反应4和2消耗,图4中所示。这得到rp-hplc数据的支持,该数据显示2-mea的显著消减以及转化为二聚体化合物胱胺(图4中的反应4)。该研究表明,还原阶段期间的do2催化形成igghc-hc和lc-hc链间二硫键,但对于完整双特异性抗体的形成不是必需的,因为即使在氧剥夺条件下也重新形成二硫键。即使在没有氧的情况下,渗滤期间去除2-mea导致由图4中的反应1的逆反应驱动的二硫键重新形成。实施例7:利用高浓度亲本抗体在环境do2中使用fab-臂交换产生双特异性egfr/c-met抗体该研究设计为评估较高的同源二聚体混合物蛋白浓度和不同的还原剂与蛋白质质量比率产生氧化的异源二聚体抗体的假设。该研究中使用双特异性egfr/cmet抗体。egfr/cmet抗体包含seqidno:4的第一重链(hc1)、seqidno:5的第一轻链(lc)、seqidno:6的第二hc(hc2)和seqidno:7的第二lc(lc2)。对于该研究,使用亲本egfr和c-met抗体(均为igg1同种型)进行fab-臂交换。制备溶液中过滤的中和的亲本抗体蛋白a洗脱液混合物,并将其调节至ph7.9,并使用209.5mm乙酸钠、300mmnaclph7.9稀释至10-35g/l的总igg浓度。将50mm乙酸钠、800mm2-meaph5.0储备液添加到各亲本混合物至35、50或100mm的还原剂浓度目标。两种还原的亲本溶液在控制为21.5℃、24℃的情况下或在环境室温不受控制的情况下温育3小时。3小时后,将温育的混合物超滤并且针对10mmtris、7.8mm乙酸、ph7.5渗滤。表10示出操作条件和分析结果的总结。本研究证明在21.5-24℃的温度范围、35-100mm的还原剂浓度和10-35g/l的同源二聚体混合物蛋白浓度的这些条件下氧化的异源二聚体。使用实施例1中描述的方法通过nr-csds和ihc-hplc评估双特异性抗体的完整性和纯度。表10seqidno:4(hc1)seqidno:5(lc1)seqidno:6(hc2)seqidno:7(lc2)序列表<110>janssenbiotech,inc.alfonsomartin,pedrojosecapaldi,michaelcohen,jeffreydetzel,andrewsakyiama,joseph<120>产生异源二聚体抗体的方法<130>jbi6029wopct1<140>待分配<141>2019-12-xx<160>7<170>patentinversion3.5<210>1<211>330<212>prt<213>智人<400>1alaserthrlysglyproservalpheproleualaproserserlys151015serthrserglyglythralaalaleuglycysleuvallysasptyr202530pheprogluprovalthrvalsertrpasnserglyalaleuthrser354045glyvalhisthrpheproalavalleuglnserserglyleutyrser505560leuserservalvalthrvalproserserserleuglythrglnthr65707580tyrilecysasnvalasnhislysproserasnthrlysvalasplys859095lysvalgluprolyssercysasplysthrhisthrcysproprocys100105110proalaprogluleuleuglyglyproservalpheleuphepropro115120125lysprolysaspthrleumetileserargthrprogluvalthrcys130135140valvalvalaspvalserhisgluaspprogluvallyspheasntrp145150155160tyrvalaspglyvalgluvalhisasnalalysthrlysproargglu165170175gluglntyrasnserthrtyrargvalvalservalleuthrvalleu180185190hisglnasptrpleuasnglylysglutyrlyscyslysvalserasn195200205lysalaleuproalaproileglulysthrileserlysalalysgly210215220glnproarggluproglnvaltyrthrleuproproserargaspglu225230235240leuthrlysasnglnvalserleuthrcysleuvallysglyphetyr245250255proseraspilealavalglutrpgluserasnglyglnprogluasn260265270asntyrlysthrthrproprovalleuaspseraspglyserphephe275280285leutyrserlysleuthrvalasplysserargtrpglnglnglyasn290295300valphesercysservalmethisglualaleuhisasnhistyrthr305310315320glnlysserleuserleuserproglylys325330<210>2<211>326<212>prt<213>智人<400>2alaserthrlysglyproservalpheproleualaprocysserarg151015serthrsergluserthralaalaleuglycysleuvallysasptyr202530pheprogluprovalthrvalsertrpasnserglyalaleuthrser354045glyvalhisthrpheproalavalleuglnserserglyleutyrser505560leuserservalvalthrvalproserserasnpheglythrglnthr65707580tyrthrcysasnvalasphislysproserasnthrlysvalasplys859095thrvalgluarglyscyscysvalglucysproprocysproalapro100105110provalalaglyproservalpheleupheproprolysprolysasp115120125thrleumetileserargthrprogluvalthrcysvalvalvalasp130135140valserhisgluaspprogluvalglnpheasntrptyrvalaspgly145150155160valgluvalhisasnalalysthrlysproargglugluglnpheasn165170175serthrpheargvalvalservalleuthrvalvalhisglnasptrp180185190leuasnglylysglutyrlyscyslysvalserasnlysglyleupro195200205alaproileglulysthrileserlysthrlysglyglnproargglu210215220proglnvaltyrthrleuproproserarggluglumetthrlysasn225230235240glnvalserleuthrcysleuvallysglyphetyrproseraspile245250255servalglutrpgluserasnglyglnprogluasnasntyrlysthr260265270thrproprometleuaspseraspglyserphepheleutyrserlys275280285leuthrvalasplysserargtrpglnglnglyasnvalphesercys290295300servalmethisglualaleuhisasnhistyrthrglnlysserleu305310315320serleuserproglylys325<210>3<211>327<212>prt<213>智人<400>3alaserthrlysglyproservalpheproleualaprocysserarg151015serthrsergluserthralaalaleuglycysleuvallysasptyr202530pheprogluprovalthrvalsertrpasnserglyalaleuthrser354045glyvalhisthrpheproalavalleuglnserserglyleutyrser505560leuserservalvalthrvalproserserserleuglythrlysthr65707580tyrthrcysasnvalasphislysproserasnthrlysvalasplys859095argvalgluserlystyrglyproprocysprosercysproalapro100105110glupheleuglyglyproservalpheleupheproprolysprolys115120125aspthrleumetileserargthrprogluvalthrcysvalvalval130135140aspvalserglngluaspprogluvalglnpheasntrptyrvalasp145150155160glyvalgluvalhisasnalalysthrlysproargglugluglnphe165170175asnserthrtyrargvalvalservalleuthrvalleuhisglnasp180185190trpleuasnglylysglutyrlyscyslysvalserasnlysglyleu195200205proserserileglulysthrileserlysalalysglyglnproarg210215220gluproglnvaltyrthrleuproproserglngluglumetthrlys225230235240asnglnvalserleuthrcysleuvallysglyphetyrproserasp245250255ilealavalglutrpgluserasnglyglnprogluasnasntyrlys260265270thrthrproprovalleuaspseraspglyserphepheleutyrser275280285argleuthrvalasplysserargtrpglngluglyasnvalpheser290295300cysservalmethisglualaleuhisasnhistyrthrglnlysser305310315320leuserleuserleuglylys325<210>4<211>455<212>prt<213>人工序列<220><223>egfr/cmet抗体的hc1<400>4glnvalglnleuvalgluserglyglyglyvalvalglnproglyarg151015serleuargleusercysalaalaserglyphethrpheserthrtyr202530glymethistrpvalargglnalaproglylysglyleuglutrpval354045alavaliletrpaspaspglysertyrlystyrtyrglyaspserval505560lysglyargphethrileserargaspasnserlysasnthrleutyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alaargaspglyilethrmetvalargglyvalmetlysasptyrphe100105110asptyrtrpglyglnglythrleuvalthrvalserseralaserthr115120125lysglyproservalpheproleualaproserserlysserthrser130135140glyglythralaalaleuglycysleuvallysasptyrpheproglu145150155160provalthrvalsertrpasnserglyalaleuthrserglyvalhis165170175thrpheproalavalleuglnserserglyleutyrserleuserser180185190valvalthrvalproserserserleuglythrglnthrtyrilecys195200205asnvalasnhislysproserasnthrlysvalasplysargvalglu210215220prolyssercysasplysthrhisthrcysproprocysproalapro225230235240gluleuleuglyglyproservalpheleupheproprolysprolys245250255aspthrleumetileserargthrprogluvalthrcysvalvalval260265270aspvalserhisgluaspprogluvallyspheasntrptyrvalasp275280285glyvalgluvalhisasnalalysthrlysproargglugluglntyr290295300asnserthrtyrargvalvalservalleuthrvalleuhisglnasp305310315320trpleuasnglylysglutyrlyscyslysvalserasnlysalaleu325330335proalaproileglulysthrileserlysalalysglyglnproarg340345350gluproglnvaltyrthrleuproproserarggluglumetthrlys355360365asnglnvalserleuthrcysleuvallysglyphetyrproserasp370375380ilealavalglutrpgluserasnglyglnprogluasnasntyrlys385390395400thrthrproprovalleuaspseraspglyserpheleuleutyrser405410415lysleuthrvalasplysserargtrpglnglnglyasnvalpheser420425430cysservalmethisglualaleuhisasnhistyrthrglnlysser435440445leuserleuserproglylys450455<210>5<211>214<212>prt<213>人工序列<220><223>egfr/cmet抗体的lc1<400>5alaileglnleuthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysargalaserglnaspileserserala202530leuvaltrptyrglnglnlysproglylysalaprolysleuleuile354045tyraspalaserserleugluserglyvalproserargphesergly505560sergluserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglnglnpheasnsertyrproleu859095thrpheglyglyglythrlysvalgluilelysargthrvalalaala100105110proservalpheilepheproproseraspgluglnleulyssergly115120125thralaservalvalcysleuleuasnasnphetyrproarggluala130135140lysvalglntrplysvalaspasnalaleuglnserglyasnsergln145150155160gluservalthrgluglnaspserlysaspserthrtyrserleuser165170175serthrleuthrleuserlysalaasptyrglulyshislysvaltyr180185190alacysgluvalthrhisglnglyleuserserprovalthrlysser195200205pheasnargglyglucys210<210>6<211>449<212>prt<213>人工序列<220><223>egfr/cmet抗体的hc2<400>6glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercysgluthrserglytyrthrphethrsertyr202530glyilesertrpvalargglnalaproglyhisglyleuglutrpmet354045glytrpileseralatyrasnglytyrthrasntyralaglnlysleu505560glnglyargvalthrmetthrthraspthrserthrserthralatyr65707580metgluleuargserleuargseraspaspthralavaltyrtyrcys859095alaargaspleuargglythrasntyrpheasptyrtrpglyglngly100105110thrleuvalthrvalserseralaserthrlysglyproservalphe115120125proleualaproserserlysserthrserglyglythralaalaleu130135140glycysleuvallysasptyrpheprogluprovalthrvalsertrp145150155160asnserglyalaleuthrserglyvalhisthrpheproalavalleu165170175glnserserglyleutyrserleuserservalvalthrvalproser180185190serserleuglythrglnthrtyrilecysasnvalasnhislyspro195200205serasnthrlysvalasplysargvalgluprolyssercysasplys210215220thrhisthrcysproprocysproalaprogluleuleuglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserhisgluasp260265270progluvallyspheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglntyrasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysalaleuproalaproileglulys325330335thrileserlysalalysglyglnproarggluproglnvaltyrthr340345350leuproproserarggluglumetthrlysasnglnvalserleuthr355360365cysleuvallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleutyrserargleuthrvalasplys405410415serargtrpglnglnglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserprogly435440445lys<210>7<211>214<212>prt<213>人工序列<220><223>egfr/cmet抗体的lc2<400>7aspileglnmetthrglnserproserservalseralaservalgly151015aspargvalthrilethrcysargalaserglnglyileserasntrp202530leualatrppheglnhislysproglylysalaprolysleuleuile354045tyralaalaserserleuleuserglyvalproserargphesergly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglnglnalaasnserpheproile859095thrpheglyglnglythrargleugluilelysargthrvalalaala100105110proservalpheilepheproproseraspgluglnleulyssergly115120125thralaservalvalcysleuleuasnasnphetyrproarggluala130135140lysvalglntrplysvalaspasnalaleuglnserglyasnsergln145150155160gluservalthrgluglnaspserlysaspserthrtyrserleuser165170175serthrleuthrleuserlysalaasptyrglulyshislysvaltyr180185190alacysgluvalthrhisglnglyleuserserprovalthrlysser195200205pheasnargglyglucys210当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1