脂肽构建块和合成病毒样颗粒
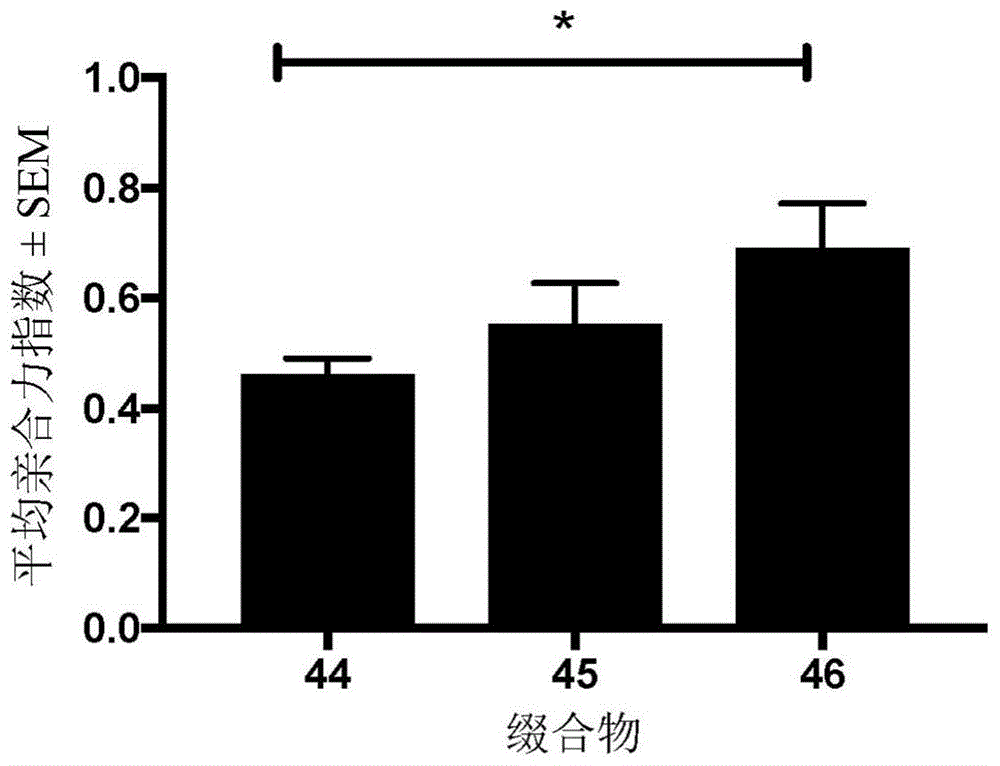
本发明涉及脂肽构建块、包括与抗原偶联的所述脂肽构建块的缀合物、此类缀合物的束、包括至少一个缀合物的束的合成病毒样颗粒(svlp)以及包括所述缀合物的药物组合物。本发明进一步涉及所述缀合物、缀合物的束、所述svlp和所述药物组合物,其用作药物、用作疫苗并且用于预防或治疗优选地选自感染性疾病、过敏症和癌症的疾病的方法并且通常用于有效地诱导抗原特异性免疫应答。
背景技术:
:合成病毒样颗粒(svlp)最近引起了广泛的关注,尤其是使用与抗原缀合并自发地自组装成20-30nm的高度免疫原性纳米颗粒的合成脂肽构建块并且包括60-80个左右的拷贝的所述脂肽构建块的基于svlp的疫苗候选物。由于所述抗原分别在纳米颗粒和svlp的整个外表面上展示,因此诱导了针对抗原的强免疫应答,尤其是b细胞应答。重要的是,svlp不含有遗传信息并且不能在细胞中复制。通常,所述脂肽构建块包括卷曲螺旋肽序列以及t辅助细胞表位(a,ghasparian和johna.robinson,于...中,编辑:...;a.ghasparian等人,《化学生物化学(chembiochem)》2011,12,100-109;t.riedel等人,《化学生物化学》2011,12,2829;r.sharma等人,《公共科学图书馆:综合(plosone)》2012,7,e43248;wo2008/068017;wo2015/082501)。卷曲螺旋设计是本领域的技术人员已知的并且已经过评审(woolfson,d.n.,《蛋白质化学进展(adv.prot.chem.)》,2005,70,79-112;parry,d.a.d.等人,《蛋白质化学进展》,2005,70)。最近已经报道了经特殊工程化的svlp和其作为疫苗的用途,并且描述了一种含有已知可形成三聚体平行螺旋状束的卷曲螺旋(iekkiea)4的脂肽构建块,所述三聚体平行螺旋状束与在疟原虫镰状疟原虫(plasmodiumfalciparum)的环子孢子(cs)蛋白中标识的混杂cd4+t辅助表位(iekkiakmekassvfnvvns)稠合(a.ghasparian等人,《化学生物化学》2011,12,100-109)。t-辅助表位(利用两个cys-ala取代)对应于cs蛋白的残基379-398并且通过小鼠和人类t细胞与多种不同mhcii类mhc分子的缔合来识别(j.kilgus等人,《免疫学杂志(j.lmmunol.)》1991,146,307;f.sinigaglia等人,《自然(nature)》1988,336,778)。所述描述的脂肽构建块是通过在c端处添加kkkc以允许b细胞表位通过半胱氨酸巯基缀合并且通过在n端处添加包括与磷脂酰乙醇胺有关的磷脂的脂质部分或pam2cys或pam3cys部分完成的(a.ghasparian等人,《化学生物化学》2011,12,100-109)。pam3cys部分,即三棕榈酰基-s-甘油半胱氨酸(n-棕榈酰基-s-(2,3-双-(o-棕榈酰基氧基)-丙基)-半胱氨酰-)和pam2cys部分,即二棕榈酰基-s-甘油半胱氨酸(2,3-双-(o-棕榈酰基氧基)-丙基)-半胱氨酰-)是本领域的技术人员已知的并且已在以下中进行了充分描述(ghielmetti,m.等人,《免疫生物学(immunobiology)》,2005,210,211-215;reutter,f.等人,《肽研究杂志(j.pept.res.)》,2005,65,375-383;buwitt-beckmann,u.等人,《欧洲免疫学杂志(eur.j.immunol.)》,2005,35,1-8)。尽管最近分别在脂肽构建块和svlp,尤其是基于svlp的疫苗候选物的开发方面取得了进步,但是分别仍需要另外的且甚至更有效的脂肽构建块和svlp,具体地以进一步增强诱导的免疫应答的质量。技术实现要素:现在惊讶地发现,包括具有位于2-丙基碳原子处的(r)配置的pam2cys或pam3cys部分并且进一步包括呈卷曲螺旋肽链段形式的序列iekkie-x0的几个单元的脂肽构建块示出针对与本发明的脂肽构建块连接并且分别由本发明的缀合物或svlp包括的抗原生成的抗体的亲合力增加,其中优选地x0为gly、ala或ser,最优选地为ser。因此,在第一方面,本发明提供了一种脂肽构建块,所述脂肽构建块由以下组成:(i)肽部分,所述肽部分包括卷曲螺旋肽链段,其中所述卷曲螺旋肽链段包括3个到8个重复单元,并且其中所述重复单元由序列iekkie-x0(seqidno:58)组成,其中x0表示氨基酸,并且其中优选地所述重复单元由选自iekkieg(seqidno:59)、iekkiea(seqidno:12)或iekkies(seqidno:13)的序列组成,并且其中进一步优选地所述重复单元由序列iekkies(seqidno:13)组成;(ii)脂质部分,所述脂质部分包括式lm-i或优选地由式lm-i组成其中r1和r2独立地为c11-15烷基,其中优选地r1和r2独立地为-c11h23、-c13h27或-c15h31,并且其中进一步优选地r1和r2为-c15h31;并且其中r3为氢或-c(o)c11-15烷基,并且其中优选地r3为h或-c(o)c15h31;并且其中所述脂质部分与所述肽部分连接,其中式lm-i中的波浪线指示与所述肽部分的连接部位,并且其中优选地所述脂质部分与所述肽部分的n端连接。在另外的方面,本发明提供了一种缀合物,所述缀合物包括(a)本发明的脂肽构建块和(b)抗原,其中所述抗原直接或通过接头与所述脂肽构建块连接。在另外的方面,本发明提供了一种缀合物,所述缀合物包括(a)本发明的脂肽构建块和(b)抗原,其中所述抗原直接或通过接头与所述脂肽构建块连接。在另一方面,本发明提供了一种缀合物的束,所述束包括本发明缀合物中的2个、3个、4个、5个、6个或7个,优选地2个、3个、4个或5个,更优选地3个。在另一方面,本发明提供了一种合成病毒样颗粒,所述合成病毒样颗粒包括至少一个本发明的缀合物的束。在另一方面,本发明提供了一种药物组合物,所述药物组合物包括免疫有效量的本发明的缀合物或本发明的合成病毒样颗粒连同药学上可接受的稀释剂、载体或赋形剂,其中优选地所述药物组合物是疫苗。在再次另一方面,本发明提供了用作药物的本发明的缀合物或本发明的合成病毒样颗粒。在再次另一方面,本发明提供了用于在用于预防疾病或用于降低疾病风险的方法中使用的本发明的缀合物或本发明的合成病毒样颗粒,其中进一步优选地所述疾病是感染性疾病、癌症或过敏症,并且再次更优选地其中所述疾病是呼吸道合胞病毒(rsv)感染。在再次另一方面,本发明提供了用于在用于预防疾病或用于降低疾病风险或用于治疗疾病的方法中使用的本发明的缀合物或本发明的合成病毒样颗粒,其中进一步优选地所述疾病是感染性疾病、癌症或过敏症,并且再次更优选地其中所述疾病是呼吸道合胞病毒(rsv)感染。在再次另一方面,本发明提供了用于在用于预防感染性疾病或降低感染性疾病的风险的方法中使用的,优选地用于在用于预防与呼吸道合胞病毒相关联的或由呼吸道合胞病毒引起的感染性疾病或降低感染性疾病的风险的方法中使用的本发明的缀合物或本发明的合成病毒样颗粒。随着此描述的继续,本发明的另外的方面和实施例将变得显而易见。附图说明图1示出了如在实例4中描述的免疫原性研究中确定的缀合物44、45和46的平均亲合力指数。具体实施方式除非另外定义,否则本文中所使用的所有技术术语和科学术语的含义与本发明所属领域的普通技术人员通常所理解的含义相同。在整个说明书和以下权利要求书中,除非上下文另外要求,否则术语“包括(comprise)”和其变体,如“包括(comprises)”和“包括(comprising)”等应被理解为非详尽措词并且意指包含陈述的特征或元素,但不排除任何其它特征或元素。术语“包括”和其变体涵盖术语“由……组成”。如在本说明书和所附权利要求书中所使用的,单数形式“一个(a)”、“一种(an)”和“所述(the)”包含复数指示物,除非上下文另外明确指明。如本文所用,术语“减少”、“抑制”或“降低”包含仅可检测到的减少,但也包含减少到零(减少100%)。如本文所定义的,肽或肽部分是氨基酸的任何肽键连接的链,而不论长度、二级结构和三级结构、亚基的数量或翻译后修饰如何。因此,术语“肽部分”的“肽”应被理解为涵盖术语“多肽”、“蛋白质”、“氨基酸链”、“多肽链”。本发明的肽中包含的氨基酸是蛋白原性氨基酸、非蛋白原性氨基酸和合成氨基酸。肽可以是开放的线性肽链或环状肽并且可以包含至少一个化学修饰,如脂化、糖基化和磷酸化。肽可以通过化学合成、rna翻译和/或重组过程产生。如本文所使用的,术语“环状肽”是指其中氨基酸链通过共价键形成至少一个环结构的肽。本发明的环状肽包括各自通过二硫键形成的环结构:半胱氨酸c4和c25的侧链连接形成第一二硫键,并且半胱氨酸c8和c21的侧链连接形成第二二硫键。如本文所使用的,术语“氨基酸”是指含有官能团胺(-nh2)和羧酸(-cooh)和其两性离子,典型地并且优选地连同对每个氨基酸具有特异性的侧链的有机化合物。术语“氨基酸”典型地并且优选地包含天然存在的氨基酸,如蛋白原氨基酸(通过rna翻译产生)、非蛋白原氨基酸(通过其它代谢机制,例如,翻译后修饰产生)、标准或典型氨基酸(由遗传密码的密码子直接编码)和非标准或非典型氨基酸(不是由遗传密码直接编码)。天然存在的氨基酸包含非真核氨基酸和真核氨基酸。如本文所使用的,术语“氨基酸”还包含:化学合成的非天然氨基酸;α-(α-)、β-(β-)、γ-(γ-)和δ-(δ-)等氨基酸以及其成任何比率的混合物;以及如果适用的话,氨基酸的异构体形式,即其d立体异构体(用小写首字母标记)和l立体异构体(用大小首字母标记)(可替代地通过(r)和(s)命名法寻址)以及其成任何比率,优选地1:1的外消旋比率的混合物。除非特别地提到d配置,否则本发明中的氨基酸优选处于l配置。术语“d立体异构体”、“l立体异构体”、“d氨基酸”或“l氨基酸”是指氨基酸的手性α碳。氨基酸可以包含一个或多个修饰和/或所附连基团,例如用于肽合成的保护基,如boc、fmoc或两者。术语“缺失”在本文中是指氨基酸序列中未被氨基酸占据的位置。在本发明的一个优选实施例中,氨基酸是天然存在的氨基酸,其中所述天然存在的氨基酸处于其l配置、处于其d配置或所述l-配置和d-配置的成任何比率的混合物。在本发明的另外的优选实施例中,氨基酸是天然存在的氨基酸,其中所述天然存在的氨基酸处于其l配置。如本文所使用的,术语“抗原”应是指能够通过抗体结合的分子。抗原可以包括具有一个或多个b细胞表位的肽、蛋白质或表位模拟物,所述一个或多个b细胞表位将用于引发动物体内的抗原特异性体液免疫应答。可替代地,抗原可以包括半抗原或碳水化合物。合适的肽和蛋白质抗原包括多达150个氨基酸并且包含糖肽和糖蛋白。可以选择肽和蛋白质序列以引发例如针对一种或多种感染剂的免疫应答。此类抗原是本领域众所周知的。表位模拟物是模拟天然肽或碳水化合物表位的分子,包含含有一种或多种非天然氨基酸的肽化合物,例如d氨基酸、β氨基酸、γ氨基酸、δ氨基酸或ε氨基酸和表位模拟物领域中已知的其它替代物。优选的是以蛋白质样构象固定的构象约束的拟肽。半抗原是指分子量小于3'000的有机化合物,所述有机化合物自身不会引发体液免疫应答,但是一旦与载体附连就会引发免疫应答。示例性半抗原包含药物、激素、毒素和碳水化合物。如本文所使用的,术语“n端”是指具有游离(-nh2)或经修饰的氨基或胺基的肽的端部。优选的n端修饰是保护n端免于蛋白水解降解的修饰。根据本发明的n端修饰包含但不限于至少一种聚合物、优选地聚乙二醇(peg化)或聚(乳酸)的乙酰化、附连或至少一种氨基酸、优选地至少一种d氨基酸的附连或至少一种化合物,如细胞穿透肽、核酸、氨基甲酸酯(如芴基甲氧基氨基甲酸酯或苄氧基氨基甲酸酯)、醛、肼基烟酸、4-甲酰基苯甲酰胺、甲基、肉豆蔻酰基、异戊二烯基、棕榈酰基、泛素、7-甲氧基香豆素乙酸(mca)、丹酰基、甲酰基、4-二苯基(4-diniphenyl)、焦谷氨酰、尿素、氨基甲酸酯、磺胺、烷基胺、脂肪酸(如棕榈酸)、放射性配体、淬灭剂、荧光素或另一种染料或标记(如生物素)的附连。如本文所使用的,术语“c端”是指具有游离(-cooh)或经修饰的羧基的肽的端部。优选的c端修饰是保护c端免于蛋白水解降解的修饰。根据本发明的c端修饰包含但不限于至少一种氨基酸、优选地至少一种d氨基酸的酰胺化或附连或至少一种化合物,如细胞穿透肽、核酸、聚乙二醇(peg化)、硫醇、酯、醛、磺胺、pna(对硝基苯胺)、amc(7-氨基-4-甲基香豆素)、酰肼、异羟肟酸、氯甲基酮、生物素、放射性配体、淬灭剂、abz或其它染料和标记的附连。在此并且按照一般惯例,肽序列从左边的n端到右边的c端(根据翻译方向)写入。如本文所使用的,术语“卷曲螺旋肽链段”是能够与至少一个其它卷曲螺旋肽链段形成卷曲螺旋(超级螺旋)的肽链的序列。卷曲螺旋是其中各具有自优选地α螺旋状二级结构的至少两个卷曲螺旋肽链段缔合成束的肽结构。本发明的卷曲螺旋肽链段含有多个重复单元,典型地并且优选地彼此连续地连接。卷曲螺旋肽链段的重复单元可以相同或可以不同,例如在重复单元内可以含有至少一个不连续性,如至少一个、优选地恰好1个、2个、3个或4个氨基酸的插入、缺失或交换。在第一方面,本发明提供了一种脂肽构建块,所述脂肽构建块由以下组成:(i)肽部分,所述肽部分包括卷曲螺旋肽链段,其中所述卷曲螺旋肽链段包括3个到8个重复单元,并且其中所述重复单元由序列iekkie-x0(seqidno:58)组成,其中x0表示氨基酸,并且其中优选地所述重复单元由选自iekkieg(seqidno:59)、iekkiea(seqidno:12)或iekkies(seqidno:13)的序列组成,并且其中进一步优选地所述重复单元由序列iekkies(seqidno:13)组成;(ii)脂质部分,所述脂质部分包括式lm-i或优选地由式lm-i组成其中r1和r2独立地为c11-15烷基,其中优选地r1和r2独立地为-c11h23、-c13h27或-c15h31,并且其中进一步优选地r1和r2为-c15h31;并且其中r3为氢或-c(o)c11-15烷基,并且其中优选地r3为h或-c(o)c15h31;并且其中所述脂质部分与所述肽部分连接,其中式lm-i中的波浪线指示与所述肽部分的连接部位,并且其中优选地所述脂质部分与所述肽部分的n端连接。在一个优选实施例中,所述肽部分的所述卷曲螺旋肽链段由3个到8个重复单元组成,包含3个、4个、5个、6个、7个、8个重复单元,更优选地四个重复单元。肽部分中的重复单元的较多数量影响卷曲螺旋的稳定性。在一个优选实施例中,所述肽部分的所述卷曲螺旋肽链段包括4个重复单元或优选地由4个重复单元组成。在一个优选实施例中,所述肽部分的所述卷曲螺旋肽链段由4个重复单元组成。在一个优选实施例中,所述4个重复单元彼此连续地连接。本发明的卷曲螺旋肽链段基于典型重复单元,典型地并且优选地基于形成右旋两亲性α-螺旋物的典型串联七肽重复序列,所述典型串联七肽重复序列然后组装以与左旋卷曲螺旋形成螺旋状束。卷曲螺旋肽链段的重复单元具有拥有一定数量的氨基酸的序列,其中氨基酸的位置传统上被标记为小写字母。例如,在以下中更详细地讨论了设计规则:woolfson,d.n.,《蛋白质化学进展》,2005,70,79-112。在本发明中,卷曲螺旋肽链段的所述重复单元由七个氨基酸组成,其中七个氨基酸位置用字母a、b、c、d、e、f和g表示。在一个优选实施例中,所述七肽基序由序列iekkie-x0(seqidno:58)组成,其中x0表示氨基酸。在一个优选实施例中,所述重复单元由序列iekkie-x0(seqidno:58)组成,其中x0表示氨基酸,条件是所述x0不是脯氨酸。在另一优选实施例中,所述重复单元由序列iekkie-x0(seqidno:58)组成,其中x0表示氨基酸,其中所述氨基酸是天然存在的氨基酸,其中所述天然存在的氨基酸处于其l配置、处于其d配置或成其任何比率的混合物,条件是所述氨基酸不是脯氨酸。在另一优选实施例中,所述重复单元由序列iekkie-x0(seqidno:58)组成,其中x0表示氨基酸,其中所述氨基酸是处于其l配置的天然存在的氨基酸。在一个优选实施例中,所述重复单元由选自iekkieg(seqidno:59)、iekkiea(seqidno:12)或iekkies(seqidno:13)的序列组成。在一个优选实施例中,所述重复单元由选自iekkiea(seqidno:12)或iekkies(seqidno:13)的序列组成。在一个优选实施例中,所述重复单元由序列iekkieg(seqidno:59)组成。在一个优选实施例中,所述重复单元由序列iekkiea(seqidno:12)组成。在一个非常优选的实施例中,所述重复单元由序列iekkies(seqidno:13)组成。在一个优选实施例中,所述卷曲螺旋肽链段包括以下或优选地由选自以下的序列组成:(iekkieg)4(seqidno:60)、(iekkiea)4(seqidno:61)或(iekkies)4(seqidno:62)。在一个优选实施例中,所述卷曲螺旋肽链段由选自以下的序列组成:(iekkieg)4(seqidno:60)、(iekkiea)4(seqidno:61)或(iekkies)4(seqidno:62)。在一个优选实施例中,所述卷曲螺旋肽链段包括以下或优选地由以下组成:序列(iekkieg)4(seqidno:60)。在一个优选实施例中,所述卷曲螺旋肽链段包括以下或由选自以下的序列组成:序列(iekkieg)4(seqidno:60)。在一个优选实施例中,所述卷曲螺旋肽链段包括以下或优选地由以下组成:序列(iekkiea)4(seqidno:61)。在一个优选实施例中,所述卷曲螺旋肽链段由以下组成:序列(iekkiea)4(seqidno:61)。在一个非常优选的实施例中,所述卷曲螺旋肽链段包括以下或优选地由以下组成:序列(iekkies)4(seqidno:62)。在一个非常优选的实施例中,所述卷曲螺旋肽链段由以下组成:序列(iekkies)4(seqidno:62)。在一个优选实施例中,所述r1和r2独立地为-c11h23、-c13h27或-c15h31。在一个非常优选的实施例中,所述r1和r2为-c15h31。在一个优选实施例中,所述r3为h或-c(o)c15h31。在一个优选实施例中,所述r1和r2独立地为-c11h23、-c13h27或-c15h31,并且r3为氢或-c(o)c11-15烷基。在一个非常优选的实施例中,所述r1和r2为-c15h31,并且r3为氢或-c(o)c11-15烷基。在一个优选实施例中,所述r1和r2独立地为-c11h23、-c13h27或-c15h31,并且r3为h或-c(o)c15h31。在一个非常优选的实施例中,所述r1和r2为-c15h31,并且r3为h或-c(o)c15h31。在一个优选实施例中,所述脂质部分与所述肽部分的n端连接。这方便地允许可以在通过固相肽合成组装所述肽部分的肽链之后,在树脂上执行所述连接。所述脂质部分与所述肽部分的c端的连接也涵盖在本发明内并且可能的是使用本领域的技术人员已知的连接化学。在一个优选实施例中,所述肽部分的长度为12个到200个氨基酸,更优选地21个到120个氨基酸,再次更优选地21个到80个氨基酸,再次更优选地21个到70个氨基酸,再次更优选地21个到60个氨基酸,再次更优选地21个到50个氨基酸,再次更优选地所述肽部分的长度为28个到48个氨基酸。优选肽部分是非人序列,以避免当应用于人类疫苗接种时自体免疫病症的风险。优选脂质部分是二棕榈酰基-s-甘油半胱氨酰(pam2cys)或三棕榈酰基-s-甘油半胱氨酸(pam3cys),其具有位于手性2-丙基碳原子处的r配置以及半胱氨酰部分的手性碳的r配置两者。在一个优选实施例中,脂质部分与肽部分直接或通过偶联部分连接。优选地,脂质部分在一个末端,即n端或c端,优选地n端处或附近与肽部分连接。在一个优选实施例中,脂质部分与肽部分的第一、第二、第三、第四或第五氨基酸连接,所述氨基酸是根据肽部分的n端或c端计算的。脂质部分可以直接或通过偶联部分与肽部分的氨基酸之一的主链或侧链连接,优选地所述氨基酸在末端附近,更优选地所述氨基酸是肽部分的第一、第二、第三、第四或第五氨基酸。脂质部分直接或通过偶联部分与肽部分附连。如果肽部分和脂质部分直接连接,则这优选地通过脂质部分羰基官能和肽部分的氨基官能,例如n端氨基官能之间的酰胺键来完成。对于本领域的技术人员显而易见的是,存在多种合适的偶联部分和偶联策略,包含但不限于基于二羧酸衍生物的接头、含有一个或多个乙二醇单元、氨基酸残基(包含α、β、γ、ω氨基酸)或糖(碳水化合物)单元或含有杂环的接头。在一个优选实施例中,所述脂质部分包括式lm-i*,优选地由式lm-i*组成其中r3为氢或-c(o)c11-15烷基,优选地h或-c(o)c15h31;其中优选地所述脂质部分与所述肽部分的n端连接。在一个优选实施例中,所述脂质部分由式lm-i*组成,其中r3为氢或-c(o)c11-15烷基。在一个优选实施例中,所述脂质部分包括式lm-i*,优选地由式lm-i*组成,其中r3为h或-c(o)c15h31。在一个优选实施例中,所述脂质部分包括式lm-i*,优选地由式lm-i*组成,其中r3为h或-c(o)c15h31,并且其中所述脂质部分与所述肽部分的n端连接。在一个优选实施例中,所述脂质部分由式lm-i*组成其中r3为h或-c(o)c15h31,并且其中优选地所述脂质部分与所述肽部分的n端连接。在一个非常优选的实施例中,所述脂质部分包括以下,优选地由以下组成:式lm-i*1或lm-i*2。在一个非常优选的实施例中,所述脂质部分由式lm-i*1或lm-i*2组成。在一个非常优选的实施例中,所述脂质部分由式lm-i*1组成。在一个非常优选的实施例中,所述脂质部分由式lm-i*2组成。因此本发明的非常优选的脂质部分是(r,r)-pam3cyslm-i*2,即三棕榈酰基-s-甘油半胱氨酸(n-棕榈酰基-s-(2,3-双-(o-棕榈酰基氧基)-(2r)-丙基)-(r)-半胱氨酰-),和(r,r)-pam2cyslm-i*1,即二棕榈酰基-s-甘油半胱氨酸(2,3-双-(o-棕榈酰基氧基)-(2r)-丙基)-(r)-半胱氨酰-)。因此,在另外的非常优选的实施例中,所述脂质部分是n-α-棕榈酰基-s-[2,3-双(棕榈酰基氧基)-(2r)-丙基]-(r)-半胱氨酸或s-[2,3-双(棕榈酰基氧基)-(2r)-丙基]-(r)-半胱氨酸,因此lm-i*1。在另外的优选实施例中,所述肽部分包括(i)n端氨基酸序列,其中所述n端氨基酸序列包括以下或优选地由以下组成:成纤维细胞刺激脂肽fsl-1(s-(2,3-双棕榈酰基氧基丙基)-或pam2-cys-gly-asp-pro-lys-his-pro-lys-ser-phe;seqidno:7)、fsl-2(s-(2,3-双棕榈酰基氧基丙基)-或pam2-cys-gly-asp-pro-lys-his-pro-lys-ser-arg;seqidno:8)、fsl-3(s-(2,3-双硬脂酰氧基丙基)-cys-gly-asp-pro-lys-his-pro-lys-ser-phe;seqidno:9)、发酵支原体(mycoplasmafermentans)衍生的肽malp-2(s-(2,3-双棕榈酰基氧基丙基)-或pam2-cys-gly-asn-asn-asp-glu-ser-asn-ile-ser-phe-lys-glu-lys;seqidno:10)或gg和/或gx,其中x为asx或ser;和/或(ii)c端氨基酸序列,其中所述c端氨基酸序列包括通过酶作为切割部位识别的序列,或优选地由所述序列组成;其中优选地所述c端氨基酸序列包括kkkca(seqidno:11)或优选地由kkkca组成,或其中优选地所述c端氨基酸序列是连续5个氨基酸的氨基酸序列。在一个优选实施例中,所述脂质部分和所述肽部分直接连接。在一个优选实施例中,所述脂质部分和所述肽部分通过偶联部分连接。在一个优选实施例中,所述脂质部分和所述肽部分通过偶联部分连接,其中所述偶联部分是由2-15个氨基酸组成的氨基酸接头。本文的实例包含由fsl-1、fsl-2、fsl-3、pam2或malp-2部分包括的氨基酸接头序列。在一个优选实施例中,所述脂质部分和所述肽部分通过偶联部分连接,其中所述偶联部分是由2-10个氨基酸组成的氨基酸接头。在一个优选实施例中,所述脂质部分和所述肽部分通过偶联部分连接,其中所述偶联部分是由2-5个氨基酸组成的氨基酸接头。在一个优选实施例中,所述脂质部分和所述肽部分通过偶联部分连接,其中所述偶联部分是氨基酸接头,其中所述氨基酸接头是gly-gly部分。在一个优选实施例中,所述脂质部分和所述肽部分通过偶联部分连接,其中所述偶联部分是gly-gly部分。在一个优选实施例中,所述脂质部分和所述肽部分的所述直接连接是通过所述脂质部分的羰基官能与所述肽部分的氨基官能之间的酰胺键。在一个优选实施例中,所述脂质部分和所述肽部分通过所述偶联部分的所述连接是通过所述脂质部分的羰基官能与所述偶联部分的氨基官能之间的酰胺键。在一个优选实施例中,所述脂质部分和所述肽部分通过所述偶联部分的所述连接是通过所述脂质部分的羰基官能与所述偶联部分的氨基官能之间的酰胺键,其中所述偶联部分是优选地由2-15个氨基酸、优选地2-10个氨基酸组成的氨基氨基酸接头,并且其中所述氨基官能是所述偶联部分的n端氨基官能。在一个优选实施例中,所述脂质部分和所述肽部分通过所述偶联部分的所述连接是通过所述脂质部分的羰基官能与所述偶联部分的氨基官能之间的酰胺键,其中所述偶联部分是优选地由2-5个氨基酸组成的氨基酸接头,并且其中所述氨基官能是所述偶联部分的n端氨基官能。在一个优选实施例中,所述脂质部分和所述肽部分的所述直接连接是通过所述脂质部分的羰基官能与所述肽部分的氨基官能之间的酰胺键,其中所述氨基官能是所述肽部分的n端氨基官能。在一个优选实施例中,两个gly残基作为脂质部分,优选地本发明的所述(r,r)-pam2cys部分lm-i*1与卷曲螺旋七肽重复序列,典型地并且优选地包括序列iekkies(seqidno:13)、优选地由序列iekkies组成的卷曲螺旋肽链段的开始之间的接头而被包含。氨基酸接头以及优选地由两个氨基酸组成的短氨基酸接头、更优选地甘氨酸的引入在肽合成期间语序在每个氨基酸偶联之后,可以用乙酸酐执行加盖步骤。这的实际优点在于,在完成肽组装并且在脂质部分,优选地由式lm-i*1[(r,r)-pam2cys部分]或式lm-i*2[(r,r)-pam3cys部分]组成的脂质部分与游离n端偶联之后,肽的hplc保留时间通过脂化显著更改,由此极大地促进本发明的期望的脂肽构建块的hplc纯化。在一个优选实施例中,所述肽部分进一步包括t辅助细胞表位。在一个优选实施例中,所述肽部分进一步包括t辅助细胞表位,其中所述t辅助细胞表位包括选自由以下组成的组的序列或优选地由所述序列组成:(i)seqidno:6、seqidno:63到seqidno:87;以及(ii)seqidno:6、seqidno:63到seqidno:87,其中一个、两个或三个氨基酸由其它氨基酸交换或缺失。在一个优选实施例中,所述肽部分进一步包括t辅助细胞表位,其中所述t辅助细胞表位由选自由以下组成的组的序列组成(i)seqidno:6、seqidno:63到seqidno:87;以及(ii)seqidno:6、seqidno:63到seqidno:87,其中一个、两个或三个氨基酸由其它氨基酸交换或缺失。在一个优选实施例中,所述肽部分进一步包括t辅助细胞表位,其中所述t辅助细胞表位包括选自由以下组成的组的序列:seqidno:6、seqidno:63到seqidno:87。在一个优选实施例中,所述t辅助细胞表位由选自由以下组成的组的序列组成:seqidno:6、seqidno:63到seqidno:87。在一个实施例中,所述肽部分进一步包括包含一个或多个t辅助细胞表位的氨基酸序列和/或促进脂肽构建块在水中的溶解度的成串的极性残基。合适的t-辅助细胞表位是本领域的技术人员已知的,并且在以下进行了描述:例如weber等人,《高级药物递送综述(advanceddrugdeliveryreviews)》,2009,61:11,965-976;caro-aguilar等人,《感染与免疫(infect.immun.)》,2002,70:7,3479-3492;mishra等人,《免疫学(immunology)》,1993,79:3,362-367;kobayashi等人,《癌症研究(cancerresearch)》,2000,60:18,5228-523;fraser等人,《疫苗(vaccine)》,2014,32:24,2896-2903;grabowska等人,《国际癌症期刊(int.j.cancer)》,2015,136:1,212–224和wo1998/023635a1。肽部分中包含的更优选的t辅助细胞表位是wo2015/082501中列示的那些,如tt830-843、tt1064-1079、tt1084-1099、tt947-968、tt1174-1189、dtd271-290、dtd321-340、dtd331-350、dtd351-370、dtd411-430、dtd431-450、tt632-651、ctmomp36-60、trat1、trat2、trat3、hbcag50-69、hbsag19-33、ha307-319、ma17-31、mvf258-277、mvf288-302、cs.t3、smth、padre1和padre2以及其中一个、两个或三个氨基酸被插入或由其它氨基酸替代或缺失的其变体。可以掺入到所述肽部分中的优选t辅助表位是选自以下表1中列示的组的任何一种以及其中一个、两个或三个氨基酸由其它氨基酸替代或缺失的其变体。表1:因此,在另外优选的实施例中,所述t辅助细胞表位包括选自由以下组成的组的序列或优选由所述序列组成:(i)seqidno:1到seqidno:26以及(ii)seqidno:1到seqidno:26,其中一个、两个或三个氨基酸由其它氨基酸交换或缺失。在一个优选实施例中,所述肽部分进一步包括t辅助细胞表位,其中所述t辅助细胞表位包括seqidno:6的氨基酸序列或优选地由所述氨基酸序列组成。在一个优选实施例中,所述肽进一步包括t辅助细胞表位,其中所述t辅助细胞表位由seqidno:6的氨基酸序列组成。在一个优选实施例中,所述t辅助细胞表位由seqidno:6的序列组成。在另外的非常优选的实施例中,所述肽部分包括以下或优选地由以下组成:(seqidno:88):ggiekkiesiekkiesiekkiesiekkiesiekkiakmekassvfnvvnskkkc。在另外的非常优选的实施例中,所述肽部分由(seqidno:88)组成。在另外的非常优选的实施例中,所述脂肽构建块具有式lbb-2或lbb-3,优选地具有lbb-2在另外的非常优选的实施例中,所述脂肽构建块具有式lbb-2。在另外的非常优选的实施例中,所述脂肽构建块具有式lbb-3。在另外的方面,本发明提供了一种脂肽构建块,所述脂肽构建块由以下组成:(i)肽部分,所述肽部分包括卷曲螺旋肽链段,并且其中所述卷曲螺旋肽链段包括序列(seqidno:62)或优选地由所述序列组成;(ii)脂质部分,所述脂质部分包括式lm-i或优选地由式lm-i组成其中r1和r2独立地为c11-15烷基,其中优选地r1和r2独立地为-c11h23、-c13h27或-c15h31,并且其中进一步优选地r1和r2为-c15h31;并且其中r3为氢或-c(o)c11-15烷基,并且其中优选地r3为h或-c(o)c15h31;并且其中所述脂质部分与所述肽部分连接,其中式lm-i中的波浪线指示与所述肽部分的连接部位,并且其中优选地所述脂质部分与所述肽部分的n端连接。在另外的方面,本发明提供了一种缀合物,所述缀合物包括(a)本发明的脂肽构建块和(b)抗原,其中所述抗原直接或通过接头与所述脂肽构建块连接。一种或多种抗原可以例如通过肽部分的氨基酸的侧链中的一个或多个侧链或通过肽部分的链末端与肽部分缀合。抗原典型地在肽部分的侧链或末端之一中携带适用于与官能团缀合的官能团。为了引发基于抗原特异性抗体的免疫应答,优选的是通过b细胞受体或半抗原识别的抗原。可以使用多种偶联或缀合程序来将抗原与肽部分附连,这对于本领域的技术人员是众所周知的。因此,lbb的肽部分中的氨基酸的侧链中的游离氨基可以与抗原中的反应性酯偶联(例如,由羧酸制备的n-羟基琥珀酰亚胺酯);肽部分中的硫醇可以与抗原中的马来酰亚胺基偶联;可以将叠氮掺入到肽部分中的氨基酸残基的侧链中,并且使用铜催化的环加成反应将其与含有乙炔基的抗原偶联;并且肽中的其它亲核体(例如,肼基、羟氨基、vic-氨基硫醇基团)可以与抗原中的亲电体(例如,醛、酮、活性酯)偶联。显然,原则上可能的是反转肽链和抗原中的两个反应性基团的位置,以实现选择性偶联。在另外的优选实施例中,所述抗原选自肽、蛋白质、表位模拟物、碳水化合物或半抗原。在另外的优选实施例中,所述抗原衍生自选自由以下组成的组的源:(a)病毒;(b)细菌;(c)寄生虫,优选地寄生性原生虫病;(d)肿瘤;(e)自身分子;(f)非肽半抗原分子;(g)过敏原以及(h)激素。在另一优选实施例中,所述抗原选自由以下组成的组:(1)适合于诱导对癌细胞的免疫应答的抗原;(2)适合于诱导对感染性疾病的免疫应答的抗原;(3)适合于诱导对过敏原的免疫应答的抗原;(4)适合于诱导对自身分子的应答的抗原;以及(5)适合于诱导对药物或激素的应答的抗原。在另一优选实施例中,所述抗原是肿瘤抗原、自身抗原、病原体的多肽、过敏原或半抗原。在另一优选实施例中,所述抗原是肿瘤抗原、自身抗原、病原体的多肽、过敏原或半抗原。在另一优选实施例中,所述抗原衍生自疟原虫镰状疟原虫的环子孢子蛋白(cs)。在另外的优选实施例中,所述抗原是抗原43。在另一优选实施例中,所述抗原是如wo2015/082501中所述的富含脯氨酸的肽抗原,所述文献通过引用以其整体并入本文。在另一优选实施例中,所述抗原包括以下、优选地由以下组成:如wo2015/082501中定义的seqidno:27到112的肽或如wo2015/082501中定义的seqidno:27到112的肽,其中一个、两个或三个氨基酸被其它氨基酸替代。在另一优选实施例中,所述抗原包括(i)如wo2015/082501中定义的seqidno:27到112的肽或(ii)如wo2015/082501中定义的seqidno:27到112的肽,其中一个、两个或三个氨基酸被其它氨基酸替代,其中所述抗原由8-80个氨基酸组成,并且其中优选地所述抗原由8-60个氨基酸组成,并且其中进一步优选地所述抗原由8-50个氨基酸组成。在另一优选实施例中,所述抗原包括(i)如wo2015/082501中定义的seqidno:27到112的肽或(ii)如wo2015/082501中定义的seqidno:27到112的肽,其中一个、两个或三个氨基酸被其它氨基酸替代,其中所述抗原由8-80个氨基酸组成,并且其中优选地所述抗原由8-60个氨基酸组成,并且其中进一步优选地所述抗原由8-50个氨基酸组成。在另一优选实施例中,所述抗原包括(i)如wo2015/082501中定义的seqidno:27到83的肽或(ii)如wo2015/082501中定义的seqidno:27到83的肽,其中一个、两个或三个氨基酸被其它氨基酸替代,其中所述抗原由8-80个氨基酸组成,并且其中优选地所述抗原由8-60个氨基酸组成,并且其中进一步优选地所述抗原由8-50个氨基酸组成。在另一优选的实施例中,所述抗原包括(i)如wo2015/082501中定义的seqidno:27到36、38到48、50到55、61到79、81到83的肽,或(ii)如wo2015/082501中定义的seqidno:27到36、38到48、50到55、61到79、81到83的肽,其中一个,两个或三个氨基酸被其它氨基酸替代,其中所述抗原由8-80个氨基酸组成,并且其中优选地所述抗原由8-60个氨基酸组成,并且其中进一步优选地所述抗原由8-50个氨基酸组成。在另一优选实施例中,所述抗原是包括氨基酸序列(i)的环状肽,其中所述氨基酸序列(i)包括以下氨基酸序列,优选地由以下氨基酸序列组成:x1-x2-x3-c4-x5-x6-x7-c8-x9-x10-x11-p12-i13-t14-n15-d16-q17-k18-k19-l20-c21-x22-x23-x24-c25-x26-x27-x28-x29-x30(seqidno:1),其中x1、x2、x3、x5、x6、x7、x9、x10、x11、x22、x23、x24、x26、x27、x28和x29彼此独立地为氨基酸;c4、c8、c21和c25彼此独立地为半胱氨酸;p12为脯氨酸;i13为异亮氨酸;t14为苏氨酸;n15为天冬酰胺;d16为天冬氨酸;q17为谷氨酰胺;k18和k19彼此独立地为赖氨酸;l20为亮氨酸;并且x30为氨基酸或缺失,其中所述半胱氨酸c4和c25形成第一二硫键,并且所述半胱氨酸c8和c21形成第二二硫键。在本发明中当将本发明脂质构建块与本发明缀合物偶联时或进一步地并且具体地当掺入在本发明合成病毒样颗粒(svlp)中时使用的环状肽能够引发对rsv病毒的中和与保护性抗体,通常在不用施用佐剂的情况下。人呼吸道合胞病毒(rsv)是病毒家族肺泡病毒科(pneumoviridae)的成员以及会使肺部和呼吸通道感染的高度传染性季节性呼吸病毒。其可以通过受感染者打喷嚏或咳嗽到空气中的液滴传播。特别是,rsv是下呼吸道感染和上呼吸道感染以及医院就诊的主要原因,尤其是在婴儿和儿童期间,但也会影响老年成人和免疫受损者。由于与rsv感染所引起的住院相关联的高昂保健费用,因此需要预防rsv感染。一种方法是通过rsv疫苗进行主动免疫。已经进行了以生成此类疫苗的几种不同尝试(wo2006/034292、us2010/0239617、wo2010/149745、wo2014/144756、wo2012/048115),但是迄今为止尚未批准任何候选物作为用于预防rsv感染的安全且有效疫苗。在所使用的环状肽中,半胱氨酸c4和c25与半胱氨酸c8和c21之间的特定二硫桥通过“螺旋状发夹”或“螺旋-转角-螺旋”构象使所述肽稳定。值得注意的是,已经发现没有或仅有一个二硫桥或在不同位置处具有二硫桥的肽未能引发中和抗体。此外,所使用的环状肽被视为是耐受良好的疫苗。掺入svlp中的环状肽所引发的免疫应答在生命rsv感染之后未激活vaerd。使用自动固相肽合成产生了所述环状肽,其中通过氧化重折叠获得了半胱氨酸c4和c25与半胱氨酸c8和c21之间的所述二硫键,从而产生了有益的空间构象。在另一优选实施例中,所述环状肽的长度为至多80个氨基酸,优选地至多60个氨基酸,更优选至多40个氨基酸,再次更优选地至多30个氨基酸。在另一优选实施例中,所述x11选自正亮氨酸、6-羟基-正亮氨酸、正缬氨酸、5-氧代-正亮氨酸、2-氨基庚酸、甲硫氨酸、乙硫氨酸、羟基甲硫氨酸、s-氧甲硫氨酸、甲硫氨酸砜或甲硫氨酸亚砜,其中优选地x11为正亮氨酸。在另一优选实施例中,所述x23选自天冬酰胺、β-羟基天冬酰胺、2,5-二氨基-4-羟基-5-戊酮酸、谷氨酰胺、谷氨酰胺异羟肟酸酯、3-甲基-谷氨酰胺、n-甲基-天冬酰胺、n5-甲基谷氨酰胺、半胱氨酸-s-乙酰胺;丝氨酸、高丝氨酸、别苏氨酸、3,3-二羟基-丙氨酸、2-氨基-5-羟基戊酸、4-羟基-1-苏氨酸、苏氨酸、羟基正缬氨酸、6-羟基-1-正亮氨酸或甘氨酸;其中优选地x23为天冬酰胺、丝氨酸、谷氨酰胺或甘氨酸。在另外的优选实施例中,所述x23为丝氨酸。在另外的优选实施例中,所述x23为谷氨酰胺。在另外的优选实施例中,所述x23为甘氨酸。在另外的优选实施例中,所述x23为天冬酰胺。在另一优选实施例中,所述x24选自天冬酰胺、β-羟基天冬酰胺、2,5-二氨基-4-羟基-5-戊酮酸、谷氨酰胺、谷氨酰胺异羟肟酸酯、3-甲基-谷氨酰胺、n-甲基-天冬酰胺、n5-甲基谷氨酰胺、半胱氨酸-s-乙酰胺;赖氨酸、2,4-二氨基丁酸、2,3-二氨基丙酸、2,8-二氨基辛酸、鸟氨酸、氨基己二酸、硫杂赖氨酸;天冬氨酸、2-氨基-6-氧代薄桃酸、3-甲基-天冬氨酸、1-2-氨基-6-亚甲基-薄桃酸、4-羟基-谷氨基酸、6-羧基赖氨酸、β-羟基天冬氨酸、3,3-二甲基天冬氨酸、2-氨基-丙二酸、谷氨酸、5-o-甲基-谷氨酸、(3r)-3-甲基-1-谷氨酸、(3s)-3-甲基-1-谷氨酸、2s,4r-4-甲基谷氨酸、2-氨基己二酸、丝氨酸、高丝氨酸、别苏氨酸、3,3-二羟基-丙氨酸、2-氨基-5-羟基戊酸、4-羟基-1-苏氨酸、苏氨酸、羟基正缬氨酸、6-羟基-1-正亮氨酸或甘氨酸。在另一优选实施例中,x24选自天冬酰胺、赖氨酸、鸟氨酸、2,4-二氨基丁酸(dab)、谷氨酰胺、甘氨酸或丝氨酸。在另一优选实施例中,x24为甘氨酸、谷氨酰胺或丝氨酸。在另一优选实施例中,x24为丝氨酸。在另一优选实施例中,x24为谷氨酰胺。在另一优选实施例中,x24为甘氨酸。在另一优选实施例中,x11为正亮氨酸,并且x24选自天冬酰胺、赖氨酸、鸟氨酸、2,4-二氨基丁酸(dab)、谷氨酰胺、甘氨酸或丝氨酸。在另一优选实施例中,x11为正亮氨酸,并且x24为丝氨酸。在另一优选实施例中,x11为正亮氨酸,并且x24为谷氨酰胺。在另一优选实施例中,x11为正亮氨酸,并且x24为天冬酰胺。在另一优选实施例中,x11为正亮氨酸,并且x24为天冬氨酸。在另一优选实施例中,x11为正亮氨酸,并且x24为天冬酰胺。在另一优选实施例中,x11为正亮氨酸,并且x24为鸟氨酸。在另一优选实施例中,x11为正亮氨酸,并且x24为2,4-二氨基丁酸。在另一优选实施例中,x11为正亮氨酸,并且x24为赖氨酸。在另一优选实施例中,所述氨基酸序列(i)的c端氨基酸选自丙氨酸、亮氨酸、缬氨酸、正亮氨酸、正缬氨酸、异亮氨酸、高亮氨酸,乙烯基甘氨酸、2-氨基丁酸、2-烯丙基甘氨酸、别亮氨酸、别苏氨酸、2-氨基庚酸、丝氨酸、谷氨酰胺或甘氨酸。在另一优选实施例中,x11为正亮氨酸,x24选自赖氨酸、2,4-二氨基丁酸、天冬氨酸、天冬酰胺、丝氨酸、谷氨酰胺或甘氨酸,并且所述氨基酸序列(i)的所述c端氨基酸选自丙氨酸、亮氨酸、缬氨酸、正亮氨酸、正缬氨酸、异亮氨酸、高亮氨酸、乙烯基甘氨酸、2-氨基丁酸、2-烯丙基甘氨酸、别亮氨酸、别异亮氨酸或2-氨基庚酸。优选地,所述氨基酸序列(i)的所述c端氨基酸选自丙氨酸、亮氨酸、缬氨酸、正亮氨酸、正缬氨酸、异亮氨酸、高亮氨酸、乙烯基甘氨酸、2-氨基丁酸、2-烯丙基甘氨酸、异亮氨酸、别异亮氨酸或2-氨基庚酸,进一步优选地或可替代地优选地,所述氨基酸序列(i)的所述c端氨基酸为d立体异构体。在另一优选实施例中,所述氨基酸序列(i)的所述c端氨基酸选自以下的d立体异构体:丙氨酸、亮氨酸、缬氨酸、正亮氨酸、正缬氨酸、异亮氨酸、高亮氨酸、乙烯基甘氨酸、2-氨基丁酸、2-烯丙基甘氨酸、别亮氨酸、别异亮氨酸或2-氨基庚酸。在另一优选实施例中,所述氨基酸序列(i)的所述c端氨基酸为丙氨酸,优选地d-丙氨酸。在另一优选实施例中,所述x1为极性或疏水性氨基酸。在另一优选实施例中,所述x1选自天冬酰胺、β-羟基天冬酰胺、2,5-二氨基-4-羟基-5-戊酮酸、谷氨酰胺、谷氨酰胺异羟肟酸、3-甲基-l-谷氨酰胺、n-甲基-天冬酰胺、n5-甲基-谷氨酰胺、半胱氨酸-s-乙酰胺;亮氨酸、别亮氨酸、别异亮氨酸、高亮氨酸、异亮氨酸、2-氨基丁酸、正亮氨酸、正缬氨酸、缬氨酸;丝氨酸、高丝氨酸、别苏氨酸、3,3-二羟基-丙氨酸、2-氨基-5-羟基戊酸、4-羟基-1-苏氨酸、苏氨酸、羟基正缬氨酸、6-羟基-1-正亮氨酸;或甘氨酸。在另一优选实施例中,所述x1选自天冬酰胺、谷氨酰胺、亮氨酸、丝氨酸或甘氨酸。在另一优选实施例中,所述x1为甘氨酸。在另一优选实施例中,所述x1为谷氨酰胺。在另一优选实施例中,所述x1为丝氨酸。在另一优选实施例中,所述x1、x23和x24各自独立地选自由以下组成的组:鸟氨酸、天冬氨酸、赖氨酸、天冬酰胺、2,4-二氨基丁酸(dab)、谷氨酰胺、亮氨酸、丝氨酸和甘氨酸。在另一优选实施例中,所述x1、x23和x24各自独立地选自由以下组成的组:天冬酰胺、2,4-二氨基丁酸(dab)、谷氨酰胺、亮氨酸、丝氨酸和甘氨酸。在另一优选实施例中,所述x1选自谷氨酰胺、丝氨酸或甘氨酸;所述x23为丝氨酸;并且所述x24为谷氨酰胺或丝氨酸。在另一优选实施例中,所述x2、x6和x22彼此独立地为极性氨基酸。优选地,x2、x6和x22彼此独立地选自:2-氨基-5-羟基戊酸、别苏氨酸、4-氯-苏氨酸、3,3-二羟基-丙氨酸、4-羟基-l-异亮氨酸、(2s,3r)-2-氨基-3-羟基-4-甲基戊酸、β-羟基-亮氨酸、高丝氨酸、3-羟基-1-缬氨酸、4,5-二羟基-异亮氨酸、6-羟基-1-正亮氨酸、s-(2-羟基乙基)-1-半胱氨酸、磷酸丝氨酸、丝氨酸、4-羟基-1-苏氨酸、苏氨酸、磷酸苏氨酸或羟基正缬氨酸。在另一优选实施例中,x2、x6和x22为丝氨酸。在另一优选实施例中,所述x3为具有处于生理ph(约ph7)的酸性或负带电侧链的氨基酸。优选地,x3选自谷氨酸、5-o-甲基-谷氨酸、(3r)-3-甲基-1-谷氨酸、(3s)-3-甲基-1-谷氨酸、2s,4r-4-甲基谷氨酸、4-羟基-谷氨基酸、2-氨基己二酸、1-2-氨基-6-亚甲基-薄桃酸、2-氨基-6-氧代薄桃酸;3-甲基-天冬氨酸、6-羧基赖氨酸、天冬氨酸、β-羟基天冬氨酸、3,3-二甲基天冬氨酸或2-氨基-丙二酸。更优选地,x3选自谷氨酸、5-o-甲基-谷氨酸、(3r)-3-甲基-1-谷氨酸、(3s)-3-甲基-1-谷氨酸、2s,4r-4-甲基谷氨酸、4-羟基-谷氨基酸、2-氨基己二酸、1-2-氨基-6-亚甲基-薄桃酸或2-氨基-6-氧代薄桃酸。在另一更优选实施例中,x3为谷氨酸。在另一优选实施例中,所述x5和x7彼此独立地为疏水性氨基酸。优选地,x5和x7彼此独立地选自亮氨酸、别亮氨酸、别异亮氨酸、高亮氨酸、异亮氨酸、2-氨基丁酸、正亮氨酸、正缬氨酸或缬氨酸。更优选地,x5或x7为亮氨酸。在另一更优选的实施例中,x5和x7为亮氨酸。在另一优选实施例中,所述x9和x23彼此独立地为极性氨基酸。优选地,x9和x23彼此独立地选自天冬酰胺、谷氨酰胺、丝氨酸或甘氨酸。在另一更优选的实施例中,x9或x23独立地选自天冬酰胺、谷氨酰胺、丝氨酸或甘氨酸。在另一再次更优选的实施例中,x9和x23两者均独立地选自天冬酰胺、谷氨酰胺、丝氨酸或甘氨酸。在另一再次更优选的实施例中,x9和x23为天冬酰胺。在另一优选实施例中,所述x10为具有处于生理ph(约ph7)的酸性或负带电侧链的氨基酸。优选地,x10选自3-甲基-天冬氨酸、6-羧基赖氨酸、天冬氨酸、β-羟基天冬氨酸、3,3-二甲基天冬氨酸或2-氨基-丙二酸。在另一更优选的实施例中,x10为天冬氨酸。在另一优选实施例中,所述x26为疏水性或极性氨基酸。优选地,x26选自亮氨酸、别亮氨酸、别异亮氨酸、高亮氨酸、异亮氨酸、2-氨基丁酸、正亮氨酸、正缬氨酸、缬氨酸;2,5-二氨基-4-羟基-5-氧戊酸、谷氨酰胺异羟肟酸酯、3-甲基-1-谷氨酰胺、n5-甲基-谷氨酰胺、天冬酰胺、2,5-二氨基-4-羟基-5-氧戊酸或n-甲基-天冬酰胺。更优选地,x26为亮氨酸或谷氨酰胺。在另一优选实施例中,所述x27为极性或疏水性氨基酸或具有处于生理ph(约ph7)的酸性或负带电侧链的氨基酸。优选地,x27为丝氨酸、异亮氨酸或赖氨酸。在另一优选实施例中,所述x28为极性或疏水性氨基酸。优选地,x28为缬氨酸或丝氨酸。在另一优选实施例中,所述x29为疏水性氨基酸或具有处于生理ph(约ph7)的负带电侧链的氨基酸。优选地,x29为d-或l-丙氨酸或d-或l-精氨酸。在另一更优选的实施例中,x29为d-丙氨酸或d-精氨酸。在另一优选实施例中,所述x30为缺失或疏水性或极性d-或l-氨基酸,优选地x30为疏水性或极性氨基酸d氨基酸。优选地,x30为缺失,或x30为d-或l-谷氨酰胺或d-或l-丙氨酸。在另一更优选的实施例中,x30为d-谷氨酰胺或d-丙氨酸。在另一再次更优选的实施例中,x30为d-丙氨酸。在一个优选实施例中,x30为缺失,并且x29为丙氨酸,优选地d-丙氨酸。在另一优选实施例中,x30为丙氨酸,优选地d-丙氨酸,并且x29为精氨酸。在另一优选实施例中,x1为天冬酰胺或亮氨酸,x2为丝氨酸,并且x3为谷氨酸。在另一优选实施例中,x1为丝氨酸、甘氨酸、谷氨酰胺、天冬酰胺或亮氨酸,x2为丝氨酸,并且x3为谷氨酸。在另一优选实施例中,x5为亮氨酸,x6为丝氨酸,并且x7为亮氨酸。在另一优选实施例中,x9为天冬酰胺,x10为天冬氨酸,并且x11为正亮氨酸或甲硫氨酸,优选地x11为正亮氨酸。在另一优选实施例中,x22为丝氨酸,x23为天冬酰胺,并且x24为丝氨酸、甘氨酸、谷氨酰胺、dab(2,4-二氨基丁酸)、天冬酰胺或赖氨酸,优选地x24为dab(2,4-二氨基丁酸)或赖氨酸。在另一优选实施例中,x26为谷氨酰胺或亮氨酸,x27为丝氨酸、赖氨酸或异亮氨酸,x28为缬氨酸,x29为d-或l-精氨酸或d-或l-丙氨酸,优选地x29为d-或l-丙氨酸,更优选地x29为d-丙氨酸,并且x30为缺失、d-或l-丙氨酸或d-或l-谷氨酰胺,优选地x30为d-或l-丙氨酸,更优选地x30为d-丙氨酸。在另一优选实施例中,x1为天冬酰胺或亮氨酸,x2为丝氨酸,x3为谷氨酸,x5为亮氨酸,x6为丝氨酸,并且x7为亮氨酸,并且优选地x9为天冬酰胺,x10为天冬氨酸,并且x11为正亮氨酸或甲硫氨酸,并且进一步优选地x11为正亮氨酸。在另一优选实施例中,x1为天冬酰胺或亮氨酸,x2为丝氨酸,x3为谷氨酸,x22为丝氨酸,x23为天冬酰胺,并且x24为dab(2,4-二氨基丁酸)、天冬酰胺或赖氨酸,优选地x24为dab(2,4-二氨基丁酸)或赖氨酸,并且优选地x26为谷氨酰胺或亮氨酸,x27为丝氨酸、赖氨酸或异亮氨酸,x28为缬氨酸,x29为d-或l-精氨酸或d-或l-丙氨酸,进一步优选地x29为d-或l-丙氨酸,更优选地x29为d-丙氨酸,并且x30为缺失、d-或l-丙氨酸或d-或l-谷氨酰胺,进一步优选地x30为d-或l-丙氨酸,更优选地x30为d-丙氨酸。在另一优选实施例中,x1为天冬酰胺或亮氨酸,x2为丝氨酸,x3为谷氨酸,x5为亮氨酸,x6为丝氨酸,并且x7为亮氨酸。在另一优选实施例中,x1为天冬酰胺或亮氨酸,x2为丝氨酸,x3为谷氨酸,x9为天冬酰胺,x10为天冬氨酸,并且x11为正亮氨酸或甲硫氨酸,优选地x11为正亮氨酸。在另一优选实施例中,x1为天冬酰胺或亮氨酸,x2为丝氨酸,x3为谷氨酸,x22为丝氨酸,x23为天冬酰胺,x24为dab(2,4-二氨基丁酸)、天冬酰胺或赖氨酸,优选地x24为dab(2,4-二氨基丁酸)或赖氨酸。在另一优选实施例中,x1为天冬酰胺或亮氨酸,x2为丝氨酸,x3为谷氨酸,x26为谷氨酰胺或亮氨酸,x27为丝氨酸、赖氨酸或异亮氨酸,x28为缬氨酸,x29为d-或l-精氨酸或d-或l-丙氨酸,优选地x29为d-或l-丙氨酸,更优选地x29为d-丙氨酸,并且x30为缺失、d-或l-丙氨酸或d-或l-谷氨酰胺,优选地x30为d-或l-丙氨酸,更优选地x30为d-丙氨酸。在一个优选实施例中,所述x2、x3、x5、x6、x7、x9、x10、x11、x22、x23、x24、x26、x27、x28和x29彼此独立地为l-氨基酸。在一个优选实施例中,脯氨酸p12、异亮氨酸i13、苏氨酸t14、天冬酰胺n15、天冬氨酸d16、谷氨酰胺q17、赖氨酸k18和k19以及亮氨酸l20彼此独立地为l-氨基酸。在一个优选实施例中,c4、c8、c21和c25彼此独立地为d-半胱氨酸或l-半胱氨酸,优选地为l-半胱氨酸。在一个优选实施例中,所述环状肽由所述氨基酸序列(i)组成。在另一优选实施例中,所述氨基酸序列(i)由seqidno:1的所述氨基酸序列组成。在另一非常优选的实施例中,seqidno:1的所述氨基酸序列选自seqidno:2-5、21-36或39-57中的任何一个。在另一非常优选的实施例中,seqidno:1的所述氨基酸序列选自seqidno:39-57中的任何一个。在另一非常优选的实施例中,seqidno:1的所述氨基酸序列选自seqidno:2-5、21-36中的任何一个。在另一非常优选的实施例中,所述氨基酸序列(i)选自以下中的任何一个:(seqidno:2)、(seqidno:3)、(seqidno:4)、(seqidno:5)、(seqidno:21)、(seqidno:22)、(seqidno:23)、(seqidno:24)、(seqidno:25)、(seqidno:26)、(seqidno:27)、(seqidno:28)、(seqidno:29)、(seqidno:30)、(seqidno:31)、(seqidno:32)、(seqidno:33)、(seqidno:34)、(seqidno:35)或(seqidno:36)。在另一非常优选的实施例中,seqidno:1的所述氨基酸序列为seqidno:2、3、21、22或23中的任何一个。在另一非常优选的实施例中,seqidno:1的所述氨基酸序列为选自seqidno:2或seqidno:3的氨基酸。在某些实施例中,所述环状肽的所述氨基酸序列(i)包括(i)选自游离氨基的n端或乙酰化n端,和/或(ii)选自离羧基的c端或酰胺化c端。在另一优选实施例中,所述环状肽进一步包括接头,其中所述接头与所述氨基酸序列(i)附连,并且其中所述接头包括(i)至少一个附连部分,(ii)至少一个间隔子部分,(iii)至少一个、优选地一个连接部分,或(iv)(i)、(ii)和(iii)的任何组合。在另一优选实施例中,所述至少一个附连部分包括以下或优选地由以下组成:-o-nh2、-o-nh-(氨氧基部分)、-c(o)-ch2-o-nh2、-c(o)-ch2-o-nh-(氨氧基乙酰基部分)、-nh-nh2、-nh-nh-(肼部分)、-e(o)-nh-nh2或-e(o)-nh-nh-(肼部分),其中e为c、s(o)或p。在另外的优选实施例中,所述附连部分包括以下或优选地由以下组成:-o-nh2、-o-nh-(氨氧基部分)、-c(o)-ch2-o-nh2、-c(o)-ch2-o-nh-(氨氧基乙酰基部分)、-nh-nh2、-nh-nh-(肼部分)或(-c(o)-nh-nh2、-c(o)-nh-nh-(碳酰肼部分)。在另一另外优选的实施例中,所述附连部分包括以下或优选地由以下组成:-o-nh2或-o-nh-(氨氧基部分)。在另一优选实施例中,所述至少一个间隔子部分包括以下或优选地由以下组成:nh2-ch2-ch2-(o-ch2-ch2)n-c(o)-或-nh-ch2-ch2-(o-ch2-ch2)n-c(o)-,其中n为1到45,优选地2到20,更优选地6到8的整数;或nh2-(ch2)m-c(o)-或-nh-(ch2)m-c(o)-,其中m为2到45、优选地2到20、更优选地2到6的整数。在另一优选实施例中,所述至少一个连接部分能够使环状肽与第二肽交联。能够使环状肽与第二肽交联的连接部分是本领域众所周知的。在本发明的一个实施例中,能够使环状肽与第二肽交联的所述连接部分包括以下或由以下组成:醛部分,如戊二醛部分、辛二醛部分、二醛部分、丁二醛部分;碳化二亚胺部分,如1-乙基-3-(3-二甲基氨丙基)碳化二亚胺盐酸盐部分;乙二醛部分;n-羟基-磺基琥珀亚氨基部分,如n-羟基-磺基琥珀亚氨基部分;阳离子连接部分;聚乙二醇部分;苯甲酰基苯甲酸部分。另外合适的连接部分在以下中列示:《皮尔斯目录及手册(piercecatalogandhandbook)》,罗克福德市的皮尔斯化学公司(piercechemicalcompany,rockford)(1997);《生物共轭技术(bio缀合物techniques)》,gregt.hermanson,罗克福德市的赛默飞世尔科技公司皮尔斯生物技术公司(piercebiotechnology,thermofisherscientific,rockford)(2013);并且在以下中进行了描述:ep1321466a1、de19821859a1、us6875737、us5456911、us5612036、us5965532、wo2001004135、wo2001070685、us20140302001a1、us6800728、us20140171619a1、us8168190、wo2012/166594a1和wo2015/082501。在一个实施例中,所述接头是至少一个、优选地恰好一个附连部分。在另一实施例中,所述接头是至少一个、优选地恰好一个、两个或三个间隔子部分,其中在多于一个间隔子部分的情况下,其优选地直接或通过互连基团连接在一起。在另一实施例中,所述接头是至少一个、优选地恰好一个间隔子部分。在另一实施例中,所述接头是至少一个、优选地恰好一个连接部分。在另一实施例中,所述接头包括至少一个附连部分和至少一个、优选地恰好一个间隔子部分,其中至少一个附连部分与所述氨基酸序列(i)的n端附连,并且至少一个间隔子部分与附连部分附连。在另一实施例中,所述接头包括至少一个附连部分和至少一个、优选地恰好一个间隔子部分,其中至少一个间隔子部分与所述氨基酸序列(i)的n端附连,并且至少一个附连部分与间隔子部分附连。在一个实施例中,所述至少一个接头包括至少一个附连部分和至少一个间隔子部分以及至少一个连接部分,其中至少一个连接部分或至少一个间隔子部分与所述氨基酸序列(i)的n端附连。在另一实施例中,至少一个附连部分与所述氨基酸序列(i)的n端附连,至少一个间隔子部分与附连部分附连,并且至少一个连接部分与间隔子部分附连。在另一实施例中,至少一个间隔子部分与氨基酸序列(i)的n端附连,至少一个附连部分与间隔子部分附连,并且至少一个连接基部分与附连部分附连。在一个优选实施例中,接头典型地并且优选地通过酰胺键与氨基酸序列(i)、与所述氨基酸序列(i)的n端或所述氨基酸序列(i)的氨基酸的侧链的游离氨基、优选地与所述氨基酸序列(i)的n端附连。在一个优选实施例中,所述连接部分能够使所述环状肽与第二肽的巯基交联。在一个优选实施例中,所述连接部分包括马来酰亚胺部分。在一个优选实施例中,所述接头与所述氨基酸序列(i)中包含的氨基附连,其中优选地所述接头与以下的游离氨基附连:(i)所述氨基酸序列(i)的n端,或(ii)所述氨基酸序列(i)的氨基酸的侧链。优选地,接头通过酰胺键与所述氨基酸序列(i)中包含的所述氨基附连。所述侧链优选地具有氨基酸赖氨酸。在一个优选实施例中,x24为赖氨酸,并且所述接头与x24的侧链的游离氨基附连。在一个非常优选的实施例中,所述接头选自以下式:其中n为1到45,优选地6到8的整数,并且波浪线指示与所述氨基酸序列(i)的附连部位。进一步非常优选地,所述n为6。在本发明的如缀合物以及由此包含所述接头的化合物包括一个或多个双键的情况下,所述双键可以具有(e)-或(z)-配置或其成任何比率的混合物。对于包括肟部分的优选接头也是如此。因此,包括肟部分的优选接头因此可以包含具有所述肟部分的呈其顺式配置的所述接头(以及因此顺式异构体),具有所述肟部分的呈其反配置的所述接头(以及因此作为抗-异构体)和其成任何比率的混合物。在本文所呈现的用于所述双键或所述肟部分的化学式内,这典型地且优选地由波浪线表示。在另外非常优选的实施例中,所述接头选自以下式:其中波浪线指示所述氨基酸序列(i)的附着位点。在另外非常优选的实施例中,所述环状肽包括、优选地是选自以下式中的任何一个的式:在另外非常优选的实施例中,所述环状肽包括、优选地是选自以下式中的任何一个的式:式(3)(seqidno:16)、式(4)(seqidno:17)、式(5)(seqidno:18)、式(6)(seqidno:19)、式(7)(seqidno:20)以及如实例章节中描述的式(19)到(37)中的任一个。在另外非常优选的实施例中,所述环状肽包括、优选地是式(3)(seqidno:16)。在另外非常优选的实施例中,所述环状肽包括、优选地是式(4)(seqidno:17)。在另外非常优选的实施例中,所述环状肽包括、优选地是式(5)(seqidno:18)。在另外非常优选的实施例中,所述环状肽包括、优选地是式(6)(seqidno:19)。在另外非常优选的实施例中,所述环状肽包括、优选地是式(7)(seqidno:20)。可以用于将环状肽与脂肽构建块附连的连接和缀合程序是本领域的技术人员众所周知的(参见例如hermanson,g.t,《生物共轭技术》,第2版,学术出版社(academicpress),2008)。可以使用用于将肽或其它抗原与抗原递送系统,如载体蛋白、聚合物、树状物、纳米颗粒或病毒样颗粒连接和缀合的任何方法来将所述环状肽与所述脂肽构建块连接。脂肽构建块的肽部分中的氨基酸的侧链中的游离氨基可以与环状肽或接头中的反应性酯偶联(例如,由羧酸制备的n-羟基琥珀酰亚胺酯);肽部分中的硫醇可以与接头中的马来酰亚胺基偶联;可以将叠氮掺入到肽部分中的氨基酸残基的侧链中,并且使用铜催化的环加成反应将其与含有乙炔基的环状肽或接头偶联;并且肽部分中的其它亲核体(例如,肼基、羟氨基、vic-氨基硫醇)可以与环状肽或接头中的亲电体(例如,醛、酮、活性酯)偶联。进一步地,设想了将肽部分和环状肽或接头中的两个反应性基团的位置反转以实现选择性偶联。本文所述的脂质构建块、缀合物以及包含抗原和接头的所有其组分的所有实施例以及优选和非常优选的实施例都适用于本发明的所有方面,即使不是所有实施例以及优选和非常优选的实施例都是不必再次重复和重申的也是如此。在另外非常优选的实施例中,所述缀合物选自以下式中的任何一个:在另外非常优选的实施例中,所述缀合物为(38)。在另外非常优选的实施例中,所述缀合物为(39)。在另外非常优选的实施例中,所述缀合物为(40)。在另外非常优选的实施例中,所述缀合物为(41)。在另外非常优选的实施例中,所述缀合物为(42)。在另外非常优选的实施例中,所述缀合物为(45)。在另外非常优选的实施例中,所述缀合物为(46)。在另一方面,本发明提供了一种缀合物的束,所述束包括本发明缀合物中的2个、3个、4个、5个、6个或7个。在另一方面,本发明提供了一种缀合物的束,所述束包括本发明缀合物中的2个、3个、4个或5个。在另一非常优选的方面,本发明提供了一种缀合物的束,所述束包括本发明缀合物中的3个。在另一方面,本发明提供了一种缀合物的束,所述束包括本发明缀合物中的2个、3个、4个、5个、6个或7个,其中所述缀合物选自式(38)、(39)、(40)、(41)、(42)、(45)或(46)中的任何一个,其中优选地所述缀合物选自式(38)、(40)、(41)、(42)或(46)中的任何一个,并且其中进一步优选地所述缀合物是式(38)或(46),优选地(38)。在另一非常优选的方面,本发明提供了一种缀合物的束,所述束包括本发明缀合物中的3个、优选地恰好3个,其中所述缀合物选自式(38)、(39)、(40)、(41)、(42)、(45)或(46)中的任何一个,其中优选地所述缀合物选自式(38)、(40)、(41)、(42)、(46)中的任何一个,并且其中进一步优选地所述缀合物是式(38)或(46),优选地(38)。根据一个优选实施例,在所述束中,由所述缀合物包括的所述肽部分的卷曲螺旋肽链段被卷曲在一起,优选地所述卷曲螺旋肽链段被螺旋状地卷曲在一起,更优选地所述卷曲螺旋肽链段被α螺旋状地卷曲在一起。在一个优选实施例中,所述肽部分的所述卷曲螺旋肽链段左旋或右旋卷曲在一起。根据一个优选实施例,在所述束中,所述肽部分的所述卷曲螺旋肽链段形成α螺旋状左旋螺旋。在一个优选实施例中,所述卷曲螺旋肽链段具有平行朝向,即其沿相同方向运作;或者其具有反平行朝向,即其沿彼此相反的方向运作;其中第一选择是优选的。术语“方向”基于在一侧具有n端并且在另一侧具有c端的肽链的方向。在所述本发明束的优选实施例中,所述肽部分的所述卷曲螺旋肽链段形成左旋α-螺旋状卷曲螺旋,其中所述卷曲螺旋肽链段在所述卷曲螺旋中具有平行朝向。优选地,所述束包括2个到7个(例如,二聚体、三聚体、四聚体、五聚体、六聚体或七聚体),更优选地2个、3个、4个或5个,再次更优选地3个螺旋状扭曲的卷曲螺旋肽链段,所述螺旋扭曲的卷曲螺旋肽链段在所述卷曲螺旋中具有平行朝向。在另一方面,本发明提供了一种合成病毒样颗粒,所述合成病毒样颗粒包括至少一个本发明的缀合物的束。在另一方面,本发明提供了一种合成病毒样颗粒,所述合成病毒样颗粒包括至少一个本发明的缀合物的束,其中所述缀合物选自式(38)、(39)、(40)、(41)、(42)、(45)或(46)中的任何一个,其中优选地所述缀合物选自式(38)、(40)、(41)、(42)或(46)中的任何一个,并且其中进一步优选地所述缀合物是式(38)或(46),优选地(38)。本发明还涉及制备本发明的合成病毒样颗粒的方法。合成病毒样颗粒(svlp)可以通过自组装过程产生,例如在水性溶液中。此方法可以涉及将脂肽构建块溶解在合适的载体,优选地水性缓冲系统(例如缓冲盐水或非缓冲盐水)中。可以在制备合成病毒样颗粒之后,例如通过冻干或喷雾干燥去除溶剂。包含本发明的环状肽和本发明的脂肽构建块的特定组合的缀合物自组装成束并且进一步组装成合成病毒样颗粒(svlp)。在另一方面,本发明提供了一种药物组合物,所述药物组合物包括免疫有效量的本发明的缀合物或本发明的合成病毒样颗粒连同药学上可接受的稀释剂、载体或赋形剂,其中优选地所述药物组合物是疫苗。如本文所使用的,术语“有效量”是指实现期望的生物学效果必需的或足够的量。优选地,术语“有效量”是指本发明的抗原、本发明的缀合物或本发明的合成病毒样颗粒的量,所述抗原、缀合物和合成病毒样颗粒(i)治疗或预防特定疾病、医疗病状或病症,(ii)减弱、减轻或消除特定疾病、医疗病状或病症的一种或多种症状,或(iii)预防或延迟本文所述的特定疾病、医疗病状或病症的一种或多种症状的发作。如本文所理解的,免疫原有效量是能够调节、优选地增强受试者的免疫系统对抗原或病原体的应答的量。本发明进一步涉及用作疫苗的本发明的缀合物或合成病毒样颗粒。如本文所使用的,疫苗是用于调节、优选地刺激身体的免疫系统对特定抗原或病原体的应答的药物组合物。在一个优选实施例中,药物组合物或优选地疫苗用于预防或降低受试者、优选地人、更优选地儿童或老年人的rsv感染的风险。在再次另一方面,本发明提供了用作药物,优选地用于在用于预防疾病或用于降低疾病风险的方法中使用的本发明的缀合物或本发明的合成病毒样颗粒,其中进一步优选地所述疾病是感染性疾病、癌症或过敏症,并且再次更优选地其中所述疾病是呼吸道合胞病毒(rsv)感染。在再次另一方面,本发明提供了用于在用于预防疾病或用于降低疾病风险或用于治疗疾病的方法中使用的本发明的缀合物或本发明的合成病毒样颗粒,其中进一步优选地所述疾病是感染性疾病、癌症或过敏症,并且再次更优选地其中所述疾病是呼吸道合胞病毒(rsv)感染。在再次另一方面,本发明提供了用于在用于预防感染性疾病或降低感染性疾病的风险的方法中使用的,优选地用于在用于预防与呼吸道合胞病毒相关联的或由呼吸道合胞病毒引起的感染性疾病或降低感染性疾病的风险的方法中使用的本发明的缀合物或本发明的合成病毒样颗粒。如本文所使用的,术语治疗是指疗法和治疗性治疗。本发明提供了用作药物、优选地用于在用于预防感染性疾病或用于降低感染性疾病的风险的方法中使用的,更优选地用于在用于预防与呼吸道合胞病毒(rsv)相关联的或由呼吸道合胞病毒引起的感染性疾病或降低感染性疾病的风险的方法中使用的本发明的缀合物、本发明的合成病毒样颗粒或本发明的药物组合物。本发明提供了用作药物、优选地用于在用于预防感染或用于降低感染的风险的方法中使用的,更优选地用于在用于预防由呼吸道合胞病毒引起的感染或降低感染的风险的方法中使用的本发明的缀合物、本发明的合成病毒样颗粒或本发明的药物组合物。本发明提供了用作药物、优选地用于在用于预防感染或用于降低感染的风险的方法中使用的,更优选地用于在用于预防rsv感染或降低rsv感染的风险的方法中使用的本发明的缀合物、本发明的合成病毒样颗粒或本发明的药物组合物。本发明进一步涉及一种引发或调节免疫应答的方法或涉及一种限制患疾病,优选地感染,更优选地与rsv相关联的或由rsv引起的感染的风险的方法,其中免疫原有效量的本发明的缀合物或合成病毒样颗粒施用于受试者,优选地人,更优选地儿童或老人。本发明进一步涉及一种用于治疗疾病,优选地感染,更优选地与rsv相关联的或由rsv引起的感染的方法,所述方法包括向受试者,优选地人,更优选地儿童或老人施用免疫原有效量的本发明的缀合物或合成病毒样颗粒。此外,本发明涉及用于治疗疾病,优选地与rsv相关联的或由rsv引起的感染的本发明的缀合物或合成病毒样颗粒。而且,本发明涉及用于治疗疾病,优选地由rsv引起的感染的本发明的缀合物或合成病毒样颗粒。此外,本发明涉及用于治疗疾病,优选地rsv感染的本发明的环状肽、缀合物或合成病毒样颗粒。实例实例1脂质构建块的制备脂肽10此脂肽10基于iekkiea(seqidno:12)。defgabc七肽重复基序与通用t辅助细胞表位seq-idno:6以及c端处的额外残基(seqidno:11)稠合,以改善溶解度和稳定性并且允许抗原缀合,并且通过gg接头与s-[2,3-双(棕榈酰基氧基)-(2)-丙基]-半胱氨酸缀合。实质上执行脂肽10的合成,并且通过如wo2008/068017中所述的rp-hplc对产物进行纯化。rp-hplc(zorbaxc8柱,含30%到100%mecn的h2o(+0.1%chooh),10分钟内)纯度:95%,tr=4.87分钟。maldi-tof:c312h552n74o85s3的m/z计算值:6796.4;m/z实测值:6797.4[m+h]+。脂肽11此脂肽11含有卷曲螺旋结构域,所述卷曲螺旋结构域在七肽重复序列“defgabc”iekkies(seqidno:13)的“c”位置处具有丝氨酸。通过如以上针对脂肽10描述的rp-hplc来合成脂肽11,并且对其进行纯化,并且通过分析rp-hplc和maldi-ms对其进行分析。hplc(zorbaxc8柱,含30%到100%mecn的h2o(+0.1%chooh),10分钟内):纯度:90%,tr=4.81分钟;maldi-ms:计算的c312h552n74o89s3的mw:6860.46da;实测值:6860.61da(±0.05%)。脂肽lbb-1除了脂质pam2-cys具有位于手性2-丙基碳原子处的r配置和半胱氨酰部分的手性碳的r配置之外,此脂肽构建块lbb-1与脂肽10相对应。通过rp-hplcrp-hplc对构建块lbb-1进行分析(agilentvaritiderpc,含0%到95%mecn的h2o(+0.1%tfa),63分钟内:纯度97.0%,tr=45.58;c312h552n74o85s3的esi-msmw计算值:6796.46da;实测值:6793.1。脂肽lbb-2除了脂质pam2-cys具有位于手性2-丙基碳原子处的r配置和半胱氨酰部分的手性碳的r配置之外,此脂肽构建块lbb-2与脂肽11相对应。通过rp-hplc对构建块lbb-2进行分析(agilentvaritiderpc,含0%到95%mecn的h2o(+0.1%tfa),63分钟内:纯度97.0%,tr=45.58分钟。maldi-ms:计算的c312h552n74o89s3的mw:6860.46da;实测值:6861.1da(±0.05%)。实例2环状rsv肽和包括所述肽的缀合物的合成诸位申请人已经描述了也可用于在2018年6月13日提交的其申请pct/ep2018/065714并且优选地在所述申请中作为本发明缀合物的抗原的环状肽。具体地,此类环状肽的设计和合成在pct/ep2018/065714的实例1中进行了描述。此外,在pct/ep2018/065714的实例2中已经描述了包含此类肽的缀合物的制备,并且在pct/ep2018/065714的实例3-5中以及在此,在pct/ep2018/065714的实例3中已经详细描述了其对于抵抗rsv感染的免疫的用途,在pct/ep2018/065714的针对进一步肌内免疫实验的实例4中以及在针对单克隆抗体的生成的实例5中已经描述了其对于抵抗小鼠体内的rsv的免疫原性研究的用途。将pct/ep2018/065714的公开内容,以及pct/ep2018/065714的所有公开内容,特别是与特定环状肽、缀合物和其它组分部分有关的公开内容通过引用以其整体并入本文,并且所生成生物学数据在此专门通过引用以其整体并入本文。据信,鉴于所公开的环状肽、缀合物和组分部分,并且具体地鉴于pct/ep2018/065714的实例1-2的所描述的环状肽、缀合物和化合物,pct/ep2018/065714的实例3-5中具体描述的所述生物学数据和作用使得利用本发明的脂质构建块、缀合物和svlp以及因此在适应于本发明和本发明的特征时实现所述生物学数据和作用变得可信。因此,考虑到在此对本发明和本发明的特征以及本发明脂质构建块、缀合物和svlp适应,认为本发明的范围通过参考所述生物学数据和作用而变得进一步可信。不论其是否通过引用并入pct/ep2018/065714,在此以完整或概括形式再次重复其某些公开内容。为了方便起见,对于本发明和说明书,保持了所述环状肽、缀合物和其它组分部分的编号以及其pct/ep2018/065714的序列。pct/ep2018/065714的实例1描述了马来酰亚胺基-肽1(seqidno:14)和(氨氧基)乙酰基肽2(seqidno:15),尤其作为参考实例,因为,如pct/ep2018/065714的实例3中所公开的,包括所述肽的缀合物不会生成抗体应答以及针对rsva2和a/长链的中和抗体。典型地使用fmoc固相肽合成(spps)方法,使用0.5mmol规模的tentagelrram树脂,执行了对本发明有用和优选的包含环状肽的所述肽的合成。组装完成之后,从树脂切割肽,并且去除侧链保护基,并且在制备型柱上通过rp-hplc对肽进行纯化,并且典型地进行冻干,以得到呈白色粉末的肽。随后执行通过rp-hplc进行的分析,并且确定纯度、tr、esi-ms和mw。本发明的另外优选的环状肽、pct/ep2018/065714中已经描述的其合成和表征如下:(氨氧基)乙酰基肽3在(氨氧基)乙酰基肽3(seqidno:16)中,(氨氧基)乙酰基部分(表示为“aoac”)通过21-氨基-3,6,9,12,15,18-六氧杂二十一烷-21-接头与肽的n端偶联,并且d-ala(表示为“a”)与c端偶联为酰胺,以赋予外切蛋白酶稳定性。(氨氧基)乙酰基肽3含有两个二硫键。(氨氧基)乙酰基肽4(氨氧基)乙酰基肽4(seqidno:17)衍生自rsv病毒在进行几个序列修饰时的f-蛋白。(氨氧基)乙酰基部分(表示为“aoac”)与肽的n端偶联,并且d-ala(表示为“a”)与c端偶联作为酰胺,以赋予外切蛋白酶稳定性。(氨氧基)乙酰基肽4含有两个二硫键,如以上式中描绘的。(氨氧基)乙酰基肽4通过标准fmocspps组装。aoac偶联为双-boc-氨氧基-乙酸、n-羟基琥珀酰亚胺酯(boc2-aoa-osu)。组装完成之后,从树脂切割肽,并且通过用87.5%tfa、5%ta、5%h2o、2.5%edt处理2.5小时去除了侧链保护基。为了通过空气氧化进行环化,将还原的肽溶解在ph7.8的0.33m碳酸氢铵缓冲液中并搅拌过夜。然后在制备型c18柱上通过rp-hplc对环状肽进行纯化,并且冻干,以得到呈白色粉末的4。分析型rp-hplc(vydac218tp54,5μm,4.6mm×250mm柱,含0%–60%mecn的h2o(+0.1%tfa),40分钟内):纯度:90.4%;tr=25.07分钟。maldi-ms:c134h226n44o49s4的mw计算值:3365.78da;mw实测值:3365.80da(±0.01%)。(氨氧基)乙酰基肽5在(氨氧基)乙酰基肽5(seqidno:18)中,将(氨氧基)乙酰基部分(表示为“aoac”)与肽中的赖氨酸侧链偶联,将n端乙酰化,并且将d-ala(表示为“a”)与c端偶联。(氨氧基)乙酰基肽5含有两个二硫键。(氨氧基)乙酰基肽6在(氨氧基)乙酰基肽6(seqidno:19)中,将(氨氧基)乙酰基部分(表示为“aoac”)与肽中的n端偶联,并且将d-ala(表示为“a”)与c端偶联。(氨氧基)乙酰基肽6含有两个二硫键。(氨氧基)乙酰基肽7在(氨氧基)乙酰基肽7(seqidno:20)中,将(氨氧基)乙酰基部分(表示为“aoac”)与n端偶联,并且将d-ala(表示为“a”)与c端偶联。(氨氧基)乙酰基肽7含有两个二硫键。用于免疫的缀合物的制备pct/ep2018/065714的实例2描述了进一步通过通用方案a-b-c制备包括环状rsv肽的缀合物,其中“a”表示抗原,“b”表示接头,并且“c”表示脂肽构建块,并且“x”表示与脂肽构建块c的附连。抗原a1包括seqidno:37,抗原a2包括seqidno:38,抗原a3包括seqidno:2,并且抗原a4包括seqidno:3。抗原a:接头b:脂肽构建块c:此外,在pct/ep2018/065714的实例2中描述了另外具体的接头、脂肽和缀合物,所述文献的具体公开内容通过引用以其整体并入本文并且如下:马来酰亚胺peg6醛接头化合物8通过使sm-peg6(赛默飞世尔科技公司)与氨基乙醛二甲基乙缩醛于h2o中反应合成了接头化合物8。将sm-peg6(7.6mg,12.6μmol)悬浮在0.3mlh2o中,并且添加17μl的氨基乙醛二甲基乙缩醛于h2o中的1:10(v/v)溶液。将混合物在室温下搅拌90分钟。在c8柱上通过rp-hplc对交联剂进行纯化并冻干。esi-ms:c26h45n3o12的mw计算值:591.66;mw实测值:591.32(±0.05%)。对于二甲基乙缩醛的水解,利用95%tfa、5%h2o将接头8(20mg)处理5分钟。在真空中去除tfa。esi-msc24h39n3o11:545.59da;mw实测值:545.28da(±0.05%)。马来酰亚胺c3醛接头化合物9已在以上实例1中描述了脂肽10和脂肽11。缀合物12(抗原a3+接头b3+脂肽构建块c1)缀合物13(抗原a3+接头b3+脂肽c2)缀合物14(抗原a3+接头b4+脂肽c1)缀合物15(抗原a3+接头b2+脂肽c1)缀合物16(抗原a4+接头b3+脂肽c1)缀合物17(抗原a1+接头b1+脂肽c1)缀合物18(抗原a2+接头b2+脂肽c1)pct/ep2018/065714的实例3描述了针对小鼠体内的rsv的免疫原性研究,所述文献的具体公开内容通过引用以其整体并入本文。pct/ep2018/065714的实例3的结果表明利用缀合物12、13和15进行的免疫在不用共同使用佐剂的情况下在血清中会引发高中和滴度。在来自用缀合物14和16免疫的动物的血清中发现了较低但可检测到的滴度,但在来自利用对应线性或单环肽抗原(缀合物17和18)免疫的动物的血清中未发现滴度。利用缀合物12进行的免疫导致在经历攻击之后完全保护肺部并且肺组织病理减少,然而在利用fi-rsv进行免疫之后在受到攻击时,观察到肺部中的病毒仅部分减少并且组织病理强。利用13进行的免疫也显著减少了肺部中的病毒复制和肺组织病理学。pct/ep2018/065714的实例4描述了肌内免疫实验,所述文献的具体公开内容通过引用以其整体并入本文。pct/ep2018/065714的实例4的结果示出,相比于pbs对照组,用150μg或300μg的缀合物12进行免疫的动物示出病毒滴定的强减少(约3×log10)。大多数动物的肺部中不具有可检测到的病毒(log10滴定≤2.6pfu/g)。疫苗接种fi-rsv、15μg或的动物示出保护越来越少(以约2×log10减少)。佐剂似乎没有改善保护。用pbs免疫的动物描绘出典型地与原发性rsv感染相关联的病理。疫苗接种fi-rsv的动物示出强的病理,这表明疫苗相关的疾病增强。用缀合物12免疫的所有动物示出,无疫苗相关疾病增强的迹象,并且病理评分与pbs对照动物相等或更低。结果示出,在未共同施用佐剂的情况下,用缀合物12进行的两次肌内免疫足以达到高水平的保护性中和抗体,并且用缀合物12进行的免疫在大剂量范围内不会引起呼吸疾病增强。实例5描述了单克隆抗体的生成,所述文献的具体公开内容通过引用以其整体并入本文。pct/ep2018/065714的实例5的结果示出,在用缀合物12进行免疫之后,可以在小鼠体内生成亚纳米摩尔范围内的kd和中和效价与帕利珠单抗(palivizumab)相似或比其更好的抗体。实例6描述了环状肽的序列变体的生成和其合成,所述文献的具体公开内容通过引用以其整体并入本文。(氨氧基)乙酰基肽19(具有seqidno:39)(氨氧基)乙酰基肽20(具有seqidno:40)(氨氧基)乙酰基肽21(具有seqidno:41)(氨氧基)乙酰基肽22(具有seqidno:42)(氨氧基)乙酰基肽23(具有seqidno:43)(氨氧基)乙酰基肽24(具有seqidno:44)(氨氧基)乙酰基肽25(具有seqidno:45)(氨氧基)乙酰基肽26(具有seqidno:46)(氨氧基)乙酰基肽27(具有seqidno:47)(氨氧基)乙酰基肽28(具有seqidno:48)(氨氧基)乙酰基肽29(具有seqidno:49)(氨氧基)乙酰基肽30(具有seqidno:50)(氨氧基)乙酰基肽31(具有seqidno:51)(氨氧基)乙酰基肽32(具有seqidno:52)(氨氧基)乙酰基肽33(具有seqidno:53)(氨氧基)乙酰基肽34(具有seqidno:54)(氨氧基)乙酰基肽35(具有seqidno:55)(氨氧基)乙酰基肽36(具有seqidno:56)(氨氧基)乙酰基肽37(具有seqidno:57)缀合物38除了使用脂肽构建块lbb-2代替lbb-1之外,如以下针对缀合物39所描述的制备缀合物38,并且对其进行纯化。分析型uplc(acquityuplcbehc8,1.7μm,2.1×150mm,含10%到90%mecn的h2o(+0.1%tfa),45分钟内,40℃):纯度79%,tr=32.43分钟。maldi-ms:c470h815n121o144s7的mw计算值:10689.8da;实测值:10746.9缀合物39为了制备缀合物39,向ph3.5的含接头8(1.9mg,3.6μmol)的0.25ml0.1m乙酸钠缓冲液中添加ph3.5的(氨氧基)乙酰基肽4(3mg,0.9μmol)于0.25ml0.1m乙酸钠缓冲液中的溶液。将混合物搅拌2.5小时,并且在制备型c8柱上通过rp-hplc对肟进行纯化。通过分析型uplc(acquityuplcbehc8,1.7μm,2.1×150mm,含10%到70%mecn的h2o(+0.1%tfa),60分钟内,70℃)对中间物进行分析:纯度95%,tr=16.59分钟。esi-ms:c158h263n47o59s4的mw计算值:3893.35da;mw实测值:3892.35(±0.01%)。将肟(2.0mg,0.5μmol)溶解在0.5mlh2o中并且添加到脂肽构建块lbb-1(3.1mg,0.5μmol)于2ml50%mecn中的溶液中。用0.1nnaoh/0.1nhcl将ph调节到ph=6.5,并且在室温下将混合物搅拌2.5小时。在c8柱上通过rp-hplc对缀合物47进行纯化。使用ag-x2阴离子交换树脂(乙酸盐形式)去除tfa。通过分析型uplc和ms分析缀合物。uplc(acquityuplcbehc8,1.7μm,2.1×150mm,含40%到80%mecn的h2o(+0.1%tfa),50分钟内,40℃):纯度94%,tr=20.75分钟。esi-ms:c470h815n121o148s7的mw计算值:10753.81da;实测值:10751.1da(±0.05%)。实例3疟疾肽抗原和包括所述肽的缀合物的合成抗原43肽序列取自疟原虫镰状疟原虫的环子孢子蛋白(cs)的npna重复区。在c端处添加额外的d-丙氨酸-酰胺(表示为“a-nh2”)以提高稳定性。已添加γ-马来酰亚胺基丁酰基(gmb)基团,以允许与半胱氨酸残基缀合。实质上执行抗原43的合成,并且通过如wo2008/068017中所述的rp-hplc对产物进行纯化。分析型反相rp-hplc(zorbaxc18柱,含5%到30%mecn的h2o(+0.1%tfa),25分钟内:纯度>95%,tr=13.02分钟。lc-ms(zorbaxc18柱,含5%到100%mecn的h2o(+0.1%chooh),10分钟内:tr=3.15分钟;esi-msm/z=746.5[m+3h]3+缀合物44为了将抗原43与脂肽10偶联,向43(2.7mg,1.2μmol,1.2当量)于h2o/mecn1:1(1ml,2.7mg,1.2μmol,1.2当量)的所搅拌溶液中逐滴添加脂肽10(6.8mg,1.0μmol)于h2o/mecn1:1(0.5ml)中的溶液。使用0.1nnaoh小心地将ph调节到ph6.5,并且将混合物搅拌3小时。在完成偶联反应之后,用含有0.1%tfa(2ml)的h2o稀释混合物,并且在17分钟内在c4半制备型柱(interchrom)上使用一定梯度的50%到100%mecn/h2o(+0.1%tfa)通过反相rp-hplc对缀合物进行纯化。分析型反相rp-hplc(interchromc4柱,含25%到100%mecn的h2o(+0.1%tfa),25分钟内):纯度>97%,tr=19.64分钟;maldi-tof:c403h686n106o120s3的m/z测量值:9032.6:m/z实测值:9032.2[m+h]+。缀合物45除了使用lbb-1替代脂肽10之外,基本上如以上针对缀合物44所描述的执行缀合物45的合成和纯化。分析型反相rp-hplc(interchromc4柱,含25%到100%mecn的h2o(+0.1%tfa),25分钟内):纯度>97%,tr=19.64分钟。maldi-tof:c403h686n106o120s3的m/z测量值:9032.6:m/z实测值:9032.4[m+h]+缀合物46除了使用lbb-2替代脂肽10之外,基本上如以上针对缀合物44所描述的执行缀合物46的合成和纯化。uplc(acquityuplcbehc8,1.7μm,2.1×150mm,含10%到90%mecn的h2o(+0.1%tfa),10分钟内,25℃):纯度>79%,tr=35.76分钟):纯度90%,tr=8.62分钟;maldi-tof:c403h687n107o123s3的m/z计算值:9095.74;m/z实测值:9096.6实例4包括疟疾肽抗原的缀合物的亲合力指数为了进行小鼠免疫原性研究,用表2中描绘的调配物对balb/c小鼠(5只每组)进行s.c.免疫。表2:调配物编号描述剂量佐剂途径1含44的0.1mlpbs40μg无sc2含45的0.1mlpbs40μg无sc3含46的0.1mlpbs40μg无sc在第0天、第28天和第56天执行免疫。在第66天收集血液。通过基本上如(perciani等人,《临床实验室分析期刊(jclinlabanal)》2007;21(3):201-6)所描述的使用2mkscn以进行洗脱的kscn洗脱elisa确定了相对亲合力指数。基本上如wo2008/068017中的执行igg终点稀释elisa。对于kscn洗脱elisa(nunc免疫板polysorbf96),其中用50μl的含5μg/ml抗原溶液的pbs涂覆过夜,用含有0.05%20的150μlpbs洗涤3次并且用两倍血清稀释液于含有0.5%脱脂奶粉和0.05%的pbs的复制品(50μl每孔)温育2.5小时。用如以上所述的含有0.05%20的pbs将板洗涤三次。用含2mkscn的pbs(ph7.2)将孔的一半温育15分钟,并且用普通pbs将孔的另一半温育相同的时间量。然后将板洗涤,用50μl的碱性磷酸酶缀合的兔抗小鼠igg抗体(西格玛公司(sigma),γ链特异性)温育,在室温下在含有0.5%脱脂奶粉和0.05%20的pbs中以1:20'000稀释1小时,用pbs+0.05%20再次洗涤三次,并且在黑暗中在室温下用ph9.6的50μl的对-硝基苯磷酸盐(西格玛公司)于50mm碳酸钠、1mmmgcl2的1mg/ml溶液中温育。在适当的时间之后,在spectramaxm5微板阅读仪上读取于405nm下的吸光度。然后计算每种血清的亲合力指数,作为获得的经kscn处理的孔的曲线下面积与获得的对应对照的曲线下面积之间的比率(perciani等人,《临床实验室分析期刊》2007;21(3):201-6)。表3和图1中示出了平均log10iggelisa终点稀释滴度和平均亲合力指数±平均的一个标准误差。表3:平均亲合力指数.结果示出,在不共同施用佐剂的情况下,用包括七肽重复基序iekkiea和在2-丙基碳处具有(r)配置的脂质pam2cys的缀合物45进行的免疫导致比利用在2-丙基碳处包括(r)非对映异构体和(s)非对映异构体的混合物的44进行的免疫更高的亲合力抗体,并且进一步示出了利用包括iekkies替代iekkiea的缀合物46进行的免疫导致比44更高的平均亲合力指数(p=0.0291)但是终点稀释滴度显著更低(p=0.0011)。实例5包括rsv抗原的缀合物的亲合力指数为了进行小鼠免疫原性研究,用表4中的调配物对balb/c小鼠(5只每组)进行免疫。表4:调配物编号描述剂量佐剂途径1含47的0.1mlpbs50μg无sc2含38的0.1mlpbs50μg无sc在第0天、第28天和第56天执行免疫。在第66天收集血液。通过基本上如(perciani等人,《临床实验室分析期刊》2007;21(3):201-6)所描述的使用2mkscn以进行洗脱的kscn洗脱elisa确定了相对亲合力指数。表5中示出了平均亲合力指数±平均的一个标准误差。表5:平均亲合力指数.实例6在小鼠体内两次皮下施用缀合物38的免疫原性和功效对于此实验,通过皮下途径用150μg的含缀合物38的0.1mlpbs对6-8周龄的雌性balb/c小鼠(十只动物每组)免疫两次(表6,编号:1)。分别用fi-rsv和pbs对两个对照组(十只动物每组)免疫两次(表6,编号:2和3)。表6:调配物编号描述剂量佐剂途径1含38的0.1mlpbs150μg无sc2fi-rsv1:100无sc3pbs0无sc在第0天和第21天对动物免疫。在第42天(d42),对所有动物放血并且进一步用106pfursva2活病毒鼻内攻击。五天之后,在第47天(d47),牺牲动物,对其完全放血,并且收获肺部并且将其平分,以用于病毒滴定和组织病理学分析。通过斑块减少中和测试(prnt)对用缀合物38、fi-rsv和pbs免疫的组的(先前流血以进行攻击的动物的)来自d0和d42的血清进行分析,以用于中和rsva2链的抗体。将测试血清在56℃下热灭活30分钟,用emem以1:10稀释,并进一步以1:4连续稀释。在室温下将经稀释的血清样品与相等体积的rsva2(25-50pfu)一起温育1小时,并且一式两份接种到24孔板中的融合hep-2单层中。在37℃下在5%co2培育箱中温育一小时之后,用0.75%甲基纤维素培养基覆盖孔。温育4天之后,去除覆盖,并且将细胞固定并且用0.1%结晶紫染色一小时,并且然后冲洗并风干。计算中和滴度,作为达到相比于病毒对照孔,噬菌斑减少60%所需的相互血清稀释度。在表7中汇总了rsva2的log2病毒prnt滴度。表7:中和抗体的引入.利用缀合物38进行的两次免疫在150μg的剂量下诱导高滴度的中和抗体。fi-rsv和pbs导致中和抗体的滴度低于检测限制(<4.32)。对于病毒滴定,通过离心澄清来自d47的肺匀浆,并且在emem中进行稀释。用经稀释的匀浆在24孔板中一式两份地使汇聚hep-2单层感染。在5%co2培育箱中在37℃下温育一小时后,用0.75%甲基纤维素培养基覆盖孔。温育4天之后,去除覆盖,并且将细胞固定并且用0.1%结晶紫染色一小时,并且然后冲洗并风干。对斑块进行计数,并且计算每克组织的斑块形成单位。以下表8中汇总了d47(攻击之后5天)样品的几何平均病毒滴度。为了进行肺组织病理学分析,如上所述,对肺部进行解剖,福尔马林固定并包埋在石蜡中。用苏木精和曙红(h&e)对肺切片染色,以用于分析肺部炎症的四个参数:细支气管周炎(peribronchiolitis)、血管周炎(perivasculitis)、间质性肺炎(interstitialpneumonia)和肺泡炎(alveolitis)。以0-4严重性尺度对载玻片进行盲评分。随后将评分转化为0-100%组织病理学尺度。以下表8中汇总了d47样品的平均病理学评分。表8:第47天的肺部病毒滴度和病理性评分.用pbs免疫的所有动物示出在攻击之后五天肺部中的病毒滴度最大(平均滴度约4.76log10pfu/g)。用150μg的缀合物38免疫的动物示出病毒滴度的强降低(平均滴度约2.58log10pfu/g),并且大多数动物的肺部具有不可检测到的病毒(log10滴度≤2.6pfu/g)。用fi-rsv免疫的动物示出较少的保护(平均滴度约3.95log10pfu/g)。在组织病理学水平上,用pbs免疫的动物描绘出典型地与原发性rsv感染相关联的病理。疫苗接种fi-rsv的动物示出强的病理,这表明疫苗相关的疾病增强。用缀合物38免疫的所有动物示出,无疫苗相关疾病增强的迹象,并且病理评分与pbs对照动物相等或更低(表8)。结果示出,在不共同施用佐剂的情况下利用缀合物38进行的两次皮下免疫足以引发保护性中和抗体的高滴度,以防范肺部中的rsva2病毒复制,并且利用缀合物38进行的免疫不会引起呼吸疾病的增强。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1