用于治疗癌症的Raf抑制剂和CDK4/6抑制剂的组合疗法的制作方法
用于治疗癌症的raf抑制剂和cdk4/6抑制剂的组合疗法
技术领域
1.本发明涉及药物组合,该药物组合包含(a)raf抑制剂(其是如本文定义的具有式(i)的化合物或其药学上可接受的盐);和(b)cdk4/6抑制剂,特别是瑞博西尼(ribociclib)或其药学上可接受的盐。
2.本发明还涉及用于在癌症的治疗中使用的此类组合;此类组合用于制备用于治疗癌症的药物的用途;在有需要的受试者中治疗癌症的方法,该方法包括向所述受试者施用联合治疗有效量的所述组合;此类组合用于治疗癌症的用途;以及包含此类组合的药物组合物。
3.本发明还涉及如本文定义的具有式(i)的化合物或其药学上可接受的盐,用于在与cdk4/6抑制剂(特别是瑞博西尼或其药学上可接受的盐)的组合疗法中使用。本文还提供cdk4/6抑制剂,特别是瑞博西尼,或其药学上可接受的盐,用于在与如本文定义的具有式(i)的化合物或其药学上可接受的盐的组合疗法中使用。
背景技术:
4.超过30%的人类癌症携带丝裂原活化蛋白激酶(mapk)途径中的突变,其中最普遍的是ras或braf突变。mapk途径(也称为ras/raf/cdk4/6/erk途径)是驱动细胞增殖、分化和存活的关键信号级联反应。该途径的失调是许多肿瘤发生包括黑色素瘤实例的基础(kirkwood等人,clin cancer res[临床癌症研究]18(2):555
‑
67,2012)。该途径包括ras小胍三磷酸酶(gtp酶),当ras小胍三磷酸酶被激活时,可以促进raf家族蛋白(araf、braf和craf,也称为raf1)的激活。激活的raf蛋白导致cdk4/61/2蛋白的磷酸化和激活,这些磷酸化和激活的cdk4/61/2蛋白随后使胞外信号调节的激酶(erk)磷酸化并将其激活。erk使多种底物(包括多个转录因子)磷酸化,并调节数种关键的细胞活性(包括增殖、分化、迁移、存活和血管生成)。此外,ras或braf突变组成性激活细胞周期蛋白d
‑
cdk4/6复合体,其中它们与cdk4活化作用协同并导致肿瘤进展(chudnovsky y等人2005;monahan kb等人2010)。
[0005]
在黑色素瘤中,mapk途径的蛋白的激活性突变频率很高。ras突变型黑色素瘤表现出侵袭性行为,在初次诊断时已经存在高肝和脑转移率(bergamasco等人,value in health journal[健康价值期刊]19a347
‑
a766,2016)并且因此预后较差。对标准化学疗法的反应非常有限。一项3期研究表明,与使用达卡巴嗪(dacarbazine)的标准化学疗法相比,cdk4/6抑制剂贝美替尼(binimetinib)有一些益处,例如整体反应率相比标准化学疗法的7%改善至15%。402名患者以2:1的方式随机分配。已经观察到中值pfs为2.8(95%ci:2.8
‑
3.6)对比1.5(1.5
‑
1.7),hr 0.62(0.47
‑
0.80),支持贝美替尼。然而,怀疑与研究药物相关的不良事件导致的停药率很高(20%对比5%),并且pfs中的益处并没有转化为总体存活率的改善(11.0(95%ci:8.9
‑
13.6)个月对比10.1(7.0
‑
16.5)个月)(dummer等人,lancet oncol[柳叶刀肿瘤学]18(4):435
‑
445,2017)。
[0006]
nras基因在15%
‑
20%的黑色素瘤(相对常见的黑色素瘤亚型)中发生了突变。在黑色素瘤中,nras中的大多数激活性变异都发生在密码子61上,而密码子12和13上的变异
发生频率较低(gao等人,sci signal[科学信号],2013;van elsas,recent results cancer res[癌症研究最新结果],1995)。黑色素瘤中nras突变的存在导致mapk信号从braf转换为craf,camp信号开始失调,这允许craf向cdk4/6发出信号(dumaz 2006)。nras中的突变不包括pten中的改变,这意味着仅nras中的突变可以激活mapk和pi3k途径的信号传导(goel等人,j invest dermatol[皮肤病学研究杂志]6(269):pl1,2006,davies等人,clin cancer res[临床癌症研究]15(24):7538
‑
46,2009)。与其他黑色素瘤亚型相比,具有nras突变的黑色素瘤与预后较差相关联(devitt等人,pigment cell melanoma res[色素细胞和黑色素瘤研究]24(4):666
‑
72,2011),并且对标准化学疗法的反应非常有限。
[0007]
在胰腺癌中频繁发现kras突变(di magliano mp&logsdon cd,gastroenterology[胃肠病学]2013;144(6):1220
‑
9)。对pdac患者样品的研究表明,所有样品的93%具有kras突变(biankin等人.nature[自然]2012;491,399
‑
405)。kras具有与nras相同的下游效应子。但是,在nras和kras突变型癌症中仍然存在高度未满足的医疗需求。
[0008]
nras的选择性药理抑制仍然存在技术上的挑战性,因为迄今为止,针对其gtp酶活性一直未能成功设计出特异性小分子拮抗剂。
‑
couselo e,等人,oncotargets and therapy[肿瘤靶标和疗法],2017:10第3941
‑
3947页提示与mek抑制剂和免疫疗法组合是最有希望的策略。然而,当前方法的有效性尚未确定。
[0009]
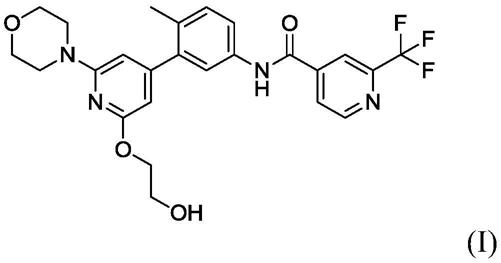
最近有报道称,泛raf抑制剂ly3009120与cdk4/6抑制剂阿贝西利(abemaciclib)组合抑制某些具有kras或braf突变的肿瘤细胞的增殖(chen sh等人,oncogene[致癌基因],2018,37,821
‑
832)。然而,ly3009120抑制几种其他激酶,包括在癌症中具有重要作用的激酶,如肝配蛋白(ephrin)受体、jnk和src家族成员,因此有可能导致脱靶毒性。
[0010]
因此,靶向ras突变型癌症(包括nras突变型黑色素瘤和kras胰腺导管腺癌(pdac))的有效疗法存在未满足的医疗需求。
技术实现要素:
[0011]
已经发现,cdk4/6抑制剂瑞博西尼与选择性raf抑制剂如具有式(i)的化合物组合在体外协同抑制肿瘤细胞。该组合还导致衍生自患者的黑色素瘤异种移植,特别是nras突变型黑色素瘤异种移植的显著肿瘤消退,并增加了临床前模型中的中值存活百分比。
[0012]
在衍生自患者的肿瘤异种移植中,与单一药剂相比,具有式(i)的化合物和瑞博西尼组合治疗的耐受性很好并导致增加的抗肿瘤活性。这些数据指示,在患有ras突变型癌症(如黑色素瘤),特别是nras突变型癌症,更具体地是nras突变型黑色素瘤的患者中,具有式(i)的化合物和瑞博西尼的组合活性可以实现更大和更持久的反应。重要的是,当将具有式(i)的化合物和瑞博西尼用作单一药剂时引起很小的作用相同剂量在两种药剂组合时引起很大的作用。
[0013]
因此,具有式(i)的化合物与cdk4/6抑制剂(尤其是瑞博西尼或其药学上活性的盐)的组合可在具有激活的mapk途径(特别是nras突变型癌症,如nras突变型黑色素瘤或kras突变型癌症,如kras突变型胰腺导管腺癌(pdac))的患者中可以实现更大和更持久的反应。组合疗法还可以提供较少的副作用和/或使需要其的患者更耐受。
[0014]
具有式(i)的化合物(选择性raf抑制剂)与cdk4/6抑制剂(瑞博西尼)也可以优化nras突变型黑色素瘤中mapk信号的抑制。具有式(i)的化合物和瑞博西尼的组合也可以帮
助预防在nras突变型黑色素瘤或kras突变型pdac中出现对braf和cdk4/6(丝裂原活化蛋白激酶激酶)抑制剂的组合的抗性。
[0015]
对于nras突变型黑色素瘤患者,目前尚无靶向疗法可用于临床研究。raf抑制剂和cdk4/6抑制剂的协同组合可以在患有nras突变型癌症特别是nras突变型黑色素瘤的患者中发挥强大的临床益处。
[0016]
因此,本发明提供了raf抑制剂和cdk4/6抑制剂的药物组合,其中raf抑制剂是具有式(i)的化合物,
[0017][0018]
或其药学上可接受的盐。
[0019]
在另一方面,本发明提供了raf抑制剂和cdk4/6抑制剂的药物组合,其中cdk4/6抑制剂是瑞博西尼或其药学上可接受的盐。
[0020]
在另一方面,本发明提供了raf抑制剂和cdk4/6抑制剂的药物组合,其中
[0021]
(i)raf抑制剂是具有式(i)的化合物或其药学上可接受的盐;以及
[0022]
(ii)cdk4/6抑制剂是瑞博西尼或其药学上可接受的盐。
[0023]
在另一方面,本发明提供了用于在癌症的治疗中使用的这些药物组合。
[0024]
本发明特别涉及用于在癌症的治疗中使用的本发明组合,该癌症的特征在于mapk途径中的激活性突变,并且特别是nras或kras中的一个或多个突变。特别地,本发明的组合可以用于黑色素瘤的治疗,特别是nras突变型黑色素瘤。而且,本发明的组合可以用于胰腺癌的治疗,特别是kras突变型pdac。
[0025]
本发明提供了通过与cdk4/6抑制剂,例如瑞博西尼或其药学上可接受的盐共同施用用于治疗癌症的具有式(i)的化合物。
[0026]
本发明还提供了通过与具有式(i)的化合物或其药学上可接受的盐共同施用用于治疗癌症的瑞博西尼或其药学上可接受的盐。
[0027]
在另一方面,本发明提供了raf抑制剂(其是具有式(i)的化合物)和cdk4/6抑制剂的药物组合在制备用于治疗癌症的药物中的用途。
[0028]
在另一方面,本发明提供了一种在有需要的受试者中治疗癌症的方法,该方法包括向有需要的受试者施用治疗有效量的raf抑制剂(其是具有式(i)的化合物)和cdk4/6抑制剂的药物组合。
[0029]
本发明还提供了治疗癌症的方法,该方法包括同时地、单独地或顺序地向有需要的受试者施用本发明的组合,该组合的量对于所述癌症具有联合治疗有效性。
[0030]
本发明还提供了药物组合物或组合制剂,其包含一定量的本发明组合(该量对癌症具有联合治疗有效性),以及任选地至少一种药学上可接受的载体。
[0031]
本发明还提供了用于在癌症的治疗中使用的组合制剂,该组合制剂包含(a)一个
或多个剂量单位的raf抑制剂,该raf抑制剂选自由以下组成的组:(i)具有式(i)的化合物或其药学上可接受的盐;以及(b)一个或多个剂量单位的cdk4/6抑制剂(优选是瑞博西尼或其药学上可接受的盐)。
[0032]
本发明还提供了商业包装物,该商业包装物包含作为活性成分的本发明的组合和用于向有需要的患者同时、分开或顺序施用本发明的组合的说明书,用于治疗癌症如黑色素瘤,以及特别是nras突变型黑色素瘤或胰腺癌如kras突变型pdac。
[0033]
下面进一步详细描述了本发明的各个方面。另外的定义在整个申请书中陈述。
附图说明
[0034]
具有式(i)的化合物在本文中也称作“lxh254”或“nvp
‑
lxh254”。瑞博西尼在本文中称作“lee011”或“nvp
‑
lee011”。
[0035]
图1:在sk
‑
mel
‑
30黑色素瘤细胞系中,相对于单一处理,具有式(i)的化合物和瑞博西尼的组合在抗增殖和phopho
‑
rb抑制作用中的影响
[0036]
(图1a、图1b、图1c)显示的是,在携带nras(q61k)和braf(d287h)共同突变的sk
‑
mel
‑
30黑色素瘤细胞系中,通过直接细胞增殖测定而测量的瑞博西尼与具有式(i)的化合物的组合的增殖抑制(图1a)、loewe(add)过量抑制(图1b)、和生长抑制(gi)(图1c)的组合矩阵。在所有情况下,沿着底行从左至右显示出增加的瑞博西尼浓度,并且沿着最左列自下至上显示出增加的具有式(i)的化合物的浓度。网格中的所有其余点显示了由对应于两个轴上指示的单一药剂浓度的两种抑制剂的组合产生的抑制百分比。过量抑制矩阵显示实验值(左网格)相对于loewe剂量可加性模型的预测值的过量抑制百分比,loewe剂量可加性模型预测仅由剂量可加性引起的抑制(lehar等人,2009)。正数代表协同作用增强的区域,负数代表拮抗作用的区域。生长抑制(gi)测量基于使用附加的计时起点媒介物参考水平(添加药物的时间点)归一化实验抑制测量。gi测量在两个不同的线性归一化比例部分上产生效果值,其中在计时起点(即在gi=100%)水平有一个“断点”。如果超过停滞点,gi值将>100%(lehar等人,2009)。(图1d)在sk
‑
mel
‑
20细胞中用瑞博西尼和具有式(i)的化合物进行单一药剂或组合处理后,磷酸化的rb1、cdk4/61/2、erk1/2和rsk3的蛋白质印迹分析。在蛋白质印迹图像上方注明了药物处理,包括纳摩尔浓度(nm)。所有样品的药物处理持续时间为48小时。每组图板的右边都注明了要探测的特定蛋白质。
[0037]
图2:在ipc
‑
298黑色素瘤细胞系中,相对于单一处理,具有式(i)的化合物和瑞博西尼的组合证实改善的抗增殖和phopho
‑
rb抑制作用
[0038]
显示的是nras突变型黑色素瘤细胞系ipc298(nrasq61l)中关键信号蛋白的抗增殖作用(图2a、图2b、图2c)和蛋白质分析(图2d)。图2a、图2b、图2c中的实验方案和数据点如以上针对图1所描述的。
[0039]
图3:在meljuso黑色素瘤细胞系中,相对于单一处理,具有式(i)的化合物和瑞博西尼的组合证实改善的抗增殖和phopho
‑
rb抑制作用
[0040]
显示的是nras突变黑色素瘤细胞系meljuso(nrasq61l)中关键信号蛋白的抗增殖作用(图3a、图3b、和图3c)和蛋白质分析(图3d)。图3a、图3b、和图3c中的实验方案和数据点如以上针对图1所描述的。
[0041]
图4:在meljuso黑色素瘤细胞系中,相对于单一处理,具有式(i)的化合物和瑞博
西尼的组合证实改善的抗增殖和phopho
‑
rb抑制作用
[0042]
显示的是nras突变黑色素瘤细胞系sk
‑
mel
‑
2(nrasq61r)中关键信号蛋白的抗增殖作用(图4a、图4b、和图4c)和蛋白质分析(图4d)。图4a、图4b、和图4c中的实验方案和数据点如以上针对图1所描述的。
[0043]
图5:具有式(i)的化合物和瑞博西尼在九个衍生自患者的nrasmut黑色素瘤肿瘤异种移植的小鼠模型中的抗肿瘤活性。
[0044]
每个条形图代表在衍生自个体患者异种移植(pdx)模型中,每种处理所获得的最佳反应(绘制为3
‑
5只小鼠/处理的平均值)。每种处理的模型按以下顺序从左到右绘制:hmex20864、hmex20744、hmex4339、hmex5727、hmex21124、hmex3486、hmex20667、hmex20585、和hmex2921。
[0045]
图6:在具有式(i)的化合物、瑞博西尼的单一药剂或两者的组合的每日处理期间肿瘤达到700mm3大小的卡普兰
‑
梅尔(kaplan
‑
meier)时间图
[0046]
当每个模型的平均肿瘤大小为350mm3左右时开始处理,并且在研究持续期间所有动物都接受连续的每日药物处理。当对动物处理>/=90天或肿瘤大小达到>/=700mm3时,终止研究。与每种单一药剂或未经处理的对照相比,组合组的存活曲线具有统计学意义[*p<0.05对数秩(曼特尔
‑
考克斯(mantel
‑
cox)检验)]。
具体实施方式
[0047]
本发明提供特别地用于在癌症的治疗中使用的药物组合,该组合包含(a)raf抑制剂,该raf抑制剂是如本文定义的具有式(i)的化合物或其药学上可接受的盐;和(b)cdk4/6抑制剂。
[0048]
如本文使用的,术语“raf抑制剂”是指b
‑
raf蛋白激酶(本文也称为b
‑
raf、braf或b
‑
raf)和c
‑
raf蛋白激酶(本文也称为c
‑
raf、craf或c
‑
raf)的三磷酸腺苷(atp)竞争性抑制剂。raf抑制剂优选地抑制raf单体和raf二聚体两者。
[0049]
具有式(i)的化合物具有以下结构:
[0050][0051]
为方便起见,将该化合物及其盐的组统称为“具有式(i)的化合物”或“化合物(i)”,意指提及“具有式(i)的化合物”或“化合物(i)”将指可替代的任何化合物或其药学上可接受的盐。
[0052]
raf抑制剂即具有式(i)的化合物及其药学上可接受的盐描述于wo 2014/151616(通过引用以其全文特此并入)中,并且其制备方法已描述于例如其中的实例1156中。具有式(i)的化合物是有效且选择性的抑制剂,其在生化测定中以亚nm抑制浓度50%(ic50)值
靶向braf和craf激酶两者,同时以相似的程度抑制456种激酶中的仅两种(盘状蛋白结构域受体酪氨酸激酶1(ddr1)和血小板源生长因子受体,β多肽(pdgfrβ))的结合。已证明具有式(i)的化合物在多种mapk途径驱动的人癌细胞系和体内肿瘤异种移植中有效,该体内肿瘤异种移植包括在kras、nras和braf癌基因中携带活化损伤的模型。例如,具有式(i)的化合物对表达kras中的突变的人胰腺癌细胞系表现出低um范围的活性(参见wo/2018/203219a1,实例1b,表2)。
[0053]
本发明的药物组合进一步包含cdk4/6抑制剂。d
‑
细胞周期蛋白
‑
cdk4/6
‑
rb1轴是mapk信号下游的控制细胞从细胞周期的g1至s期转变的主要效应子途径。
[0054]
用于本发明的合适的cdk4/6抑制剂包括瑞博西尼或其药学上可接受的盐,和帕博西尼(palbociclib)或其药学上可接受的盐。
[0055]
用于本发明药物组合的cdk4/6抑制剂包括瑞博西尼或帕博西尼。
[0056]
瑞博西尼是一种口服生物可利用的且高选择性的小分子抑制剂,对cdk4/细胞周期蛋白
‑
d1和cdk6/细胞周期蛋白
‑
d3酶复合体具有高度特异性的抑制活性。瑞博西尼的特别有用的盐是其琥珀酸盐。
[0057]
本发明进一步涉及药物组合,该药物组合包含(a)raf抑制剂(其是如本文定义的具有式(i)的化合物或其药学上可接受的盐);和(b)cdk4/6抑制剂,特别地用于同时地、单独地或顺序地治疗癌症。
[0058]
在下面和整个申请中定义所选择的术语。使用标准命名法描述本发明的化合物。除非另外限定,否则本文使用的所有技术术语和科学术语均具有与本发明所属领域的技术人员通常理解的相同的含义。除非另有说明,否则以下通用定义应当适用于本说明书。
[0059]
如本文所用,术语“本发明的组合”是指(a)raf抑制剂(其是具有式(i)的化合物或其药学上可接受的盐)和(b)cdk4/6抑制剂(优选是瑞博西尼(ribociclib))或其药学上可接受的盐的药物组合。如本文所用,术语“本发明的组合”也是指(a)raf抑制剂(其是具有式(i)的化合物或其药学上可接受的盐)和(b)cdk4/6抑制剂(优选是瑞博西尼(ribociclib))或其药学上可接受的盐的共同施用或组合施用。根据本发明,具有式(i)的化合物或其药学上可接受的盐和cdk4/6抑制剂(优选瑞博西尼或其药学上可接受的盐)可以通过包括这两种化合物的单一药物组合物的同时施用来以组合采用。可替代地,能以分开的药物组合物单独施用组合,每种药物组合物以顺序方式包含raf抑制剂和cdk4/6抑制剂,其中例如,首先施用raf抑制剂或cdk4/6抑制剂,并且接下来施用另一种。这种顺序施用可以在时间上接近(例如,同时地)或在时间上远离。
[0060]
除非本文另外指示或与上下文明显矛盾,否则在描述本发明的上下文中,如本文使用的术语“一个/种(a/an)”和“该(the)”以及类似提及应解释为包括单数和复数二者。当复数形式用于化合物、盐等时,这也意指单数的化合物、盐等。
[0061]
除非上下文另有明确说明,否则术语“或”在本文中用于表示术语“和/或”并且可与术语“和/或”互换使用。
[0062]“约”和“大约”通常意指在给定测量的性质或精度的情况下测量的量的可接受的误差度。示例性误差度在给定值或值范围的20%内,典型地在10%内,并且更典型地,在5%内。当将本文中的剂量描述为“约”指定量时,实际剂量可以从该量变化高达10%:这种“约”的使用承认,给定剂型中的精确量可能由于各种原因而与预期量略有不同,但不会实质上
影响所施用化合物的体内作用。
[0063]
当将本文中的剂量描述为指定量时,即,不使用术语“约”,实际剂量可以从该量变化高达10%(优选高达5%):这种使用承认,给定剂型中的精确量可能由于各种原因而与预期量略有不同,但不会实质上影响所施用化合物的体内作用。
[0064]
除非另外指明,否则术语“包含”和“包括”在本文中以其开放式和非限制性的含义使用。
[0065]“组合”或“与
……
组合”或“共同施用”并不旨在暗示必须物理混合或同时施用疗法或治疗剂和/或配制这些治疗剂用于一起递送,尽管这些递送方法在本文所述的范围内。这些组合中的治疗剂可以与一种或多种其他另外的疗法或治疗剂同时、在其之前或之后施用。可以按任何顺序施用治疗剂。一般而言,每种药剂将以针对该药剂所确定的剂量和/或时间排程施用。还应理解,该组合中使用的另外的治疗剂可以按单一组合物一起施用或按不同组合物单独施用。一般而言,预期组合中使用的另外的治疗剂以不超过它们单独使用时的水平使用。在一些实施例中,组合中使用的水平将低于单一药剂疗法中使用的水平。
[0066]
本发明的组合具有治疗或保护功能或两者。例如,可以将这些分子施用人受试者,以治疗和/或预防多种障碍,如本文所述的癌症。
[0067]
如本文使用的,术语“组合”、“治疗性组合”或“药物组合”是指在一个剂量单位形式中的固定组合、或非固定组合、或用于组合施用(共同施用)的套装盒(kit of parts),其中两种或更多种治疗剂可以一起、在同一时间独立地或在时间间隔内单独地施用,尤其在这些时间间隔允许组合配偶体显示合作(例如协同)效应的情况下。
[0068]
术语“组合疗法”是指施用两种或更多种治疗剂以治疗本披露中描述的治疗性病症或障碍。这种施用涵盖以基本上同时的方式共同施用这些治疗剂,如以具有固定比率的活性成分的单个配制品施用或以每种活性成分的单独配制品(例如,胶囊和/或静脉内配制品)施用。此外,这种施用和共同施用也涵盖在大致相同的时间或在不同的时间以顺序或单独的方式使用每种类型的治疗剂。无论活性成分是作为单一配制品施用还是以分开的配制品施用,将药物作为同一疗程的一部分施用同一患者。在任何情况下,治疗方案将在治疗本文所述的病症或障碍方面提供有益作用。
[0069]
在本发明的含义内,同时的治疗性使用是指通过相同途径并同时或基本上同时施用至少两种活性成分。
[0070]
在本发明的含义内,单独使用特别是指通过不同途径同时或基本上同时施用至少两种活性成分。
[0071]
顺序的治疗性使用是指在不同的时间施用至少两种活性成分,施用途径相同或不同。更特别地,施用方法意指根据该方法,在一种或多种其他活性成分开始施用之前进行一种活性成分的全部施用。
[0072]
如本文使用的,术语“固定组合”、“固定剂量”和“单一配制品”是指配制的单一载体或媒介物或剂型,以向患者递送一定量的两种治疗剂,该量对于癌症的治疗具有联合治疗有效性。单一媒介物被设计为递送一定量的每种药剂连同任何药学上可接受的载体或赋形剂。在一些实施例中,媒介物是片剂、胶囊剂、丸剂或贴剂。在其他实施例中,媒介物是溶液或悬浮液。
[0073]
术语“非固定组合”或“套装盒”意指本发明组合的治疗剂作为分开的实体同时地、
并行地或顺序地施用至患者(没有特定的时间限制),其中这种施用在有需要的受试者体内提供治疗有效水平的两种化合物。后者也适用于混合物疗法,例如三种或更多种活性成分的施用。
[0074]
如本文使用的,术语“药学上可接受的”是指在合理医学判断的范围内适合用于与受试者(例如,哺乳动物或人)的组织相接触而无过度毒性、刺激、过敏反应和其他问题或并发症,并且与合理的益处/风险比相称的那些化合物、材料、组合物和/或剂型。
[0075]
如本文使用的,术语“药学上可接受的赋形剂”或“药学上可接受的载体”包括如本领域技术人员应已知的任何和所有溶剂、分散介质、包衣、表面活性剂、抗氧化剂、防腐剂(例如,抗细菌剂、抗真菌剂)、等渗剂、吸收延迟剂、盐、防腐剂、药物、药物稳定剂、粘合剂、赋形剂、崩解剂、润滑剂、甜味剂、调味剂、染料、类似材料及其组合。除了任何常规载体与活性成分不相容的情况外,考虑了其在治疗或药物组合物中的用途。
[0076]
术语“药物组合物”在本文中被定义为是指包含有待施用受试者(例如,哺乳动物或人)的至少一种治疗剂的混合物或溶液,以治疗影响该受试者的特定疾病或病症。本发明的药物组合可以配制成合适的药物组合物用于肠内或肠胃外施用,例如糖衣片剂、片剂、胶囊或栓剂或安瓿剂。如果未另外指明,那么这些以本身已知的方式进行制备,例如借助各种常规的混合、粉碎、直接压片、制粒、糖包衣、溶解、冻干方法或对本领域技术人员来说显而易见的制造技术。应当理解,包含在每种剂型的单独剂量中的组合配偶体的单位含量本身不必构成有效量,因为必需的有效量可以通过施用多个剂量单位达到。该药物组合物可以含有约0.1%至约99.9%、优选地约1%至约60%的一种或多种治疗剂。本领域普通技术人员可以关于剂型的特定所希望的特性,通过常规实验而没有任何不适的负担来选择前述载体中的一种或多种。所使用的每种载体的量可以在本领域常规的范围之内变化。以下参考文献披露了用于配制口服剂型的技术和赋形剂:the handbook of pharmaceutical excipients[药用辅料手册],第4版,rowe等人编,american pharmaceuticals association[美国药师协会](2003年);以及remington:the science and practice of pharmacy[雷明顿:药学的科学与实践],第20版,gennaro编,lippincott williams&wilkins[威尔金斯出版公司](2003)。这些任选的附加的常规载体可以掺入到口服剂型中,方式为在制粒之前或期间将一种或多种常规载体掺入到初始混合物中,或将一种或多种常规载体与包含药剂组合的颗粒或呈口服剂型的药剂组合的单独药剂组合。在后一个实施例中,组合的混合物可以进一步共混(例如通过v
‑
共混器),然后压制或模塑成片剂(例如整块片剂)、用胶囊包封,或填充到小袋中。
[0077]
药物组合物可以按每单位剂量包含预定量的活性成分的单位剂型呈现。在某些实施例中,单位剂量包括一种或多种媒介物,使得每种媒介物包括有效量的至少一种治疗剂连同药学上可接受的载体和赋形剂。在一些实施例中,单位剂量是在相同时间施用患者的一种或多种片剂、胶囊、丸剂、注射剂、输注剂、贴剂等。如本领域技术人员已知的,活性成分/剂量的量将取决于所治疗的病症;施用途径;以及患者的年龄、体重和健康状况。优选的单位剂量组合物是含有活性成分的每日剂量或亚剂量、或其适当部分的那些。此外,此类药物组合物可以通过药学领域熟知的任何方法制备。
[0078]
本发明的药物组合物可以包括“治疗有效量”或“有效量”的本发明化合物。治疗剂组合的术语“药学有效量”、“治疗有效量”或“临床有效量”是以必要的剂量和在必要的时间
段内足以提供超过用该组合治疗的障碍的临床可观察的体征和症状的基线的、可观察的或临床上显著改善的量。治疗有效量将根据以下因素而变化:如个体的疾病状态、年龄、性别、和体重。治疗有效量也是治疗有益效果超过治疗剂的任何毒性或有害作用的量。“治疗有效剂量”优选地以所需方式调节可测量的参数,例如肿瘤生长速率或疾病进展。可以在预测人肿瘤中的功效的动物模型系统中评估化合物调节可测量参数的能力,以帮助建立合适的剂量水平和方案。可替代地,组合物的此性质可以通过使用本领域技术人员已知的体外测定检查化合物调节不希望的参数的能力来评估。
[0079]
如本文使用的,术语“联合治疗活性”或“联合治疗作用”意指可以将治疗剂在其优选的时间间隔内联合地、单独地或顺序地给予,使得待治疗的受试者(特别是人)仍显示出(优选地协同性)相互作用(联合治疗作用)。情况是否如此尤其可以通过以下方式确定:跟踪化合物的血液水平,证实两种化合物至少在某些时间间隔期间皆存在于待治疗的人的血液中。
[0080]
如本文使用的,术语“药剂”应理解为意指在组织、系统、动物、哺乳动物、人或其他受试者中产生所希望作用的物质。还应理解,“药剂”可以是单一化合物、或两种或更多种化合物的组合或组合物。
[0081]
术语“癌症”优选地是癌症。
[0082]
如本文使用的,术语“癌症”是指以异常细胞的不希望和不受控制的生长为特征的疾病。癌细胞可以局部或通过血流和淋巴系统扩散到身体的其他部位。如本文所用,术语“癌症”或“肿瘤”包括恶化前以及恶性癌症和肿瘤。术语“癌症”在本文中用于意指广谱的肿瘤,包括所有实体瘤和血液恶性肿瘤。
[0083]
术语“增殖性疾病”或“增殖性障碍”还是指一般癌症或如本文定义的癌症。
[0084]“口服剂型”包括开处方或意欲用于口服施用的单位剂型。
[0085]
如本文使用的,术语“治疗(treat、treatment和treating)”是指由施用一种或多种疗法导致的障碍(例如增殖性障碍)的进展、严重性和/或持续时间的减少或缓解,或者障碍的一种或多种症状(适当地,一种或多种可辨别的症状)的缓解。在具体的实施例中,术语“治疗(treat、treatment和treating)”是指改善增殖性障碍的至少一种可测量的物理参数,如肿瘤的生长,这不一定是患者可辨别的。在其他实施例中,术语“治疗(treat、treatment和treating)”是指通过例如稳定可辨别的症状来物理地,或通过例如稳定物理参数来生理地,或通过两者,抑制增殖性障碍的进展。在其他实施例中,术语“治疗(treat、treatment和treating)”是指减少或稳定肿瘤大小或癌细胞计数。
[0086]
术语“治疗(treat、treatment和treating)”包括降低患者或患者群体中的不良事件(ae)和严重ae(sae)的发生率和严重性,包括实验室值、生命体征和心电图(ecg)的变化。
[0087]
术语“治疗(treat、treatment和treating)”包括改善患者或患者群体中的整体反应率(orr)、疾病控制率(dcr)、反应持续时间(dor)、无进展存活期(pfs),例如,根据实体瘤反应评估标准(recist)版本1.1。
[0088]
在本披露的含义范围内,术语“治疗”还表示阻止、延迟发作(即在疾病的临床表现之前的时间段)和/或降低疾病发展或疾病恶化的风险。术语“保护”在本文中用于表示阻止、延迟或治疗,或者视情况而定既阻止、延迟又治疗受试者(例如哺乳动物或人)体内疾病的发展、持续或恶化。
[0089]
如本文使用的,术语“受试者”或“患者”旨在包括易于患有癌症或任何障碍(直接或间接涉及癌症)或受其折磨的动物。受试者的实例包括哺乳动物,例如人、猿、猴、狗、乳牛、马、猪、绵羊、山羊、猫、小鼠、兔、大鼠和转基因非人动物。在一个优选的实施例中,受试者是人,例如患有、有风险患有或潜在能患有癌症(例如癌症)的人。
[0090]
术语“抑制”、“抑制剂”或“拮抗剂”包括给定分子或途径的某些参数(例如活性)的降低。例如,此术语包括将靶激酶(raf或cdk4/6)的活性抑制5%、10%、20%、30%、40%或更多。因此,抑制可以是但不必是100%。
[0091]
如本文使用的,“盐”(其由“或其多种盐”或“或其一种盐”表示)可以单独存在或以与本发明组合的游离化合物(例如raf抑制剂即具有式(i)的化合物或cdk4/6抑制剂(优选瑞博西尼))的混合物存在,并且优选地是药学上可接受的盐。优选由具有碱性氮原子的本发明组合的化合物与有机酸或无机酸形成此类盐,例如作为酸加成盐,尤其是药学上可接受的盐。术语“药学上可接受的盐”是指保留化合物的生物有效性和特性的盐,并且这些盐典型地不是生物学上或其他方面不希望的。由于氨基基团的存在,化合物可能能够形成酸加成盐。
[0092]
合适的盐的列表可见于“remington’s pharmaceutical sciences[雷明顿药物科学]”,第20版,mack publishing company[麦克出版公司],伊斯顿(easton),宾夕法尼亚州(pa.),(1985);新版本:“remington:the science and practice of pharmacy[雷明顿:药学科学与实践]”,第22版,pharmaceutical press,london[伦敦医药出版社](2012);以及stahl和wermuth的“handbook of pharmaceutical salts:properties,selection,and use[药物盐手册:特性、选择和使用]”(wiley
‑
vch出版社,德国魏因海姆,2011)。
[0093]
出于分离或纯化的目的,还可能使用药学上不可接受的盐,例如苦味酸盐或高氯酸盐。对于治疗用途,仅使用药学上可接受的盐或游离化合物(适用于药物制剂形式的情况下),并且因此这些是优选的。鉴于游离形式的新颖的化合物与呈其盐(包括例如在新颖化合物的纯化或鉴定中可用作中间体的那些盐)形式的化合物之间的密切关系,任何对游离化合物的提及应理解为在适当和方便的情况下也指相应的盐。在本发明的组合中使用的化合物的盐优选是药学上可接受的盐;形成药学上可接受的盐的合适的反荷离子是本领域已知的。除非文中另有说明或明确指出,否则提及本文提供的药物组合中有用的治疗剂包括化合物的游离碱和化合物的所有药学上可接受的盐。
[0094]
如本文使用的,术语“协同作用”是指两种药剂的作用,这两种药剂例如像,raf抑制剂即具有式(i)的化合物或其药学上可接受的盐、和cdk4/6抑制剂(优选瑞博西尼或其药学上可接受的盐),以产生如下作用,例如减缓癌症或其症状的症状进展,这比自身施用的每种药物的作用的简单加和要大。
[0095]
在一个实施例中,本发明的组合包含(a)raf抑制剂,该raf抑制剂是具有式(i)的化合物
[0096][0097]
或其药学上可接受的盐;以及(b)cdk4/6抑制剂。
[0098]
在一个实施例中,本发明的组合包含(a)raf抑制剂具有式(i)的化合物
[0099][0100]
或其药学上可接受的盐,以及(b)cdk4/6抑制剂,该cdk4/6抑制剂选自瑞博西尼和帕博西尼,和其药学上可接受的盐。该cdk4/6抑制剂优选是瑞博西尼或其药学上可接受的盐。
[0101]
与细胞系和人异种移植物模型(参见实例)中的任一单一药剂疗法相比,本发明的组合证明了肿瘤应答的增加的深度和持久性,并因此对于癌症的治疗可能是有效的。因此,本发明提供了使用raf抑制剂(其是具有式(i)的化合物或其药学上可接受的盐)与cdk4/6抑制剂(并且特别是瑞博西尼或其药学上可接受的盐)组合的组合物和方法,用于治疗实体瘤,特别是携带一个或多个mapk途径改变的肿瘤(例如,nras突变型癌症和kras突变型癌症)。
[0102]
优选地,将这些治疗剂按治疗有效的剂量施用,当组合时其提供有益的作用。本发明特别涉及本发明的组合,其可用于向有需要的受试者进行单独、同时或顺序施用以治疗癌症。可替代地阐明,本发明特别涉及用于在癌症的治疗中使用的本发明的组合。
[0103]
癌症的性质是多因素的。在某些情况下,可以组合具有不同作用机制的治疗剂。然而,仅考虑具有不同作用方式的治疗剂的任何组合并不一定导致具有有利效果的组合,并且不一定转化为患有某些癌症的患者的临床益处。
[0104]
在本发明中,预期本发明的组合的施用会产生更有益的作用,例如协同的或改善的抗增殖作用,例如关于延缓进展或抑制癌症或其症状,并且还可能提供另外有益的作用,如以下任何一种或多种:与现有技术中的任何疗法或与任何一种组合配偶体的单一疗法相比,与皮肤相关的毒性(例如皮疹)和胃肠道毒性(例如腹泻)的副作用更少、耐受性改善、生
活质量更高且发病率降低。
[0105]
本发明的组合的治疗剂可以单独地、同时地或顺序地施用有需要的受试者。优选地,将这些治疗剂按治疗有效的剂量施用,当组合时其提供有益的作用。因此,在本发明的一个实施例中,本发明的组合用于在癌症特别是如本文所描述的癌症的治疗中使用。
[0106]
术语“癌症”在本文中用于意指广谱的肿瘤,包括所有实体瘤和血液恶性肿瘤。癌症可以处于早期、中期或晚期阶段。癌症可以是局部晚期的或转移性的。
[0107]
通过本文所述的组合疗法治疗的癌症可能在标准治疗后已经进展,或者对于其没有有效的标准疗法。
[0108]
在一个实施例中,癌症是黑色素瘤。
[0109]
本发明的组合特别地可用于治疗癌症,例如携带一个或多个丝裂原活化蛋白激酶(mapk)途径改变的癌症,例如nras
‑
突变型肿瘤,并且特别地是,如本文所述的表达ras的至少一种功能获得性突变的肿瘤,和/或如本文所述的raf的至少一种功能获得性突变。
[0110]
包括nras突变型癌症或肿瘤。感兴趣的nras突变可选自g12c、g12r、g12d、g12v、g12s、g12a、g13r、g13d、g13c、g13a、g13、g13s、g13v、q61r、q61l、q61k、q61h、q61p和q61e。术语“nras突变型”肿瘤或癌症包括展现突变的nras蛋白(特别是功能获得性nras突变)的任何肿瘤;尤其是任何g13r、q61k、q61l、q61r、nras突变型肿瘤。因此,nras突变型黑色素瘤包括具有至少一个对应于q61k、q61l或q61r的nras突变的黑色素瘤。癌症可以是nras qg13r突变型黑色素瘤。还包括kras突变型癌症或肿瘤。感兴趣的kras突变可选自g12c、g12r、g12d、g12v、g12s、g12a、g13r、g13d、g13c、g13a、g13、g13s、g13v、q61r、q61l、q61k、q61h、q61p和q61e。术语“kras突变型”肿瘤或癌症包括展现突变的kras蛋白质的任何肿瘤。癌症可以处于早期、中期或晚期阶段。癌症可以是局部晚期的或转移性的。
[0111]
在另一个实施例中,癌症对于标准治疗具有抗性或难治性。
[0112]
在另一个实施例中,癌症对于用达卡巴嗪的标准治疗具有抗性或难治性。
[0113]
在另一个实施例中,癌症对于用mek抑制剂的治疗具有抗性或难治性。
[0114]
在另一个实施例中,癌症对与用免疫疗法的治疗(包括使用一种或多种免疫检查点抑制剂的疗法)具有抗性或难治性。
[0115]
在另一个实施例中,癌症对于用细胞毒素剂如亚硝基脲和/或丝裂霉素c的治疗具有抗性或难治性。
[0116]
在一个实施例中,癌症的特征在于选自包含nras蛋白的组的至少一个突变。
[0117]
在一实施例中,癌症的特征在于nras突变。
[0118]
在一个实施例中,本发明的组合涉及用于治疗癌症特别是黑色素瘤的方法。
[0119]
本发明的组合在nras突变型黑色素瘤的治疗中尤其有用。
[0120]
在一个实施例中,癌症的特征在于选自包含kras蛋白的组的至少一个突变。
[0121]
在一实施例中,癌症的特征在于kras突变。
[0122]
在一个实施例中,本发明的组合涉及用于治疗癌症,特别是胰腺癌的方法。
[0123]
本发明的组合在kras突变型pdac的治疗中尤其有用。
[0124]
在一个实施例中,本文提供了用于在有需要的受试者中治疗癌症的方法,该方法包括施用治疗有效量的本发明的药物组合,该药物组合包含(a)raf抑制剂(其是如本文定义的具有式(i)的化合物或其药学上可接受的盐),和(b)cdk4/6抑制剂。在优选的实施例,
cdk4/6抑制剂是瑞博西尼或其药学上可接受的盐。
[0125]
在一个实施例中,本文提供了用于在有需要的受试者中治疗癌症的方法,该方法包括向有需要的受试者以针对所述癌症是联合治疗有效的量同时地、单独地或顺序地施用本发明的组合,其中本发明组合包含(a)raf抑制剂(其是如本文定义的具有式(i)的化合物或其药学上可接受的盐),和(b)cdk4/6抑制剂。在优选的实施例,cdk4/6抑制剂是瑞博西尼或其药学上可接受的盐。
[0126]
在另外的实施例中,本发明特别涉及治疗携带一个或多个丝裂原活化蛋白激酶(mapk)途径改变的癌症的方法。在一个实施例中,本发明涉及治疗癌症的方法,该癌症的特征在于在nras中的至少一个突变。在另一个实施例中,本发明涉及治疗癌症的方法,该癌症的特征在于在kras中的至少一个突变。在一个实施例中,本发明涉及本发明组合用于制备治疗癌症特别是如本文所描述的癌症的药物的用途。在一个实施例中,本发明的组合用于制备用于治疗癌症的药物。
[0127]
在另外的实施例中,本发明涉及本发明的组合用于制备治疗以mapk途径中的功能获得性突变为特征的癌症的药物的用途。
[0128]
在一个实施例中,本文提供的组合或组合物、或两者展示出协同作用。
[0129]
因此,在一方面,本发明可以提供通过使用一种抗癌化合物与另一种抗癌化合物的组合来增强该抗癌化合物的功效的方法,特别是使用raf抑制剂(其是如本文定义的具有式(i)的化合物或其药学上可接受的盐)和cdk4/6抑制剂(适合地是瑞博西尼或其药学上可接受的盐)的方法,以提供通过施用相似剂量的作为单一药剂(单一疗法)的具有式(i)的化合物或其药学上可接受的盐或cdk4/6抑制剂无法获得的增强的功效。
[0130]
本发明提供的另外的益处可以是可以使用较低剂量的本发明组合的治疗剂,例如,这样使得剂量不仅可以通常更小,而且还可以不频繁地施用,或可以按顺序使用以减少仅使用组合配偶体之一观察到的副作用的发生率。
[0131]
在一些实施例中,相对于单一药剂剂量水平,如本文定义的具有式(i)的化合物或其药学上可接受的盐和/或cdk4/6抑制剂(优选瑞博西尼或其药学上可接受的盐)可以以治疗剂量或低于治疗剂量施用。在某些实施例中,实现抑制(例如,生长抑制或肿瘤缩小)所需的一种治疗剂的浓度或剂量比当使用另一治疗剂时或与第一治疗剂组合施用时、比单独施用每种治疗剂时更低。在某些实施例中,在组合疗法中,实现抑制(例如,生长抑制)所需的一种治疗剂的浓度或剂量比作为单一疗法的治疗剂量更低,例如低10%
‑
20%、20%
‑
30%、30%
‑
40%、40%
‑
50%、50%
‑
60%、60%
‑
70%、70%
‑
80%、或80%
‑
90%。
[0132]
在确定一种或多种组分之间的协同相互作用时,可以通过向需要治疗的患者施用不同w/w比率的范围和剂量的组分来最终测量针对作用的最佳范围和针对作用的每种组分的绝对剂量范围。对于人而言,对患者进行临床研究的复杂性和成本可能使得使用这种测试形式作为协同作用的主要模型变得不切实际。然而,在某些实验中观察到的协同作用可以预测在其他物种中的作用,并且可以将现有的动物模型用于进一步量化协同作用。在一种物种中观察到的协同作用可以预测在其他物种中的作用,并且使用如本文所述的动物模型可以测量协同作用,并且还可以将此类研究的结果用于通过应用药代动力学/药效学(pk/pd)方法预测其他物种所需的有效剂量比率范围和绝对剂量、以及血浆浓度。在肿瘤模型与在人中观察到的作用之间已建立的相关性表明,可以例如通过异种移植物模型或在适
当的细胞系中证明动物体内的协同作用。通过已建立的测试模型可以表明,本发明的组合产生了本文所述的有益作用。本领域技术人员完全能够选择相关的测试模型来证明这样的有益作用。本发明的组合的药理学活性可以例如在临床研究中或如在本文基本描述的体内或体外测试方法中得到证明。
[0133]
组合(换言之,将一种治疗剂与另一种组合配偶体一起施用,即“共同施用”)的施用包括以单一配制品或单位剂型施用组合,同时但单独地施用该组合的各个剂,或通过任何合适的途径顺序地施用组合的各个剂。可以将本发明的组合的各个组合配偶体在治疗过程中的不同的时间单独地施用,或以分开的或单一的组合形式以任何顺序地或并行地施用,例如同时地施用,或以联合治疗有效量,优选地以协同有效量,例如以对应于本文所述的量的每日剂量或间隔(即,非每日)剂量施用。
[0134]
用于在本文所披露的方法、治疗、组合和组合物中使用的具有式(i)的化合物或其药学上可接受的盐是braf和craf的强效抑制剂。在一些实施例中,将具有式(i)的化合物或其药学上可接受的盐口服施用。在一个实施例中,将具有式(i)的化合物或其药学上可接受的盐以约200
‑
1200mg、约300
‑
1000mg、约400
‑
800mg、或约500
‑
600mg的总日剂量施用(例如,每日一次)。具有式(i)的化合物或其药学上可接受的盐可以以约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg约550mg、约600mg、约650mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg或约1200mg的总日剂量施用。在优选的实施例中,具有式(i)的化合物或其药学上可接受的盐可以以选自约200mg、400mg、600mg、800mg和1200mg的总日剂量施用。
[0135]
具有式(i)的化合物或其药学上可接受的盐的总剂量,可以每日一次施用或可以分成两份,每个剂量的具有式(i)的化合物每日两次施用,其中实际施用剂量和施用时间由多个标准确定,如患者年龄、体重和性别;待治疗的癌症的程度和严重性;和主治医师的判断。优选地,将具有式(i)的化合物的总剂量每日一次施用。在另一个优选的实施例中,将具有式(i)的化合物的总剂量每日两次施用。
[0136]
作为根据本发明的组合的一部分的cdk4/6抑制剂以治疗有效量施用有需要的受试者。
[0137]
在优选的实施例中,在有需要的受试者中每日施用的、作为根据本发明的组合的一部分的cdk4/6抑制剂瑞博西尼或其药学上可接受的盐的总日剂量的量将选自每日从约100mg至约600mg;适合地,该量将选自每日约200mg至约400mg。在优选的实施例中,瑞博西尼或其药学上可接受的盐以选自约100、约200mg、约400mg和约600mg的日剂量施用。可替代地,总剂量可以分为两份剂量,将其每日两次施用。
[0138]
特别地,可以设想以下每日剂量:
[0139][0140]
在本文中提及剂量(dose/dosage)时,提及的量是指治疗剂的量。例如,当施用200mg剂量的瑞博西尼并且将瑞博西尼以含有瑞博西尼琥珀酸盐的片剂施用时,该片剂将含有相当于200mg瑞博西尼的瑞博西尼琥珀酸盐。
[0141]
在一些实施例中,将瑞博西尼或其药学上可接受的盐口服施用。在一个实施例中,制备瑞博西尼用于经由口服递送施用,并且可以盐形式使用,例如琥珀酸盐形式。在一些实施例中,以片剂形式制备化合物用于口服施用。能以多种剂量生产片剂,以便灵活施用。
[0142]
可以将瑞博西尼的剂量或其药学上可接受的盐每日一次、或每日两次、或每日三次、或每日四次施用。可以将瑞博西尼或其药学上可接受的盐的总日剂量每日一次或两次施用。
[0143]
例如,作为组合疗法的一部分,具有式(i)的化合物或其药学上可接受的盐可以以约200mg、约400mg、约600mg、约800mg或约1200mg的总日剂量施用,以及瑞博西尼,例如以琥珀酸盐的形式,可以以选自约100mg、约200mg、约400mg和约600mg的总日剂量施用。可以将具有式(1)的化合物的日剂量每日一次或两次施用。因此,可以将剂量为约200mg的具有式(i)的化合物以每日两次施用(总日剂量约400mg),并且可以将剂量为约100mg或约200mg的瑞博西尼以每日一次施用。可替代地,可以将剂量为约200mg的具有式(i)的化合物以每日两次施用(总日剂量约400mg),并且可以将剂量为约100mg或约200mg的瑞博西尼以每日两次施用。
[0144]
可替代地,可以将具有式(i)的化合物以600mg一天两次施用(b.i.d或bid)以及将瑞博西尼以600mg一天一次施用。也可以将具有式(i)的化合物以400mg一天两次施用(b.i.d或bid)以及将瑞博西尼以200mg一天一次施用。
[0145]
优选地将具有式(i)的化合物连续地施用,即没有药物假期。
[0146]
cdk4/6抑制剂也可以连续施用,即在治疗期间没有间断或没有药物假期。
[0147]
例如,cdk4/6抑制剂,例如瑞博西尼或其药学上可接受的盐可以以施用3周停止1周,或施用2周停止2周的方式施用;优选地施用3周停止1周。特别地,根据本发明可以使用以下方案:
[0148][0149]
b.i.d.或bid:一天两次
[0150]
qd或qd:一天一次
[0151]
例如,具有式(i)的化合物可以一天一次或两次无药物假期地给予,并且cdk4/6抑制剂(例如瑞博西尼或其药学上可接受的盐)可以以施用三周停止一周的方式施用。
[0152]
在设想的药物方案中,具有式(i)的化合物和cdk4/6抑制剂的总日剂量如上文和整个说明书中所描述。
[0153]
例如,可以一天一次或两次,优选一天两次,给予400mg或600mg的剂量的具有式(i)的化合物,并且可以一天一次,施用三周停止一周给予200mg的剂量的瑞博西尼。
[0154]
例如,可以一天一次或两次,优选一天两次,给予600mg的剂量的具有式(i)的化合物,并且可以一天一次,施用三周停止一周给予600mg的剂量的瑞博西尼。
[0155]
根据本文披露的方法,具有式(i)的化合物或其药学上可接受的盐和cdk4/6抑制剂,优选瑞博西尼或其药学上可接受的盐可以一起使用。取决于预期的给药剂量和频率,两种化合物能一起施用或单独施用,因为预期本发明的治疗可以持续如治疗医师认为合适的以及进一步使用本文所述的确定合适的剂量和施用频率的方法指导的2天、3天、4天、5天、6天、1周、2周、3周、4周或超过4周。剂量的频率可以根据所使用的化合物和待治疗的具体病症而变化。通常,优选使用足以提供有效治疗的最小剂量,并且其可以通过以下标准来确定,例如患者的年龄、体重和性别;待治疗的癌症的程度和严重性;和主治医师的判断。通常可以使用适合于正在治疗的病症的测定法来监测患者的治疗效果,这些测定法为本领域的普通技术人员所熟悉。
[0156]
产生功效而无毒性的本发明组合的组合配偶体(即,具有式(i)的化合物或其药学上可接受的盐、和cdk4/6抑制剂(适合地瑞博西尼或其药学上可接受的盐))的最佳比率、单个剂量和组合剂量、以及浓度是基于治疗剂对靶部位的可用性的动力学和多种因素,这些因素包括但不限于疾病的进展程度;个体的年龄、体重、总体健康状况、性别和饮食;施用的
时间和途径;以及个体正在服用的其他药物。可以使用本领域熟知的常规测试和程序来确定最佳剂量。例如,如由治疗情况的紧急状态所指示的,可以施用单次推注,可以随着时间的推移施用若干个分次剂量,或可以按比例地减少或增加剂量。
[0157]
可以通过任何合适的途径施用本发明的组合的治疗剂。应当理解,优选的途径可以根据例如该组合的接受者的健康状况和待治疗的癌症位置而变化。还应理解,可以通过相同或不同的途径施用每种治疗剂,并且可以将这些治疗剂,例如具有式(i)的化合物或其药学上可接受的盐、和cdk4/6抑制剂(适合地瑞博西尼或其药学上可接受的盐),一起复合在药物组合物中。
[0158]
如本文披露,具有式(i)的化合物或其药学上可接受的盐,和cdk4/6抑制剂,适合地瑞博西尼或其药学上可接受的盐可以一起使用。可以将本发明的组合的两种治疗剂一起(同时地)、顺序地或单独地施用。
[0159]
此外,是否将化合物以相同的剂型施用并不重要,例如,可以将一种化合物局部施用而可以将另一种化合物口服施用。适合地,将两种治疗剂口服施用。化合物可以以相同或不同剂型施用。
[0160]
因此,在一个实施例中,将一个或多个剂量的具有式(i)的化合物或其药学上可接受的盐与一个或多个剂量的cdk4/6抑制剂(适合地瑞博西尼或其药学上可接受的盐)同时地、顺序地或单独地施用。
[0161]
在一个实施例中,将多剂量的具有式(i)的化合物或其药学上可接受的盐与多剂量的cdk4/6抑制剂(适合地瑞博西尼或其药学上可接受的盐)同时地、顺序地或单独地施用。
[0162]
在一个实施例中,将多剂量的具有式(i)的化合物或其药学上可接受的盐与一个剂量的cdk4/6抑制剂(适合地瑞博西尼或其药学上可接受的盐)同时地、顺序地或单独地施用。
[0163]
在一个实施例中,将一个剂量的具有式(i)的化合物或其药学上可接受的盐与多剂量的cdk4/6抑制剂(适合地瑞博西尼或其药学上可接受的盐)同时地、顺序地或单独地施用。
[0164]
在一个实施例中,将一个剂量的具有式(i)的化合物或其药学上可接受的盐与一个剂量的cdk4/6抑制剂(适合地瑞博西尼或其药学上可接受的盐)同时地、顺序地或单独地施用。
[0165]
在所有上述实施例中,可以首先施用具有式(i)的化合物或其药学上可接受的盐,或可以首先施用cdk4/6抑制剂(适合地瑞博西尼或其药学上可接受的盐)。
[0166]
在一个实施例中,本文提供药物组合物,该药物组合物包含用于本发明方法的(a)具有式(i)的化合物或其药学上可接受的盐和(b)cdk4/6抑制剂(适合地瑞博西尼或其药学上可接受的盐)。在一个实施例中,药物组合物进一步包含一种或多种药学上可接受的稀释剂、赋形剂或载体。一种或多种载体、稀释剂或赋形剂在与配制品(能够是药物配制品)的其他成分相容的意义上必须是可接受的,并且对其接受者无害。所使用的药物组合物的此类元素可以按单独的药物组合形式呈现或一起配制于一种药物组合物中。可以将本文披露的组合以单一的组合物一起施用或以两种或更多种不同的组合物单独地施用,例如,如所述的组合物或剂型,并且这些组分可以作为相同的配制品或作为单独的配制品单独地(例如,
如上所示)施用或通过任何合适的途径与一种或多种药学上可接受的载体组合地施用。
[0167]
如本文所用的剂量单位形式是指适合作为用于要治疗的受试者的单元剂量的物理上离散的单位;每个单位包含经计算以产生与所需的药物载体相关联的所需治疗效果的预定量的活性化合物(例如,具有式(i)的化合物或其药学上可接受的盐,或cdk4/6抑制剂(适合地瑞博西尼或其药学上可接受的盐))。该单位剂型还可以是固定组合。
[0168]
这些组合配偶体中的每一者的有效剂量可能需要当与组合中的其他治疗剂相比时更频繁地施用治疗剂中的一种。因此,为了允许适当地给药,包装的药物产品可以包含一种或多种含有化合物组合的剂型,以及一种或多种含有本发明组合的治疗剂中的一种治疗剂、但不含有本发明组合的另一治疗剂的剂型。
[0169]
当在本发明的组合中采用的组合配偶体以作为单一药物销售的形式使用时,如果没有另外提及,则它们的剂量和施用方式可以依据相应市售药物的包装说明书上提供的信息。
[0170]
因此,为允许适当地给药,包装的药物产品可以包含一种或多种含有药剂组合的剂型,以及一种或多种含有组合的治疗剂中的一种治疗剂、但不含有组合的另一治疗剂的剂型。
[0171]
还在本发明范围内的是组合试剂盒,其包含作为治疗剂的本发明的组合,如本文所述用于同时、单独或顺序地施用,以及一种或多种其他的元素:使用说明书;用于与本发明的组合一起使用的其他试剂;用于制备施用化合物的装置或其他材料,如混合容器;药学上可接受的载体;以及用于向受试者施用的装置或其他材料,如注射器。
[0172]
如本文使用的术语“组合试剂盒”或“套装盒”意指根据本发明使用的一种或多种药物组合物。当同时施用两种化合物时,组合试剂盒可以包含呈单一药物组合物(例如片剂)或分开的药物组合物的具有式(i)的化合物或其药学上可接受的盐、和cdk4/6抑制剂(适合地瑞博西尼或其药学上可接受的盐)、和cdk4/6抑制剂(适合地瑞博西尼或其药学上可接受的盐)。当未同时施用具有式(i)的化合物或其药学上可接受的盐、和cdk4/6抑制剂(适合地瑞博西尼或其药学上可接受的盐),和cdk4/6抑制剂(适合地瑞博西尼或其药学上可接受的盐)时,组合试剂盒将包含呈以单一包装的单独药物组合物或以分开包装的分开药物组合物的具有式(i)的化合物或其药学上可接受的盐、和cdk4/6抑制剂(适合地瑞博西尼或其药学上可接受的盐)。
[0173]
在本发明的一个实施例中,该套装盒包含以下组分:(a)raf抑制剂化合物,其选自由以下组成的组:(i)与药学上可接受的赋形剂、稀释剂和/或载体关联的、具有式(i)的化合物或其药学上可接受的盐,和(b)与药学上可接受的赋形剂、稀释剂或载体关联的cdk4/6抑制剂(优选瑞博西尼或其药学上可接受的盐),其中将这些组分以适合用于顺序地、单独地和/或同时地施用的形式提供。组合试剂盒还可以提供有说明书,例如剂量说明书和施用说明书。这样的剂量说明书和给药说明书可以属于提供给医生的种类(例如通过药品产品标签),或者它们可以属于医生提供的种类(例如对患者的说明)。
[0174]
根据说明书和附图并且如权利要求书,本发明的其他特征、目标和优点将是清楚的。
[0175]
以下实例展示了上述发明;然而,这些实例并不旨在以任何方式限制本发明的范围。本发明的药物组合的有益作用还可以通过相关领域技术人员已知的像这样的其他测试
模型来确定。
[0176]
实例
[0177]
实例1:nras突变型黑色素瘤细胞系中raf抑制与cdk4/cdk6抑制的增强的组合作用
[0178]
方法
[0179]
合成具有式(i)的化合物(nvp
‑
lxh254)和瑞博西尼(nvp
‑
瑞博西尼),并在dmso中以10mm的终浓度制备瑞博西尼的化合物储备液。对于组合试验,将工作储备液在适当的细胞培养基中以3倍的增量进行连续稀释(对于瑞博西尼,2倍增量),以达到最终测定浓度:nvp
‑
lxh254的范围为10μm至1.5nm,nvp
‑
瑞博西尼为10μm至39nm(琥珀酸盐形式)。
[0180]
sk
‑
mel
‑
2细胞购自美国菌种保藏中心(atcc),mel
‑
juso细胞购自德国微生物和细胞培养系列有限公司(dsmz),mm415细胞购自澳大利亚细胞库,以及ipc
‑
298和sk
‑
mel
‑
30细胞获自gnf。将ipc
‑
298、mel
‑
juso、mm415、和sk
‑
mel
‑
30细胞培养于rpmi培养基(atcc)中,且将sk
‑
mel
‑
2细胞培养于emem培养基(atcc)中,这两种培养基均补充有10%胎牛血清(gibco),然后在37℃/5%co2下孵育。对于组合活性,将细胞以每孔5,000个细胞的密度接种在96孔板(康宁公司#3904)中的80μl培养基中,并在添加化合物之前孵育过夜。在适当培养基中新鲜制备化合物储备液(10x)且通过电子多通道移液管一式三份手动添加至板中以创建完整的10x 10组合矩阵网格。在至少三个重复孔中,根据制造商的方案通过基于荧光的dna结合增殖测定(赛默飞公司#c35011)评价在化合物添加时细胞的数量和生存能力,以及72小时后组合效应的定量。使用诺华内部软件“组合分析模块”进行组合数据分析。应用程序利用loewe剂量加和模型计算每个剂量矩阵的加权协同作用得分,该得分对剂量采样和覆盖范围进行了调整,并且针对高抑制水平下的有利组合效应进行权重(lehar等人,2009)。
[0181]
将细胞以0.5x 106个细胞/孔的密度铺在6孔培养皿(#3506,康宁公司,ny)中。铺板后一天,将品系用200nm、400nm和800nm的单一药剂瑞博西尼和具有式(i)的化合物(300nm)的组合处理48小时。在含有蛋白酶抑制剂(#87785,赛默飞世尔公司(thermo fisher),沃尔瑟姆,马萨诸塞州)和磷酸酶抑制剂(#78420,赛默飞世尔公司,沃尔瑟姆,马萨诸塞州)的ripa裂解缓冲液(#89900,赛默飞世尔公司,沃尔瑟姆,马萨诸塞州)中收获细胞。在4%
‑
12%bis
‑
tris nupage sds凝胶(#wg1403bx10,美国生命技术公司(life technologies),卡尔斯巴德,加利福尼亚州)上分离蛋白质,并使用trans
‑
blot turbo系统(伯乐公司(bio
‑
rad),赫拉克勒斯(hercules),加利福尼亚州)将其转移至硝化纤维素。用识别prb(#8516,细胞信号技术,beverly,ma)、pcdk4/61/2(#9154,细胞信号技术,beverly,ma)、perk1/2(#4730,细胞信号技术,beverly,ma)和prsk(#9348,细胞信号技术,beverly,ma)的抗体以1:1000稀释度和识别β
‑
肌动蛋白的抗体(#am4302,生命技术公司,卡尔斯巴德,加利福尼亚州)以1:5000稀释度检测蛋白质。使用抗小鼠hrp或抗兔hrp二抗检测蛋白水平,并在ge image quant las 4000成像系统(ge健康医疗公司(ge healthcare),沃本,马萨诸塞州)上用supersignal west femto(#34096,赛默飞科学公司(thermo scientific),沃尔瑟姆,马萨诸塞州)或dura化学发光底物(#34076,赛默飞科学公司,沃尔瑟姆,马萨诸塞州)进行显影。
[0182]
结果
[0183]
相对于sk
‑
mel
‑
30黑色素瘤细胞系中的单一处理,具有式(i)的化合物和瑞博西尼的组合证实了改善抗增殖和phopho
‑
rb抑制作用(图1)。sk
‑
mel
‑
30黑色素瘤细胞系在nras(q61k)和braf(d287h)中携带同时突变。
[0184]
相对于ipc
‑
298黑色素瘤细胞系中的单一处理,具有式(i)的化合物和瑞博西尼的组合证实了改善抗增殖和phopho
‑
rb抑制作用(图2)。ipc
‑
298黑色素瘤细胞系携带nras突变(nrasq61l)。
[0185]
相对于meljuso黑色素瘤细胞系中的单一处理,具有式(i)的化合物和瑞博西尼的组合证实了改善抗增殖和phopho
‑
rb抑制作用(图3)。meljuso黑色素瘤细胞系携带nras突变(nrasq61l)。
[0186]
相对于meljuso黑色素瘤细胞系中的单一处理,具有式(i)的化合物和瑞博西尼的组合证实了改善抗增殖和phopho
‑
rb抑制作用(图4)。
[0187]
实例2:具有式(i)的化合物和瑞博西尼在衍生自nras突变型黑色素瘤患者的异种移植中的组合功效
[0188]
通过将具有式(i)的化合物和瑞博西尼在九个衍生自nras突变型黑色素瘤患者的异种移植中组合,研究了选择性双重raf和cdk4/6抑制在体内的作用。
[0189]
方法
[0190]
动物和维持条件:在操作前至少3天,允许远系杂交无胸腺的(nu/nu)雌性小鼠(athymic nude
‑
nu”)(查尔斯河,印第安纳波利斯)在随意获取食物和水的诺华公司nibr动物设施中适应新环境(表1)。
[0191]
表1动物特征
[0192][0193]
关于动物福利的声明:根据诺华nibr acuc条例和指南处理动物。
[0194]
测试化合物和配方:将具有式(i)的化合物(游离碱形式)在mepc4媒介物(45%克列莫佛(cremophor)rh40+27%peg400+18%玉米油甘油酯+10%乙醇)中经口(口服)给药。将具有式(i)的化合物配制为5mg/ml。将瑞博西尼琥珀酸盐在0.5%甲基纤维素的媒介物中经口(口服)给药;将瑞博西尼配制为7.5mg/ml。
[0195]
在裸小鼠中开发衍生自患者的异种移植(pdx)模型
[0196]
衍生自患者的肿瘤异种移植(pdx)hmex5727、hmex3486、hmex20667、hmex2921、hmex20864、hmex20585、hmex4339、hmex20744、和hmex21124通过肿瘤浆液的连续传代在裸鼠中繁殖。简而言之,使用温和的macs分离器(macs美天旎生物技术公司(macs miltenyi biotec)、#120
‑
005
‑
331)将先前传代的新鲜肿瘤片段匀浆,通过组织研磨机(chemglass生命科学公司(chemglass lifesciences)#cls
‑
5020
‑
085),在pbs中稀释,并与等体积的matrigel
tm
基质(康宁#354234)混合。然后将200ul肿瘤浆液皮下植入雌性裸小鼠的右侧。通过用卡尺测量并使用公式计算肿瘤体积,其中肿瘤体积(v
t
)(mm3)=(l x w2)/2,其中l是肿瘤的最长轴并且w垂直于l。监测小鼠的肿瘤生长、体重和身体状况,两次/周。
[0197]
在pdx模型中的功效研究设计
[0198]
表2描述了所有模型的功效研究设计。以根据体重调整的10ml/kg的剂量体积给予测试剂。在随机分组时收集肿瘤尺寸和体重,之后在研究持续时间内每周收集两次。当平均肿瘤体积为大约350mm3时,将小鼠随机分为处理组(n=3
‑
5/组),并实施处理直至肿瘤长大(肿瘤体积>/=700mm3)或大约90天。通过将时间t处的肿瘤体积变化与其基线进行比较,确定所有模型的肿瘤体积变化百分比。最佳反应是t≥10天的肿瘤体积变化百分比的最小值。在处死未经处理的对照小鼠时,也处死来自每组的2只小鼠,并收集肿瘤用于将来的药效学(pd)分析。对超过这一点的3只小鼠/组进行功效研究。
[0199]
表2功效研究的处理组
[0200][0201]
p.o.:口服(口服填喂法)
[0202]
qd:每日一次
[0203]
bid:一天两次
[0204]
数据分析
[0205]
体重:体重变化百分比计算为(bw
当前
‑
bw
初始
)/(bw
初始
)
×
100%。数据表示为相比处理开始日的体重变化平均百分比
±
sem。
[0206]
肿瘤体积:通过将时间t处的肿瘤体积变化与其基线使用以下公式进行比较,确定肿瘤体积变化百分比:%肿瘤体积变化=δv
t
=100%
×
((v
t
‑
v
初始
)/v
初始
)。最佳反应是t≥10天的δv
t
的最小值。
[0207]
其中:
[0208]
δv
t
=肿瘤体积变化
[0209]
v
t
=研究给定日药物处理(或未经处理)组的肿瘤体积;
[0210]
v
初始
=给药初始日药物处理(或未经处理)组的肿瘤体积。最佳反应>/=
‑
30%考被认为肿瘤消退。
[0211]
使用graphpad prism软件为达到肿瘤大小>/=700mm3的终点的个体小鼠生成卡普兰
‑
梅尔存活图。使用对数秩(曼特尔
‑
考克斯)检验对组之间的显著性进行统计学分析。p<0.05被认为是显著的。
[0212]
结果:具有式(i)的化合物和瑞博西尼在衍生自患者的nras突变型黑色素瘤异种移植裸小鼠模型中的组合功效
[0213]
使用九个衍生自nras突变型黑色素瘤患者的异种移植裸小鼠模型确定具有式(i)的化合物与瑞博西尼组合使用时的抗肿瘤功效:hmex5727(nrasq61k)、hmex3486(nrasq61k)、hmex20667(nrasq61r)、hmex2921(nrasq61r)、hmex20585(nrasq61r)、hmex20864(nrasq61r)、hmex21124(nrasq61h)、hmex20744(nrasq61k)、和hmex4339(nrasq61r)。将小鼠处理大约90
‑
100天或直到每组中的肿瘤大小达到>/=700mm3。表3、图5和图6报告了肿瘤体积变化百分比(最佳反应)、体重变化百分比和存活率。
[0214]
以50mg/kg bid(具有式(i)的化合物)+75mg/kg qd(瑞博西尼)给药的具有式(i)的化合物+瑞博西尼的组合活性在44%的测试模型中导致肿瘤消退。相比之下,在任何测试的模型中,以50mg/kg bid给药的具有式(i)的化合物的单一药剂或以75mg/kg qd给药的瑞博西尼的单一药剂均未实现肿瘤消退(表3和图5)。此外,与每种单一药剂或未经处理的对照相比,具有式(i)的化合物+瑞博西尼的组合导致生存中值显著增加(图6)。
[0215]
根据各模型缺乏体重减轻的判断,单一药剂和组合处理的耐受性都很好。由于体重减轻,在较早的时间点处死了用具有式(i)的化合物处理的一只小鼠。
[0216]
表3:具有式(i)的化合物和瑞博西尼在九个衍生自患者的nras突变型黑色素瘤肿瘤异种移植小鼠模型中的抗肿瘤功效和耐受性
[0217]
[0218]
[0219][0220]
*表示治疗的最后一天(肿瘤大小>/=700mm3)
[0221]
#组在单独的实验中运行
[0222]
结论与讨论
[0223]
在一组九个衍生自患者的nras突变型黑色素瘤异种移植中,描述了具有式(i)的化合物+瑞博西尼组合在nras突变型黑色素瘤中的体内活性。以50mg/kg bid(具有式(i)的化合物)+75mg/kg qd(瑞博西尼)给药的具有式(i)的化合物+瑞博西尼的组合活性在44%的测试模型中导致肿瘤消退。相比之下,在任何测试的模型中,以50mg/kg bid给药的具有式(i)的化合物的单一药剂或以75mg/kg qd给药的瑞博西尼的单一药剂均未实现肿瘤消退。此外,与每种单一药剂或未经处理的对照相比,具有式(i)的化合物+瑞博西尼的组合耐受性很好并导致生存中值百分比显著增加。在衍生自nras突变型患者的黑色素瘤异种移植中,已观察到cdk4/6抑制剂瑞博西尼与具有式(i)的化合物强效协同作用,且导致临床前模型中显著的肿瘤消退和生存中值百分比增加。总体而言,这些数据表明,在nras突变型黑色素瘤患者中,具有式(i)的化合物+瑞博西尼的组合可实现更大和更持久的反应。
[0224]
实例3:在nras突变型黑色素瘤患者中进行的、具有式(i)的化合物与瑞博西尼组合的ib期、非盲、多中心研究
[0225]
这项研究的目的是表征在nras突变型黑色素瘤患者中的具有式(i)的化合物和瑞博西尼双重组合的安全性和耐受性,并确定推荐剂量。
[0226]
主要终点是
[0227]
(1)安全性:不良事件(ae)和严重ae(sae)的发生率和严重性,包括实验室值、生命体征和心电图(ecg)的变化,第一周期(仅剂量递增)期间剂量限制毒性(dlt)的发生率和性质,
[0228]
(2)耐受性:剂量中断、减少和剂量强度。
[0229]
次要目的和终点是:
[0230]
(a)评估具有式(i)的化合物与瑞博西尼组合的初始抗肿瘤活性。根据实体瘤反应评估标准(recist)版本1.1的整体反应率(orr)、疾病控制率(dcr)、反应持续时间(dor)、无进展存活期(pfs)。仅对于剂量扩展部分:总体存活(os)、血浆浓度和推导的pk参数
[0231]
(b)表征具有式(i)的化合物和瑞博西尼的组合的药代动力学(pk)曲线。在肿瘤组织中pd标记dusp6从基线的变化。
[0232]
(c)评估具有式(i)的化合物和瑞博西尼的组合在肿瘤中的药效学(pd)效应(dusp6)
[0233]
探索性目标和终点是:
[0234]
(a)评价肿瘤样品(肿瘤和血浆(循环游离dna(cfdna))中多种癌症相关基因的遗传改变,以评估它们与临床结果/抗性发展的关系。在基线和给药后(包括疾病进展时)在肿瘤样品中发现的多种癌症相关基因中的遗传改变,以及它们与临床结果终点的关系。
[0235]
(b)进一步评价具有式(i)的化合物与瑞博西尼组合的pd效应。在血液中pd标记(例如,dusp6)从基线的变化。
[0236]
(c)评估具有式(i)的化合物与瑞博西尼之间的药物
‑
药物相互作用(ddi)。具有式(i)的化合物和瑞博西尼血浆浓度和推导的pk参数。
[0237]
(d)调查cfdna改变如何反映档案和(如果有)新获得的肿瘤样品的遗传改变。在给定的时间点(给药前和给药后),来自同一患者肿瘤和作为替代组织的血浆样品中测得的遗传改变的差异。
[0238]
这是一项多中心、非盲、ib期剂量递增研究,后面是剂量扩展部分。具有式(i)的化合物与瑞博西尼的组合将在携带nras突变的黑色素瘤患者中施用。研究治疗将一直进行,直到患者出现无法接受的毒性、进展性疾病和/或根据研究者或患者的判断或由于撤回同意而中断治疗。一个周期定义为28天。
[0239]
入选标准:患有诊断为局部晚期或转移性nras突变的黑色素瘤的成年(18岁或以上)黑色素瘤患者,他们遵循标准治疗进展,或对其尚无有效的标准疗法,不耐受,不适当或不被认为与研究治疗等效,这些患者将有资格参加本研究。肿瘤组织中nras突变的存在先于由当地实验室或诺华指定的中心实验室确定的研究治疗,或kras、braf或nras突变的书面文件。ecog(美国东岸癌症临床研究合作组织(eastern cooperative oncology group)体能状态≤2。患者必须具有适合活检的疾病部位,并且必须愿意根据治疗机构自己的指导方针和此类程序的要求在基线和治疗期间接受新的肿瘤活检。根据recist v1.1要求存在至少一个可测量的病变。
[0240]
排除标准:
[0241]
(a)先前用raf抑制剂(包括任何braf抑制剂和raf抑制剂)或cdk4/6抑制剂治疗。
[0242]
(b)在规定的时间范围内,在研究治疗的第一剂量之前,使用以下任何抗癌疗法治疗:
[0243]
(i)在研究治疗的第一剂量之前,放射疗法≤4周或缓解性有限域放射≤2周。
[0244]
(ii)化学疗法或生物疗法(免疫疗法除外)或连续或间歇性小分子疗法或任何其他试验剂的≤4周或≤5个半衰期(以较短者为准)。
[0245]
(iii)包括免疫检查点抑制剂的任何免疫疗法≤4周。
[0246]
(iv)具有主要延迟毒性的细胞毒素剂(如亚硝基脲和丝裂霉素c)≤6周。
[0247]
(c)视网膜静脉阻塞(rvo)或当前rvo危险因素(例如不受控制的青光眼或高眼压症,高粘血症或血凝过快综合征的病史)的病史或当前证据。
[0248]
(d)研究者判断,由于安全问题或遵守临床研究程序而妨碍患者参加临床研究的
任何医疗状况。可增加与研究参与或研究治疗施用有关的风险或可干扰研究结果的判读和在研究者判断下将使患者不适于该研究的任何严重、急性或慢性医学或精神病症或实验异常。
[0249]
(e)接受已知是cyp3a和cyp2c8的强抑制剂和/或诱导剂;ugt2b7的抑制剂或诱导剂;ugt1a1的底物和抑制剂;具有较窄的治疗指数的cyp2c8、cyp2c9和cyp3a的底物;以及cyp3a的敏感底物、已知会引起肝毒性的草药(这些在开始研究治疗前7天和整个研究期间不能中断)的药物治疗的患者。
[0250]
(f)接受质子泵抑制剂(ppi)(其在开始研究治疗前3天和整个研究期间不能中断)的患者。
[0251]
(g)具有除了在本研究中接受治疗的之外的恶性疾病的患者。此排除标准的例外情况包括:在研究治疗前2年内已治愈并且未复发的恶性肿瘤;完全切除的基底细胞和鳞状细胞皮肤癌;以及完全切除的任何类型的原位癌。
[0252]
评估临床功效,根据recist版本1.1和总体存活(os)(仅在剂量扩展部分)测量整体反应率(orr)、疾病控制率(dcr)、响应持续时间(dor)、无进展存活(pfs)。
[0253]
来自calu
‑
6异种移植物中的剂量分级功效研究的数据证明,在不同给药水平下,qd(qd)给药和每日两次(bid)分次给药具有式(i)的化合物显示出相似水平的抗肿瘤活性。这些结果支持在临床中探索qd或bid剂量方案。
[0254]
将进行临床功效潜在体征的评价,包括orr、pfs和os评价。
[0255]
在研究的剂量递增部分期间招募的所有患者,将被分配接受与瑞博西尼组合的具有式(i)的化合物,以评估组合的安全性和耐受性。
[0256]
每个测试方案的剂量递增将由基于第一周期dlt数据的贝叶斯逻辑回归模型(blrm)指导。
[0257]
blrm/bhlrm是一种公认的在癌症患者中评估mtd的方法。自适应blrm/bhlrm将由控制剂量过量的递增设计(ewoc)原理指导以控制研究中未来患者的dlt风险。针对小数据集使用贝叶斯响应自适应模型已经被emea(“guideline on clinical trials in small populations[群体临床试验指南]”,2007年2月13日)接受并得到众多出版物(babb等人1998,neuenschwander等人2008,neuenschwander等人2010)的认可,其开发和适当使用是fda关键路径计划的一个方面。
[0258]
进入该扩展部分的患者将以推荐的具有式(i)的化合物和瑞博西尼的剂量组合(mtd或较低剂量组合)治疗。
[0259]
将评价组合的安全性(包括剂量
‑
dlt关系)和耐受性;基于这些数据的审查,将确定用于剂量扩展的一个或多个剂量和一个或多个方案。推荐的扩展剂量也将由有关pk、pd和初步抗肿瘤活性的可用信息来指导。
[0260]
治疗
[0261]
研究治疗将在禁食状态下按28天给药周期施用。
[0262]
口服使用片剂和胶囊剂,分配剂量,每日剂量,持续28天。
[0263]
研究者或负责的研究中心人员应指导患者按如规定服用研究药物提高顺应性。
[0264]
患者应将任何错过或延迟的剂量告知研究工作人员。
[0265]
如果研究者或患者自行决定中断治疗和/或患者撤回同意,则由于不可接受的毒
性、进展性疾病,患者较早中断研究治疗。
[0266]
下表描述了可在该试验期间评估的单独研究药物(非组合)的起始剂量和临时剂量水平。
[0267]
具有式(i)的化合物和瑞博西尼的组合的建议剂量水平
[0268][0269][0270]
任何组合的一个或多个mtd均定义为该组合的最高剂量组合,该组合在研究的递增部分中,在具有式(i)的化合物和瑞博西尼治疗的第一个周期中不太可能(<25%的后验概率)导致33%或更多的接受治疗的患者产生dlt。
[0271]
研究者和诺华研究人员认为,rd将是小于或等于mtd并具有基于对安全性和耐受性、pk、pd和活性信息的审查而最适当的利益风险评价的剂量。应当注意的是在某些情况下可能无法达到mtd。
[0272]
cdk4/6抑制剂也可以连续施用(即在治疗期间没有间断)或在具有假期期间的情况下施用。
[0273]
例如,cdk4/6抑制剂,例如瑞博西尼或其药学上可接受的盐可以以施用3周停止1周,或施用2周停止2周的方式施用;优选地施用3周停止1周。特别地,根据本发明可以使用以下方案:
[0274][0275]
b.i.d.或bid:一天两次
[0276]
qd或qd:一天一次。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1