3,4-裂环环阿屯烷型四环三萜化合物或其药学上可接受的盐在制备抗癌药物中的用途
1.本发明属于化学医药领域,具体涉及3,4-裂环环阿屯烷型四环三萜化合物或其药学上可接受的盐在制备抗癌药物中的用途。
背景技术:
2.癌症是世界上人类死亡的主要原因之一,其发病率和死亡率的不断增高以及年轻化趋势严重威胁着人类的健康和生命。其中男性发病率最高的是肺癌,其次为胃癌、肝癌。女性发病率最高的是乳腺癌,其次为肺癌、结直肠癌。而在所有癌症中,生存率最低的为胰腺癌、肺癌。
3.栀子是我国第一批药食同源的中药材,味苦性寒,归心、肺、三焦经,具有泻火除烦、清热利尿、凉血解毒等功效,可用于消肿止痛、热病心烦、湿热黄疸、淋证涩痛、血热吐衄、目赤肿痛、火毒疮疡等病症。三萜类成分大量存在于栀子属植物的花和茎皮中,目前己报道20余种。栀子中常见的有:熊果酸、豆留醇、胡萝卜苷、户谷甾醇、齐墩果酸、长春藤皂苷元、泰国树脂酸、栀子花乙酸、3-乙酰-栀子花甲酸等。栀子在我国应用历史悠久,是中医药宝库中的中药的一员,具有保护消化系统、心血管系统、中枢神经系统的作用,还有抗炎、抗癌、抗抑郁、抗菌等作用。但抗癌作用的研究不够深入,还有更多未发现的高活性化合物。
4.环阿屯烷型三萜,也叫环阿尔廷烷型三萜、环菠萝蜜型三萜,其结构骨架中c9、c10和c19形成的三元环成为环阿尔廷烷类三萜的典型结构特征,并以此区别于其他类型的三萜结构,具有较好的药理活性,如抗肿瘤、抗衰老、抗菌、护肝等。
5.cn101824068b提供了一种环屯烷型三萜皂苷类化合物、制备方法及其应用,该发明从选定的几种中药通过利用闪式提取技术或溶剂提取法得到粗总皂苷,经硅胶闪烁柱色谱法快速处理、溶剂梯度洗脱、分离纯化后得到环阿尔廷型三萜皂苷类化合物,所制备的环阿尔廷型三萜皂苷类化合物具有较好的抗肿瘤活性。
6.裂环环阿屯烷型三萜化合物是一类结构新颖的三萜类化合物,具有多种生物活性。药用植物中裂环环阿屯烷型化学成分的研究对于丰富天然化合物的结构以及中药药效物质基础的研究具有积极的意义。
7.cn109180623b公开了两种3,4-裂环环阿屯烷型栀子新萜a和栀子新萜f的制备方法及其应用,有效解决快速从水栀子中制备两个具有肾细胞保护活性的3,4-裂环环菠萝蜜烷型三萜类化合物的问题。
8.3,4-裂环环阿屯烷型的三萜化合物陆续有报道,但生物活性研究还不够完全。
技术实现要素:
9.针对现有技术的不足,本发明的目的在于提供3,4-裂环环阿屯烷型四环三萜化合物或其药学上可接受的盐在制备抗癌药物中的用途。
10.为达到此发明目的,本发明采用以下技术方案:
11.本发明提供3,4-裂环环阿屯烷型四环三萜化合物或其药学上可接受的盐在制备抗癌药物中的用途。
12.优选地,所述3,4-裂环环阿屯烷型四环三萜化合物的结构包括符合通式1、通式2或通式3所示的化合物结构:
[0013][0014]
其中,r1选自ch3、ch2oh、cho或cooh;r2选自ch3、ch2oh、cho或cooh;r3选自h或oh;r4选自h或ch3;r5选自h或oh;
[0015]
r1'选自ch3、ch2oh、cho或cooh;r2'选自ch3、ch2oh、cho或cooh;r3'选自h或oh;r4'选自h或ch3;r5'选自h或oh;
[0016]
r
1”选自ch3、ch2oh或cho;r
2”选自ch3、ch2oh或cho;r
3”选自h或oh;r
4”选自h或ch3;r
5”选自h或oh。
[0017]
在通式1、通式2或通式3所示的化合物结构中,碳碳双键任选地为顺式结构或反式结构。
[0018]
优选地,所述3,4-裂环环阿屯烷型四环三萜化合物的结构包括13种如下所述的化合物结构:
[0019]
[0020][0021]
本发明创造性地发现了3,4-裂环环阿屯烷型四环三萜化合物尤其是上述13种3,4-裂环环阿屯烷型四环三萜化合物具有很显著的抗癌功效,实验研究发现,其对人肝癌细胞株huh7、人肝癌细胞系hepg2、人非小细胞肺癌细胞株a549、人乳腺癌细胞株mcf-7、人三阴性乳腺癌细胞株mda-mb-231、人结肠癌细胞株sw480、人胰腺癌细胞株panc-1、人前列腺癌细胞株pc3、人宫颈癌细胞株hela、人肾癌细胞株786-o均具有一定的细胞毒性作用,可以抑制细胞的增殖、杀死癌症细胞,可以将细胞阻滞在复制期,降低dna的复制效率,进一步影响癌细胞的增殖。
[0022]
优选地,所述抗癌药物是指抑制真核生物癌症细胞增殖的药物。
[0023]
优选地,所述癌包括肝癌、乳腺癌、结肠癌、肾癌、宫颈癌、胰腺癌、前列腺癌或肺癌。
[0024]
优选地,所述抗癌药物的剂型为普通压制片、分散片、肠溶片、胶囊剂、颗粒剂、滴丸剂、乳剂、散剂、口服液或注射剂中的任意一种。
[0025]
优选地,所述注射剂包括小水针剂、输液剂或冻干粉针剂。
[0026]
本发明所涉及的3,4-裂环环阿屯烷型四环三萜化合物可以被制成各种药学上可接受的制剂形式应用在制备抗癌药物中。
[0027]
优选地,所述3,4-裂环环阿屯烷型四环三萜化合物或其药学上可接受的盐为负载于药用载体上的3,4-裂环环阿屯烷型四环三萜化合物或其药学上可接受的盐。
[0028]
优选地,所述药用载体包括脂质体、胶束、微球、微囊或树枝状大分子。
[0029]
本发明所涉及的3,4-裂环环阿屯烷型四环三萜化合物或其药学上可接受的盐可以被负载于各种药学上可接受的载体上应用在制备抗癌药物中,以获得更高的生物利用率、更低的药物毒性、更好的生物相容性。
[0030]
优选地,所述3,4-裂环环阿屯烷型四环三萜化合物或其药学上可接受的盐为药物组合物中含有的3,4-裂环环阿屯烷型四环三萜化合物或其药学上可接受的盐。
[0031]
本发明所涉及的3,4-裂环环阿屯烷型四环三萜化合物或其药学上可接受的盐可以与常见的药用辅料组合使用,也可以与其他功效相似的药物复配使用。
[0032]
优选地,所述药物组合物还包括药用辅料,所述药用辅料包括增溶剂、崩解剂、润湿剂、稳定剂、增稠剂、稀释剂、缓冲剂或矫味剂。
[0033]
优选地,所述3,4-裂环环阿屯烷型四环三萜化合物或其药学上可接受的盐在药物组合物中的重量百分比为1-99%,例如1%、3%、5%、8%、10%、15%、20%、30%、40%、50%、60%、70%、80%、90%或99%等,优选1-90%。
[0034]
相对于现有技术,本发明具有以下有益效果:
[0035]
本发明创造性地发现了一批3,4-裂环环阿屯烷型四环三萜化合物尤其是上述13种3,4-裂环环阿屯烷型四环三萜化合物具有很显著的抗癌功效,实验研究发现,其对人肝癌细胞株huh7、人肝癌细胞系hepg2、人非小细胞肺癌细胞株a549、人乳腺癌细胞株mcf-7、人三阴性乳腺癌细胞株mda-mb-231、人结肠癌细胞株sw480、人胰腺癌细胞株panc-1、人前列腺癌细胞株pc3、人宫颈癌细胞株hela、人肾癌细胞株786-o均具有一定的细胞毒性作用,可以抑制细胞的增殖、杀死癌症细胞,可以将细胞阻滞在复制期,降低dna的复制效率,进一步影响癌细胞的增殖。
附图说明
[0036]
图1是5gj-5j6a对mcf7的细胞形态学影响结果图;
[0037]
图2是5gj-5j6a对hepg2的细胞形态学影响结果图;
[0038]
图3是14gj-5l12c对mcf7的细胞形态学影响结果图;
[0039]
图4是14gj-5l12c对hepg2的细胞形态学影响结果图;
[0040]
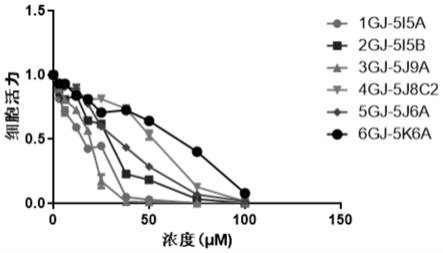
图5是1gj-5i5a、2gj-5i5b、3gj-5j9a、4gj-5j8c2、5gj-5j6a、6gj-5k6a对mcf7细胞的抑制结果图;
[0041]
图6是7gj-5h8a、8gj-5k10a、11gj-5l11c、12gj-5j10e1、14gj-5l12c对mcf7细胞的抑制结果图;
[0042]
图7是1gj-5i5a、2gj-5i5b、3gj-5j9a、4gj-5j8c2、5gj-5j6a、6gj-5k6a对hepg2细胞的抑制结果图;
[0043]
图8是7gj-5h8a、8gj-5k10a、11gj-5l11c、12gj-5j10e1、14gj-5l12c对hepg2细胞的抑制结果图;
[0044]
图9是药物处理sw480细胞72h细胞活力变化图;
[0045]
图10是药物处理786-o细胞72h细胞活力变化图;
[0046]
图11是药物处理hela细胞72h细胞活力变化图;
[0047]
图12是药物处理huh7细胞72h细胞活力变化图;
[0048]
图13是药物处理panc1细胞72h细胞活力变化图;
[0049]
图14是药物处理pc3细胞72h细胞活力变化图;
[0050]
图15是药物处理a549细胞72h细胞活力变化图;
[0051]
图16是药物处理mda-mb-231细胞72h细胞活力变化图;
[0052]
图17是11种化合物对mcf7细胞和hepg2细胞的ic
50
分布趋势图;
[0053]
图18是5种化合物对8个癌症细胞系的ic
50
分布趋势图;
[0054]
图19是化合物1gj-5i5a经edu反应后的细胞流式结果图(a、b、c、d图分别代表经过0μm、12μm、25μm、38μm加药处理后的结果);
[0055]
图20是化合物1gj-5i5a经edu反应后的细胞周期条形统计图;
[0056]
图21是化合物2gj-5i5b经edu反应后的细胞流式结果图(a、b、c、d图分别代表经过0μm、38μm、50μm、75μm加药处理后的结果);
[0057]
图22是化合物2gj-5i5b经edu反应后的细胞周期条形统计图;
[0058]
图23是化合物xii-xvi对mcf7细胞的抑制结果图。
具体实施方式
[0059]
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
[0060]
为了便于叙述,在下述实施例中用代号1gj-5i5a、2gj-5i5b、3gj-5j9a、4gj-5j8c2、5gj-5j6a、6gj-5k6a、7gj-5h8a、8gj-5k10a、11gj-5l11c、12gj-5j10e1、14gj-5l12c分别依次表示上述式ⅰ至式
ⅺ
的化合物。
[0061]
在下述实施例中所涉及的式ⅰ至式
ⅺ
的上述3,4-裂环环阿屯烷型四环三萜化合物,其可参照专利号202010113708.3的相关专利中涉及的制备方法进行制备,但是本发明中所使用的上述3,4-裂环环阿屯烷型四环三萜化合物的来源并不局限于该方法制备。
[0062]
在下述实施例中化合物xii、xiii、xiv、xv、xvi均购自成都德锐可生物科技有限公司,分别为secaubryenol(cas号:925932-08-7)、coronalolic acid(cas号:268214-52-4)、gaedenoin j(cas号:1345109-46-7)、sootepin d(cas号:1154518-97-4)、nigranoic acid(cas号:39111-07-4),其结构如下所示:
[0063][0064]
上述式ⅰ至式
ⅺ
的化合物代号-名称对应表如表1所示:
[0065]
表1
[0066]
[0067]
实施例1
[0068]
3,4-裂环环阿屯烷型四环三萜化合物的体外抗癌活性测定实验,操作如下:
[0069]
1、实验操作
[0070]
(1)细胞培养与传代
[0071]
本实施例所涉及的癌症细胞系有:人肝癌细胞株huh7、人肝癌细胞系hepg2、人非小细胞肺癌细胞株a549、人乳腺癌细胞株mcf-7、人三阴性乳腺癌细胞株mda-mb-231、人结肠癌细胞株sw480、人胰腺癌细胞株panc-1、人前列腺癌细胞株pc3、人宫颈癌细胞株hela、人肾癌细胞株786-o。所有细胞系由南方科技大学生物系系统生物学实验室提供。
[0072]
将mcf-7、sw480、pc3、panc-1、786-o细胞置于含10%的fbs(胎牛血清)、100u/ml青霉素、100u/ml链霉素的rpmi-1640培养基中培养,将huh7、hepg2、a549、hela、mda-mb-231细胞置于10%的fbs、100u/ml青霉素、100u/ml链霉素的dmem培养基中,在37℃、5%co2饱和湿度培养箱中培养。待细胞长满培养皿底后,弃去培养液,用适量的pbs(磷酸盐缓冲液)洗去残留培养基,加入0.25%的胰蛋白酶适量消化2min,加入对应的培养基终止胰蛋白酶消化,离心去除上清液,更换培养液,重悬均匀后,1:5传代,取对数生长期细胞用于实验。
[0073]
(2)给药
[0074]
接种癌细胞于黑色96孔板:选用对数生长期的癌细胞,用0.25%的胰蛋白酶消化2min后,加入含有胎牛血清的培养基终止消化,离心去除培养基,每种细胞株加入对应的培养基配制成1
×
105个/ml的细胞悬液,接种在96孔培养板中的b
2-g
11
区域,每孔接种100μl,96孔培养板四周的孔加100μl pbs,不接细胞,置于37℃、5%co2、饱和湿度的培养箱培养24h,使其贴壁。
[0075]
24h后,吸去96孔板原培养基,加入相应的药物,给药浓度依次为0μm、3μm、6μm、12μm、18μm、25μm、38μm、50μm、75μm、100μm,药物溶解在细胞培养所对应的不含酚红的培养基中,保证每个浓度药物中的dmso浓度为千分之一。每孔加培养基50μl,每个剂量设3个平行孔。其中,0μm组为对照组,其余组为实验组,其余孔只加pbs为空白组。96孔板置于37℃、5%co2、饱和湿度的培养箱中培养72h。
[0076]
(3)倒置显微镜观察给药后细胞形态变化
[0077]
将加药处理后的96孔板分别于6h、24h、48h、72h使用倒置显微镜(nikon eclipse ti2)观察细胞形态变化并拍照记录。
[0078]
(4)ctg(cell titer-glo)发光法实验
[0079]
atp(腺嘌呤核苷三磷酸,简称三磷酸腺苷)参与生物体内多种酶促反应,是活细胞新陈代谢的一个指标,其含量直接反应了细胞的数量及细胞状态:实验过程中向细胞培养基加入等体积celltiter-glo
tm
试剂,测量发光值,在光信号和体系中,发光值与atp量成正比,而atp又和活细胞数正相关,因此可通过检测atp含量得细胞活力。
[0080]
培养72h后,每孔加入50μl ctg检测试剂,在酶标仪(thermo varioskan lux)上测定其化学发光值。按照下述公式计算癌细胞存活率,癌症细胞存活率(%)=(样品组化学发光值/对照组化学发值)
×
100%,其中各项化学发光值均已扣除空白组实验值。
[0081]
(5)流式细胞术检测细胞周期
[0082]
edu(5-乙炔基-2'-脱氧尿苷),是一种新型胸苷类似物,edu可以在dna合成过程中替代胸苷掺入到新合成的dna中。另一方面,edu上的乙炔基能与荧光标记的小分子叠氮化
物探针(如azidealexa fluor 488、azidealexa fluor 594等)通过一价铜离子的催化发生共价反应,形成稳定的三唑环,该反应非常迅速,被称作点击反应。通过点击反应,新合成的dna会被相应的荧光探针所标记,从而可以使用适当的荧光检测设备检测到增殖的细胞。
[0083]
本实施例试剂盒采用的是beyoclick
tm
edu-488细胞增殖检测试剂盒,azide-488掺入到新合成的dna中呈现绿色荧光,细胞核染色采用pi(碘化丙啶),呈现红色荧光。
[0084]
6孔板培养mcf7细胞,0μm、12μm、25μm、38μm、50μm、75μm处理15h后,细胞经edu工作液孵育3h后,用多聚甲醛固定后加入500μl点击反应混合反应液,避光孵育30min后,吸去反应液,洗涤3次后,pi孵育10min,洗涤三次后重悬后上流式分析仪(beckman coulter cytoflex 5),检测细胞周期。
[0085]
(6)数据处理
[0086]
ctg发光法数据采用graphpad prism统计软件进行统计分析,绘制加药处理后的癌症细胞存活率与药物浓度的关系图,采用logit法计算药物的半数抑制浓度(ic
50
)。流式分析数据采用flowjo软件进行分析,条形统计图使用graphpad prism绘制。
[0087]
2、结果
[0088]
(1)3,4-裂环环阿屯烷型四环三萜化合物对癌细胞形态学影响
[0089]
如图1-图4所示(图1为5gj-5j6a对mcf7的细胞形态学影响、图2为5gj-5j6a对hepg2的细胞形态学影响、图3为14gj-5l12c对mcf7的细胞形态学影响、图4为14gj-5l12c对hepg2的细胞形态学影响):各癌细胞株的对照组细胞生长状态良好,20x倒置显微镜观察可见,透明度大、折光性强、细胞轮廓不清、形态较规则、贴壁性好。相反,给药组各癌细胞生长状态不良,细胞折光性变弱、轮廓增强、延展性减弱、胞质中常出现蜂窝状空泡或变黄发亮、细胞之间间隙加大、细胞变得不规则、贴壁性不好,且药物浓度越高,变圆的细胞数越多。
[0090]
(2)对癌细胞的增殖抑制作用
[0091]
(2.1)ctg发光法检测的11种3,4-裂环环阿屯烷型四环三萜化合物处理乳腺癌细胞mcf7、hepg2的ic
50
结果如表2所示,细胞活力与药物浓度关系见图5-图8(图5为1gj-5i5a、2gj-5i5b、3gj-5j9a、4gj-5j8c2、5gj-5j6a、6gj-5k6a对mcf7细胞的抑制结果图、图6为7gj-5h8a、8gj-5k10a、11gj-5l11c、12gj-5j10e1、14gj-5l12c对mcf7细胞的抑制结果图、图7为1gj-5i5a、2gj-5i5b、3gj-5j9a、4gj-5j8c2、5gj-5j6a、6gj-5k6a对hepg2细胞的抑制结果图、图8为7gj-5h8a、8gj-5k10a、11gj-5l11c、12gj-5j10e1、14gj-5l12c对hepg2细胞的抑制结果图)。
[0092]
由表2和图5-图8可知:本发明所涉及的3,4-裂环环阿屯烷型四环三萜化合物对癌细胞均具有一定的细胞毒性作用,可以抑制细胞的增殖、杀死癌症细胞,其中1gj-5i5a、3gj-5j9a、7gj-5h8a、14gj-5l12c毒性较强。
[0093]
表2
[0094]
化合物类型ic
50
(μm,mcf7)ic
50
(μm,hepg2)1gj-5i5a13.5818.922gj-5i5b24.0944.893gj-5j9a17.0225.364gj-5j8c247.4861.085gj-5j6a31.1165.36
6gj-5k6a40.8379.497gj-5h8a14.3814.298gj-5k10a30.2549.2611gj-5l11c31.6140.1312gj-5j10e144.8764.7514gj-5l12c19.9619.79
[0095]
(2.2)ctg发光法检测的5种3,4-裂环环阿屯烷型四环三萜化合物处理人结肠癌细胞株sw480、人肾癌细胞株786-o、人宫颈癌细胞株hela、人肝癌细胞株huh7、人胰腺癌细胞株panc-1、人前列腺癌细胞株pc3、人非小细胞肺癌细胞株a549、人三阴性乳腺癌细胞株mda-mb-231的ic
50
结果如表3所示,细胞活力与药物浓度关系依次见图9-图16所示,由表3和图9-图16结果可知:本发明所涉及的3,4-裂环环阿屯烷型四环三萜化合物对癌细胞均具有一定的细胞毒性作用,可以抑制细胞的增殖、杀死癌症细胞,而且不同细胞系的ic
50
值有一定的差异,其中结肠癌细胞株sw480、人肾癌细胞株786-o、人宫颈癌细胞株hela的ic
50
较小,说明结肠癌细胞、肾癌细胞、宫颈癌细胞对本发明所涉及的3,4-裂环环阿屯烷型四环三萜化合物更敏感。
[0096]
表3
[0097]
细胞系类型1gj-5i5a2gj-5i5b3gj-5j9a7gj-5h8a8gj-5k10asw4808.96720.4137.37122.45786-o13.1318.2913.059.27819.69hela17.6731.6220.1123.6441.12huh718.0627.9420.0214.0250.73panc-118.2646.9819.4613.1444.84pc319.9336.6427.0516.1138.39a54937.1661.7734.0332.3280mda-mb-23129.0646.9336.6533.0952.39
[0098]
(2.3)上述11种化合物对mcf7细胞和hepg2细胞的ic
50
分布趋势图如图17所示,上述5种化合物对其他8个癌症细胞系的ic
50
分布趋势图如图18所示,可知本发明所涉及的3,4-裂环环阿屯烷型四环三萜化合物对上述癌细胞系均具有杀伤作用,而且在不同细胞系上的毒性趋势基本一致。1gj-5i5a、2gj-5i5b、3gj-5j9a、7gj-5h8a、8gj-5k10a对人结肠癌细胞株sw480、人肾癌细胞株786-o、人宫颈癌细胞株hela、人肝癌细胞株huh7、人胰腺癌细胞株panc-1、人前列腺癌细胞株pc3、人非小细胞肺癌细胞株a549、人三阴性乳腺癌细胞株mda-mb-231都有抑制作用,那么剩下的4gj-5j8c2、5gj-5j6a、6gj-5k6a、11gj-5l11c、12gj-5j10e1、14gj-5l12c对这8个癌症细胞系也有抑制作用。
[0099]
(3)3,4-裂环环阿屯烷型四环三萜化合物对癌细胞周期的影响
[0100]
化合物1gj-5i5a经edu反应后用流式细胞仪检测细胞周期,细胞流式结果如图19所示(a、b、c、d图分别代表经过0μm、12μm、25μm、38μm加药处理后的结果),细胞周期条形统计图如图20,可以看出,经过12μm、25μm、38μm加药处理后,随着浓度的增加,进入复制期(s phase)的细胞比例增加,但是细胞edu嵌入的效率降低。
[0101]
化合物2gj-5i5b经edu反应后用流式细胞仪检测细胞周期,细胞流式结果如图21
所示(a、b、c、d图分别代表经过0μm、38μm、50μm、75μm加药处理后的结果),细胞周期条形统计图如图22,可以看出,经过38μm、50μm、75μm加药处理后,随着浓度的增加,周期分布趋势与1gj-5i5a处理后的一致。
[0102]
综上所述,本发明所涉及的3,4-裂环环阿屯烷型四环三萜化合物可以将细胞阻滞在复制期(s phase),降低dna的复制效率,从而影响细胞增殖。
[0103]
3、结论
[0104]
本发明所涉及的10种带有苯丙烯酸取代基的裂环环阿屯烷型三萜化合物和1种不带苯丙烯酸取代基的3,4-裂环环阿屯烷型三萜化合物对人乳腺癌细胞mcf7和人肝癌细胞hepg2均具有一定的细胞毒性作用,其中1gj-5i5a、3gj-5j9a、7gj-5h8a、14gj-5l12c毒性较强。
[0105]
1gj-5i5a、2gj-5i5b、3gj-5j9a、7gj-5h8a、8gj-5k10a这五种化合物对人结肠癌细胞株sw480、人肾癌细胞株786-o、人宫颈癌细胞株hela、人肝癌细胞株huh7、人胰腺癌细胞株panc-1、人前列腺癌细胞株pc3、人非小细胞肺癌细胞株a549、人三阴性乳腺癌细胞株mda-mb-231都有抑制作用,其中结肠癌细胞sw480、肾癌细胞786o、宫颈癌细胞hela对这批三萜化合物更敏感。
[0106]
通过实验数据合理推测得出4gj-5j8c2、5gj-5j6a、6gj-5k6a、11gj-5l11c、12gj-5j10e1、14gj-5l12c对人结肠癌细胞株sw480、人肾癌细胞株786-o、人宫颈癌细胞株hela、人肝癌细胞株huh7、人胰腺癌细胞株panc-1、人前列腺癌细胞株pc3、人非小细胞肺癌细胞株a549、人三阴性乳腺癌细胞株mda-mb-231均都有抑制作用。
[0107]
实施例2
[0108]
带苯丙烯酸取代基的3,4-裂环环阿屯烷型化合物的构效关系研究:
[0109]
化合物母核编号如下:
[0110][0111]
根据表2数据结果,比较1gj-5i5a、2gj-5i5b、3gj-5j9a、4gj-5j8c2、5gj-5j6a、6gj-5k6a、7gj-5h8a、8gj-5k10a、11gj-5l11c和12gj-5j10e1共10种带苯丙烯酸取代基的3,4-裂环环阿屯烷型化合物的ic
50
和结构的关系,可以得出构效关系总结如下:
[0112]
c-2羧基变酯基之后,活性下降1倍左右;
[0113]
c-4碳碳双键变单键之后,活性下降1-2倍;
[0114]
c-2’碳碳双键的顺反异构,反式结构活性比顺式结构高1-2倍;
[0115]
c-24碳碳双键的顺反异构,顺式结构活性比反式结构高1倍左右;
[0116]
c-25r1在甲基的基础上增加羟基,活性降低1-2倍;
[0117]
c-27增加羟基,活性没有明显变化;
[0118]
c-6’增加羟基,在顺式c-2’中,活性降低1倍左右,在反式c-2’中,活性没有明显变化。
[0119]
综上,此类化合物单个取代基的改变对化合物的活性改变相对较小,化合物活性降低之后,在人乳腺癌细胞mcf7的ic
50
仍然<50μm。
[0120]
实施例3
[0121]
不带苯丙烯酸取代基的3,4-裂环环阿屯烷型化合物的构效关系研究:
[0122]
本实施例对无苯丙烯酸取代的3,4-裂环环阿屯烷型四环三萜化合物xi、xii、xiii、xiv、xv、xvi的构效关系展开研究。按照实施例1所述的方法,将xii-xvi这五个化合物作用于人乳腺癌细胞mcf7,细胞活力与药物浓度之间的曲线图如图23所示,其中化合物xii的ic
50
为44.70μm,化合物xiii的ic
50
为42.21μm,其余三个化合物ic
50
>100μm,活性较低。并与ic
50
为19.96μm的化合物xi相比,可以得出活性与结构的关系。
[0123]
化合物母核编号如下:
[0124][0125]
总结如下:
[0126]
c-2羧基变酯基之后,活性下降;
[0127]
c-4碳碳双键变单键之后,活性下降;
[0128]
c-21增加羟基,活性增加;
[0129]
c-25r1和r2上甲基和醛基的影响相差不大;
[0130]
r2羟基变羧基,活性降低。
[0131]
综上,与有苯丙烯酸取代基的3,4-裂环环阿屯烷型化合物相比,相同碳位上相同取代基的改变对活性的影响趋势基本一样,但单个取代基对化合物活性的影响范围较大,故部分化合物活性很低。
[0132]
根据实施例2和3的分析结果,可以总结如下:
[0133]
(1)羧基与醛基、羟基均为含氧极性集团,从以上两部分内容可知带有苯丙烯取代基3,4-裂环环阿屯烷型化合物的r1、r2、r1'、r2'取代基对化合物活性的影响较小,故而可以为甲基、羟甲基、醛基或者是羧基。
[0134]
(2)符合通式1和通式2的带苯丙烯酸取代基的3,4-裂环环阿屯烷型化合物的抗肿
瘤活性较强。
[0135]
(3)符合通式3的3,4-裂环环阿屯烷型化合物的抗肿瘤活性较强。
[0136]
综上所述,本发明所涉及的裂环环阿屯烷型四环三贴化合物在体外表现出了良好的抗癌活性(如肝癌、乳腺癌、结肠癌、肾癌、宫颈癌、胰腺癌、前列腺癌、肺癌),可以抑制癌细胞的增殖,可用于制备抗癌的药物。
[0137]
申请人声明,本发明通过上述实施例来说明本发明的3,4-裂环环阿屯烷型四环三萜化合物在制备抗癌药物中的用途,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
[0138]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
[0139]
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1