JAK/STAT信号通路磷酸盐抑制剂在制备治疗DBA疾病的药物中的应用的制作方法
本发明属于生物医药技术领域,具体地,涉及jak/stat信号通路磷酸盐抑制剂在制备治疗dba疾病的药物中的应用。
背景技术:
先天性纯红细胞再生障碍性贫血又称diamond-blackfan贫血(diamond-blackfananemia,dba)是一种少见的先天性骨髓衰竭性疾病,其血液学特点为巨幼红细胞性贫血,网织红细胞计数减少,骨髓粒系、巨核系细胞增生正常、红系细胞明显缺乏,因diamond和blackfan于1938年首先报道而得名。欧美国家dba的发病率为5~7/100万,国内暂没有dba发病率的统计。dba虽然是一种少见的遗传性骨髓衰竭性疾病,但在儿童先天性骨髓衰竭性疾病中所占比例较高,仅次于范可尼贫血。dba—般在婴幼儿时期发病,95%的案例都是在3月龄至2周岁期间被诊断出来的。典型的表现除了在年幼时期出现不同程度的贫血,还通常伴有身体器官的发育异常和身材矮小等病征。大约50%患者会出现身体发育的异常,但是其严重性的表现程度大不相同。20%的患者通常有典型的颅面特征,比如五官距离过远、髙腭穹、鼻梁平坦、和腭裂等。20%左右的患者有拇指发育的异常。除此之外,还有大约40%的病人会出现颈部、上肢、泌尿系统和心血管系统的发育异常,这反映出dba是一种在发育上有多种异常表现的疾病。dba疾病大多数都是没有家族遗传史的,但是也有研究报道的病人有明显的家族遗传史。
dba患者通常表现为全血细胞缺乏,并伴有长期的较低的网织红细胞计数和幼红细胞减少症,而血小板和白细胞数通常是正常的,但是也可能会有轻度的血小板减少症、嗜中性白血球减少症、或者血小板增多症。dba的临床治疗目前是医学上的一大难题。dba临床体征与5q-综合征较为相似,但是治疗方案却不尽相同。研究显示,大约有70%的患者接受过甾类激素治疗,但是这种治疗方案并不适合于所有的病患,还是有40%左右的病患不得不长期依赖于输血治疗,除非他们有了合适的供体来移植造血干细胞。但是长期的甾类激素治疗或者铁超负荷也存在许多问题,比如会加重患者的发育迟缓,使身体的畸形变得更加糟糕等。当然自发的病情减轻也可能会发生,即使是长期依赖输血的病人,也有病情自发好转的情况。对北美的患者的跟踪研究显示,他们在40年内的生存率为75%,其中对激素治疗无效的患者有较低的平均寿命。大部分的患者的死亡都是由治疗直接或间接引发的,比如造血干细胞移植带来的并发症,铁超负荷等。患者还表现出比正常人高的恶性肿瘤的患病风险,比如急性髓系白血病,骨髓增生异常综合征和骨源性肉瘤的发病率都比较高。该疾病给患者和家庭带来了巨大的痛苦和负担,因此有效地防范并治疗这些疾病对于提高国民健康和人民生活水平有着重要的社会意义。
自1999年draptchinskaia首次报道dba病人存在核糖体蛋白rps19基因突变并作为第一个dba基因以来,大量的研究已证实约50%–60%的dba病人存在核糖体蛋白rps19、rps24、rps17、rps7、rps10、rps26、rps29、rpl5、rpl11、rpl35a、rpl26、rpl15基因或gata-1基因中一个或多个基因的致病性突变。至今为止,所有发现的dba致病基因的突变都是杂合性的,这与家族遗传性分析dba是常染色体显性的遗传模式的结论是一致的。而且研究发现,大部分的突变结果都导致了相应的核糖体蛋白质合成量不足,揭示dba的本质为核糖体疾病。
现阶段普遍认为在“核糖体压力”的条件下,p53信号通路会被激活,进而促进了它的许多靶基因的转录,并导致p53依赖的细胞周期终止、衰老或者调亡。最近的研究表型来自dba病人的红系前体细胞具有趋向凋亡的表型,该表型与p53的水平升高有关。dutt等研究cd34+原始骨髓细胞,发现其rps19或者rps14的水平降低,选择性的诱导p53在红系细胞中表达,nutilin阻碍p53与hdm2的联系,与a-抑制剂抑制p53具有相同的效应,p53的抑制能缓解红系细胞缺乏的表型;sieff等在小鼠肝细胞中敲除rps19基因,结果p53和p21的表达水平上调,细胞增殖减少与g1/s期延后;mcgowan等研究与dba抑制的rps19突变体老鼠模型,在p53基因敲除后,p53蛋白含量减少,rps19突变体小鼠的红系贫血得到缓解;在rps19缺陷的斑马鱼模型中,p53的抑制也能够减轻红细胞生成的损害。一系列证据表型p53的激活或者上调是dba的红系细胞生成障碍的关键因素。
技术实现要素:
本发明的目的在于提供jak/stat信号通路磷酸盐抑制剂在制备治疗dba疾病的药物中的应用,以开拓一种有效治疗dba疾病的新药物。
根据本发明的一个方面,提供jak/stat信号通路磷酸盐抑制剂在制备治疗dba疾病的药物中的应用。
优选地,jak/stat信号通路为jak2/stat3信号通路。
优选地,jak/stat信号通路磷酸盐抑制剂的靶点为jak2或stat3。
优选地,所述药物用于治疗dba疾病的贫血表型。
优选地,所述药物用于治疗由于rpl18突变而导致的dba疾病。
可选地,jak/stat信号通路磷酸盐抑制剂的靶点为stat3,jak/stat信号通路磷酸盐抑制剂选自bp-1-102、cryptotanshinone、hjc0152hydrochloride、ochromycinone中的一种或多种。
可选地,jak/stat信号通路磷酸盐抑制剂的靶点为jak2,jak/stat信号通路磷酸盐抑制剂选自az960、cep-33779中的一种或两种。
可选地,所述药物包含药学上可接受的辅料。
可选地,所述药物包含药用载体。
jak-stat信号通路是一条多种细胞因子共用的信号传导途径,其作用模式已基本搞清,但对其作用环节中的调控及与其它细胞因子信号传导途径的联系仍有待深入研究。jak-stat信号通路发现于干扰素的信号传导研究中,现在已知在几乎所有细胞因子信号的传递中,该途径都发挥着重要的作用。jak即januskinase(两面神激酶),是一种非受体型酪氨酸蛋白激酶(ptk)。该族成员有7个同源区(jh1~7),其中jh1区为激酶区,jh2区为伪激酶区。与其它ptk不同,jak内无src同源区2(sh2)结构,因其既能催化与之相连的细胞因子受体发生酪氨酸磷酸化,又能磷酸化多种含特定sh2区的信号分子从而使其激活。stat即signaltransducersandactivatorsoftranscription(信号传导及转录激活因子),含有sh2和sh3结构域,可与特定的含磷酸化酪氨酸的肽段结合。当stat被磷酸化后,发生聚合成为活化的转录激活因子形式,进入胞核内与靶基因结合,促进其转录。现在已克隆成功4种jak(jak1~3和tyk2)与6种stat(stat1~6)。
在现有技术中,从未有关于利用作用于jak/stat信号通路的磷酸化抑制剂以治疗dba疾病的报道被公开。我们研究发现通过抑制jak2或stat3的磷酸化反应能够有效缓和dba模型中的贫血缺陷。通过对dba不同基因模型进行研究和测试,我们发现stat3的过磷酸化可能是dba不同基因模型常见的现象。特别地,在这项工作中,我们提供了一种新的dba基因模型——rpl18突变型的dba模型,得出jak2/stat3的信号通路参与dba发病机制,并成功地采用靶向jak2或stat3的磷酸化抑制剂提高rpl18突变型的dba模型的血细胞水平。具体而言,对rpl18突变型的dba模型分别施用bp-1-102、cryptotanshinone、hjc0152hydrochloride、ochromycinone这四种靶向stat3的磷酸化抑制剂以及az960、cep-33779这两种靶向jak2的磷酸化抑制剂都能够在一定程度上改善rpl18突变型的dba模型的贫血表型。
附图说明
图1为rpl18-/-野生型和rpl18-/-突变体的基因组序列对比示意图;
图2为对照斑马鱼和rpl18-/-突变体斑马鱼的wish结果;
图3为邻联茴香胺染色结果,图中的箭头分别指向无rpl18mrna注射组斑马鱼和rpl18mrna注射组斑马鱼的邻联茴香胺染色阳性部位;
图4为关于gata1的wish结果;
图5为关于hbae1.1的wish结果;
图6为关于hbbe1.1的wish结果;
图7为细胞核的wright-giemsa染色结果;
图8为rpl18-/-突变体胚胎的kegg通路分析结果;
图9为将以rpl18-/-突变体胚胎构建的空白组和治疗组在3hpf时的邻联茴香胺染色结果,图中的箭头分别指向对应治疗组胚胎的邻联茴香胺染色阳性部位;
图10为无注射stat3camrna与有注射stat3camrna的野生型斑马鱼的邻联茴香胺染色结果;
图11为无注射stat3dnmrna和有注射stat3dnmrna的对照组斑马鱼、无注射stat3dnmrna和有注射stat3dnmrna的rpl18-/-突变体斑马鱼的邻联茴香胺染色结果;
图12为wt、mu)、mu+bp和mu+az的westernblot实验结果。
具体实施方式
为了使本技术领域的人员更好地理解本发明方案,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。
实施例1
斑马鱼是脊椎动物模式生物,拥有人类所拥有的绝大多数器官系统。研究者发现斑马鱼的基因序列与人类基因序列有87%的相似性;与其他物种包括哺乳类相比,斑马鱼重要器官发生中的许多关键作用分子以及重要事件在在进化和功能方面都有很强的保守性,尤其是在胚胎发育,血液发生等研究中得到了广泛应用。此外由于斑马鱼体型小、子代数量多、胚胎发育迅速,非常适合大规模的遗传与药物筛选,也可以为筛选治疗dba疾病的有效药物提供强有力的工具。因此,本实施例将利用模式生物斑马鱼构建dba模型,以深入探讨jak/stat信号通路的磷酸化抑制剂对dba疾病的调控。
在本实施例中所涉及的实验材料以及相应的具体操作方式如下。
1.构建rpl18突变型的dba模型
1.1动物管理方式
在28.5℃下,斑马鱼按照标准实验室条件饲养和维护。本实施例所涉及的所有斑马鱼实验均获北京大学动物护理与使用委员会(iacuc)批准。
1.2构建模板
对斑马鱼的rpl18基因进行扩增,并将其亚克隆后接入载体pcs2+,然后利用noti(neb)消化,由此获得的模板用于mrna合成。
1.3合成cas9mrna和sgrna
合成zcas9mrna:
利用xbai消化线性化得到的mrna模板,并采用tianquik迷你纯化试剂盒对mrna模板进行纯化。使用t3mmessagemmachine试剂盒合成zcas9mrna,并采用rneasyffpe试剂盒对zcas9mrna进行纯化。
合成sgrna
本研究中所有sgrna(single-guiderna)模板均采用与克隆无关的sgrna生成方法制备。所有sgrna均使用t7rna聚合酶在体外转录,并使用
利用1.5%的琼脂糖凝胶电泳检测本实施例所合成的mrna和sgrna的大小和质量。
1.4构建rpl18-/-同源突变体
向单细胞级的斑马鱼胚胎中同时注入zcas9mrna(200ng/μl)溶液1-2nl和sgrna(30ng/ul)溶液1-2nl。在28.5℃下孵育这些胚胎,以观察表型和pcr扩增。将上述胚胎培养其至成年,并标记为f0。以f0代的成年斑马鱼作为rpl18-/-野生型,收集了其子一代胚胎。采用序列为5’-atgcgtcagttttggccagt-3’(seqidno.1)的上游引物和序列为5’-tgtggacggagagcttttca-3’(seqidno.2)的下游引物对其后代胚胎目标部位的侧翼区域进行pcr扩增。纯化的pcr产物由常用于ta克隆的peasy-t1simplecloning试剂盒制备,然后对pcr产物进行测序。将f0斑马鱼的子一代培育至成年,并标记为f1。为了识别传播f1鱼的生殖系,性成熟f1的尾巴被切断,以获得基因组,然后对其进行基因分型。基因分型的操作如下:
胚胎被放置在离心管中,浸入10μl的50mmnaoh中,然后在95℃下孵育20分钟,重复两次,离心。离心后,将1μl的1mtrishcl(ph8.0)添加到清液中。最后,对制备的dna进行扩增,并利用序列为5’-acacctctgtgctttttgtgc-3’(seqidno.3)的上游引物和序列为5’-acataccctgtctcccttgc-3’(seqidno.4)的下游引物对其进行测序以识别基因型。rpl18+/-f1杂合子对交叉并生成rpl18-/-同源突变体。
1.5胚胎的整体原位杂交(wholemountinsituhybridization,wish)
分别对24hpf和48hpf的对照胚胎和rpl18-/-突变体胚胎进行整体原位杂交(wholemountinsituhybridization,wish),具体操作如下:
使用多聚甲醛溶液(4%pfa),在4℃将胚胎固定,胚胎经过固定和梯度脱水后,能够在-20℃长期保存。以线性质粒用作模板,使用digrna标记混合物和t7rna聚合酶合成二角基因标记的反义探针。利用
1.6实时定量pcr(quantitativereal-timepcr,qrt-pcr)分析
利用实时定量pcr(quantitativereal-timepcr,qrt-pcr)分别分析24hpf和48hpf的对照胚胎和rpl18-/-突变体胚胎的rpl18转录本,具体操作如下:
使用
1.7构建结果
将rpl18-/-野生型和的基因序列进行对比,如图1所示,揭示了rpl18-/-突变体含有四对碱基对(bp)缺失的突变,由此确认在斑马鱼中成功靶向rpl18。这种突变导致原本包括rpl18-/-突变体了164个氨基酸的rpl18蛋白(seqidno.5)被截断,rpl18-/-突变体的rpl18蛋白(seqidno.6)只含有57个氨基酸。
wish结果如图2所示,对照胚胎中观察到rpl18的强烈表达,然而,在rpl18-/-突变体中,几乎没有观察到任何rpl18表达。进一步地,qrt-pcr结果显示,与对照胚胎相比,rpl18-/-突变体胚胎的rpl18转录本明显降低。qrt-pcr结果与wish结果相符,证明本实施例构建的rpl18-/-同源突变体具有较高的可靠性。
2.rpl18缺陷导致的dba贫血表型
通过胚胎进行邻联茴香胺(o-dianisidine)染色以研究rpl18对机体血细胞水平的影响作用。采用无rpl18缺陷的对照胚胎作为对照组,将rpl18-/-突变体胚胎分为无rpl18mrna注射组和rpl18mrna注射组,向rpl18mrna注射组的胚胎注射斑马鱼rpl18mrna(100pg/胚胎)。在3hpf,对对照组、无rpl18mrna注射组和rpl18mrna注射组的胚胎分别进行邻联茴香胺染色。
2.1邻联茴香胺染色实验操作
使用多聚甲醛溶液(4%pfa),在4℃将胚胎固定,随后采用pbst缓冲液洗涤胚胎4次(每次5分钟)。然后,利用邻联茴香胺染色溶液(40%无水乙醇、0.65%过氧化氢、10mm醋酸钠和0.6mg/ml邻联茴香胺),在黑暗中染色胚胎染色孵育时间为50分钟。孵育后,在pbst缓冲液中清洗胚胎4次(每次5分钟),然后,加入漂白液(1%氢氧化钾,3%过氧化氢),直到胚胎的色素沉着被去除。最后,利用pbst缓冲液洗涤胚胎,并通过显微镜(zeiss,discovery.v2.0)成像。
2.2邻联茴香胺染色结果
与对照胚胎相比,无rpl18mrna注射组胚胎中的红细胞(邻联茴香胺染色阳性细胞)数量大大减少,这表明rpl18蛋白在斑马鱼胚胎成熟红细胞的生产或维持中具有作用,与无rpl18mrna注射组胚胎相比,rpl18mrna注射组胚胎中的红细胞明显增多,从而说明rpl18突变可能是dba患者的致病性突变。
3.rpl18-/-突变体的红细胞生成情况分析
3.1造血标记物的wish实验
通过为不同发育阶段的几种造血标记物进行了wish(按照上述内容进行操作),以评估rpl18缺陷对突变胚胎红细胞生成的影响。
我们发现,在24hpf–30hpf,红细胞系的最早标记之一的gata1的表达水平随着时间的延长而稍有升高,如图4所示。由此,猜想其中有某些机制促进gata1在rpl18-/-突变体中表达。
然后,我们研究了两个珠蛋白转录本hbae1.1和hbbe1.1的表达模式。如图5、图6所示,rpl18-/-突变体胚胎的hbae1.1表达水平和hbbe1.1表达水平在24hpf前波动不大,但在36hpf–72hpf,hbae1.1表达水平和hbbe1.1表达水平皆呈下降趋势。
3.2细胞核观测实验
本节内容中所涉及的wright-giemsa染色的具体操作如下:
在60hpf,利用三联苯麻醉斑马鱼胚胎,然后浸入混合物溶液(40%胎牛血清和含有最终浓度为5mmedta的pbs缓冲液)。使用微注射针从心脏收集红细胞。在1000rpm下离心红细胞溶液5分钟,上清液被丢弃。然后,将富集细胞均匀地涂抹在载波片上,并迅速风干。使待测红细胞在甲醇中固定5分钟后,载玻片在现配的wright-giemsa染色溶液中浸泡10分钟。最后,用去离子水冲洗载玻片。待测红细胞经历空气干燥后,使用100x镜头捕获图像,并将图像结果现有技术以评价红细胞的状态。
显然,rpl18突变体中的红细胞在这个时间点被逮捕,表明红细胞的成熟在rpl18突变体中受损。
在2.5hpf时,收集经过wright-giemsa染色而分离的斑马鱼胚胎红细胞,如图7所示,此时对照胚胎的红细胞已经处于成熟期,然而,在rpl18-/-突变体中依然能够检测到处于嗜碱性期的红细胞,由此说明rpl18-/-缺陷导致rpl18-/-突变体的红细胞发育受阻,成熟期迟缓,正因如此导致了贫血表型的产生。另外,rpl18-/-突变体中红细胞的细胞核大小比对照胚胎大得多,也就是说rpl18-/-突变体中红细胞的细胞核的负担相对较重。
4.kegg通路分析
为了更全面地了解rpl18对斑马鱼发育的影响机制,我们利用rna序列来分析rpl18-/-突变体胚胎的珠蛋白转录本的变化。对于信号通路的分析,kegg作为一个整合了基因组、化学和系统功能信息的数据库,能够为研究者提供更为丰富的生物学信息。如图8所示,kegg通路分析表明,p53信号通路、细胞周期、jak-stat信号通路和核糖体生物发生在rpl18-/-突变体中显著中断。由此证实,rpl18缺陷确实会影响核糖体相关的基因表达。毫无意外地,p53信号通路及其下游基因的表达量在rpl18-/-突变体中得到了升高。使用p53反义寡核苷酸(p53morpholinos)抑制p53信号通路的活性仅部分地挽救了rpl18-/-突变体形态缺陷和贫血表型,表明rpl18缺陷诱导dba的发病机制还可能涉及其他因素或途径。在图8所列举的信号通路中,jak-stat信号通路在rpl18-/-突变体胚胎中异常激活。更重要的是,qrt-pcr分析表明,jak-stat通路相关基因(如il6、il6st、stat3、irf9、socs3a和socs3b)的表达量得到了升高。
现有技术表明,磷酸化的stat3通过直接蛋白-蛋白质相互作用抑制gata1,而gata1可以逆转stat3介导的人类红细胞γ-珠蛋白基因;然而,在我们的rpl18突变dba模型中,gata1表达在24hpf–30hpf略有增加(如图4所示)。因此,磷酸化的stat3和gata1之间可能存在一种正反馈机制,其中stat3的磷酸化反应促进gata1表达,但同时也抑制了gata1活性。
5.jak/stat信号通路的磷酸化抑制剂对dba模型的红细胞发育的影响
为了研究jak/stat信号通路以及该通路上的不同位点对dba模型中红细胞发育的影响,将rpl18-/-突变体胚胎暴露于针对jak-stat信号通路不同位点的小分子抑制剂。
5.1主要试剂及试剂的预处理方式
本节内容所需的主要试剂在表1中列出。所有的抑制剂均分别溶解在dmso中,按照10mm的抑制剂浓度配制dmso溶液,并储存在-80℃。注意避免反复冻结和解冻抑制剂而影响抑制剂的活性。
表1参试的小分子抑制剂种类及其相关信息
5.2动物分组与管理方式
在6hpf时,将来自同一亲源的同一父母的rpl18-/-突变体胚胎分成一个空白组和12个治疗组,每组包括30个胚胎,每个胚胎为一个重复。将治疗组的胚胎置于含有单一种表1中列举的磷酸化抑制剂的在1xholt缓冲液中孵育,每组治疗组对应一种磷酸化抑制剂,对照组在不含有磷酸化抑制剂的1xholt缓冲液中孵育。
5.3邻联茴香胺染色
在3hpf时,对空白组和治疗组的胚胎进行邻联茴香胺染色。根据邻联茴香胺染色结果表明,以下六种小分子抑制剂在不同程度上缓解了rpl18-/-突变体胚胎的贫血表型,上述小分子抑制剂的具体包括:
四种靶向的stat3的特异性磷酸化抑制剂:bp-1-102、cryptotanshinone、hjc0152hydrochloride、ochromycinone;
两种靶向jak2的特异性磷酸化抑制剂:az960、cep-33779。
参照有效作用的小分子抑制剂分别对应的邻联茴香胺染色结果(图9–11),在3hpf时:分别采用bp-1-102(给药量:2.5μm)、cryptotanshinone(给药量:1μm)、hjc0152hydrochloride(给药量:5μm)、ochromycinone(给药量:2.5μm)对突变胚胎施药,突变胚胎的邻联茴香胺染色显示红细胞出现明显的恢复;分别采用az960(给药量:0.1μm)、cep-33779(给药量:5μm)对突变胚胎施药,突变胚胎的红细胞也得到部分恢复。对应上述6种有效作用的小分子抑制剂的邻联茴香胺染色结果如图9所示。
为了在分子水平上进一步验证stat3对dba模型中红细胞发育的影响机制,将stat3camrna(具有组织活性的人类stat3mrna)注射到斑马鱼的野生型胚胎中,并在3hpf时对野生型胚胎进行邻联茴香胺染色。在注射了stat3camrna后,从图10中可以看到,野生型斑马鱼胚胎的血红蛋白明显减少(图10中的箭头指出斑马鱼中原本应呈邻联茴香胺染色阳性的部位在注射了stat3camrna的斑马鱼体内呈邻联茴香胺染色阴性),这表明stat3的过度磷酸化足以损害红细胞发育。而将stat3dnmrna(显性失活的人类stat3mrna)分别注射到野生型对照胚胎和rpl18-/-突变体胚胎中,对照胚胎的红细胞表达水平没有明显变化,然而rpl18-/-突变体胚胎的红细胞表达水平得到了明显程度的提高(图11)。
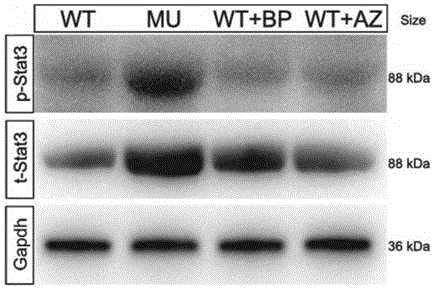
5.4蛋白质印迹法(westernblot)实验
在3hpf时,以野生型斑马鱼(wt)、无注射抑制剂的rpl18-/-突变斑马鱼(mu)、注射了bp-1-102的rpl18-/-突变斑马鱼(mu+bp)和注射了az960的rpl18-/-突变斑马鱼(mu+az)作为测试对象,开展westernblot实验。结果如图12所示,mu的stat3(t-stat3)的水平和内源性stat3蛋白(p-stat3)的磷酸化水平明显高于wt。在注射了相应的抑制剂后,与mu相比,mu+bp和mu+az的t-stat3水平和p-stat3水平均得到显著下降。westernblot实验结果进一步证实,抑制stat3的磷酸化或抑制jak2的磷酸化都能够改善挽救本实施构建的rpl18-/-突变dba模型中的贫血表型。我们得出结论,rpl18缺陷可能通过激活jak/stat信号通路的磷酸化反应从而阻碍红细胞的生长发育。
最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对其限制,尽管参照上述实施例对本发明进行了详细的说明,所属领域的普通技术人员应当理解,技术人员阅读本申请说明书后依然可以对本发明的具体实施方式进行修改或者等同替换,但这些修改或变更均未脱离本发明申请待批权利要求保护范围之内。
sequencelisting
<110>深圳百奥捷生物科技有限公司,深圳探影生物科技有限公司
<120>jak/stat信号通路磷酸盐抑制剂在制备治疗dba疾病的药物中的应用
<130>
<160>6
<170>patentinversion3.5
<210>1
<211>20
<212>dna
<213>人工序列
<400>1
atgcgtcagttttggccagt20
<210>2
<211>20
<212>dna
<213>人工序列
<400>2
tgtggacggagagcttttca20
<210>3
<211>21
<212>dna
<213>人工序列
<400>3
acacctctgtgctttttgtgc21
<210>4
<211>20
<212>dna
<213>人工序列
<400>4
acataccctgtctcccttgc20
<210>5
<211>164
<212>prt
<213>人工序列
<400>5
metglyvalaspilearghisasnlysasparglysvalhisarglys
151015
gluprolysserglnaspiletyrleuargleuleuvallysleutyr
202530
argpheleuserargargseraspalapropheasnlysvalileleu
354045
argargleuphemetserlysthrasnargproproleualaleuser
505560
argleuilearglysmetlysleuproglyarggluasnleuthrala
65707580
valvalvalglythrilethraspaspvalargileglnasnilepro
859095
lysleulysvalcysalaleulysvalthraspargalaargserarg
100105110
ileleulysalaglyglyglnilemetthrpheaspglnleualaleu
115120125
thrserproargglyargglythrvalleuleuserglyproarglys
130135140
glyargglnvaltyrarghispheglylysalaproglythrprohis
145150155160
serhisthrlys
<210>6
<211>57
<212>prt
<213>人工序列
<400>6
leuargleuleuvallysleutyrargpheleuserargargserasp
151015
alapropheasnlysvalileleuargargleuphemetserlysthr
202530
asnargproproleualaleuserargleuilearglysmetlysleu
354045
proglyarggluasnleuthralaval
5055
- 还没有人留言评论。精彩留言会获得点赞!