糖基聚醚化合物在制备抗RNA病毒药物中的用途
糖基聚醚化合物在制备抗rna病毒药物中的用途
技术领域
1.本发明涉及生物医药领域,具体地,本发明涉及糖基聚醚化合物在制备抗rna病毒药物中的用途。
背景技术:
2.rna病毒具有比较强的致病能力,以黄病毒科病毒和冠状病毒为例。黄病毒科病毒是一类具有包膜结构的单正链rna病毒,该类病毒通过节肢动物如蚊、蜱、白蛉等虫媒传播而引起感染。主要包括登革病毒、流行性乙型脑炎病毒、森林脑炎病毒、基肯孔雅病毒、黄热病毒和丙型肝炎病毒等。目前对于此类病毒大部分尚无有效疫苗用于预防,也无临床特效药。因传播途径主要通过感染病毒的伊蚊类蚊虫叮咬,故现阶段预防措施主要为防蚊控蚊,但此类办法不能彻底切断病毒扩散和传播,且防蚊控蚊措施主要为生物控蚊和化学控蚊,容易对人类本身造成带来一定的损伤。
3.冠状病毒是一类具囊膜(envelope)、基因组为线性单股正链的rna病毒,是自然界广泛存在的一大类病毒。已经发现的冠状病毒包括hcov-229e、hcov-oc43、hcov-nl63、hcov-hku1、sars-cov(引发重症急性呼吸综合征)和mers-cov(引发中东呼吸综合征)。近期在国内甚至国外肆虐的人类新型冠状病毒(sars-cov-2)以其高致病性以及传播速度迅速,已导致数万人感染。
4.研究开发抗rna病毒的药物,用于治疗rna病毒所引起的诸多疾病,尤为迫切。
技术实现要素:
5.本发明旨在至少解决现有技术中存在的技术问题之一,提供了一种糖基聚醚类化合物在制备抗rna病毒的药物中的用途。
6.发明人经过研究发现,糖基聚醚类化合物或其药学上可接受的盐可以影响rna病毒的蛋白功能和结构,破坏病毒复制和感染周期的多个阶段,可以达到广谱的抗病毒效果,尤其是能够用来抑制黄病毒科病毒或冠状病毒等的增殖。因此利用糖基聚醚类化合物或其药学上可接受的盐制备药物或者试剂盒,可以用于抗rna病毒。
7.为此,在本发明的第一方面,本发明提出了糖基聚醚化合物或其药学上可接受的盐在制备药物中的用途。根据本发明的实施例,所述药物用于抗rna病毒。本发明的发明人经过大量研究证明糖基聚醚类化合物会大范围影响宿主细胞代谢通路,影响钙离子通道蛋白,影响病毒的核蛋白、包衣前体、糖蛋白和基质蛋白功能,破坏病毒复制和感染周期的多个阶段,可以达到广谱的抗病毒效果,尤其是能够用来抑制黄病毒科病毒或冠状病毒等的增殖。
8.根据本发明的实施例,以上所述的糖基聚醚化合物或其药学上可接受的盐在制备抗rna病毒药物中的用途可以进一步包括如下技术特征:
9.根据本发明的实施例,所述rna病毒包括选自黄病毒科病毒、冠状病毒科病毒中的至少一种。所提供的糖基聚醚化合物或其药学上可接受的盐能够通过改变这些病毒所寄生
的宿主细胞环境来抑制此类病毒的生存方式,从而为其开发成广谱抗rna病毒药物提供巨大可能。根据本发明的实施例,所述rna病毒包括选自寨卡病毒、登革热病毒、日本脑炎病毒、新型冠状病毒、西尼罗河病毒、基孔肯雅病毒中的至少一种。
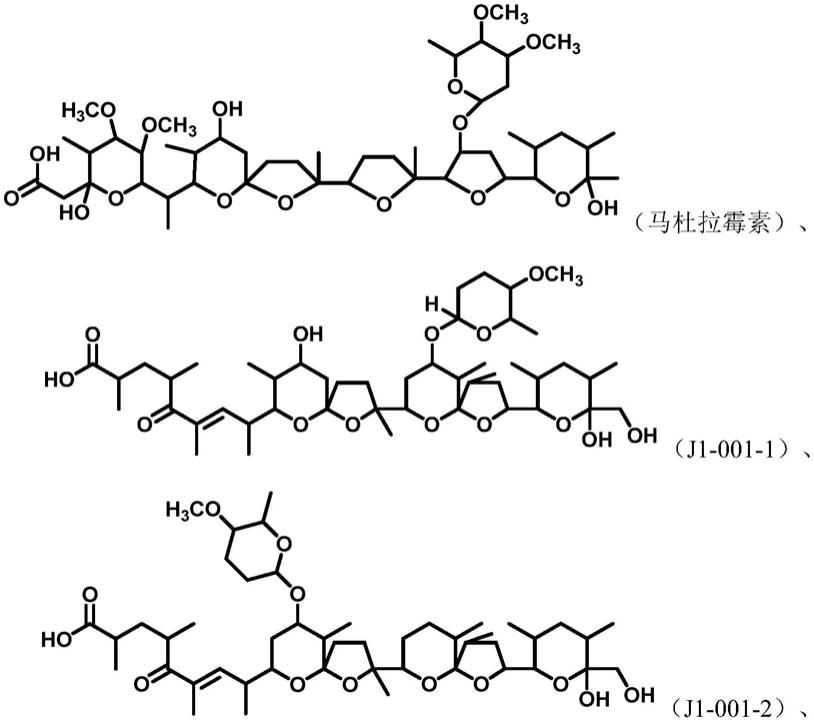
10.根据本发明的实施例,所述糖基聚醚化合物包括选自具有下列结构式的化合物中的至少一种:
[0011][0012][0013]
根据本发明的实施例,所述药物可以为液体制剂或者固体制剂。液体制剂包括但不限于溶液、胶体、微粒制剂、乳剂、混悬剂中的至少一种。糖基聚醚化合物或其药学上可接
受的盐可以与常用辅料制备成液体制剂或者固体制剂等多种剂型,用于于阻断rna病毒在细胞内的复制和繁殖,从而可以用于杀死rna病毒或者预防或者治疗由rna病毒引起的疾病。
[0014]
根据本发明的实施例,糖基聚醚类药物可以和药学上可用的辅料制备成任何剂型。例如包括但不限于溶液剂、胶体、微粒制剂、乳剂、混悬剂、片剂、胶囊、滴丸、气雾剂、丸剂、粉剂、颗粒剂、栓剂、冻干粉针剂中的至少一种。
[0015]
当然,也可以为了进一步提高药物的治疗效果或者实现精准用药,可以根据需要,采用药物制剂领域常用的辅料,制备成缓释制剂、控释制剂、靶向制剂及各种微粒给药系统。
[0016]
根据本发明的实施例,所制备的药物可以呈口服或者注射剂。采用注射剂的方式,可以有效地被细胞吸收,提高药物的生物利用度。其中注射剂的给药方式包括静脉注射、肌肉注射、腹腔注射、皮下注射和皮内注射等。根据本发明的实施例,可以利用脂质体包裹糖基聚醚类化合物,形成药物,用于rna病毒的治疗。
[0017]
根据本发明的实施例,所述药物为注射剂,所述注射剂中包含的所述的糖基聚醚类化合物或其药学上可接受的盐的浓度为0.001μm-10μm,例如为0.01μm-10μm或者0.1μm-10μm,1μm-10μm。
[0018]
在本发明的第二方面,本发明提供了糖基聚醚化合物或其药学上可以接受的盐在制备试剂盒中的用途,所述试剂盒用于抗rna病毒。
[0019]
根据本发明的实施例,所述试剂盒包括各自独立的试剂单元,每个所述试剂单元含有所述糖基聚醚化合物或其药学上可接受的盐,所述所述糖基聚醚化合物或其药学上可接受的盐的浓度为0.001μm-10μm。例如可以为0.01μm-10μm,0.1μm-10μm,1μm-10μm等。
[0020]
在本发明的第三方面,本发明提供了一种体外非治疗性抑制rna病毒对细胞侵袭的方法,包括:在糖基聚醚类化合物或其药学上可接受的盐的存在下,对rna病毒和细胞进行共培养。根据本发明的实施例,所述细胞为rna病毒感染的细胞或者病毒未感染的细胞。所提到的rna病毒可以为上述提到的rna病毒。应用rna病毒感染的细胞作为施用对象,与糖基聚醚化合物和rna病毒共同作用,可以在细胞水平上研究或者验证不同糖基聚醚化合物对于rna病毒的治疗效果。应用病毒未感染的细胞作为施用对象,与糖基聚醚化合物和rna病毒共同作用,可以在细胞水平上研究或者验证不同糖基聚醚化合物对于rna病毒的预防效果。以此可以确定不同糖基聚醚化合物的合适用量,从而可以应用于制药工艺或者试剂盒的制备工艺中,并进一步指导临床用药或者科研。
[0021]
在本发明的第四方面,本发明提供了一种糖基聚醚化合物或其药学上可接受的盐在制备药物中的用途,所述药物用于治疗rna病毒引起的疾病。
[0022]
在本发明的第五方面,本发明还提供了一种预防和/或治疗rna病毒感染的方法,包括向所需要的对象施用治疗有效量的糖基聚醚化合物或其药学上可接受的盐。其中所提到的所需要的对象可以是感染或易感rna病毒的对象。可以为动物。所提到的动物包括人。
[0023]
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
[0024]
图1是根据本发明的实施例提供的不同药物在体外对jev病毒的抑制实验结果图。
[0025]
图2是根据本发明的实施例提供的不同药物在体外对sars-cov-2病毒的抑制实验结果图。
[0026]
图3是根据本发明的实施例提供的不同处理组的c57小鼠感染日本脑炎病毒后体重的变化图。
[0027]
图4是根据本发明的实施例提供的不同处理组的c57小鼠感染日本脑炎病毒后1天后血液的病毒量图。
[0028]
图5是根据本发明的是实施例提供的不同处理组的c57小鼠感染日本脑炎病毒后12天后小鼠的存活情况图。
具体实施方式
[0029]
下面详细描述本发明的实施例,需要说明的是,所描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
[0030]
本文中,无论是“糖基聚醚化合物”、“糖基聚醚类化合物”均是指带有糖基修饰的聚醚类化合物。
[0031]
本发明提供了一种糖基聚醚化合物或其药学上可接受的盐在制备药物中的用途,所述药物用于抗rna病毒或者用于预防和/或治疗rna病毒引起的疾病。糖基聚醚化合物能够改变rna病毒在宿主细胞中的寄生环境,破坏蛋白结构,从而抑制rna病毒的增殖。尤其是对于黄病毒科病毒和冠状病毒科病毒具有显著的抑制效果。根据本发明的实施例,所提到的黄病毒科病毒包括但不限于寨卡病毒mex2-81毒株、西尼罗河病毒(wnv-kunjin)、基孔肯雅病毒(chikv-mkate)、登革热病毒denv2-ngc毒株中的至少一种。所提到的冠状病毒科病毒包括但不限于sars-cov-1毒株、mers-cov毒株、sars-cov-2毒株中的至少一种。
[0032]
所提到的rna病毒引起的疾病包括由rna病毒直接引起的疾病或者rna病毒间接引起的疾病。包括但不限于一些呼吸系统疾病或者脑炎、中枢神经病变、出血热、双相热、免疫系统低下等相关疾病。
[0033]
例如,冠状病毒可能引发肺部感染、呼吸困难等呼吸系统疾病以及一些继发性疾病;黄病毒科病毒包括70余种病毒,与人类疾病密切相关的至少有以下24种:登革热病毒(denv)、日本脑炎病毒(jev)、蜱媒脑炎病毒(tbev)、黄热病病毒(yfv)、西尼罗病毒(wnv)、圣路易脑炎病毒(slev)、库宁病毒(kunv)、墨累谷脑炎病毒(mvev)、罗西奥病毒(rocv)、西门利克病毒(sfv)、波瓦生病毒(powv)、马雅罗病毒(mayv)、科萨努尔森林病病毒(kfdv)、鄂木斯克出血热病毒(ohfv)、韦塞尔斯布朗病病毒(wdv)、跳跃病病毒(liv)、伊利乌斯病毒(ilhv)、布尼安姆韦拉病毒(bunv)、科科贝拉(kokv)、乌苏图(usuv)、riobravo encephalitis(rbev)、negishi encephalitis(negv)、cell fusing agent(cfav)和kamiti river(krv)等病毒,可引起包括脑炎、中枢神经病变、出血热、双相热、免疫系统低下、迟缓性瘫痪和黄疸等疾病,其中西尼罗、圣路易、登革等可通过母婴垂直传播引起流产、早产和死胎等现象。
[0034]
应用糖基聚醚类化合物可以用于治疗这些rna病毒所引起的疾病,并以寨卡病毒、登革热病毒、日本脑炎病毒、新型冠状病毒、西尼罗河病毒、基孔肯雅病毒为例,将糖基聚醚
类化合物对于这些病毒的抑制作用进行了验证,呈现在后续具体实施例中。结果表明这些糖基聚醚类化合物表现出良好的rna病毒抑制效果。针对其他rna病毒的治疗效果未专门示出。
[0035]
本发明还提供了一种预防和/或治疗rna病毒感染的方法,包括向所需要的对象施用治疗有效量的糖基聚醚化合物或其药学上可接受的盐。
[0036]
本发明所使用的术语“治疗”用于指获得期望的药理学和/或生理学效果。所述效果就完全或部分预防疾病或其症状而言可以是预防性的,和/或就部分或完全治愈疾病和/或疾病导致的不良作用而言可以是治疗性的。本文使用的“治疗”涵盖哺乳动物的疾病,包括:(a)在容易患病但是尚未确诊得病的个体中预防疾病或病症发生;(b)抑制疾病,例如阻滞疾病发展;或(c)缓解疾病,例如减轻与疾病相关的症状。本文使用的“治疗”涵盖将药物或化合物给予个体以治疗、治愈、缓解、改善、减轻或抑制个体的疾病的任何用药,包括但不限于将含本文所述聚醚类化合物、或其药学上可接受的盐的药物给予有需要的个体。
[0037]
在施用药物时,药物的给药频率和剂量可以通过多个相关因素被确定,该因素包括要被治疗的疾病类型,给药途径,病人年龄,性别,体重和疾病的严重程度以及作为活性成分的药物类型。根据本发明的一些实施例,日剂量可分为适宜形式的1剂、2剂或多剂,以在整个时间段内以1次、2次或多次给药,只要达到治疗有效量即可。
[0038]
本发明所使用的术语“治疗有效量”是指化合物足以显著改善某些与疾病或病症相关的症状的量,也即为给定病症和给药方案提供治疗效果的量。例如,在黄病毒科病毒或流感病毒等相关疾病治疗中,减少、预防、延缓、抑制或阻滞疾病或病症的任何症状的药物或化合物应当是治疗有效的。治疗有效量的药物或化合物不需要治愈疾病或病症,但将为疾病或病症提供治疗,使得个体的疾病或病症的发作被延缓、阻止或预防,或者疾病或病症的症状得以缓解,或者疾病或病症的期限被改变,或者例如疾病或病症变得不严重,或者加速康复。
[0039]
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
[0040]
实施例1马杜拉霉素的制备
[0041]
马杜拉霉素主要通过工程改造的链霉菌株发酵分离获得,具体发酵分离方法如下:
[0042]
1)将菌种接种于固体培养基中进行分单,挑选饱满的正常单菌落,进行效价验证,挑选效价高者作为保留菌种供应发酵分离产物使用。同时对菌种进行无杂菌试验,要求无杂菌。后将高产菌株依次接种于摇瓶种子培养基培养成熟,成为母瓶摇瓶种子、一代子瓶种子和二代子瓶种子,检验无杂菌者,一代种子和二代种子均可进行大规模发酵。固体培养基配方如下:琼脂粉(20.0g/l)、葡萄糖(10.0g/l)、酵母膏(2.5g/l)、牛肉浸出膏(2.5g/l)、酶水解酪素(4.0g/l)、蒸馏水若干、ph为7.4。种子摇瓶配方如下:葡萄糖(10.0g/l)、黄豆饼粉(20.0g/l)、蛋白胨(5.0g/l)、牛肉膏(3.0g/l)、酵母膏(5.0g/l)、琼脂粉(0.5g/l)、自来水若干、ph为7.4。发酵摇瓶配方如下:葡萄糖(60.0g/l)、羽毛粉(24.0g/l)、磷酸氢二钾(0.15g/l)、硫酸铁(0.05g/l)、轻质碳酸钙(1.0g/l)、氯化钠(3.0g/l)、玉米浆(4.0g/l)、自
来水若干、ph为7.4。接种量:按4~10%接种量用无菌吸管接入发酵摇瓶。培养基灭菌:120-125℃灭菌30分钟。培养条件:32
±
2℃,5~10天(9天为宜)。
[0043]
2)大规模摇瓶发酵7-8天后,将所有的发酵液收集离心分为上清液和菌丝体,其中上清液用等量的乙酸乙酯萃取,乙酸乙酯重复1次,合并有机相,真空旋蒸浓缩;菌丝体加入丙酮莫过菌丝体超声破碎菌丝体20min,离心取上清,菌丝体丙酮超声重复一次,合并上清液,旋蒸除去丙酮,加入少量的水用乙酸乙酯萃取,重复一次,合并有机相真空旋蒸浓缩。
[0044]
3)在旋蒸瓶中加入少量的的硅胶,缓慢旋蒸使样品都吸附到硅胶上,然后取出粉末并黏磨成细粉倒入到已经装好的柱子中。先用石油醚与乙酸乙酯混合物(二者体积比例为9:1到7:3之间)洗脱2个柱体积,后用乙酸乙酯,最后用乙酸乙酯与甲醇混合物(二者体积比例为9:1)洗脱,得到4份馏分,通过tlc以及ms分析,确定目标产物的所属馏分位置。合并馏分。
[0045]
4)样品经过初步分离后锁定目标馏分,采用半制备hplc方法纯化,所使用的仪器购自于thermo公司,使用的半制备柱购自于thermo,hplc的流速1.5ml/min,检测波长为279nm,柱温为30摄氏度,流动相为100%的甲醇,洗脱时间为35分钟。后用分析型的hplc检测纯度,所使用的仪器购自于thermo公司,使用的分析型柱购自于thermo,hplc的流速为0.3ml/min,检测波长为279nm,柱温为30摄氏度,流动相a为0.1%三氟乙酸的水溶液,流动相b为甲醇。洗脱时间为60分钟。洗脱条件如下表:
[0046]
洗脱时间(min)b相洗脱百分比0-2010%增加至95%20-55维持95%55-5695%降低至10%56-60维持10%
[0047]
产物采用低分辨确认目标产物分子量后,收集目标产物,并用核磁共振进行结构确定。马杜拉霉素(h-nmr):1h nmr(400mhz,cdcl3)δ=4.42(m,3h),4.11(q,j=7.1,2h),3.99(d,j=10.4,1h),3.89(s,1h),3.70(d,j=11.9,2h),3.54(m,9h),3.46(dd,j=10.5,4.1,1h),3.41(s,3h),3.25(m,4h),2.70(t,j=8.9,1h),2.61(d,j=13.6,1h),2.41(t,j=10.5,1h),2.16(m,2h),2.03(s,1h),1.95(m,3h),1.82(m,4h),1.69(m,2h),1.59(dd,j=21.5,16.6,2h),1.44(dd,j=19.1,8.1,10h),1.36(dd,j=17.1,6.8,2h),1.25(m,8h),1.03(dd,j=14.2,6.6,6h),0.88(m,10h)。
[0048]
实施例2j1-001-1、j1-001-2、j1-001-3、j1-001-4化合物的制备
[0049]
4种不同的糖基聚醚类化合物主要通过不同的链霉菌发酵分离获得,具体发酵分离方法如下:
[0050]
1)将链霉菌接种于固体sfm平板,培养三天到四天左右,挑选单菌落至种子培养基中培养三天到四天左右,按1-2%的接种量至发酵培养中培养7天到8天。培养条件为30摄氏度,220rpm。发酵培养基灭菌:120-125℃灭菌30分钟。发酵培养基配方为:可溶性淀粉30g/l,黄豆饼粉10g/l,酵母提取物2.5g/l,碳酸钙3g/l,ph 7.2。种子培养基(sfm):tsb 30g/l,酵母提取物3g/l,牛肉提取物3g/l,七水硫酸镁2g/l,葡萄糖10g/l,ph 7.0。种子培养基灭菌温度为115℃灭菌30分钟。
[0051]
2)大规模摇瓶发酵7-8天后,将所有的发酵液收集离心分为上清液和菌丝体分离,
其中上清液用等量的乙酸乙酯萃取,乙酸乙酯重复1次,合并有机相,真空旋蒸浓缩;菌丝体加入丙酮莫过菌丝体超声破碎菌丝体20min,离心取上清,菌丝体丙酮超声重复一次,合并上清液,旋蒸除去丙酮,加入少量的水用乙酸乙酯萃取,重复一次,合并有机相真空旋蒸浓缩。
[0052]
3)在旋蒸瓶中加入少量的硅胶,缓慢旋蒸使样品都吸附到硅胶上,然后取出粉末并黏磨成细粉倒入到已经装好的柱子中。先用石油醚与乙酸乙酯混合物(二者体积比例为9:1到7:3之间)洗脱2个柱体积,后用乙酸乙酯,最后用乙酸乙酯与甲醇混合物(二者体积比例为9:1)洗脱,得到4份馏分,通过tlc以及ms分析,确定目标产物的所属馏分位置。合并馏分。
[0053]
4)样品经过初步分离后锁定目标馏分,采用半制备hplc方法纯化,所使用的仪器购自于thermo公司,使用的半制备柱购自于thermo公司,hplc的流速1.5ml/min,检测波长为279nm,柱温为30摄氏度,流动相为100%的甲醇,洗脱时间为35分钟。后用分析型的hplc检测纯度,所使用的仪器购自于thermo公司,使用的分析型柱购自于thermo公司,hplc的流速为0.3ml/min,检测波长为279nm,柱温为30摄氏度,流动相a为0.1%三氟乙酸的水溶液,流动相b为甲醇。洗脱时间为60分钟。洗脱条件如下表:
[0054][0055][0056]
产物采用低分辨确认目标产物分子量后,收集目标产物,并用核磁共振进行结构确定。
[0057]
j1-001-1(h-nmr):1h nmr(600mhz,cdcl3)δ6.72(d,j=10.0hz,1h),4.66(d,j=10.5hz,1h),4.35(dd,j=11.0hz,1h),4.39(dt,j=5.4,3.8hz,2h),4.02(d,j=12.2hz,1h),3.85
–
3.73(m,2h),3.58(dd,j=11.6,2.0hz,2h),3.42(s,3h),3.30
–
3.10(m,2h),2.95
–
2.70(m,1h),2.64
–
2.54(m,2h),2.50(ddd,j=11.7,6.9,2.2hz,1h),2.31
–
2.25(m,2h),2.20
–
2.15(m,1h),1.99
–
1.78(m,6h),1.78
–
1.69(m,7h),1.55(d,j=2.9hz,3h),1.54
–
1.39(m,8h),1.38
–
1.31(m,3h),1.31
–
1.22(m,8h),1.15
–
1.06(m,8h),1.04
–
0.98(m,7h),0.95
–
0.91(m,4h),0.90
–
0.85(m,4h),0.83
–
0.76(m,4h),0.76
–
0.65(m,4h).
[0058]
j1-001-2(h-nmr):1h nmr(400mhz,cdcl3)δ7.36(d,j=9.9hz,1h),4.53(t,j=10.1hz,1h),4.47
–
4.34(m,2h),4.12
–
4.06(m,1h),4.02(d,j=12.0hz,1h),3.82(t,j=9.2hz,1h),3.57(s,1h),3.44(s,1h),3.32(s,3h),3.28(dd,j=9.0,6.6hz,2h),3.16(d,j=12.1hz,1h),2.91(td,j=10.6,4.2hz,1h),2.63
–
2.44(m,3h),2.38(td,j=11.7,6.8hz,1h),2.19
–
2.06(m,2h),2.06
–
1.91(m,6h),1.90
–
1.75(m,6h),1.73(d,j=10.6hz,3h),1.66
–
1.55(m,4h),1.49
–
1.39(m,8h),1.30
–
1.17(m,14h),1.13(t,j=6.9hz,4h),1.10
–
1.00(m,14h),0.96(d,j=7.1hz,3h),0.90(d,j=6.2hz,4h),0.84(t,j=5.4hz,4h).
[0059]
j1-001-3(h-nmr):1h nmr(600mhz,cdcl3)δ6.70(d,j=10.0hz,1h),4.63(d,j=10.5hz,1h),4.46(dd,j=11.0,7.6hz,1h),4.35(dt,j=5.4,3.8hz,2h),3.98(d,j=12.2hz,1h),3.92
–
3.80(m,2h),3.48(dd,j=11.6,2.0hz,2h),3.33(s,3h),3.30
–
3.23(m,2h),2.84
–
2.77(m,1h),2.64
–
2.54(m,2h),2.47(ddd,j=11.7,6.9,2.2hz,1h),2.31
–
2.25(m,2h),2.20
–
2.15(m,1h),1.99
–
1.78(m,6h),1.78
–
1.69(m,7h),1.58(d,j=2.9hz,3h),1.52
–
1.41(m,8h),1.40
–
1.31(m,3h),1.31
–
1.20(m,8h),1.12
–
1.04(m,8h),1.04
–
0.98(m,7h),0.98
–
0.92(m,4h),0.91
–
0.86(m,4h),0.85
–
0.78(m,4h),0.78
–
0.67(m,4h).
[0060]
j1-001-4(h-nmr):1h nmr(400mhz,cdcl 3)δ6.69(d,j=10.1hz,1h),4.66(d,j=10.3hz,1h),4.47(dd,j=10.8,7.7hz,1h),4.36(d,j=7.8hz,2h),3.99(d,j=12.1hz,1h),3.88(d,j=11.3hz,2h),3.53
–
3.43(m,2h),3.35(s,3h),3.28(t,j=9.7hz,2h),2.82(td,j=10.1,4.5hz,1h),2.67
–
2.46(m,3h),2.34
–
2.23(m,4h),2.19(dd,j=12.7,3.7hz,1h),1.97(dd,j=8.8,4.9hz,1h),1.88(dd,j=13.6,10.1hz,3h),1.83
–
1.67(m,9h),1.59(s,5h),1.55
–
1.43(m,8h),1.38
–
1.18(m,33h),1.07(ddd,j=14.4,9.2,4.5hz,16h),0.97(t,j=7.0hz,4h),0.91
–
0.81(m,12h),0.72(t,j=8.8hz,3h).
[0061]
实施例3马杜拉霉素、j1-001-1、j1-001-2、j1-001-3、j1-001-4对寨卡病毒(zikv)的抗病毒活性检测
[0062]
先将糖基聚醚类化合物用dmso配置成一定浓度的母液,后根据各糖基聚醚化合物的分子量,用含有2%fbs的培养基进行稀释,稀释成下列浓度:10μm、5μm、2.5μm、1.0μm、0.5μm、0.1μm、0.01μm、0.01μm、0.001μm共9个浓度梯度。
[0063]
将正常vero(非洲绿猴肾)细胞接种到96孔板(加入1ml培养基)中,按照3
×
105进行细胞接种,约在12-16h后,细胞约90%铺满孔底,换液,根据接种的孔板型号加入含有药物的dmem培养基(含有10%fbs)体积。同时加入一定量的寨卡病毒,病毒接种的感染复数(moi)为0.1。共培养36小时后,收集上清液,上清液用含有2%fbs的dmem培养基进行10倍梯度稀释,稀释倍数为10-106,在含有bhk细胞的24孔板中(10w/孔),弃培养液,每孔加入稀释上清液100μl,于37度培养箱温育1h,每15min轻摇一次,1h后弃培养液,并加入覆盖物,37℃培养箱培养;后培养约1-2天即可看见针尖状斑点,约3天后可见较大斑点,建议染色时间在感染病毒后3-4天之间。吸弃覆盖物,每孔加入3.7%甲醛,室温放置30min;吸弃甲醛,加入1%(w/v)结晶紫,于室温放置30min,用流水冲洗,然后置于50℃,10min,即可数斑。在根据接种量和病毒的稀释度换算成每毫升培养基中含有病毒的数量(pfu/ml),采集数据并分析实验结果。每个药物浓度重复4个孔,将来自四份孔的值平均化并与对照进行比较,以产生每种药物稀释度的抑制百分比值。使用graphpad prism6.0软件分析数据。使用剂量-响应(可变斜率)方程(四参数逻辑方程)通过非线性回归分析计算ec
50
值。ec
50
值定义为病毒复制减少50%时的药物浓度。实验结果如下表:
[0064]
化合物ec
50
(μm)马杜拉霉素0.1357j1-001-10.8768j1-001-20.5360j1-001-30.6419j1-001-40.1055
[0065]
从上述结果不难看出,针对寨卡病毒无论是马杜拉霉素、j1-001-1、j1-001-2、j1-001-3、j1-001-4均表现出良好的病毒抑制效果,尤其是马杜拉霉素和j1-001-4对于寨卡病毒的抑制效果更强。
[0066]
实施例4马杜拉霉素、j1-001-1、j1-001-2、j1-001-3、j1-001-4对登革热病毒(denv)的抗病毒活性检测
[0067]
用实施例3相同的方法,检测这5个糖基聚醚类化合物对登革热病毒的抑制作用。实验结果如下表:
[0068]
化合物ec
50
(μm)马杜拉霉素0.7345j1-001-11.5768j1-001-21.0360j1-001-30.6419j1-001-40.4955
[0069]
从上述结果不难看出,针对登革热病毒无论是马杜拉霉素、j1-001-1、j1-001-2、j1-001-3、j1-001-4均表现出良好的病毒抑制效果,尤其是j1-001-3和j1-001-4对于登革热病毒的抑制效果更强。
[0070]
实施例5马杜拉霉素、j1-001、j1-001-2、j1-001-3、j1-001-4对日本脑炎病毒(jev)的抗病毒活性检测
[0071]
先将糖基聚醚类化合物用dmso配置成一定浓度的母液,后根据各糖基聚醚化合物的分子量,用含有2%fbs的培养基进行稀释,稀释成下列浓度:10μm、5μm、2.5μm、1.25μm、0.625μm、0μm共六个浓度梯度。
[0072]
用实施例3相同的方法,检测这5个糖基聚醚类化合物对日本脑炎病毒(jev)的抑制作用。实验结果如图1所示。
[0073]
从图1结果不难看出,针对日本脑炎病毒无论是马杜拉霉素、j1-001-1、j1-001-2、j1-001-3、j1-001-4均表现出良好的病毒抑制效果,尤其是j1-001-3和j1-001-4对于日本脑炎病毒的抑制效果更强。
[0074]
实施例6马杜拉霉素、j1-001-1、j1-001-2、j1-001-3、j1-001-4对西尼罗河病毒(wnv)的抗病毒活性检测
[0075]
用实施例2相同的方法,检测这5个糖基聚醚类化合物对西尼罗河病毒的抑制作用。
[0076]
实验结果如下表:
[0077]
[0078][0079]
从上述结果不难看出,针对西尼罗河病毒无论是马杜拉霉素、j1-001-1、j1-001-2、j1-001-3、j1-001-4均表现出良好的病毒抑制效果,尤其是马杜拉霉素和j1-001-4对于西尼罗河病毒的抑制效果更强。
[0080]
实施例7马杜拉霉素、j1-001-1、j1-001-2、j1-001-3、j1-001-4对基孔肯雅病毒(chikv)的抗病毒活性检测
[0081]
用实施例2相同的方法,检测这5个糖基聚醚类化合物对基孔肯雅病毒的抑制作用。
[0082]
实验结果如下表:
[0083]
化合物ec
50
(μm)马杜拉霉素0.8457j1-001-12.6578j1-001-21.4528j1-001-31.5867j1-001-40.5874
[0084]
从上述结果不难看出,针对基孔肯雅病毒无论是马杜拉霉素、j1-001-1、j1-001-2、j1-001-3、j1-001-4均表现出良好的病毒抑制效果,尤其是马杜拉霉素和j1-001-4对于基孔肯雅病毒的抑制效果更强。
[0085]
实施例8马杜拉霉素、j1-001-4对新型冠状病毒(sars-cov-2)的抗病毒活性检测
[0086]
将正常vero-e6(非洲绿猴肾)细胞接种到24孔板(加入1ml培养基)中,按照8
×
104进行细胞接种,约在12-16h后,细胞汇合密度约70%~80%时,更换为含有药物的dmem培养基(含有10%fbs)1ml。同时加入一定量的sars-cov-2病毒,病毒接种量是接种的vero细胞量的5倍。共培养24小时后,再收集细胞上清并抽提rna,通过real-time pcr方法检测细胞培养上清中病毒rna载量。每个药物浓度重复4个孔,将来自四份孔的值平均化并与对照进行比较,以产生每种药物浓度的抑制百分比值。使用graphpadprism6.0软件分析数据。使用剂量-响应(可变斜率)方程(四参数逻辑方程)通过非线性回归分析计算ec50值。ec50值定义为病毒复制减少50%时的药物浓度。实验结果如图2所示。从图2结果不难看出,针对新型冠状病毒无论是马杜拉霉素、j1-001-4均表现出良好的病毒抑制效果,尤其是j1-001-4对于新型冠状病毒的抑制效果更强。
[0087]
实施例9马杜拉霉素在c57小鼠体内对日本脑炎病毒(jev)的抑制活性
[0088]
选取4周左右的雌性c57小鼠,用jev病毒进行药物体内抑制验证实验,设置mock组(不攻毒和不加药物的小鼠即正常小鼠)、wt组(只攻毒的小鼠)、马杜拉霉素高剂量组
(1.0mg/kg/天)、马杜拉霉素低剂量组(0.2mg/kg/天),每组为5只小鼠。所用到的马杜拉霉素为脂质体包裹的马杜拉霉素溶液,给药方式为每天腹腔给药,给药周期为7天。
[0089]
抽取小鼠血液,检测给药后的病毒量,同时观察小鼠的存活状态与小鼠体重变化。实验结束后为小鼠安乐死。
[0090]
实验结果图3、图4、图5所示。其中图3为不同处理组的c57小鼠感染日本脑炎病毒后体重的变化结果图,图4为不同处理组的c57小鼠感染日本脑炎病毒1天后血液的病毒量结果图,图4中编号a为wt组,编号b为马杜拉霉素低剂量组,编号c为马杜拉霉素高剂量组。图5为不同处理组感染病毒后12天后小鼠的存活情况结果图。
[0091]
实验结果显示,马杜拉霉素高剂量组(1.0mg/kg/天)给药1天后,小鼠血液的病毒量下降了2个数量级;马杜拉霉素低剂量组(0.2mg/kg/天)给药1天后,小鼠血液的病毒量下降了1个数量级。药物均给药7天,且在给毒后12天后高剂量组小鼠(1.0mg/kg/天)没有出现死亡情况,马杜拉霉素低剂量组(0.2mg/kg/天)在第十天后部分小鼠出现死亡。因此,实验结果表明马杜拉霉素能够抑制小鼠体内的日本脑炎病毒,达到治疗的效果。
[0092]
同样地,j1-001-1、j1-001-2、j1-001-3、j1-001-4等按照上述实施例9相同的方法对感染了日本脑炎病毒的小鼠进行治疗,也能够抑制小鼠体内的病毒,表现出良好的治疗效果。
[0093]
同样地,采用其他的rna病毒,例如寨卡病毒、登革热病毒、新型冠状病毒、西尼罗河病毒或基孔肯雅病毒等感染小鼠,同时采用马杜拉霉素、j1-001-1、j1-001-2、j1-001-3、j1-001-4等按照上述实施例9相同的方法进行治疗,也能够抑制小鼠体内的病毒,表现出良好的治疗效果。
[0094]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
[0095]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1