外泌体联合免疫检查点阻断剂的肿瘤疫苗及其制备方法与流程
本发明涉及肿瘤免疫治疗药物技术领域,具体地说是一种外泌体联合免疫检查点阻断剂的肿瘤疫苗及其制备方法。
背景技术:
目前,肿瘤免疫治疗手段包括嵌合抗原受体(car)t细胞疗法,免疫检查点阻断(icb)疗法和肿瘤疫苗等,这些免疫治疗手段分别作用于肿瘤免疫循环的不同阶段,提高免疫应答效率,在临床试验中已经实现了患者生存率的显著提高。但是,目前研究中的单一免疫治疗方法存在各自的局限性。
car-t细胞被刺激后可以成指数级增殖,从而在几周内产生高度放大的t细胞反应以清除肿瘤细胞。然而,广泛的研究揭示了car-t细胞免疫疗法的局限性。首先,car-t细胞即使在低水平也可以识别并对表达靶抗原的正常细胞起作用,这种脱靶的肿瘤毒性可能导致死亡。其次,即使有特定的肿瘤靶向,大剂量car-t细胞输注后也可能发生细胞因子释放综合征等严重副作用。此外,由于不同患者t细胞反应、持续性和副作用的不同,预测最佳输注细胞数仍然是一个挑战。更值得注意的是,由于肿瘤促结缔组织增生的特性和免疫抑制的肿瘤微环境使得car-t细胞通常在肿瘤中的浸润效率较低,以至于car-t细胞疗法对于实体瘤的治疗效果并不理想。
免疫检查点阻断的肿瘤免疫治疗方法通过阻断负荷肿瘤突变抗原t细胞的抑制途径来激活抗肿瘤免疫,但对免疫原性差的肿瘤无效。众所周知,晚期肿瘤抑制性受体信号转导造成的周期障碍常常导致免疫逃逸。因此,尽管icb治疗取得了相当大的成功,仍然存在一些问题亟待解决。例如,较低的客观应答率(仅有约20%),这是由于肿瘤局部存在的多种免疫逃逸机制导致的,包括肿瘤相关抗原的缺乏,免疫抑制细胞的渗透,表观遗传改变以及免疫抑制肿瘤微环境的限制等。此外,icb的临床应用也与正常器官的各种副作用有关,容易出现与免疫相关的严重不良反应。因此,icb治疗作为单一治疗方法的使用往往局限于一小部分患者。
肿瘤疫苗包括亚单位疫苗,核酸疫苗,dc疫苗等。一般肿瘤疫苗因为其投放效率低下,不足以引起有效的免疫应答。针对这一问题开发了纳米疫苗,通过合成纳米颗粒或天然衍生纳米颗粒输送疫苗用于癌症免疫治疗。纳米疫苗可以一定程度上将佐剂和多表位抗原共传递到淋巴器官和抗原提呈细胞中,通过纳米疫苗工程可以微调疫苗的细胞内释放和抗原的交叉表达。但是随着研究的深入发现,生物体内的多种生物屏障及不同组织血管间的压力梯度,使得纳米疫苗只有约5%可到达病灶部位。dc疫苗治疗中,从患者的身体中提取dc,然后大量体外增殖,并被特定的肿瘤抗原激活,最后注射回患者体内进行免疫调节。临床结果表明,保护性抗肿瘤免疫的产生依赖于dc提呈肿瘤抗原。但是,体外培养增殖后的dc细胞回输后存在机体排异现象且操作繁琐,耗时昂贵。
由于癌症患者的免疫系统受到多重免疫抑制机制的阻碍,单一的解除某一抑制通路并不能有效激活免疫应答。因此,多种免疫治疗手段的联合疗法更有利于解除癌症的众多免疫抑制机制,更显著的激活免疫系统,彻底清除原发肿瘤和转移肿瘤,有效抑制肿瘤复发。但是,目前还没有一种制备简单且效果较好的联合肿瘤疫苗。
技术实现要素:
本发明的目的就是提供一种外泌体联合免疫检查点阻断剂的肿瘤疫苗及其制备方法,以解决现有肿瘤免疫治疗手段以及肿瘤疫苗治疗效果不理想的问题。
本发明的目的是这样实现的:一种外泌体联合免疫检查点阻断剂的肿瘤疫苗,所述肿瘤疫苗是以特定的肿瘤抗原ag激活的树突状细胞的外泌体exo-ag为载体,利用磷脂-聚乙二醇-琥珀酰亚胺酯dspe-peg-nhs为交联剂,将pd-l1抗体修饰到外泌体exo-ag表面而得到的apd-l1修饰的肿瘤疫苗exo-ag-apd-l1。
所述树突状细胞为骨髓来源的树突状细胞、dc2.4细胞系、外周血树突状细胞中的至少一种。
所述特定的肿瘤抗原ag为ova抗原、黑色素瘤相关抗原mage以及通过细胞或组织破碎提取出的黑色素瘤特异性抗原中的至少一种。
上述的肿瘤疫苗的制备方法,包括以下步骤:
(a)培养原代树突状细胞:将骨髓细胞均匀分散在细胞培养板中培养,以rmil-4和rmgm-csf为诱导因子,诱导骨髓细胞分化为树突状细胞;
(b)提取外泌体疫苗:将特定的肿瘤抗原ag与树突状细胞共孵育,孵育完成后,收集细胞培养上清液,利用真空过滤器过滤,除去细胞碎片和大颗粒蛋白杂质,之后利用超滤离心管进行浓缩除杂,得到外泌体溶液exo-ag;
(c)pd-l1抗体修饰exo-ag:将磷脂-聚乙二醇-琥珀酰亚胺酯dspe-peg-nhs溶于dmso中,并与经离心洗涤后的apd-l1以1-5∶1的比例混合,并于0-4℃条件下持续搅拌反应,apd-l1与dspe-peg-nhs通过酰胺化反应连接生成dspe-peg-nhs-apd-l1;反应完成后离心除去未反应的dspe-peg-nhs,并将上层溶液的dspe-peg-nhs-apd-l1回收后与exo-ag于0-4℃条件下反应,使dspe-peg-nhs-apd-l1的dspe端插入到外泌体的膜磷脂双分子层中,从而得到成功修饰apd-l1的exo-ag-apd-l1。
步骤(a)中,在细胞培养板中加入含有10-30ng/ml的rmil-4和10-30ng/ml的rmgm-csf的rpmi1640培养基,每隔2天,用含有20-60ng/ml的rmil-4和20-60ng/ml的rmgm-csf的新鲜培养基半量换液,以保持细胞生长环境中诱导因子浓度不变;树突状细胞在第10天使用或进一步成熟后使用。
步骤(a)中,所有培养基均含有100u/ml青霉素和100u/ml链霉素。
步骤(b)中,将0.1-0.5mg/ml的肿瘤抗原ag与树突状细胞共孵育12-24h后,更换新鲜培养基48h后收集细胞培养上清液进行过滤。
步骤(c)中,利用10kda超滤离心管将apd-l1溶液离心除去溶剂,并用pbs洗涤并溶解后回收备用。
步骤(c)中,apd-l1与dspe-peg-nhs酰胺化反应的时间为12-24h,dspe-peg-nhs-apd-l1与exo-ag于pbs中反应的时间为3-5h。
本发明将树突状细胞外泌体、肿瘤疫苗和免疫检查点阻断剂有机结合,同时克服了血管与淋巴结间的压力梯度,解决了肿瘤疫苗投放效率低,肿瘤的免疫逃逸和易转移复发等问题。
本发明合理联合肿瘤疫苗与免疫检查点阻断剂,利用树突状细胞外泌体为载体实现了肿瘤疫苗高效的淋巴结富集及显著的免疫激活作用,同时通过阻断免疫检查点通路,解除其对免疫应答的“刹车”效应,达到一加一大于二的效果,克服了单一免疫疗法的局限性。本发明以树突状细胞外泌体为载体,达到有效的抗原呈递激活免疫,与免疫检查点阻断剂有效联合,协同清除肿瘤,并防止肿瘤转移及复发。
本发明制备方法简单,通过特定的交联剂得到apd-l1修饰的exo-ag,降低了疫苗制备成本,减少了毒副作用。
附图说明
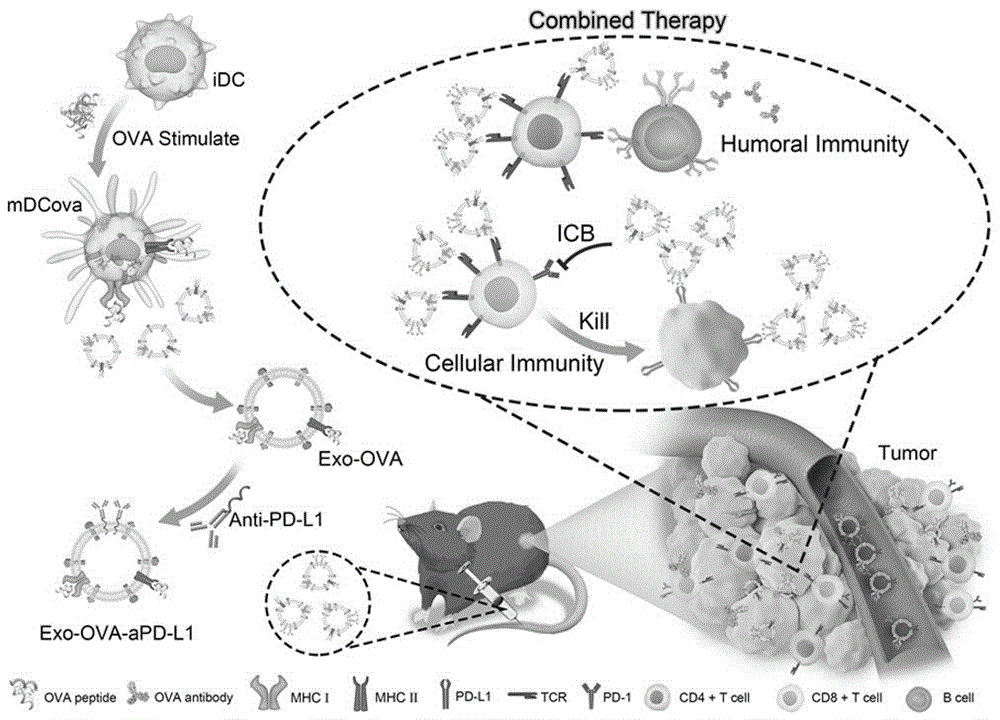
图1是本发明实施例的肿瘤疫苗的制备步骤及治疗原理示意图。
图2是本发明实施例中apd-l1与dspe-peg-nhs连接后的凝胶电泳图。
图3是本发明实施例exo-ova-apd-l1的westernblot定性分析结果图。
图4是本发明实施例exo-ova-apd-l1的免疫金标tem图。
图5是本发明实施例exo-ova-apd-l1的粒径分布图。
图6是流式细胞仪分析exo-ova-apd-l1体外免疫激活能力。
图7是本发明实施例中exo-ova-apd-l1对肿瘤生长的抑制作用结果。
图8是本发明实施例中exo-ova-apd-l1治疗后荷瘤小鼠的存活率。
图9是本发明实施例中器官及肿瘤组织的病理分析图。
图10是本发明实施例中exo-ova-apd-l1治疗后流式细胞仪分析肿瘤局部免疫激活效率图。
图11是本发明实施例中治疗后小鼠血清中的相关免疫细胞因子的测定结果图。
图12是本发明实施例中小鼠肿瘤复发情况测定结果图。
图13是本发明实施例中荷瘤小鼠肺组织转移结节测定结果图。
图14是随时间延长exo-ova-apd-l1和exo-ova+apd-l1的肿瘤生长抑制作用对比图。
图15是exo-ova-apd-l1和exo-ova+apd-l1免疫组化分析肿瘤局部cd8+t细胞浸润对比图。
具体实施方式
下面结合具体实施例对本发明的技术方案进行详细说明。本发明实施例中未提到的试验条件和操作均按本领域常规方法或制造商建议的条件进行。
实施例1:
下面以一种广泛使用的抗原模型ova为例,详细介绍exo-ova-apd-l1的制备方法,如图1所示,包括如下步骤:
(1)培养原代树突状细胞(dc)
c57bl/6雌性小鼠脱颈处死后,于75%酒精中浸泡5-10min,初步消毒。在超净工作台中,使用清洁灭菌后的剪刀镊子等器械进行实验。无菌状态下取出小鼠四肢腿骨,浸泡在含有10%青霉素&链霉素(双抗)的pbs中,利用手术刀片尽可能的去除腿骨表面的肌肉及结缔组织。将处理后的腿骨置于不完全培养基rpmi1640中,剪除腿骨两端关节,暴露骨髓细胞(bonemarrowcell,bmc)。用准备好的1ml注射器,针头插入腿骨两端反复吹吸,至骨髓细胞完全进入培养基,弃去腿骨。收集到的bmc,在4°c下13523g离心5min,细胞成团弃去上清液,然后加入细胞裂解液静置。将混合物离心弃去上清液,以除去富含的红细胞和悬浮细胞,用冷的完全培养基rpmi1640重悬。细胞均匀分散在12孔板细胞培养板中培养,加入含有rmil-4(20ng/ml)、rmgm-csf(20ng/ml)的rpmi1640培养基(10%fbs)。每隔2天,半量换液,用含有40ng/ml的rmil-4和40ng/ml的rmgm-csf的新鲜培养基替换,以保持细胞生长环境中诱导因子浓度不变。树突状细胞可以在第10天使用,也可以进一步成熟。所有培养基均含有100u/ml青霉素&链霉素。
(2)提取外泌体疫苗
0.1mg/mlova与dc共孵育24h后,更换新鲜培养基48h后收集细胞培养上清液,利用0.22µm真空过滤器过滤,除去细胞碎片及大颗粒蛋白等杂质。随后利用100kd超滤离心管在4000g转速下离心5min,进行浓缩同时除去培养液中的小颗粒杂质。浓缩后得到纯度较好的外泌体溶液(exo-ova)。可以于-80°c冰箱中长期保存,或在4°c冰箱中至多可保存一周。
(3)pd-l1抗体修饰exo-ova
exo-ova分离纯化后利用抗小鼠pd-l1抗体(apd-l1)进行表面修饰。为防止apd-l1的溶剂干扰抗体与连接剂的结合反应,利用10kda超滤离心管在2000g,5min条件下离心除去溶剂,pbs洗涤一次,回收备用。选用磷脂-聚乙二醇-琥珀酰亚胺酯(dspe-peg-nhs)为交联剂。将dspe-peg-nhs溶于dmso,与离心后的apd-l1以2:1比例、4°c条件下持续搅拌反应24h,apd-l1与dspe-peg-nhs通过酰胺化反应连接。4500g超滤离心5min,除去未反应的dspe-peg-nhs,上层溶液dspe-peg-nhs-apd-l1回收后与纯化后的exo-ova4°c条件下反应3h,dspe-peg-nhs-apd-l1的dspe端插入外泌体的膜磷脂双分子层中,成功修饰apd-l1得到exo-ova-apd-l1。
如图1所示,exo-ova-apd-l1抗肿瘤原理是:exo-ova-apd-l1表面的mhcii分子将抗原肽呈递给th细胞进而刺激b细胞产生抗体,同时通过抗原的交叉呈递作用激活细胞毒性t淋巴细胞,触发黑色素瘤细胞(b16-ova)的抗ova特异性抗体的产生,激活cd8+t细胞的应答。此外,引入的pd-l1抗体阻断肿瘤细胞的免疫逃逸,进一步提高疫苗治疗的效率。疫苗和免疫检查点阻断治疗的联合治疗,可以增强免疫细胞的激活及识别作用,进而抑制肿瘤的转移,达到治疗肿瘤并抑制转移的效果。另外,exo-ova可作为apd-l1的纳米载体,增强apd-l1的稳定性和在肿瘤组织中的蓄积。因此,dc衍生外泌体疫苗与icb相结合提供了一种协同治疗策略,显著提高免疫疗效并减少毒副作用。
对exo-ova-apd-l1进行表征,结果如图2-图5所示。
图2凝胶电泳结果显示apd-l1与dspe-peg-nhs键连后(dspe-peg-nhs-apd-l1)电泳条带位于纯apd-l1条带之上,说明apd-l1与连接剂键连后分子量变大,且条带弥散,证明apd-l1与dspe-peg-nhs成功通过酰胺化反应连接。
图3exo-ova-apd-l1的westernblot定性分析结果表明,提取的囊泡表达cd63、cd81、tsg101等标记蛋白是外泌体。且ova刺激后dc分泌的外泌体成功表达ova抗原,表示exo-ova-apd-l1具有激活免疫系统的功能,且表达apd-l1说明修饰成功。
图4通过免疫金标电镜观察,5nm金颗粒标记的二抗可以与外泌体表面修饰的apd-l1结合,也可以证明有效的apd-l1修饰,且形貌仍为150nm左右的球形球形中空囊泡。
图5纳米颗粒追踪分析仪(nta)测定exo-ova-apd-l1粒径为154.0±0.9nm,浓度为3-5×106个/ml。
实施例2
对exo-ova-apd-l1的抗肿瘤效果进行研究,结果如下:
(1)exo-ova-apd-l1体外免疫激活能力评价
通过分离小鼠脾淋巴细胞,检测淋巴细胞的增殖分化数量,验证材料的体外激活免疫能力。小鼠脾淋巴细胞与exo、exo-ova、exo-ova-apd-l1孵育后,离心pbs重悬细胞细胞并用荧光抗体分别标记t细胞、dc、b细胞和巨噬细胞。用流式细胞术检测,结果如图6所示,其中a图第一列是cd8+t细胞,第二列是cd4+t细胞。b图是树突状细胞,c图是巨噬细胞,d图是b细胞。结果表明,exo与对照组基本相同,没有激活免疫系统的能力。而exo-ova和exo-ova-apd-l1均能不同程度地激活免疫细胞,促进其增殖分化。其中,exo-ova-apd-l1能显著诱导cd4+t细胞增殖31.31%和b细胞增殖12.81%分化,证明该材料携带的抗原可以有效激活cd4+t细胞,从而促进b细胞分化为浆细胞之后分泌对应抗体。同时,cd8+t细胞、巨噬细胞等免疫细胞通过抗原交叉提呈被激活。体外免疫细胞活化实验表明,携带ova抗原的外泌体能够激活免疫系统,促进相关免疫细胞的增殖、分化。
(2)exo-ova-apd-l1体内抑瘤水平评价
为了验证ova特异性肿瘤疫苗与icb联合治疗是否能增强抑制肿瘤生长的作用,将不同材料pbs、exo、exo-ova、exo-apd-l1、exo-ova-apd-l1(exo1010/只,apd-l140µg/只)尾静脉给药b16-ova荷瘤小鼠。同时每两天测量各组小鼠的肿瘤大小,检测肿瘤生长情况。如图7,exo-ova-apd-l1治疗组对肿瘤生长的抑制作用最显著,与pbs对照组相比有极显著的差异性。而exo、exo-ova、exo-apd-l1等治疗组对肿瘤生长的抑制作用有限,其中exo-ova-apd-l1组与exo-ova组肿瘤体积存在显著差异。说明icb与肿瘤疫苗联合作用,有助于肿瘤的免疫治疗。此外,直到治疗后40天,exo-ova-apd-l1治疗组的肿瘤体积生长速度仍然较慢,显示出明显的抗肿瘤作用。
图8结果表明,exo-ova-apd-l1得摄入有效地延长了小鼠的平均存活时间,直至40天实验结束仍旧有4只小鼠存活。
图9表明h&e染色的心、肝、脾、肺、肾,观察各组器官并无明显损伤。肿瘤组织染色结果显示经exo-ova-apd-l1处理的肿瘤细胞明显坏死。
治疗21天后,收集荷瘤小鼠的肿瘤样本利用流式细胞术进行分析。如图10所示,与未处理组相比,exo-ova-apd-l1组b细胞、cd4+t细胞和cd8+t细胞的浸润明显增加。值得注意的是,exo-ova-apd-l1组分比exo-ova组分更有利于免疫细胞的浸润,这可能是由于pd-l1抗体的免疫检查点封闭作用所致。肿瘤局部免疫细胞的浸润增加,可有效改善肿瘤局部的免疫抑制性微环境,显著增强肿瘤免疫治疗效果。已有研究表明肿瘤浸润性淋巴细胞(til)的比例提高可有效逆转抑制性微环境。
治疗过程中对血清中的相关免疫细胞因子进行分析。如图11a-c细胞因子的分泌,包括干扰素-γ、肿瘤坏死因子-α和白细胞介素-6等,进一步证实了exo-ova-apd-l1能有效地激活天然免疫和获得性免疫反应,产生有效杀伤。用elisa法检测小鼠血清中的ova抗体。图11d结果表明,exo-ova-apd-l1治疗小鼠产生大量ova抗体,抗体特异性识别高表达ova抗原的b18-ova肿瘤,导致肿瘤特异性杀伤。与exo-apd-l1相比,exo-ova-apd-l1的抗癌效果的提高可以归因于抗原有效激活了免疫,癌细胞周围抗体局部浓度的增加,从而导致产生的抗体对肿瘤的特异性杀伤。
(3)exo-ova-apd-l1抑制肿瘤转移复发效果评价
为了测试exo-ova-apd-l1的治疗潜力,建立复发转移小鼠模型进行了试验。基于小鼠手术后肿瘤复发体积,发现单一药物治疗组不能有效阻止手术部位的局部肿瘤复发。相比之下,exo-ova-apd-l1治疗显著有效的阻止了局部肿瘤的复发,如图12显示。
小鼠肿瘤复发转移模型中,收集转移肺组织,分析每组肺组织统计肺结节数量,发现空白组有明显的转移点,而经过exo-ova-apd-l1治疗的小组,肺转移的平均数量显著减少,与空白组存在极显著差异性。而exo-ova-apd-l1与exo-ova组差异性一般,结果可见图13。
实施例3
将交联后的exo-ova-apd-l1与单纯的外泌体exo-ova与免疫检查点药物apd-l1组合应用的抗肿瘤效果进行研究,结果如图14和图15所示。
通过小鼠活体抑瘤作用及肿瘤局部免疫组化分析,都可以证明交联后的材料比单纯的药物组合治疗,更有效的激活了免疫,增强肿瘤局部免疫细胞浸润,有效抑制肿瘤生长。
1.dc细胞是抗原呈递细胞,其本身表达pd-l1,其分泌的外泌体也表达pd-l1,在抗原呈递过程中与t细胞表面的pd-1形成免疫抑制通路,会影响dc及外泌体激活免疫细胞的效率。而我们通过pd-l1抗体的修饰,可以封闭其本身的pd-l1,同时在表面修饰上pd-l1抗体,增强抗原呈递,提高免疫激活效率。
2.单纯的免疫检查点药物与外泌体的组合应用,免疫检查点阻断剂是游离的,已经有研究证明游离态的pd-l1抗体,会产生严重的免疫不良反应。
3.交联后的材料一方面可以根据epr效应富集在在肿瘤部位,另一方面可以与激活后的t细胞一同转运到肿瘤部位。与肿瘤细胞表面的pd-l1结合后,解除刹车作用,增强免疫治疗。
- 还没有人留言评论。精彩留言会获得点赞!