一种去乙酰化酶的激动剂及其应用的制作方法
本发明涉及一种去乙酰化酶的激动剂及其应用,属于医药
技术领域:
。
背景技术:
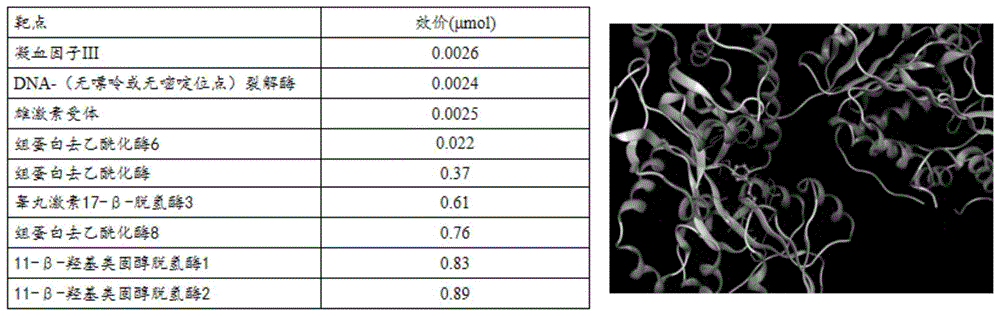
:组蛋白去乙酰化酶(hdac)是一类与表观遗传修饰相关的蛋白酶,在人体中可以使染色质致密,抑制mrna的合成,或通过调控转录因子、原癌基因和信号介质等发挥翻译后修饰作用,调节细胞内稳态。目前hdac家族分四类,共包含18种亚型,每种具体亚型的生物学功能各不相同。hdac目前主要通过两种调控机制参与生理病理学过程,一是对组蛋白乙酰化水平的调控:在细胞核内,hdac作用是通过将乙酰辅酶a的乙酰基从组蛋白氨基末端特定的赖氨酸残基上移除,以完成组蛋白的去乙酰化,从而抑制基因的转录。hdac对组蛋白的翻译后修饰作用,已在基因转录调控作用中被广泛研究,并被证明是表观遗传机制研究的重要方向。二是对非组蛋白乙酰化水平的调控:越来越多的研究表明,非组蛋白乙酰化参与了所有主要生物过程,包括调控蛋白的稳定性,酶的活性,亚细胞结构的再定位,蛋白与蛋白的相互作用,蛋白与基因的相互作用及对其它转录后调控机制的作用。先前研究表明,hdac参与多种疾病过程。例如,在类风湿性关节炎患者外周血单个核细胞中测得i类hdac(1,2,3,8)的mrna表达和蛋白质水平均显著降低;在慢性阻塞性肺疾病的患者的肺组织标本中观察到,随着疾病严重程度增加,hdac活性逐渐降低,并且伴随hdac2,hdac5和hdac8的mrna表达以及hdac2蛋白的表达水平的下降。在血管系统相关疾病中,沉默hdac4基因表达,可抑制tnf诱导的单细胞粘附因子(vcam-1)和nf-κb的表达,降低血管平滑肌氧化应激水平;内皮特异过表达sirt1可以通过上调enos的表达改善血管内皮细胞依赖性主动脉舒张功能;在氧化低密度脂蛋白诱导的动脉粥样硬化内皮细胞损伤模型中,hdac1和2选择性抑制剂可以增加小鼠主动脉内皮细胞精氨酸酶2(arg2)的表达,而过表达hdac2则通过降低arg2启动子的活性,增加一氧化氮的生成,进而改善了血管内皮细胞损伤。另外,hdac活性异常与肿瘤发生也密切相关,例如,dengwenli等人的研究发现,在人胰腺癌组织中hdac6的mrna和蛋白质均高度表达,进一步研究发现高表达的hdac6与细胞质接头蛋白170(clip-170)相互作用并刺激胰腺癌细胞的迁移;还有研究表明sirt3具有抑癌作用,敲除sirt3基因的小鼠比对照小鼠更快地发展肿瘤。并且有研究发现在异种移植模型中,敲除sirt3基因的肿瘤比对照肿瘤生长更快,体积更大。以上研究表明,实现对hdac活性的调控,是对多种疾病的治疗和病理机制的研究的必须手段。随着人类对hdac酶活性异常在疾病发生发展中作用的深入认识,近几年来多种hdac抑制剂,特别是作为抗肿瘤制剂已在科研试验和临床市场上广泛应用,目前有5种已上市的hdac抑制剂和超过11种hdac抑制剂正在临床开发中。例如,伏立诺他(saha)作为泛hdac抑制剂,是第一批被fda批准用于临床的hdac抑制剂。saha在广谱癌症中显著抗癌活性,在ii期试验中研究了用于治疗难治性皮肤t细胞淋巴瘤。fk228是一种有效的ii类hdac抑制剂,临床试验用于甲状腺,难治性肺癌及转移性肾细胞癌等晚期癌症患者。丙戊酸除了是治疗癫痫病的公认药物外,近几年也被发现是一种强大的hdac抑制剂。chaveza等人根据药物流行病学研究探讨丙戊酸的使用与黑色素瘤风险之间的关系,结果表明丙戊酸暴露可能与黑色素瘤风险降低和进展有关。garcía-guerreroe等人研究发现新型hdac6抑制剂ricolinostat可能通过上调多发性骨髓瘤细胞上的cd38,从而增强cd38特异性疗法的性能。然而,对于hdac激动剂的研究报道却非常少,目前报道过的hdac激动剂包括天然sirt1激动剂白芦藜醇,异黄酮,香豆素等,人工合成sirt1激动剂包括二氢吡啶,恶唑烷吡啶及相关类似物,sirt3激动剂厚朴酚及sirt6激动剂mdl-8000,例如kangl等人发现白藜芦醇通过上调sirt1介导的途径减轻新生大鼠高氧诱导的脑凋亡;max等人发现在患有并发ad的糖尿病大鼠模型中,白藜芦醇可显着增加sirt1的表达,抑制记忆障碍,白介素-1β和白介素6水平升高,sod和谷胱甘肽水平降低,从而预防神经变性。张健与陈国强团队研究发现mdl-800可以在肝癌细胞内特异性激活sirt6组蛋白去乙酰化活性,下调h3k9ac和h3k56ac,阻断细胞周期阻滞从而抑制肝癌细胞增殖。但这些激动剂都只局限于文献报道,目前市场上没有商品化的hdac激动剂。糖尿病是以慢性高血糖为特征的代谢性疾病,国际糖尿病联合会最新发布:预计到2040年,全球患糖尿病人数将从2015年的4.15亿增加到6.4亿,是全球排名第六位的高致死性疾病。糖尿病并发症是导致糖尿病高致死和致残的最主要原因,而糖尿病血管病变则是导致糖尿病多种并发症共同的病理基础。糖尿病血管病变包括大血管及微小血管病变,分别危及心、脑、肾、周围神经、眼睛、足等组织器官。由于糖尿病血管损伤的病因不明,导致目前缺少有效的临床治疗手段。大量的研究表明血管内皮细胞的损伤发生在糖尿病血管损伤初期,高糖诱导的血管内皮细胞损伤是糖尿病血管损伤的关键。因此,靶向改善糖尿病所致的血管内皮细胞损伤的药物是研制糖尿病血管并发症治疗药物的主要方向之一。内皮细胞合成的一氧化氮(nitricoxide,no)的能力下降是一个主要的病理因素,临床上也把测定no生成量及活性作为预测和评价血管损伤的重要指标。另外,在血管内皮细胞中存在着一种双核含锰金属酶-精氨酸酶(arginase,arg),它可以通过与一氧化氮合成酶(nitricoxidesynthetase,enos)竞争它们共同的底物l-精氨酸,从而负调控no的生成。目前发现精氨酸酶有两种亚型:arg1和arg2,两者的氨基酸序列约有60%的同源性,且均在内皮细胞中有表达。以往研究表明arg的活性、arg1和arg2与包括糖尿病在内的多种疾病所导致的血管内皮功能损伤密切相关。例如在糖尿病患者分离的冠状动脉和链脲佐菌素(stz)诱导糖尿病的小鼠主动脉中均能检测到arg1的高表达,而在粥样动脉硬化模型小鼠的主动脉和stz糖尿病小鼠肾小球内皮细胞中则检测到arg2的表达升高。同时,抑制arg活性对以上疾病中内皮功能损伤均有改善作用。因此,no生成、arg活性和arg1/2的表达是血管内皮功能评价的关键指标。桂皮醛(trans-cinnamaldehyde,tca)是中药桂枝或者肉桂中提取的主要成分,具有药食同源的特性。自然界中天然存在的桂皮醛均为反式结构,也称为反式肉桂醛(式1),为浅黄色油状液体,有强烈的肉桂气味,相对分子质量132.16。近30年来的药理学研究证实,桂皮醛具有镇静、镇痛、解热、抗炎、抗菌等作用,且毒副作用低,有着广泛的开发前景。在心血管领域的研究中发现,桂皮醛可以降低大鼠或狗的血压水平,长期服用桂皮醛可以对糖尿病引起的高血压具有一定的治疗作用。桂皮醛离体给药可以增加大鼠主动脉和小鼠肠系膜的血管舒张能力。富集桂皮醛的胶束制剂可以通过体外抚育的方式,提高血管内皮依赖性舒张功能。但大部分研究都集中在药效评价、细胞分子表型变化及经典通路等,并没有深入研究桂皮醛在动物或人体内具体的作用蛋白靶点,也没有研究桂皮醛结构类似物和桂皮醛衍生物在动物或人体内具体的作用蛋白靶点;技术实现要素:本发明的目的在于克服现有技术的不足,提供一种去乙酰化酶的激动剂。为实现上述目的,本发明采取的技术方案为:一种去乙酰化酶的激动剂,所述激动剂包括桂皮醛、桂皮醛的结构类似物和桂皮醛的衍生物中的至少一种。本发明首先通过targethunter软件对本发明所述去乙酰化酶的激动剂(桂皮醛、桂皮醛的结构类似物或桂皮醛的衍生物)在小鼠体内靶标进行预测,发现预测结果提示与去乙酰化酶结合有关,说明本发明所述的去乙酰化酶的激动剂在体内的作用靶标可能是去乙酰化酶。本发明通过对高糖诱导的人脐静脉内皮细胞(huvec)进行高糖孵育,发现本发明所述去乙酰化酶的激动剂能显著升高高糖组内皮细胞组蛋白去乙酰化酶(hdac)活性,证明本发明所述的去乙酰化酶的激动剂能通过调控hdac活性从而保护高糖所致的内皮细胞损伤;同时本发明通过体外实验进行了本发明所述的去乙酰化酶的激动剂对组蛋白去乙酰化酶6(hdac6)活性试剂盒的检测,证实本发明所述的去乙酰化酶的激动剂的浓度a在一定范围内(1nm≤a≤100nm)对hdac6有激活作用。另外,本发明通过高糖诱导内皮细胞损伤模型中“arg-no”通路的调控作用,证实本发明所述的去乙酰化酶的激动剂作为hdac6的激动剂对血管内皮损伤的保护作用。作为所述去乙酰化酶的激动剂的优选实施方式,所述桂皮醛的结构类似物包括苯丙醛、苯乙醛、苯甲醛、丙醛、乙醛和甲醛中的至少一种;作为所述去乙酰化酶的激动剂的优选实施方式,所述桂皮醛的衍生物包括α-溴代肉桂醛、α-溴代对氯肉桂醛、α-溴代对甲基肉桂醛、α-甲基肉桂醛、α-己基肉桂醛、4-氯肉桂醛、4-甲氧基肉桂醛、4-氟肉桂醛、2-硝基肉桂醛、对氯肉桂醛中的至少一种。作为所述去乙酰化酶的激动剂的优选实施方式,所述去乙酰化酶为组蛋白去乙酰化酶家族;所述组蛋白去乙酰化酶家族包括组蛋白去乙酰化酶i类、组蛋白去乙酰化酶ii类、组蛋白去乙酰化酶iii类和组蛋白去乙酰化酶iv类中的至少一种。作为所述去乙酰化酶的激动剂的优选实施方式,所述组蛋白去乙酰化酶i类包括组蛋白去乙酰化酶1、组蛋白去乙酰化酶2、组蛋白去乙酰化酶3和组蛋白去乙酰化酶8中的至少一种。作为所述去乙酰化酶的激动剂的优选实施方式,所述组蛋白去乙酰化酶ii类包括组蛋白去乙酰化酶iia类和组蛋白去乙酰化酶iib类中的至少一种;所述组蛋白去乙酰化酶iia类包括组蛋白去乙酰化酶4、组蛋白去乙酰化酶5、组蛋白去乙酰化酶7和组蛋白去乙酰化酶9中的至少一种;所述组蛋白去乙酰化酶iib类包括组蛋白去乙酰化酶6和组蛋白去乙酰化酶10中的至少一种。作为所述去乙酰化酶的激动剂的优选实施方式,所述组蛋白去乙酰化酶iii类为sirt1-7。作为所述去乙酰化酶的激动剂的优选实施方式,所述组蛋白去乙酰化酶iv类为组蛋白去乙酰化酶11。本发明以桂皮醛、桂皮醛的结构类似物或桂皮醛的衍生物作为hdac的激动剂,其在血管内皮损伤中具有改善内皮功能的作用,拓宽了桂皮醛、桂皮醛的结构类似物或桂皮醛的衍生物在药用方面的临床价值。本发明的另一目的是提供所述的去乙酰化酶的激动剂在制备用于预防和/或治疗组蛋白去乙酰化酶异常相关的疾病的药物、激活剂或试剂盒中的应用。作为本发明所述的应用的优选实施方式,所述去乙酰化酶的激动剂用于升高高糖诱导的内皮细胞中组蛋白去乙酰化酶活性。作为本发明所述的应用的优选实施方式,所述去乙酰化酶的激动剂用于对组蛋白去乙酰化酶的活性产生激动作用。作为本发明所述的应用的优选实施方式,所述去乙酰化酶的激动剂用于对组蛋白去乙酰化酶6的活性产生激动作用。作为本发明所述的应用的优选实施方式,当所述去乙酰化酶的激动剂浓度为a时,用于对组蛋白去乙酰化酶6的活性产生激动作用;所述a的范围值为1nm≤a≤100nm;更优选地,所述a为30nm。通过在体外将桂皮醛配制成梯度浓度(1nm-100nm)进行hdac6活性试剂盒检测,检测结果表明,随着桂皮醛浓度梯度增加,对hdac6活性的激动作用也呈梯度增加,说明桂皮醛1nm≤a≤100nm浓度范围内可直接对hdac6活性产生激动作用,当桂皮醛浓度a为30nm,对hdac6活性产生激动作用最显著。作为本发明所述的应用的优选实施方式,所述去乙酰化酶的激动作用用于逆转由高糖引起内皮细胞no生成量的降低;所述去乙酰化酶的激动作用用于逆转由高糖引起内皮细胞精氨酸酶活性的升高。在血管内皮细胞中,精氨酸酶(arginase,arg)与一氧化氮合成酶(enos)竞争,代谢它们共同的底物l-精氨酸(l-arginine),升高的arg活性降低了底物l-arginine对enos的生物利用度,同时增加了enos的非耦合,从而导致一氧化氮(no)的合成降低和过氧化亚硝酸盐阴离子(onoo-)生成增加,进而消耗更多的no。内皮合成的no的能力代表了血管内皮依赖性舒张功能的变化,是临床用来预测和评价血管损伤的关键性指标。本发明基于“arg-no”通路在血管内皮细胞中的重要作用,建立由高糖诱导的人脐静脉内皮细胞(huvec)模型,验证了桂皮醛、桂皮醛的结构类似物或桂皮醛的衍生物作为药物通过hdac的靶向作用对高糖诱导的内皮细胞损伤的保护作用。作为本发明所述的应用的优选实施方式,所述组蛋白去乙酰化酶异常相关的疾病为糖尿病所致的血管内皮细胞损伤。与现有技术相比,本发明的有益效果为:(1)本发明首次通过targethunter软件预测本发明所述去乙酰化酶的激动剂的蛋白靶标,发现其浓度a在一定范围内(1nm≤a≤100nm)能激动hdac6;本发明所述去乙酰化酶的激动剂能显著升高高糖诱导降低的内皮细胞hdac活性,证明本发明所述的去乙酰化酶的激动剂能通过调控hdac活性从而影响内皮细胞功能;本发明通过高糖诱导内皮细胞损伤模型中“arg-no”通路的调控作用,证实本发明所述的去乙酰化酶的激动剂作为hdac6的激动剂对血管内皮损伤的保护作用。(2)本发明所述去乙酰化酶的激动剂包括桂皮醛、桂皮醛的结构类似物和桂皮醛的衍生物中的至少一种,桂皮醛不仅作为药食同源的中药有效成分,安全性高、价格低廉,具有良好的应用前景,还可应用于制备预防和/或治疗hdac异常相关的疾病的药物、激活剂或试剂盒。(3)本发明以桂皮醛、桂皮醛的结构类似物或桂皮醛的衍生物作为hdac的激动剂,其在血管内皮损伤中具有改善内皮损伤的作用,拓宽了桂皮醛、桂皮醛的结构类似物或桂皮醛的衍生物在药用方面的临床价值。(4)本发明首次通过实验验证桂皮醛、桂皮醛的结构类似物或桂皮醛的衍生物通过激活hdac来保护糖尿病导致的内皮细胞损伤,为临床治疗糖尿病血管病变提供新的治疗手段。附图说明图1targethunter数据库中tca体内结合靶标蛋白预测结果及tca3d分子结构;图2为本发明实施例2桂皮醛对高糖诱导的内皮细胞的hdac活性影响结果图;其中,*p<0.05;图3为本发明实施例3桂皮醛对hdac6活性的激动作用结果图;其中,*表示与对照组对比,*p<0.05;图4为本发明实施例4在不同hdac抑制剂作用下桂皮醛对高糖孵育的人脐静脉内皮细胞中no生成和arg活性的作用结果图;其中,图4a为不同hdac抑制剂作用下桂皮醛对高糖孵育的人脐静脉内皮细胞中no生成量的影响结果图;图4b为不同hdac抑制剂作用下桂皮醛对高糖孵育的人脐静脉内皮细胞中arg活性的影响结果图;其中,*表示与对照组对比,*p<0.05,#表示与高糖+桂皮醛组对比,#p<0.05。具体实施方式为更好地说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明作进一步说明。实施例1本实施例通过targethunter软件对桂皮醛在体内结合靶标蛋白的预测预测结果:如图1所示,根据桂皮醛小分子3d结构,targethunter软件结合cvdplatform预测桂皮醛的体内结合的蛋白靶标,根据p-value选择前5个蛋白,其中有3个预测结果说明桂皮醛与组蛋白去乙酰化酶6、8或组蛋白去乙酰化酶有较强的结合作用。实施例2本实施例为桂皮醛对高糖诱导的内皮细胞的hdac活性影响的研究一、细胞培养将huvec接种于含10%胎牛血清,100u/ml双抗的人脐静脉内皮细胞培养基中,置于37℃、5%co2恒温箱培养,当细胞培养至80%-90%时进行消化、传代。二、药品及主要试剂桂皮醛(trans-cinnamaldehyde,tca),购自sigma-aldrich公司(中国,上海);二甲基亚砜(dmso),购自sigma-aldrich公司(中国,上海),葡萄糖(d(+)-glucose),购自sigma-aldrich公司(中国,上海);人脐静脉内皮培养基,购自北京裕恒丰公司(中国,北京)。三、实验方法1.细胞分组及高糖造模:细胞分为3组,正常对照组(control),高糖组(hg),桂皮醛给药的高糖组(hg+tca)。在第4-6代之间使用人脐静脉内皮细胞(huvec),待细胞长到40%-60%后,将细胞分别置于含有正常葡萄糖(ng,5.5mmol/l),高葡萄糖(hg,25mmol/l)培养基中持续24小时。2.高糖培养基及桂皮醛的配制:1)配制高糖母液(500mm)及实验使用的高糖溶液:用内皮培养基溶解葡萄糖配成500mm浓度,充分混匀,母液可放置冰箱4℃存储(若发现白色絮状物析出则要重新配制新鲜母液),再将500mm浓度稀释20倍成25mm浓度实验用的高糖溶液。2)桂皮醛溶液配制:使用dmso及内皮培养基将桂皮醛原液充分溶解并逐步稀释至给药终浓度10μm,溶液现配现用。3.给药方法:吸除旧的培养基,用pbs洗2-3遍,沿培养皿边缘缓慢加入培养基,对照组使用正常内皮培养基换液,高糖组加入配置好的高糖培养基(25mm),桂皮醛高糖给药组使用配制好的含10μm桂皮醛的高糖培养基,最后放入培养箱孵育24h。4.hdac活性试剂盒检测根据hdac活性试剂盒检测(enzolifesciences,bml-ak500)的使用说明,使用荧光hdac活性测定试剂盒测量总hdac的活性。造模给药的huvec细胞在有蛋白酶抑制剂的裂解缓冲液中充分裂解,随后进行超声处理和离心。将50μghuvec细胞提取物在白色96孔板用缓冲液稀释(总体积为25μl),加入抑制hdac去乙酰酶活性的抑制剂tsa(1μmol/l)(selleck)(37℃下30分钟),然后再添加用hdac分析缓冲液稀释的fluor-底物(每孔25μl)(在37℃下40分钟)。用50μl终止溶液(包含tsa1μmol/l;显影剂浓缩液10μl/孔;hdac分析缓冲液)终止反应,在室温下孵育50分钟。用酶标仪(tecan,infinitem200)测量荧光(360nm激发,460nm发射),减去背景信号,并计算hdac脱乙酰酶活性。相对去乙酰化(hdac)活性计算方法:每个样品hdac活性值/对照组hdac活性值的平均值х100%。四、实验结果:通过hdac活性(hdacactivity)试剂盒检测高糖诱导的内皮细胞及桂皮醛给药后细胞内hdac活性变化,检测结果如图2所示,其结果表明:与正常对照组(ng)相比,高糖(hg)组中hdac活性明显降低(为对照组的60%±2%),桂皮醛给药后能显著升高高糖组内皮细胞的hdac活性(为对照组的82%±3%),说明桂皮醛通过对hdac的激动作用,显著增加高糖诱导的内皮细胞中hdac活性。实施例3本实施例为桂皮醛对hdac6活性的激动作用的研究一、细胞培养:同实施例2。二、药品及主要试剂:同实施例2。三、实验方法hdac6活性试剂盒检测(enzolifesciences,bml-ak516):试剂盒采用fluordelys系统(荧光组蛋白去乙酰化酶赖氨酸底物/显影剂),可针对特定组蛋白去乙酰化酶6进行测定。测定过程分为两个步骤,首先,将含有乙酰化赖氨酸侧链的sirt1底物与hdac6一起孵育,底物的脱乙酰作用会使底物敏感,在第二步中,用显影剂处理会产生荧光团。操作步骤如下:1)将桂皮醛按梯度配成不同终浓度:10μtca(dmso稀释,最后一步用buffer稀释)加入140μ混合溶液中,实验前先将tca梯度稀释配制浓度为15、45、150、450和1500nm,每个板孔中tca终浓度为1、3、10、30或100nm;每组做3个副孔。2)按测定步骤使桂皮醛在混合溶液中充分混匀,在37℃孵育孔板30分钟,然后通过显影剂(50ul)终止反应,在37℃下孵育孔板60分钟。3)在微孔板荧光计中读取样品,在360nm的波长范围内激发和检测在460nm范围内的发射光,相对组蛋白去乙酰化酶6(hdac6)的活性计算方法:每个样品的hdac6活性值/对照组hdac6活性值的平均值х100%。四、实验结果:在体外将桂皮醛配制成梯度浓度后,通过hdac6活性试剂盒检测其对hdac6活性的作用,检测结果如图3所示,其结果表明:tsa作为总hdac抑制剂,显著降低了hdac6活性(hdac6活性值为正常对照组的13%±4%),说明tsa作为阴性对照组,能有效抑制hdac6活性。与正常对照组相比,tca浓度为10nm、30nm和100nm时,均显著性升高hdac6活性,tca浓度为10nm和100nm时hdac6活性分别为正常对照组的125%±9%和133%±9%,tca浓度为30nm对hdac6的激动作用最强,为正常对照组hdac6活性的156%±16%。说明桂皮醛在一定浓度范围内(1nm≤a≤100nm)可直接对hdac6活性产生激动作用,尤其当桂皮醛浓度a为30nm,对hdac6活性产生激动作用最显著。实施例4本实施例为在不同hdac抑制剂作用下桂皮醛对人脐静脉内皮细胞中no和arg活性的不同影响研究一、细胞培养:同实施例2二、药品及主要试剂:tsa,mgcd0301,ms275,fk228均购自selleck公司(中国,上海),其他同实施例2。三、实验方法(1)细胞分组及高糖造模:同实施例2。(2)高糖培养基及桂皮醛的配制:同实施例2。(3)给药方法:同实施例2。(4)no生成测定:采用硝酸还原酶法检测血清总no水平,根据试剂盒说明书操作,利用nadph酶将硝酸盐还原成为亚硝酸盐,然后通过griess试剂检测总的亚硝酸盐,得到总no。由于no生物半衰期短,在细胞内很快代谢为硝酸盐和亚硝酸盐,通过硝酸盐和亚硝酸盐的od值根据标准曲线换算出no的生成量。空白孔中加入60μl样本稀释液,其他孔中加入60μl上清样本。所有孔依次加入5μlnadph(2mmol/l),10μlfad,再加入5μl硝酸盐还原酶,混匀后,37℃烘箱孵育30min,充分将硝酸盐还原成亚硝酸盐。孵育结束后,分别加入10μl乳酸脱氢酶(ldh)缓冲液,再加入10μl乳酸脱氢酶(ldh),混匀37℃烘箱孵育30min,以终止上一步的还原反应,孵育结束后,每孔加入50μlgriess试剂1和50μlgriess试剂。用酶标仪设定为540nm检测各孔光密度值并通过设立的亚硝酸盐标准曲线计算结果,相对一氧化氮(no)生成量计算方式:每个样品的no生成量/对照组no生成量的平均值х100%。(5)精氨酸酶活性测定:1)收集细胞:装冰塑料盒,相应样品数量的1.5mlep管,在每个装有细胞样品的孔板中先加相应量的裂解液,置于-80℃,30min,倾斜孔板,用细胞刮将其细胞刮置所倾斜的底部,重复操作,收集完所有的细胞样品;2)超声离心:收集好的细胞样本进行超声处理:超声仪中放入样品和tris盐酸缓冲液,超声时间15min。超声好的样品离心机离心(4℃,14000rpm,20min),离心后吸取上清液置于另外一份ep管中;3)加25μl10mmmncl2到ep管中(每管25μl样品),55-60℃加热混合物10min,激活arginase。再加50μl0.5ml-arginase,将混合物37℃放置1h后加400μl配好的混合酸终止反应;4)所有样品ep管按步骤操作反应:所有ep管加25μl9%α-ispf,在98℃加热混合物45min,将样品放在暗处10min后加200μl样品到96孔板中,在540-550nm读数,测尿素浓度;5)结果分析:根据标准孔制作标准曲线,y=ax+b,计算od值,代入标准曲线公式,求出浓度。相对精氨酸酶(arg)活性计算方法:每个样品arg活性浓度/对照组arg活性浓度的平均值x100%。(6)hdac抑制剂分类及配制:所有hdac抑制剂均用dmso溶解并混匀到高糖培养基中配成不同浓度,hdac抑制剂类别及使用浓度如表1所示。表1hdac抑制剂类别及使用浓度hdac抑制剂抑制剂类别使用浓度tsa总hdac抑制剂0.1,0.3,1μmmgcd0301i和iv类hdac抑制剂0.1,1,10mmms275i类hdac抑制剂1,3,10mmfk228ii类hdac抑制剂10,30,100nm四、一氧化氮(no)含量及精氨酸活性检测结果(1)使用碧云天(beyotime)公司的总一氧化氮检测试剂盒(编号:s0024)对细胞上清进行no含量检测,检测结果如图4a所示,其结果表明:桂皮醛可逆转由高糖引起的内皮细胞no生成量降低,与对照组相比,高糖孵育使no生成降低为74%±9%,tca给药后高糖诱导的内皮细胞no生成量恢复到与对照组相同水平(97%±4%)。实验使用的四种hdac抑制剂[tsa(总hdac抑制剂),mgcd0301(i和iv类hdac抑制剂),ms275(i类hdac抑制剂)和fk228(ii类hdac抑制剂)]均能阻断桂皮醛对高糖所致的内皮细胞no生成的损伤作用,说明桂皮醛是通过对去乙酰化酶的激动作用对内皮细胞的no生成产生影响:在高糖组同时给予tca和tsa浓度(0.3μm),no生成量降低为对照组的76%±6%。当同时给予mgcd0301(1mm),no生成量降低为对照组的72%±4%。当同时给予ms275(1和3mm)时,no生成量降低为对照组的77%±8%和72%±4%。同样,当同时给予fk228浓度为10,30和100nm时,no生成量也分别降低为分别为对照组的78%±6%,79%±6%及66%±6%。(2)精氨酸酶活性检测:通过arg水解底物l-arginine生成尿素的量,评价细胞组织arg酶的活性,检测结果如图4b所示,其结果表明:桂皮醛可逆转由高糖引起的内皮细胞arg活性升高,与对照组相比,高糖孵育使arg活性升高为165%±23%,tca给药后高糖诱导的内皮细胞arg活性恢复到与对照组相同水平(107%±4%)。实验使用的四种hdac抑制剂均能阻断桂皮醛对高糖所致的内皮细胞arg活性的降低作用,说明桂皮醛是通过对去乙酰化酶的激动作用对内皮细胞的arg活性产生影响:在高糖组同时给予tca和tsa(0.3和1μm)时,arg活性分别升高为对照组的203%±24%和292%±33%,当同时给予mgcd0301(1mm),arg活性升高为对照组的147%±10%,给予ms275(1,3,10mm),arg活性分别升高为对照组的144%±4%,161%±9%,181%±7%,给予fk228(10,30,100nm)时,arg活性分别升高为对照组的214%±12%,235%±11%,231%±15%。综上,实验结果表明,本发明首次通过targethunter软件预测本发明所述去乙酰化酶的激动剂的蛋白靶标,发现其浓度a在一定范围内(1nm≤a≤100nm)能激动hdac6;本发明所述去乙酰化酶的激动剂能显著升高高糖诱导降低的内皮细胞hdac活性,证明本发明所述的去乙酰化酶的激动剂能通过调控hdac活性从而影响内皮细胞功能;本发明通过高糖诱导内皮细胞损伤模型中“arg-no”通路的调控作用,证实本发明所述的去乙酰化酶的激动剂作为hdac6的激动剂对血管内皮损伤的保护作用。最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1