一种尿道支架及其制备方法和应用与流程
本发明属于医疗器械领域,涉及一种尿道支架及其制备方法和应用。
背景技术:
尿道狭窄是泌尿系统常见疾病,除先天性狭窄外,炎症、损伤是导致尿道狭窄的主要原因,比如,常见的有尿道管腔感染造成的感染性尿道狭窄、经尿道的各种手术或检查等造成的医源性尿道狭窄,另外,随着工业和交通运输业的迅速发展,骨盆骨折和骑跨伤所致的创伤性尿道狭窄病例有较大增加趋势。
目前临床上对于尿道狭窄的治疗方式有反复扩张术、切开术、吻合术、拖入术、替代成形术等手术方式,术后,患者需要植入导尿管做支撑、引流。目前,市面上的导尿管只做物理支撑、引流作用,并未对损伤起到修复或治疗作用,导尿管植入后反而可能会刺激机体引发炎症,损伤部位形成瘢痕组织,从而导致尿道再狭窄。针对尿道再狭窄,若反复进行手术,则容易引起其它并发症,不仅给患者身体和精神上带来巨大的痛苦,也会增加经济负担。
因此,提供一种可以预防或降低尿道再狭窄的尿道支架非常有必要。
技术实现要素:
本发明的目的在于提供一种尿道支架及其制备方法和应用,所述尿道支架一方面可以对尿道起到支撑、引流的作用,另一方面能够预防或降低尿道再狭窄的发生,且所述尿道支架具有低药量高效率的治疗效果,以及具有较久的释药周期和较好的缓释能力。
为达此目的,本发明采用以下技术方案:
本发明的目的之一在于提供一种尿道支架,所述尿道支架包括支架基体以及设置在所述支架基体外表面上的药膜,所述药膜包括控释因子和药物。当所述尿道支架植入尿道中时,所述支架基体对尿道起到支撑、引流的作用,所述药物用于预防或降低尿道再狭窄的发生,所述控释因子用于控制所述药物的释放。
在其中一个具体实施方式中,所述支架基体可以为单腔导尿管、双腔导尿管、三腔导尿管或编织支架中的任意一种,本领域技术人员根据实际需要进行选择即可。
在其中一个具体实施方式中,所述支架基体可以为带球囊的支架基体或不带球囊的支架基体,本领域技术人员根据实际需要进行选择及调整即可。
在其中一个具体实施方式中,所述支架基体的材质为可降解材料和/或不可降解材料。
在其中一个具体实施方式中,所述支架基体的材质是可降解材料。
在其中一个具体实施方式中,所述可降解材料包括聚乳酸、聚丙交酯-乙交酯、聚乙交酯、聚羟基乙酸、聚羟基乙酸/聚乳酸共聚物、聚乙醇酸、聚乙二醇、聚丁二酸丁二醇酯、聚正酯、聚己内酯、透明质酸、纤维素、壳聚糖、聚乙烯醇、聚丙交酯-己内酯、聚乳酸-己内酯、淀粉、聚苯乙烯、聚羟基乙酸/聚乳酸共聚物或明胶中的任意一种或至少两种的组合。
在其中一个具体实施方式中,所述支架基体的材质是不可降解材料。
在其中一个具体实施方式中,所述不可降解材料包括橡胶、乳胶、硅橡胶、聚酯、聚氯乙烯、聚氨酯或金属中的任意一种或至少两种的组合。
在其中一个具体实施方式中,所述药膜和所述支架基体是通过胶粘或二次固化的方式结合在一起的,具有较强的结合强度,避免所述尿道支架植入所述尿道的过程中,所述药膜在摩擦力作用下剥落,也避免所述尿道支架在所述尿道中时,所述药膜被尿液冲刷而剥落。
在其中一个具体实施方式中,当所述支架基体的材质为硅橡胶时,所述药膜和所述支架基体是在半固态的状态下通过二次固化的方式结合在一起的。
在其中一个具体实施方式中,所述药物包括抗炎药物、抗粘连药物或抗瘢痕药物中的任意一种或至少两种的组合。
在其中一个具体实施方式中,考虑到尿道支架植入尿道后,容易引发炎症,通过在尿道支架中引入抗炎药物,可以尽可能的去减少或消除炎症。所述抗炎药物包括阿司匹林、水杨酸、二氟尼柳、双水杨酸酯、布洛芬、吲哚美辛、氟比布洛芬、苯氧基布洛芬、荼普生、吡罗昔康、保泰松、芬洛芬、芬布芬、卡洛芬、酮基布洛芬、双氯灭痛、酮咯酸、四氟芬那酸、舒林酸、托美丁、塞来昔布或氨基糖苷类抗生素中的任意一种或至少两种的组合。所述氨基糖苷类抗生素包括链霉素、庆大霉素、卡那霉素、西索米星、妥布霉素、阿米卡星、奈替米星、淋必治、异帕米星、青紫霉素、小诺霉素、巴龙霉素、新霉素或阿司霉素中的任意一种或至少两种的组合。
在其中一个具体实施方式中,所述抗粘连药物和所述抗瘢痕药物均为含有糖皮质激素的药物。在炎症早期,糖皮质激素可稳定细胞内溶酶体膜,保护线粒体,减轻渗出、水肿、毛细血管扩张、白细胞浸润及吞噬反应,从而改善红、肿、热、痛等症状;在炎症后期,糖皮质激素可抑制毛细血管和纤维母细胞的增生,抑制胶原蛋白、粘多糖的合成及肉芽组织增生,从而防止粘连及瘢痕形成,进而可以预防或降低尿道再狭窄的发生。
在其中一个具体实施方式中,所述含有糖皮质激素的药物包括曲安奈德、地塞米松、倍他米松、可的松、氢化可的松、糠酸莫米松、利美索龙、泼尼松、泼尼松龙、甲泼尼龙、曲安西龙、布地奈德、二丙酸倍氯米松、丙酸氟替卡松、环索奈德、氟轻松、氯氟舒松、卤美他松、双醋二氟松、卤米松或氟氯奈德中的任意一种或至少两种的组合。
在其中一个具体实施方式中,考虑到尿道支架植入后,尿道可能会出现其他的并发症,因此,所述药物还包括大环内酯类抗生素、环孢素a、小檗碱、盐酸小檗碱、紫杉醇、多西他赛、长春瑞滨、榄香烯或依那普利中的任意一种或至少两种的组合。所述大环内酯类抗生素包括红霉素及其衍生物、阿奇霉素、麦迪霉素及其衍生物、螺旋霉素及其衍生物、乙酰螺旋霉素、他克莫司、西罗莫司、依维莫司、两性霉素b、喷他霉素、非达霉素、泰利霉素或丝裂霉素中的任意一种或至少两种的组合。
在其中一个具体实施方式中,所述控释因子为硅橡胶。
在其中一个具体实施方式中,所述硅橡胶包括热硫化硅橡胶、室温硫化硅橡胶、低温硫化硅橡胶、美国道康宁silastic-382医用级硅橡胶、美国道康宁q7医用级硅橡胶系列或植入级mdx医用硅橡胶系列中的任意一种或至少两种的组合。
在其中一个具体实施方式中,所述硅橡胶的交联密度为1000-8000g/mol,例如1500g/mol、2000g/mol、2500g/mol、3000g/mol、3500g/mol、4000g/mol、4500g/mol、5000g/mol、5500g/mol、6000g/mol、6500g/mol、7000g/mol、7500g/mol或8000g/mol等。
所述硅橡胶的交联密度是指单位体积硅橡胶中所含有的有效网链数目,可表征硅橡胶的交联程度。在测试过程中发现,在相同条件下,硅橡胶的交联密度越大,药物释放量越小。当药物分散在硅橡胶中时,通过控制硅橡胶的交联密度,从而控制药物的释放速率,以达到较好的治疗效果。但是,硅橡胶的交联密度会影响硅橡胶的弹性模量、断裂强度、断裂伸长率等性能。根据测试可得,硅橡胶的交联密度在上述范围内具有最佳的弹性及缓释效果。
在其中一个具体实施方式中,在所述尿道中植入一个或一个以上的所述尿道支架,本领域技术人员可根据实际需要调整具体的植入数量。
在其中一个具体实施方式中,所述尿道支架可以整体带药,在植入时无需定位放置,适用于所有的病变位置,以起到整体治疗的效果。
在其中一个具体实施方式中,所述尿道支架可以根据病变位置设置局部带药,以根据损伤情况进行针对性的局部治疗,可以有效提高药物的利用率,降低所述尿道支架整体的带药量。
在其中一个具体实施方式中,单个所述尿道支架的载药量为30μg-200mg,例如30μg、50μg、100μg、500μg、800μg、1mg、10mg、50mg、100mg、150mg、200mg等。
在其中一个具体实施方式中,单个所述尿道支架每天释放5μg-2mg的药量,例如5μg、10μg、50μg、100μg、300μg、500μg、800μg、1mg、1.2mg、1.5mg、1.8mg、2mg等。
在其中一个具体实施方式中,单个所述尿道支架的药物的释放周期为3-90天,例如3天、5天、10天、20天、30天、40天、50天、60天、70天、80天、90天等,优选释放周期为5天、7天、14天、30天、60天或90天中的任意一种。
单个所述尿道支架每天释放5μg-2mg的药量,且单个所述尿道支架的总带药量在30μg-200mg范围内是为了使得每天释放的药量以及总药量达到作用的阈值,从而可以进行有效治疗,与此同时,还使得每天释放的药量以及总药量控制在安全量内,如此,药物用量少但治疗效率高。另外,单个所述尿道支架每天释放5μg-2mg的药量,并持续释放3-90天,释放速度稳定且释放均匀。
在其中一个具体实施方式中,单个所述尿道支架的药物在所述尿道支架完成植入后的1h-7天(例如1h、6h、12h、18h、1天、2天、3天、4天、45天、6天、7天等)不释放或释放量低于1mg(例如5μg、10μg、50μg、100μg、300μg、500μg、800μg、1mg等)。
单个所述尿道支架的药物在所述尿道支架完成植入后的1h-7天不释放或释放量低于1mg,是为了避免前期大量药物作用,降低机体的防御和修复功能,从而导致感染扩散和延缓创口愈合。
另外,需要注意的是,糖皮质激素不利于伤口的愈合,如上述所述,单个所述尿道支架的药物在所述尿道支架完成植入后的前期具有较低的释放量,这样,就有足够的时间供伤口愈合后再释放带有糖皮质激素的药物。
在其中一个具体实施方式中,所述药膜的厚度为0.01-1mm,例如0.01mm、0.05mm、0.1mm、0.3mm、0.5mm、0.7mm、1mm等,优选0.05-0.5mm;所述药膜的厚度影响药物的释放速率,优选0.05-0.5mm范围内,既能保持预期的释放速率,又不会对所述尿道支架的整体壁厚造成影响。
在其中一个具体实施方式中,所述支架基体包括相对的两端,其中一端为引入端,用于引入尿液,另一端为引出端,用于引出尿液。所述引入端的药膜的厚度大于所述引出端的药膜的厚度。
在其中一个具体实施方式中,所述尿道支架的引入端为近膀胱端,所述尿道支架的引出端为近尿道口端。
考虑到在泌尿系统中,正常情况下每天会有1-2l尿液的产生,尿液会沿尿道自上而下流出,引入端的药膜的厚度大于引出端的药膜的厚度,可以弥补因尿液冲刷导致的药物浓度差。从引入端至引出端,药膜的厚度可以呈直线型变化,也可以呈曲线型变化,还可以呈梯度型变化,本发明对药膜厚度变化的规则不做具体限定,只要满足引入端的药膜厚度大于引出端的药膜厚度即可。
在其中一个具体实施方式中,所述药膜的外表面上还设置有亲水涂层。
所述尿道支架在植入尿道的过程中,会与尿道的管腔壁产生一定的摩擦,从而会致使患者出现一定程度的疼痛感。
为降低植入过程中的摩擦力,可在药膜的外表面上设置一层亲水涂层,当亲水涂层与水或者含水的组织接触时,水滴在亲水涂层表面形成较小的接触角,从而可以使水滴拥有较大的铺展面积,形成一层超润滑的表面水膜,从而降低尿道支架植入尿道的过程中的摩擦力。
在其中一个具体实施方式中,所述亲水涂层的厚度为0.01-0.5mm,例如0.01mm、0.05mm、0.1mm、0.12mm、0.15mm、0.17mm、0.2mm、0.22mm、0.25mm、0.27mm、0.3mm、0.35mm、0.4mm、0.45mm、0.5mm等;优选0.05mm。
在其中一个具体实施方式中,所述亲水涂层的材质为聚氧化乙烯、聚丙烯酸、聚丙烯酰胺、聚乙烯醇、聚乙烯吡咯烷酮、马来酸、聚异氰酸酯或透明质酸钠中的任意一种或至少两种的组合。如此,亲水涂层不会与药物发生化学反应致使药物改性或失活。
所述亲水涂层的厚度为0.01-0.5mm,一方面能够均匀充分的与水接触,使水迅速铺展,形成超光滑的表面水膜,另一方面通过亲水涂层的设置,可以进一步控制药物的释放速率,从而控制药效和释放周期。
另外,通过设置所述亲水涂层,可以避免在尿道支架植入的过程中,药膜因摩擦而脱落。
设置药膜或药膜和亲水涂层后,使最终得到的尿道支架的直径比市面常规的支架的直径大0.1-1mm,这样可以增加尿道支架的贴壁性,即,可以使得尿道支架与尿道的管壁紧密贴合,而管壁具有一定的弹性,经反复实验可知,1mm以内的扩张不会影响尿道支架的植入,也不会导致因管壁扩张而额外增加不适感。尿道支架与尿道的管壁紧密贴合,有利于药物被管壁的粘膜层吸收。
本发明的目的之二在于提供一种如目的之一所述的尿道支架的制备方法。
根据本发明的一个方面,所述尿道支架的制备方法包括:将控释因子、微粉化的药物、交联剂以及催化剂进行混练得到混炼物,所述混炼物固化得到药膜,而后将所述药膜和支架基体通过二次固化或胶粘的方式结合在一起,得到所述尿道支架。其中,所述支架基体可以预先通过挤出成型、编织成型等方法制备。
二次固化适用于硅橡胶材质的支架基体,将未完全固化的药膜和支架基体经过加压和/或加热进行二段硫化,使支架基体与药膜完整结合。此方法不需要添加新材料,两者结合牢固,性能稳定。
胶粘适用于所有材质的支架基体,选用的胶具有较好的胶黏性,避免药膜因尿液冲刷而脱落,从而导致药物丢失,所选胶可以为硅橡胶、uv胶、树脂胶、热熔胶、压敏胶、乳胶等中的任意一种或至少两种的组合,优选硅橡胶。
在其中一个具体实施方式中,以药膜中所有原料的添加量之和为100%计,所述控释因子的添加量为55-90%(例如58%、60%、65%、70%、75%、80%、85%、90%等),微粉化的药物的添加量为4-40%(例如4%、8%、10%、15%、20%、25%、30%、35%、40%等),交联剂的添加量为0.1-3%(例如0.1%、0.5%、1%、1.5%、2%、2.5%、3%等),催化剂的添加量为0.1-3%(例如0.1%、0.5%、1%、1.5%、2%、2.5%、3%等),通过控制药膜中各物质的添加量,使得各物质相互配合作用,控制药物的释放速率,从而控制药效以及释放周期。
在其中一个具体实施方式中,所述微粉化的药物的粒径为800-12500目,例如800目、1000目、2000目、3000目、4000目、5000目、6000目、7000目、8000目、9000目、12500目等。通过控制所述药物的目数来控制药物的释放速率,从而控制药效以及释放周期;当所述药物的目数过低时,则所述药物的粒径较大,难以从所述控释因子的内部向外溶出,从而影响治疗效果;当所述药物的目数过高时,则所述药物的粒径较小,容易从所述控释因子的内部向外溶出,会导致血药浓度过高,从而可能引发其他的副反应。
在其中一个具体实施方式中,所述交联剂包括含氢硅油和/或含氢硅氧烷。
在其中一个具体实施方式中,所述催化剂包括铂、铂络合物、钌络合物或铑络合物中的任意一种或至少两种的组合。
根据本发明的另一个方面,所述尿道支架的制备方法包括:将控释因子、药物、交联剂和催化剂制备成药膜液,而后通过浸泡或涂覆的方式将所述药膜液设置于支架基体的表面上,最后,通过固化形成药膜,得到所述尿道支架。其中,所述支架基体可以预先通过挤出成型、编织成型等方法制备。
在其中一个具体实施方式中,以药膜液中所有原料的添加量之和为100%计,所述控释因子的添加量为55-95%(例如58%、60%、65%、70%、75%、80%、85%、90%等),所述药物的添加量为4-40%(例如4%、8%、10%、15%、20%、25%、30%、35%、40%等),所述交联剂的添加量为0.1-3%(例如0.1%、0.5%、1%、1.5%、2%、2.5%、3%等),所述催化剂的添加量为0.1-3%(例如0.1%、0.5%、1%、1.5%、2%、2.5%、3%等),溶解在有机溶剂中,得到药膜液。
在其中一个具体实施方式中,所述控释因子为液态控释因子,以药膜液中所有原料的添加量之和为100%计,所述液态控释因子的添加量为55-95%,微粉化药物的添加量为4-40%,交联剂的添加量为0.1-3%,催化剂的添加量为0.1-3%,混合均匀,得到所述药膜液。
在其中一个具体实施方式中,所述交联剂包括含氢硅油和/或含氢硅氧烷。
在其中一个具体实施方式中,所述催化剂包括铂、铂络合物、钌络合物或铑络合物中的任意一种或至少两种的组合。
在其中一个具体实施方式中,所述有机溶剂包括石油醚、烷类溶剂或苯类溶剂中的任意一种或至少两种的组合,优选正己烷和/或二甲苯。
在其中一个具体实施方式中,将所述药膜液涂覆到支架基体的表面上,而后固化形成药膜,得到所述尿道支架;优选地,所述涂覆的方式包括涂刷、喷涂或浸蘸。
对于具体的涂覆方式本发明不做具体限定,本领域技术人员根据实际需要进行调整,只要满足药膜固化后的厚度在本发明限定的范围之内即可。
在其中一个具体实施方式中,将所述药膜液和支架基体均置于模具中,即支架基体浸泡于药膜液中,而后药膜液在支架基体的表面上经过加压和/或加热硫化成型,再将溶剂除去,得到所述尿道支架。
对于具体的模具需要根据最终植入尿道的尿道支架的形状和尺寸去设置,本发明对此不做具体限定,本领域技术人员根据实际需要进行调整即可。
在其中一个具体实施方式中,所述尿道支架的制备方法还包括:在尿道支架的外表面设置亲水涂层。
本发明的目的之三在于提供一种如目的之一所述的尿道支架在制备药物缓释系统中的应用。
在其中一个具体实施方式中,尿道支架用于尿道的支撑、引流以及预防或减少尿道再狭窄。
相对于现有技术,本发明具有以下有益效果:
本发明的尿道支架包括支架基体以及设置在所述支架基体表面的药膜,当所述尿道支架植入所述尿道中时,所述支架基体对所述尿道起到支撑、引流的作用,所述药膜用于预防或降低尿道再狭窄的发生,且所述尿道支架具有低药量高效率的治疗效果以及具有较久的释药周期和较好的缓释能力。另外,本发明的尿道支架可以靶向作用,有效避免了口服用药时肝脏首先要进行代谢的情况,使用剂量是口服或者注射方式的10%左右,大大降低了药物对全身的副作用。
附图说明
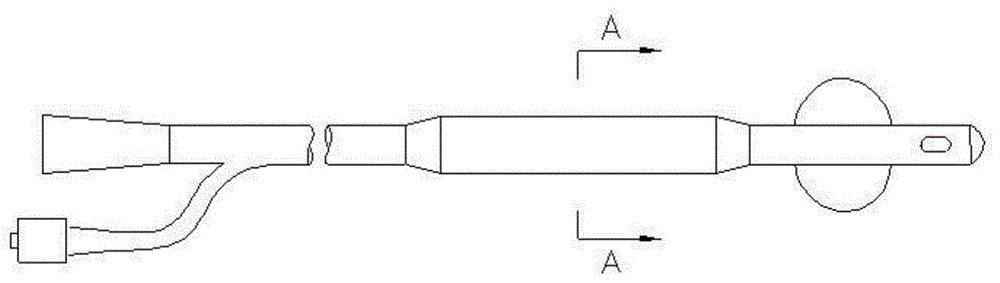
图1为实施例1中支架基体的结构示意图;
图2为实施例1中支架基体沿a-a的剖视图;
图3为实施例1中尿道支架的药物溶出曲线图;
图4为实施例5中尿道支架的药物溶出曲线图。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
实施例1
本实施例提供一种尿道支架,包括支架基体以及设置在支架基体外表面上的药膜,其中药膜的厚度为0.05mm;支架基体为8f规格聚氨酯材料的带球囊的支架基体(如图1所示),所述支架基体沿a-a的剖视图如图2所示。
本实施例提供一种尿道支架的制备方法,包括如下步骤:
(1)药膜液制备:将单组份htv硅橡胶78重量份、地塞米松20重量份(粒径为1000目)、含氢硅油1重量份以及铂催化剂1重量份,溶解在200重量份的正己烷中,混合搅拌均匀得到药膜液;
(2)尿道支架的制备:取8f规格聚氨酯材料的带球囊的支架基体,采用浸蘸的方式在支架基体远端球囊下段涂上100mm长度段的药膜液,药膜液均匀浸蘸后,模压热硫化,脱模后在40℃条件下烘干30min,得到尿道支架。
硅橡胶的交联密度为3000g/mol。
按照标准gb/t531的测试方法对本实施例的尿道支架测试其物理性能,可知:支架基体的硬度为82a。
使用径向支撑测力仪对支架的支撑力进行测试,压缩10%的力值为103n。
根据重量计算样品中的药物成分含量,使用药物溶出试验仪对样品在37℃的模拟尿液溶液中进行药物溶出,用高效液相色谱(hplc)测试溶出药物量,如图3所示:在30天内,前7天药物溶出最大量为210μg/d,后面逐渐平稳趋缓,前7天药物溶出总量为1296μg,30天内平均释放度为92μg/d,此处d为单位天的缩写,后文如出现相同的标识,指代的意义均与此处相同,后文不再具体赘述。
建立尿道瘢痕机制动物模型,取10只雌性新西兰兔,在尿道前球部使用钬激光建立损伤模型,清创后,造影测量狭窄段直径d1和狭窄段近端正常尿道直径d2,利用
将动物分为实验组和对照组,将实验组5只植入自制的带药尿道支架,对照组植入市面常规不带药8f规格支架。分别于1个月后拔管,测量观察瘢痕情况以及狭窄程度。
建立损伤模型后,尿道狭窄率为48.88±8.39%,随机植入实验支架和对照支架,1个月后拔管,采用造影测量尿道狭窄程度,实验组狭窄程度为13.40±2.10%,对照组狭窄程度为21.09±2.69%,p为0.001<0.05,具有显著性差异。
拔管后继续饲养1个月,观察排尿情况,如下表1所示:
表1
通过对表1的分析可知,拔管后以及拔管后1个月,实验组排尿均比较顺畅,对照组有尿线变细情况,实验组排尿情况比对照组好。
拔管后1个月解剖,取组织切片,使用image-proplus6.0软件分析,每张切片选取8处,测量组织的损伤深度。实验组损伤深度为1569±165μm,对照组损伤深度为1819±128μm,p为0.032<0.05,具有显著性差异。
取组织切片,对组织切片染色,使用image-proplus6.0分析软件测量胶原纤维面积百分比,实验组胶原纤维面积百分比为55.50±6.53%,对照组胶原纤维面积百分比为71.61±2.46%。p为0.004<0.05,具有显著性差异。
实施例2
本实施例提供一种尿道支架,包括支架基体以及设置在支架基体外表面上的药膜,其中药膜的厚度为0.5mm;支架基体为硅橡胶制成的单腔导尿管(型号8f)。
本实施例提供一种尿道支架的制备方法,包括如下步骤:
(1)药膜液制备:将单组份htv液态硅橡胶60重量份、糠酸莫米松20重量份(粒径为3000目)、含氢硅油0.2重量份以及铂催化剂0.2重量份混合均匀,得到药膜液;
(2)尿道支架的制备:取8f规格硅橡胶材料的支架基体,将药膜液和支架基体放在模具中,采加热硫化形式将药膜固化在支架基体上,脱模后,得到尿道支架。
按照实施例1的测试方法对本实施例的支架测试其物理性能,可知:支架基体的硬度为85a。
使用径向支撑测力仪对支架的支撑力进行测试,压缩10%的力值为118n。
根据重量计算样品中的药物成分含量,使用药物溶出试验仪对样品在37℃的模拟尿液溶液中进行药物溶出,用hplc测试溶出药物量,可见在30天内,前7天药物溶出最大量为228μg/d,后面逐渐平稳趋缓,30天内平均释放度为103μg/d。
实施例3
本实施例提供一种尿道支架,包括支架基体以及设置在支架基体外表面上的药膜,其中药膜的厚度为1mm;支架基体为金属制成的编织支架(型号8f)。
本实施例提供一种尿道支架的制备方法,包括如下步骤:
(1)药膜液制备:将双组份室温硫化液态硅橡胶a30重量份、糠酸莫米松10重量份(粒径为3000目)、铂催化剂0.1重量份混合,得到药膜液a;将双组份室温硫化液态硅橡胶b30重量份、糠酸莫米松10重量份(粒径为3000目)、含氢硅油0.1重量份混合,得到药膜液b;
(2)尿道支架的制备:取8f规格金属丝(例如镍钛合金丝)编织成型的支架基体,将药膜液a/b称取等重量混合均匀,将支架基体和药膜液放入模具中,加压固化,得到尿道支架。
按照实施例1的测试方法对本实施例的支架测试其物理性能,可知:支架的硬度为90a。
使用径向支撑测力仪对支架的支撑力进行测试,压缩10%的力值为158n。
根据重量计算样品中的药物成分含量,使用药物溶出试验仪对样品在37℃的模拟尿液溶液中进行药物溶出,用hplc测试溶出药物量,可见在30天内,前7天药物溶出最大量为196μg/d,后面逐渐平稳趋缓,30天内平均释放度为82μg/d。
实施例4
与实施例1的区别仅在于,药膜的外表面还设置有亲水涂层,亲水涂层的材质为聚乙烯吡咯烷酮,厚度为0.02mm。
与实施例1相比,本实施例中尿道支架的制备方法还包括:将聚乙烯吡咯烷酮混合液喷涂在实施例1得到的支架的外表面上,通过紫外光交联固化,得到尿道支架。
使用径向支撑测力仪对支架的支撑力进行测试,压缩10%的力值为108n。
根据重量计算样品中的药物成分含量,使用药物溶出试验仪对样品在37℃的模拟尿液溶液中进行药物溶出,用hplc测试溶出药物量,可见在30天内,前7天药物溶出最大量为6μg/d,前7天药物溶出总量为23μg,30天内平均释放度为56μg/d。
以上述方法制备的尿道支架,对其进行和实施例1相同的动物实验。
植入1个月后拔管,采用造影测量尿道狭窄程度,实施例1组狭窄程度为13.40±2.10%,本实施例狭窄程度为10.09±0.97%,p为0.024<0.05,具有显著性差异。
拔管后继续饲养1个月,观察排尿情况,如下表2所示:
表2
通过表2分析可知,拔管后以及拔管后1个月,实施例1和本实施例组排尿均比较顺畅,两组无显著差异。
拔管后1个月解剖,取组织切片,使用image-proplus6.0软件分析,每张切片选取8处,测量组织的损伤深度。实施例1组损伤深度为1569±165μm,本实施例损伤深度为1341±161μm,p为0.063>0.05,无显著性差异。
取组织切片,对组织切片染色,使用image-proplus6.0分析软件测量胶原纤维面积百分比,实施例1组胶原纤维面积百分比为55.50±6.53%,本实施例组胶原纤维面积百分比为43.48±5.36%。p为0.015<0.05,具有显著性差异。
通过动物实验得知,降低前7天药物释放量的动物实验结果优于不做处理的样品。
实施例5
本实施例提供一种尿道支架,包括支架基体以及设置在支架基体外表面上的药膜,其中药膜的厚度为0.2mm;支架基体为8f规格聚氨酯材料的带球囊的支架。
本实施例提供一种尿道支架的制备方法,包括如下步骤:
(1)药膜的制备:将热硫化型硅橡胶双组份a30重量份、糠酸莫米松10重量份(粒径为6000目)、催化剂0.5重量份,混炼均匀;将热硫化型硅橡胶双组份b30重量份,阿司匹林10重量份(粒径为800目)、高含氢硅油0.5重量份,混练均匀。最后将混炼好的a/b组分等量充分混炼,在模具中硫化成0.2mm的药膜;
(2)尿道支架的制备:采用硅橡胶(e41,wacker)将药膜粘贴在8f规格聚氨酯材料的支架基体上,得到尿道支架。
使用径向支撑测力仪对支架的支撑力进行测试,压缩10%的力值为106n。
根据重量计算样品中的药物成分含量,使用药物溶出试验仪对样品在37℃的模拟尿液溶液中进行药物溶出,用hplc测试溶出药物量,如图4所示:在30天内,前7天糠酸莫米松药物溶出最大量为439μg/d,阿司匹林药物溶出最大量为137μg/d,后面逐渐平稳趋缓,30天内糠酸莫米松平均释放度为264μg/d,阿司匹林平均释放度为54μg/d。
在本实施例的制备方法中,引入了两种药物,两种药物协同作用,可以起到更好的治疗效果。
对比例1
与实施例1的区别仅在于药膜的厚度为0.005mm,其余组成以及制备方法均与实施例1相同。
使用径向支撑测力仪对支架的支撑力进行测试,压缩10%的力值为98n。
根据重量计算样品中的药物成分含量,使用药物溶出试验仪对样品在37℃的模拟尿液溶液中进行药物溶出,用hplc测试溶出药物量,可见在30天内,前7天药物溶出最大量为17μg/d,后面逐渐平稳趋缓,30天内平均释放度为8μg/d。
与实施例1相比,在对比例1中,药膜太薄,因此,尿道支架的载药量低,药物浓度梯度小,所以,药物溶出度低。
对比例2
与实施例1的区别仅在于药膜的厚度为2mm,其余组成以及制备方法均与实施例1相同。
使用径向支撑测力仪对支架的支撑力进行测试,压缩10%的力值为137n。
根据重量计算样品中的药物成分含量,使用药物溶出试验仪对样品在37℃的模拟尿液溶液中进行药物溶出,用hplc测试溶出药物量,可见在30天内,前7天药物溶出最大量为468μg/d,后面逐渐平稳趋缓,30天内平均释放度为206μg/d。
与实施例1相比,在对比例2中,药膜比较厚,因此,尿道支架的载药量高,药物浓度梯度大,所以,药物溶出度高。
另外,以上述方法制备的尿道支架,对其进行和实施例1相同的动物实验,在植入时,摩擦阻力较大,无法顺利输送进入尿道。
对比例3
与实施例5的区别仅在于糠酸莫米松的粒径为10000目,阿司匹林的粒径为500目,其余组成以及制备方法均与实施例5相同。
使用径向支撑测力仪对支架的支撑力进行测试,压缩10%的力值为105n。
根据重量计算样品中的药物成分含量,使用药物溶出试验仪对样品在37℃的模拟尿液溶液中进行药物溶出,用hplc测试溶出药物量,在30天内,前7天糠酸莫米松药物溶出最大量为896μg/d,阿司匹林药物溶出最大量为32μg/d,后面逐渐平稳趋缓,30天内糠酸莫米松平均释放度为467μg/d,阿司匹林平均释放度为8μg/d。
通过实施例5和对比例3可知,药物的目数越低,药物颗粒越大,药物难以通过硅橡胶孔隙释放出来;药物的目数越高,药物颗粒越小,药物越容易通过孔隙释放出来。
对比例4
与实施例1的区别仅在于硅橡胶的交联密度为1000g/mol,其余组成以及制备方法均与实施例1相同。
使用径向支撑测力仪对支架的支撑力进行测试,压缩10%的力值为86n。
根据重量计算样品中的药物成分含量,使用药物溶出试验仪对样品在37℃的模拟尿液溶液中进行药物溶出,用hplc测试溶出药物量,可见在30天内,前7天药物溶出最大量为376μg/d,后面逐渐平稳趋缓,30天内平均释放度为154μg/d。
通过实施例1和对比例4的对比可知,交联密度低会增加药物释放量。
对比例5
与实施例1的区别仅在于硅橡胶的交联密度为10000g/mol,其余组成以及制备方法均与实施例1相同。
使用径向支撑测力仪对支架的支撑力进行测试,压缩10%的力值为129n。
根据重量计算样品中的药物成分含量,使用药物溶出试验仪对样品在37℃的模拟尿液溶液中进行药物溶出,用hplc测试溶出药物量,可见在30天内,前7天药物溶出最大量为112μg/d,后面逐渐平稳趋缓,30天内平均释放度为59μg/d。
通过实施例1和对比例5的对比可知,交联密度高会降低药物释放量。
申请人声明,以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,所属技术领域的技术人员应该明了,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!