一种FAP-α特异性肿瘤诊断SPECT显像剂的制作方法
本发明涉及一种放射性核素标记的诊断型药物配合物,包括制备该配合物的前体化合物及其药物组合物或成药型试剂盒,特别涉及一种靶向fap-α的广谱肿瘤spect显像剂。
背景技术:
恶性肿瘤患者中90%的死亡是由转移导致的,但现在针对肿瘤转移的预防性或治疗性策略仍处于匮乏阶段。
肿瘤是由肿瘤细胞及其周围基质细胞和非细胞组分构成的复合体,肿瘤的发生发展是肿瘤细胞与其微环境相互促进、共同演化的一个动态过程。肿瘤微环境包括细胞及细胞外基质,有形成分主要是细胞组分,包括免疫细胞、内皮细胞、成纤维细胞等,其中肿瘤相关成纤维细胞(cancerassociatedfibroblasts,cafs)是肿瘤微环境中最主要的基质细胞,占到肿瘤组织细胞总数的50%左右。cafs在肿瘤的生长、转移、耐药及治疗抵抗等方面均发挥重要作用,是肿瘤诊治研究的热点之一。
cafs的一个显著特征是seprase或成纤维细胞活化蛋白(fap-α)的高表达。二者是同一种细胞表面的膜丝氨酸蛋白酶,具有二肽基肽酶(dpp)及胶原酶两种活性,能降解二肽及ⅰ型胶原。fap-α与二肽基肽酶iv(dipeptidylpeptidaseiv,dppiv/cd26)具有相似的结构域及二肽基肽酶活性,同属于丝氨酸蛋白酶家族。但fap-α具有独特的肽链内切酶活性,可以裂解明胶、变性的ι型胶原和α2-抗纤维蛋白,而dppiv不具有,故可区别二者。
fap-α选择性地表达于90%以上的上皮恶性肿瘤的基质成纤维细胞表面,包括乳腺癌、卵巢癌、肺癌、结直肠癌、胃癌、胰腺癌、皮肤黑色素瘤等。良性及癌前病变的上皮肿瘤,如结直肠腺瘤、乳腺叶状肿瘤和纤维腺瘤中fap-α通常不表达。而fap-α在正常人组织中一般无表达,仅存在于宫颈和子宫内膜,在胚胎发育过程中短暂表达。
大量研究表明,fap-α在上皮肿瘤cafs中的高表达与患者预后较差相关,说明其活性程度与癌症的发展以及癌细胞的转移和扩散有关。因此,将其作为靶点用于核医学显像将是早期诊断恶性肿瘤、评估肿瘤分期或作为肿瘤治疗伴随诊断、疗效评估的一种有前途策略。
spect(单光子发射计算机断层成像)和pet(正电子发射断层成像)同属于核医学的两种显像技术,由于它们都是对从病人体内发射的γ射线成像,故统称发射型计算机断层成像术。二者相比,pet诊断在检测灵敏度、图像分辨率及清晰度、定位准确性方面具有显著优势,然而其设备、药物和检查费用都更为昂贵。相比而言,spect诊断使用到的药物制备相对简便且成本低、临床检查费用适中,普及率高,易于推广和接受。但目前临床使用的肿瘤特异性spect显像剂品种较少,靶向特异性不高,成像效果差,因此大力发展广谱的肿瘤特异性spect显像技术非常必要。
技术实现要素:
本发明提供如下技术方案:
一种用于形成放射性核素配合物的前体化合物,其具有如下结构:
本发明还提供一种放射性核素标记上述前体化合物后形成的配合物。
根据本发明的配合物,其放射性核素为99mtc。
根据本发明的配合物,除上述前体化合物外,所述配合物中还具有与99mtc络合的另外两种协同配体化合物:n-三(羟甲基)甲基甘氨酸(tricine)和三苯基膦三间磺酸钠盐(tppts)。
根据本发明的配合物,其具有下述结构:
本发明还提供一种含有上述99mtc标记的配合物的药物组合物。
根据本发明的药物组合物,其是一种可静脉注射的药物组合物。
本发明还提供一种便捷制备上述99mtc标记配合物的试剂盒,所述试剂盒含有本发明上述的前体化合物、n-三(羟甲基)甲基甘氨酸(tricine)和三苯基膦三间磺酸钠盐(tppts)的冻干制剂。优选地,所述试剂盒可以通过将含有所述配体化合物的缓冲溶液冻干至西林瓶中制备获得。更优选地,上述前体化合物、n-三(羟甲基)甲基甘氨酸(tricine)、三苯基膦三间磺酸钠盐(tppts)置于琥珀酸/氢氧化钠的溶液中,过滤后冻干得到试剂盒。在每次进行本发明的99mtc标记配合物制备时,只需取出制备好的试剂盒,加入相应放射性活度的na99mtco4洗脱液,在80-120℃,优选99℃水浴,加热5-20分钟,优选15分钟,即可制得本发明的99mtc标记配合物。
本发明还提供本发明的上述前体化合物或放射性核素标记的配合物在制备肿瘤spect显像剂中的用途。
发明详述
本领域已知fap-α与涉及重塑细胞外基质的多种疾病相关,fap-α抑制剂作为一些疾病的治疗选择被广泛研究,其中最受关注的是肿瘤学应用。jansen团队在2014年文献(journalofmedicinalchemistry,2014,57,3053-3074页)公开了一系列n-4-喹啉基-甘氨酸-(2s)-氰基脯氨酸骨架的fap-α抑制剂,其中一种具体结构如下所示:
而后uwehaberkorn团队在上述fap-α小分子抑制剂的基础上,开发研究了一系列用于pet、mri、spect的显像剂和放射靶向治疗剂。其在wo2019154886a1中公开了如下结构的显像剂配体化合物:
同时该文献还公开了由所述配体化合物与放射性核素形成的用于显像的配合物。其中大部分标记配合物用于pet显像,例如:
然而在该文献中,uwehaberkorn团队并未公开上述spect显像剂的研究实验数据。随后,uwehaberkorn团队在2020年文献(journalofnuclearmedicine,2020年3月13日在线发表,doi:10.2967/jnumed.119.239731)公开了用于spect显像的99mtc标记的系列fapi配合物:
根据该文献记载,uwehaberkorn团队认为,除了基团的亲水性、极性之外,其他很多因素都会影响显像剂在肿瘤中的摄取,而99mtc-fapi-34因具有快速的肿瘤吸收和从正常脏器快速的清除,被认为是最适合用于spect显像。
然而,本发明经过潜心研究,发现了一种新的靶向fap-α的spect显像剂,不同于uwehaberkorn团队中的基于三羰基99mtc配合物,本发明采用了新的螯合配体、新的配合方式从而得到新的结构的配合物,所述配合物结构如下所示:
本发明上述配合物作为靶向fap-α的spect显像剂,相比于上述现有技术,甚至是效果最佳的99mtc-fapi-34,显示出令人意外的更为优异的体内生物分布,更高的肿瘤摄取和肿瘤/脏器摄取比及极佳的肿瘤成像能力。同时本发明的配合物相比于现有技术的基于三羰基99mtc配合物而言,具有更为稳定的配位性,进而显示出优秀的体内、外稳定性;由于使用了一步标记法的试剂盒化技术,因此具有更好的成药性,适于工业化生产和临床推广。
附图说明
附图1:hfapi的合成路线。
附图2:hpfapi的合成路线。
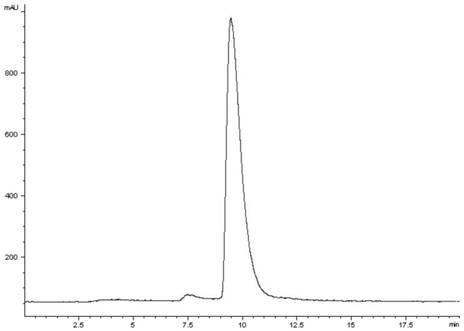
附图3:99mtc-hfapi的放射性hplc信号图。
附图4:99mtc-hpfapi的放射性hplc信号图。
附图5:99mtc-hfapi与fap-α重组蛋白的结合与封闭实验结果。
附图6:99mtc-hpfapi与fap-α重组蛋白的结合与封闭实验结果。
附图7:99mtc-hfapi在u87mg荷瘤小鼠模型中的spect/ct显像。
附图8:99mtc-hpfapi在u87mg荷瘤小鼠模型中的spect/ct显像。
附图9:uwehaberkorn团队在2020年文献中公开的99mtc-fapi-34的显像。
附图10:99mtc-hfapi在u87mg小鼠模型中的生物分布及封闭实验数据。
附图11:99mtc-hpfapi在u87mg荷瘤小鼠中的生物分布及封闭实验数据。。
附图12:乳腺癌患者18f-fdg-pet和99mtc-hfapi-spect显像。
具体实施方式
下文将结合具体实施例对本发明的化合物及其制备方法和应用做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
实验仪器耗材
高效液相色谱仪(hplc-1260infinity)和数模信号转换模块(35900e)购自美国agilent公司,hplc放射性性信号检测器(gabistarγ-raytest)购自德国raytest公司。半制备型c18反相色谱柱(ymc-packods-a,250×10.0mml.d.s-5μm,12nm)、分析型c18反相色谱柱(ymc-packods-a,250×4.6mml.d.s-5μm,12nm)购自日本ymc公司。精密电子天平(bp211d)购自德国sartorius公司。冷冻干燥机(fd-1d-50)购自北京博医康实验仪器有限公司。放射性γ-计数仪(wizard-2470)购自美国perkinelmer公司。放射性活度计(crc-25r)购自美国capintec公司。小动物spect/ct成像仪(nanoscanspect/ct)购自匈牙利mediso公司。
实验细胞和动物
spf级雌性balb/cnude小鼠,4~5周龄;spf级雌性昆明白鼠,6周龄,均购买于北京维通利华实验动物技术有限公司。u87mg(人神经胶质瘤细胞系)购自atcc(americantypeculturecollection,manassas,va)。u87mg培养于含10%fbs的dmem细胞培养基。细胞在37℃,含5%co2的培养箱中常规培养传代培养。取4-5周龄balb/c裸鼠,每只分别于右侧腋窝皮下接种5×106u87mg细胞,spf条件下饲养。待肿瘤体积达到100~300mm3时用于显像和生物分布实验。
实施例1hfapi和hpfapi的化学合成
高效液相色谱法对目标产物进行分离与纯化的方法一:agilent1260hplc系统配备ymc-packods-ac18半制备柱(250×10mml.d.s-5μm,12nm)。梯度淋洗25min,流速3.2ml/min,其中流动a相为去离子水(含0.05%tfa),流动b相为乙腈(含0.05%tfa),淋洗梯度设定为起始时85%a和15%b,5min时为85%a和15%b,25min时45%a和55%b。
高效液相色谱法对目标产物进行分离与纯化的方法二:agilent1260hplc系统配备ymc-packods-ac18半制备柱(250×10mml.d.s-5μm,12nm)。梯度淋洗25min,流速2.0ml/min,其中流动a相为去离子水(含0.05%tfa),流动b相为乙腈(含0.05%tfa),淋洗梯度设定为起始时80%a和20%b,5min时为80%a和20%b,25min时40%a和60%b。
(1)hfapi的合成
hfapi的合成路线如图1所示,全部反应共需14步,具体反应步骤如下:
步骤1:制备(2s)-2-氨基甲酰基-4-羟基吡咯烷-1-羧酸叔丁酯(化合物2)
氩气保护下向(2s)-1-(叔丁氧基羰基)-4-羟基吡咯烷-2-羧酸(化合物1,27.5g,119mmol)和三乙胺(18.0ml,131mmol)的thf(400ml)溶液中逐滴缓慢加入氯甲酸乙酯(14.2g,131mmol)。将反应混合物在-5℃下搅拌10分钟。然后再加入氨水(73.7ml)并将该混合物升温至室温继续搅拌30分钟。反应结束后将饱和nahco3溶液(180ml)加入到反应混合物中。萃取水相后合并有机相,经硫酸钠干燥并真空抽干,得到为白色固体化合物2(27g,98.6%)。lc/ms:252.9[m+na]+。
步骤2:制备(s)-2-氨基甲酰基-4-氧吡咯烷-1-羧酸叔丁酯(化合物3)
向冷却至-78℃的含有草酰氯(5.6g,0.044mol)的dcm溶液(80ml)中加入dmso(4.9g,0.063mol)。15分钟后,滴加含有化合物2(7.23g,0.031mol)的dcm/thf溶液(120ml/100ml)。再加入et3n(9.5g,0.094mol)反应搅拌20分钟。冰浴冷却10分钟后继续搅拌1小时。向混合物通过加入饱和nahco3溶液猝灭反应并过滤。真空蒸发滤液并通过快速色谱法用dcm/meoh=15∶1纯化。得到为淡黄色固体的化合物3(2.16g,29.1%)。lc/ms:250.9[m+na]+。
步骤3:制备(s)-2-氨基甲酰基-4,4-二氟吡咯烷-1-羧酸叔丁酯(化合物4)
将含化合物3(2.61g,0.011mol)的dcm溶液(60ml)冷却至-70℃后加入dast(5.51g,0.034mmol)。-70℃下搅拌反应30分钟,然后在室温下搅拌反应2小时。向混合物通过加入饱和nahco3溶液猝灭反应并用dcm萃取。用mgso4干燥后,残余的黄色固体通过硅胶柱色谱法用dcm/meoh=15∶1纯化。得到为褐色固体的化合物4(1.21g,42.1%)。lc/ms:404.8[m+na]+。
步骤4:制备(s)-2-氰基-4,4-二氟吡咯烷-1-羧酸叔丁酯(化合物5)
向含有化合物4(1.5g,6.0mmol)的无水吡啶溶液(30ml)中加入tfaa(1.51g,7.2mol)。将混合物在-5℃下搅拌反应15分钟,然后将溶液升温至室温并继续搅拌1.5小时。反应混合物用ea和h2o稀释。水层用ea萃取。合并有机相,用饱和盐水洗涤后硫酸镁干燥,过滤并浓缩。粗产物通过硅胶柱色谱法用pe/ea=10∶1纯化。得到淡黄色固体的化合物5(1g,71.7%)。lc/ms:254.8[m+na]+。
步骤5:制备(s)-4,4-二氟吡咯烷-2-甲腈(化合物6)
向溶解有化合物5(1.6g,6.9mmol)的无水乙腈(20ml)溶液中加入tfa(4ml)。将混合物在室温下搅拌反应2小时。将混合物真空蒸干,无需进一步纯化即可直接用于随后的步骤。lc/ms:133.0[m+h]+。
步骤6:制备叔丁基(s)-(2-(2-氰基-4,4-二氟吡咯烷-1-基)-2-氧代乙基)-氨基甲酸叔丁酯(化合物7)
将化合物7(1.7g,粗品),(叔丁氧羰基)甘氨酸(1.76g,10mmol),hatu(4.2mg,11mmol),diea(5.17g,40mmol),dcm(20ml)和dmf(20ml)加入圆底烧瓶中并在室温下搅拌3小时。真空蒸发混合物并通过快速色谱法以
步骤7:制备(s)-4,4-二氟-1-glycylpyrrolidine-2-甲腈(化合物8)
将对甲苯磺酸一水合物(0.9g,4.7mmol)加入到冷却至0℃的含有化合物7(1g,3.4mmol)的乙腈溶液中(10ml)。将混合物缓慢升温至室温并搅拌24小时。将混合物用ea和h2o稀释。将水层用ea洗涤3次,然后将水层真空蒸发得到粗产物。粗品无需进一步纯化即可用于后续步骤。lc/ms:189.9[m+h]+。
步骤8:制备6-羟基喹啉-4-羧酸(化合物10)
在一个50ml圆底烧瓶中加入6-甲氧基喹啉-4-羧酸(化合物9,1.0g,4.92mmol)和hbr水溶液(40%,35ml),氮气保护下于100℃搅拌反应30小时。真空蒸干混合物得到1.76g粗产物。粗产物无需进一步纯化即可直接用于后续步骤。lc/ms:189.9[m+h]+。
步骤9:制备3-氯丙基-6-(3-氯丙氧基)喹啉-4-羧酸乙酯(化合物11)
将化合物10(1.76g,粗品),1-溴-3-氯丙烷(3.22ml,32.5mmol)和k2co3(3.86g,27.9mmol)的溶解于30ml的dmf溶液中,60℃下搅拌3小时。将混合物用naoh水溶液(6m,5ml)淬灭反应,55℃旋蒸,再添加meoh并过滤,收集滤过液真空蒸发得到3.17g粗产物。粗产物无需进一步纯化即可直接用于后续步骤。lc/ms:341.7[m+h]+。
步骤10:制备3-(4-(叔丁氧基羰基)哌嗪-1-)丙基6-(3-(4-(叔丁氧基羰基)哌嗪-1-)丙氧基)喹啉-4-羧酸乙酯(化合物12)
将化合物11(3.17g,粗品),哌嗪-1-羧酸叔丁酯(8.71g,46.5mmol)和ki(1.7g,10.2mmol)加入dmf(40ml)溶液中60℃搅拌反应17小时。真空蒸干混合物得到3.87g粗产物。粗产物无需进一步纯化即可直接用于后续步骤。lc/ms:641.8[m+h]+。
步骤11:制备6-(3-(4-(叔丁氧基羰基)哌嗪-1-基)丙氧基)喹啉-4-羧酸(化合物13)
将化合物12(3.87g,粗品)和氢氧化锂一水合物(3.126g,74.5mmol)溶解在thf/h2o(v1:v2=1:1)的溶液中,室温搅拌反应1小时。真空蒸干混合物并通过硅胶柱色谱用dcm/甲醇=8:1~6:1纯化。获得为白色固体的化合物13(1.2g,58.8%)。lc/ms:415.7[m+h]+。
步骤12:制备4-(3-((4-((2-(2-氰基-4,4-二氟吡咯烷-1-基)-2-氧代乙基)-氨基甲酰基)喹啉-6-基)氧基)丙基)哌嗪-1-甲酸叔丁酯(化合物14)
将化合物13(957mg,2.3mmol),化合物8(652mg,3.45mmol),hatu(1.05g,2.76mmol),n,n-二异丙基乙胺(1.5g,11.5mmol)和dmf(15ml)加入圆底烧瓶中,室温搅拌反应2小时。真空蒸发混合物并通过硅胶柱层析使用dcm/甲醇=10∶1纯化获得白色固体的化合物14(440mg,30.9%)。lc/ms:586.7[m+h]+。
步骤13:制备(s)-n-(2-(2-氰基-4,4-二氟吡咯烷-1-基)-2-氧代乙基)-6-(3-(哌嗪-1-基)丙氧基)喹啉-4-甲酰胺(fapi)
将化合物14与tfa(2.5ml)和dcm(5ml)混合,室温搅拌0.5小时。将混合物真空蒸发,通过制备型hplc纯化混合物。获得为白色固体的产物(fapi,20mg,20.2%)。lc/ms:486.7[m+h]+。
步骤14:制备hfapi
将化合物15(6-(2-(2-磺基亚苄基)肼基)烟酸)(1eq)、hatu(1.2eq)溶于装有200μldmf的ep管,再加入diea(2eq),在振荡器上30℃反应20分钟。另称取fapi(1eq)溶于100μldmf,并将其加入上述反应液中。使用高效液相色谱法对反应进行监测、并对目标产物进行分离与纯化(方法一)。收集13.9分钟的洗脱峰,洗脱液使用真空冷冻干燥方法冻干,获得白色粉末状产物。取少量产物溶解后,hplc鉴定纯度为98.9%。经maldi-tof质谱分析确认为预期产物,maldi-tof-ms:m/z=790.31([m+h]+),[c37h37f2n9o7s]+理论值为789.82。
(2)hpfapi的合成
hpfapi的合成路线共分15步,其中前13步与hfapi一致,后两步合成路线如图2所示,具体步骤如下:
步骤1:制备peg4-sbzh(化合物18)
称取化合物17(1.2eq)加入ep管,溶于50μldmf,加入diea调节ph值至7.8-8.0;另称取化合物16(1eq)于ep管中,溶于50μldmf中。将sbz-hynic-nhs加入化合物17溶液中,充分混匀,再加入diea调节ph值至7.8-8.0,室温反应过夜。使用高效液相色谱法对反映进行监测、目标产物进行分离与纯化(方法二)。收集18.2分钟的洗脱液,洗脱液使用真空冷冻干燥方法冻干,得到白色固体化合物18。取少量产物溶解后,hplc鉴定纯度>98%。经maldi-tof质谱分析确认为预期产物,maldi-tof-ms:m/z=569.21([m+h]+),[c24h32n4o10s]+理论值为568.60。
步骤2:制备hpfapi
秤取化合物18(1eq)、hatu(1eq)加入ep管,溶于200μldmf,取diea(2eq)加入上述ep管,在恒温振荡器上30℃反应20分钟。另称取fapi(1eq)溶于100μldmf,并将其加入上述反应液中。使用高效液相色谱法对反应进行监测、对目标产物进行分离与纯化(方法一)。收集合并16.7分钟的洗脱峰,洗脱液使用真空冷冻干燥方法冻干,获得产物hpfapi。取少量产物溶解后,hplc鉴定纯度为98.2%。经maldi-tof质谱分析确认为预期产物,maldi-tof-ms:m/z=1037.37([m+h]+),[c48h58f2n10o12s]+理论值为1037.11。
实施例2hfapi和hpfapi冻干标记试剂盒的制备
(1)hfapi试剂盒制备
称取1mghfapi,溶于1ml75%乙醇的水溶液,浓度为1μg/μl;接着配制含25μg(25μl)hfapi、2.0mgtricine、3.0mgtppts、29.55mg琥珀酸和17.0mg氢氧化钠的混合液1ml,经0.22μm滤膜过滤后,加入到10ml无菌西林瓶中,将混合液冷冻干燥后密封压盖后即得到1支可用于99mtc标记的冻干试剂盒。
(2)hpfapi的试剂盒制备
称取1mghpfapi,溶于1ml75%乙醇的水溶液,浓度为1μg/μl;接着配制含25μg(25μl)hfapi、2.0mgtricine、3.0mgtppts、29.55mg琥珀酸和17.0mg氢氧化钠的混合液1ml,经0.22μm滤膜过滤后,加入到10ml无菌西林瓶中,将混合液冷冻干燥后密封压盖后即得到1支可用于99mtc标记的冻干试剂盒。
实施例399mtc-hfapi和99mtc-hpfapi的制备与质控
标记物的放射化学纯度(radiochemicalpurity,rcp)的测定使用hplc(配有raytestgabistar放射性检测器和agilent-35900e数模转换器)和ymc-packods-ac18分析柱(250×4.6mml.d.s-5μm,12nm),梯度淋洗20分钟,流速1ml/min,其中流动a相为去离子水(含0.05%tfa),流动b相为乙腈(含0.05%tfa)。淋洗梯度设定为起始时90%a和10%b,17.5min时60%a和40%b,20min时90%a和10%b。
(1)99mtc-hfapi的制备:
向hfapi冻干试剂盒(不开盖)中使用无菌注射器加入1mlna99mtco4溶液(~740mbq),99℃水浴反应15分钟,反应结束取出试剂盒冷却至室温,即得到放射性药物99mtc-hfapi,其结构如下所示。使用上述放射性hplc方法进行分析,结果如图3,99mtc-hfapi的放射化学纯度为大于98%。
(2)99mtc-hpfapi的制备:
向hpfapi冻干试剂盒(不开盖)中使用无菌注射器加入1mlna99mtco4溶液(~740mbq),99℃水浴反应15分钟,反应结束取出试剂盒冷却至室温,即得到放射性药物99mtc-hpfapi,其结构如下所示。使用上述放射性hplc方法进行分析,结果如图4,99mtc-hfapi的放射化学纯度为大于98%。
本发明上述实施例2先将包含三种配体hfapi、tricine、tppts以及琥珀酸/氢氧化钠溶液的混合物制备成冻干试剂盒。在进行肿瘤显像前,只需加入一定体积的na99mtco4洗脱液,水浴加热15分钟,即可制得本发明的99mtc标记配合物。上述制备只需要1步密封加液过程,中间不涉及放射性溶液的开放操作,因此极大地避免了对环境的放射性污染及环境带给药物溶液的杂质或生物污染。而uwehaberkorn团队在2020年文献公开的标记方法却较为复杂,其先将na99mtco4洗脱液加入至制备羰基配合物的试剂盒,加热反应20分钟得到一个三羰基锝的中间体,随后再加入fapi配体化合物,用酸溶液和缓冲液调整ph值后,再加热20分钟才能得到其99mtc标记配合物。由此可见,本发明上述制备方法更为简便易得,尤其是冻干试剂盒可完全商品化,易于质控和批量化生产,符合药剂成药性规定。而现有技术的上述文献,需要先产生一个三羰基络合物的中间体并调整ph值后再加入配体溶液,过程复杂繁琐,杂质和污染不易控制,很难符合药剂商品化的规范和要求。而且,本领域技术人员可以理解,本发明显像剂的这一优势,完全是由本发明显像剂的组成、结构本身所带来的。
实施例4体外rhfap-α蛋白结合实验
(1)99mtc-hfapi与重组人fap-α蛋白(rhfap-α)的结合实验
将rhfap-α蛋白溶解于elisa包被缓冲液(1×)中(浓度为1μg/ml),每孔0.2μg/200μl包被于96孔板中,4℃过夜。包被结束后弃去包被液,使用pbs重复洗涤96孔板3~5次。加封闭液(5%小牛血清/pbs缓冲液,ph7.4)于96孔板中,放置于37℃孵育2小时。封闭结束后使用pbs重复洗涤96孔板3~5次。将制备好的99mtc-hpfapi分别加入包被有rhfap-α的样品孔之中,每孔加入0.4μci/200μl的放射性标记物,设置4个平行孔。另备4个样品孔加入等量的99mtc-hfapi,然后再加入1000倍摩尔量的hfapi,混匀。将96孔板在37℃条件下孵育1小时。另准备三个放免管,加入等量的放射性标记物99mtc-hfapi,留作标样。孵育完成后,倒掉孵育液,然后用pbs洗五遍,之后将液体弃去,用剪刀剪下每个样品孔,置于放免管中,用放射性γ-全自动计数仪测量每个孔中的放射性计数。之后通过公式计算出99mtc-hfapi与rhfap-α的结合百分率。实验结果如图5,99mtc-hfapi与rhfap-α结合的%ad值为4.4%(±0.2%);而在同等条件下的hfapiblock实验组其%ad值为0.95%(±0.02%),与binding组有显著性差异(p<0.0001)。实验结果说明99mtc-hfapi可以特异性结合rhfap-α蛋白。
(2)99mtc-hpfapi与重组人fap-α蛋白(rhfap-α)的结合实验
实验操作步骤同上。结果如图6所示,99mtc-hpfapi与rhfap-α结合的%ad值为4.3%(±0.2%);而在同等条件下的hpfapiblock实验组其%ad值为1.1%(±0.03%),与binding组有显著性差异(p<0.0001)。实验结果说明99mtc-hpfapi可以特异性结合rhfap-α蛋白。
实施例599mtc-hfapi和99mtc-hpfapi在荷瘤小鼠中的spect/ct显像
(1)99mtc-hfapi在u87mg荷瘤小鼠模型中的显像
将制备的99mtc-hfapi用生理盐水配制成37mbq/100μl后,每只小鼠经尾静脉注射100μl(37mbq),在注射后0.5、1、2和4小时进行spect/ct显像。封闭组小鼠在注射显像药物的同时注射100μl(500μg)的hfapi,并于给药后0.5小时进行显像。小鼠在显像过程中使用1.5%异氟烷-氧气进行麻醉。显像后对spect图像进行重建并与ct图像进行融合得到3d显像图,后位像(posteriorview)用于展示并且肿瘤位置用箭头标注。显像结果如图7所示。
(2)99mtc-hpfapi在u87mg荷瘤小鼠模型中的显像
将制备的99mtc-hpfapi用生理盐水配制成37mbq/100μl后,每只小鼠经尾静脉注射100μl(37mbq),在注射后0.5、1、2和4小时进行spect/ct显像。封闭组小鼠在注射显像药物的同时注射100μl(500μg)的hpfapi,并于给药后0.5小时进行显像。小鼠在显像过程中使用1.5%异氟烷-氧气进行麻醉。显像后对spect图像进行重建并与ct图像进行融合得到3d显像图,后位像(posteriorview)用于展示并且肿瘤位置用箭头标注。显像结果如图8所示。
显像图比较:uwehaberkorn团队在2020年文献中也公开了其最佳spect显像剂99mtc-fapi-34(见图9)在10分钟、0.5、1、2、4小时的spect平面显像。本发明的图7、图8分别是99mtc-hfapi、99mtc-hpfapi在0.5、1、2、4小时的spect/ct的3d显像图。图像中灰度值的高与低对应放射性药物在靶器官中浓聚量的多与少。
从二者的图像可明确对比得出如下结论:
99mtc-fapi-34的显像图中(m1及m2分别代表两只平行试验动物),小鼠身体最下方,接近尾巴处的大块斑点为膀胱位置,在大块斑点上方的两个小点代表肾脏位置,肿瘤位置在上肢腋下(图像右侧)。从注射显像剂后的30-120分钟时间内,膀胱位置的放射性浓聚量始终最大,其次双肾部位显示也有较高的药物摄取,而肿瘤位置处摄取量一般。尽管药物随着时间延长,其在身体各个脏器中逐渐被清除,但是在10-60分钟,身体正常器官摄取依然较多,即本底较高,肿瘤/其他脏器摄取比值低。在120分钟虽然身体其他部位基本清除,但其肿瘤摄取也同样降低,肾脏始终显示较高的放射性浓聚。
而本发明的显像图中:箭头所指的斑块是肿瘤位置处,在小鼠身体下方的圆形斑块是膀胱位置处。99mtc-hfapi和99mtc-hpfapi在显像的30-240分钟内,只有肿瘤和膀胱位置始终清晰可见,这意味着本发明的显像剂在肿瘤处高代谢,且体内代谢是经尿液排出体外。此外,从30-240分钟的图像变化看,在这段时间内(包括注射时间较短的30min时),本发明的显像剂在身体其他正常脏摄取非常少,并且几乎看不到肾脏的放射性信号,这意味着本发明的显像剂具有很高的肿瘤/其他脏器摄取比,在肾脏和肝脏等重要大器官并没有明显摄取。0.5小时的封闭实验(block)显示,99mtc-hfapi和99mtc-hpfapi在肿瘤处的摄取均是特异性的,即肿瘤中fap-α受体与放射性药物的结合可以被相同靶点有活性的药物前体竞争取代。
由此可见,本发明的显像剂具有更优的肿瘤摄取、肿瘤/其他脏器摄取比以及更低的本底显像。这在实际应用中具有巨大优势。例如:(1)spect显像诊断对噪音非常敏感,本底低更有利于精准显像。(2)对于原发灶微小的医学诊断,更为准确和精确。(3)肿瘤/非肿瘤部位的高对比度,利于清晰显示病灶与临近组织的分界,对肿瘤靶区勾画更有利,使精确放疗做到有的放矢。
实施例699mtc-hfapi和99mtc-hpfapi在u87mg小鼠模型中的生物分布研究
(1)99mtc-hfapi在u87mg荷瘤小鼠模型中的生物分布
取20只u87mg荷瘤balb/c裸鼠(6周龄),随机分成5组,每组4只。将制备的99mtc-hfapi用生理盐水配制成370kbq/100μl后,每只小鼠经尾静脉注射100μl(370kbq),在注射后0.5、1、2和4小时将动物处死,取血液及主要脏器,称重并测量放射性cpm计数,经衰变校正后计算每克组织的百分注射剂量(%id/g)。生物分布结果表示为平均值±标准偏差(means±sd,n=4)。封闭组小鼠在注射药物的同时注射100μl(650μg)的hfapi,并于给药后1小时进行生物分布研究。
实验结果如图10所示,99mtc-hfapi在肿瘤中始终保持最高的摄取值,远高于全身主要脏器的药物代谢水平。离体的生物分布定量数据与活体显像半定量数据一致。肾脏、肝脏和肺的药物浓度与同时相血药浓度接近,说明药物在这些器官并无异常浓聚现象,提示99mtc-hfapi具有优良的体内稳定性和极佳的体内代谢特性。
(2)99mtc-hpfapi在u87mg荷瘤小鼠模型中的生物分布
取12只u87mg荷瘤balb/c裸鼠(6周龄),随机分成3组,每组4只。将制备的99mtc-hpfapi用生理盐水配制成370kbq/100μl后,每只小鼠经尾静脉注射100μl(370kbq),在注射后1和2小时将动物处死,取血液及主要脏器,称重并测量放射性cpm计数,经衰变校正后计算每克组织的百分注射剂量(%id/g)。生物分布结果表示为平均值±标准偏差(means±sd,n=4)。封闭组小鼠在注射药物的同时注射100μl(650μg)的hpfapi,并于给药后1小时进行生物分布研究。
实验结果如图11所示,99mtc-hpfapi与99mtc-hfapi具有相似的药代特性。
实施例799mtc-hfapi和99mtc-hpfapi的急性毒性实验
取21只昆明鼠(6周龄),随机分成3组,每组7只。其中两组分别经尾静脉注射99mtc-hfapi(每只37mbq/100μl)和99mtc-hpfapi(每只37mbq/100μl),另一组经尾静脉注射100μl生理盐水。将实验鼠置于无菌层流柜中,以spf级鼠饲料及高温灭菌水饲养。给药后每日监测小鼠的体重变化,并于给药前一天、给药后第1、3和6天测定小鼠血常规指标(红细胞数、血红蛋白、血小板、白细胞数、淋巴细胞数等),最后在给药后第7天用断颈法处死小鼠,观察主要器官如心、肺、肝、肾、肠有无异常。监测结果显示,与生理盐水对照组相比,两个实验组的各项指标均未显示出差异,说明未观察到明显的药物急性毒性。
实施例8乳腺癌患者的18f-fdg-pet和99mtc-hfapi-spect显像
1名47岁女性患者发现右乳肿物1个月后,行乳腺彩超提示右乳2:00低回声,birads4c类,右侧腋窝低回声,不除外异常肿大淋巴结。随后分别进行了18f-fdg-pet和99mtc-hfapi-spect的核医学显像,显像结果如图12所示。pet结果显示:右乳2:00方向及右侧腋窝见糖代谢异常增高影,同时脑部和肾脏摄取较高,膀胱中放射性的积累明显;心脏、肝脏、脾脏有轻度摄取;甲状腺、唾液腺、乳腺、肺等部位的本底较低。spect结果显示:右乳及右侧腋窝见放射性分布异常增高影;胆囊和膀胱中放射性积累明显;唾液腺、甲状腺、心脏、肝脏、肾脏有轻度摄取。而在脑部、乳腺、肺和腹部等部位的本底较低。最终手术病理证实右乳肿物为乳腺非特殊型浸润性癌ii级,伴随右腋窝淋巴结转移癌。99mtc-hfapi-spect在本病例中对乳腺癌原发灶及淋巴结转移灶的检测能力与18f-fdg-pet相当,同时显示出更低的脑和肾脏摄取。
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种具抗肿瘤活性的不对称双1‑取代5‑N杂靛红席夫碱类化合物的合成方法与制造工艺
- 一种具抗肿瘤活性的不对称双7‑N杂靛红席夫碱类化合物的合成方法与制造工艺
- 一种具抗肿瘤活性的不对称双取代靛红席夫碱类化合物及其合成方法与制造工艺
- 一种全人源抗MAGEA1的全分子IgG抗体及其应用
- 基于特异性单克隆或多克隆抗体建立的ny-eso-1抗原检测方法
- 一种规模化制备人前列腺癌pc-3细胞的方法
- 一种肿瘤抗原gpc3的ctl识别表位肽及其应用
- 一种<sup>18</sup>F标记的多肽化合物及其制备方法和应用
- 一种靶向Mesothelin的复制缺陷性重组慢病毒CAR-T转基因载体及其构建方法和应用
- 一种靶向cd123的复制缺陷性重组慢病毒car-t转基因载体及其构建方法和应用