蓝萼甲素在制备预防、治疗牙周病产品中的用途的制作方法
本发明涉及牙周病治疗产品领域,特别是涉及蓝萼甲素在制备预防、治疗牙周病产品中的用途。
背景技术:
牙周炎(periodontitis)是一种微生物相关的、宿主介导的、多因素参与并导致牙周附着丧失的炎症性疾病。药物治疗是一种牙周炎的辅助治疗方式,目前最常用于临床的药物主要是一些抗生素类药物,如:甲硝唑、阿莫西林等,它们主要通过抑制某些特定种类的细菌及细菌复合物发挥其辅助治疗的效果。但近些年来,抗生素耐药性问题已经被认为是全球健康的主要风险,而且相关研究人员已经从感染的牙髓组织和牙周组织中分离出多种耐药菌株,这表明口腔很可能作为耐药菌菌库,限制抗生素在治疗身体其他部位的感染性疾病中的有效性。与此同时,有研究表明基于天然化合物的治疗方法能有效抑制口腔中致病微生物的定植和生长,并且有的化合物还能够达到抑制口腔生物膜形成和减少口腔中成熟生物膜的作用,这些研究提示将天然化合物用于牙周炎治疗可能在不造成耐药性问题的基础之上达到有效控制牙周病发展的效果。因此有越来越多的牙周炎药物研究开始将目光聚焦于具有较高安全性以及广泛生物学活性的天然化合物。
蓝萼甲素(glaucocalyxina,gla)是从唇形科香茶菜属植物蓝萼香茶菜中分离并提取出来的一种天然化合物,属于对映-贝壳杉烷型二萜类化合物,具有抗氧化活性、抗肿瘤活性、抗凝血及抗血栓活性以及免疫活性。但目前尚无关于gla针对牙周致病菌的实验研究。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供蓝萼甲素在制备预防、治疗牙周病产品中的用途,用于解决现有技术中的问题。
为实现上述目的及其他相关目的,本发明第一方面提供蓝萼甲素在制备预防、治疗牙周病产品中的用途。
进一步的,所述牙周病包括牙龈病和牙周炎。
具体的,所述蓝萼甲素包括蓝萼甲素衍生物、从植物中提取的天然蓝萼甲素以及它们的可溶性盐。
具体的,所述预防、治疗牙周病产品为药物、保健品、食品。
进一步的,所述药物包括蓝萼甲素与药学上可接受的药物载体或辅料。
更进一步的,所述预防、治疗牙周病产品通过蓝萼甲素抑制牙龈卟啉单胞菌活性或杀灭牙龈卟啉单胞菌来预防、治疗牙周病。
具体的,所述抑制牙龈卟啉单胞菌活性包括抑制牙龈卟啉单胞菌生物膜的形成或抑制牙龈卟啉单胞菌生物膜的生物活性。
本发明第二方面提供蓝萼甲素在制备抑制牙龈卟啉单胞菌活性或杀灭牙龈卟啉单胞菌产品中的用途。
优选地,所述抑制牙龈卟啉单胞菌活性包括抑制牙龈卟啉单胞菌生物膜的形成或抑制牙龈卟啉单胞菌生物膜的生物活性。
优选地,所述蓝萼甲素包括蓝萼甲素衍生物、从植物中提取的天然蓝萼甲素以及它们的可溶性盐。
如上所述,本发明的蓝萼甲素在制备预防、治疗牙周病产品中的用途,具有以下有益效果:
1)能够有效抑制p.gingivalis的生长及其生物膜的形成和生物活性;可用于制备预防、治疗牙周病产品。
2)蓝萼甲素无耐药性问题。
附图说明
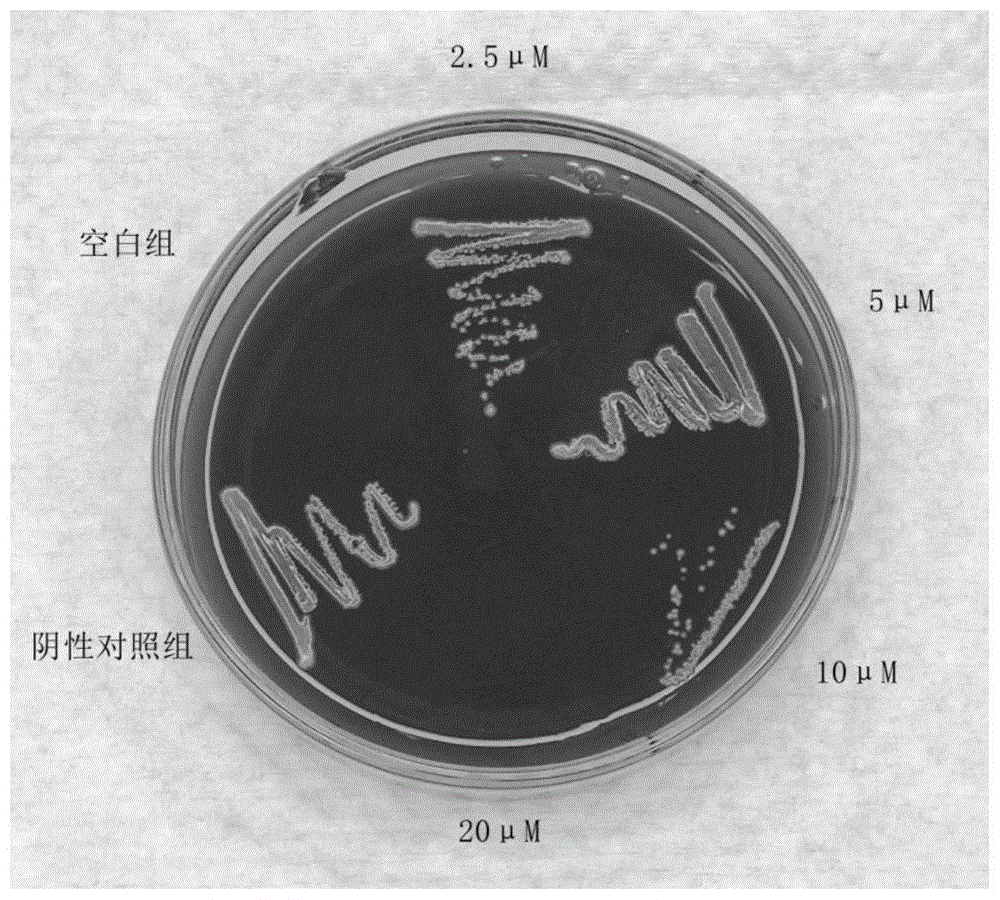
图1显示为本发明的不同浓度gla对p.gingivalis在bhi琼脂血平板上的生长情况的影响。
图2显示为本发明的结晶紫染色法检测不同浓度gla对p.gingivalis生物膜形成的影响,其中,1为阴性对照组,2、3、4、5均为实验组,分别代表浓度为0.625μm、1.25μm、2.5μm、5μm;与阴性对照组相比,**p<0.01,****p<0.0001;1.25μm与0.625μm相比,+p<0.05;2.5μm与5μm相比,####p<0.0001。
图3显示为mtt法检测不同浓度gla对p.gingivalis生物膜生物活性的影响,其中,1为阴性对照组,2、3、4、5均为实验组,分别代表浓度为0.625μm、1.25μm、2.5μm、5μm;与阴性对照组相比,**p<0.01,****p<0.0001;0.625μm与1.25μm相比,+p<0.05;1.25μm与2.5μm相比,&p<0.05;2.5μm与5μm相比,####p<0.0001。
具体实施方式
本发明第一方面提供蓝萼甲素在制备预防、治疗牙周病产品中的用途。
所述牙周病是指发生在牙周支持组织(包括牙龈、牙周膜、牙槽骨和牙骨质)的各种疾病。牙周病包括牙龈病和牙周炎。
较佳的,所述用途为蓝萼甲素在制备预防、治疗牙周炎产品中的用途。
所述牙周炎为一种微生物相关的、宿主介导的、多因素参与并导致牙周附着丧失的炎症性疾病。
具体的,按照2018年牙周病和植体周病国际新分类,牙周炎包括坏死性牙周病、反映全身疾病的牙周炎以及各期各级牙周炎。其中,各期各级牙周炎分期包括四期分别为:i期、ii期、iii期、iv期,分级包括三级分别为:慢速进展、中速进展和快速进展。
所述蓝萼甲素包括蓝萼甲素衍生物、从植物中提取的天然蓝萼甲素以及它们的可溶性盐。
所述蓝萼甲素衍生物为保留药效基团α,β-不饱和环戊酮的前提下,对其他基团例如环外双键进行结构修饰形成的。所述蓝萼甲素衍生物可以为蓝萼甲素芳胺类衍生物。
所述蓝萼甲素衍生物或天然蓝萼甲素的可溶性盐为蓝萼甲素衍生物或天然蓝萼甲素与酸发生成盐反应获得的。
所述产品可以为单成分物质,亦可为多成分物质。
所述预防、治疗牙周病产品为药物、保健品、食品。
进一步的,所述药物包括蓝萼甲素与药学上可接受的药物载体或辅料。
“药学上可接受的”是指当分子本体和组合物适当地给予动物或人时,它们不会产生不利的、过敏的或其它不良反应。
更进一步的,所述药学上可接受的药物载体包含肠溶衣制剂、胶囊、微球/囊、脂质体、微乳液、复乳液、纳米颗粒、磁颗粒、明胶或凝胶中的一种或一种以上。
更进一步的,药学上可接受的辅料应当与所述有效成分相容,即能与其共混而不会在通常情况下大幅度降低药物的效果。可作为药学上可接受的载体或辅料的一些物质的具体例子是糖类,如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和土豆淀粉;纤维素及其衍生物,如甲基纤维素钠、乙基纤维素和甲基纤维素;西黄蓍胶粉末;麦芽;明胶;滑石;固体润滑剂,如硬脂酸和硬脂酸镁;硫酸钙;植物油,如花生油、棉籽油、芝麻油、橄榄油、玉米油和可可油;多元醇,如丙二醇、甘油、山梨糖醇、甘露糖醇和聚乙二醇;海藻酸;乳化剂,如tween;润湿剂,如月桂基硫酸钠;着色剂;调味剂;压片剂、稳定剂;抗氧化剂;防腐剂;无热原水;等渗盐溶液;和磷酸盐缓冲液等。这些物质根据需要用于帮助配方的稳定性或有助于提高活性或它的生物有效性或在口服的情况下产生可接受的口感或气味。
本发明中,除非特别说明,药物剂型并无特别限定,可以被制成针剂、口服液、片剂、胶囊、滴丸、喷剂、吸入剂等剂型,可通过常规方法进行制备。药物剂型的选择应与给药方式相匹配。
更进一步的,所述预防、治疗牙周病产品通过蓝萼甲素抑制牙龈卟啉单胞菌活性或杀灭牙龈卟啉单胞菌来预防、治疗牙周病。
具体的,所述抑制牙龈卟啉单胞菌活性包括抑制牙龈卟啉单胞菌生物膜的形成或抑制牙龈卟啉单胞菌生物膜的生物活性。
牙龈卟啉单胞菌(porphyromonasgingivalis,p.gingivalis)是牙周病、尤其是慢性牙周炎病变区或活动部位最主要的优势菌,相关研究显示p.gingivalis在慢性牙周炎患者龈下菌斑中的检出率高达85.75%。p.gingivalis能从龈沟或牙周袋内的上皮细胞侵入宿主的牙周组织中,释放各种毒素,诱导宿主产生一系列炎症反应。毒素的作用加之机体自身的免疫炎症反应将导致宿主牙周支持组织的吸收和破坏,最终使得牙齿松动、脱落。除此之外,p.gingivalis还能够逃避宿主的免疫防御,这一特点使得由p.gingivalis所导致的牙周组织的感染和破坏更难得到有效抑制。也正因为如此,在与牙周炎相关的体外抑菌实验中常将p.gingivalis作为实验对象来观察和研究不同处理方式对牙周致病菌的作用。
本发明第二方面提供蓝萼甲素在制备抑制牙龈卟啉单胞菌活性或杀灭牙龈卟啉单胞菌产品中的用途。
具体的,所述抑制牙龈卟啉单胞菌活性包括抑制牙龈卟啉单胞菌生物膜的形成或抑制牙龈卟啉单胞菌生物膜的生物活性。
所述蓝萼甲素包括蓝萼甲素衍生物、从植物中提取的天然蓝萼甲素以及它们的可溶性盐。
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
实施例所用的材料来源:蓝萼甲素溶液(上海艾济生物科技有限公司,中国),p.gingivalis(atcc33277),脑心浸液(bhi)培养基(bd,美国),厌氧培养箱(baker,英国),酶标仪(biotekepoch2,美国),结晶紫染料(sigma,美国),mtt试剂盒(碧云天,中国)
实施例1gla对p.gingivalis的药物敏感性实验
将p.gingivalis作为实验对象来观察和研究不同处理方式对牙周致病菌的作用。取冻存的p.gingivalisatcc33277菌株于超净台中常规接种复苏。复苏成功后取适量菌液以四区划线法均匀涂布于bhi琼脂平板上,将平板倒置放入37℃恒温厌氧箱中厌氧培养72h形成形态均一的黑色菌落。挑取部分菌落进行革兰氏染色,并在光学显微镜下根据p.gingivalis的形态学特点对复苏的菌株进行鉴定,鉴定无误后,挑取菌落接种至bhi液体培养基中进行增菌培养。
取培养至对数生长期的p.gingivalis,再次用bhi培养基将菌液浓度调整至约2.0×107cfu/ml,备用。
实验组为用bhi培养基稀释好的gla与备用的菌液各100μl加入96孔板中混合,使其中gla的终浓度分别为:10μm、5μm、2.5μm、1.25μm,菌液的终浓度为1.0×107cfu/ml。另外还设置gla加bhi培养基以及单纯的bhi培养基作为空白组用于调零。每组至少设置三副孔。
将上述配置好的孔板放入37℃恒温厌氧箱中厌氧培养48h后,用酶标仪读取各组在600nm波长时的光密度值,用各组的od600减去对应空白组的od600得到实验组和对照组的准确od600值。其中,将od600<0.05所对应的最小浓度定为gla对p.gingivalis的最小抑菌浓度(minimuminhibitoryconcentration,mic)。
取适量浓度在mic值左右的孔内的菌液涂布于bhi琼脂血平板上,将平板倒置放入37℃恒温厌氧箱中厌氧培养48h,将观察到菌落数量为0的最小浓度定为gla对p.gingivalis的最小杀菌浓度(minimalbactericidalconcentration,mbc)。
如表1所示,当gla浓度达到5μm时,其所对应的od600=0.024±0.008,是od600<0.05所对应的最小浓度,故gla对p.gingivalis的mic为5μm。当gla浓度达到1/2mic即2.5μm时,与阴性对照组相比p.gingivalis细菌悬液的生长已受到显著的抑制效果(p<0.05)。
表1不同浓度gla对p.gingivalis细菌悬浮液od值的影响
注:与阴性对照组比较,*p<0.05
如图1所示,当gla浓度为2.5μm和5μm时,p.gingivalis在bhi琼脂血平板上的生长情况与阴性对照组无明显差异。当gla浓度为10μm时,与阴性对照组相比p.gingivalis的生长受到显著抑制,只在划线的起始部分观察到明显的成群的菌落,随着划线往后菌落数量也随之减少,并且菌落密度也越来越低,甚至在划线的末端已未见有明显的黑色菌落形成。当gla的浓度达到20μm时,bhi琼脂血平板上的该区域内未见有p.gingivalis菌落生长和形成,菌落数为0,故gla对p.gingivalis的mbc为20μm,为mic值的4倍。
实施例2gla对p.gingivalis生物膜的影响
实验组按照gla终浓度分为:0.625μm、1.25μm、2.5μm、5μm,阴性对照组培养基中不加入gla,具体处理过程同上述药物敏感性实验。将配置好的96孔板放入37℃恒温厌氧箱中厌氧培养48h后取出,将孔板内多余液体弃去,用pbs轻轻冲洗三次,注意冲洗过程尽量小心轻柔不要破坏生物膜的完整性。然后往孔板内加入甲醇固定生物膜15min,弃甲醇待96孔板干燥后,往每孔中加入0.4%的结晶紫(crystalviolet,cv)溶液染色15min,弃染料,将多余染料冲洗干净,待96孔板充分干燥后,每孔加入100μl95%乙醇溶液,盖上盖板轻轻震荡1h,最后用酶标仪在波长550nm处读取od值。
如图2所示,当gla浓度为0.625μm时,对p.gingivalis生物膜的形成无影响(p>0.05)。当浓度达到1.25μm时,gla对p.gingivalis生物膜的形成具有显著抑制作用(p<0.01),与阴性对照组相比能够抑制14%p.gingivalis生物膜的形成,而2.5μmgla能抑制25%p.gingivalis生物膜的形成。gla浓度达到5μm时,其对p.gingivalis生物膜形成的抑制率进一步升高,达到76%。此外,2.5μm组与1.25μm组相比差异无统计学意义(p>0.05),而5μm组与2.5μm组相比差异存在显著的统计学意义(p<0.0001),这表明5μm的gla对p.gingivalis生物膜形成的抑制效果显著大于2.5μmgla。
实施例3gla对p.gingivalis生物膜生物活性的影响
分组及处理同实施例2,将配置好的96孔板放入37℃恒温厌氧箱中厌氧培养48h后取出,将孔板内多余液体弃去,用pbs轻轻冲洗三次,然后往孔板内加入0.5%mtt50μl,厌氧避光孵育4h后弃去孔内液体,加入100μldmso进行溶解,轻轻震荡10min后用酶标仪在波长490nm处读取od值。
从图3可见,当gla的浓度小于1.25μm时,其对p.gingivalis生物膜的生物活性无显著抑制作用(p>0.05)。当浓度达到1.25μm时,p.gingivalis生物膜生物活性开始受到抑制(p<0.01),此时有20%生物膜活性受到抑制;当gla的浓度上升到2.5μm时,gla对p.gingivalis生物膜生物活性的抑制率为38%;5μm时抑制率已经达到74%,与阴性对照组相比能显著地抑制p.gingivalis生物膜的生物活性(p<0.0001)。不同浓度的实验组之间的差异均存在统计学意义(p<0.05),说明gla对p.gingivalis生物膜的生物学活性的抑制作用呈浓度依赖性,抑制作用从1.25μm开始随着gla浓度的升高而不断增强。
本申请中使用graphpadprism6.0软件对实验数据进行统计学分析。定量资料采用均数标准差
本申请通过观察gla对p.gingivalis的生长及其生物膜的形成(图2)和生物活性(图3)的影响,初步探究gla作为一种抗菌药物用于辅助治疗牙周炎的可行性,为牙周炎辅助治疗药物的研发工作带来新思路。
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!