一种促进神经元轴突再生的药物组合物及其应用的制作方法
本发明属于医药技术领域。更具体地,涉及一种促进神经元轴突再生的药物组合物及其应用。
背景技术:
缺血性脑中风是一类常见的脑血管疾病,80%的中风都属于缺血性脑中风,致死率、致残率和复发率极高。中风发病突然,病情缓和之后,患者多出现偏瘫、口眼歪斜等中风后遗症,严重者生活不能自理,给患者及家庭带来严重的负担。
脑梗塞使得神经元受到巨大损伤,而且在神经元损伤的几小时后即可观察到轴突反应,包括线粒体聚集、轴突轴浆凝聚、轴突破碎溶解和髓鞘轮廓失常等。在正常生理情况下,轴突负责传递神经冲动,中枢系统得以维持正常的神经功能。轴突损伤导致神经元之间、皮质和皮质以下的中枢之间信号传递异常,神经细胞间建立的联系中断,所以缺血性脑中风患者多出现肢体、语言和认知功能失常等中风后遗症。因此,促进缺血性脑损伤后神经元轴突的生长,在梗死灶周围建立新的神经网络,有利于缺血性脑中风后神经康复。但是目前国内外尚未发现对中风及中风后遗症较好的治疗药物。
现有治疗缺血性脑中风的药物能够促进中风后血液循环,抑制血小板聚集,产生溶栓作用,但是溶栓药物在缺血性脑中风后3个小时内治疗效果最佳,而且中风后溶栓会引起脑部出血,增加中风的风险。公开号为cn107115336a的中国专利提供了一种组合物,通过组分之间的协同作用,能够有效地对抗缺血再灌注引起的脑损伤,为临床提供治疗缺血性脑中风的新选择。现有治疗缺血性脑中风的药物能够减少脑组织炎症损伤、氧化应激损伤,但是缺血性脑中风的临床表现多为神经功能失常,其恢复最根本的是神经功能的恢复,脑损伤减轻并不意味着损伤的神经元间能建立联系,即不一定能帮助中风后神经功能的康复,因此脑损伤的减轻与神经功能的康复无法等同,脑中风的恢复最根本在于神经功能的恢复,轴突再生延长在神经功能的康复过程中起至关重要的作用,促进缺血性脑损伤后神经元轴突的生长,在梗死灶周围建立新的神经网络,有利于缺血性脑中风后神经康复。因此,亟待开发一种可以促进缺血性脑中风后神经元轴突再生的中药制剂。
技术实现要素:
针对目前治疗缺血性脑中风的药物在神经功能的恢复方面存在的不足,本发明旨在提供一种促进神经元轴突再生的药物组合物及其应用。
本发明的首要目的是提供一种促进神经元轴突再生的药物组合物。
本发明的另一目的是提供上述组合物在制备促进神经元轴突再生制剂中的应用。
本发明的另一目的是提供上述组合物在制备减少神经元轴突变性制剂中的应用。
本发明的另一目的是提供上述组合物在制备减少神经元损伤制剂中的应用。
本发明的另一目的是提供上述组合物在制备减轻脑梗死制剂中的应用。
本发明的另一目的是提供上述组合物在制备减轻脑水肿制剂中的应用。
本发明的另一目的是提供上述组合物在制备促进神经功能康复制剂中的应用。
本发明的再一目的是提供神经元轴突再生制剂在制备促进缺血性脑中风康复药物中的应用。
本发明上述目的通过以下技术方案实现:
本发明提供了一种神经元轴突再生的药物组合物,所述组合物由质量比为1~4:2~8的毛蕊异黄酮苷和芍药苷组成。
通过对毛蕊异黄酮苷(cg)和芍药苷(pf)进行合理的复配使用,得到的药物组合物充分发挥了有效成分的优势,能够显著减轻缺血性脑中风大鼠的脑梗死和脑水肿程度,修复损伤的脑组织,减少神经元凋亡提高受损神经元的存活率,减少神经元轴突变性并促进轴突再生、延长和再髓鞘化,在体促进损伤的神经元之间建立联系,有效促进中风后神经功能的恢复,且本发明中的药物组合简单有效,无其他组分的干扰,便于开发临床应用的各种有效制剂。
作为一种优选地可实施方式,所述组合物由质量比为1:2或2:1的毛蕊异黄酮苷和芍药苷组成。
上述毛蕊异黄酮苷和芍药苷可以市购现成的原料,也可自行制备。
本发明通过构建缺血性脑中风模型,对大鼠脑切片进行脑干湿比测定、ttc染色、尼氏染色和改良银染色,结果表明本发明能减轻缺血性脑中风大鼠的脑水肿和脑梗死程度,提高受损神经元的存活率,减少神经元轴突变性并促进轴突再生延长。
因此,上述药物组合物在制备促进神经元轴突再生制剂中的应用,在制备减少神经元轴突变性制剂中的应用,在制备减少神经元损伤制剂中的应用也在本发明的保护范围内。
优选地,所述神经元为皮层神经元。
此外,述组合物在制备促进神经功能康复制剂中的应用,在制备减轻脑梗死制剂中的应用,以及在制备减轻脑水肿制剂中的应用都应在本发明的范围内。
本发明的药物组合物是通过诱导缺血性脑中风后神经元轴突的再生以帮助神经功能恢复,从而促进缺血性脑中风患者的康复。因此,本发明还请求保护上述任一所述神经元轴突再生的药物组合物在制备促进缺血性脑中风康复药物中的应用。
本发明具有以下有益效果:
本发明将毛蕊异黄酮苷与芍药苷以特定的配比组合联用,得到的药物组合物充分发挥了有效成分的优势,能够修复损伤的脑组织,减少神经元凋亡和轴突变性,促进轴突再生、延长和再髓鞘化,从而促进患者神经功能的恢复;同时能够减轻缺血性脑中风大鼠的脑梗死和脑水肿程度,减少脑损伤,提高受损神经元的存活率,减少神经元轴突变性并促进轴突再生延长,有效促进中风后神经功能的康复,且本发明中的药物组合简单有效,无其他组分的干扰,便于开发临床应用的各种有效制剂和新剂型的研究。
附图说明
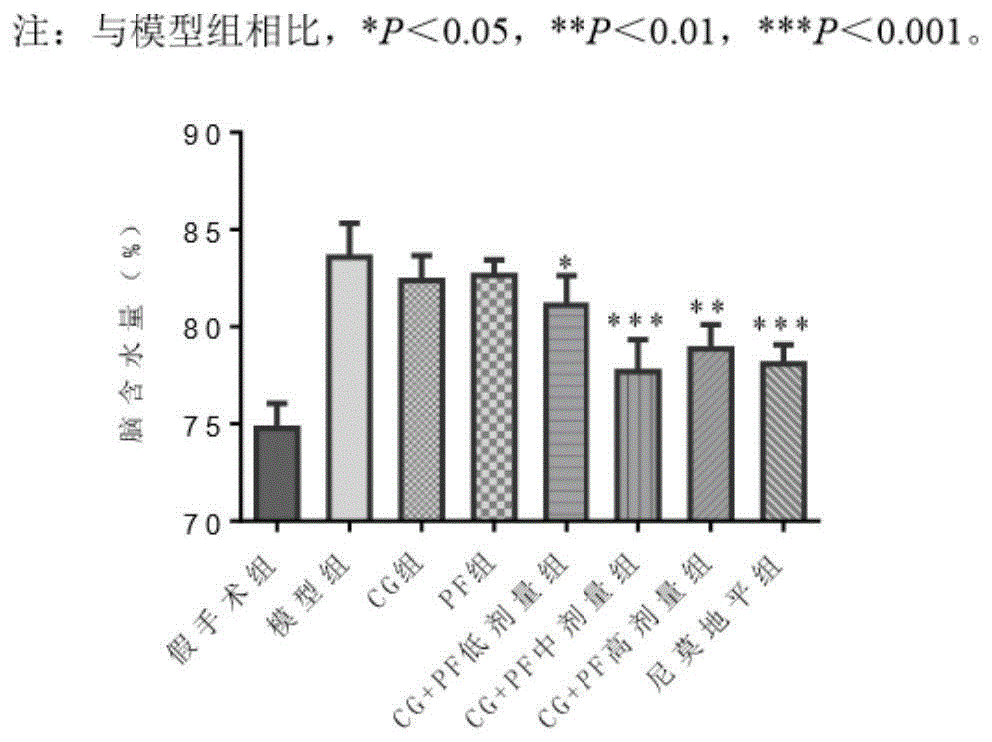
图1是不同组别大鼠脑含水量统计图;
图2是不同给药组对脑梗死情况的影响ttc染色图;
图3是不同给药组对脑梗死情况的影响脑梗死率统计图;
图4是不同组别大鼠缺血侧nf-200,map2和gap43免疫荧光图(比例尺=40μm);
图5是不同组别大鼠缺血侧(a)nf-200,(b)map2和(c)gap43平均荧光密度统计图;
图6是不同组别大鼠缺血侧皮层改良银染色图;
图7是不同组别大鼠缺血侧皮层和海马尼氏染色图(比例尺=50μm);
图8是不同组别大鼠缺血侧皮层和海马神经元数量统计图;
图9是不同组别大鼠mnss评分统计图;
图10是不同组别大鼠平衡木评分统计图;
图11是毛蕊异黄酮苷、芍药苷2:1脑组织含水量检测结果;
图12是毛蕊异黄酮苷、芍药苷2:1脑梗死体积检测结果;
图13是毛蕊异黄酮苷、芍药苷2:1zea-longa级标准评分结果。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
1、实验动物
sd大鼠,雄性,250~280g,spf级,购于广州中医药大学实验动物中心,生产许可证号:scxk(粤)2008-0020。饲养于广州中医药大学实验动物中心,使用许可证号:syxk(粤)2018-0001。
(1)行为学评分方法
改良神经功能评分:对各组大鼠进行自发活动,四肢运动的协调性,前肢协调性,攀爬,刺激躯体反应,以及触须反应6个方面进行评分。最后的分数是6项评价项目的总分,最高分18分,最低分3分,分数越低表示神经功能损伤越重。评分标准见表1所示。
表1mnss神经功能评分标准
(2)平衡木实验方法
将80cm长,1.5cm宽的长木板放置于软平台上方15cm,造模前把大鼠放在木条上面,每天训练使其能顺利通过木条。造模后每天使用6分评分法进行评分,评分标准见表2,分数越高表示伤害越严重。
表2平衡木实验评分标准
实施例1脑水肿实验
1、实验方法
(1)实验动物分组
模型组:麻醉大鼠后,将大鼠固定在37℃恒温电热板上。用剪刀在大鼠颈部正中开一个约2cm的小口,用止血钳钝性分离颈部肌肉,依次暴露大鼠左侧颈总动脉、颈外动脉和颈内动脉,并用缝合线结扎颈总动脉和颈外动脉。随后用止血夹夹闭颈内动脉,在颈总动脉远心端开一个小口,将线栓沿着颈总动脉插入颈内动脉,直至2cm的标记到达颈总动脉的分叉口,关闭术野,阻断大脑中动脉的血流。缺血两小时后,取出鱼线恢复左脑半球供血,并肌肉注射青霉素25万单位预防感染。按1ml/100g给予大鼠0.5%cmc-na溶液。
假手术组:麻醉大鼠后,将大鼠固定在37℃恒温电热板上。用剪刀在大鼠颈部正中开一个约2cm的小口,用止血钳钝性分离颈部肌肉,依次暴露大鼠左侧颈总动脉、颈外动脉和颈内动脉,关闭术野,并肌肉注射青霉素25万单位预防感染。按1ml/kg给予大鼠0.5%cmc-na溶液。
毛蕊异黄酮苷组(cg):麻醉大鼠后,将大鼠固定在37℃恒温电热板上。用剪刀在大鼠颈部正中开一个约2cm的小口,用止血钳钝性分离颈部肌肉,依次暴露大鼠左侧颈总动脉、颈外动脉和颈内动脉,并用缝合线结扎颈总动脉和颈外动脉。随后用止血夹夹闭颈内动脉,在颈总动脉远心端开一个小口,将线栓沿着颈总动脉插入颈内动脉,直至2cm的标记到达颈总动脉的分叉口,关闭术野,阻断大脑中动脉的血流。缺血两小时后,取出鱼线恢复左脑半球供血,并肌肉注射青霉素25万单位预防感染。给药剂量20mg/kg,连续给药七天。
芍药苷组(pf):麻醉大鼠后,将大鼠固定在37℃恒温电热板上。用剪刀在大鼠颈部正中开一个约2cm的小口,用止血钳钝性分离颈部肌肉,依次暴露大鼠左侧颈总动脉、颈外动脉和颈内动脉,并用缝合线结扎颈总动脉和颈外动脉。随后用止血夹夹闭颈内动脉,在颈总动脉远心端开一个小口,将线栓沿着颈总动脉插入颈内动脉,直至2cm的标记到达颈总动脉的分叉口,关闭术野,阻断大脑中动脉的血流。缺血两小时后,取出鱼线恢复左脑半球供血,并肌肉注射青霉素25万单位预防感染。给药剂量40mg/kg,连续给药七天。
cg+pf低剂量组:麻醉大鼠后,将大鼠固定在37℃恒温电热板上。用剪刀在大鼠颈部正中开一个约2cm的小口,用止血钳钝性分离颈部肌肉,依次暴露大鼠左侧颈总动脉、颈外动脉和颈内动脉,并用缝合线结扎颈总动脉和颈外动脉。随后用止血夹夹闭颈内动脉,在颈总动脉远心端开一个小口,将线栓沿着颈总动脉插入颈内动脉,直至2cm的标记到达颈总动脉的分叉口,关闭术野,阻断大脑中动脉的血流。缺血两小时后,取出鱼线恢复左脑半球供血,并肌肉注射青霉素25万单位预防感染。给药剂量10mg/kgcg+20mg/kgpf,连续给药七天。
cg+pf中剂量组:麻醉大鼠后,将大鼠固定在37℃恒温电热板上。用剪刀在大鼠颈部正中开一个约2cm的小口,用止血钳钝性分离颈部肌肉,依次暴露大鼠左侧颈总动脉、颈外动脉和颈内动脉,并用缝合线结扎颈总动脉和颈外动脉。随后用止血夹夹闭颈内动脉,在颈总动脉远心端开一个小口,将线栓沿着颈总动脉插入颈内动脉,直至2cm的标记到达颈总动脉的分叉口,关闭术野,阻断大脑中动脉的血流。缺血两小时后,取出鱼线恢复左脑半球供血,并肌肉注射青霉素25万单位预防感染。给药剂量20mg/kgcg+40mg/kgpf,连续给药七天。
cg+pf高剂量组:麻醉大鼠后,将大鼠固定在37℃恒温电热板上。用剪刀在大鼠颈部正中开一个约2cm的小口,用止血钳钝性分离颈部肌肉,依次暴露大鼠左侧颈总动脉、颈外动脉和颈内动脉,并用缝合线结扎颈总动脉和颈外动脉。随后用止血夹夹闭颈内动脉,在颈总动脉远心端开一个小口,将线栓沿着颈总动脉插入颈内动脉,直至2cm的标记到达颈总动脉的分叉口,关闭术野,阻断大脑中动脉的血流。缺血两小时后,取出鱼线恢复左脑半球供血,并肌肉注射青霉素25万单位预防感染。给药剂量40mg/kgcg+80mg/kgpf,连续给药七天。
尼莫地平组:麻醉大鼠后,将大鼠固定在37℃恒温电热板上。用剪刀在大鼠颈部正中开一个约2cm的小口,用止血钳钝性分离颈部肌肉,依次暴露大鼠左侧颈总动脉、颈外动脉和颈内动脉,并用缝合线结扎颈总动脉和颈外动脉。随后用止血夹夹闭颈内动脉,在颈总动脉远心端开一个小口,将线栓沿着颈总动脉插入颈内动脉,直至2cm的标记到达颈总动脉的分叉口,关闭术野,阻断大脑中动脉的血流。缺血两小时后,取出鱼线恢复左脑半球供血,并肌肉注射青霉素25万单位预防感染。给药剂量20mg/kg,连续给药七天。
(2)通过测定大脑干湿比来分析脑组织的含水量:末次给药后,迅速断头取脑,作冠状切片,每片约3mm厚,立刻用电子天平称重,得到脑湿重。将脑片放在烘烤过的锡箔纸上,放入烘箱中102℃烘干12h,称重,得到脑干重。脑含水量计算公式如下:
脑含水量(%)=(湿重-干重)/湿重×100%。
1、实验结果
如图1所示,灌胃给药7天后,毛蕊异黄酮苷组和芍药苷组大鼠脑组织含水量与模型组相比无差异(p>0.05);毛蕊异黄酮苷和芍药苷联合给药低、中、高剂量均可明显降低脑含水量,以中剂量最为明显(***p<0.001),为78.86%±1.25%,但中、高剂量相比无统计学差异(p>0.05),说明两个剂量效果相当,可减缺血性脑中风后脑水肿程度。
实施例2脑梗死实验
1、实验方法
(1)实验动物分组同实施例1。
(2)制备缺血性脑中风模型七天后取出组织,用冰冷的生理盐水洗去血液,置于-20℃冰箱中冰冻30min,切成2mm厚的冠状切片,放入2%ttc溶液中,在37℃水浴下染色30min,每隔5min翻动一次。因ttc在光照下不稳定,整个染色过程需要避光。染色完成后用pbs漂洗脑片3次,用4%多聚甲醛固定后拍照。用imageproplus6.0图像分析软件测量红色和白色区域面积,计算梗死体积比。脑梗死率计算公式如下:
脑梗死率(%)=(缺血对侧半球体积-缺血侧非梗死体积)/缺血对侧半球体积。
2、实验结果
如图2和3所示,和假手术组相比,模型组出现明显的白色梗死区域;和模型组相比,毛蕊异黄酮苷和芍药苷单独给药都不能降低脑梗死体积(p>0.05);毛蕊异黄酮苷+芍药苷的低、中、高剂量组白色区域减少,梗死率明显降低(***p<0.001),其中中剂量给药组梗死率下降到15.63%±1.63%。
实施例3神经元轴突再生实验
1、实验方法
(1)实验动物分组同实施例1。
(2)取出冰冻切片,室温复温至切片干燥。用蒸馏水洗切片3次,每次5min,甩干。室温下用0.3%triton-x100溶液透膜30min。加入10%山羊血清,室温孵育1h,以封闭抗原。甩干封闭液,滴加一抗(nf-200,1:50;map2,1:200;gap43,1:5000,一抗用pbs稀释),放入湿盒中,4℃冰箱中孵育过夜。取出切片,用pbst溶液洗涤3次,每次5min。甩干切片,滴加荧光二抗(fitc,1:250;fluor594,1:100,用pbs稀释),在湿盒中37℃温浴1h,此后的步骤全部需要避光操作。pbst浸洗切片3次,每次5min。甩干切片,滴加dapi(10μg/ml)复染核,避光孵育5min。pbst浸洗切片4次,每次5min。甩干切片,滴加抗荧光淬灭剂封片。
2、实验结果
nf-200是轴突伸长的标志物,因此可以反映损伤后神经元的形态;map2是神经元中的标志性微管相关蛋白,维持微管的组装并促进受损轴突的修复和再生;gap43是一种神经元特异性蛋白,参与神经元突触发育形成和神经细胞再生。如图4和5所示,在假手术组的脑组织切片中可明显看到nf-200、map2和gap43蛋白表达,在模型组中仅观察到少量荧光。与模型组相比,cg+pf低、中、高剂量组的nf-200表达均有所提高(***p<0.001);cg+pf中、高剂量组可提高map2(***p<0.001)和gap43(***p<0.001)的表达,但低剂量组对上调map2(p>0.05)和gap43(p>0.05)的表达没有明显作用。
实施例4神经元轴突变性实验
1、实验方法
(1)实验动物分组同实施例1。
(2)大鼠经心脏灌注后,制作冰冻切片。从-80℃冰箱中取出冰冻切片,室温复温,用蒸馏水洗3次,每次5min。放入硝酸银溶液中,在37℃下避光温浴30min。取出切片,用蒸馏水洗2次,每次3min。放入10%福尔马林溶液中10s,重复2次,甩掉多余的甲醛液。将切片浸润于银氨溶液中30s,甩干,放入10%福尔马林溶液中,每次1min,直至甲醛液不再变浑浊为止。用蒸馏水洗1次,甩干,放入氯金酸溶液中调色。用蒸馏水洗1次,甩干,放入硫代硫酸钠溶液中5min。用自来水洗1次,甩干,进行常规的脱水、透明步骤,用中性树胶封片。在显微镜下观察各组织大脑缺血侧皮层轴突变性情况。
2、实验结果
如图6所示,假手术组脑组织神经纤维被染成深褐色,呈丝状,有规律地排列;模型组组织疏松,失去明显的组织结构,并出现大量轴突回缩球和轴突肿胀。与模型组相比,毛蕊异黄酮苷+芍药苷给药中、高剂量组神经纤维排列较有规律,轴突回缩球和轴突肿胀减少,神经纤维变长,轴突变性损伤有所改善。
实施例5神经元损伤实验
1、实验方法
(1)实验动物分组同实施例1。
(2)大鼠经心脏灌注后,制作石蜡切片。石蜡切片经脱蜡处理后,放入尼氏染色液中染色10min。随后依次放入以下试剂:蒸馏水洗涤2次,每次15s;95%乙醇5s;70%乙醇5s。然后进行常规的脱水、透明、封片处理,显微镜下观察组织形态并拍照。
2、实验结果
如图7所示,假手术组脑组织神经元形态正常,有明显的圆形或椭圆形细胞核,细胞质中可见清晰的、深蓝色的、排列紧密的尼氏小体,没有发现间质水肿。模型组皮层和海马各区均发现大量神经元退化和坏死,排列紊乱;细胞体、核固缩,尼氏体溶解。毛蕊异黄酮苷和芍药苷组除海马ca3区外,其他脑区的神经元尼氏体轮廓依然不清。毛蕊异黄酮苷+芍药苷低、中、高剂量组和尼莫地平组各脑区尼氏体较模型组清晰,神经元损伤程度减轻。
如图8所示,对各组尼氏体数量进行统计,与模型组相比,毛蕊异黄酮苷和芍药苷单独使用均不能提高皮层和海马各区的神经元数量(p>0.05),毛蕊异黄酮苷+芍药苷低剂量组仅能提高ca1区的神经元数量(**p<0.01),毛蕊异黄酮苷+芍药苷中、高剂量组皮层和海马各区的神经元数量明显增加(***p<0.001),说明毛蕊异黄酮苷+芍药苷中、高剂量组可降低神经元死亡率,保护神经元,而中、高剂量间神经元数量无统计学差异(p>0.05),提示毛蕊异黄酮苷和芍药苷联用中、高剂量效果相当。
实施例6毛蕊异黄酮苷和芍药苷联用对大鼠神经功能的影响
1、实验动物分组同实施例1。
2、实验结果
(1)行为学评分
给药后每天对各组大鼠进行mnss评分,分数越高代表神经功能越好。假手术组的大鼠没有神经功能缺失。
如图9所示,第一天:模型组、毛蕊异黄酮苷和芍药苷单独给药组、联合用药组和阳性对照组的大鼠神经功能缺损严重,说明缺血再灌注处理给大鼠造成严重的神经功能损害(图a);第二天:与模型组相比,毛蕊异黄酮苷和芍药苷单独给药组、联合用药组和阳性对照组的大鼠神经功能均没有改善(p>0.05)(图b);第三天:与模型组相比,毛蕊异黄酮苷和芍药苷单独给药组、联合用药低剂量和高剂量组的大鼠神经功能均没有改善(p>0.05),联合用药中剂量能改善大鼠的神经功能缺损程度(*p<0.05)(图c)。第四、五、六、七天:与模型组相比,毛蕊异黄酮苷和芍药苷单独给药组、联合给药低剂量组的大鼠神经功能没有改善(p>0.05),联合用药中剂量(**p<0.01)和高剂量组(**p<0.01)的大鼠神经功能均有不同程度的恢复(图d-g)。
综合以上结果,毛蕊异黄酮苷和芍药苷单独给药均不能改善mcao大鼠的神经功能,毛蕊异黄酮苷和芍药苷联合中、高剂量给药三天后开始发挥促进神经功能恢复的作用,随着给药时间的增长神经功能改善越明显(图h),说明毛蕊异黄酮苷和芍药苷联合给药可促进缺血性脑中风损伤后神经功能康复,中、高剂量组药效无明显差别,提示毛蕊异黄酮苷和芍药苷联用达到治疗剂量后再增加剂量药效增加不明显。
(2)平衡木试验
平衡木实验可测试动物的运动整合和协调能力,分数越低代表神经功能越好。如图10所示,假手术组没有神经功能缺失。
第一到第四天:与模型组相比,毛蕊异黄酮苷组、芍药苷组、联合用药各组和阳性对照组的mcao大鼠运动能力缺失并没有改善(p>0.05,图10的a-d);第五天:与模型组相比,毛蕊异黄酮苷和芍药苷单独给药组、低剂量组大鼠的神经功能没有改善,中剂量组(*p<0.05)和高剂量组(**p<0.01)大鼠的运动功能均有不同程度的恢复,中、高剂量相比无统计学差异(p>0.05)(图10的e图)。第六天:与模型组相比,毛蕊异黄酮苷和芍药苷单独给药、联合用药低剂量不能改善大鼠的神经功能,中剂量组(*p<0.05)和高剂量组(**p<0.01)大鼠的运动功能均有改善,中、高剂量相比无统计学差异(p>0.05)(图10的f图)。第七天:与模型组相比,毛蕊异黄酮苷和芍药苷单独给药、联合给药低剂量不能改善大鼠的神经功能(p>0.05),联合给药中剂量(**p<0.01)和高剂量(**p<0.01)对运动功能的改善效果明显,但中、高剂量相比无统计学差异(p>0.05)(图10的g图)。综合以上结果,毛蕊异黄酮苷组、芍药苷组、毛蕊异黄酮苷+芍药苷低剂量组的大鼠运动功能没有恢复,毛蕊异黄酮苷和芍药苷联合用药中、高剂量可促进缺血性脑中风损伤后运动功能康复。
实施例7脑水肿实验
1、实验方法
(1)实验动物分组
模型组:麻醉大鼠后,将大鼠固定在37℃恒温电热板上。用剪刀在大鼠颈部正中开一个约2cm的小口,用止血钳钝性分离颈部肌肉,依次暴露大鼠左侧颈总动脉、颈外动脉和颈内动脉,并用缝合线结扎颈总动脉和颈外动脉。随后用止血夹夹闭颈内动脉,在颈总动脉远心端开一个小口,将线栓沿着颈总动脉插入颈内动脉,直至2cm的标记到达颈总动脉的分叉口,关闭术野,阻断大脑中动脉的血流。缺血两小时后,取出鱼线恢复左脑半球供血,并肌肉注射青霉素25万单位预防感染。按1ml/kg给予大鼠0.5%cmc-na溶液。
假手术组:麻醉大鼠后,将大鼠固定在37℃恒温电热板上。用剪刀在大鼠颈部正中开一个约2cm的小口,用止血钳钝性分离颈部肌肉,依次暴露大鼠左侧颈总动脉、颈外动脉和颈内动脉,关闭术野,并肌肉注射青霉素25万单位预防感染。按1ml/kg给予大鼠0.5%cmc-na溶液。
(cg)毛蕊异黄酮苷组:麻醉大鼠后,将大鼠固定在37℃恒温电热板上。用剪刀在大鼠颈部正中开一个约2cm的小口,用止血钳钝性分离颈部肌肉,依次暴露大鼠左侧颈总动脉、颈外动脉和颈内动脉,并用缝合线结扎颈总动脉和颈外动脉。随后用止血夹夹闭颈内动脉,在颈总动脉远心端开一个小口,将线栓沿着颈总动脉插入颈内动脉,直至2cm的标记到达颈总动脉的分叉口,关闭术野,阻断大脑中动脉的血流。缺血两小时后,取出鱼线恢复左脑半球供血,并肌肉注射青霉素25万单位预防感染。给药剂量20mg/kg,连续给药七天。
(pf)芍药苷组:麻醉大鼠后,将大鼠固定在37℃恒温电热板上。用剪刀在大鼠颈部正中开一个约2cm的小口,用止血钳钝性分离颈部肌肉,依次暴露大鼠左侧颈总动脉、颈外动脉和颈内动脉,并用缝合线结扎颈总动脉和颈外动脉。随后用止血夹夹闭颈内动脉,在颈总动脉远心端开一个小口,将线栓沿着颈总动脉插入颈内动脉,直至2cm的标记到达颈总动脉的分叉口,关闭术野,阻断大脑中动脉的血流。缺血两小时后,取出鱼线恢复左脑半球供血,并肌肉注射青霉素25万单位预防感染。给药剂量10mg/kg,连续给药七天。
cg+pf低剂量组:麻醉大鼠后,将大鼠固定在37℃恒温电热板上。用剪刀在大鼠颈部正中开一个约2cm的小口,用止血钳钝性分离颈部肌肉,依次暴露大鼠左侧颈总动脉、颈外动脉和颈内动脉,并用缝合线结扎颈总动脉和颈外动脉。随后用止血夹夹闭颈内动脉,在颈总动脉远心端开一个小口,将线栓沿着颈总动脉插入颈内动脉,直至2cm的标记到达颈总动脉的分叉口,关闭术野,阻断大脑中动脉的血流。缺血两小时后,取出鱼线恢复左脑半球供血,并肌肉注射青霉素25万单位预防感染。给药剂量10mg/kgcg+5mg/kgpf,连续给药七天。
cg+pf中剂量组:麻醉大鼠后,将大鼠固定在37℃恒温电热板上。用剪刀在大鼠颈部正中开一个约2cm的小口,用止血钳钝性分离颈部肌肉,依次暴露大鼠左侧颈总动脉、颈外动脉和颈内动脉,并用缝合线结扎颈总动脉和颈外动脉。随后用止血夹夹闭颈内动脉,在颈总动脉远心端开一个小口,将线栓沿着颈总动脉插入颈内动脉,直至2cm的标记到达颈总动脉的分叉口,关闭术野,阻断大脑中动脉的血流。缺血两小时后,取出鱼线恢复左脑半球供血,并肌肉注射青霉素25万单位预防感染。给药剂量20mg/kgcg+10mg/kgpf,连续给药七天。
cg+pf高剂量组:麻醉大鼠后,将大鼠固定在37℃恒温电热板上。用剪刀在大鼠颈部正中开一个约2cm的小口,用止血钳钝性分离颈部肌肉,依次暴露大鼠左侧颈总动脉、颈外动脉和颈内动脉,并用缝合线结扎颈总动脉和颈外动脉。随后用止血夹夹闭颈内动脉,在颈总动脉远心端开一个小口,将线栓沿着颈总动脉插入颈内动脉,直至2cm的标记到达颈总动脉的分叉口,关闭术野,阻断大脑中动脉的血流。缺血两小时后,取出鱼线恢复左脑半球供血,并肌肉注射青霉素25万单位预防感染。给药剂量30mg/kgcg+15mg/kgpf,连续给药七天。
尼莫地平组:麻醉大鼠后,将大鼠固定在37℃恒温电热板上。用剪刀在大鼠颈部正中开一个约2cm的小口,用止血钳钝性分离颈部肌肉,依次暴露大鼠左侧颈总动脉、颈外动脉和颈内动脉,并用缝合线结扎颈总动脉和颈外动脉。随后用止血夹夹闭颈内动脉,在颈总动脉远心端开一个小口,将线栓沿着颈总动脉插入颈内动脉,直至2cm的标记到达颈总动脉的分叉口,关闭术野,阻断大脑中动脉的血流。缺血两小时后,取出鱼线恢复左脑半球供血,并肌肉注射青霉素25万单位预防感染。给药剂量20mg/kg,连续给药七天。
(2)通过测定大脑干湿比来分析脑组织的含水量:末次给药后,迅速断头取脑,作冠状切片,每片约3mm厚,立刻用电子天平称重,得到脑湿重。将脑片放在烘烤过的锡箔纸上,放入烘箱中102℃烘干12h,称重,得到脑干重。脑含水量计算公式如下:
脑含水量(%)=(湿重-干重)/湿重×100%。
2、实验结果
如图11所示,与假手术组相比,模型组脑组织含水量显著增大(p<0.01);与模型组相比,亲和性成分低中高剂量组、芍药苷组、毛蕊异黄酮苷组以及尼莫地平组均能显著降低脑组织含水量(p<0.05,p<0.01);与中剂量组相比,芍药苷组和毛蕊异黄酮苷组对脑水肿的改善效果不如中剂量组(p<0.05)。以上结果显示,大鼠脑缺血再灌注后毛蕊异黄酮苷和芍药苷联用,能有效改善脑水肿;联合用药的中剂量治疗效果最佳,并且联合用药的效果优于单独用药。
实施例8脑梗死实验
1、实验方法
(1)实验动物分组同实施例7。
(2)制备缺血性脑中风模型七天后取出组织,用冰冷的生理盐水洗去血液,置于-20℃冰箱中冰冻30min,切成2mm厚的冠状切片,放入2%ttc溶液中,在37℃水浴下染色30min,每隔5min翻动一次。因ttc在光照下不稳定,整个染色过程需要避光。染色完成后用pbs漂洗脑片3次,用4%多聚甲醛固定后拍照。用imageproplus6.0图像分析软件测量红色和白色区域面积,计算梗死体积比。脑梗死率计算公式如下:
脑梗死率(%)=(缺血对侧半球体积-缺血侧非梗死体积)/缺血对侧半球体积。
2、实验结果
如图12所示,与假手术组相比,模型组损伤侧脑梗死体积显著增大(p<0.01),与模型组相比,亲和性成分中剂量组能显著降低脑梗死体积(p<0.01),抑制剂组显著增大脑梗死体积(p<0.01);与抑制剂组相比,抑制剂联合毛蕊异黄酮苷和芍药苷中剂量组显著降低脑梗死体积(p<0.01)。以上结果显示,大鼠脑缺血再灌注后联用毛蕊异黄酮苷和芍药苷,能有效降低脑梗死体积;给予抑制剂后,明显增大脑梗死体积。
实施例9神经行为学评分结果
1、实验方法
实验动物分组同实施例7。
2、实验结果
如图13所示,第1天时,与假手术组相比,模型组神经功能评分显著升高(p<0.01);第7天时,与假手术组相比,模型组显神经功能评分著升高(p<0.01);与模型组组相比,毛蕊异黄酮苷、芍药苷联用中剂量组以及尼莫地平组神经功能评分显著降低(中剂量p<0.01,尼莫地平p<0.05);与第1天相比,第7天毛蕊异黄酮苷、芍药苷联用中剂量组以及尼莫地平组神经功能评分显著降低(中剂量p<0.01,尼莫地平p<0.05);上述结果显示,大鼠脑缺血损伤再灌注时灌胃联用毛蕊异黄酮苷、芍药苷可以显著改善神经功能,联合用药的效果优于单独用药。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!