一种以五氧化二钒为核的复合纳米材料及应用的制作方法
[0001]
本发明属于生物医药领域,具体涉及一种以五氧化二钒为核的复合纳米材料的合成与应用
背景技术:
[0002]
光动力疗法(pdt)是一种重要的癌症治疗方法,它使用光和光敏剂来产生活性氧(ros)来特异性杀死癌细胞。它具有许多优点,例如,降低了系统毒性,降低了治疗抵抗力并具有最小的侵入性.而pdt的治疗需要消耗肿瘤组织中大量的氧气,因此其治疗效率高度依赖于肿瘤中的氧气含量。不幸的是,由于肿瘤脉管系统的缺乏和癌细胞的异常增殖,大多数肿瘤都是乏氧的,而由于直接耗氧和对肿瘤脉管系统的损害,pdt的过程又会进一步降低肿瘤部位的氧气浓度,导致显著的自我约束。pdt的这种自我约束对于分级光动力疗法的影响尤其明显。分级光动力治疗是指在肿瘤区域进行多次激光照射,因此由前一次的光动力治疗产生的肿瘤乏氧将极大地限制后续的光动力治疗的效率。为了改善pdt期间的肿瘤氧合作用,已经有很多方法被开发出来,例如直接将氧气输送到肿瘤组织中以及使用酶和其他催化剂在肿瘤区域内原位供氧。然而,这些方法所使用的材料多集中于单一改善肿瘤氧含量,如用于直接递氧的氟碳化合物以及用于催化肿瘤组织过氧化氢反应产生氧气的二氧化锰纳米催化剂。这种单一方式供氧能力很有限,而如果将供氧剂与pdt光敏剂联合使用,又会存在药物循环差异,以及药物代谢过快的问题,治疗效果非常有限。
技术实现要素:
[0003]
本发明针对现有技术下pdt的自我限制尤其是分级光动力治疗的自我限制的问题,以五氧化二钒作为产氧剂,并整合光敏剂、乏氧探针和肿瘤微环境调节剂形成复合纳米粒,发挥整体协同的治疗效果。
[0004]
本发明具体技术方案如下:
[0005]
一种复合纳米粒,以五氧化二钒纳米粒为核,以二氧化硅为壳,所述二氧化硅修饰有光敏剂、乏氧探针、肿瘤微环境调节剂中的一种或几种。
[0006]
优选的,所述光敏剂、乏氧探针或肿瘤微环境调节剂以硅氧烷基为连接臂与二氧化硅偶联。可利用光敏剂、乏氧探针或微环境调节剂或经衍生化后与活性基团封端的硅氧烷通过加成反应、酯化反应、缩合反应、置换反应中的一种或几种连接,,再与包覆五氧化二钒纳米粒的二氧化硅反应偶联。
[0007]
本发明可以根据现有技术根据反机理,利用光敏剂、乏氧探针或微环境调节剂自身的基团或将其衍生化,选择或设计具有和这些基团能够反应的活性基团封端的硅氧烷。例如,光敏剂、乏氧探针或微环境调节剂自身或其衍生化的基团与硅氧烷封端的活性基团可以互为以下可反应的基团对:羧基-氨基、羧基-羟基、叠氮-炔基、酰氯-氨基、酰氯-羟基、巯基-烯基、烯基-共轭双烯。
[0008]
优选的,所述活性基团封端的硅氧烷结构式如下:
[0009]
n=1~6,r
1-r3相同或者不同,代表c1-c6的烷基,r4代表氨基、羟基、羧基、烯基、巯基、卤素、酰氯、hooc(ch2)
m
conh-,m=1-6、ch2=chconh-。
[0010]
优选的,所述n=1~3,r
1-r3相同或者不同,代表甲基、乙基或丙基,r4代表氨基、羟基、羧基、烯基、巯基、卤素、酰氯、hooc(ch2)
m
conh-,m=1-3、ch2=ch conh-。
[0011]
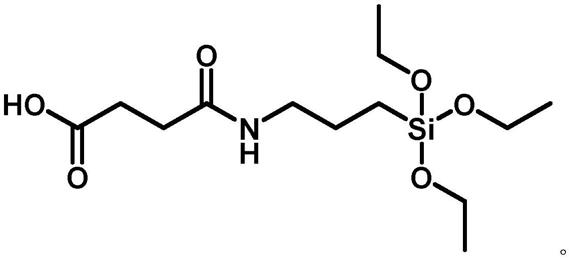
本发明一个具体的示例,所述活性基团封端的硅氧烷为:4-氧代-4-((3-(三乙氧基甲硅烷基)丙基)氨基)丁酸,其结构式如下:
[0012]
可以与光敏剂、乏氧探针或微环境调节剂或其衍生物结构中的氨基、羟基等反应。
[0013]
所述活性基团封端的硅氧烷还可以为n-(3-(三乙氧基甲硅烷基)丙基)丙烯酰胺,其结构式为:可以与光敏剂、乏氧探针或微环境调节剂或其衍生物结构中的巯基或共轭双烯等反应。
[0014]
本发明所述的光敏剂选自血卟啉类光敏剂、卟啉类光敏剂、稠环醌类光敏剂、酞菁类光敏剂、磷光金属配合物光敏剂中的一种或几种。第一代光敏剂主要是血卟啉衍生物(hpd)的混合制剂,如photofrin、二血卟啉醚(dhe)等;第二代光敏剂包括卟啉类衍生物(如5-氨基酮戊酸、血卟啉单甲醚、叶绿素衍生物(叶绿素a、叶绿素b、叶绿素c、叶绿素d、叶绿素f以及原叶绿素和细菌叶绿素、脱镁叶绿酸a-己醚衍生物(2-[1-hexyloxyethyl]-2-devinyl pyropheophorbide-a,hpph)、n-天门冬酰基二氢卟吩(monoaspartyl chlorin e6,npe6))、稠环醌类光敏剂(如竹红菌素、金丝桃素、姜黄素)、酞菁类光敏剂(如酞菁、磺化铝酞菁、硅酞菁、萘酞菁/萘菁、锌酞菁等)。磷光金属配合物光敏剂为铱配合物,钌配合物或钯配合物等。第三代光敏剂为与多聚体、脂质体、靶组织特异的抗体和配体结合的第二代光敏剂。所述乏氧探针选自罗丹明类、香豆素类、氟硼吡咯类、荧光素类、萘酰亚胺类、吖啶类、
菁染料类,磷光金属配合物类乏氧探针中的一种或几种,所述肿瘤微环境调节剂选自血管紧张素受体拮抗剂、血管紧张素转化酶抑制剂中的一种或几种。
[0015]
优选的,所述光敏剂和乏氧探针选自铱配合物,钌配合物或钯配合物中的一种或几种,所述血管紧张素受体拮抗剂选自氯沙坦、缬沙坦、厄贝沙坦、坎地沙坦酯、他索沙坦、依普罗沙坦、替米沙坦,所述血管紧张素转化酶抑制剂选自卡托普利、依那普利、苯那普利、赖诺普利、培哚普利、福辛普利、西拉普利、雷米普利、地拉普利、赖诺普利、培哚普利中的一种或几种。
[0016]
本发明所述的光敏剂可以在光动力疗法中,利用光照产生活性氧(ros)特异性杀死癌细胞。所述乏氧探针能够实时监测肿瘤内氧含量的变化。
[0017]
本发明所述肿瘤微环境调节剂可以在光动力治疗过程中扩充血管,改善肿瘤灌注进而改善乏氧。
[0018]
本发明一个优选的方案,选择既可以作为光敏剂又可以作为乏氧探针的磷光金属配合物,如铱(iii)配合物,钌配合物或钯配合物中的一种或几种。
[0019]
具体的,所述铱(iii)配合物选自irpvp或者irpeg中的一种或几种。优选为亲水性聚乙烯基吡咯烷酮(pvp)缀合的铱(iii)配合物(irpvp)(nat.commun.2015,6,6834)。所述肿瘤微环境调节剂选自氯沙坦。
[0020]
本发明一个优选的技术方案,所述的复合纳米粒以五氧化二钒纳米粒为核,以二氧化硅为壳后,再与氨丙基三乙氧基硅烷修饰的铱(iii)配合物和氨丙基三乙氧基硅烷修饰的氯沙坦反应。
[0021]
优选的,本发明所述的复合纳米粒,所述五氧化二钒、铱配合物和血管紧张素受体拮抗剂的摩尔比为1:6~15:0.3~5,更优选为1:12:1.6。
[0022]
本发明所述的五氧化二钒纳米粒以五氧化二钒为钒源采用水热法制备而成。一个具体的示例如下:
[0023]
将五氧化二钒,草酸和水搅拌澄清后,将其加入到高压反应釜中,再向其中加入异丙醇和正丁醇,加热反应过夜后,煅烧得到五氧化二钒纳米粒子。
[0024]
本发明所述硅氧烷修饰的光敏剂、乏氧探针、肿瘤微环境调节剂制备方法的一个具体示例如下:
[0025]
所述硅氧烷为氨丙基三乙氧基硅烷,铱配合物(irpvp)作为光敏剂和乏氧探针,氯沙坦作为肿瘤微环境调节剂。
[0026]
将氨丙基三乙氧基硅烷(aptes)和琥珀酸酐溶于无水dcm中。在室温下搅拌后,蒸发溶剂,得到4-氧代-4-((3-(三乙氧基甲硅烷基)丙基)氨基)丁酸,其结构式如下:
[0027][0028]
将氯沙坦、羧基硅氧烷、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和二甲氨基
吡啶加入四氢呋喃后反应,将产物纯化后得到氯沙坦硅氧烷(losartan-aptes),其结构式为:
[0029][0030]
将氨丙基三乙氧基硅烷和三乙胺溶于无水dcm中,然后将丙烯酰氯逐滴加入到上述溶液中。在室温下搅拌,纯化得到n-(3-(三乙氧基甲硅烷基)丙基)丙烯酰胺,其结构式为:
[0031]
将铱配合物(irpvp),溶解在无水dmf中,并于室温下氩气保护下搅拌。然后加入烯基硅氧烷的无水dmf溶液,室温再搅拌后,将溶液在乙醚中沉淀两次,得到铱配合物硅氧烷,其结构式为:
[0032]
本发明所述复合纳米粒的一个具体的制备方法如下:
[0033]
将五氧化二钒纳米粒子先和正硅酸乙酯在无水甲苯中加热回流过夜,得到二氧化硅包覆的五氧化二钒纳米粒子,然后将硅氧烷修饰的铱配合物和硅氧烷修饰的氯沙坦同时或先后添加到该溶液中并超声处理,将该溶液加热至120℃并回流得到铱配合物和氯沙坦修饰的五氧化二钒纳米粒子。
[0034]
本发明另一目的在于提供所述的复合纳米粒在制备光动力疗法药物中的应用。
[0035]
本发明技术方案中五氧化二钒作为产氧剂可以与内源性过氧化氢(h2o2)反应生成氧气,改善肿瘤乏氧。铱配合物(如亲水性聚乙烯基吡咯烷酮(pvp)缀合的铱(iii)配合物(irpvp))不仅可以作为杀死癌细胞的光敏剂,而且还可以作为乏氧敏感性探针来报告肿瘤的乏氧状态。肿瘤微环境调节剂氯沙坦,作为一种血管活性剂和血管紧张素受体阻滞剂,可以使抑制肿瘤相关成纤维细胞活化并降低肿瘤血管压力以促进肿瘤中的血管灌注和氧气供应,改善肿瘤微环境。
[0036]
本发明优点:
[0037]
本发明提供了一种综合产氧剂、光敏剂、乏氧探针以及微环境调节功能的复合型纳米粒,可以克服光动力治疗过程的自我限制并实时监测肿瘤组织氧含量,为光动力治疗提供指导,可用于光动力治疗等领域。为了实现本发明目的,本发明开发了独特的复合纳米粒的制备方法,实现了五氧化二钒的化学修饰。本发明相比于传统光动力治疗药物,所述复合纳米粒子不仅可以实时监测光动力过程中肿瘤氧合状态,还可以克服光动力治疗过程的自我限制。
附图说明
[0038]
图1:本发明所述复合纳米粒子的红外光谱图。
[0039]
图2:本发明所述复合纳米粒子的透射电镜图。
[0040]
图3:本发明所述复合纳米粒子的稳定性考察结果。
[0041]
图4:本发明所述复合纳米粒子的体外产氧结果。
[0042]
图5:本发明所述复合纳米粒子在乏氧条件下对细胞内的ros检测结果。
[0043]
图6:本发明所述复合纳米粒子对小鼠肿瘤的乏氧成像。
[0044]
图7:本发明所述复合纳米粒子对小鼠进行光动力治疗前后肿瘤组织的氧分压检测结果。
[0045]
图8:本发明所述复合纳米粒子的抗肿瘤效果。
具体实施方式
[0046]
下面结合实例进一步阐明本发明的内容,但是这些实例并不限制本发明的保护范围。
[0047]
实施例1:偶联氯沙坦和铱配合物的二氧化硅-五氧化二钒纳米粒子的制备。
[0048]
a.称取1.2g五氧化二钒,2.5g草酸二水合物加入40ml水中并加热至60度反应1h后,将其与20ml异丙醇和10ml正丁醇一起加入反应釜中,200度反应12h后取出在300度下煅烧2h得到五氧化二钒纳米粒子。
[0049]
b.将aptes(221mg,1mmol)和琥珀酸酐(100mg,1mmol)溶于20ml无水dcm中。在室温下搅拌过夜后,用旋转蒸发仪减压蒸发溶剂,得到羧基硅氧烷。hnmr(400mhz,cdcl3):δ=3.86(t,6h),3.42(t,2h),2.60(t,2h),2.50(t,2h),1.51(m,2h),1.21(t,9h),0.56(t,3h)。
[0050]
c.将aptes(220mg,1mmol)和三乙胺(200mg,2mmol)溶于20ml无水dcm中,并在冰浴中搅拌10分钟。并将丙烯酰氯(180mg,2mmol)溶于10ml dcm中,并逐滴加入到上述溶液中。接下来在室温下搅拌过夜后,将沉淀物过滤并将溶剂减压蒸发。残余物通过硅胶柱纯化,用dcm/etoac(8/1)洗脱,得到烯基硅氧烷。1hnmr(400mhz,cdcl3):δ=6.71(m,1h),6.48(d,2h),5.78(d,2h),3.83(m,6h),3.18(t,2h),2.60(t,2h),2.50(t,2h),1.51(m,2h),1.21(t,9h),0.56(t,3h).
[0051]
d.将羧基硅氧烷(321mg,1mmol),edc(230mg,1.2mmol)和一小勺dmap溶解在20ml无水thf中,并在冰浴中搅拌10分钟。然后滴加氯沙坦(500mg,1.2mmol)的无水thf(30ml)溶液,并在室温下搅拌过夜。过滤沉淀物,并在减压下除去溶剂。然后将残余物通过硅胶柱纯化,用thf/etoac(4/1)纯化,得到氯沙坦硅氧烷。hnmr(400mhz,cdcl3):δ=7.96(d,2h),7.6(d,2h),7.33(m,4h),5.46(s,1h),5.40(s,1h),3.83(m,6h)),3.42(t,2h),2.87(t,2h),
2.61(t,2h),2.49(t,2h),1.51-1.59(m,4h),1.30(m,2h),1.21(t,9h),0.90(t,2h)0.56(t,3h).
[0052]
e.将irpvp(900mg,0.06mmol),正己胺(70μl)和催化量的tcep溶解在15ml无水dmf中,并于室温下氩气保护下搅拌过夜。然后加入烯基硅氧烷(100mg)的无水dmf溶液,并将反应混合物在氩气保护下于室温再搅拌24小时。之后,将溶液在乙醚中沉淀两次,得到铱配合物硅氧烷。hnmr(400mhz,cdcl3):δ=9.27(d,1h),9.06(d,1h),8.80(d,1h),8.65(d,1h),8.56(d,1h),8.19(d,1h),8.04-7.99(m,2h),7.94(t,2h),7.84(t,1h),7.71(d,1h),7.58(d,1h),7.52(t,1h),7.09-7.04(m,2h),6.91(m,2h),6.71(m,1h),6.49-6.42(m,5h),6.35-6.30(m,2h),5.78(d,2h),5.18(s,1h),3.72(m,125h),3.21(m,248h),2.36-1.41(m,741h),1.21(t,9h),0.56(t,3h)。
[0053]
f.将10mg正硅酸乙酯和8mg五氧化二钒纳米粒子在无水甲苯中超声半小时后,120度加热回流过夜,再分别将氯沙坦aptes和irpvpaptes加入到甲苯溶液中反应过夜,得到铱配合物和氯沙坦修饰的核壳纳米粒子(irp-l@sio
2-v2o5)。所述复合纳米粒子的红外光谱图如图1所示。从图中可以看出所合成的纳米粒子同时具有五氧化二钒,氯沙坦和铱配合物的特征峰,证明所述五氧化二钒纳米粒偶联有氯沙坦和铱配合物。所述复合纳米粒子的透射电镜图如图2所示,从图中可以看出纳米粒子是规则的球形,且其具有核壳结构。
[0054]
实施例2包覆氯沙坦和铱配合物的五氧化二钒纳米粒子的制备
[0055]
参照实施例1步骤a-e,依次制备相应产物。将200mg铱配合物硅氧烷和10mg v2o5纳米粒子添加到50ml无水甲苯中并超声处理0.5h。将该溶液加热至120℃并回流24小时。所得固体用甲苯洗涤5次,然后真空干燥,得到铱配合物包覆的五氧化二钒纳米粒子(irp@v2o5)。将65mg irp@v2o5与10mg洛沙坦硅氧烷在相同条件下反应制备铱配合物和洛沙坦共同包覆的五氧化二钒纳米粒子(irp-l@v2o5)。
[0056]
实施例3
[0057]
将1mg ml-1
irp-l@v2o5和irp-l@sio
2-v2o5的纳米粒子分别置于10%胎牛血清溶液中,接着利用动态光散射测量其水合粒径的变化。如图3所示,irp-l@sio
2-v2o5的纳米粒子稳定性较好,不易聚集,随着时间的增加,粒径增大不明显。与实施例1的irp-l@sio
2-v2o5相比,实施例2所得五氧化二钒纳米粒子irp-l@v2o5的稳定性较差,随着时间的增加,易发生聚集,粒径逐渐增大,在体内易引发血管堵塞等安全性问题。
[0058]
实施例4
[0059]
将1mg ml-1
irpvp、irp@sio
2-v2o5和irp-l@sio
2-v2o5纳米粒子加入50mm的过氧化氢溶液中,利用氧分压仪监测溶液中氧含量变化。如图4所示,与没有五氧化二钒的irpvp实验组相比,具有五氧化二钒的irp@sio
2-v2o5和irp-l@sio
2-v2o5实验组在过氧化氢存在情况下均可以产生氧气。表明五氧化二钒可以催化双氧水分解产生氧气。
[0060]
实施例5
[0061]
irp-l@sio
2-v2o5的细胞内单线态氧产生通过单线态氧绿色荧光探针进行监测。先将h22细胞与单线态氧绿色荧光探针培养1小时后,再接着将irp-l@sio
2-v2o5纳米粒子加入培养皿中培养四小时后用乏氧袋进行培养1小时后用635nm激光器对其进行照射5分钟。在细胞内的ros检测结果如图5所示,结果显示在635nm的激光照射下,加入纳米粒子的实验组细胞内显著产生了单线态氧,而单纯的irpvp实验组在乏氧条件下产生的单线态氧很少。表
明该纳米粒子可用于乏氧肿瘤的光动力治疗。
[0062]
实施例6
[0063]
通过尾静脉将含有irpvp或irp-l@sio
2-v2o5的pbs(200μl,60mg ml-1
irpvp)溶液注入h22荷瘤小鼠中。用异氟烷麻醉小鼠,并在注射后的不同时间使用ivis体内成像系统对小鼠成像。如图6所示,注射irp-l@sio
2-v2o5纳米粒子的实验组展示出了更低的荧光强度,显示肿瘤乏氧可以显著改善。
[0064]
实施例7
[0065]
将携带h22肿瘤的小鼠随机分为三组(每组六只小鼠),分别并在第1,3,5天静脉注射irpvp、irp@sio
2-v2o5或irp-l@sio
2-v2o5(在200μl pbs溶液中60mg ml-1
irpvp)纳米粒子。并在2,4,6天使用635nm激光进行照射,使用oxylite(英国牛津)测量肿瘤组织的氧分压。将探针直接插入肿瘤组织约2
–
3mm的深度以获取读数。如图7所示,注射有irp@sio
2-v2o5实验组的小鼠氧分压在激光照射后显示出明显下降,这表明光动力治疗是一种氧消耗的治疗方式,但是当继续给药并照射以后,irp@sio
2-v2o5实验组的氧分压增加量很低,这表明随着光动力治疗的进行,其自我限制能力逐渐显现。而同时具有五氧化二钒和氯沙坦的irp-l@sio
2-v2o5纳米粒子组并没有显著的氧分压降低,显示出五氧化二钒和氯沙坦的协同作用可以克服光动力治疗的自我限制。
[0066]
实施例8
[0067]
将h22荷瘤小鼠分为8组(每组5只小鼠),然后分别在第1,3和5天通过尾静脉注射pbs,irpvp(60mg kg-1
),irp@sio
2-v2o5(60mg kg-1
irpvp)或irp-l@sio
2-v2o5(60mg kg-1
irpvp),而每个注射组分为激光照射组和没有激光照射组。在第2、4和6天,激光照射组的小鼠在635nm激光下暴露5分钟。经过不同的处理后,每隔一天测量一次肿瘤大小和体重。如图8所示,五氧化二钒和氯沙坦共同包覆的纳米粒子具有更好的抗肿瘤效果,这表明两者的协同作用可以显著改善光动力治疗的自我限制,提高光动力治疗的效率。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1