一种提高艾塞那肽人血清白蛋白融合蛋白稳定性的冻干粉的制作方法
[0001]
本发明属于药剂学技术领域,具体涉及一种提高艾塞那肽人血清白蛋白融合蛋白稳定性的冻干粉、制备方法及应用。
背景技术:
[0002]
ii型糖尿病是危害我国乃至全世界人民身体健康最重要的慢性病之一,2013年我国糖尿病患者人数已经达到1.32亿,预计发病人数将进一步增加,是一个重大的民生问题。糖尿病产生的原因主要有胰岛素分泌不足或胰岛素的利用障碍,除早期可以通过控制饮食、加强煅炼来进行治疗外,其治疗方法主要是增加患者体内的胰岛素水平、增加患者对胰岛素的敏感性,除了化学治疗药物,主要是使用胰岛素进行治疗。但胰岛素治疗的主要缺点是会引起低血糖反应、抑制患者自身的胰岛素分泌,甚至会产生对胰岛素药物的依赖性及胰岛素抗性。
[0003]
促胰岛素分泌肽类药物,包括glp-1、艾塞那肽(exendin-4)及其类似物,能通过camp和/或其它细胞内信号通路来增强葡萄糖依赖性的胰岛合成和体内胰腺β细胞的胰岛素分泌,抑制胰高血糖素过量分泌,同时还可以通过降低ii型糖尿病患者空腹和餐后血糖浓度来改善血糖控制,具有保护患者胰岛功能、增加自身胰岛素分泌量、提高患者对胰岛素的敏感性等优点。促胰岛素分泌肽类药物促胰岛素分泌功能受到血糖水平的反馈调节,不会引起低血糖,可以克服胰岛素治疗的缺点,被称为“智慧型”药物。
[0004]
艾塞那肽是促胰岛素分泌肽类药物中的一种,是第一个被制成治疗ii型糖尿病的药物。由于天然的艾塞那肽是一种多肽分子(分子量为4186da),体内清除速率快,半衰期短,患者需要每天注射2次才能达到满意的治疗效果,给患者带来不便和痛苦。
[0005]
本申请专利的申请人于2008年申请了中国发明专利zl 200810018639.7,采用基因工程技术将编码艾塞那肽的基因序列与编码人血清白蛋白(human serum albumin)分子基因序列融合在一起,构建表达艾塞那肽人血清白蛋白融合蛋白(exendin-4-hsa)的酵母表达系统,成功地制备了分子量为70.6kda的exendin-4-hsa融合蛋白,该融合蛋白分子保持了exendin-4的降血糖生物活性,同时其在体内的半衰期明显延长,患者每周只需要注射一次即达到满意的降血糖效果,从而增加了药品临床应用价值与医从性,有效地解决了短肽艾塞那肽用于临床治疗的缺点,是一个应用前景非常广泛的ii型糖尿病长效治疗新药。
[0006]
exendin-4-hsa是一个大分子融合蛋白,由艾塞那肽与人血清白蛋白组成。人血清白蛋白虽然是一个结构非常稳定的天然分子,但是与外源性分子艾塞那肽融合形成一个新的融合蛋白分子后,其结构及理化特性便发生了改变,其稳定性亦随之发生改变,在水溶液中长期保存易发生降解、聚合等现象,从而导致艾塞那肽生物活性丧失,影响了药物的治疗效果及其长效性,不利于药物的长期保存与应用。为了解决这一问题,需要开发能够长期保持exendin-4-hsa融合蛋白稳定性的制剂配方与剂型。
[0007]
众所周知,影响蛋白质稳定性的因素有很多,有物理因素和化学因素,如温度、湿度、光照、离子强度、表面活性剂、缓冲系统、ph值、渗透压以及防腐剂等,剂型对蛋白质稳定
性亦有关键的影响作用,有的蛋白在水溶液中稳定性好,而有的蛋白以固体的形式存在比较稳定。合适的制剂离子强度、渗透压、缓冲系统、ph值、促溶剂对稳定活性蛋白质的结构和活性具有重要的作用,但是,不同的蛋白质因其物理化学特性不同,维持其结构稳定性所需辅料及剂型的要求又不同,需要进行专门的优化研究。为此,研发一种能够延长艾塞那肽人血清白蛋白融合蛋白(exendin-4-hsa)稳定性的冻干粉制剂配方及冻干工艺具有重要的现实意义。
技术实现要素:
[0008]
为解决现有技术中存在的技术问题,本发明的目的在于提供一种提高艾塞那肽人血清白蛋白融合蛋白稳定性的冻干粉、制备方法及应用。
[0009]
为实现上述目的,达到上述技术效果,本发明采用的技术方案为:
[0010]
一种提高艾塞那肽人血清白蛋白融合蛋白稳定性的冻干粉,由重组艾塞那肽人血清白蛋白融合蛋白和辅料制成,所述辅料包括赋形剂、稳定剂、促溶剂和渗透压缓冲维持剂。
[0011]
进一步的,所述重组艾塞那肽人血清白蛋白融合蛋白的浓度为0.1~500mg/ml,采用本发明的申请人研制的exendin-4-has产品即可。
[0012]
进一步的,所述赋形剂为甘露醇、甘氨酸、丙氨酸、水解明胶中的一种或几种的组合,用量浓度为0.5~10%。
[0013]
进一步的,所述稳定剂为乳糖、蔗糖、葡萄糖、海藻糖、精氨酸中的一种或几种的组合,用量浓度为1~10%。
[0014]
进一步的,所述促溶剂为泊洛沙姆、环糊精、吐温-80、吐温-20中的一种或几种的组合,用量浓度为0.001~4%。
[0015]
进一步的,所述渗透压缓冲维持剂为磷酸盐、醋酸盐、碳酸盐、乳酸盐、柠檬酸盐、硼酸盐、氯化钠、氢氧化钠中的一种或几种的组合。
[0016]
进一步的,所述渗透压缓冲维持剂为磷酸盐缓冲液和氯化钠溶液的混合,所述磷酸盐缓冲液的浓度为5~20mm,磷酸盐缓冲液的ph值为5~10,氯化钠溶液的浓度为2~50mm
[0017]
本发明公开了一种提高艾塞那肽人血清白蛋白融合蛋白稳定性的冻干粉的制备方法,包括以下步骤:
[0018]
1)先制配渗透压缓冲维持剂缓冲系统,将纯化的重组艾塞那肽人血清白蛋白融合蛋白与赋形剂、稳定剂和促溶剂混合,制成制剂溶液;
[0019]
2)对步骤1)所得制剂溶液进行除菌过滤,随后进行真空冷冻干燥,得所需冻干粉。
[0020]
进一步的,步骤2)中,真空冷冻干燥采用预冷、升化和解析工艺,包括以下步骤:
[0021]
21)对权利要求8中的步骤1)所得制剂溶液进行除菌过滤后,放于-20~-50℃低温箱下冷冻2~8h;
[0022]
22)对步骤21)所得产物进行抽真空,真空度维持在2~30pa,并调高低温箱内的环境温度,使制剂溶液中的水分升华变成气体后依靠负压作用排出,升华温度为-20~-50℃,升华时间为10~70h;
[0023]
23)在真空状态下,将低温箱内的温度升至-10~30℃进行解析,解析温度为10~25℃,解析时间为3~15h。
[0024]
本发明还公开了一种提高艾塞那肽人血清白蛋白融合蛋白稳定性的冻干粉在治疗人类ii型糖尿病、肥胖症、老年性痴呆症的药物中的应用。
[0025]
与现有技术相比,本发明的有益效果为:
[0026]
本发明公开了一种提高艾塞那肽人血清白蛋白融合蛋白稳定性的冻干粉、制备方法及应用,冻干粉由重组艾塞那肽人血清白蛋白融合蛋白和辅料制成,辅料包括赋形剂、稳定剂、促溶剂和渗透压缓冲维持剂,还可添加其他各种有助于重组艾塞那肽人血清白蛋白融合exendin-4-hsa结构稳定的各种增溶剂、赋形剂、稳定剂以及各种渗透压维持剂、抑菌剂和缓冲体系等,重组艾塞那肽人血清白蛋白融合蛋白和辅料结合后结构稳定。本发明提供的提高艾塞那肽人血清白蛋白融合蛋白稳定性的冻干粉、制备方法及应用,可使活性成分重组艾塞那肽人血清白蛋白融合蛋白长期保持稳定,产品2~8℃保存有效期可达36个月,其含量及生物活性仍维持在规定范围内,符合产品质量标准的要求,有效地延长药物的稳定性,从而提高药物的临床治疗价值和适用性。
附图说明
[0027]
图1为本发明的冻干机在艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa冻干时实时记录的冻干曲线图;图1a为温度曲线;图1b为真空度曲线;
[0028]
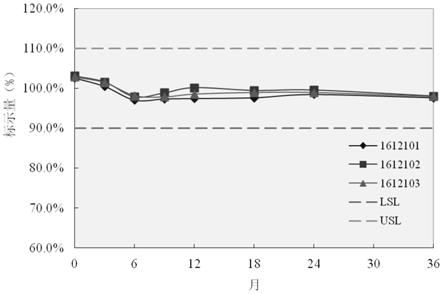
图2为本发明的三批样品36个月长期稳定性含量变化趋势图。
具体实施方式
[0029]
下面结合附图对本发明的实施例进行详细阐述,以使本发明的优点和特征能更易于被本领域技术人员理解,从而对本发明的保护范围做出更为清楚明确的界定。
[0030]
如图1-2所示,一种提高艾塞那肽人血清白蛋白融合蛋白稳定性的冻干粉,由重组艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa和辅料制成,辅料包括赋形剂、稳定剂、促溶剂和渗透压缓冲维持剂,重组艾塞那肽人血清白蛋白融合蛋白和辅料结合后结构稳定。
[0031]
一种适合注射用的提高艾塞那肽人血清白蛋白融合蛋白稳定性的冻干粉的制备方法,
[0032]
首先,通过辅料相容性试验确定注射用提高艾塞那肽人血清白蛋白融合蛋白稳定性的冻干粉制剂配方中辅料由赋形剂、稳定剂、促溶剂、氯化钠溶液和磷酸缓冲液组成;具体包括以下步骤:
[0033]
1)先制配渗透压缓冲维持剂缓冲系统,将纯化的适量重组艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa与不同浓度的赋形剂、稳定剂、促溶剂混合,制成不同配方的制剂溶液;
[0034]
2)将步骤1)制备的制剂溶液经过除菌过滤后分装至3ml西林瓶中,随后经过真空冷冻干燥工艺,制成冻干粉;
[0035]
3)通过在不同条件下的稳定性考察,按照制定的质量标准对步骤2)制备的冻干粉制剂经各种稳定性考察条件处理后的样本进行检测,确定优化的注射用提高艾塞那肽人血清白蛋白融合蛋白稳定性的冻干粉制剂配方与冻干工艺,该冻干粉制剂可用于包括但不限于人类ii型糖尿病、肥胖症、老年性痴呆的治疗。
[0036]
本发明的冻干粉制剂配方包括但不限于由活性成分重组艾塞那肽人血清白蛋白
融合蛋白exendin-4-hsa制备的适用于临床治疗用药的冻干粉针剂配方。配方中的辅料成分可以是但不限于各种有助于重组艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa结构稳定的各种促溶剂、赋形剂、稳定剂,以及各种渗透压维持剂、抑菌剂和缓冲体系等。
[0037]
本发明优化后的冻干粉制剂的配方组成为:活性成分重组艾塞那肽人血清白蛋白融合蛋白(exendin-4-hsa)、甘露醇、海藻糖、吐温-80、nacl、磷酸盐缓冲液。
[0038]
本发明的活性成分为重组艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa,其表达与制备过程可参考本公司发明专利zl 200810018639.7。活性成分重组艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa的浓度在0.1~500mg/ml,优选的浓度为1~100mg/ml。
[0039]
赋形剂包括但不仅限于以下物质:甘露醇、甘氨酸、丙氨酸、水解明胶等等,赋形剂的用量浓度为0.5~10%,优选的用量浓度为2~6%;优先赋形剂为甘露醇。
[0040]
稳定剂包括但不仅限于以下物质:乳糖、蔗糖、葡萄糖、海藻糖、精氨酸等等;稳定剂的用量浓度为1~10%,优选的用量浓度为3~5%;优选的稳定剂为海藻糖。
[0041]
促溶剂包括但不仅限于以下物质:泊洛沙姆、环糊精、吐温-80、吐温-20等;促溶剂的用量浓度为0.001~4%,优选浓度为0.01~0.2%;优选的促溶剂为吐温-80。
[0042]
渗透压缓冲维持剂包括但不仅于以下物质:磷酸盐、醋酸盐、碳酸盐、乳酸盐、柠檬酸盐、硼酸盐、nacl和naoh等等,优选为磷酸盐缓冲液和nacl;磷酸盐缓冲液由磷酸二氢钠和磷酸氢二钠组成,其浓度在5~20mm,优选的浓度为10mm,磷酸盐缓冲液的ph值为5~10,优选7.0;nacl的用量浓度为2~50mm,优选的浓度为3~10mm。
[0043]
本发明所述的真空冷冻干燥工艺包括以下阶段:预冷、升化和解析三个阶段。
[0044]
本发明真空冷冻干燥工艺中所述预冷是将待冻干样品在低温环境下预先进行冷冻。冷冻温度为-20~-50℃,优选冷冻温度为-30~-40℃;预冷冻时间为2-8h,优选的预冷冻时间为2-5h。
[0045]
本发明真空冷冻干燥工艺中所述的升华是指将预冷的样本进行抽真空,真空度维持2~30pa,并将环境温度适当提高,使冻结样本中的水份由固态冰直接升华至气态在负压吸引作用下排出。升华温度为-20~-50℃,优选的升华温度为-25~-35℃,升华时间为10~70h,优选的升华时间为30~60h。
[0046]
本发明真空冷冻干燥工艺中所述的解析为在真空状态下,将腔内温度升至-10~30℃进行解析,优选的解析温度为10~25℃;解析时间为3~15h,优选的解析时间为保持5~10h。
[0047]
本发明制得的产品为注入人体内的注射剂。注射剂一般要求药液的摩尔渗透压不超过260-320mosm/kg的生理范围,而药液的摩尔渗透压由其配方中的所有成份的含量来决定。在本发明的有效成份、nacl、磷酸盐浓度不变的情况下,甘露醇、海藻糖及其它成分用量的选择是受到限制的,用量需要综合考虑衡量,选择合适的用量,用量过低或过高均会导致本品药液渗透压高于或低于生理渗透压范围,不能满足产品质量标准的要求。
[0048]
实施例1
[0049]
活性成分重组艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa与辅料海藻糖的相容性研究:
[0050]
分别配制含0、3%、5%、10%质量分数海藻糖的重组艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa(3mg/ml)溶液,冻干;再将样品分别置于室温和40℃条件下并均放置5
天和10天,然后检测冻干后0天、室温放置5天和10天以及40℃下放置5天和10天的样品的性状、含量与纯度的变化。
[0051]
实验结果显示,与冻干后0天相比,室温放置5天、10天以及40℃下放置5天、10天的样品的外观性状没有发生改变,仍为白色疏松体,样品中重组艾塞那肽人血清白蛋白融合exendin-4-hsa的含量与纯度均没有发生明显的变化,这一结果证明海藻糖对重组艾塞那肽人血清白蛋白融合exendin-4-hsa的性质没有影响,并且在高温环境下具有保护重组艾塞那肽人血清白蛋白融合exendin-4-hsa的功能,可防止其降解,二者的相容性好。
[0052]
实施例2
[0053]
活性成分重组艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa与辅料吐温-80的相容性研究:
[0054]
用不同质量分数(0、0.005%、0.01%、0.02%)的吐温-80溶液配制重组艾塞那肽人血清白蛋白融合exendin-4-hsa(3mg/ml)溶液,冻干。再将样品分别置于室温和40℃条件下并均放置5天和10天,检测冻干后0天、室温放置5天和10天、40℃放置5天和10天样品的性状、含量与纯度的变化。
[0055]
实验结果显示,不同质量分数的吐温-80配制重组艾塞那肽人血清白蛋白融合exendin-4-hsa溶液,冻干后,室温放置5天和10天以及40℃下放置5天和10天的样品的外观性状没有发生改变,仍旧为白色疏松体,含量和纯度变化分别如表1-2所示。
[0056]
表1为室温和40℃高温条件下不同质量分数的吐温-80对冻干样品中活性成分重组艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa含量的影响。
[0057]
表1
[0058][0059]
表2为室温和40℃高温条件下不同质量分数的吐温-80对冻干样品中活性成分重组艾塞那肽人血清白融合蛋白exendin-4-hsa纯度的影响。
[0060]
表2
[0061][0062]
表1-2的数据显示,在室温及高温环境下,吐温-80对重组艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa的含量无太大影响,但高温可以使纯度小幅度降低。
[0063]
实施例3
[0064]
活性成分重组艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa与辅料甘露醇的相容性研究:
[0065]
用不同浓度的甘露醇溶液(0、3%、6%、10%)配制重组艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa(3mg/ml)溶液,冻干,再将样品分别置于室温和40℃条件下并均放置5天和10天,随后检测的样品性状、含量与纯度的变化。
[0066]
实验结果显示,不同浓度的甘露醇配制的重组艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa溶液冻干后,室温放置5天和10天以及40℃下放置5天和10天后的样品的外观性状没有发生改变,仍为白色疏松体,含量和纯度数据分别如表3-4所示。
[0067]
表3为室温和40℃高温条件下不同浓度的甘露醇对冻干样品中活性成分重组艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa含量的影响。
[0068]
表3
[0069][0070]
表4为室温和40℃高温条件下不同浓度的甘露醇对冻干样品中活性成分重组艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa纯度的影响。
[0071]
表4
[0072][0073]
实验结果显示,在室温及高温环境下,高浓度的甘露醇可使艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa的含量明显下降;3%的甘露醇的含量影响不明显,3%的甘露醇在室温下5天、10天对艾塞那肽人血清白蛋白融合蛋白的纯度影响不明显,但在高温40℃有一定的影响,在40℃高温条件下5天和10天,活性成分含量有小幅度下降;高浓度的甘露醇(6%、10%)对艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa的含量影响很大,含量下降很明显,在高温环境下含量下降更快,6%、10%的甘露醇在室温5天、10天和40℃下5天、10天均对艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa的纯度有明显的影响。
[0074]
实施例4
[0075]
综合辅料相容性研究结果,设计5个处方进行基本性能评价及稳定性考察。具体配方如表5所示。
[0076]
表5
[0077][0078]
按照表5的1#、2#、3#、4#、5#配方制备5种重组艾塞那肽人血清白蛋白融合蛋白溶液,充分溶解后,用0.22μm的微孔滤膜过滤器(ge,polyethersulfone聚醚砜)过滤,随后进行蛋白定量。根据测定的活性蛋白浓度,按每瓶3mg活性蛋白量进行分装,按照如下冻干曲线进行冷冻干燥:
[0079]-38~-40℃,预冻4h;
[0080]-30℃维持20h;
[0081]-30~-10℃维持12h;
[0082]-10~25℃维持12h。
[0083]
观察冻干样品的的外观性状。将冻干后样品用1ml注射用水复溶,考察复溶时间、澄清度、颜色、ph值及摩尔渗透压。将样品分别置于4℃、25℃、40℃、高湿、光照条件下并均
放置5天、10天。采用hplc测定0天、5天和10天后样品中的艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa的含量、纯度变化,以筛选最佳处方。
[0084]
实验结果显示:
[0085]
所有冻干样品的外观性状均合要求,呈白色粉末状、成形状态、蓬松度好。注射用水复溶迅速、为无色透明澄清液体,ph值、摩尔渗透压均符合要求。
[0086]
采用hplc测定不同条件下放置样品中艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa的含量与纯度,结果见表6、7。
[0087]
表6为不同条件下1#、2#、3#、4#、5#配方制成的样品中活性成分艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa的含量的变化。
[0088]
表6
[0089][0090]
表7为不同条件下1#、2#、3#、4#、5#配方制成的样品中活性成分艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa纯度的变化。
[0091]
表7
[0092][0093]
综合分析表6-7的数据结果,5#配方制成的样品的综合性能相对比较好,确定为最佳配方。
[0094]
实施例5
[0095]
根据文献报道,海藻糖塌陷温度为-32℃左右,设计冻干工艺的升华温度分别在-35℃、-32℃、-29℃进行三次冻干实验,对冻干样品的外观性状:成形状态、蓬松度、颜色以及含水量进行评价。将表5中5个配方的样品按如下冻干工艺进行冻干:
[0096]-38℃预冻3h;真空保持在2~30pa,分别升温至-35℃、-32℃、-29℃(三次)保持25h;最后以0.5℃/min升温至25℃,保持6h。
[0097]
结果显示,三个升华温度下冻干成品均为白色疏松体,用1ml注射用水复溶迅速溶解,成型良好,1~5#配方冻干样品的下部均略有萎缩,水分检测均符合标准。综合考虑外观、水分、能耗等方面因素,初步选择升华温度为-29℃的工艺条件为后续的处方筛选、稳定性样品制备等冻干操作的冻干工艺。
[0098]
鉴于上述实验中冻干成品底部略有萎缩,分析认为升华时间不够,为进一步优化冻干工艺,将升华时间延长至50h,对5#配方再次进行冻干,冻干程序如下:-38℃预冻3h;真空保持在2-30pa,升温至-29℃保持50h;最后以0.5℃/min升温至25℃,保持6h。
[0099]
实验结果显示,冻干成品为白色疏松体,成型良好,水分检测符合标准。冻干曲线如图1所示。
[0100]
实施例6
[0101]
产品长期稳定性研究:
[0102]
按照5#配方和优化的冻干工艺,制备三批注射用重组艾塞那肽人血清白蛋白融合蛋白exendin-4-hsa样品,样品批号为:1612101、1612102、1612103,将三批样品置于5℃
±
3℃放置36个月,分别于0、3、6、9、12、18、24、36个月取样,用1ml无菌注射用水进行复溶,检测不同时间点样品的性状、可见异物、不容性微粒、水分、ph值、生物活性、蛋白含量的变化,结果见表8和图2。
[0103]
表8
[0104]
[0105][0106]
长期稳定性数据显示,优化配方及冻干工艺制备的三批注射用艾塞那肽人血清白蛋白融合exendin-4-hsa在5
±
3℃的条件放置36个月,产品质量保持稳定,各项质量指标均符合质量标准的要求,有效期可长达36个月,可以满足临床用的需要。
[0107]
需要说明的是,本申请中所述含量与纯度都是通过液相来进行分析的,含量与纯
度是百分比;含量是外标法,与对照品相比,测试产品峰面积与对照品峰面积之比;纯度是产品中有效成分的主峰面积与总峰面积之比。
[0108]
本发明未详细说明的部分采用现有技术即可实现,在此不做赘述。
[0109]
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1