包含含有双链聚核糖核苷酸与聚亚烷基亚胺的复合物的粒子的医药组合物的制作方法
包含含有双链聚核糖核苷酸与聚亚烷基亚胺的复合物的粒子的医药组合物
[0001]
本申请是2016年11月17日提交的申请号为2016800495213的专利申请(名称为《包含含有双链聚核糖核苷酸与聚亚烷基亚胺的复合物的粒子的新颖医药组合物》)的分案。
技术领域
[0002]
本发明涉及包含通过聚核糖核苷酸和聚合物形成的粒子的医药调配物领域,其生产和其医学用途。
背景技术:
[0003]
近年来已研究使用模拟病毒dsrna的双链rna(dsrna)的合成类似物用于特异性地激活针对肿瘤的免疫系统,其具有抑制癌细胞生长和诱导癌细胞细胞凋亡的范围。特定来说,双链聚肌苷酸-聚胞苷酸(成为poly(i:c)或pic)已表征为一种以以下方式针对各种癌症(如黑素瘤、肝癌、结肠癌、胃癌和口癌瘤、宫颈癌、乳癌、卵巢癌、泌尿道肿瘤、肺癌和前列腺癌)和其癌转移的各种关注治疗性效果的dsrna类型:可能与免疫系统激活、自然杀伤细胞和/或树突状细胞介导的激活和/或肿瘤基因表达与微环境的改变相关或无关的方式(hafner a等人,2013)。
[0004]
令人遗憾的是,这些初始临床前证据是不充分地,或未在用裸poly(i:c)分子的临床研究中确认,所述分子由于各种机制,如较差的细胞摄取或由胞质rna酶降解,显示其较低稳定性、较差均质性、不可预测的药物动力学和受限抗肿瘤效果(hafner a等人,2013)。实际上,为了实现有效治疗性或预防性效果,poly(i:c)分子可能需要在紧接着使用前或使用前不久再溶解,可以呈较低浓度的调配物获得,和/或频繁地给药(例如每2小时)。
[0005]
在近几年中,在调配具有免疫调节和/或治疗性特性的poly(i:c)上已有显著进展。已公开将poly(i:c)分子制备和调配为粉末和/或结合在具有或不具有靶向部分和额外化学连接子的聚合物基微粒子内的各种方法(cn103599071;cn102988303;wo2004045491;wo2008057696;wo2013164380;wo2015067632;wo2014057432;wo2014165296;schaffert d等人,2011;wo2015173824;kabilova t等人,2014;kubler k等人,2011;palchetti s等人,2013;saheki a等人,2011)。poly(i:c)分子已用载剂聚合物调配,且调配呈可与鼻内给药相容的格式(wo2013164380),用聚赖氨酸和羧甲基纤维素稳定(wo2005102278),囊封在阳离子脂质包覆的磷酸钙纳米粒子、脂质体或其它囊状结构内(chen l等人,2013;us2009117306;us2011003883,或与单链rna和与阳离子肽,类似鱼精蛋白(wo2013087083)一起。替代地,poly(i:c)分子也已固定于具有或不具有将帮助靶向poly(i:c)分子到特定细胞或组织的药剂的固体粒子和载剂上,如氧化铁纳米粒子(mcbain s等人,2007;cobaleda-siles m等人,2014)。
[0006]
一些公开进一步公开各种在亚微米范围内的三元或四元复合物,所述复合物在具有或不具有其它组分和基因特异性的情况下通过聚合物、poly(i:c)和/或双链dna形成(kurosaki t等人,2009;wo2013040552;wo2013063019;tutin-moeavin i等人,2015)。
[0007]
然而,这些方法的目标是提供基本上将dna给药到细胞,同时维持其存活力,且不选择性杀伤癌细胞的药剂。
[0008]
限制poly(i:c)分子作为药物的临床研究和其与调节要求的顺应性的缺陷可通过制造结构上复杂的包含poly(i:c)分子与癌症疗法用药物传递系统一起抗癌复合物克服,所述药物传递系统通常基于阳离子聚合物,如壳聚糖、聚乙烯亚胺(pei)、聚l-赖氨酸、聚甲基丙烯酸酯、含咪唑聚合物或含环糊精聚合物、聚(β-氨基酯)和相关树枝状分子。这些聚合物系统(也称为聚合复合体)结构上和功能上不同于类似地用于局部或全身性递送核酸的脂质基系统(也称为脂复合体)和杂合系统(也称为脂聚合复合体)(bilensoy e,2010;germershaus o和nultsch k,2015)。在聚合复合体中,pei是可在直链/支化结构和大小、化学连接、可降解性和衍生作用的水平上改性(islam m等人,2014)且不同于由细胞内化的脂复合体的备受关注的阳离子聚合物,其通过网格蛋白介导的和通过窖蛋白介导的胞吞作用两个内化(shabani m等人,2010)。
[0009]
涉及制备和给药与pei结合的poly(i:c)分子的这种治疗性方法已示例在称为bo-110的药剂的文献中(pozuelo-rubio m等人,2014;tormo d等人,2009;wo2011003883)。这种复合物,也鉴别为[plc]
pei
,不仅接合黑素瘤和其它肿瘤类型(如神经胶质瘤或癌瘤)的若干癌细胞系中的自噬和细胞凋亡的双诱导,且还对正常细胞,如黑色素细胞,的存活力无效果或限制其效果。bo-110在动物模型中抑制黑素瘤生长,表明在活体内,甚至在严重免疫功能不全的小鼠中的抗肿瘤和抗转移性活性。此外,类似物[pic]
pei
基药剂刺激胰腺导管腺癌细胞中的细胞凋亡而不影响正常胰腺上皮细胞,且在活体内给药[pic]
pei
抑制肿瘤动物模型中的肿瘤生长(bhoopathi p等人,2014)。bo-110给药的其它效果在子宫内膜异位的模型中表征,其中这种药剂减少血管生成和细胞增殖且增加细胞凋亡(garcia-pascual c和gomez r,2013)。
[0010]
因此,bo-110和包含双链聚核糖核苷酸的类似物[pic]
pei
药剂表示具有广谱作用的新颖抗癌策略,这是由于自主地和选择性地在肿瘤细胞中组合激活自噬和细胞凋亡,同时维持不同谱系的正常细胞的存活力。然而,bo-110,如当与载剂结合时已在各种临床前模型中证实效果的其它双链聚核糖核苷酸基药剂,仍需要以在不同存储条件下稳定,均一地制造和设定大小的调配物形式提供。
[0011]
实际上,现有技术并不提供用于解决关于结构和生物物理准则的允许产生用于治疗癌症的含poly(i:c)组合物的最有效组合的问题的适当教示。管理机构也需要严格地顺应关于再现、存储和大小与浓度均一的包含于人类用组合物内的含poly(i:c)粒子的规范。因此,以较高和良好受控浓度提供双链聚核糖核苷酸分子,如poly(i:c)分子的药剂、组合物和相关方法仍需要其作为药物(特定来说针对癌症)的广泛临床前和临床研究,同时改进患者顺应性且降低给药具有明确界定安全性界限和治疗作用的双链聚核糖核苷酸分子的频率。
技术实现要素:
[0012]
本发明涉及一种组合物,包含粒子,其中
[0013]
(i)所述粒子中的每一个包含至少一条双链聚核糖核苷酸、或其盐或溶剂合物与至少一条聚亚烷基亚胺、或其盐和/或溶剂合物的复合物;
[0014]
(ii)至少95%或至少90%的所述粒子的直径小于或等于600nm,优选地,小于或等于300nm(例如,在140nm与250nm之间);以及
[0015]
(iii)所述粒子的z平均直径小于或等于200nm,优选地小于或等于150nm,特定来说,如根据iso 22412所测量。
[0016]
在一优选实施例中,本发明涉及一种水性组合物,包含粒子,其中
[0017]
(i)所述粒子中的每一个包含至少一种双链聚核糖核苷酸、或其盐或溶剂合物与至少一种直链聚亚烷基亚胺、或其盐和/或溶剂合物的复合物,其中所述双链聚核糖核苷酸是聚肌苷酸-聚胞苷酸[poly(i:c)],且所述直链聚亚烷基亚胺的平均分子量在17kda与23kda之间;
[0018]
(ii)至少90%的所述粒子的单峰直径分布低于300nm;
[0019]
(iii)所述粒子的z平均直径小于或等于150nm,如根据iso 22412所测量;以及
[0020]
(iv)所述组合物的ζ电位等于或大于30mv,根据iso 13099。
[0021]
本发明还涉及一种水性组合物,包含如本文中所公开的粒子,其中:
[0022]
(i)所述粒子中的每一个通过制备至少一条双链聚核糖核苷酸、或其盐或溶剂合物与至少一条直链聚亚烷基亚胺、或其盐和/或溶剂合物的复合物形成,其中所述双链聚核糖核苷酸是聚肌苷酸-聚胞苷酸[poly(i:c)],且所述直链聚亚烷基亚胺的平均分子量在17kda与23kda之间;
[0023]
(ii)至少90%的所述粒子的单峰直径低于300nm;
[0024]
(iii)所述粒子的z平均直径小于或等于150nm,如根据iso 22412所测量;以及
[0025]
(iv)所述组合物的ζ电位等于或大于30mv,根据iso 13099;
[0026]
其中所述粒子以所述组合物中的所述聚亚烷基亚胺的氮的摩尔数比所述双链聚核糖核苷酸的磷的摩尔数等于或大于2.5的比率形成。
[0027]
本发明还涉及一种组合物,可通过冻干如本文中所公开的水性组合物获得。
[0028]
另外,本发明涉及一种组合物,如本文中所公开,用作药物。
[0029]
此外,本发明涉及一种组合物,如本文中所公开,用于治疗表征为人类或动物细胞异常生长的细胞生长病症。
[0030]
此外,本发明涉及一种制备如本文中所公开的组合物的方法,其包含:
[0031]
(i)制备至少一条双链聚核糖核苷酸、或其盐或溶剂合物的水溶液,和至少一条聚亚烷基亚胺、或其盐或溶剂合物的水溶液,其中任一个或两个溶液任选地进一步包含医药学上可接受的载剂、有机溶剂、赋形剂和/或佐剂;
[0032]
(ii)独立地通过孔径小于或等于500nm的过滤器过滤每一种溶液,形成无菌溶液;
[0033]
(iii)通过在混合室中将所述溶液中的一种添加到另一种溶液中,任选地以大于或等于1ml/min的速率通过注射,或通过同时添加所述溶液中的每一种到所述混合室中,任选地以大于或等于1ml/min的速率通过注射,在所述混合室中混合所得无菌溶液,形成水性组合物;以及任选地
[0034]
(iv)通过孔径小于或等于600nm的过滤器过滤所得水性组合物,形成滤液,或以大于或等于22480m/s2离心所得水性组合物,形成上清液;和/或
[0035]
(v)冻干所得水性组合物、滤液或上清液。
[0036]
优选地,本发明还涉及一种组合物,包含粒子,其中:
[0037]
(i)所述粒子中的每一个包含至少一条双链聚核糖核苷酸、或其盐或溶剂合物与至少一条聚亚烷基亚胺、或其盐和/或溶剂合物的复合物,其中
[0038]
(a)所述双链聚核糖核苷酸是聚肌苷酸-聚胞苷酸[poly(i:c)]或聚腺苷酸-聚尿苷酸[poly(a:u)],至少60%的所述双链聚核糖核苷酸具有至少850个碱基对,至少70%的所述双链聚核糖核苷酸具有400个与5000个之间的碱基对,且20%与45%之间的所述双链聚核糖核苷酸具有400个与850个之间的碱基对;以及
[0039]
(b)所述聚亚烷基亚胺包含至少95%的聚乙烯亚胺,其中所述聚亚烷基亚胺的重量平均分子量在17kda与23kda之间,且多分散指数<1.5,且其中组合物中的所述聚亚烷基亚胺的氮摩尔数比所述双链聚核糖核苷酸的磷摩尔数的比率在2.5与5.5之间;
[0040]
(ii)至少99%的所述粒子的直径小于或等于600nm;以及
[0041]
(iii)所述粒子的z平均直径在30nm与150nm之间。
[0042]
更优选地,本发明还涉及一种水性组合物,其包含粒子,其中:
[0043]
(i)所述粒子中的每一个包含至少一条双链聚核糖核苷酸、或其盐或溶剂合物与至少一条聚亚烷基亚胺、或其盐和/或溶剂合物的复合物,其中
[0044]
(a)所述双链聚核糖核苷酸是聚肌苷酸-聚胞苷酸[poly(i:c)],其中至少60%的所述poly(i:c)具有至少850个碱基对,至少70%的所述poly(i:c)具有400个与5000个之间的碱基对,且20%与45%之间的所述poly(i:c)具有400个与850个之间的碱基对;以及
[0045]
(b)所述聚亚烷基亚胺是聚乙烯亚胺(pei),其中所述pei的重量平均分子量在17.5kda与22.6kda之间,且多分散指数<1.5,且其中所述组合物中的所述聚亚烷基亚胺的氮摩尔数比所述双链聚核糖核苷酸的磷摩尔数的比率在2.5与4.5之间;
[0046]
(ii)至少99%的所述粒子的直径小于或等于500nm;
[0047]
(iii)所述粒子的z平均直径在60nm与130nm之间;以及
[0048]
(iv)所述粒子的中值直径(d50%)在75nm与150nm之间。
[0049]
其它实施例涉及这种呈bo-11x调配物形式的组合物的制备,其特征、其分析和其用途提供于具体实施方式和以下实施例中。
[0050]
本发明还涉及以下实施方式:
[0051]
方式1.一种水性组合物,包含一或多种粒子,其中
[0052]
(a)每一个粒子包含至少一条双链聚核糖核苷酸、或其盐或溶剂合物与至少一条聚亚烷基亚胺或其盐和/或溶剂合物的复合物,其中
[0053]
(i)所述双链聚核糖核苷酸是聚肌苷酸-聚胞苷酸[poly(i:c)],
[0054]
其中至少60%的所述双链聚核糖核苷酸具有至少850个碱基对,至少70%的所述双链聚核糖核苷酸具有400个与5000个之间的碱基对,且20%与45%之间的所述双链聚核糖核苷酸具有400个与850个之间的碱基对;以及
[0055]
(ii)所述聚亚烷基亚胺包含至少95%个直链聚乙烯亚胺,
[0056]
其中所述直链聚亚烷基亚胺的平均分子量在17kda与23kda之间,且多分散指数<1.5,和
[0057]
其中所述组合物中的所述聚亚烷基亚胺的氮的摩尔数比所述双链聚核糖核苷酸的磷的摩尔数的比率在2.5与5.5之间;以及
[0058]
(b)所述粒子的z平均直径在30nm与150nm之间,根据iso 22412测量。
[0059]
方式2.根据方式1所述的组合物,其中至少99%的所述粒子的单峰直径分布低于600nm。
[0060]
方式3.根据方式1所述的组合物,其中所述组合物的ζ电位在35mv与50mv之间。
[0061]
方式4.根据方式1到3中任一项所述的组合物,其中所述直链聚亚烷基亚胺是水可溶的同质聚亚烷基亚胺或异质聚亚烷基亚胺。
[0062]
方式5.根据前述方式中任一项所述的组合物,其中所述聚核糖核苷酸组合物含有呈至少0.5mg/ml浓度的聚肌苷酸-聚胞苷酸[poly(i:c)]。
[0063]
方式6.根据前述方式中任一项所述的组合物,其中所述组合物进一步包含:
[0064]
(a)至少一种医药学上可接受的载剂、有机溶剂、赋形剂和/或佐剂;和/或
[0065]
(b)至少一种选自有机化合物、无机化合物、核酸、适体、肽和蛋白质的化合物。
[0066]
方式7.根据方式1所述的组合物,其中所述组合物进一步包含呈1%与10%重量/体积的组合物之间的浓度的葡萄糖或甘露醇。
[0067]
方式8.根据前述方式中任一项所述的组合物,其中组合物进一步包含:
[0068]
(a)2与4之间的ph;和/或
[0069]
(b)200与600mosm/kg之间的渗透性。
[0070]
方式9.根据前述方式中任一项所述的组合物,其中所述组合物通过由至少0.5mg聚肌苷酸-聚胞苷酸[poly(i:c)]每ml的所述组合物的总体积制备复合物形成。
[0071]
方式10.根据前述方式中任一项所述的组合物,其中所述组合物通过以1%与10%重量/体积的所述组合物之间的浓度另外添加葡萄糖或甘露醇形成。
[0072]
方式11.一种组合物,通过冻干根据前述方式中任一项所述的水性组合物获得。
[0073]
方式12.一种根据前述方式中任一项所述的组合物,用作药物,任选地其中所述药物是可注射的水性组合物,任选地进一步包含医药学上可接受的载剂、赋形剂和/或佐剂。
[0074]
方式13.一种根据方式1到12中任一项所述的组合物,用于治疗表征为人类或动物细胞异常生长的细胞生长病症,其中所述细胞生长病症是表征为雌性哺乳动物生殖器官细胞异常生长的癌症或妇科病症。
[0075]
方式14.根据方式12使用的组合物,其中所述组合物通过瘤内或瘤周注射或通过注射到皮肤或内部器官或组织中给药。
[0076]
方式15.一种生产水性组合物的方法,包含:
[0077]
(a)提供(i)至少一条双链聚核糖核苷酸、或其盐或溶剂合物的水溶液和(ii)至少一条直链聚亚烷基亚胺、或其盐或溶剂合物的水溶液,其中任一个或两个溶液任选地进一步包含医药学上可接受的载剂、有机溶剂、赋形剂和/或佐剂;
[0078]
(b)独立地通过孔径小于或等于500nm的过滤器过滤步骤(a)的每一种相应水溶液,形成相应无菌溶液;以及
[0079]
(c)通过同时添加每一种相应无菌溶液到混合室中,任选地以大于或等于1ml/min的速率通过注射,或通过在所述混合室中依序添加一个无菌溶液到另一种无菌溶液中,任选地以大于或等于1ml/min的速率通过注射,在所述混合室中混合每一种相应所得无菌溶液,形成根据方式1所述的水性组合物;以及任选地
[0080]
(d)通过孔径小于或等于600nm的过滤器过滤步骤(c)的所述所得水性组合物,形成滤液,或在大于或等于22480m/s2下离心所述所得水性组合物,形成上清液。
[0081]
方式16.根据方式15所述的方法,进一步包含:
[0082]
(e)冻干所述所得水性组合物、滤液或上清液。
附图说明
[0083]
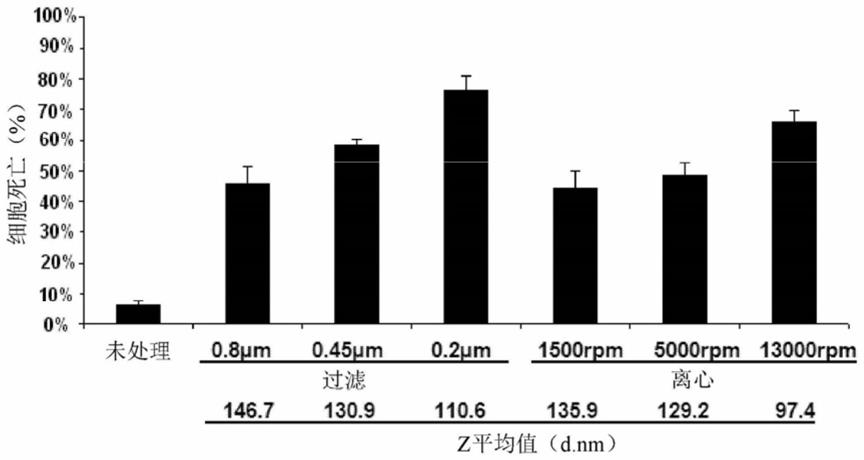
图1a至图1b:不同bo-111制剂在过滤或离心之后通过分析黑素瘤细胞sk-mel-103在48小时暴露之后的细胞死亡的功能活性。(图1a):根据实施例1中的2-小瓶制造方法,poly(i:c)分子与pei结合,形成bo-111复合物,且所得溶液使用具有不同孔径的膜过滤(且接着使用导流溶液用于基于细胞的分析)或在不同速度下离心(且接着使用上清液用于基于细胞的分析),产生不同bo-111制剂,其中的每一个含有较均质、较小尺寸的poly(i:c)基复合物,所述尺寸测定为z平均值(流体动力学直径,表述为d.nm)。定性类似数据通过测试在24小时处的细胞死亡获得。将细胞死亡数据与未用bo-111处理的样本相比。(图1b):通过经0.8μm过滤器(阴影柱)过滤获得bo-111制剂当相比于对应未过滤的bo-111制剂(白色柱)时的剂量反应活性。由于离心或过滤产生一些poly(i:c)损耗,这是由于较大的复合物沉降或保留(分别地),每一种不同bo-111制剂中的poly(i:c)量通过在260nm波长下进行分光光度法分析定量,以便通过因此稀释呈适当浓度的初始制剂正确地比较这种制剂对于的细胞的效果。定性类似数据通过测试在12、24和36小时处的细胞死亡获得。细胞死亡通过如文献中所描述的台盼蓝分析测定。使用相同实验的每一种条件的三个重复数据计算标准差。
[0084]
图2a至图2b:pei特征对于bo-111功能活性的效果,如使用图1a至图1b相同的基于细胞的分析和bo-111浓度测定。(图2a):不同bo-111制剂通过使用可商购的含有具有不同分子量(以千道尔顿作为单位表达;nt:对照,未处理细胞;这种jetpei制剂呈现单峰分布,其中多分散指数低于1.5,特定来说在1.1与1.4之间)的直链聚合物的jetpei制剂获得。(图2b):不同bo-111制剂通过调节比率n/p(1.2到5.3)获得,所述比率计算为:μl pei
×
150nm/μg poly(i:c)
×
3nmol,其中150nm是指pei中的氮残基的浓度,且3nmol是指每1μg poly(i:c)的阴离子磷酸根的纳摩尔数。每一种组合的药理学效果通过比较黑素瘤细胞和黑色素细胞(对照细胞;nt:对照,为处理细胞)两种中的细胞死亡百分比测定。如图1a至图1b中所描述的相同poly(i:c)制剂用于(图1a)和(图1b)中描述但应用“快速吸液”方法的所有bo-111制剂,在含有pei溶液的小瓶中使用注射器快速注射poly(i:c)溶液,从而增加混合速度(至少如其可视觉地测定)。使用相同实验的每一种条件的三个重复数据计算标准差。
[0085]
图3a至图3c:通过电泳对于在bo-111制剂内的poly(i:c)分子的分析。(图3a):以0.8%琼脂糖凝胶(1小时电泳)将未标记的初始poly(i)或poly(i:c)分子的制剂与增加量的bo-111制剂相比。与尺寸标记物相比测定poly(i:c)分子的分子尺寸。(图3b):使用暴露于照相胶片的1%琼脂糖凝胶(1小时电泳),将放射性标记的poly(i:c)分子与未标记的poly(i:c)相比和与bo-111制剂,包括相同放射性标记的poly(i:c)相比。在图3a中不可见的不同bo-111制剂内的poly(i:c)分子如阻断在琼脂糖凝胶的孔内出现在图3b中,这是由于其与jetpei结合,形成电场不能跨越琼脂糖凝胶位移的粒子(由于其大小和/或电荷分布)。(图3c):以0.8%琼脂糖凝胶(1小时电泳),将未标记的poly(i:c)分子与通过调节比率n/p(1.2、3和5.3;这个值如在图2a-图2b中计算)获得的不同bo-111制剂相比。在负载在琼脂糖凝胶上之前,每一个样本未处理(c+)或用特异性降解酶(rna酶;rna酶a:5μg/ml历经30分钟)处理,以评价poly(i:c)分子在不同bo-111制剂中的稳定性。当与jetpei以较高n/p比
率(大于或等于3)复合时,poly(i:c)分子对于这种酶呈现不敏感;且当n/p比率低于3时,一个poly(i:c)分子涂片呈现释放的。在图3a和图3c中,与尺寸标记物相比,测定poly(i:c)分子的分子尺寸。
[0086]
图4a-图4d:bo-111复合物在使用2-小瓶生产方法获得的制剂中的尺寸分布,如通过使用动态光散射通过zeta sizer纳米zs技术比较信号强度测定。(图4a):使用通过使用相同生产方法获得的三个不同bo-111批次进行粒子直径分布的比较。(图4b):当暴露(或不暴露,样本指示为对照)于在室温下在搅动下的培育30分钟时,不同bo-111制剂的比较。(图4c):当暴露(或不暴露,样本指示为对照)于在50℃下的培育30分钟时长时。不同bo-111制剂的比较。(图4d):不同bo-111制剂、如实施例1所示的对照产品和“缓慢混合”样本的通过三个重复曲线评价的比较,其通过逐滴方法使用减少的混合速度获得。考虑以纳米为单位(d.nm)的粒子直径,评价粒径。
[0087]
图5a-图5c:gmp制造bo-11x化合物,如以bo-112示例,的流程。(图5a):概述制造作为包含poly(i:c)分子、可商购的jetpei制剂和葡萄糖的gmp顺应性药物制剂的bo-112化合物的主要步骤的流程图。(图5b):使用折射率检测(rl)分析的bo-112、jetpei和葡萄糖样本的渗透色谱图。bo-112信号与葡萄糖信号重叠,而在13.75ml的保留体积下游离jetpei的特征峰消失,表明所有初始jetpei并入到bo-112中。(图5c):由于增加在以较低(低于100rpm)或以较高(超过100rpm,高达550rpm)注射速度制备制程期间的混合速度,bo-112化合物分布的变化,其中550rpm是在bo-112制造方法中混合溶液的参考速度,其针对z平均直径(d.nm)从约100nm降到73nm、54nm或更低的粒子获得(功能性bo-112制剂的平均直径呈现在30nm与150nm之间;粒子直径如先前图中所定义,d.nm)。
[0088]
图6a-图6b:不同poly(i:c)调配物的结构性分析。(图6a):不同poly(i:c)制剂的分子尺寸以琼脂糖凝胶使用尺寸标记物测定。(图6b):将bo-112复合物的尺寸分布与三个含poly(i:c)的可商购的产物(poly-iclc、lyovec-hmw和lyovec-lmw;粒径如先前图中所定义,nm)相比。
[0089]
图7a-图7d:测定bo-112(图7a)、poly-iclc(图7b)、lyovec-hmw(图7c)和lyovec-lmw(图7d)在-20℃下存储后的尺寸分布的改变,如通过使用nanosizer技术比较信号强度测定(粒子直径如先前图中所定义,nm)。
[0090]
图8a-图8c:不同poly(i:c)调配物对于两个不同癌细胞模型的细胞存活力的效果。将bo-112与未处理细胞相比,且与用poly-iclc、lyovec-lmw或lyovec-hmw处理的细胞相比,所测试的每一种调配物在根据复合物重量测定的指示浓度下,但具有黑素瘤(图8a)或胰脏癌(图8b)细胞模型任一个中的poly(i:c)分子的类似含量。细胞存活力数据使用在24小时之后的结晶紫分析方法产生。(图8c):不同poly(i:c)调配物对于所关注治疗性的信号传导分子的效果。通过在暴露于bo-112、poly-iclc(或未处理的,nt)8、16和24小时的sk-mel-103细胞中进行rt-qpcr方法评价干扰素-β(ifn-β)表达。在提供类似含量的poly(i:c)分子的浓度下使用bo-112和poly-iclc调配物。
[0091]
图9:单独直链pei、poly(i:c)和两个不同pei/poly(i:c)调配物(bo-110和bo-112;)对于正常、原代黑色素细胞(制剂1号和2号)和四个癌细胞系的存活力的效果,表明这种pei/poly(i:c)调配物针对癌细胞系的特异性细胞毒性。用于仅poly(i:c)、bo-110和bo-112给药治疗制剂中的poly(i:c)含量相同(1μg/ml每40小时的治疗)。
[0092]
图10a-图10b:对于在动物模型中bo-112给药针对人类癌症的效果。(图10a):展示治疗时间表的时间线。所有小鼠均在第0天皮下注射b16-f10鼠黑素瘤细胞。在将小鼠随机化为在第7天呈现类似肿瘤平均尺寸(80到100mm3)的五个组之后,用bo-112调配物(双圆圈)处理,所述处理通过在组2、3和4(g2、g3、g4)中以3个不同浓度或在剩余两个组(g1和g5)中仅用媒剂,直接注射到肿瘤组织(i.t.治疗)中。在治疗后的天(10、14、17、21和24),除了g1的所有组,除在第7天以相同浓度瘤内给药bo-112调配物以外,均接受腹膜内(i.p.)给药抗pd-l1鼠抗体(150μg/剂量)。每日监测存活,且在发现小鼠已故后或当肿瘤体积达到最大所允许尺寸时,将其记分为死亡。在上一次治疗之后继续监测直至第45天,当最后的小鼠死亡且实验终止时。(图10b):比较对照组g1和g5与以所指示三个浓度给药bo-112调配物的三个组的存活曲线。当比较各组时,在对照组与测试组之间存在统计学差异(p<0.0001,log-rank mantel-cox测试),其中g4展示存活相对于单独媒剂或抗pd-l1的最强增加。
具体实施方式
[0093]
本发明涉及一种组合物,包含粒子,其中:
[0094]
(i)所述粒子中的每一个包含至少一条双链聚核糖核苷酸、或其盐或溶剂合物与至少一条聚亚烷基亚胺、或其盐和/或溶剂合物的复合物;
[0095]
(ii)至少95%的所述粒子的直径小于或等于600nm,优选地,小于或等于300nm;以及
[0096]
(iii)所述粒子的z平均直径小于或等于200nm,优选地小于或等于150nm,特定来说,如根据iso 22412所测量。
[0097]
在一优选实施例中,本发明涉及一种水性组合物,包含粒子,其中
[0098]
(i)所述粒子中的每一个包含至少一条双链聚核糖核苷酸、或其盐或溶剂合物与至少一条聚亚烷基亚胺、或其盐和/或溶剂合物的复合物,其中所述双链聚核糖核苷酸是聚肌苷酸-聚胞苷酸[poly(i:c)],且所述直链聚亚烷基亚胺的平均分子量在17kda与23kda之间。
[0099]
(ii)至少90%的所述粒子的单峰直径分布低于300nm;
[0100]
(iii)所述粒子的z平均直径小于或等于150nm,如根据iso 22412所测量;以及
[0101]
(iv)所述组合物的ζ电位等于或大于30mv,根据iso 13099
[0102]
本发明还涉及一种水性组合物,包含如本文中所公开的粒子,其中:
[0103]
(i)所述粒子中的每一个通过制备至少一条双链聚核糖核苷酸、或其盐或溶剂合物与至少一条直链聚亚烷基亚胺、或其盐和/或溶剂合物的复合物形成,其中所述双链聚核糖核苷酸是聚肌苷酸-聚胞苷酸[poly(i:c)],且所述直链聚亚烷基亚胺的平均分子量在17kda与23kda之间;
[0104]
(ii)至少90%的所述粒子的单峰直径分布低于300nm;
[0105]
(iii)所述粒子的z平均直径小于或等于150nm,如根据iso 22412所测量;以及
[0106]
(iv)所述组合物的ζ电位等于或大于30mv,根据iso 13099;
[0107]
其中所述粒子以所述组合物中的所述聚亚烷基亚胺的氮的摩尔数比所述双链聚核糖核苷酸的磷的摩尔数等于或大于2.5的比率形成。
[0108]
由所述复合物组成和通过所述复合物形成的粒子可呈现其它特征,根据本公开下
文,使得在其它实施例中,所述粒子可包含其它组分,如赋形剂,如甘露醇或葡萄糖,或不存在其它元件,如癌症靶向官能性或其它部分和连接子。当在组合物内[即在液体(水溶液)或冻干调配物内]提供粒子且分析时,如当如单峰尺寸分布在特定范围,例如,30nm与150nm之间,内所定义时,或当组合物特征为不存在单链聚核糖核苷酸分子(如通过较低浓色效应或不存在浓色效应建立)时,其它特征可在其它优选实施例中定义。如根据管理批准所需的国际建立标准定义的其它特征和/或优良制造工艺公开在下文中。
[0109]
在本发明组合物的一优选实施例中,包含于所述组合物中的至少40%的双链聚核糖核苷酸具有至少850个碱基对,且包含于所述粒子中的至少50%的双链聚核糖核苷酸具有400个与5000个之间的碱基对。此外,包含于复合物中的双链聚核糖核苷酸可呈现特定范围的长度,所述长度范围由其制备方法和/或根据所需用途定义。举例来说,包含于所述粒子中的至少40%、50%、60%或任何其它较高百分比的双链聚核糖核苷酸可具有至少850个碱基对,且包含于所述粒子中的至少50%、60%、70%或任何其它较高百分比的双链聚核糖核苷酸可具有400个与5000个之间的碱基对。可定义包含于所述粒子中的双链聚核糖核苷酸的额外范围为:
[0110]
(i)5%与60%之间(并优选地10%与30%之间)的具有小于400个碱基对的双链聚核糖核苷酸;
[0111]
(ii)20%与45%之间(或15%与30%之间,但优选地20%与30%之间)的具有400个与850个之间的碱基对的双链聚核糖核苷酸;
[0112]
(iii)20%与70%之间(并优选地50%与60%之间)的具有850个与5000之间的碱基对的双链聚核糖核苷酸;和/或
[0113]
(iv)0%与10%之间(并优选地1%或更低)的具有多于5000个碱基对的双链聚核糖核苷酸。
[0114]
因此,在本发明组合物的更优选实施例中,包含于所述组合物中的至少50%的双链聚核糖核苷酸具有至少850个碱基对,且包含于所述组合物中的至少60%的双链聚核糖核苷酸具有400个与5000个之间的碱基对。然而更优选地,包含于所述组合物中的至少60%的双链聚核糖核苷酸具有至少850个碱基对,包含于所述组合物中的至少70%的所述双链聚核糖核苷酸具有400个与5000个之间的碱基对,且20%与45%之间的所述双链聚核糖核苷酸具有400个与850个之间的碱基对。甚至更优选地,包含于所述组合物中的至少60%的双链聚核糖核苷酸具有至少850个碱基对,包含于所述组合物中的至少70%的所述双链聚核糖核苷酸具有400个与5000个之间的碱基对,20%与30%之间的所述双链聚核糖核苷酸具有400个与850个之间的碱基对,且10%与30%之间的所述双链聚核糖核苷酸具有小于400个碱基对。
[0115]
在本发明的一个实施例中,双链聚核糖核苷酸优选地是聚肌苷酸-聚胞苷酸[poly(i:c)]分子或聚腺苷酸-聚尿苷酸[poly(a:u)]分子。更优选地,双链聚核糖核苷酸是聚肌苷酸-聚胞苷酸[poly(i:c)]分子。所述双链聚核糖核苷酸分子包含例如分别地与poly(c)和poly(u)配对因此形成双链聚核糖核苷酸的poly(i)和poly(a)的链,其中每一条链可包含高达5%的不同于所述链中的大部分核糖核苷酸的核糖核苷酸和/或包含高达5%的错配碱基对,更优选地高达1%的不同于所述链中的大部分核糖核苷酸的核糖核苷酸和/或包含高达1%的错配碱基对。视所选择的聚核糖核苷酸和/或产生所述复合物的方法而定,包含
于复合物中的聚核糖核苷酸的一部分还可包含单链(即未配对的)聚核糖核苷酸。
[0116]
在一优选实施例中,这些粒子和组合物内的游离、单链聚核糖核苷酸的含量基于增色性(或浓色效应)评价。这种效应是由于当双螺旋结构变性时双链多核苷酸的光密度(吸光度)增加所致。聚核苷酸的uv(紫外光)吸收在通过加热或通过添加变性剂或通过增加ph水平而分离两条单链时增加。因此,增色性可用于检查粒子内的poly(i:c)或poly(a:u)分子的结构随着温度(或另一条件)的变化,从而分别地测定poly(i:c)分子中的poly(i)与poly(c)链之间的分离或poly(a:u)分子中的poly(a)链与poly(u)链之间的分离。优选地,粒子中的单链poly(i)分子与poly(c)分子或单链poly(a)分子与poly(u)分子的这种含量尽可能低,如通过使用标准设备和方案测量在260nm波长区中光的吸光度测定。举例来说,这种效果可使用分光光度计和根据欧洲药典(2.2.25;吸收分光光度法,紫外光和可见光)测量。特定来说,在20℃与80℃之间,在260nm下的吸收上,本文中所公开的组合物呈现小于20%的增加,在20℃与80℃之间,在260nm下的吸收上,优选地小于10%,更优选地小于5%,甚至更优选地小于1%的增加。替代地,在室温与40℃、50℃、60℃、70℃、80℃和90℃之间,本文中所公开的组合物展示小于0.2的透射率的增加。这个值可测量为在260nm下的吸光度(a)或在室温下的透射率(1/a),且接着计算与在前述较高温度下的吸光度或透射率的相应值的差异。
[0117]
在本发明组合物的一优选实施例中,聚亚烷基亚胺、或其盐和/或溶剂合物是直链、分支链和/或树突状的,更优选地所述聚亚烷基亚胺是直链聚亚烷基亚胺。在一优选实施例中,所述聚亚烷基亚胺是同质聚亚烷基亚胺或异质聚亚烷基亚胺。聚阳离子同质聚合物或异质聚合物优选地包含由胺基和至少一两个碳原子间隔形成的重复单元,因此包含直链或分支链和/或树突状的同质聚亚烷基亚胺或异质聚亚烷基亚胺聚合物。聚亚烷基亚胺的实例是聚乙烯亚胺、聚丙烯亚胺、聚丁烯亚胺和聚戊烯亚胺,这些均聚物中的任一种的混合聚合物、或任何可商购的或以其它方式公开的衍生物。这种聚亚烷基亚胺聚合物优选地是水可溶的。在本发明的一尤其优选的实施例中,所述聚亚烷基亚胺是水可溶的、直链同质聚亚烷基亚胺或异质聚亚烷基亚胺。在一甚至更优选的实施例中,所述聚亚烷基亚胺尤其包含水可溶直链同质聚亚烷基亚胺,更优选地其包含至少75%的直链聚乙烯亚胺,又更优选地95%的直链聚乙烯亚胺。在本发明组合物的再更优选的实施例中,所述聚亚烷基亚胺是聚乙烯亚胺(也称为pei)。因此,在一尤其优选实施例中,所述聚亚烷基亚胺是直链聚乙烯亚胺。
[0118]
在本发明组合物的另一优选实施例中,所述聚亚烷基亚胺的重量平均分子量在17kda与23kda之间,再更优选地在17.5kda与22.6kda之间,且分子量多分散指数<1.5。根据iso 16014:2012,优选地通过凝胶渗透色谱法(gpc),根据iso 16014-2:2012,测定聚烷醚前体到所述聚亚烷基亚胺的所述重量平均分子量和所述多分散指数。多分散指数计算为m
w
/m
n
(重量平均分子量/数量平均分子量),且小于1.5。
[0119]
在本发明组合物的另一优选实施例中,所述组合物中的所述聚亚烷基亚胺的氮的摩尔数比所述双链聚核糖核苷酸的磷的摩尔数的比率等于或大于2.5,更优选地在2.5与5.5之间,再更优选地在2.5与4.5之间,另外优选地在2.5与3.5之间。这个比率在于组合物内形成粒子和提供具有所需效果和特性的组合物时尤其重要。
[0120]
因此,如上文所提及,本发明涉及一种水性组合物,包含如本文中所公开的粒子,
其中:
[0121]
(i)所述粒子中的每一个通过制备至少一条双链聚核糖核苷酸、或其盐或溶剂合物与至少一条直链聚亚烷基亚胺、或其盐和/或溶剂合物的复合物形成,其中所述双链聚核糖核苷酸是聚肌苷酸-聚胞苷酸[poly(i:c)],且所述直链聚亚烷基亚胺的平均分子量在17kda与23kda之间;
[0122]
(ii)至少90%的所述粒子的单峰直径分布低于300nm;
[0123]
(iii)所述粒子的z平均直径小于或等于150nm,如根据iso 22412所测量;以及
[0124]
(iv)所述组合物的ζ电位等于或大于30mv,根据iso 13099;
[0125]
其中所述粒子以所述组合物中的所述聚亚烷基亚胺的氮的摩尔数比所述双链聚核糖核苷酸的磷的摩尔数等于或大于2.5的比率形成,所述比率更优选地在2.5与5.5之间,再更优选地在2.5与4.5之间,另外优选地在2.5与3.5之间。在一另外优选实施例中,所述组合物通过由至少0.5mg聚肌苷酸-聚胞苷酸[poly(i:c)]每ml的总(即最终)体积的所述组合物,更优选地由至少2.0mg的poly(i:c)每ml的总体积的所述组合物,的复合物制备形成。因此,在本发明的一尤其优选的实施例中,双链聚核糖核苷酸是聚肌苷酸到聚胞苷酸[poly(i:c)]或聚腺苷酸-聚尿苷酸[poly(a:u)],其中至少60%的所述双链聚核糖核苷酸具有至少850个碱基对(bp),至少70%的所述双链聚核糖核苷酸具有400个与5000个之间的碱基对,且20%与45%之间的所述双链聚核糖核苷酸具有400个与850个之间的碱基对;且聚亚烷基亚胺包含至少95%个聚乙烯亚胺,其中所述聚亚烷基亚胺的重量平均分子量在17kda与23kda之间,且多分散指数<1.5,且其中用于形成所述组合物的所述聚亚烷基亚胺的氮的摩尔数比所述双链聚核糖核苷酸的磷的摩尔数的比率(即用于形成所述粒子的所述聚亚烷基亚胺的氮的摩尔数比所述双链聚核糖核苷酸的磷的摩尔数的比率)在2.5与5.5之间。
[0126]
在本发明的一甚至更优选尤其优选的实施例中,双链聚核糖核苷酸是聚肌苷酸-聚胞苷酸[poly(i:c)],其中至少60%的poly(i:c)分子具有至少850个碱基对,至少70%的所述poly(i:c)分子具有400个与5000个之间的碱基对,20%与30%之间的所述poly(i:c)分子具有400个与850个之间的碱基对,且10%与30%之间的所述poly(i:c)分子具有小于400个碱基对;且聚亚烷基亚胺是聚乙烯亚胺,其中所述聚亚烷基亚胺的重量平均分子量在17.5kda与22.6kda之间,且多分散指数<1.5(如在0.1与0.6之间,如在组合物内所测量),且其中用于形成所述组合物的所述聚乙烯亚胺的氮的摩尔数比所述poly(i:c)的磷的摩尔数的比率(即用于形成所述粒子的所述聚亚烷基亚胺的氮的摩尔数比所述双链聚核糖核苷酸的磷的摩尔数的比率)在2.5与4.5之间。
[0127]
在本发明中,包含于本发明组合物中的粒子的直径的z平均直径和多分散指数通过动态光散射(dls)技术基于所述粒子各向同性和球形形状的假设测定。特定来说,z-平均直径(ζ平均直径)是指所述粒子的加权算术平均流体动力学直径,如根据行业标准iso 22412:2008所测定。另外,行业标准iso 22412:2008提供呈多分散指数形式的粒子直径(尺寸)分布的测量,且允许得出称为d50%(低于其,50%的样本强度下降的最大粒子直径,也称为中值直径)、d90%(低于其,90%的样本强度下降的最大粒子直径)、d95%(低于其,95%的样本强度下降的最大粒子直径)和d99%(低于其,99%的样本强度下降的最大粒子直径)的百分点(d值)的计算。因此,基于呈现于iso 22412中的方法论,有可能确定,包含于本发明组合物中的至少95%(d95)或优选地90%(d90)的粒子的直径小于或等于600nm,更
优选地小于或等于300nm,且所述粒子的z平均直径小于或等于200nm,更优选地小于150nm。
[0128]
在本发明组合物的一优选实施例中,所述粒子具有单峰直径分布,特定来说,在上文所指示的亚微米范围内。实际上,在一个方面中,本发明的水性组合物包含粒子,其中至少90%的所述粒子的单峰直径分布低于300nm,其中所述粒子的z平均直径小于或等于150nm,如根据iso 22412所测量。可仍存在(但在任何情况下,低于欧洲药典中所指示的极限值)的尺寸大于这种值(例如在微米范围中,如高于10μm)的粒子(或其集聚物)可通过在生产结束时和/或刚好在给药之前过滤(例如通过0.8微米过滤器)移除。因此,包含于这种组合物中的所有或较大部分的粒子可在组合物内呈现单峰直径分布,如实施例中所展示,所述单峰直径分布在其制备期间建立,且可根据所需用途和/或存储维持和调适。
[0129]
在本发明的另一优选实施例中,至少95%或90%的所述粒子的直径小于或等于600nm(即低于其,95%或90%的样本强度下降的最大粒子直径=d95%或d90%,=600nm)更优选地直径不超过500nm,再更优选地直径不超过400nm,且又更优选地直径不超过300nm。在这种限制内,甚至更优选地,至少99%的所述粒子的直径小于或等于600nm,又更优选地至少99%的所述粒子的直径小于或等于500nm,更优选许多地至少99%的所述粒子的直径小于或等于400nm,且又更优选地直径不超过300nm。另一方面,在一优选实施例中,所述粒子的中值直径(d50%)在75nm与150nm之间,更优选地在80nm与130nm之间,且d90%在140nm与250nm之间,更优选地在170nm与240nm之间。
[0130]
在本发明的另一优选实施例中,所述粒子的z平均直径低于150nm,并且更优选在30nm与150nm之间(如另外优选地在50nm与150nm之间,在75nm与150nm之间,在50nm与100nm之间,在100nm与150nm之间,或在60nm与130nm之间)的范围中。更优选地,本发明的水性组合物的所述粒子的单峰直径分布在30nm与150nm之间。
[0131]
因此,在最优选的实施例中:(i)包含于本发明组合物中的至少99%的粒子的直径小于或等于600nm,由此所述粒子的z平均直径在30nm与150nm之间;以及(ii)包含于本发明组合物中的至少99%的粒子的直径小于或等于500nm,由此所述粒子的z平均直径在60nm与130nm之间,且中值直径(d50%)在75nm与150nm之间。
[0132]
在本发明的一优选实施例中,所述组合物可通过冻干本文中所公开的水性组合物获得。因此,本发明组合物可为水性或冻干组合物。因此,本发明组合物(下文bo-11x调配物,其中x可以是整数,使得bo-11x调配物涵盖例如bo-111和bo-112调配物)可以固体(作为粒子的冻干或其它高度浓缩的形式)、半固体(作为凝胶)、或液体形式提供,但优选呈液体组合物(如水性组合物或可注射或吸入的其它类型的颗粒悬浮液)。bo-11x调配物可如此使用、运送和存储,或可用于获得用于特定用途、运送、存储、给药其它化合物和/或其它技术要求的冻干形式。关于冻干方法和设备,经典的冷冻干燥或最近的方法(如电冷冻、超声波控制或冰雾)也通过改变如ph、干燥空速、时间、湿度、压力或温度的参数可适用于操作和生产bo-11x调配物。
[0133]
因此,在一个最优选实施例中,本发明组合物包含粒子,其中:
[0134]
(i)所述粒子中的每一个包含至少一条双链聚核糖核苷酸、或其盐或溶剂合物与至少一条聚亚烷基亚胺、或其盐和/或溶剂合物的复合物,其中
[0135]
(a)所述双链聚核糖核苷酸是聚肌苷酸-聚胞苷酸[poly(i:c)]或聚腺苷酸-聚尿苷酸[poly(a:u)],其中至少60%的所述双链聚核糖核苷酸具有至少850个碱基对,至少
70%的所述双链聚核糖核苷酸具有400个与5000个之间的碱基对,且20%与45%之间的所述双链聚核糖核苷酸具有400个与850个之间的碱基对;以及
[0136]
(b)所述聚亚烷基亚胺包含至少95%的聚乙烯亚胺,其中所述聚亚烷基亚胺的平均分子量在17kda与23kda之间,且多分散指数<1.5,且其中用于形成所述组合物的所述聚亚烷基亚胺的氮的摩尔数比所述双链聚核糖核苷酸的磷的摩尔数的比率(即用于形成所述粒子的所述聚亚烷基亚胺的氮的摩尔数比所述双链聚核糖核苷酸的磷的摩尔数的比率)在2.5与5.5之间;
[0137]
(ii)至少99%的所述粒子的直径小于或等于600nm,优选地至少95%的所述粒子的直径小于或等于400nm;以及
[0138]
(iii)所述粒子的z平均直径在30nm与150nm之间。
[0139]
在另一最优选实施例中,本发明组合物是水性组合物,其包含粒子,其中:
[0140]
(i)所述粒子中的每一个包含至少一条双链聚核糖核苷酸、或其盐或溶剂合物与至少一条聚亚烷基亚胺、或其盐和/或溶剂合物的复合物,其中
[0141]
(a)所述双链聚核糖核苷酸是聚肌苷酸-聚胞苷酸[poly(i:c)],其中至少60%的所述poly(i:c)具有至少850个碱基对,至少70%的所述poly(i:c)具有400个与5000个之间的碱基对,且20%与45%之间的所述poly(i:c)具有400个与850个之间的碱基对;以及
[0142]
(b)所述聚亚烷基亚胺是聚乙烯亚胺(pei),其中所述pei的重量平均分子量在17.5kda与22.6kda之间,且多分散指数<1.5,且其中用于形成所述组合物的所述聚亚烷基亚胺的氮的摩尔数比所述双链聚核糖核苷酸的磷的摩尔数的比率(即用于形成所述粒子的所述聚亚烷基亚胺的氮的摩尔数比所述双链聚核糖核苷酸的磷的摩尔数的比率)在2.5与4.5之间;
[0143]
(ii)至少99%的所述粒子的直径小于或等于500nm,优选地至少95%或90%的所述例子的单峰直径分布低于300nm;
[0144]
(iii)所述粒子的z平均直径在60nm与130nm之间;以及
[0145]
(iv)所述粒子的中值直径(d50%)在75nm与150nm之间。
[0146]
在本发明的一优选实施例中,bo-11x调配物可提供为组合物,所述组合物进一步包含最适于优选的最终形式(如液体或冻干的)、用途、运送、存储、给药其它化合物和/或其它技术要求的医药学上可接受的载剂、赋形剂、有机溶剂和/或佐剂[如甘油、乙醇、葡萄糖或甘露醇,优选地葡萄糖或甘露醇,更优选地呈1%与10%(重量/体积)之间的浓度][即其中所述组合物通过另外添加呈1%与10%(重量/所述组合物的总体积)之间的浓度的葡萄糖或甘露醇形成]。在一优选实施例中,所述组合物进一步包含选自有机化合物、无机化合物、核酸、适体、肽或蛋白质的至少一种化合物。
[0147]
在一个方面中,本发明的水性组合物的ζ电位等于或大于30mv,优选地在35mv与50mv之间或在38mv与45mv之间,再更优选地在40mv与45mv之间,根据iso 13099。
[0148]
在本发明组合物的另一实施例中,所述组合物是具有以下的水性组合物:
[0149]
(i)2与4之间的ph;
[0150]
(ii)200与600mosm/kg之间的渗透性
[0151]
(iii)在589nm波长下在20℃下,当所述水性组合物包含5%(重量/体积)d-葡萄糖于水中,以水作为参考时,+1500与+3750度.ml.g-1
.dm-1
之间的比旋光度;和/或
[0152]
(iv)大于或等于30mv(举例来说,在35mv与50mv之间)的ζ电位。
[0153]
在本发明的一甚至更优选实施例中,所述组合物是具有以下的水性组合物:
[0154]
(i)2与4之间的ph;
[0155]
(ii)200与600mosm/kg之间的渗透性;和/或
[0156]
(iii)大于或等于30mv(举例来说,在35mv与50mv之间)的ζ电位。
[0157]
在一个尤其优选实施例中,所述组合物是包含葡萄糖或甘露醇具有以下的水性组合物:
[0158]
(i)2与4之间的ph;和/或
[0159]
(ii)200与600mosm/kg之间的渗透性。
[0160]
在本发明的一个另外优选实施例中,所述组合物是包含葡萄糖具有以下的水性组合物:
[0161]
(i)2.7与3.4之间的ph;
[0162]
(ii)200与340mosm/kg之间的渗透性;和/或
[0163]
(iii)35mv与50mv之间或38mv与45mv之间,再更优选地40mv与45mv之间的ζ电位。
[0164]
在替代的另外优选实施例中,所述组合物是包含甘露醇具有以下的水性组合物:
[0165]
(i)2.7与3.4之间的ph;
[0166]
(ii)200与600mosm/kg之间的渗透性;和/或
[0167]
(iii)35mv与50mv之间或38mv与45mv之间,再更优选地40mv与45mv之间的ζ电位。
[0168]
为了本发明的目的,本文中报告的渗透性值是严格地渗透性值,但由于水(在其中制成本发明的水性组合物的溶剂)在20℃下的密度接近于1.00g/ml,这些术语互换地使用。为了本发明的目的,室温是指20与25℃之间的温度。
[0169]
在本发明中,根据iso 13099,优选地13099-2:2012测量ζ电位。
[0170]
本发明还涉及一种组合物,如本文中所公开的,用作药物。类似地,因此本发明还涉及如本文中所公开的组合物的用途,用于制备药物。这种用途可通过将组合物提供为液体(水性)或冻干组合物实现,其中poly(i:c)分子和包含其的粒子处于高度稳定的形式且在较高浓度下{例如其中所述组合物通过使用至少0.5mg,0.7mg/ml,0.9mg/ml,高达2.0mg的聚肌苷酸-聚胞苷酸[poly(i:c)]或聚腺苷酸-聚尿苷酸[poly(a:u)]或更高每ml的总(即最终)体积的所述组合物制备复合物形成。
[0171]
这些组合物尤其适用于向癌细胞直接给药,例如借助于瘤内或瘤周注射到包含这种肿瘤和癌细胞的皮肤或内部器官或组织中。在本发明的一优选实施例中,所述药物是可注射的。在本发明的一优选实施例中,所述药物是可注射的水性组合物,任选地包含医药学上可接受的载剂、赋形剂和/或佐剂。这种可注射的水性组合物可如此或在稀释poly(i:c)或poly(a:u)分子的浓缩制剂(在至少0.5mg的poly(i:c)或poly(a:u)/ml的待制成的总体积的组合物的相应浓度或更高浓度下,如当制备关于添加到既定体积的溶液中的poly(i:c)或poly(a:u)分子的相应重量的粒子时所建立)之后或冻干组合物形式提供,以构成总体积的本发明组合物。这意味着,所述组合物以关于在制备复合物中每体积的总水性组合物所采用的poly(i:c)或poly(a:u)的重量所测定前述浓度提供,但适当时可浓缩,尤其对于长期存储和/或瘤内给药。特定来说,具有双链poly(i:c)分子的呈这种较高浓度的bo-11x调配物(即由包含通过每ml的总水性组合物复合至少0.5mg高达0.7mg,优选地0.9mg,更优
选地2.0mg或更高的poly(i:c)与直链pei形成的复合物的粒子制成调配物)最适合于给药且用作药物。在存在肿瘤和癌细胞的一或多个较小或受限位置内瘤内或瘤周注射这类组合物(也视如由医师评价的肿瘤块的实际可接近性和/或尺寸而定),可提供更强和/或更及时的治疗效果。
[0172]
此外,本发明另外涉及一种组合物,如本文中所公开的,用于治疗表征为人类或动物细胞异常生长的细胞生长病症。这种治疗可涉及本发明组合物与另一种治疗性治疗,如另一种癌症特异性药物(例如,靶向癌症抗原或癌症疫苗的抗体)或标准护理治疗(如放疗或化疗)的组合给药。组合给药可不仅提供附加的治疗效果,且还提供其它有价值的效果,如降低实现类似治疗效益所必需的其它药物的剂量,降低副作用,或提供较长持续时间和/或对于肿瘤和癌细胞的协同效应。类似地,因此本发明还涉及所述组合物的用途,如本文中所公开的,用于制备用于治疗表征为人类或动物细胞异常生长的细胞生长病症的药物。为了本发明的目的,异常生长表征为不受控的细胞分裂和/或分化。
[0173]
在一优选实施例中,所述细胞生长病症是表征为雌性哺乳动物生殖器官的细胞异常生长的癌症或妇科病症。本发明中提及的癌症优选地是以下中的一或多种:基底细胞癌;胆道癌;膀胱癌;骨癌;大脑和中枢神经系统癌症;乳癌;腹膜癌;绒膜癌;结缔组织癌症;消化系统癌症(包括食道癌、胃癌、结肠癌、直肠癌或其它胃肠癌);眼癌;头颈癌;神经胶母细胞瘤;肝癌瘤;肝细胞瘤;上皮内肿瘤;肾脏癌、肾上腺或肾癌;白血病;肝癌;肺癌(例如小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞癌);黑素瘤;骨髓瘤;神经母细胞瘤;口腔癌(例如唇癌、喉癌、舌癌、口癌或咽癌);胰脏癌;前列腺癌;成视网膜细胞瘤;横纹肌肉瘤;呼吸系统癌症;唾液腺癌瘤;皮肤癌;鳞状细胞癌;睾丸癌;甲状腺癌;子宫癌、子宫内膜癌、子宫颈癌、外阴癌、卵巢癌或其它妇科癌症;泌尿系统癌症;淋巴瘤,包括b细胞淋巴瘤、霍奇金氏(hodgkin's)和非霍奇金淋巴瘤(nhl;包括特定类型,如轻度/滤泡、小淋巴球性、中度/滤泡、中度扩散、重度成免疫细胞、重度淋巴母细胞、重度小未裂解细胞或肿块性病变nhl);套细胞和aids相关淋巴瘤;慢性淋巴球性白血病;急性淋巴母细胞性白血病;毛状细胞白血病;慢性骨髓母细胞性白血病;以及其它癌瘤和肉瘤;移植后淋巴增生病症(ptld),以及与母斑病或水肿(如与脑瘤关联的那些那些)关联的异常血管增生。更优选地,所述癌症选自以下中的一或多种:膀胱癌;骨癌;大脑和中枢神经系统癌症;乳癌;消化系统癌症(包括食道癌、胃癌、结肠癌、直肠癌或其它胃肠癌);头颈癌;神经胶母细胞瘤;肝癌瘤;肝细胞瘤;肾脏癌、肾上腺癌或肾癌;白血病;肝癌;肺癌;黑素瘤;骨髓瘤;神经母细胞瘤;胰脏癌;前列腺癌;呼吸系统癌症;皮肤癌;睾丸癌;甲状腺癌;子宫癌、子宫内膜癌、子宫颈癌、外阴癌、卵巢癌或其它妇科癌症;泌尿系统癌症;淋巴瘤或白血病。再更优选地,所述癌症选自癌瘤、神经胶瘤、黑素瘤或肉瘤中的一或多种,甚至更优选地黑素瘤、前列腺癌、结肠癌、乳癌或胰脏癌,或替代地黑素瘤或胰脏癌。
[0174]
本发明中所提及的雌性哺乳动物生殖器官是位于阴道与输卵管之间,包括阴道和输卵管,的雌性哺乳动物性器官。本发明的所述生殖器官是子宫、输卵管(包含子宫输卵管接合部)、卵巢、子宫颈和阴道,优选地子宫、输卵管和子宫颈,更优选地哺乳动物子宫。因此,本发明的妇科病症是影响位于阴道与输卵管之间的雌性哺乳动物生殖道,优选地子宫、输卵管和子宫颈,的至少一种细胞的疾病。在本发明中,妇科病症更优选地是影响哺乳动物子宫的组织中的至少一种细胞的疾病。在一最优选实施例中,妇科病症选自子宫内膜异位
或平滑肌瘤。
[0175]
在本发明中,哺乳动物优选地是人、牛、马、犬、猫、绵羊、猪、骆驼、山羊或鹿。此外优选地,所述哺乳动物是人类、狗、牛、马或骆驼,甚至更优选地人类或狗,并且最优选地人类。
[0176]
因此,bo-11x调配物可呈现组分与其它物理化学特征的组合,所述物理化学特征提供所关注医学效果(如治疗癌症、这种黑素瘤或癌瘤),且优选地可通过施用符合规章和工业要求,如适用于药物生产的那些要求,的方法获得。特定来说,bo-11x生产阶段以严格符合在欧洲、美国、日本和/或其它国家中有效的优良生产规范(具体地说附件13)的要求和/或符合药品试验档案(impd)的批准的要求进行。bo-11x调配物应通过针对无菌、纯度、稳定性和生物安全(不存在或大体上不含内毒素、病毒、细菌、化学试剂、金属或与人用不相容的其它污染物)的测试。举例来说,内毒素水平应不大于1.0eu/mg或1μg/ml,使用官方批准的检测试剂盒。
[0177]
进一步表征bo-11x调配物(作为包含于本文中的组合物或粒子)的这种组分和特征可为以下中的一个或多个:
[0178]
(i)一种组合物,包含医药学上可接受的载剂、赋形剂和/或佐剂,具有或不具有任何其它具有医学价值的有机化合物(如溶剂)、无机化合物、核酸、适体、肽或蛋白质,其包含于粒子本身(例如在其生产期间)中或稍后添加到包含这些粒子的组合物中;
[0179]
(ii)由聚亚烷基亚胺(如直链pei)形成的粒子,特定来说重量平均分子量在17kda与23kda之间,更优选地在17.5kda与22.6kda之间;
[0180]
(iii)一种组合物,包含通过使用在至少0.5mg/ml的总(即最终)体积的所述组合物的浓度(举例来说,0.5mg/ml高达0.7mg/ml、0.9mg/ml、2mg/ml或更高)下的双链聚核糖核苷酸制备复合物形成的粒子;
[0181]
(iv)粒子,包含以所述聚亚烷基亚胺的氮的摩尔数比所述双链聚核糖核苷酸的磷的摩尔数的比率(即用于形成所述粒子的所述聚亚烷基亚胺的氮的摩尔数比所述双链聚核糖核苷酸的磷的摩尔数的比率)等于或大于2.5,更优选地在2.5与5.5之间,再更优选地2.5与4.5之间,另外优选地2.5与3.5之间形成的聚亚烷基亚胺和双链聚核糖核苷酸;
[0182]
(v)粒子,具有单峰直径分布,其中z平均直径,如本文所定义且根据iso 22412测量,优选地低于200nm,更优选地低于150nm,并且甚至更优选地在150nm与30nm之间(如在150nm与50nm之间,在150nm与75nm之间,在100nm与50nm之间,在150nm与100nm之间,或在60nm与130nm之间)的范围内;
[0183]
(vi)粒子,具有由根据iso 22412的直径分布测定的单峰直径分布,所述直径分布由d值表示,d50%(低于其,50%的样本强度下降的最大粒子直径,也称为中值直径)在75nm与150nm之间,且d90%(低于其,90%的样本强度下降的最大粒子直径)在140nm与250nm之间;
[0184]
(vii)至少95%的粒子的直径是600nm,优选地直径是500nm,更优选地直径是400nm,并且甚至更优选地直径是300nm。又更优选地,至少90%的粒子的单峰直径分布低于300nm;
[0185]
(viii)一种组合物,呈现200与600mosm/kg之间的渗透性;优选地一种水性组合物,包含呈现200与400mosm/kg之间,更优选地260与340mosm/kg之间的的渗透性的5%(重
量/体积)葡萄糖;
[0186]
(ix)一种组合物,呈现2.7与3.4之间的ph;
[0187]
(x)一种水性组合物,包含在589nm波长下在20℃下在589nm波长下在20℃下在水中,以水为参考,呈现+1500与+3750度.ml.g-1
.dm-1
之间的比旋光度的5%(重量/体积)d-葡萄糖;和/或
[0188]
(xi)一种组合物,呈现等于或大于30mv,如38mv,优选地在35mv与50mv之间,或更优选地在约40mv与45mv之间(例如43mv)的ζ电位,如本文所定义且根据iso 13099测量。
[0189]
在一优选实施例中,本发明可涉及组合物,特定来说用于医药用途,包含粒子,其中所述粒子包含双链聚核苷酸与水可溶、聚阳离子同质聚合物或异质聚合物的复合物,其中所述粒子表征为由直径小于或等于600nm,优选地小于或等于300nm,且z平均直径小于或等于200nm,优选地小于或等于150nm限定的单峰直径分布。
[0190]
在另一优选实施例中,双链聚核糖核苷酸是poly(i:c)分子,其存在与由聚肌苷酸[poly(i)]分子和聚胞苷酸[poly(c)]单链分子的退火产生bo-11x调配物,所述聚肌苷酸和聚胞苷酸分子本身的大小特定百分比范围低于0.4kb,在0.4kb与0.85kb之间,在0.85kb与5.0kb之间,和高于5.0kb,如中所指示,其还提供用于产生poly(i:c)分子的水溶液(已经含有或不含有赋形剂,如葡萄糖或甘露醇)的手段,且所述聚肌苷酸和聚胞苷酸分子具有与聚亚烷基亚胺(如聚乙烯亚胺)水溶液混合的适当特征以用于产生bo-11x调配物。接着,将由混合这两种水溶液产生的含poly(i:c)调配物维持为一批制剂(优选地仍呈水溶液或呈冻干形式),或可直接呈等分试样制备,每个包含于单次使用式小瓶、注射器或其它存储用、这种等分试样的单次使用和/或冻干用的适当容器中。bo-11x调配物(呈液体或冻干形式)可存储在室温或低于0℃或低于-20℃的温度下。
[0191]
在这种优选实施例中,可在将两个水溶液混合之前或在已通过混合两个水溶液(双链聚核糖核苷酸和聚亚烷基亚胺水溶液)制造bo-11x调配物之后,在两个水溶液(若不更改粒子或上文针对bo-11x调配物所列的任何其它特征的正确形式)中的每一个中添加其它化合物(如一或多种抗体、激素、肽、赋形剂、载剂、酶活性抑制剂、化疗剂、抗生素、稳定剂、标记试剂、有机溶剂、防腐剂、载剂或其它药物)。因此在与bo-11x组分同时给药的这种额外组分可提供具有以下特性改进的组合物:生物可用性、疗效、药物代谢动力学/药效动力学曲线、稳定性、代谢,或医药价值的其它特性,所述改进在单独给药初始bo-11x调配物或额外组分(举例来说,时另一种医药价值的化合物)中的每一个或分开地给药初始bo-11x调配物或额外组分中的每一个时不能观测到。
[0192]
在一另外主要优选实施例中,bo-11x调配物用作药物,如调配(例如呈可注射、水性组合物,任选地包含医药学上可接受的载剂、赋形剂和/或佐剂)和给药用于递送双链聚核糖核苷酸到健康状态的器官或组织中的医药组合物,所述器官或组织呈现涉及外源性病原体(如细菌或病毒)的疾病,或呈现由于表征为人类或动物细胞异常生长的细胞生长病症,例如由于癌症(即,涉及致肿瘤转换、癌转移、有毒化合物),或表征为雌性哺乳动物生殖器官细胞异常生长的妇科病症,的更改。因此,在一优选实施例中,本发明涉及一种治疗疾病的方法,包含向人类或动物给药本发明组合物。在一另外优选实施例中,本发明涉及一种治疗表征为人类或动物细胞异常生长的细胞生长病症的方法,如本文中所定义,包含向人类或动物给药本发明组合物。
[0193]
优选地,在治疗、减少、改善或预防癌症生长、存活、癌转移、上皮间叶细胞转移、免疫逃逸或复发的范围,bo-11x调配物用于诱导(直接或间接)肿瘤细胞死亡或抑制肿瘤细胞生长的方法。更优选地,bo-11x调配物用于治疗实体肿瘤,如癌瘤、神经胶质瘤、黑色素瘤或肉瘤的方法中。特定来说,bo-11x调配物全身性或更通常直接在靠近肿瘤的位置内或中给药,所述位置如在肿瘤块的界限处,在周围上皮细胞、淋巴或血管中(例如通过瘤内或瘤周注射)、或雌性哺乳动物生殖器官的异常生长细胞。
[0194]
在一些实施例中,bo-11x调配物是根据生产方法制造且接着如实施例中所描述在结构上和功能上定义为bo-111或bo-112调配物的调配物。在癌细胞中或在衍生于癌细胞的细胞系(优选地衍生于人类源)中,与诱导自噬组合,尽管改进的程度,bo-11x调配物可进一步呈现如wo2011003883中所描述的针对bo-110定性的生物活性,即激活解螺旋酶mda-5家族或noxa表达的水平。验证bo-11x调配物的细胞系的实例是人类sk-mel-19、sk-mel-28、sk-mel-103和sk-mel-147细胞,以及鼠b16细胞,所述黑素瘤细胞株在暴露于bo-11x调配物时呈现如干扰素β的分子的表达增加。此外,bo-11x调配物针对用作对照的正常细胞呈现无毒性,所述正常细胞如黑色素细胞或其它皮肤细胞以及免疫系统细胞,其通常表示癌症治疗的继发性毒性的位点。在癌细胞自噬和细胞凋亡(或这种调配物可在这种细胞中诱导的治疗性价值的任何其它效果)之后,bo-11x调配物还可诱导可充当肿瘤特异性免疫反应的诱导剂的癌细胞抗原释放,尤其在bo-11x调配物向癌性细胞或肿瘤局部给药(例如通过瘤周或瘤内注射,在肿瘤块的界限处,在周围上皮细胞、淋巴或血管中或直接在肿瘤块内给药bo-11x)时,在存在或不存在同时或依序给药另一种药物或相同适应症的其它治疗下。
[0195]
本发明还涉及一种制备如本文中所公开的组合物的方法,其包含:
[0196]
(i)制备至少一条双链聚核糖核苷酸、或其盐或溶剂合物的水溶液,和至少一条聚亚烷基亚胺、或其盐或溶剂合物的水溶液,其中任一个或两个溶液任选地进一步包含医药学上可接受的载剂、有机溶剂、赋形剂和/或佐剂;
[0197]
(ii)独立地通过孔径小于或等于500nm的过滤器过滤每一种溶液,形成无菌溶液;
[0198]
(iii)通过在混合室中将所述溶液中的一种添加到另一种溶液中,任选地以大于或等于1ml/min的速率通过注射,或通过同时添加所述溶液中的每一种到所述混合室中,任选地以大于或等于1ml/min的速率通过注射,在所述混合室中混合所得无菌溶液,形成水性组合物;以及任选地
[0199]
(iv)通过孔径小于或等于600nm的过滤器过滤所得水性组合物,形成滤液,或以大于或等于22480m/s2离心所得水性组合物,形成上清液;和/或
[0200]
(v)冻干所得水性组合物、滤液或上清液。
[0201]
因此,在一个优选实施例中,本发明可涉及一种制备如本文中所公开的组合物的方法,其包含:
[0202]
(i)制备至少一条双链聚核糖核苷酸、或其盐或溶剂合物的水溶液,和至少一条聚亚烷基亚胺、或其盐或溶剂合物的水溶液,其中任一个或两个溶液任选地进一步包含医药学上可接受的载剂、有机溶剂、赋形剂和/或佐剂;
[0203]
(ii)独立地通过孔径小于或等于500nm的过滤器过滤每一种溶液,形成无菌溶液;以及
[0204]
(iiii)通过在混合室中将所述溶液中的一种添加到另一种溶液中,任选地以大于
或等于1ml/min的速率通过注射,或通过同时添加所述溶液中的每一种到所述混合室中,任选地以大于或等于1ml/min的速率通过注射,在所述混合室中混合所得无菌溶液,形成水性组合物;以及
[0205]
(iv)任选地冻干所得水性组合物。
[0206]
另外,在另一优选实施例中,本发明可涉及一种制备如本文中所公开的组合物的方法,其包含:
[0207]
(i)制备至少一条双链聚核糖核苷酸、或其盐或溶剂合物的水溶液,和至少一条聚亚烷基亚胺、或其盐或溶剂合物的水溶液,其中任一个或两个溶液任选地进一步包含医药学上可接受的载剂、有机溶剂、赋形剂和/或佐剂;
[0208]
(ii)独立地通过孔径小于或等于500nm的过滤器过滤每一种溶液,形成无菌溶液;
[0209]
(iiii)通过在混合室中将所述溶液中的一种添加到另一种溶液中,任选地以大于或等于1ml/min的速率通过注射,或通过同时添加所述溶液中的每一种到所述混合室中,任选地以大于或等于1ml/min的速率通过注射,在所述混合室中混合所得无菌溶液,形成水性组合物;以及
[0210]
(iv)通过孔径小于或等于600nm的过滤器过滤所得水性组合物,形成滤液,或在大于或等于22480m/s2下离心所得水性组合物,形成上清液;以及
[0211]
(v)任选地冻干所得滤液或上清液
[0212]
更优选地,本发明的方法并不包含最终冻干步骤。在本发明的方法中,所述双链聚核糖核苷酸、所述聚亚烷基亚胺和所述医药学上可接受的载剂、有机溶剂、赋形剂和/或佐剂如本文中所公开的。通过独立地通过孔径小于或等于500nm过滤所述溶液,优选地通过独立地通过孔径小于或等于300nm的过滤器过滤所述溶液,更优选地通过通过孔径小于或等于200nm的过滤器过滤所述溶液,对每一种溶液进行灭菌,形成无菌溶液。优选地,通过大规模旋涡对流输送和随后通过经纯粹的扩散输送消除浓度差进行对所得滤过物的混合。混合室可以是开始在其中混合所述溶液的任何腔室或容器,如烧瓶、反应器或混合器。更优选地,所述混合室具有0.1与20ml之间,此外优选地0.2与10ml之间,更优选许多地0.5与8ml之间的固定体积。更优选地,通过以1ml/min与2000ml/min之间,再更优选地以10与1000ml/min之间的,另外优选地以20与500ml/min之间的速率添加,任选地通过注射,进行混合。任选的过滤所得水性组合物,形成或收集滤液,可随后通过孔径小于或等于600nm的过滤器进行,优选地直径不超过500nm,更优选地直径不超过400nm,又更优选地直径不超过300nm。替代地,任选的离心所得水性组合物,形成或收集上清液,可随后在大于22480m/s2(在半径0.082m的转子上,5000rpm)下,优选地在大于27202m/s2(在半径0.082m的转子上,5500rpm)下,更优选地在大于32372m/s2(在半径0.082m的转子上,6000rpm)下,又更优选地44062m/s2(在半径0.082m的转子上,7000rpm)进行。在一个尤其优选实施例中,当不通过本发明方法的步骤(i)到(iii)实现本发明组合物时,即当在使得包含于所述水性组合物中的小于95%的粒子的直径小于或等于600nm;和/或所述粒子的z平均直径大于200nm的速率下进行添加时,更优选地当所述粒子不具有单峰直径分布时,步骤(iv)是必须的。当特定来说在0.5与20ml之间的反应室中以1ml/min与20ml/min之间的的速率进行添加时,情况可能如此。最终,所得水性组合物、滤液或上清液可经受冻干,得到呈颗粒固体的本发明组合物。
[0213]
因此,在本发明方法的一个尤其更优选许多的实施例中,所述方法包含
[0214]
(i)制备至少一条双链聚核糖核苷酸、或其盐或溶剂合物的水溶液,和至少一条聚亚烷基亚胺、或其盐或溶剂合物的水溶液,其中任一个或两个溶液任选地进一步包含医药学上可接受的载剂、有机溶剂、赋形剂和/或佐剂;
[0215]
(ii)独立地通过孔径小于或等于200nm的过滤器过滤每一种溶液,形成无菌溶液;
[0216]
(iiii)通过在混合室中将所述溶液中的一种添加到另一种溶液中,任选地以20ml/min与100ml/min之间的速率通过注射,或通过同时添加所述溶液中的每一种到所述混合室中,任选地以20ml/min与100ml/min之间的速率通过注射,在所述混合室中混合所得无菌溶液,形成水性组合物,其中所述混合室的体积在0.2与10ml之间;
[0217]
(iv)通过孔径小于或等于500nm的过滤器过滤所得水性组合物,形成滤液,或在大于或等于32372m/s2(在半径0.082m的转子上6000rpm)下离心所得水性组合物,形成上清液;以及
[0218]
(v)任选地冻干所得滤液或上清液。
[0219]
在本发明方法的另一甚至尤其更优选许多的实施例中,所述方法包含
[0220]
(i)制备至少一条双链聚核糖核苷酸、或其盐或溶剂合物的水溶液,和至少一条聚亚烷基亚胺、或其盐或溶剂合物的水溶液,其中任一个或两个溶液任选地进一步包含医药学上可接受的载剂、有机溶剂、赋形剂和/或佐剂;
[0221]
(ii)独立地通过孔径小于或等于200nm的过滤器过滤每一种溶液,形成无菌溶液;
[0222]
(iiii)通过在混合室中将所述溶液中的一种添加到另一种溶液中,任选地以30ml/min与100ml/min之间的速率通过注射,或通过同时添加所述溶液中的每一种到所述混合室中,任选地以30ml/min与100ml/min之间的速率通过注射,在所述混合室中混合所得无菌溶液,形成水性组合物,其中所述混合室的体积在0.5与8ml之间;以及
[0223]
(vi)任选地冻干所得水性组合物。
[0224]
在一另外实施例中,bo-11x调配物根据制造方法制造,所述制造方法涉及混合两个水溶液,第一个水溶液包含双链聚核糖核苷酸(或其盐或溶剂合物)且第二个水溶液包含聚亚烷基亚胺(或其盐或溶剂合物),使得所得粒子呈现上文所定义之特征,特定来说在直径和单峰直径分布方面,以及外观呈基本上澄清胶质溶液。
[0225]
如用实施例中的其它细节所描述,可通过过滤和/或离心医药组合物提供bo-11x调配物,所述医药组合物包含由双链聚核糖核苷酸和水可溶聚阳离子同质聚合物或异质聚合物形成的粒子,从而呈成批或单次使用液体组合物而无可见集聚物提供bo-11x调配物。这类制备组合物的方法包含:
[0226]
(i)制备至少一条双链聚核糖核苷酸、或其盐或溶剂合物的水溶液,和至少一条聚亚烷基亚胺、或其盐或溶剂合物的水溶液,任选地与存在于任一个溶液中的医药学上可接受的载剂、有机溶剂、赋形剂和/或佐剂一起;
[0227]
(ii)混合所述溶液;以及
[0228]
(iii)通过孔径小于或等于600nm的过滤器过滤所得混合物,或在大于22480m/s2下离心。
[0229]
这种方法可进一步适用于组合物的实际组分(双链聚核糖核苷酸、聚亚烷基亚胺和任选的其它组分)以及使用、存储、运送、包装和/或给药组合物的所需方法,特定来说在需要紧接着在使用之前或如对于医药组合物更通常的制造组合物,需要制造长期存储和/
或呈多容器(每一个为单次使用式(例如在无菌小瓶或注射器中))形式用且含有大部分均匀大小、poly(i:c)含量、稳定性、溶解度和在给药时最终生物效果的粒子的组合物时。
[0230]
在这个范围下,以上混合(ii)和过滤步骤(iii)可在过滤和/或混合的次序、混合方法、混合速度、和/或所混合的溶液的量的水平上进行调适。在一另外优选实施例中,制备bo-11x调配物方法包含:
[0231]
(i)制备至少一条双链聚核糖核苷酸、或其盐或溶剂合物的水溶液,和至少一条聚亚烷基亚胺、或其盐或溶剂合物的水溶液,任选地与存在于任一个溶液中的医药学上可接受的载剂、有机溶剂、赋形剂和/或佐剂一起;
[0232]
(ii)通过独立地过滤其对每一种溶液进行灭菌;
[0233]
(iii)通过首先添加任一个溶液且接着以大于50rpm的注射速度以1ml/min与50ml/min之间的流速添加另一种溶液,在容器中混合所述溶液,以用于存储、冻干和/或使用组合物;以及
[0234]
(iv)密封容器。
[0235]
组合
[0236]
在不提供附加或甚至协同效应的情况下,根据本发明的组合物可以组合形式使用,包括已知与其相容的其它化合物或治疗。举例来说,poly(i:c)分子可与不同抗癌药物、抗体、放疗或化疗(le u等人,2008;le u等人,2009;taura m等人,2010;matijevic t等人,2011;levitzki a,2012;yoshino h和kashiwakura i,2013;hafner a等人,2013)或不同长度的poly(i:c)分子(zhou y等人,2013)组合使用。当与其它药剂(如接种癌症抗原或细胞裂解物)(ammi r等人,2015)、阻断pd-1/pd-l1路径药剂(nagato t和celis e,2014)、其它tlr促效剂(如tlr9促效剂cpg odn)(zhang y等人,2014)、二氯乙酸酯(ohashi t等人,2013)、il27(chiba y等人,2013)、激酶抑制剂(如索拉非尼(sorafenib))(ho v等人,2015)、促凋亡蛋白质(如ns1)(gupta s等人,2016)、唑来膦酸(chen l等人,2013)或全反式视黄酸(szabo a等人,2012)组合时,poly(i:c)分子也已用作佐剂或协同作用药剂。鉴于最近证实的poly(i:c)分子针对特定细胞类型的活性,bo-11x调配物的其它用途可变得显而易见,至少在活体外分析中使用,如在前脂肪细胞上,抑制脂肪细胞中的分化和分化(yu l等人,2016)、间质干细胞,增强免疫抑制效果(cho k等人,2016;vega-letter a等人,2016),或激活nk细胞(perrot i等人,2010)。
[0237]
在一些方面中,本发明涉及一种医药组合物,包含有效量的bo-11x调配物和有效量的一或多种免疫调节剂,特定来说靶向免疫检验点分子(如pd-1、pd-l1、pd-l2、ctla-4、cd134、cd134l、cd137、cd137l、cd80、cd86、b7-h3、b7-h4、b7rp1、lag3、icos、tim3、gal9、cd28、ap2m1、shp-2、ppp2r5a或ox-40)的药剂,所述化合物通常称为检验点抑制剂(cpi)。
[0238]
因此,本发明提供适用于组合疗法和方案的组合物和方法,包含给药bo-11x调配物和另一种治疗剂或治疗(包括放疗、化疗、超低温疗法、肿瘤消融或光动力学疗法)。特定来说,本发明涉及一种治疗、改善或预防个体的癌症生长、癌转移、溃疡、免疫逃逸或复发的方法,包含给药bo-11x调配物和一或多种抗癌药物,优选地免疫调节剂,其中同时(作为独立调配物或在共配制制剂情况下)或依序(以任何顺序或以的连续循环)给药。在一些方面,本发明涉及一种用于治疗癌症的方法,包含向有需要的个体给药有效量的bo-11x调配物药剂和有效量的一或多种免疫调节剂,特定来说其中个体经历用一或多种免疫调节剂的癌症
疗法。
[0239]
在不同实施例中,免疫调节剂优选地是抗体,包括单株抗体和其它抗体形式、或任何其它医药学上可用的结合控制免疫反应的细胞表面蛋白质的药剂,因此充当cpi,这种cpi可阻断、降低和/或抑制pd-1和pd-l1或pd-l2和/或pd-1与pd-l1或pd-l2的结合。替代地,这种cpi可阻断、降低和/或抑制其它免疫检验点分子的活性,所述免疫检验点分子如ctla-4、ap2m1、cd80、cd86、shp-2和/或ppp2r5a作为另一替代方案,cpi增加和/或刺激cd137(4-1bb)和/或cd137(4-1bb)与4-1bb配位体和traf2中的一或多个的结合。
[0240]
在不同实施例中,涉及治疗癌症用的组合疗法和方案的方法,包含给药bo-11x调配物,可进一步关于特定给药方法定义,其中bo-11x调配物通过不同于其它治疗化合物中的一个,如免疫调节剂,并优选地cpi,的途径给药。这种方法可涉及通过瘤内或瘤周注射(在肿瘤内,在肿瘤块的界限处、在周围上皮细胞、淋巴或血管中)或允许直接在癌细胞或包含癌细胞的器官内或附近给药bo-11x调配物(和不间接的,举例来说通过血流)的其它手段给药bo-11x调配物,和全身给药cpi或其它免疫刺激剂)。通过瘤内或瘤周注射的bo-11x调配物可在皮肤(即注射到皮肤中(例如用于治疗黑素瘤或与疫苗组合))或内部器官或组织(即注射到所述内部器官或组织(例如通过肝内注射以用于治疗肝癌或囊泡内给药以针对膀胱癌)中)的水平下进行。这种局部给药bo-11x调配物优选地在给药免疫刺激剂后或(优选地)随后进行给药免疫刺激剂。
[0241]
额外效果和用途
[0242]
在一另外实施例中,本发明提供涉及给药bo-11x调配物以用于增加针对病原体或非所要生物学试剂的免疫反应,且特定来说以用于增强抗肿瘤免疫反应,潜在地自身作用为免疫调节剂的医药用途和方法。可通过测量在相关细胞类型或亚群水平(例如树突状细胞、t调节性细胞、t细胞和/或nk细胞)和/或免疫生物标记(例如趋化因子、生长因子、细胞因子和其受体)水平下的肿瘤位点和肿瘤微环境(或在血流、其它生物液体和组织中)内的肿瘤相关免疫反应,来监测这种效果。
[0243]
医药组合物
[0244]
还提供用于通过混合bo-11x调配物与一或多种医药学上可接受的佐剂、稀释剂、载剂或其赋形剂制备bo-111或bo-112(和/或其它bo-11x调配物)的医药组合物的方法。这种组分可适用于特定医学适应症(例如实体癌或血液癌)和/或例如通过注射(瘤周、瘤内、肝内、胰内或皮下喷射)、通过吸入或口服的给药手段。
[0245]
bo-11x调配物基组合治疗可涉及与针对bo-11x调配物和其它化合物相同或不同的给药途径。特定来说,如对于其它免疫刺激rna药剂,bo-11x调配物可通过瘤内或瘤周注射给药,其可在全身给药充当cpi的治疗抗体之前激活免疫系统,如pd-1/pd-l1路径抑制剂(bald t等人,2014)或活化t细胞(amos sm等人,2011)。替代地,bo-11x调配物与为tlr促效剂或配位体(如cpg分子或雷西莫特(resiquimod))的其它治疗性化合物一起以用于增强抗癌接种(sajadian a等人,2014)或树突状细胞(fujimura t等人,2006)的效果。
[0246]
免疫调节剂
[0247]
bo-11x调配物可与一或多种免疫调节剂组合。在一些实施例中,免疫调节剂是(例如一或多种免疫细胞,如非限制性的举例,t细胞和nk细胞的)共刺激或共抑制性分子。在一些实施例中,免疫调节剂是调节cd4和/或cd8t细胞的药剂,例如通过充当关于cd3、cd4、
cd8、pd-1、pd-l1、pd-l2、ctla-4、cd137、cd96、cd73、cd90、cd47、cd69、cd26、tim3和lag3的促效剂或拮抗剂调节。在其它实施例中,免疫调节剂是调节nk细胞的药剂,例如通过充当关于cd3、nkp46、cd16、nkg2d、nkp44和nkp30的促效剂或拮抗剂调节。在其它实施例中,免疫调节剂是调节肿瘤基质和内皮生物标记的药剂,例如通过充当关于cd45、pd-l1、pd-l2、pten和cd31的促效剂或拮抗剂调节。
[0248]
免疫调节剂提供为呈化学有机或无机化合物、核酸、适体、肽、蛋白质,且更特定地说结合生物液体中或细胞表面上的相关靶标的抗体的形式的另外化合物。抗体可为:多克隆或单克隆的;完整或截断的(例如f(ab')2、fab、fv);双特异性或多特异性的;异种的、同种异体的、同基因或其改性形式的(例如嵌合抗体或人类化抗体)。当免疫调节剂是单克隆抗体时,其可以是非人类哺乳动物衍生的单克隆抗体、重组嵌合单克隆抗体、重组人类化单克隆抗体或人类单克隆抗体。
[0249]
充当免疫调节剂的抗体可以进一步包含施加所需生物活性通常所需要的结构要素,如能够结合一种或多种抗原(例如双特异性或多特异性抗体)且展示免疫球蛋白(例如iga、igg、ige、igd或igm)的fc区的四条多肽链(通过二硫键互连的两条重(h)链和两条轻(l)链),所述免疫球蛋白可与fc受体相互作用并激活免疫反应导致免疫细胞或其它细胞的耗减和/或细胞死亡。每条重链由重链可变区(v
h
)和重链恒定区组成。重链恒定区由三个结构域组成:ch1、ch2和ch3。每条轻链由轻链可变区(v
l
)和轻链恒定区组成。轻链恒定区由一个结构域c
l
组成。v
h
和v
l
区可以进一步细分成高变区,称为互补决定区(cdr),穿插有称为构架区(fr)的更保守区。每个可变区(v
h
或v
l
)含有3个cdr,命名为cdr1、cdr2和cdr3。每个可变区还含有4个构架子区,命名为fr1、fr2、fr3和fr4。术语抗体包括所有类型的抗体,包括例如iga、igg、igd、ige和igm;和其对应的亚类(同型),例如lgg-l、gg-2、gg-3和lgg-4;lga-1和lga-2。在一些实施例中,抗体还指代抗体片段和抗原结合片段。
[0250]
适用于实践本文所描述的方法的抗体可以具有各种抗体形式,例如单株、多株双特异性、多特异性,且可以包括(但不限于)人类抗体、人类化抗体或嵌合抗体,包含单链抗体、fab片段、f(ab')片段、由fab表达库产生的片段,和/或以上中的任一种的结合片段。抗体还指代免疫球蛋白分子和免疫球蛋白分子的免疫活性部分,即,含有至少两种抗原或针对本文中所描述的至少两种靶标的靶结合位点的分子。本文中所描述的免疫球蛋白分子可以具有任何类型(例如igg、ige、igm、igd、iga和igy)、类别(例如igg1、lgg2、lgg3、lgg4、lga1和lga2)或亚类别的免疫球蛋白分子。另外,适用于实践在本文中所描述的发明的抗体(例如单特异性、双特异性和/或多特异性)可以文献中所公开的替代形式中的任一种提供,例如双抗体;flexibodies;骆驼科抗体、immunobodies;triomabs、pepbodies、vaccibodies、微型抗体、fcabs、unibodies或duobodies(storz u 2011)。
[0251]
pd-1(又称为cd279或程序性细胞死亡蛋白质1)是b7受体家族的成员。在一些实施例中,pd-1是指人类pd-1序列(参见,例如ncbi参考序列:np_005009)和任何天然存在的等位的剪接变异体,和其经过加工的形式(keir m等人,2008;uniprot:q15116)。pd-1结合pd-l1(又称为cd274或b7-h1)和pd-l2(又称为cd273或b7-dc),它们也是b7家族的成员。在一些实施例中,pd-l1是指人类pd-l1(参见,例如基因库:af233516),pd-l2是指人类pd-l2(例如ncbi参考序列:nm_025239),以及任何天然存在的等位的剪接变异体和其经过加工的形式。
[0252]
在各种实施例中,免疫调节剂靶向pd-1、pd-l1和pd-l2中的一种或多种。在各种实
施例中,免疫调节剂是pd-1抑制剂。在各种实施例中,免疫调节剂是对pd-1、pd-l1和pd-l2中的一种或多种具有特异性的抗体。举例来说,在一些实施例中,免疫调节剂是抗体,以非限制的方式例如尼沃单抗、(ono-4538/bms-936558、mdx1106、opdivo)、派立珠单抗(keytruda)、匹立珠单抗(ct-011)、mk-3475、bms 936559、mpdl3280a。
[0253]
在一些实施例中,bo-11x调配物与bms-936559和medi4736中的一种或多种组合用于治疗例如晚期实体肿瘤。在一些实施例中,bo-11x调配物与一种或多种mpdl3280a(任选地与维罗非尼(vemurafenib))和medi4736()任选地与达拉菲尼(dabrafenib)和曲美替尼(trametinib)中的一种或多种)组合用于治疗黑素瘤。在一些实施例中,bo-11x调配物与一种或多种mpdl3280a(任选地与埃罗替尼(erlotinib))和medi4736(任选地与曲美单抗)组合用于治疗nsclc。在一些实施例中,bo-11x调配物与mpdl3280a(任选地与贝伐单抗(bevacizumab)和舒尼替尼(sunitinib)中的一种或多种)组合用于治疗rcc。在一些实施例中,bo-11x调配物与mpdl3280a组合用于治疗实体恶性肿瘤或血液恶性肿瘤。在一些实施例中,bo-11x调配物与一种或多种mpdl3280a(任选地与贝伐单抗、化学治疗剂和考比替尼(cobimetinib)中的一种或多种);medi4736(任选地与曲美单抗)和msb0010718c组合用于治疗实体肿瘤。在一些实施例中,bo-11x调配物与amp-224组合用于治疗晚期癌症。在一些实施例中,bo-11x调配物与尼沃单抗(任选地与髂腰(iliolumbar)(抗kir))组合用于治疗晚期实体肿瘤。在一些实施例中,bo-11x调配物与尼沃单抗组合用于治疗去势难治性前列腺癌、黑素瘤、nsclc和rcc。在一些实施例中,bo-11x调配物与派立珠单抗(pembrolizumab)组合用于治疗结肠癌。在一些实施例中,bo-11x调配物与派立珠单抗组合用于治疗胃癌、头颈癌、tnbc和泌尿道上皮癌。在一些实施例中,bo-11x调配物与尼沃单抗(任选地与伊派利单抗)组合用于治疗胃癌、胰脏癌、小细胞肺癌和tnbc。在一些实施例中,bo-11x调配物与尼沃单抗(任选地与伊派利单抗)组合用于治疗胶质母细胞瘤。在一些实施例中,bo-11x调配物与尼沃单抗组合用于治疗肝细胞癌。在一些实施例中,bo-11x调配物与派立珠单抗组合用于治疗霍奇金淋巴瘤(hodgkin lymphoma)、骨髓瘤、骨髓发育不良综合症和非霍奇金淋巴瘤。在一些实施例中,bo-11x调配物与匹立珠单抗组合用于治疗恶性神经胶质瘤。在一些实施例中,bo-11x调配物与尼沃单抗(任选地与伊派利单抗和多种类别1肽和montanide isa 51vg中的一种或多种;以及任选地依序与伊派利单抗)和派立珠单抗中的一种或多种组合用于治疗黑素瘤。在一些实施例中,bo-11x调配物与派立珠单抗组合用于治疗黑素瘤和nsclc。在一些实施例中,bo-11x调配物与尼沃单抗(任选地与吉西他滨(gemcitabine)/顺铂(cisplatin)、培美曲塞(pemetrexed)/顺铂、卡铂(carboplatin)/紫杉醇(paclitaxel)、贝伐单抗、埃罗替尼(erlotinib)和伊派利单抗中的一种或多种)和派立珠单抗中的一种或多种组合用于治疗nsclc。在一些实施例中,bo-11x调配物与匹立珠单抗(任选地与吉西他滨)组合用于治疗胰脏癌。在一些实施例中,bo-11x调配物与匹立珠单抗(任选地与西普亮塞-t和环磷酰胺中的一种或多种)组合用于治疗前列腺癌。在一些实施例中,bo-11x调配物与尼沃单抗(任选地与舒尼替尼、帕唑帕尼和伊派利单抗中的一种或多种)、派立珠单抗(任选地与帕唑帕尼)和匹立珠单抗(任选地与树突状细胞/rcc融合细胞疫苗)中的一种或多种组合用于治疗rcc。在一些实施例中,bo-11x调配物与抗lag3(bms-986016,任选地与尼沃单抗)、尼沃单抗(任选地与介白素-21)和amp-554中的一种或多种组合用于治疗实体肿瘤。在一些实施例中,bo-11x调配物与派立珠单抗组合用于治疗实体肿
瘤。
[0254]
在各种实施例中,免疫调节剂靶向cd137或cd137l中的一种或多种。在各种实施例中,免疫调节剂是对cd137或cd137l中的一种或多种具有特异性的抗体。举例来说,在一些实施例中,免疫调节剂是抗体,以非限制的方式例如乌瑞鲁单抗(urelumab)(又称为bms-663513和抗-4-1bb抗体)。在一些实施例中,bo-11x调配物与乌瑞鲁单抗(任选地与尼沃单抗、立瑞单抗(lirilumab)和乌瑞鲁单抗中的一种或多种)组合用于治疗实体肿瘤和/或b细胞非霍奇金氏淋巴瘤和/或头颈癌和/或多发性骨髓瘤。在一些实施例中,免疫调节剂是抗体,以非限制的方式如伊派利单抗(mdx-010、mdx-101、yervoy、bms)和/或曲美单抗(辉瑞公司(pfizer))。在一些实施例中,bo-11x调配物与伊派利单抗(任选地与巴韦西布(bavituximab))组合用于治疗黑素瘤、前列腺癌和肺癌中的一种或多种。
[0255]
在各种实施例中,免疫调节剂靶向cd20。在各种实施例中,免疫调节剂是对cd20具有特异性的抗体。举例来说,在一些实施例中,免疫调节剂是抗体,以非限制的方式如奥法木单抗(ofatumumab)、奥必珠单抗(obinutuzumab)(gazyva)、ame-133v、奥克雷珠单抗(ocrelizumab)、tru-015和维托珠单抗。
[0256]
bo-11x调配物的验证
[0257]
bo-11x调配物(根据本发明且如由实施例中的bo bo 111和bo-112示范)的疗效的临床前验证可以基于细胞的试验且最有趣地在动物模型中单独的或与候选的或审批通过的抗癌药物组合使用bo-11x调配物来进行,在所述动物模型中,可以测试并比较不同的实验标准以确定获得有效地治疗作用的最适当条件。这些标准包括剂量、投药途径、化合物在一定范围内的投药顺序和/或频率,以鉴定哪些是对于bo-11x调配物(单独的或与候选或审批通过的抗癌药物协同地)关于功效、安全性和/或临床使用的治疗用途的更好条件。
[0258]
bo-11x调配物的不同剂量效应、投药次数和/或部位(具体地说,通过在一个或多个部位注射所述调配物)、投药途径、频率,和/或投药时间点可与从暴露于所测试化合物(单独的或与其它药物组合)的细胞或(优选地)动物中获得的生物样本中所测量的相关终点和生理参数相关。这类参数的非限制性清单包括肿瘤尺寸的消退、肿瘤生长的阻断和/或肿瘤细胞的增殖、细胞凋亡、降低肿瘤血管形成或癌转移、克服对常用抗癌药物的耐药性(或以其他方式提高经治疗人群中的这种药物的反应)、降低对正常组织和功能的治疗相关的不良事件、免疫反应的调节和/或具有特异性活性和特征的免疫细胞的调节、生物材料中的生物标记或特异性细胞群的识别(例如存在于癌细胞制剂、肿瘤活检体或生物体液中),所述生物标记或特异性细胞群的增加(或减小)在文献中已知与一般抗癌效果且尤其与动物模型的存活率和癌症患者的可能性相关。只要可能,在投与每一种测试化合物或化合物以给定剂量和/或疗程的测试组合之后,通过使用特定的投药途径和/或药物调配物在中间和最终时间点测量这类终点。
[0259]
可以单独的或与护理标准、常规治疗(如放射线疗法、化学疗法、细胞激酶的抑制剂等)或包括新颖机制和/或新颖候选抗癌药物的治疗组合测试bo-11x调配物的治疗性抗癌功效。实际上,可与bo-11x调配物组合测试的一种类别的新颖抗癌化合物是通过提供靶向播散性肿瘤细胞的全身性抗肿瘤免疫来提高肿瘤微环境内的抗肿瘤免疫反应的那些抗癌化合物。这种方法已证实在动物模型和患者中是有成效的且可以提高常规疗法(如放射线疗法或化学疗法)的最终结果(参见,例如galluzzi l等人,2014;vacchelli e等人,
2013;van der jeught k等人,2015)。
[0260]
这种越来越多的新癌症药物靶向癌细胞逃脱免疫检测和人体破坏的机制。癌症特异性免疫疗法当相比于其它癌症疗法时可以提供一系列优势(例如肿瘤细胞特异性)。实际上,对癌症免疫疗法的一系列分子靶点的识别允许在定义机制和化合物方面取得重大进展,所述机制和化合物可以针对肿瘤的可塑性、不均匀性、耐药性或微环境提供抗肿瘤免疫反应的恰当共刺激(或共抑制)效果。
[0261]
分别作用于不同分子靶点和/或机制的癌症被动或主动免疫治疗剂的非限制性清单包括靶向肿瘤的抗体或其它免疫调节单克隆抗体、溶瘤病毒、免疫刺激细胞介素、过继细胞转移和其它基于细胞的治疗剂、基于dna的疫苗或基于肽的疫苗、免疫抑制代谢的抑制剂或模式识别受体的激动剂。在这些机制中,针对分子靶标的具有促效性或拮抗性活性(取决于其在免疫反应或癌症逃逸免疫反应中的作用)的抗体或其它化合物包括一系列为肿瘤发展的检查点的细胞膜蛋白质,如pd-1、pd-l1、pd-l2、ctla-4、cd137、cd38、ox-40、cd26、tim3和lag3,且针对分子靶标的不同促效性或拮抗性抗体可商购或在表征其抗人类抗原或(当处理动物模型时)对应啮齿动物抗原的特异性和/或抗癌效应水平的科学存储库中得到。
[0262]
不管给人深刻印象的患者对靶向这些共刺激或共抑制分子的药剂(例如基于抗pd-1或抗pd-l1抗体的治疗剂)的反应如何,对免疫检查点抑制剂的临床反应仍在太多癌症患者中不完全地或低效地达到所需治疗效果。bo-11x调配物与如抗pd-1或抗cd137抗体的化合物的恰当组合可以促进肿瘤生长和癌转移的减少(或增加展示此减少的个体数量),当相比于单独投与那两种抗癌剂中的一种的效果,可能超出可以预测的附加作用。
[0263]
bo-11x调配物的治疗作用可以在若干基于细胞的模型中的一种中评估,所述基于细胞的模型基于包括原发性癌细胞的经分离或混合细胞培养物或优选地从人类来源建立的癌细胞系。用于验证bo-11x调配物的癌细胞系的实例可以根据癌症类型来定义,如黑素瘤(人类sk-mel-19、sk-mel-103和uacc62细胞;鼠类b16细胞)、癌瘤(小鼠hepa 1-6细胞;大鼠fao细胞)、乳癌(人类bt483、hcc1143、hcc1937、mda-mb-231、mda-mb-415、mda-mb-468和bt549细胞)、胰脏癌(人类miapaca2、imim-pc2、panel、panc0203、pane 3.27或bxpc3细胞),或可以通过atcc、其它官方或学术存储库或商业供应商获得的其它相关细胞系。bo-11x调配物的抗癌作用可以在时间段水平、频率,和/或使增殖阻断所需要的剂量、死亡、生物标记的表达,和/或信号传导分子的释放(如趋化因子或干扰素β)上评估,所述信号传导分子指示bo-11x调配物的潜在相关效应在更多生理病况中被证实。
[0264]
于是,bo-11x调配物的效应可以在肿瘤动物模型中评估,在所述肿瘤动物模型中,在投药之后,因投与示范性调配物(如bo-112)而导致的抗肿瘤反应在单药疗法和组合治疗(例如与cpi(抗pd-1抗体)一起)两种的不同方案中评估更短或更长时间段。可以通过在因注射细胞的增殖而导致肿瘤发展给定时间(即在注射癌细胞之后的具体天数后)或(优选地)呈现所需肿瘤尺寸(例如80到100mm3的平均尺寸)或甚至在其消失后(以评估每一种药物或药物组合对肿瘤复发的任何效应)的动物中投与bo-112和/或抗pd-1抗体来实行研究。所述研究还将包括为阴性(例如仅媒剂)或阳性对照的对照化合物,如在文献中指示为对于特异性肿瘤具有药物有效性的标准和/或在给定动物模型中指示的化学治疗剂或其它抗癌药物。在动物模型和动物细胞中的这些验证活动还可以产生bo-11x调配物对于兽医学使用的发展。
[0265]
动物模型是典型地小鼠模型,其中癌症是随着动物中的人类癌细胞的转移和移植(来自永生化细胞系或由患者获得的癌症活检)或小鼠肿瘤细胞的诱导(或转移)而发生的。细胞可以由不同类型的肿瘤(例如肺癌、黑素瘤淋巴瘤)发起且在研究期间,可以经皮下注射在小鼠的侧腹中以仅检测肿瘤和分析其尺寸和/或组合物。随后通过将小鼠随机分组来治疗小鼠,在每一组中,大小允许统计分析结果(例如每个对照组或治疗组有3、5、10、12、15、20或更多个动物)。
[0266]
bo-11x调配物(如bo-112)和检查点抑制剂(如抗pd-1抗体)可以在癌症动物模型中改善的特征(尤其当在量、顺序或其它投药标准方面恰当组合时)可以包括在治疗和/或肿瘤消失之后的动物存活率、降低的肿瘤复发、有限的或延迟的毒性和/或耐药效应,和在终止用bo-112和/或抗pd-1抗体治疗之后对重新挑战肿瘤接种的反应。
[0267]
以上在结构上和功能上识别为bo-112和抗pd-1抗体的示范性bo-11x调配物可以在相对于肿瘤细胞的不同位置处和/或以不同量投与(单独的或与单一或多个剂量组合)。典型地,bo-112和对小鼠pd-1具有特异性的单株抗体(例如,来自biolegend的纯系rmp1-14或由其它供应商获得的类似抗体)以相对于动物重量所判定的浓度(例如在0.01与2.5mg/kg之间)、注射体积中的浓度(例如在0.01与0.5ml之间)和/或每一剂量中的含量(例如每剂量在0.01与250pg之间)经皮下、囊泡内、腹膜内、瘤周或瘤内(视模型和肿瘤分子和病理性特征而定)注射。
[0268]
bo-112可以在间隔既定天数(1、2、3、5、7、或更多天)的一个或多个周期(例如2、3、4或更多个)中注射。替代地,当bo-112与抗pd1抗体共同投与时,bo-112可以紧接在抗体(或以单一可注射制剂)之前(或之后),又在一个或多个周期(间隔既定天数)中注射。又替代地,两种药剂可以调配,或以任何相继次序但间隔可变的时间段(例如,1小时、3小时、6小时、12小时、18小时、24小时、36小时、2天或更长)来投与。具体地说,当bo-112在抗pd-1抗体之后投与时,其较晚投与(单独的或进一步与抗pd-1抗体组合)可以在动物中提供抗肿瘤急救效应,在所述动物中,抗pd-1抗体抗肿瘤细胞是低效的,从而克服任何的特异性肿瘤耐受或逃脱机制。在治疗结束时,所有存活的动物可以保持不治疗1周、2周、3周或更多连续的数周以监测在通过进一步皮下注射癌细胞重新刺激肿瘤完全消退的所有动物或不重新刺激肿瘤完全消退的所有动物的情况下,肿瘤细胞是否重现和如何重现。
[0269]
bo-112单独或与如上文所列出的抗pd1抗体组合的效应可以评估为中间结果,所述中间结果是在研究期间在不处死动物的情况下(例如,通过测量肿瘤尺寸、仍存活小鼠的百分比、体重或行为标准)或在处死动物之后(或在已经死亡的小鼠中)对于测定肿瘤和/或正常细胞的分子特征(包括nk细胞的总数和/或特异性亚群、肿瘤浸润的淋巴细胞、脾脏细胞、放射性标记前体的并入,和可以参与抗肿瘤局部或全身性免疫反应的其它细胞,如骨髓衍生的抑制细胞(mdsc)、调节性t细胞(treg)、肿瘤相关的嗜中性白细胞(tan)、m2巨噬细胞和肿瘤相关的巨噬细胞(tam))而报告的。同时,相关生物标记的存在/不存在可以通过相关rna的pcr放大或以在组织内或循环在血液中的细胞的表面上的蛋白质水平来判定,如通过使用标准的免疫试验和试剂盒测定细胞因子或趋化因子。
[0270]
这种整体表型分析可以通过使用从肿瘤、血液、脾脏、淋巴结或其它相关组织和位置分离的细胞以检测在表达细胞表面标记物的细胞数量上的任何统计学上和/或治疗学上的相关变化来进行,所述细胞通过流式细胞测量术来检测且描述在文献中,如cd3、cd4、
cd25、foxp3、cd8、pd-1、pd-l1、pd-l2、pten、ctla-4、cd137、cd96、cd73、cd90、cd47、cd69、cd26、tim3、lag3、gr1、cd11b、ly6c、ly6g、nkp46、cd16、nkg2d、nkp44、nkp30、cd45和cd31。这类细胞还可以肿瘤抗原特异性免疫反应水平、相关转录因子的表达水平、细胞因子含量或趋化因子含量(例如ifn-γ、ifn-β、tnfα、hif1a、hif2a、p53)或通过使用其它基于细胞的试验来评估。
[0271]
另外,在任一免疫缺陷型的完全免疫动物模型中对器官和皮肤的宏观检查和微观的病理性分析可以进一步提供关于研究化合物(单独的或组合的)的功效或其毒性功效的指示,如器官炎症和尸检。在类似研究中产生的定量数据可以在不同实验组中通过使用恰当的统计检验来进行比较,在对多个检验进行校正和不进行校正的情况下,评估治疗性(尤其抗肿瘤)效应的范围是通过单独的或与另一抗癌剂组合投与bo-11x调配物来提供的。
[0272]
治疗方法和患者选择方法
[0273]
在一些实施例中,本发明涉及一种治疗、降低、减缓或防止癌症生长、存活、癌转移、上皮-间质转化、免疫逃逸或复发的方法,包含投与bo-11x调配物和一种或多种免疫调节剂。癌症可以是肿瘤疾病。癌症可以是由癌症的癌转移所产生的休眠肿瘤。休眠肿瘤还可以是从手术去除肿瘤后留下的。癌症复发可以是例如肿瘤再生、肺癌转移或肝癌转移。
[0274]
在各种实施例中,癌症为以下中的一种或多种:基底细胞癌;胆道癌;膀胱癌;骨癌;大脑和中枢神经系统癌;乳癌;腹膜癌;绒膜癌;结缔组织癌;消化系统癌(包括食道癌、胃癌、结肠癌、直肠癌或其它胃肠癌);眼癌;头部和颈部癌;胶质母细胞瘤;肝脏癌;肝细胞癌;上皮内肿瘤;肾脏、肾上腺或肾癌;白血病;肝癌;肺癌(例如小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞状癌);黑素瘤;骨髓瘤;神经母细胞瘤;口腔癌(唇、喉、舌、口腔和咽);胰脏癌;前列腺癌;成视网膜细胞瘤;横纹肌肉瘤;呼吸系统癌;唾液腺癌;皮肤癌;鳞状细胞癌;睾丸癌;甲状腺癌;子宫、子宫内膜、子宫颈、外阴、卵巢或其它妇科癌症;泌尿系统癌症;淋巴瘤,包括b细胞淋巴瘤、霍奇金氏和非霍奇金淋巴瘤(nhl;包括特定类型,如低级/滤泡、较小淋巴球性、中级/滤泡、中级扩散、高级免疫母细胞、高级淋巴母细胞性、高级小非分裂细胞或肿块性病变nhl)、套细胞和aids相关淋巴瘤;慢性淋巴细胞性白血病;急性淋巴母细胞性白血病;毛状细胞白血病;慢性骨髓母细胞白血病;以及其它癌瘤和肉瘤;移植后淋巴增生性病症(ptld),以及与母斑病或水肿相关的异常血管增生(如与大脑肿瘤相关的那些)。
[0275]
在各种实施例中,癌症是胆道癌。在一些实施例中,胆道癌选自胰脏癌、胆囊癌、胆管癌和乏特氏壶腹癌(cancer of the ampulla of vater)。在各种实施例中,癌症是肝癌。在各种实施例中,癌症是结肠癌。在一些实施例中,胆道癌是胆管癌和/或腺癌。
[0276]
在一些实施例中,bo-11x调配物和/或免疫调节剂用于治疗各个阶段的癌症(例如i期,或ii期,或iii期,或iv期)。作为非限制性实例,使用整体阶段分组,i期癌症局限于身体的一部分;ii期癌症是局部晚期的,iii期癌症也是如此。将癌症指定为ii期或iii期可以取决于癌症的特异性类型。在一个非限制性实例中,霍奇金氏疾病ii期指示仅隔膜一侧上的淋巴结受侵袭,而iii期指示隔膜上方和下方的淋巴结均受侵袭。因此ii期和iii期的特异性标准根据诊断而不同。iv期癌症通常已转移或扩散到其它器官或整个身体中。
[0277]
在一些实施例中,bo-11x调配物(和/或免疫调节剂)减小了患者可能经受的治疗副效应。举例来说,bo-11x调配物和一种或多种免疫调节剂的组合疗法可以允许较低剂量的bo-11x调配物和/或一种或多种免疫调节剂(例如与单一疗法相比)并由此增加任一种药
剂的治疗窗。在一些实施例中,降低剂量在不(或最小)损耗功效的情况下减轻了一种或多种副效应。在一些实施例中,bo-11x调配物和/或免疫调节剂用于治疗患有难治性癌症的个体。在一些实施例中,bo-11x调配物用于治疗对于一种或多种免疫调节剂(尤其实际上与bo-11x调配物组合的一种药剂)难治愈的个体。
[0278]
举例来说,在一些实施例中,个体对于pd-1和/或pd-l1和/或pd-l2药剂是治愈的,包括例如尼沃单抗(ono-4538/bms-936558、mdx1106、opdivo)、派立珠单抗(keytruda)、匹立珠单抗(ct-011)、mk-3475、bms-936559、依鲁替尼、和/或mpdl3280a难治性患者。举例来说,在一些实施例中,个体对于抗ctla-4剂是治愈的,例如伊派利单抗(yervoy)难治性患者(例如黑素瘤患者)。在一些实施例中,个体对于bo-11x调配物是难治愈的。因此,在各种实施例中,本发明提供拯救对各种治疗剂不反应的患者的癌症治疗方法,包括bo-11x调配物或一种或多种免疫调节剂的单一疗法。
[0279]
在各种实施例中,术语“患者”和“个体”可以互换地使用。在一些实施例中,个体和/或动物是哺乳动物,例如,人类、小鼠、大鼠、天竺鼠、狗、猫、马、牛、猪、兔、绵羊,或非人类灵长类,如猴(例如狒狒)或黑猩猩。
[0280]
在各种实施例中,本发明的方法适用于治疗人类个体。在一些实施例中,人类是儿童。在其它实施例中,人类是成年人。在其它实施例中,人类是老年人。在其它实施例中,人类可以被称为患者或个体。在一些实施例中,人类是女性。在一些实施例中,人类是男性。
[0281]
治疗方案和组合疗法
[0282]
在一些实施例中,本发明为特异性癌症治疗方案提供bo-11x调配物和免疫调节剂(和任选地一种或多种额外治疗剂)。举例来说,在一些实施例中,向患者投与bo-11x调配物(例如,bo-111或bo-112)以首先任选地提供降低或消除缺氧来使肿瘤血管形成正常化。bo-11x调配物(例如,bo-111或bo-112)的这种第一次投与可以刺激和/或增加t淋巴细胞(例如cd4+和cd8+t细胞)和/或nk细胞肿瘤且/或抑制和/或减少免疫抑制细胞(例如骨髓衍生的抑制细胞(mdsc)、调节性t细胞(treg);肿瘤相关的嗜中性白细胞(tan)、m2巨噬细胞和肿瘤相关的巨噬细胞(tam))募集到肿瘤。在一些实施例中,当前治疗剂可以改变肿瘤部位中的m1比m2巨噬细胞的比率以促进m1巨噬细胞。值得注意地,在一些实施例中,不同于例如抗血管生成分子,bo-11x调配物诱导持久的(即超过短暂)血管正常化。举例来说,bo-11x调配血管正常化可以持续超过1,或2,或3,或4,或5,或6,或7,或14天,或21天。因此,在一些实施例中,这种持久的bo-11x调配血管正常化允许更有可能对一种或多种免疫调节剂反应的可持续许可的肿瘤微环境。也就是说,在一些实施例中,bo-11x调配物增强了免疫调节剂疗法。
[0283]
替代地,在用一种或多种免疫调节剂治疗之后,向患者投与bo-11x调配物(例如,bo-111或bo-112)。举例来说,在一些实施例中,免疫调节剂靶标一种或多种共抑制性分子且降低或消除免疫抑止。在这种有利的背景下,即在去除抑制后,投与bo-11x调配物(例如,bo-111或bo-112)以刺激免疫系统。或免疫调节剂首先靶向一种或多种共刺激分子且其次例如同时地投与bo-11x调配物(例如,bo-111或bo-112)以加强这种效应。
[0284]
另外,如本文所描述,bo-11x调配物和/或免疫-调节剂可以在例如共同投药、治疗方案或共调配的背景下与额外治疗剂组合。
[0285]
在一些实施例中,bo-11x调配物和/或免疫调节剂,任选地与额外治疗剂可以依序地进行投与。如本文所使用的术语“依序地”是指额外治疗剂和bo-11x调配物和/或免疫调
节剂以大于约60分钟的时间间隔来投与。举例来说,在依序投与额外治疗剂与bo-11x调配物和/或免疫调节剂之间的时间可以间隔大于约60分钟、大于约2小时、大于约5小时、大于约10小时、大于约1天、大于约2天、大于约3天,或大于约1周。最优的投药时间可以视代谢速率、分泌速率,和/或所投与的额外治疗剂和bo-11x调配物和/或免疫调节剂的药效动力学活性而定。可以首先投与额外治疗剂或当前药剂。
[0286]
在一些实施例中,bo-11x调配物和/或免疫调节剂,任选地与额外治疗剂可以同时投与。如本文中所使用的术语“同时地”是指额外治疗剂与bo-11x调配物和/或免疫调节剂以不超过约60分钟,如不超过约30分钟、不超过约20分钟、不超过约10分钟、不超过约5分钟或不超过约1分钟的时间间隔来投与。额外治疗剂与bo-11x调配物和/或免疫调节剂的投与可以是单一调配物(例如,包含额外治疗剂和bo-11x调配物和/或免疫调节剂的调配物)或个别调配物(例如,包括额外治疗剂的第一调配物和包括bo-11x调配物和/或免疫调节剂的第二调配物)的同时投与。
[0287]
共投药也不需要通过相同的投药途径来向个体投与额外治疗剂。相反地,每一种治疗剂可以通过任何恰当的途径,例如肠胃外或非肠胃外来投与。
[0288]
这种组合可以在较低剂量的bo-11x调配物和/或免疫调节剂下导致协同效应和/或附加和/或强效效应。举例来说,当bo-11x调配物与一种或多种免疫调节剂组合时,bo-11x调配物的有效量可以低于其在单一疗法中的有效量。在一些实施例中,bo-11x调配物与免疫调节剂组合且bo-11x调配物的有效量是亚治疗剂量,例如当免疫调节剂与bo-11x调配物组合时,免疫调节剂的有效量可以低于其在单一疗法中的有效量。在一些实施例中,免疫调节剂与bo-11x调配物组合且免疫调节剂的有效量是亚治疗剂量。在各种实施例中,免疫调节剂与bo-11x调配物和额外治疗剂组合且额外治疗剂的有效量是亚治疗剂量。术语“亚治疗剂量或亚量”是指药理学活性物质的剂量或量低于作为单一物质投与以达到治疗效果的物质的剂量或量。这种物质的亚治疗剂量可以视待治疗的个体和疾病病症、个体的重量和年龄、疾病病症严重程度、投与方式等而改变,其可以容易地由本领域的普通技术人员判定。在一个实施例中,化疗剂的亚治疗剂量或亚量小于化疗剂的审批通过的充分剂量的90%,如美国食品与药物管理局(u.s.food&drug administration)审批通过的化疗剂的标签信息中提供的量。在其它实施例中,化疗剂的亚治疗剂量或亚量小于审批通过的充分剂量的80%、70%、60%、50%、40%、30%、20%或甚至10%,如20%到90%、30%到80%、40%到70%或本文所提供的所述值内的其它范围。
[0289]
在一些实施例中,免疫调节剂的有效量小于用于同一癌症的单一疗法和/或用于同一癌症的具有除bo-11x调配物以外的药剂的组合疗法中所使用的有效量。在一些实施例中,bo-11x调配物的有效量小于用于同一癌症或临床状况的单一疗法和/或用于同一癌症或临床状况的具有药剂(如免疫调节剂)的组合疗法中所使用的有效量。
[0290]
在各种实施例中,bo-11x调配物与一种或多种免疫调节剂(例如1,或2,或3,或4,或5种免疫调节剂)和任选地一种或多种额外治疗剂(例如1,或2,或3,或4,或5种额外治疗剂)组合。这类组合可以在bo-11x调配物和/或免疫调节剂和/或一种或多种额外治疗剂的较低剂量下产生协同效应和/或附加和/或强效效应。共投药可以是同时的或依序的。另外,包括bo-11x调配物和/或免疫调节剂的医药组合物可以包含额外治疗剂(例如凭借共调配物)。也就是说,在一些实施例中,本文中所公开的药剂中的任何两种或更多种可以共调配。
另外,在一些实施例中,bo-11x调配物和/或免疫调节剂可以向经历用一种或多种额外治疗剂治疗的患者投与。另外,在一些实施例中,bo-11x调配物和/或免疫调节剂可以取代患者当前用一种或多种额外治疗剂的治疗。
[0291]
辅助疗法,也被称为辅助护理,是给定的除初始的、主要的或最初的治疗以外的治疗。作为非限制性实例,辅助疗法可以是在手术之后通常给定的额外治疗,在所述手术中所有可检测的疾病已被去除,但仍存在因隐性疾病而导致的统计学复发风险。在一些实施例中,本文中所描述的药剂在癌症治疗中用作辅助疗法。在一些实施例中,本文中所描述的治疗剂在切除术之前投与作为新的辅助疗法。在某些实施例中,新的辅助疗法是指在任何手术之前缩小和/或降级肿瘤的疗法。在一些实施例中,新的辅助疗法是指在手术或允许肿瘤切除的其它技术之前向癌症患者投与的本文中所描述的治疗剂。
[0292]
在一些实施例中,本文中所描述的治疗剂适用作在用一线疗法的初始治疗之后的维持性疗法,包括(但不限于)本公开的额外治疗剂中的任一种。
[0293]
在各种实施例中,本发明提供用于治疗个体的癌症或肿瘤的治疗方案或方法,所述方法包括同时或依序投与治疗有效量的bo-11x调配物和/或免疫调节剂和本文中所描述的额外治疗剂中的一种或多种。在各种实施例中,本发明提供用于治疗个体的癌症或肿瘤的治疗方案或方法,所述方法包括同时或依序投与治疗有效量的bo-11x调配物和/或免疫调节剂和本文中所描述的抗癌剂中的一种或多种,包括(但不限于)化疗剂。本发明的方法中待使用的适合化疗剂可以包括本文中所描述的那些化疗剂。在某些实施例中,化疗剂是5-氟尿嘧啶(5-fu)、小红莓(doxorubicin)、吉西他滨、紫杉醇和顺铂中的一种或多种。作为实例,在一些实施例中,本发明提供将bo-11x调配物和/或免疫调节剂与一种或多种通用的癌症治疗方案(作为非限制性说明,folfox、folfiri、ifl、fl(mayo)、quasar、machover时间表、caf、cmf、ecf和fec)组合。
[0294]
在各种实施例中,额外治疗剂是抗过度增殖剂。抗过度增殖剂包括(但不限于)小红莓、道诺霉素(daunorubicin)、丝裂霉素、放射菌素d、博莱霉素(bleomycin)、顺铂、vp16、烯二炔(enedyine)、紫杉醇、长春新碱、长春碱、卡莫司汀(carmustine)、美法仑(melphalan)、环磷酰胺(cyclophsophamide)、苯丁酸氮芥、白消安、洛莫司汀(lomustine)、5-氟尿嘧啶、吉西他滨、bcnu或喜树碱(camptothecin)。
[0295]
另外,额外治疗剂可以进一步包括辐射的使用。另外,治疗方法可以进一步包括光动力疗法的使用。
[0296]
盐类、医药组合物和剂量
[0297]
在一些实施例中,本发明提供本文中所描述的药剂和医药学上可接受的酯、前药、盐类、溶剂合物、对映异构体、立体异构体、活性代谢物、共晶体,和其它生理学上的其功能性衍生物。
[0298]
在一个方面,本发明提供本文中所描述的药剂和医药学上可接受的载剂或赋形剂。医药组合物可以呈适用于所需用途和投与途径的任何适合的形式。药物赋形剂可为液体,如水和油,包括石油、动物、植物或合成来源的油,如花生油、大豆油、矿物油、芝麻油等。药物赋形剂可为例如盐水、阿拉伯胶、明胶、淀粉糊、滑石、角蛋白、胶态二氧化硅、尿素等。在一个实施例中,医药学上可接受的赋形剂当投与个体时为无菌的。当本文中所描述的任何药剂静脉内投与时,水为适用的赋形剂。还可以使用盐水溶液和右旋糖水溶液以及甘油
溶液作为液体赋形剂,特别是用于可注射溶液。合适的药物赋形剂还包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、稻米、粉末、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、无水脱脂奶、甘油、丙二醇、乙二醇、水、乙醇等。适合药物赋形剂的其它实例描述在《雷明顿药物科学(remington’s pharmaceutical sciences)》(allen,loyd v.,jr编辑,第22版本,2012)中。
[0299]
另外,本发明的医药组合物可以含有佐剂,如防腐剂、润湿剂、乳化剂、ph缓冲剂和分散剂。另外,可以包括助剂、稳定剂、增稠剂、润滑剂和着色剂。微生物的作用的预防可以通过各种抗细菌和抗真菌剂来确保,例如对羟基苯甲酸酯、氯丁醇、酚类山梨酸等。医药组合物还可以包括等渗剂,如糖、氯化钠等。
[0300]
必要时,医药组合物还可以包括增溶剂。此外,药剂可用如所属领域中已知的合适的媒剂或传递装置传递。用于投与的组合物可以任选地包括局部麻醉剂(如利多卡因(lignocaine))以减轻注射部位的疼痛。
[0301]
本发明的医药组合物可以采取以下形式:溶液、悬浮液、乳液、滴剂、锭剂、丸剂、球粒、胶囊、含液体胶囊、粉末、持续释放调配物、栓剂、乳液、气雾剂、喷雾、悬浮液或任何其它适用的形式。因此,本文中所描述的组合物可以包含在胶囊、锭剂、丸剂、囊片、瓶、安瓿、药囊、注射器、料筒、雾化器或其它容器中。在一个实施例中,医药组合物呈胶囊形式。在另一个实施例中,医药组合物呈锭剂形式。
[0302]
在一些实施例中,所描述的药剂和组合物中的任一种的投与是经口、静脉内和肠胃外中的任一种。在各种实施例中,投药途径包括例如:经口、皮内、肌内、腹膜内、静脉内、皮下、鼻内、硬膜外、舌下、鼻内、脑内、肝内、胰内、囊泡内、阴道内、经皮、经直肠、通过吸入或局部例如耳朵、鼻、眼睛或皮肤。在一些实施例中,投药是经口或通过肠胃外注射实现。投药模式可以留给医师判断,且部分取决于医学病状和/或并发治疗的部位(例如化学疗法、放射线疗法,或与抗体、疫苗和其它靶向癌症的药物组合)。在各种实施例中,投药使得本文中所描述的任何药剂释放到血流中。
[0303]
本文中所描述的任何药剂和/或医药组合物可以经口投与。这类药剂和/或医药组合物还可通过任何其它便利的途径,例如通过静脉内输注或快速注射、通过上皮或粘膜皮肤衬里(例如,口腔粘膜、直肠和肠道黏膜等)吸入来投与且可以与额外治疗剂一起投与。可全身性或局部施用。各种传递系统为已知的,例如包装在脂质体、微米粒子、微胶囊、胶囊等中且可以使用。在特定实施例中,可能需要局部投与到需要治疗的区域。
[0304]
在一个实施例中,本文中所描述的药剂和/或本文中所描述的医药组合物是根据常规程序调配为适合于经口投与人类的组合物。用于经口投与的固体剂型包括例如胶囊、锭剂、丸剂、粉末和颗粒。在这类剂型中,活性剂与至少一种惰性的医药学上可接受的赋形剂或载剂(如柠檬酸钠磷酸二钙等)和/或以下者混合:a)填充剂或补充剂,如淀粉、乳糖、蔗糖、葡萄糖、甘露醇、硅酸、微晶纤维素和烘焙专用糖等;b)黏合剂,如羧基甲基纤维素、褐藻酸盐、明胶、聚乙烯-吡咯啶酮等;c)保湿剂,如丙三醇等;d)崩解剂,如琼脂-琼脂、碳酸钙、马铃薯或木薯淀粉、褐藻酸、特定硅酸盐、碳酸钠,交联聚合物,如交联聚维酮(交联聚乙烯吡咯啶酮)、交联羧甲纤维素钠(交联羧甲基纤维素钠)、羟基乙酸淀粉钠等;e)溶液阻滞剂,如烷烃等;f)吸收加速剂,如季铵药剂等;g)润湿剂,如十六烷醇和单硬脂酸甘油酯等;h)吸附剂,如高岭土和膨润土等;以及i)润滑剂,如滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、月
桂基硫酸钠、山嵛酸甘油酯(glycerylbehenate)等,和这类赋形剂的混合物。所属领域的技术人员将认识到特定赋形剂可在口服剂型中具有两种或更多种功能。在口服剂型(例如胶囊或锭剂)的情况下,剂型还可以包含缓冲剂。
[0305]
用于经口投药的液体剂型包括医药学上可接受的乳液、溶液、悬浮液、糖浆和酏剂。除了活性剂外,液体剂型可以含有本领域中常用的惰性稀释剂,如水或其它溶剂、增溶剂和乳化剂,如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苯甲酯、丙二醇、1,3-丁二醇、二甲基甲酰胺、油类(尤其是棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢糠醇、聚乙二醇和脱水山梨糖醇脂肪酸酯和其混合物。适用于肠胃外投药(例如静脉内、肌内、肝内、胰内、腹膜内、皮下和关节内注射和输注)的剂型包括例如溶液、悬浮液、分散液、乳液等。它们还可以无菌固体组合物(例如冻干组合物)形式制造,所述无菌固体组合物可在即将使用之前溶解或悬浮于无菌可注射介质中。它们可含有例如所属领域中已知的悬浮或分散剂。用于肠胃外注射的本发明的医药组合物包含医药学上可接受的无菌水性或非水性溶液、分散液、悬浮液或乳液,以及在即将使用之前在无菌可注射溶液或分散液中复原的无菌粉末。适合水性和非水性载剂、稀释剂、溶剂或媒剂的实例包括水、乙醇、多元醇(例如丙三醇、丙二醇、聚乙二醇等),和其适合混合物、植物油(例如橄榄油)以及可注射有机酯,例如油酸乙酯。可以例如通过使用涂层材料(例如卵磷脂)、通过在分散液情况下维持所需粒度和通过使用表面活性剂来维持适当流动性。
[0306]
本文中所描述的任何药剂和/或本文中所描述的医药组合物可以通过控制释放或持续释放方式或通过本领域普通技术人员已知的递送装置来投与。这类剂型可以适用于提供一或多种活性成分的控制或持续释放,使用例如变化比例的羟丙基纤维素、羟丙基甲基纤维素、聚乙烯吡咯啶酮、尤特奇(eudragit)、其它聚合物基质、凝胶、可渗透膜、渗透系统、多层包衣、微米粒子、脂质体、微球体或其组合以提供所要释放曲线。适合的控制或持续释放的调配物可以容易地选择与本文中所描述的药剂的活性成分一起使用。因此,本发明提供适用于经口投药的单一单位剂型,例如(但不限于)被调适用于控制或持续释放的锭剂、胶囊、囊形片和囊片。
[0307]
包含本文中所描述的药剂和/或本发明的医药组合物的调配物可以便利地以单位剂型呈现且可以通过药剂学领域中已知的方法中的任一种来制备。这类方法通常包括将治疗剂引入与载剂结合的步骤,其构成一种或多种副成分。典型地,调配物是通过将治疗剂均一地且紧密引入与液体载剂、细粉状固体载剂或两种结合,且接着必要时将制品塑形成所需调配物的剂型(例如,湿式或干式粒化、粉末共混物等,接着使用本领域中已知的常规方法压片)来制备的。
[0308]
应了解,根据本发明将投与的本文中所描述的药剂和/或本发明的医药组合物的实际剂量可以根据特定药剂、特定剂型和投药模式而改变。可以调节bo-11x调配物的作用的多种因素(例如体重、性别、饮食、投药时间、投药途径、分泌速率、个体病状、药物组合、基因配置和反应灵敏度)可以由本领域的普通技术人员考虑。投药可以连续地或以最大耐受剂量内的一个或多个离散剂量进行。对于给定病状组的最优投药速率可以由本领域的普通技术人员使用常规的剂量投药测试来确定。
[0309]
本文中所描述的药剂和/或本发明的医药组合物的单独剂量可以在bo-11x调配物[例如,其中所述个别bo-11x调配物是通过制造约0.01mg到约1000mg聚(l:c)的复合物来形
成的]内含有例如约0.01mg到约1,000mg聚(l:c)分子的单位剂型(例如锭剂或胶囊)来投与,包括在其之间的所有值和范围。在一些实施例中,本文中所描述的药剂和/或本发明的医药组合物以每天bo-11x调配物内具有约0.01mg到约1000mg的量的聚(l:c)分子,或每天约0.1mg到约10mg来投与,[例如,其中所述个别的bo-11x调配物是通过制造约0.01mg到约1000mg,优选地约0.01mg到10mg聚(l:c)的复合物来形成的],包括在其之间的所有值和范围。
[0310]
在一些实施例中,本发明的药剂和/或医药组合物的适合剂量在bo-11x调配物内约0.001到约10mg聚(l:c)分子/kg个体体重,优选地bo-11x调配物内0.003到约10mg聚(l:c)分子/kg个体体重,更优选地bo-11x调配物内0.005到约10mg聚(l:c)分子/kg个体体重并且甚至更优选地bo-11x调配物内0.01到约10mg聚(l:c)分子/kg个体体重的范围内,[例如,其中所述经投与的个别bo-11x调配物是通过制造具有约0.005mg到约10mg聚(l:c)/kg个体体重,优选地约0.003mg到约10mg聚(l:c)/kg个体体重,更优选地约0.001mg到约10mg聚(l:c)/kg个体体重的复合物来形成的],包括在其之间的使用值和范围。在其它实施例中,bo-11x调配物和/或免疫调节剂和/或额外治疗剂的适合剂量在约0.01mg/kg到约10mg/kg体重的范围内,或约0.05mg/kg到约1mg/kg体重的范围内。
[0311]
根据本发明的某些实施例,本文中所描述的药剂和/或医药组合物可以以下来投与:例如每天大于一次、大约每天一次、大约隔一天一次、大约每三天一次、大约每周一次、大约每两周一次、大约每月一次、大约每两月一次、大约每三月一次、大约每六个月一次,或大约每年一次。
[0312]
试剂盒
[0313]
本发明还提供可以简化投与本文中所描述的药剂和/或医药组合物的试剂盒。所述试剂盒是材料或组分的组合件,包括本文中所描述的药剂中的至少一种。试剂盒中配置的组分的准确性质取决于其希望的目的。在一个实施例中,试剂盒被配置成出于治疗人类个体的目的。
[0314]
使用说明书可以包括于试剂盒中。使用说明书典型地包括描述在使用试剂盒的组分以倾向所需的最终结果(如治疗例如癌症、糖尿病或肥胖)中所采用的技术的有形表达。任选地,试剂盒还含有其它有用的组分,如稀释剂、缓冲剂、医药学上可接受的载剂、注射器、导液管、施用器、过滤器、(微)针、移液或测量工具、包扎材料或如可由本领域的技术人员轻易识别的其它有用的用品。
[0315]
组合在试剂盒中的材料和组分可以保存其可操作性和效用的任何便利且适合的方式提供到医师存储库。举例来说,所述组分可以提供在室温、冷藏或凝固温度下。所述组分典型地包含于适合的包装材料中。在各种实施例中,包装材料是通过众所周知的方法来构建的,优选地以提供无菌的无污染物的环境。包装材料可具有指示试剂盒和/或其组分的内含物和/或目的的外部标记。
[0316]
尽管已结合具体实施例描述本发明,但应理解,其能够进一步修改并且本申请案打算涵盖本发明的任何变化、使用或修改,所述变化、使用或修改一般来说遵循本发明原理并且包括本公开的此类背离作为在本发明所涉及的所属领域内的已知或惯用实践范围内并且作为可以应用于上文阐述和如下的所附权利要求书的范围中的基本特征。
[0317]
实施例
[0318]
实施例1:复合物大小对不同jetpei类poly(i:c)制剂(bo-111调配物)的抗癌作用的影响
[0319]
材料与方法
[0320]
bo-111调配物(2-小瓶方法)
[0321]
用于产生双链聚肌苷酸-聚胞苷酸[poly(i:c)]分子的单链聚肌苷酸[poly(i)]和聚胞苷酸[poly(c)]分子是从商业供应商获得的,如泰达集团(tide group)、carbogen或invivogen。取决于供应商和批次,poly(c)分子的尺寸分布被定义为:<400个碱基,20%-82%(使用制剂进行的进一步测试呈现例如33%、43%或50%);400-850个碱基,15%-40%(使用制剂进行的进一步测试呈现例如27%、30%或37%);850-5000个碱基,3%-50%(使用制剂进行的进一步测试呈现例如13%、30%或34%);>5000个碱基,1%或更小(通常不存在)。取决于供应商和批次,poly(i)分子的尺寸分布被定义为:<400个碱基,80%-95%(使用制剂进行的进一步测试呈现例如86%或91%);400-850个碱基,5%-20%(使用制剂进行的进一步测试呈现例如8%或12%);850-5000个碱基,0-5%(使用制剂进行的进一步测试呈现例如1%或更小);>5000个碱基,1%或更小(通常不存在)。应用于poly(i)和poly(c)粉末或溶液的用于制造bo-111调配物的验收准则还包括最大吸收率(分别在poly(i)和poly(c)的248
±
1nm和268
±
1nm波长下)、内毒素含量(≤10eu/)、ph(6.0-8.0)和沉淀系数(≥4s)。
[0322]
批量poly(i)制剂是通过在50℃下将粉末poly(i)(1.0eq.,23.99g)溶解于pbs1
×
(2.4l)并持续搅拌到6升烧瓶中来获得的。批量poly(c)制剂是分别以相同方式和相同的浓度使用粉末poly(c)来获得的。可以实施额外的过滤步骤以使用具有300kda截留值或500kda截留值的膜(pellicon 2卡盒,密理博公司(millipore))进一步提高起始溶液的质量。将这些过滤步骤的渗透物是由小尺寸杂质(如单体)历经30kda膜(pellicon 2卡盒,密理博公司)来浓缩且释放的。将每一种溶液的所得保留物与浓缩的缓冲溶液(如pbs 10倍)混合。对于两种溶液,测定光密度以将浓度计算为用于随后退火步骤的1:1化学计量基础,从而在退火步骤之前调节总体积。在55℃到62℃下将poly(i)溶液与poly(c)溶液分子混合且搅拌30分钟。使所得溶液在室温下缓慢冷却大约3小时以使单链分子退火并产生poly(i:c)分子,且最后历经g3玻璃孔式过滤器(孔大小为大约15到40pm)来过滤。
[0323]
这种退火工艺产生含有不同双链poly(i:c)分子库的溶液,所述溶液随后被施加在色谱gpc柱上。色谱法是用填充有700ml toyopearl hw-65f于40mm磷酸钠缓冲液中的浆液的具有5cm直径的omnifit玻璃柱来进行的。使浆液缓慢沉淀,接着用40mm磷酸钠缓冲液(ph=6.9)以10ml/min到60ml/min的递增流速来洗涤。将管柱安装在由两个进料泵、uv检测器、抽样阀和计算机组成的制备型hplc装置中。将来自退火的反应混合物负载于管柱上且用40mm磷酸钠缓冲液溶离(流速=50ml/min,ph=6.9)。当uv信号在100mv与1250mv之间时获取目标馏分,且合并以使用四个稀释脱盐周期进一步处理且使用切向流动装置(tff,密理博pellicon 2,再生纤维素,配备有三个各0.1m2,300kda截留值的膜卡盒)来浓缩。将入口和出口连接到具有合并的色谱馏分的第一玻璃瓶。最终的保留物和洗涤溶液历经膜过滤以得到澄清的无色溶液,所述澄清的无色溶液使用异丙醇脱盐、冷冻干燥且在室温下冻干(在1mbar下大约5天)。
[0324]
不同的可商购活体内jetpei[具有8.3与22.5kda之间的平均分子量,和多分散指
数<1.5,如由凝胶渗透色谱法(gel permeation chromatography;gpc:sop gpc-0044)从peox(聚氧化乙烯,pei的前体)测定并通过0.2pm过滤器无菌过滤]是从polyplus(目录号201-50g)获得的。2-小瓶方法包括将含有poly(i:c)分子的小瓶1(当快速移液时,为1.0ml或更小的体积,或当使用注射器时高达5.5ml)的内含物与含有pei溶液的小瓶2(当快速移液时为1.0ml或更小的体积,或当使用注射器时高达5.5ml)混合。替代地,用注射器(10ml)和针(g20-0.9pm)抽吸小瓶1的内含物且快速喷射在小瓶2中的液体表面上。随后使所得bo-111制剂通过具有1到5pm范围的孔大小的膜过滤,确保除去较大的可见粒子。葡萄糖(或甘露醇)包括为小瓶1中的赋形剂以在最终bo-111制剂中达到5%(w/v)的浓度[即,所述组合物是通过以5%(所述组合物的重量/总体积)的浓度额外添加葡萄糖(或甘露醇)来形成的]。葡萄糖已广泛地用作提升bo-111的可接受渗透压(302mosm/kg)而不损害功能性或物理化学特征且避免因投与高浓度的甘露醇而导致的潜在非所需副效应的赋形剂。
[0325]
不同的bo-111制剂是通过不同孔尺寸的纤维素乙酸酯膜(nml注射过滤器;赛多利斯公司(sartorius))根据制造商的说明书过滤初始bo-111溶液一次或两次来生产的。替代地,使用离心机5415d/5415r(eppendorf)的固定角转子fa-45-24-11以指定速度将初始bo-111制剂离心15分钟。将通过膜过滤的流动液和离心上清液分别存储直到在4℃下以如由uv测定的0.5到0.8mg/ml的poly(i:c)浓度使用。随后在每一个实验之前重新计算poly(i:c)浓度,产生对于每一种病状具有相同剂量的样本。
[0326]
使用琼脂糖凝胶剂和未标记或经[
32
p]标记的poly(i)和poly(i:c)制剂测定bo-111制剂内的poly(i:c)分子尺寸。简单来说,将1pg的poly(i)和poly(i:c)(pbs)装载到琼脂糖凝胶中且在80伏特下在tbe缓冲液中进行电泳1小时。取决于初始poly(c)和poly(i)分子的尺寸分布,bo-111制剂中存在的poly(i:c)分子的尺寸分布测定为:<400个碱基,7%-57%(使用制剂进行的进一步测试呈现例如15%或21%);400-850各碱基,20%-45%(使用制剂进行的进一步测试呈现例如25%或27%);850-5000个碱基,20%-70%(使用制剂进行的进一步测试呈现例如52%或53%);>5000个碱基,0-9%(使用制剂进行的进一步测试呈现例如1%或0%)。
[0327]
分析型技术
[0328]
不同的bo-111制剂(在0.5到0.8mg/ml之间,经稀释以用于在1.0pg/ml的poly(i:c)浓度下的基于细胞的试验和其它试验)中的jetpei/poly(i:c)粒子的ζ平均(z-平均)直径和多分散指数的值是基于所述粒子为球形的假设,使用zetasizer nano zs根据制造商的说明书并根据iso 22412来测定的。一般来说,使用v7.11软件施加动态光散射(nanosizer技术)。
[0329]
bo-111制剂的功能性特征
[0330]
不同的bo-111制剂使用人类黑素瘤细胞人类胰腺细胞或人类黑色素细胞根据描述bo-110复合物的特性的文献(pozuelo-rubio m等人,2014;tormo d等人,2009;wo2011003883)来测试。简单来说,在治疗之前,对粘附细胞进行细胞存活率试验至少12小时。在指定时间和治疗浓度下细胞死亡的百分比是通过对合并的漂浮细胞和贴壁细胞的标准锥虫蓝去除试验,用0.4%锥虫蓝溶液(吉毕科实验室(gibco laboratories),格兰德岛,纽约,美国)且在光学显微镜下记分(计数每次治疗100到500个细胞的最小值)来估算的。每一种制剂测试12小时与48小时之间的时间段且不同制剂中的poly(i:c)分子的浓度在0.1
与2.5μg/ml之间。
[0331]
结果
[0332]
如文献(pozuelo-rubio m等人,2014;tormo d等人,2009;wo2011003883)中所描述的用于制备bo-110复合物的现有方法已在实验室规模上建立且相对于产生可在较大临床前规模上测试并接着用于临床评估的材料的要求具有一些重要局限性:有限的浓度(不超出0.05mg/ml)和有限的按比例放大的可能性且,同时使制造方法符合gmp。具体地说,制造方法应允许产生批量的调配物,所述调配物包含在不同制剂中具有尽可能一致的物理化学特征(如无菌性、粒度分布、稳定性、不具有可见粒子和在显微镜下才可见的粒子(sub-visible particles),和至少0.5mg/ml的浓度)的含poly(i:c)的粒子以用于正确地评估其在相关临床前模型和药物毒理学试验中的生物效应和医学用途。
[0333]
达到这些目标的第一步骤是取代将poly(i:c)溶液逐滴添加到jetpei溶液(或相反的,如在初始bo-110制剂中;wo2011003883)且将混合物保温在室温下的步骤。将混合速度识别为用于解决制造问题的可能重要的但又不被评估的因子。在这个范围下,新类型的poly(i:c)-pei调配物(名称为bo-111)是通过代替大量混合待冻干的溶液并封装到小瓶中的方法,用制备两个小瓶(每一个含有所需量的jetpei和poly(i:c)分子)的方法来形成的。通过注射(或由快速混合液体的其它构件,如快速移液)将两个小瓶的内含物快速混合,所述两种溶液具有类似的体积。所得溶液具有与稍后试验和用途相容的体积(例如0.5mg/ml的1.2ml bo-111制剂,由混合各自具有0.6ml体积的2种溶液产生的)。
[0334]
用于混合的注射器和针产生充足的湍流以促进快速混合且在bo-111制剂中快速形成粒子,具有有限的(或不具有)可见粒子。bo-111制造方法的具体技术细节可以通过例如提取盐类、去除生产残留物、用具有较大孔径(例如1与5pm之间的范围内)的过滤器过滤溶液、快速移液或涡流两种溶液、选择注射器尺寸/直径、快速添加poly(i:c)溶液dao jetpei溶液且不相反,或使用类似于葡萄糖或甘露醇的化合物作为赋形剂冻干制剂来调整以便使bo-111制剂的活性水平、可再生性水平、稳定性水平和/或均匀性水平进一步增加。
[0335]
然而,这些细节很难从小量的单一或即时使用转换到大规模制备符合gmp的医药调配物,所述医药配制物基于jetpei作为载剂且含有用于在药物毒理学或其它临床前评估期间测试高剂量所需要的足够地高浓度(至少0.5mg/ml)和均一浓度的poly(i:c)分子。此外,仅在投药之前将bo-111的组分混合的步骤在技术人员的手中留下最终物质的良好质量,尤其在形成含有具有较大且不完全受控的直径(尺寸)范围的bo-111粒子的澄清不浑浊的溶液方面。
[0336]
在此上下文中,下一步骤的目的是评估使bo-111粒子混合物的直径标准化的不同方式和效应。通过2-小瓶的快速移液方法获得的初始bo-111制剂用于产生并比较替代制剂,其中溶质如bo-111复合物的浓度和/或尺寸通过使用通用技术在溶液内改变,如在高速下(例如超出5000rpm)离心和过滤(例如在1到5pm范围中或在低于微摩尔范围中的孔尺寸)。
[0337]
这种初始分析展示:通过施加任何技术,所得bo-111制剂不仅呈现平均bo-111粒子直径减小,而且这类制剂针对癌细胞的细胞毒性出人意料地增加,并与bo-111复合物的平均直径的减小成比例(图1a)。这类增加的抗癌效应还在剂量反应研究中被证实,所述剂量反应研究展示:通过用较大的低于微摩尔孔尺寸过滤初始bo-111溶液获得的流通bo-111
溶液呈现特别是在较低bo-111浓度下,bo-111复合物的抗癌效应的已经显著增加(图1b)。通过使用bo-110制剂还证实细胞毒性的类似增加,所述制剂是通过具有0.8pm孔尺寸的过滤器过滤的。
[0338]
可以评估的其它标准是与jetpei特征相关的那些和相对于poly(i:c)分子的比率。在结构水平上,使用2-小瓶方法测试包括处于平均分子量范围内的直链pei的jetpei制剂。这类bo-111制剂的细胞毒性的比较(图2a)展示更高分子量(例如在17与23kda之间)的直链pei提供比包括具有较低分子量(例如8.3kda)的直链pei的那些更有效的抗癌bo-111制剂。
[0339]
除限定适用于制造具有所需抗癌特性的bo-111的直链pei尺寸范围以外,在bo-111制造背景下还测试在pei的胺与poly(i:c)分子的阴离子磷酸根之间的不同浓度比率的效应。jetpei与poly(i:c)分子之间的离子平衡可以提供呈现与细胞组分相互作用的不同水平(例如有效的细胞进入)。这种平衡被计算为n/p比率,定义了每一个聚核糖核苷酸磷酸根的jetpei的氮残留物量,用于活体内聚核糖核苷酸递送实验的值建议在6与8之间(避免毒性问题超出8,也就是0.16pl jetpei/pg双链poly(i:c)分子)。不同的bo-111制剂展示在此比率n/p从1.8增加到5.2时在黑素瘤细胞和正常的黑色素细胞两种上的剂量反应细胞毒素效应。实际上,仅在中间范围(大约3的比率n/p)下,针对黑素瘤细胞的细胞毒性远远优于针对正常黑色素细胞的细胞毒性,当相比于未治疗的细胞,后者细胞的存活率仅稍微地受到这种特异性bo-111制剂的影响(图2b)。
[0340]
bo-111制剂也已使用标记的或未标记的poly(i:c)批量来分析poly(i:c)分子的内含物。初始poly(i:c)批量制剂包含双链poly(i:c)分子,因此对于其制造和其退火,尺寸分布高达5千碱基长度(或更大),且至少40%或50%的这类双链具有高于0.85kb的尺寸且至少70%的这类双链聚核糖核苷酸具有在0.4与5kb之间的尺寸(在代表性制剂中,<400碱基对(bp):21%,400-850bp:27%,850-5000bp:52%)。当poly(i:c)分子使用2个小瓶方法与bo-111制剂内的复合物中的jetpei相反时,poly(i:c)分子d总数与jetpei相关,如通过用未标记的或标记的poly(i:c)制剂进行琼脂糖凝胶分析所展示(图3a和图3b)。通过电泳还测定在n/p比率低于3的bo-111制剂中,poly(i:c)分子不完全与jetpei相关,因为可以观测其具有更高的n/p比率(3或更高;图3c)。因此,恰当的制造方法允许将具有较宽尺寸分布的poly(i:c)分子有效地并入到生物学上的功能性bo-111制剂中,而不增加用于移除未复合的poly(i:c)分子或jetpei的特定程序。
[0341]
当重复或修改制造方法时,或当测试bo-111制剂的稳定性时还通过使用确定粒子在低于微米范围的尺寸分布的技术来评估结构性bo-111特征。在不同的bo-111制剂始终呈现单峰的粒度分布,且直径大部分集中在100nm,最通常的在50与90nm之间(85到90nm的平均直径(d.nm)),且较大部分的粒子具有小于100nm或200nm但不超出400nm,但通常甚至不超出300nm的尺寸的条件下证实这种制造方法的可再生性(图4a)。当这种参考bo-111制剂暴露于温度或培育时间差异时,直径分布可以改变,但其仍是单峰,峰值在100与150nm之间(105到110nm的平均直径(d.nm)),且较大部分粒子仍具有小于300nm且不超出600nm的直径(图4b和图4c)。当如图1a至图1b和图2a至图2b所描述测试时相应的bo-111制剂仍呈现类似的细胞毒性水平,从而证实这种混合程序可以提供与医药发展要求一致的调配物。然而,对方法的修改,如降低混合速度或不引入过滤程序可以改变bo-111复合物的尺寸分布,从而
变成双峰,具有不良受控的且更高的平均尺寸(d.nm)且较大部分的粒子超出500nm(图4d)。
[0342]
这些实验展示名称为bo-110的复合物的制造和调配方法可以通过在其使用之前应用以小比例快速且受控的混合组分来改进,从而产生更均一的、浓缩的且有效的基于poly(i:c)的制剂,名称为bo-111。然而,需要进一步改进以产生展示完全符合gmp制备的制剂以达到最高的稳定性和功效特征,而不依赖于恰好在医学使用之前确立程序。具体地说,“快速移液”方法或2-小瓶方法的其它变化形式仍可以提供大量的具有高于200nm(高达1pm或几微米)直径的粒子。将需要以提供所需无菌且浓缩的bo-111制剂(呈现较小的、更狭窄分布的、大约100nm的均一直径的功能性复合物)的额外(且可能仅部分有效的)过滤步骤可具有丢失保留在薄膜滤器中的大量物质的后果。因此,即使初始方法已允许用bo-111复合物直径与其治疗活性之间的反比关系形成小规模的bo-111制剂,但仍需要进一步的技术改进用于以便于批量制造符合gmp的稳定的医药调配物的方式形成并混合poly(i:c)分子和jetpei溶液,所述医药配制物包含具有狭窄的且受控的尺寸分布的基于poly(i:c)的复合物且随后可用于制造各自具有受控的且相当的特征[如调配物的poly(i:c)内含物、复合稳定性和生物活性]的几个小瓶。
[0343]
实施例2:用于在gmp下条件生产bo-11x制剂(bo-112调配物)的1-小瓶方法
[0344]
材料与方法
[0345]
制造bo-112制剂(1-小瓶方法)
[0346]
根据如实施例1中所描述的方案,将poly(i:c)制剂生产为具有浓度、分子尺寸分布的溶液。然而,在一个批次中,poly(i:c)本身是通过以下示范性过程获得的:在61℃到66℃下加热poly(c)溶液1.5h,之后将所述溶液与poly(i)混合并在55℃到58℃下搅拌70分钟,之后使所述混合物冷却且在0.2pm膜上过滤。适用于色谱法和/或过滤步骤的一些条件,不存在或存在冷冻步骤,以及缓冲和退火时间,被调适成进一步降低溶液粘度或复合物沉淀。甘露醇或葡萄糖在最终调配物中用作赋形剂。含有jetpei的溶液1是通过使用含jetpei的浓缩液体制剂或将jetpei的固体块制剂(具有在17与23kda之间的分子量)溶解于一定量的无菌水中以注射到达150mm,且混合以获得均匀的溶液来获得的。进行进一步稀释步骤以到达11.25mm的浓度,之后在最终小瓶中最终稀释到5.62mm。溶液2含有poly(i:c)分子和呈一定量的葡萄糖单水合物,在与jetpei混合之后,提供通过添加5%葡萄糖(重量/所述组合物的总量)和呈所述组合物总体积的0.5到0.7mg/ml的poly(i:c)所形成的溶液,由此所述poly(i:c)复合物具有所述jetpei,因此产生每小瓶具有108到10
10
个呈溶解状态的粒子的bo-112组合物。
[0347]
溶液1和溶液2独立地使用通过0.2pm过滤器(2 150 0.2pm,使用泵watson marlon(速度30rpm)充分验证为除菌级过滤器(根据astm f-838-05指导原则))的双过滤来除菌。两种溶液的自动化混合是在每一个小瓶中使用连续的过程来进行的:(i)使用watson-marlow泵将溶液1添加到小瓶中达到剂量5.95到6.05g(6ml;密度:1g/ml),(ii)使用flexicon泵以550rpm速度使用连接到g20-0.9μm针的1.8mm内径导管将溶液2添加到溶液1上达到剂量6.08到6.40g(6ml)。结果可以通过使用t型混合器来改进。在通过在制造方法的末端(或在其存储期间)目视检查仍存在的因静电相互作用所导致的粒子聚集体(例如具有在1到100μm或更大范围内的尺寸)情况下,产物可以在使用前(例如,在其注射之前)在0.8pm过滤器上过滤,以此既不改变生物特性也不改变组合物内粒子的单峰直径分布。举例
来说,bo-112调配物可以通过具有0.8pm排出尺寸的minisart注射器过滤器(赛多利斯)过滤。小瓶用无菌无热原质的橡胶塞子密封且用铝胶囊织缩并单独地标记。
[0348]
可商购的含poly(i:c)的调配物
[0349]
poly-iclc是用聚离胺酸和羧基甲基纤维素稳定的poly(i:c)制剂(ewel c等人,1992;w02005102278)。lyovec-hmw(目录号tlrl-piclv)和lyovec-lmw(目录号tlrl-picwlv)以及具有高分子量(hmw;目录名称tlrl-pic)和低分子量(lmw;目录名称tlrl-picw)的对应的poly(i:c)制剂购自invivogen。
[0350]
分析型测试
[0351]
根据实施例1使用标准的动态光散射设备进行bo-112的直径和分布分析。
[0352]
结果
[0353]
将所述定义的bo-11x制剂施加到通过恰当地混合含有类似于pei的聚合物的溶液与含有poly(i:c)分子的溶液而获得的医药组合物以便产生具有较小的狭窄分布的粒子直径范围的复合物(如由50与100nm之间且不超出300nm或甚至200nm的z-平均直径峰值界定,如实施例1中所展示)。如果bo-111制剂由恰好在进一步使用之前人工地进行的混合步骤(即“2-小瓶方法”)产生,那么对于确定“1-小瓶方法”已考虑到与gmp相关的和其它工业要求(例如使所述方法自动化),所述1-小瓶方法提供遵守所需的医药规格和备用以注射的bo-11x调配物。在此范围下,两种溶液单独地制备(且在poly(i:c)溶液还包括一种或多种赋形剂的情况下)并通过在自动化系统中混合之前过滤来除菌,在所述自动化系统中控制并维持每一个小瓶的混合速度和时间。
[0354]
图5a提供用于产生第一类型的bo-11x制剂(名称为bo-112调配物)的这种方法的综述,其中原料药(即,由对poly(i)和poly(c)单链分子进行退火而产生的双链poly(i:c)分子)首先与含类似于葡萄糖的赋形剂的溶液混合,所述溶液通过单独地从含有具有载剂功能的聚合物(即jetpei)的溶液过滤来除菌。随后,将这两种大量制剂恰当地混合到每一个小瓶中以产生大量结构上和功能上相当的药物毒理学研究和临床应用所需要的医药调配物。
[0355]
这种方法利用实施例1中所描述的研究结果,且所述方法可以自动化以提供具有甚至更均一特征的bo-112制剂。这种混合程序不仅允许将所有可获得的葡萄糖、jetpei和poly(i:c)分子并入到bo-112制剂内的复合物中(图5b)而且允许调节bo-112制剂内的复合物的平均直径和单峰直径分布以使得z-平均值可以调节在30与150nm之间(图5c)。所得bo-112制剂呈现bo-112复合物具有单峰直径分布,即使在混合散装溶液1和2之后不经由5pm过滤最终溶液也不具有可见粒子。混合条件可以具体地通过将混合速度更改在50rpm与600rpm之间和/或将poly(i:c)或jetpei溶液的流速更改在1ml/min与50ml/min之间来调适。
[0356]
一般来说,b0-11x制剂(且具体地说bo-112制剂)呈现以下主要特征:无色,无可见粒子,渗透性包含在260与340mosm/kg之间,ph包含在2.7与3.4之间,在+1500与+3750之间的旋光度,等于或大于30mv的ζ电位、,单峰直径分布的粒子具有在30与150nm之间、但优选地在60nm与130nm之间的z-平均直径(nm),且包含poly(i:c)分子,其中至少40%或50%的这类双链聚核糖核苷酸具有高于0.85kb的尺寸且至少70%的这类双链聚核糖核苷酸具有包含在0.4与5kb之间的尺寸。粒子的特征(如直径分布)可以通过与溶液1和溶液2两种的不
同流速组合使用t型混合器来改良。当这种速度大于20ml/min(例如30ml/min)时,所得bo-112制剂的浑浊度随着z-平均粒子直径和直径分布围绕这个值减小的同时减小,而可能由于流动状态的改变而维持单峰性。
[0357]
示范性bo-112制剂展示类似于bo-111(用6.924mg的poly(i:c)、5.625mm jetpei、5%葡萄糖形成的)的组合物,但每一个小瓶包含具有在45+/-5nm与81+/-5nm(例如73+/-5nm)之间的z-平均直径的粒子(其中至少50%的粒子小于85+/-20nm)、38mv的ζ电位和ph 3.1。在-20℃下或广泛暴露在室温下的冷冻/解冻周期之后所维持的这些结构特性可以在不同批料中被修改,将验收准则维持在特定范围值内(例如,bo-112调配物可以呈现100+/-50nm(例如89nm)的z-平均直径),且电位z包含在约40与45mv(例如43mv)之间。这些值可以根据低温保存来修改,但它们其仍可以保持在这些范围内。
[0358]
这类可再生性和验收准则中的至少一些可以与其它已知其抗癌活性的含poly(i:c)的调配物的一种相比。在poly(i:c)分子尺寸的水平下,包括于可商购lyovec-hmw和lyovec-lmw中的poly(i:c)分子涵盖与实际利用的bo-11x制造方法中的那些明显不同的尺寸范围(其中hmw几乎完全大于0.85kb且lmw几乎完全小于0.85kb;图6a)。poly(i:c)分子的这种尺寸差可以取决于不同的制造方法和/或在复合物中与poly(i:c)分子结合的载剂。将poly-iclc(包含聚离胺酸和羧基甲基纤维素)和lyovec-hmw/lyovec-lmw(根据制造商,包含阳离子脂质类的转染试剂双-十四烷基磷酰基-n,n,n-三甲基甲基氯化胺,或dtcpta和中性脂质1,2-二植烷酰基-sn-甘油-3-磷酸乙醇胺,或dippe)内的基于poly(i:c)的复合物内的复合物的z-平均值与bo-112调配物中的一种相比,展示出这些可商购的调配物含有大许多的复合物(较大部分大于200nm)且至少对于lyovec-lmw,具有双模态分布(图6b)。
[0359]
如果在冷冻/解冻周期之后进行这种分析,那么这些可商购的制剂还呈现较小的稳定性,且对于bo-112没有观测到变异性(图7a-图7d)。实际上,如果bo-112调配物100+/-50nm(例如82.5nm)且不超出400nm的z-平均直径(d.nm),如在bo-111调配物中(参见图4a-图4d和图6b),lyovec类和poly-iclc调配物具有大于300nm的z-平均值,那么由此证实可商购的poly(i:c)提供为在组合物中为异质的制剂或包括在功能上未充分表征的较大粒子且其尺寸在冷冻/解冻周期期间被更改。
[0360]
增色性还可以用于评估bo-112调配物,且具体地说双链poly(i:c)分子在粒子内的稳定性作为温度(或其它条件)改变的结果,从而测定poly(i)链与poly(c)链之间的间隔。bo-112调配物展示非常低的增色性效应,且在260nm下的透光率差异小于0.2或0.1。还评估和证实了bo-11x小瓶在-20℃下冷冻不同时间的稳定性。
[0361]
在投与之前对bo-112调配物的过滤、冻干和冷冻相对于初始bo-112调配物并未促进对组合物内的粒子的细胞毒素特性、稳定性或结构特征显著改良。举例来说,组合物维持小于250nm的d90%、在40mv与50mv之间的ζ电位、具有在30与150nm之间的z-平均值的流体动力学直径、与使用葡萄糖作为赋形剂的相容性、包含在0.1与0.6之间的多分散性值,和欧洲药典(european pharmacopoeia)的其它可适用标准。
[0362]
因此,bo-11x制剂(如bo-112制剂)为针对粒子呈现高水平稳定性和可再生性的调配物,所述粒子是由具有小于200nm(当不小于100nm时)的z-平均直径(d.nm)的poly(i:c)-jetpei复合物形成的,对于基于其它载剂和制造方法的可商购poly(i:c)调配物未观测到所述稳定性和可再生性。
[0363]
实施例3:基于细胞的模型中的bo-11x制剂的功能性特征
[0364]
材料与方法
[0365]
poly(i:c)调配物
[0366]
已根据实施例2中所述来获得poly(i:c)制剂。
[0367]
细胞存活率的分析
[0368]
人类黑素瘤细胞系sk-mel-103和人类胰脏癌细胞系panc 02.03已如实施例1和本文中所列举的文献中所描述来使用,使用含有在0.3与2.5μg/ml之间(0.85pg/ml是最恰当的参考值)的范围内的poly(i:c)分子的浓度的poly(i:c)调配物且暴露细胞持续包含在12与48小时之间的一段时间。
[0369]
在正常黑色素细胞和来自黑素瘤和胶质母细胞瘤的细胞系中测试bo-112的诱导死亡活性并与分离的组分(即poly(i:c)分子和直链pei(jet pei;polyplus))进行比较。正常的黑色素细胞是从无症状供体的包皮中分离出的。黑素瘤细胞sk-mel-28、sk-mel-103和uacc62(分别在p53、nras和braf中具有突变)是从atcc或纪念斯隆凯特琳癌症中心(memorial sloan kettering cancer centre)(美国)处已建立的集合中获得的且经历用于细胞系认证的短串联重复序列(str)分析(10系统)。将细胞接种在96孔板(6000个细胞/孔)上。每个实验重复三次,用仅poly(i:c)、以0.5或1μg/ml的bo-110或bo-112调配物治疗24h或40h。
[0370]
结果
[0371]
实施例1和实施例2展示引起bo-11x调配物抗癌细胞的细胞毒性相比于bo-110增加的关于bo-11x调配物的初始发展和特征化的实验数据。这些数据可以通过比较bo-11x制造方法且用文献中公开的方法和制剂产生含poly(i:c)的制剂来进一步整合。
[0372]
实施例2已展示可商购的lyovec-hmw和lyovec-lmw具有实质上不同的分布。然而,可以评估对应的poly(i:c)whe和lmw制剂中的poly(i:c)分子的不同尺寸还可以影响使用bo-11x制造方法和poly(i:c)hmw和lmw所产生的复合物的活性的程度。如果bo-112调配物的细胞毒素活性与可商购的调配物进行比较,那么在至少两种活体外模型中后者调配物在杀灭癌细胞上呈现效率更低(图8a和图8b)。在不同类型的癌细胞系(代表不同的临床癌症适应症)中测量bo-11x的细胞毒素活性以评估bo-11x更高效地治疗哪种癌症适应症。还可以通过测量已知蛋白质的表达和/或分泌来研究这些效应以改良并可能地改善抵抗癌细胞的细胞反应。举例来说,在至少24小时的时间段内,bo-112调配物比poly-iclc更高效地诱导黑素瘤细胞系中的干扰素-β表达(图8c)。这种活体外证据可用于不仅评估哪种类型的癌症可以通过投与bo-11x调配物来更高效地治疗而且评定哪种其它癌症治疗(如疫苗、助剂、抗体、化学治疗药物、放射线疗法、免疫疗法、或酶活性(激酶)抑制剂)在与bo-11x调配物组合投与时可以更有效的方式起作用(例如,通过减少用这种其它方法治疗的剂量、频率和/或时间)。
[0373]
实际上,bo-11x调配物(如针对实验室规模的bo-110调配物的先前描述;tormo d等人,2009)抵抗癌细胞系且不抵抗正常原代细胞的这种细胞毒素效应的特异性是通过比较与恰当化合物和细胞对照的活性来进行活体外证实的(图9)。直链pel或poly(i:c)分子皆不独自以显著的方式影响肿瘤细胞(黑素瘤或神经胶质瘤)的生存率。仅在直链pei和poly(i:c)分子复合时,观测到肿瘤细胞的大量杀灭,而不影响正常黑色素细胞的生存率。
类似的基于细胞的方法已经用于验证bo-11x(且具体地说bo-112调配物)已经受过滤、冻干和/或冻结,从而确认在这类方法之后细胞毒素效应定性且定量的保持在bo-112制剂中。可以使用不同的临床前模型对这些活体外数据进行更多的深度分析以引导临床发展,所述模型包括制造并比较不同的bo-11x调配物、不同的投药方案和/或与疾病(如癌症)相关的病状。
[0374]
实施例4:动物模型中的bo-11x制剂的功能性特征
[0375]
材料与方法
[0376]
bo-11x调配物和其它化合物
[0377]
bo-112调配物已根据实施例2中所描述来获得,且根据动物的每千克体重的给药量用5%葡糖pbs溶液(媒剂;参考物:be14-516f,龙沙(lonza),法国)稀释成三种不同浓度,分别为0.05mg/kg、0.5mg/kg和2.5mg/kg。
[0378]
选择鼠类抗pd-l1抗体(invivoplus,纯系10f.9g2)作为组合免疫疗法化合物。每天向小鼠注射,抗pd-1抗体用媒剂稀释成最终浓度1.5mg/ml。
[0379]
结果
[0380]
在植入有鼠类黑素瘤细胞的免疫胜任小鼠品系中活体内探究bo-112调配物的活体内抗癌功效。使用pbs溶液或与鼠类抗pd-l1抗体(优选经静脉内投与)组合使用三种不同浓度(0.05、0.5或2.5mg/kg,优选地瘤内投与)的bo-112调配物治疗小鼠并与单独的媒剂比较3周(图10a)。与媒剂组合的抗pd-l1抗体当与单独的媒剂比较时并未显著地增加存活率。与抗pd-l1一起测试的所有三种bo-112调配物组合(且可能独立地形成这类抗体)与单独的媒剂或抗pd-l1比较时显著地增加小鼠的存活率。此外,相比于低剂量的bo-112调配物,2.5mg/kg bo-112调配物+抗pd-l1的组合中的存活率显著增加。这些结果与这些组中测量的肿瘤尺寸相关。
[0381]
抗pd-l1抗体是重要的且经验证的抗癌药物,且是抵抗癌细胞的有效免疫反应的介体。我们的实验表明bo-11x复合物可以以其它抗癌剂组合使用,且bo-11x化合物与其它抗癌剂(如抗pd1)的组合具有比单独的抗癌剂更优良的效能,从而导致存活率和抗肿瘤功效显著增加。此外,存活率的提高与组合中的bo-11x调配物的剂量增加相关,从而支持通过bo-11x调配物来调节存活率增加的益处。
[0382]
因此,bo-11x调配物可用于(单独的或与其它抗癌剂(如抗体、免疫疗法或化学疗法)组合,可以使用相同或不同途径来投与)治疗黑素瘤和其它适应症,尤其允许瘤周或瘤内注射的那些癌症适应症,如胰腺癌、子宫内膜癌、卵巢癌或结肠直肠癌。在这种范围下,特异性生物路径的识别和作用机制可以引导最恰当的剂量、方案、与其它药物或疗法的组合,以及bo-11x调配物的指示,如靶向pd-1或cd137的免疫调节单克隆抗体和增强树突状细胞活性的poly(i:c)的组合效应所展示(sanchez-paulete ar等人,2015)。为此目的,duewell p等人,2015公开可以用于测试本发明的组合物的替代的动物疾病模型。
[0383]
可以通过进行活体内研究瘤内(i.t.)投与跨越一定浓度范围的poly(i:c)分子(如0.5、1、2、2.5或5mg/kg)来测量bo11x对肿瘤生长的治疗效果(局部和/或末端部位)和抗肿瘤免疫反应以评估在或不在共投与其它药物或疫苗的情况下,这类治疗如何提高恰当模型(如小鼠黑素瘤模型)中的小鼠存活率。同时,由bo-11x治疗诱导的关于特异性生物活性的剂量反应研究可以并行地在活体外使用处于细胞凋亡诱发水平(由半胱天冬酶相关的辉
光)人类或动物样本、生物流体中的趋化因子/细胞因子分泌(例如il-6和ip-10的分泌)、活体外细胞活化和/或增殖(例如,与cd40、cd86、cd69在相关细胞类型上的上调相关)来评估。这些研究可以使用直接参与疾病(例如,肿瘤细胞、上皮细胞、内皮或上皮细胞)或间接参与实施一些免疫或免疫调节活性(例如人类外周血单核细胞、nk细胞、b细胞、cd4+/cd8+t细胞、树突状细胞)的细胞来进行。这些研究可以进一步关联到对可以用作生物标记的分子的识别以预测对bo-11x的反应(或不具有所述反应)以便分层用于bo-11x治疗的疾病阶段和/或患者群。
[0384]
参考文献
[0385]
ammi r等人,2015,《药理学与治疗学(pharmacol.ther.)》;146:1 20-31。
[0386]
amos sm等人,2011,《癌症免疫与免疫治疗(cancer immunol.immunother.)》;60:671-83。
[0387]
bald t等人,2014.《癌症探索(cancer discov.)》;4:674-87。
[0388]
bhoopathi p等人,2014《癌症研究(cancer res.)》;74:6224-35.
[0389]
bilensoy e,2010.《药物传输的专家评论(expert opin.drug deliv.)》;7:795-809。
[0390]
chen l等人,2013.《国际纳米医学杂志(int.j.nanomed.)》;8:137-145。
[0391]
chiba y等人,2013.《公共科学图书馆期刊(plosone.)》;8:e76159。
[0392]
cho k等人,2016,《免疫生物学(immunobiology)》,pii:s0171-2985(16)30359-x.doi:10.1016/j.imbio.2016.08.012。
[0393]
cobaleda-siles m等人,2014.《微小(small.)》;10:5054-67。
[0394]
duewell p等人,2015.《肿瘤免疫学(oncolmmunol.)》;4(10):e1029698。
[0395]
ewel c等人,1992.《癌症研究(cancer res.)》;52:3005-10。
[0396]
fujimura t等人,2006.《欧洲免疫学杂志(eur.j.immunol.)》;36:3371-80。
[0397]
galluzzi l等人,2014.《肿瘤标靶(oncotarget)》5:12472-508。
[0398]
garcia-pascual c和gomez r,2013.《子宫内膜盆腔疼痛疾病杂志(j.endometr.)》5(增刊1):s13(sp-04)。
[0399]
germershaus o和nultsch k,2015.《美国药学杂志(asi j pharm sci.)》10:159-175。
[0400]
gupta s等人,2016.《肿瘤生物学(tumor biol.)》37:12089
–
12102。
[0401]
hafner a等人,2013.《先进药物递送综述(advanced drug delivery rev.)》;65(10):1386-1399。
[0402]
ho v等人,2015.《肿瘤标靶(oncotarget)》6:27252-27266)。
[0403]
islam m等人,2014.《控制释放杂志(journal of controlled release)》;193:74-89。
[0404]
kabilova t等人,2014.《bmc癌症(bmc cancer.)》;14:338。
[0405]
keir m等人,2008.《免疫年度评论(annu.rev.immunol.)》;26:677-704。
[0406]
kubler k等人,2011.《欧洲免疫学杂志(eur.j.immunol.)》;41:3028-39。
[0407]
kurosaki t等人,2009.《生物材料(biomaterials)》,30:2846-2853。
[0408]
le u等人,2008.《肿瘤生物治疗学(cane.biol.ther.)》;7:440-447。
[0409]
le u等人,2009.《放射治疗与肿瘤学(radiother.oncol.)》;90:273-279。
[0410]
levitzki a,2012.《肿瘤学前沿(front.oncol.)》;2:4。
[0411]
matijevic t等人,2011.《化学疗法(chemotherapy)》57:460-7。
[0412]
mcbain s等人,2007.《材料化学杂志(j.mater.chem.)》;17:2561-2565。
[0413]
nagato t和celis e,2014.《肿瘤免疫学(oncoimmunology)》3:e28440。
[0414]
ohashi t等人,2013.《国际癌症杂志(int.j.cancer)》;133:1107-18。
[0415]
palchetti s等人,2013.《皇家化学学会进展(rsc adv.)》;3:24597-24604。
[0416]
perrot i等人,2010.《免疫杂志(j.immunol.)》185:2080-2088。
[0417]
pozuelo-rubio m等人,2014.《先进递送科学与技术中的纳米肿瘤学(nano-oncologicals in adv.del.sci.tech.)》,斯普林格出版社(springer),第453-470页。
[0418]
saheki a等人,2011.《国际制药学杂志(int.j.pharm.)》;406:117-21。
[0419]
sajadian a等人,2014.《病毒性分析(arch.virol.)》;159:1951-1960。
[0420]
sanchez-paulete ar等人,2015.《癌症探索(cancer discov.)》pii:cd-15-0510。
[0421]
schaffert d等人,2011.《药物研究(pharm.res.)》,28:731-741。
[0422]
shabani m等人,2010.《阿维森纳医学生物技术(avicenna j.med.biotech.)》;2:123-130。
[0423]
storz u,2011.《机械式防抱死制动系统(mabs.)》;3:310-7。
[0424]
szabo a等人,2012.《黑素瘤研究(melanoma res.)》;22:351-361。
[0425]
taura m等人,2010.《癌症科学(cancer sci.)》;101:1610-7。
[0426]
tormo d等人,2009.《癌症细胞(cancer cell)》16:103-114。
[0427]
tutin-moeavin i等人,2015《有机与生物分子化学(org&biomol chem)》13:9005-9011.
[0428]
vacchelli e等人,2013.《肿瘤免疫科学(oncoimmunology)》;2:e25396,e23510,e25595。
[0429]
van der jeught k等人,2015.《肿瘤靶标(oncotarget)》;6:1359-81。
[0430]
vega-letter a等人,2016.《干细胞研究与治疗(stem cell res.&ther.)》7:150。
[0431]
yoshino h和kashiwakura i,2013.《血液学(blood)》;122:4721。
[0432]
yu l等人,2016.《免疫细胞生物学(immunol cell biol.)》94:875-885。
[0433]
zhang y等人,2014.《癌症快报(cancer lett.)》355:76-84。
[0434]
zhou y等人,2013.《先天免疫系统学(innate immun.)》;19:184-192。
[0435]
wo2004045491。
[0436]
wo2005102278。
[0437]
wo2011003883。
[0438]
《雷明顿药物科学(remington’s pharmaceutical sciences)》,allen,loyd v.,jr编辑,第22版本,2012。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1