一种口服载小分子核酸药物微球的制备方法及应用与流程
[0001]
本发明属于生物材料领域,尤其涉及一种口服载小分子核酸药物微球的制备方法及应用。
背景技术:
[0002]
炎症性肠病(ibd)是一种慢性胃肠道炎症性疾病,其复发率极高进而增加了结肠癌的发病风险,严重影响患者愈后的生活质量。在目前的临床治疗中,口服方式因其无痛、操作简单、安全自主等独特优点,是大多数患者最能接受的治疗途径之一。然而,大部分口服药物的疗效往往受到复杂的消化道内环境限制,导致药物吸收及代谢不良,极大影响药物的生物利用率。单分散性微胶囊是用高分子材料制备的胶囊壁层将药物活性分子,生物大分子如小分子核酸、蛋白质等包裹在内部而形成微胶囊。这样的微胶囊结构具有诸多优点,不仅可以保护内部包裹的物质,增加其稳定性、长效性,还能够实现控制释放内部活性物质,具有良好的缓释性和控释型。
[0003]
传统的载药微球的制备方法主要包括乳化溶剂挥发法、相分离法、喷雾干燥法等,其设备和操作步骤都较为复杂,最终得到的微球结构差异大、单分散性差。另外,由于机械搅拌的剧烈性,导致产生的乳滴碰撞、破碎,使其中的药物扩散出去造成损失,同时强大的机械外力也会引起生物活性药物失活,使制备的载体药物装载率低。因此传统制备工艺已经不能满足当今高质量高标准的要求。
技术实现要素:
[0004]
本发明提供一种口服载小分子核酸药物微球的制备方法及应用,以克服现有传统口服微球载体制备较复杂、药物装载率及治疗效率低等技术缺陷。
[0005]
为实现上述目的,本发明提供一种口服载小分子核酸药物微球的制备方法,具有这样的特征:所述口服载小分子核酸药物微球包括微球核壳结构的外壳和内容物,外壳为尤特奇(eudragit)结肠溶包衣涂层,内容物为生物可降解载体和稳定掺入的纳米核酸药物;
[0006]
所述口服载小分子核酸药物微球的制备方法包括以下步骤:
[0007]
步骤一、阳离子化魔芋多糖与小分子核酸药物复合的纳米核酸药物的制备:制备阳离子化魔芋多糖,配制阳离子化魔芋多糖溶液,加入小分子核酸药物溶液,静置反应0.5~2h,即得到稳定的纳米核酸药物。
[0008]
步骤二、负载纳米核酸药物微球的制备:配制生物可降解载体的溶液,将所述纳米核酸药物按0.5~10%w/v比例均匀混合于生物可降解载体溶液中,作为内相,采用微流控装置,设置共轴微流控装置参数后,在不混融的外相流体剪切作用下产生具有可控尺寸及良好分布的液滴,聚合或者固化后获得负载纳米核酸药物的微球;取出用乙醇清洗两遍,冻干保存。微球大小可通过内相毛细管直径及内外相流速进行调控。
[0009]
步骤三、包衣涂层外壳的制备:配制eudragit结肠溶水分散体包衣液,将预调量的
eudragit结肠溶水分散体包衣液装载于包衣设备,设置好喷液速率和其他操作参数,利用包衣设备对负载纳米核酸药物的微球进行包衣,即获得所述口服载小分子核酸药物微球。
[0010]
进一步,本发明提供一种口服载小分子核酸药物微球的制备方法,还可以具有这样的特征:其中,步骤一中,阳离子化魔芋多糖的制备方法为:称取魔芋多糖(kgm)于二甲基亚砜(dmso)中,加热溶解2~4h,40~60℃,冷却至室温,加入过量的羰基二咪唑(cdi),室温反应2~4h充分活化,再加入过量的乙二胺,继续搅拌使其充分反应,透析,冻干抽真空即得阳离子化魔芋多糖(ckgm);其中,魔芋多糖与二甲基亚砜的摩尔比为1∶10
6
~1∶10
8
,魔芋多糖与羰基二咪唑的质量比为1∶2~1∶4,魔芋多糖与乙二胺摩尔比为1∶10
5
~1∶10
6
。
[0011]
进一步,本发明提供一种口服载小分子核酸药物微球的制备方法,还可以具有这样的特征:其中,步骤一中,所述阳离子化魔芋多糖与小分子核酸药物的质量比是1∶0.5~1∶10,阳离子化魔芋多糖溶液浓度为1~10%w/v。
[0012]
进一步,本发明提供一种口服载小分子核酸药物微球的制备方法,还可以具有这样的特征:其中,步骤一中,所述小分子核酸药物选自tnf-αaso或tnf-αsirna中的一种或两种。
[0013]
进一步,本发明提供一种口服载小分子核酸药物微球的制备方法,还可以具有这样的特征:其中,步骤二中,所述生物可降解载体选自甲基丙烯酸酯丝素蛋白(sima)、聚乙二醇双丙烯酸酯(pegda)、甲基丙烯酸酯明胶(gelma)、海藻糖、羧甲基纤维素、甲基丙烯酸酯透明质酸(hama)、聚乳酸-羟基乙酸共聚物(plga)、半乳糖、糊精、麦芽糖、聚乳酸(pla)、聚乙烯吡咯烷酮(pvp)、聚乙烯醇(pva)、聚二甲基硅氧烷(pdms)中的一种或两种以上材料;生物可降解载体溶液的浓度为1%~20%。根据选用生物可降解载体材料的性质,通过紫外光聚合/固化、溶剂挥发、冻结、交联等方法使其固化或聚合。
[0014]
进一步,本发明提供一种口服载小分子核酸药物微球的制备方法,还可以具有这样的特征:其中,步骤二中,所述外相选自花生油、橄榄油、火麻油、玉米油、山茶油、棕榈油、葵花子油、大豆油、芝麻油、亚麻籽油、葡萄籽油、核桃油中的一种。
[0015]
进一步,本发明提供一种口服载小分子核酸药物微球的制备方法,还可以具有这样的特征:其中,步骤二采用微流控装置制备负载纳米核酸药物微球时,内相毛细管的内径为70~120μm,内外相流速参数分别设置为0.1~0.6ml/h、5~30ml/h。
[0016]
进一步,本发明提供一种口服载小分子核酸药物微球的制备方法,还可以具有这样的特征:其中,步骤二制备的负载纳米核酸药物微球的尺寸为100~300μm。
[0017]
进一步,本发明提供一种口服载小分子核酸药物微球的制备方法,还可以具有这样的特征:其中,步骤三中,所述eudragit结肠溶水分散体包衣液选自eudragit fs30d或eudragit s100水分散体的一种;所述eudragit结肠溶水分散体包衣液的质量分数为1~5%w/v;所述eudragit s100水分散体成分为甲基丙烯酸酯∶甲基丙烯酸质量比=1∶2,含有50~70%的柠檬酸三乙酯增塑剂。
[0018]
本方法制备出的口服载小分子核酸药物微球中,利用微流控技术制备的负载纳米核酸药物微球中小分子核酸药物的携载量为0.01~1μg/个。负载纳米核酸药物微球中的生物可降解载体具有可控尺寸的孔隙结构,孔隙大小为1~10μm,可以控释、缓释纳米核酸药物。
[0019]
本发明提供上述口服载小分子核酸药物微球在制备治疗炎症性肠病肠道药物中
的应用。
[0020]
本发明的有益效果在于:
[0021]
一、本发明首先分析结肠口服给药系统特征,结合生物可降解材料的性质,通过微流控技术联合成熟的包衣工艺,构建出包裹核酸纳米药物的结肠溶抗炎微球,实现抗炎小分子核酸药物口服递送到结肠部位,通过缓控释药物缓解炎症疾病的作用。方法简单,操作方便,且不需要很高的技术要求。具体的,口服结肠靶向给药目的在于,活性药物通过胃、小肠成功到达结肠部位,并发挥治疗功能。阳离子化魔芋多糖具有靶细胞-巨噬细胞的配体,能够携载小分子核酸特异性进入巨噬细胞;小分子核酸能够抑制靶基因的表达水平;生物可降解载体是纳米药物的载体,同时其具有可控尺寸的孔隙结构,可以控释、缓释纳米核酸药物;包衣是最外层能够抵抗胃酸的涂层材料。
[0022]
二、本发明通过高精度控制微球体积大小的单乳液微流控技术,高度优化了微球的尺寸结构特征,突出核壳的功能,从而实现抵抗消化液(胃酸、压力、消化酶),靶向到结肠,实现控释缓释的功能,解决了传统软胶囊工艺中涂层厚度不均一、结构简单、差异性较大的问题。本发明提出了包衣技术联合单乳液微流控制备包裹具有巨噬细胞靶向性的小分子核酸纳米药物,形成具有抗消化功能(防胃酸和消化酶提前破坏微球结构造成药物突释)以及结肠定位释放的口服微球,实现了长时间给药和药物缓释,实用性强。其中,液滴微流控技术是利用流体界面张力,不相容的外相液体剪切而形成微乳液,液滴的大小由微通道的尺寸大小和结构而决定。在载药微球的表面包裹一层结肠溶的甲烯酸树脂后形成的一种均匀稳定的包衣,既具有胶囊剂的缓控释性又具有包衣材料的结肠靶向性。通过改变内外相流速不仅可以准确地控制单个乳化液地的大小和结构,同时避免了通过扩散及表面相互作用而造成的污染,灵活、省时、方便。
[0023]
三、本发明提供了一种小分子核酸的口服给药途径及其相关医学应用,缓解了小分子核酸类口服微球在消化道被蛋白酶和酸破坏的问题,同时确保了小分子核酸药物在结肠肠道内长时间稳定发挥抗炎生物功能,使小分子核酸口服微球可以在体内达到治疗最小剂量,缓解结肠相关疾病症状,实现无痛、安全、自主给药。
附图说明
[0024]
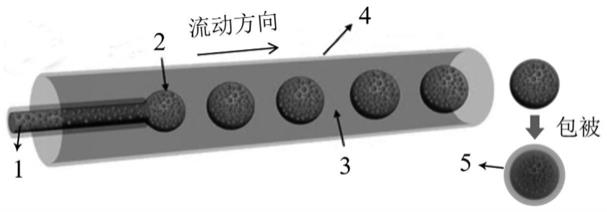
图1是口服载小分子核酸纳米药物微球的制备过程示意图,其中1为ckgm&tnf-αaso/sirna复合纳米结构,2为生物可降解载体,3为食用油,4为单乳液共轴微流控装置,5为包衣材料;
[0025]
图2是单乳液玻璃毛细管微流控装置;
[0026]
图3是gelma微球的表征分析,其中a图为微球形貌结构,b为微球尺寸大小的分布图;
[0027]
图4是液滴微流控技术的内、外相流速对口服载小分子核酸微球尺寸的影响图示;
[0028]
图5是口服载ckgm&tnf-αaso的gelma微球在dss诱导的结肠炎组织内的生物分布图示;
[0029]
图6是口服载ckgm&tnf-αaso的gelma微球对dss诱导的小鼠炎症性肠病的疗效考核,其中a为口服载ckgm&tnf-αaso的gelma微球治疗dss诱导的肠炎小鼠的结肠照片,b为口服载ckgm&tnf-αaso的gelma微球治疗dss诱导的肠炎小鼠结肠h&e病理图片。
具体实施方式
[0030]
以下结合具体实施例对本发明作进一步说明。
[0031]
实施例1
[0032]
本实施例提供一种口服载小分子核酸药物微球的制备方法,具体的是口服载ckgm&tnf-αaso纳米核酸的gelma微球的制备方法,制备过程如图1所示,包括以下步骤:
[0033]
步骤一、ckgm&tnf-αaso复合纳米药物的制备:
[0034]
称取kgm于dmso中,加热溶解4h,60℃,冷却至室温,加入过量的cdi,室温反应3h充分活化,再加入过量的乙二胺,继续搅拌使其充分反应,透析,冻干抽真空即得ckgm。配制10%w/v的ckgm溶液,加入小分子核酸类药物溶液,静置反应0.5h,即得到稳定的纳米核酸药物。其中的kgm与dmso的摩尔比为1∶10
6
,kgm与cdi的质量比为1∶2,kgm与乙二胺摩尔比为1∶10
5
,ckgm与tnf-αaso的质量比是1∶5。
[0035]
步骤二、载ckgm&tnf-αaso的gelma微球的制备:
[0036]
配制15%w/v gelma水溶液,将核酸药物按0.5%w/v比例均匀混合于gelma溶液中作为内相,采用如图2所示的微流控装置,设置共轴微流控装置参数后,在大豆油外相的剪切作用下产生具有可控尺寸及良好分布的gelma液滴,紫外光固化60s后获得包裹药物的微球,取出用乙醇清洗两遍,冻干保存。gelma微球尺寸大小可通过内相毛细管直径及内外相流速进行调控。
[0037]
本实施例中,外相流速为5ml/h,内相流速为0.5ml/h,内相毛细管直径为80mm,制备出包含0.01%tnf-αaso的gelma液滴,在紫外光照射下固化,得到单分散性较好的微球。如图3所示,其中3a为紫外固化单乳液gelma载药微球的体视显微镜照片,3b为统计后的粒径分布;固定内相直径为100mm,只需要调节两相流体的相对流速,就可以制备出不同尺寸的微球。见图4a和4b,不同的内外相流速对gelma微球尺寸大小的影响。
[0038]
其中,gelma也可以替换为甲基丙烯酸酯丝素蛋白(sima)、聚乙二醇双丙烯酸酯(pegda)、甲基丙烯酸酯明胶(gelma)、海藻糖、羧甲基纤维素、甲基丙烯酸酯透明质酸(hama)、聚乳酸-羟基乙酸共聚物(plga)、半乳糖、糊精、麦芽糖、聚乳酸(pla)、聚乙烯吡咯烷酮(pvp)、聚乙烯醇(pva)、聚二甲基硅氧烷(pdms)中的一种或两种以上材料。根据选用生物可降解载体材料的性质,通过紫外光聚合/固化、溶剂挥发、冻结、交联等方法使其固化或聚合。
[0039]
大豆油也可以替换为花生油、橄榄油、火麻油、玉米油、山茶油、棕榈油、葵花子油、芝麻油、亚麻籽油、葡萄籽油、核桃油中的一种。
[0040]
步骤三、包衣涂层外壳的制备:
[0041]
配制5%w/v eudragit fs30d水分散体,将预调量的eudragit fs30d水分散体装载于包衣设备,设置好喷液速率和其他操作参数,实现微球的包衣过程。
[0042]
实施例2
[0043]
本实施例提供一种口服载小分子核酸药物微球的制备方法,具体的是负载ckgm&tnf-αsirna纳米核酸的gelma微球的制备,包括以下步骤:
[0044]
步骤一、ckgm&tnf-αsirna复合纳米药物的制备:
[0045]
称取kgm于dmso中,加热溶解4h,60℃,冷却至室温,加入过量的cdi,室温反应3h充分活化,再加入过量的乙二胺,继续搅拌使其充分反应,透析,冻干抽真空即得ckgm。配制
10%w/v的ckgm溶液,加入小分子核酸类药物溶液,静置反应0.5h,即得到稳定的纳米核酸药物。其中的kgm与dmso的摩尔比为1∶10
6
,kgm与cdi的质量比为1∶2,kgm与乙二胺摩尔比为1∶10
5
,ckgm与tnf-αsirna的质量比是1∶5。
[0046]
步骤二、载ckgm&tnf-αsirna的gelma微球的制备:
[0047]
配制15%w/v gelma水溶液,将核酸药物按0.5%w/v比例均匀混合于gelma溶液中作为内相,采用微流控装置,设置共轴微流控装置参数后,在大豆油外相的剪切作用下产生具有可控尺寸及良好分布的gelma液滴,紫外光固化60s后获得包裹药物的微球,取出用乙醇清洗两遍,冻干保存。gelma微球尺寸大小可通过内相毛细管直径及内外相流速进行调控。
[0048]
本实施例中,外相流速为4ml/h,内相流速为0.4ml/h,内相毛细管直径为90mm,制备出包含0.5%tnf-αsirna的gelma液滴,在紫外光照射下固化,得到单分散性较好的微球。
[0049]
步骤三、包衣涂层外壳的制备:
[0050]
配制5%w/v eudragit fs30d水分散体,将预调量的eudragit fs30d水分散体装载于包衣设备,设置好喷液速率和其他操作参数,实现微球的包衣过程。
[0051]
实施例3
[0052]
本实施例提供一种口服载小分子核酸药物微球的制备方法,具体的是负载ckgm&tnf-αaso纳米核酸的甲基丙烯酸酯透明质酸(hama)微球的制备,包括以下步骤:
[0053]
步骤一、ckgm&tnf-αaso复合纳米药物的制备:
[0054]
称取kgm于dmso中,加热溶解4h,60℃,冷却至室温,加入过量的cdi,室温反应3h充分活化,再加入过量的乙二胺,继续搅拌使其充分反应,透析,冻干抽真空即得ckgm。配制10%w/v的ckgm溶液,加入小分子核酸类药物溶液,静置反应0.5h,即得到稳定的纳米核酸药物。其中的kgm与dmso的摩尔比为1∶10
6
,kgm与cdi的质量比为1∶2,kgm与乙二胺摩尔比为1∶10
5
,ckgm与tnf-αaso的质量比是1∶5。
[0055]
步骤二、载ckgm&tnf-αaso的gelma微球的制备:
[0056]
配制20%w/v hama水溶液,将核酸药物按0.5%w/v比例均匀混合于hama溶液中作为内相,设置共轴微流控装置参数后,在大豆油外相的剪切作用下产生具有可控尺寸及良好分布的hama液滴,紫外光固化60s后获得包裹药物的微球,取出用乙醇清洗两遍,冻干保存。hama微球尺寸大小可通过内相毛细管直径及内外相流速进行调控。
[0057]
本实施例中,外相流速为5ml/h,内相流速为0.5ml/h,内相毛细管直径为100mm,制备出包含0.01%tnf-αaso的hama液滴,在紫外光照射下固化,得到单分散性较好的微球。
[0058]
步骤三、包衣涂层外壳的制备:
[0059]
配制5%w/v eudragit fs30d水分散体,将预调量的eudragit fs30d水分散体装载于包衣设备,设置好喷液速率和其他操作参数,实现微球的包衣过程。
[0060]
实施例4
[0061]
本实施例提供一种口服载小分子核酸药物微球的制备方法,具体的是负载ckgm&tnf-αaso纳米核酸的甲基丙烯酸化透明质酸(hama)微球的制备,包括以下步骤:
[0062]
步骤一、ckgm&tnf-αaso复合纳米药物的制备:
[0063]
称取kgm于dmso中,加热溶解2h,40℃,冷却至室温,加入过量的cdi,室温反应2h充分活化,再加入过量的乙二胺,继续搅拌使其充分反应,透析,冻干抽真空即得ckgm。配制
1%w/v的ckgm溶液,加入小分子核酸类药物溶液,静置反应2h,即得到稳定的纳米核酸药物。其中的kgm与dmso的摩尔比为1∶10
8
,kgm与cdi的质量比为1∶4,kgm与乙二胺摩尔比为1∶10
6
,ckgm与tnf-αaso的质量比是1∶10。
[0064]
步骤二、载ckgm&tnf-αaso的gelma微球的制备:
[0065]
配制1%w/v hama水溶液,将核酸药物按10%w/v比例均匀混合于hama溶液中作为内相,设置共轴微流控装置参数后,在大豆油外相的剪切作用下产生具有可控尺寸及良好分布的hama液滴,紫外光固化60s后获得包裹药物的微球,取出用乙醇清洗两遍,冻干保存。hama微球尺寸大小可通过内相毛细管直径及内外相流速进行调控。
[0066]
本实施例中,外相流速为20ml/h,内相流速为0.2ml/h,内相毛细管直径为120mm,制备出包含0.5%tnf-αaso的hama液滴,在紫外光照射下固化,得到单分散性较好的微球。
[0067]
步骤三、包衣涂层外壳的制备:
[0068]
配制1%w/v eudragit s100水分散体。其中eudragit s100水分散体成分为甲基丙烯酸酯∶甲基丙烯酸质量比=1∶2,含有50~70%的柠檬酸三乙酯增塑剂。将预调量的eudragit fs30d水分散体装载于包衣设备,设置好喷液速率和其他操作参数,实现微球的包衣过程。
[0069]
实施例5
[0070]
对口服载ckgm&tnf-αaso的gelma微球在dss诱导的结肠炎组织内的生物分布进行表征:
[0071]
在体内药物分布试验中,采用原位灌胃给药的方式。首先检测灌胃给入后的微球在消化道分布情况。在5%dss饮水建模一周后,灌胃给入含有fitc标记的tnf-αaso gelma微球,24小时后脱颈处死小鼠,快速取出胃、小肠和结肠(避光),使用小动物活体成像仪对各部位进行检测拍照,统计分析。同时对结肠部位的冰冻切片进行免疫标记染色,使用共聚焦显微镜观察拍照分析。如图5所示,口服载ckgm&tnf-αaso的gelma微球组小鼠结肠部位荧光强度显著高于其他对照组,表明ckgm&tnf-αaso的gelma微球具有结肠靶向性,有望应用于后续治疗。
[0072]
实施例6
[0073]
口服载ckgm&tnf-αaso的gelma微球在dss诱导的肠炎模型的治疗应用:
[0074]
本实施例采取口服载ckgm&tnf-αaso的gelma微球灌胃给药方式给予合适的剂量。该微球的有效量是能导致dss肠炎疾病症状明显降低的量。
[0075]
c57bl/6雄性小鼠给予5%的dss饮用水,治疗组给予预先制备好的通过灌胃给药的方式输入小鼠胃中,对照组相同剂量的ckgm&错配序列的小分子核酸(scr)。
[0076]
dss模型中均为一周连续给药,灌胃后每天观察小鼠毛发状况,粪便性状,称量小鼠体重,并详细记录。当结肠炎症最严重时,处死各组小鼠。取结肠组织,观察拍照后,部分结肠固定包埋用于h&e染色等病理学分析。
[0077]
设立正常对照组,肠炎模型组给予dss自由饮水,治疗组在造模第1、3、5天灌胃胶囊。8天后处死小鼠取结肠,拍照结果如图6a,从图6a可以看出,对照小鼠结肠长度较长,无红肿现象,无明显其他炎症症状。dss组炎症症状明显,有红肿,结肠变短的现象。ckgm&tnf-αscr的gelma微球对照组与模型组有明显差异,这是由于错配的小分子核酸对dss诱导的肠炎无治疗效果。ckgm&tnf-αaso的gelma微球治疗组与正常存在相似,结肠处无明显红肿现
象。由此可见载ckgm&tnf-αaso的微球经口服确有缓解dss诱导的小鼠结肠炎症的作用。载ckgm&tnf-αaso微球的治疗h&e染色图片见图6b。由图发现,相比于dss模型组和错配核酸组,治疗组中仅见少量炎症细胞浸润,结肠结构较为完整,由此可见载核酸药物微球的口服治疗可以有效缓解dss诱导的肠道炎症。
[0078]
以上所述,仅是本发明的较佳实施例,并非对本发明作任何形式上的限制,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,依据本发明的技术实质,对以上实施例所作的任何简单的修改、等同替换与改进等,均仍属于本发明技术方案的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1