一种纳米碳酸钙载药系统、其制备方法及其应用与流程
[0001]
本发明属于纳米医学技术领域,具体涉及一种纳米碳酸钙载药系统、其制备方法及其应用。
背景技术:
[0002]
牙周炎是一种由龈下菌斑中病原微生物引起的牙周支持组织慢性炎症,其主要临床特征为牙龈红肿、牙周袋形成和周围牙槽骨的丧失。牙周炎被认为是口腔中最常见的一种疾病,是成人牙齿脱落的主要原因之一,并且在全球范围内,重度牙周炎的患病率呈明显上升趋势。研究表明,牙周炎不仅会导致牙齿脱落,还会影响全身健康。例如牙周炎与血管功能障碍、心脏病发作和类风湿关节炎有着密切联系。此外,牙周炎也是阿尔茨海默病潜在危险因素之一。因此,有效的预防和治疗牙周炎对患者来说至关重要。然而,传统的牙周炎治疗方法,仅仅对牙周根部表面和病变的组织表面进行机械清创,这不足以防止牙周发病过程中进一步的组织损失和维持成骨破骨的平衡。因此,发展新型的牙周炎治疗策略具有十分重要的意义。
[0003]
牙周炎及其伴发病变可触发局部适应性免疫反应,巨噬细胞是牙周组织中对抗牙周致病菌的第一道防线,其可以通过吞噬作用杀死病原菌,但其过度的活化也会导致牙周组织的破坏,加重牙周炎的进程。m1型巨噬细胞通过分泌促炎性细胞因子和趋化因子,参与正向免疫应答,而m2型巨噬细胞通过分泌抑制性细胞因子il-10、tgf-b等下调免疫应答。一定条件下,巨噬细胞可从促炎(m1)型转为抗炎(m2)的表型,表达高水平的cd206和arg1,参与免疫负调控。研究表明,牙周炎症与巨噬细胞的m1和m2表型增强有关,而m2向m1的表型转化可能是介导牙周组织损伤包括牙槽骨丢失的关键免疫机制。m1/m2巨噬细胞平衡对炎症发展也有着重要的作用。在炎症的早期,m1型巨噬细胞主导地位,细胞分泌促炎细胞因子如inos1、il-1抗氧化蛋白(il-1)和tnf-a等诱导炎症,并会产生大量的活性氧(reactive oxygen,ros)。使得免疫细胞被招募和激活,随着炎症细胞因子的进一步增加和活性氧的释放,导致m1型巨噬细胞极化。通过清除ros,可以使巨噬细胞从m1型向m2型极化,从而用来治疗炎症性疾病。是否可以调控炎症微环境下的巨噬细胞极化,使巨噬细胞由m1向m2转变,表达抗炎表型,从而改善牙周微环境,达到治疗牙周炎的目的。
[0004]
近年来,纳米递药系统在牙周疾病的诊疗方面引起了广泛的研究。有研究通过纳米递药系统来清除活性氧,控制炎症反应。例如,通过合成负载甲氨蝶呤的纳米颗粒,清除巨噬细胞内ros,减少m1型巨噬细胞水平,诱导其向m2巨噬细胞转变,从而治疗类风湿关节炎;通过多孔se@sio2纳米涂层导管可以抑制ros-nf-κb通路,促进巨噬细胞向m2表型极化,从而促进前列腺尿道术后创面恢复,改善炎症反应。聚多巴胺(polydopamine,pda)含有大量高活性的邻苯二酚基团,能与各种材料表面形成强键,便于与其他分子相互作用,是抗氧化系统的重要组成部分。pda也被认为是多种炎症性疾病中有效的ros清除剂,可有效清除活性氧,使抗氧化状态正常化,促进生长和增强血管生成,从而抑制炎症前m1巨噬细胞反应,但在牙周炎领域尚未有相关研究。目前,利用独特的微环境,激活药物释放或改善药物
靶向性且副作用少的新策略已显示出良好的应用前景。
[0005]
米诺环素(mino),是一种广谱抗菌的四环素类抗生素,具备广谱抗菌作用以及抗炎、抑制胶原酶活性、促进牙周组织再生等药理学特性,是治疗牙周病最常见的药物之一,但其全是给药具有较强的不良反应。
技术实现要素:
[0006]
本发明要解决的技术问题是提供一种纳米碳酸钙载药系统、其制备方法及其应用,在清除活性氧的同时释放出米诺环素,达到协同治疗牙周炎的目的。
[0007]
为解决上述技术问题,本发明的实施例提供一种纳米碳酸钙载药系统,包括介孔二氧化硅球和聚多巴胺层,所述介孔二氧化硅球上负载有米诺环素,所述聚多巴胺层包覆于介孔二氧化硅微球的外侧。
[0008]
本发明还提供一种纳米碳酸钙载药系统的制备方法,包括如下步骤:(1)合成介孔二氧化硅球msns将1.5-2.8ml的teo、40-70ml乙醇、2-5ml氢氧化铵、0.5-2ml去离子水混合,在40-60℃下搅拌4-8h,收集离心,用去离子水反复清洗三次,合成介孔二氧化硅球msns,干燥过夜备用;(2)介孔二氧化硅球上负载米诺环素将20mg单分散的介孔二氧化硅球分散在含有1mg/ml mino的10-40ml乙醇中,搅拌过夜,6000rpm离心收集,得到负载有米诺环素的介孔二氧化硅球msns@mino;(3)介孔二氧化硅球的表面还原生成一层聚多巴胺将负载有米诺环素的介孔二氧化硅球添加到25-40ml的包含氢氧化铵、10mg/ml盐酸多巴胺、乙醇和去离子水的混合溶液中,搅拌反应15-30h;然后通过离心纯化,去离子水洗净、晒干,得到纳米碳酸钙载药系统pda@msns@mino,备用。
[0009]
其中,步骤(3)中,氢氧化铵、10mg/ml盐酸多巴胺、乙醇和去离子水的质量比为1:10:25:0.5。
[0010]
本发明还提供一种纳米碳酸钙载药系统的应用,用于调节巨噬细胞极化协同mino治疗牙周炎。
[0011]
本发明的上述技术方案的有益效果如下:1、本发明提供了一种活性氧响应的纳米递药系统—pda@msns@mino,将抗炎药物米诺环素包裹在硅球中,并在其表面还原生成一层聚多巴胺。此处聚多巴胺将药物封闭在硅球中,能有效控制药物的泄露,在牙周炎巨噬细胞中高表达的活性氧的作用下,聚多巴胺被分解从而释放出包裹在其中的米诺环素,进一步作用于巨噬细胞,调节巨噬细胞细胞因子的分泌,改善牙周炎症微环境,达到治疗牙周炎的目的。
[0012]
2、传统的牙周炎治疗,通过对牙周根部表面和病变的软硬组织表面进行机械清创,不足以防止牙周发病过程造成的牙周附着丧失,骨组织缺损。本发明将纳米技术应用在牙周炎的治疗中,利用聚多巴胺和米诺环素的协同作用,调控巨噬细胞的极化,改善牙周炎症微环境,最终达到治疗牙周炎的目的3、本发明的纳米碳酸钙载药系统,分散性好,形貌好,利用聚多巴胺和米诺环素的协同作用,调控巨噬细胞的极化,改善牙周炎症微环境,最终达到治疗牙周炎的目的,制备工艺
简易经济,适用于工业规模的生产,具有较大的应用前景。
附图说明
[0013]
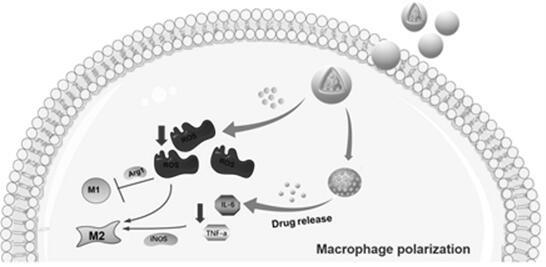
图1为本发明中纳米碳酸钙载药系统的结构图;图2为本发明中pda@msns@mino递药系统调节巨噬细胞极化协同mino治疗牙周炎的过程图;图3为本发明中pda@msns@mino纳米材料表征图;图4为本发明中巨噬细胞与纳米颗粒共培养状况示意图。
具体实施方式
[0014]
为使本发明要解决的技术问题、技术方案和优点更加清楚,下面将结合附图及具体实施例进行详细描述。
[0015]
如图1所示,本发明提供一种纳米碳酸钙载药系统,包括介孔二氧化硅球和聚多巴胺层,所述介孔二氧化硅球上负载有米诺环素,所述聚多巴胺层包覆于介孔二氧化硅微球的外侧。
[0016]
本发明还提供一种纳米碳酸钙载药系统的制备方法,包括如下步骤:(1)合成介孔二氧化硅球msns将2.3ml的teo、60ml乙醇、3ml氢氧化铵、1ml去离子水混合,在40℃下搅拌6h,收集离心,用去离子水反复清洗三次,合成介孔二氧化硅球msns,干燥过夜备用;(2)介孔二氧化硅球上负载米诺环素将20mg单分散的介孔二氧化硅球分散在含有1mg/ml mino的20ml乙醇中,搅拌过夜,6000rpm离心收集,得到负载有米诺环素的介孔二氧化硅球msns@mino;(3)介孔二氧化硅球的表面还原生成一层聚多巴胺将负载有米诺环素的介孔二氧化硅球添加到36.5ml的包含氢氧化铵、10 mg/ml盐酸多巴胺、乙醇和去离子水的混合溶液中,搅拌反应24h;其中,氢氧化铵、10 mg/ml盐酸多巴胺、乙醇和去离子水的质量比为1:10:25:0.5。然后通过离心纯化,去离子水洗净、晒干,得到纳米碳酸钙载药系统pda@msns@mino,备用。
[0017]
本发明还提供一种纳米碳酸钙载药系统的应用,用于调节巨噬细胞极化协同mino治疗牙周炎。图2所述为本发明中pda@msns@mino递药系统调节巨噬细胞极化协同mino治疗牙周炎的过程图。
[0018] 下面结合具体实施例进一步阐述本发明的技术方案。
[0019]
实施例一:新型纳米材料pda@msns@mino的制备首先,合成介孔二氧化硅颗粒msns。将2.3ml的teo,60ml乙醇,3ml氢氧化铵,1ml去离子水混合,在40℃下,搅拌6h,然后收集离心,去离子水反复清洗三次,干燥过夜备用。将20mg单分散二氧化硅微球分散在含有1mg/ml mino的20ml乙醇中,搅拌过夜,6000rpm离心收集,添加到36.5ml溶液中,包含氢氧化铵、10mg/ml盐酸多巴胺、乙醇和去离子水(1:10:25:0.5),搅拌反应24h。最后,通过离心纯化,去离子水洗净、晒干供进一步使用。
[0020]
图3所示为本发明中pda@msns@mino纳米材料表征图,其中,图3(a)msns;图3(b)msns@mino;图3(c)pda@msns@mino的tem图谱;图3(d)msns;图3(e)msns@mino;图3(f)pda@
msns@mino的sem图谱;图3(g)粒径分析;图3(h)不同溶液中,浓度为1 mg/ml的pda@msns@mino 纳米颗粒溶解情况。
[0021]
实施例二:生物安全性验证用cck-8法检测巨噬细胞存活率。细胞raw 264.7取自中国科学院细胞库。将细胞以每孔1.0
×
103的密度接种于96孔板上。孵化后一夜后,raw264.7的原始细胞与不同浓度的纳米颗粒(0、100、250μg/ ml)共培养,时间(0、6、12、24和36h),然后每孔加入10μl cck-8,37℃,孵化0.5h。最后,测量在450nm的吸光度。raw264.7和纳米颗粒结合后,检测是否对细胞存在毒性,培养24小时后的显微镜下观察。
[0022]
图4所示为本发明中巨噬细胞与纳米颗粒共培养状况示意图,其中,图4(a)为在不同浓度的pda@msns@mino纳米载体(0、50、100和250g/ml)刺激巨噬细胞,通过cck-8测定raw264.7的细胞活力;图4(b)为并选取最适浓度50μg/ml,与细胞孵育6、12、24、36 h后,测细胞毒性。图4(c)-图4(f)为显微镜下观察pda@msns@mino共培养状况。
[0023]
实施例三、活性氧清除,炎症微环境变化情况将raw264.7细胞置于密度为每孔104的六孔板中,孵育12h。更换出培养基,加入含胎牛血清(10%)和pda@msns@mino nps(50mol/lg/ml)的dmem孵育4h。加入活性氧阳性对照(rosup),0.5h后,二氯荧光素二醋酸酯(dcfh-da)避光孵育0.5h。
[0024]
同时,本发明还研究了lps刺激模拟炎症微环境,pda@msns@mino对活性氧的清除能力。荧光显微镜图像收集奥林巴斯成像系统。定量结果采用流式细胞术检测raw264.7细胞(n=3)。同时使用elisa,western blot分析巨噬细胞极化、炎症反应特征。
[0025]
本发明提供了一个活性氧响应的纳米递药系统,在清除活性氧的同时释放出米诺环素,达到协同治疗牙周炎的目的。其基本过程如图2所示,首先将米诺环素负载于介孔二氧化硅中(msns@mino),然后在其表面还原生成一层聚多巴胺分子,得到pda@msns@mino纳米载体。该载体被巨噬细胞吞噬后,在巨噬细胞高表达的活性氧的作用下,pda被氧化分解,清除了ros,最终导致巨噬细胞由m1型向m2型极化,同时释放米诺环素,进一步作用于巨噬细胞,调节巨噬细胞细胞因子的分泌,改善牙周炎症微环境,达到治疗牙周炎的目的。
[0026]
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1