1,6-O,O-二乙酰基大花旋覆花内酯的制备方法及其制备抗阿尔兹海默症药物的应用
本发明属于生物技术领域,具体涉及一种1,6-o,o-二乙酰基大花旋覆花内酯的制备方法及其制备抗阿尔兹海默症药物的应用。
背景技术:
欧亚旋覆花是一种二年生或多年生植物,向光性,金黄色花瓣,直立生长,高约15~75cm,喜沙质壤土和粘土,常用于治疗肿瘤、消化系统疾病、支气管炎、抗菌和病毒感染(包括肝炎病毒),其中花序可用于治疗肠道疾病及支气管炎等呼吸道炎症。1,6-o,o-二乙酰基大花旋覆花内酯(oabl)被报道从欧亚旋覆花花序经过乙醇提取后从氯仿相分离后得到,分离过程需要正相硅胶、反相色谱、凝胶分离技术等,过程费力耗时。
已有技术表明,oabl的抗肿瘤活性和抗炎活性较为突出。oabl抑制了乳腺癌细胞brk-p53的bcl-2的磷酸化,并阻滞细胞周期g2/m。此外,oabl通过激活caspases-3、8和9,线粒体中细胞色素c的释放,诱导细胞凋亡,抑制了白血病细胞hl-60增殖。oabl显示的抗炎活性,通过抑制一氧化氮合酶(inos)和环氧化酶2(cox-2)的合成抑制巨噬细胞raw264.7中一氧化氮(no)及前列腺素2(pge2)的合成。此外,oabl能够有效活化内皮细胞,可以通过减少血管细胞黏附分子-1(vcam-1)、血浆骨桥蛋白(opn)、mmp-9和韧粘素-c(tenascin-c)(细胞外基质中的一种大分子糖蛋白)等物质的表达而有效抑制巨噬细胞对内皮细胞的粘附。然而,oabl对阿尔兹海默病的作用尚未有报道。
技术实现要素:
本发明基于新的研究发现,首先提供了1,6-o,o-二乙酰基大花旋覆花内酯制备抗阿尔兹海默症药物的应用。
基于上述应用的药物包括1,6-o,o-二乙酰基大花旋覆花内酯和药物辅料。所述药物辅料可为在药学领域常用的辅料中合理选择后不影响药效或有助于药效发挥的药物辅料。药物剂型可选注射型。
本发明同时提供了一种1,6-o,o-二乙酰基大花旋覆花内酯的制备方法。为此,所提供的方法包括:欧亚旋覆花干燥花序的乙醇浸提物经乙酸乙酯萃取得乙酸乙酯浸提物;之后对乙酸乙酯浸提物进行分离得到1,6-o,o-二乙酰基大花旋覆花内酯。
优选的,所述分离包括采用正相硅胶柱、石油醚和乙酸乙酯的混合液为洗脱剂进行分离。
阿兹海默病的临床特征主要表现为空间学习记忆等认知障碍和行为障碍。攻克该疾病一直是亟待解决的医学难题。包括辉瑞、强生、葛兰素史克等巨头在内的一众跨国药企,曾集体在阿尔茨海默病药物上折戟,烧钱百亿却无功而返。由此可见,寻找到一种治疗ad的新药或新方法仍任重道远。ad的病因和发病机制目前尚不明确,β淀粉样蛋白(aβ)的异常沉积被公认为是导致ad的最后共同途径。一直以来针对aβ病因说的抗ad新药物在不断地进行临床试验,但尚未有成功的临床报道。本发明通过研究发现oabl对ad模型小鼠进行腹腔注射后,ad模型小鼠的海马区及大脑皮层aβ淀粉样蛋白沉淀显著减少;相应地,oabl对ad模型小鼠的水迷宫实验中表现出的学习记忆能力改善较明显。基于此,oabl能用于制备抗阿尔兹海默症药物。
附图说明
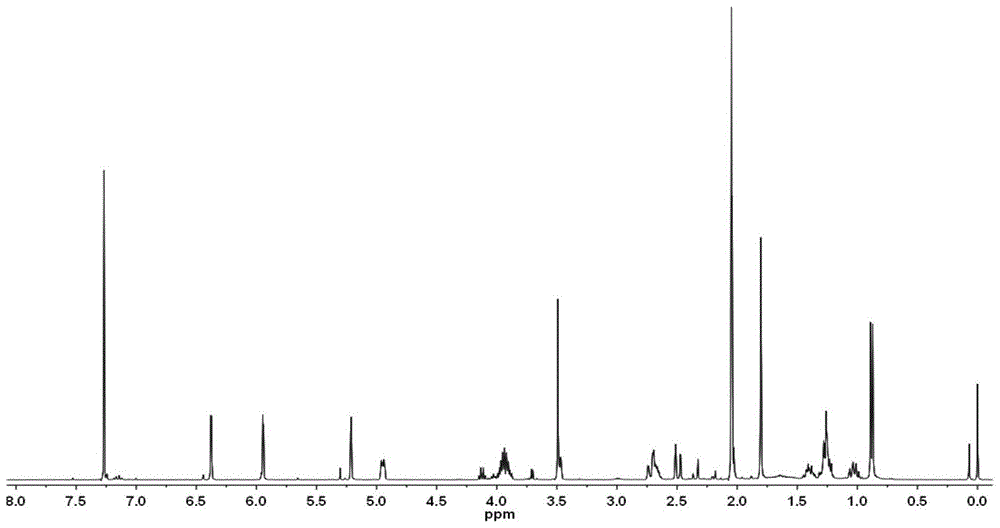
图1为本发明化合物的1hnmr(400mhz,cdcl3)图谱;
图2为本发明化合物的13cnmr(100mhz,cdcl3)图谱;
图3为本发明化合物分离的纯度分析结果;
图4为oabl改善5xfad小鼠认知功能实验结果;
图5为oabl减轻ad模型小鼠β淀粉样蛋白(aβ)沉积的实验结果;
图6为oabl减轻ad模型小鼠炎症蛋白的表达的实验结果。
具体实施方式
除非另有说明,本文中的术语根据相关领域普通技术人员的认识理解。
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
以下实施例中所用实验材料及试剂均为市售产品。以下实施例中所用的oabl可以为市售产品也可以采用本发明提供的方法进行获取。
本发明的oabl制备方法实施实例为:
称取欧亚旋覆花干燥花序10kg,加入工业乙醇20l浸泡3小时,加沸石数粒,经乙醇回流萃取3次,每次20l、4小时,弃去残渣,回收乙醇相,浓缩浸膏;
加入三倍体积的水(2l)后,用乙酸乙酯(3*2l)萃取后减压浓缩得到乙酸乙酯相浸膏乙酸乙酯相浸膏0.4kg;
将乙酸乙酯相浸膏直接上正相硅胶柱(100-200目,20cm*140cm),依次用石油醚:乙酸乙酯9:5、7:5、1:1各1l来洗脱;其中在石油醚:乙酸乙酯7:5段,有晶体析出,经乙醇重结晶后得到纯品oabl;经鉴定为1,6-o,o-二乙酰基大花旋覆花内酯(oabl),结构式为式(ⅰ)所示,鉴定结果如图1和2所示;
同时对分离物进行纯度分析:通过带有蒸发光散射检测器(elsd)的waters1525series分析,10mingradient,80%meoh:20%h2oto100%meoh;tr=4.164min,99.27%atelsd;hplc分析纯度>99%,结果如图3所示。
实施例1:oabl改善5xfad小鼠认知功能
1.morris水迷宫实验
使用的ad模型小鼠为5xfad转基因小鼠,购自美国杰克森实验室(jax),该转基因小鼠在淀粉样前体蛋白(app)产生swedish(k670n/m671l),florida(i716v)和london(v717i)突变,在前期素蛋白1(psen1)产生m146l和l286v突变。
所有小鼠于22±2℃,湿度50±10%下,自由采食和饮水,12h光/暗周期,进行饲养,饲养至6月龄,开始进行实验,所有的操作遵守国家卫生局指导指南和实验室动物使用指南;
实验分为4组,空白对照组(wt组)、oabl对照组(wt-oabl组)、ad模型组(5xfad组)、oabl干预组(5xfad-oabl组),其中wt组和wt-oabl组使用的小鼠为野生型健康小鼠,5xfad组和5xfad-oabl组使用的小鼠为5xfad转基因小鼠;wt-oabl组和5xfad-oabl组按照剂量为20mg/kg/天腹腔注射式(i)天然化合物oabl,对照组给予溶剂,连续给药3周,给药周期结束后,进行morris水迷宫测试,具体参照morris水迷宫实验方法进行,用于测量小鼠的学习和记忆能力。
morris水迷宫(mwm)迷宫是一个注有水(24±1)℃的圆形水池(直径150cm,高50cm),迷宫分为4个象限,在其中一个象限水下1cm处放置直径10cm的站台。小鼠连续训练4天,每天训练4个象限;训练时,将小鼠面朝壁放入水中,若小鼠在60s内找到站台,则让其在站台待10s。若不能找到站台,则将其引至站台,并让其站台待10s。第5天,进行定位导航测试:将小鼠面朝壁从站台邻近象限放入水中60s,记录小鼠从入水至上站台的潜伏期。
2.实验结果
如图4a所示,morris水迷宫测试中,ad模型组与空白对照组相比,小鼠从入水至上站台的逃避潜伏时间极显著上升,5xfad小鼠经oabl处理后,逃避潜伏时间显著降低,如图5b所示,为第5天小鼠定位巡航的轨迹图,揭示式(i)天然化合物oabl可以改善ad模型小鼠学习记忆能力。
实施例2:oabl减轻ad模型小鼠β淀粉样蛋白(aβ)沉积
1.免疫荧光实验
小鼠牺牲后,小鼠脑组织立即用10%中性缓冲甲醛固定,固定24h以上,将组织从固定液取出在通风橱内用手术刀将目的部位组织修平整,组织在一系列梯度乙醇溶液(70、80、95和100%,v/v)中逐渐脱水,并嵌入石蜡块中,石蜡切片上切取4μm厚的组织切片进行免疫荧光实验。
将切片至于盛满edta抗原修复缓冲液(ph8.0)(中国,塞维尔)的修复盒中于微波炉内进行抗原修复,抗原修复后,室温下用3%bsa封闭30min,用aβ1-42蛋白的一抗(美国,cst)在4℃下孵育过夜,再用荧光二抗(中国,塞维尔),在室温避光孵育50min。dapi复染,封片,切片于荧光显微镜下观察并采集图像。
2.酶联免疫吸附测定实验
小鼠大脑皮层组织用蛋白裂解液(含蛋白酶抑制剂)充分裂解后,得到大脑皮层组织蛋白样品,用微孔板包被抗体,加入标准品、蛋白样品,4℃孵育2小时,洗板,加入humanamyloidβ(aa1-42)抗体,4℃孵育2小时,洗板,加入底物溶液避光室温孵育30min,加(美国,r&dsystrms)入终止液,30分钟内使用酶标仪检测吸光度值。通过标准曲线将所测吸光度值换算成humanamyloidβ(aa1-42)的浓度。
3.免疫印迹实验
小鼠大脑皮层组织用蛋白裂解液(含蛋白酶抑制剂)充分裂解后,得到大脑皮层组织蛋白样品,bca蛋白质定量试剂盒(中国,天根)进行蛋白定量,煮沸变性后经过sds-page电泳分离蛋白样品,然后转膜,用bace-1蛋白的一抗(美国,cst)4℃孵育过夜,然后用5%脱脂奶粉封闭,再用相应种属的二抗(美国,sab)进行孵育,然后用扫膜仪检测蛋白的相对表达水平。
4.实验结果
根据免疫荧光实验结果,如图5a所示,ad模型组与空白对照组相比,小鼠脑组织中β淀粉样蛋白(图中粉色部分)沉积明显增多,5xfad小鼠经oabl处理后,小鼠脑组织中β淀粉样蛋白沉积明显减少;(图5a中,“gd、ca1、ca2、cortexprl”分别表示小鼠海马组织gd区、ca1区、ca2区、ca3区及大脑皮层区);根据酶联免疫吸附测定实验结果,如图5b所示,ad模型组与空白对照组相比,小鼠脑组织中β淀粉样蛋白沉积极显著增多,5xfad小鼠经oabl处理后,小鼠皮层组织中β淀粉样蛋白沉积显著减少。
以上结果显示,式(i)天然化合物oabl可以减少ad模型小鼠大脑皮层组织和海马组织中β淀粉样蛋白沉积。
发明人进一步探索了式(i)天然化合物oabl减少β淀粉样蛋白沉积的可能机制,β淀粉样前体蛋白裂解酶1(bace-1)是β淀粉样蛋白产生的关键酶,根据免疫印迹实验结果,如图5c和5d所示,ad模型组与空白对照组相比,小鼠脑皮层组织中bace-1的表达显著增多,经式(i)天然化合物oabl处理后,小鼠脑皮层组织中bace-1的表达显著减少,揭示式(i)天然化合物oabl减轻脑组织中β淀粉样蛋白的可能机制为抑制β淀粉样前体蛋白裂解酶1(bace-1)的表达。(图5c中gapdh为westernblot蛋白质标准化的内参)。
实施例3:oabl减轻ad模型小鼠炎症蛋白的表达
1.免疫荧光实验
操作方法同实施例三中免疫荧光实验,用gfap、iba-1蛋白的一抗(美国,cst)在4℃下孵育过夜,再用荧光二抗(中国,塞维尔),在室温避光孵育50min,dapi复染,封片,切片于荧光显微镜下观察并采集图像。
2.免疫印迹实验
小鼠大脑皮层组织用蛋白裂解液(含蛋白酶抑制剂)充分裂解后,得到大脑皮层组织蛋白样品,bca蛋白质定量试剂盒进行蛋白定量,煮沸变性后经过sds-page电泳分离蛋白样品,然后转膜,用gfap、iba-1蛋白的一抗4℃孵育过夜,然后用5%脱脂奶粉封闭,再用相应种属的二抗进行孵育,然后用扫膜仪检测蛋白的相对表达水平。
3.实验结果
根据免疫荧光实验结果,如图6a和6b所示,ad模型组与空白对照组相比,小鼠脑组织中gfap蛋白(图中红色标记部分)和iba-1蛋白(图中绿色部分)表达明显增多,5xfad小鼠经oabl处理后,小鼠脑组织中gfap蛋白明显减少,(图6a和6b中,“gd、ca1、ca2、cortexprl”分别表示小鼠海马组织gd区、ca1区、ca2区、ca3区及大脑皮层区),发明人通过免疫印迹实验对以上结果进行了验证,如图6c、d、e、f所示,经式(i)天然化合物oabl处理后,ad模型小鼠脑组织中gfap蛋白和iba-1蛋白表达水平降低。以上结果显示,式(i)天然化合物oabl可以抑制ad模型小鼠中神经炎症的表达。
- 还没有人留言评论。精彩留言会获得点赞!