一种布雷默浪丹口服药物组合物及其应用的制作方法
本发明涉及多肽类药物口服药物组合物领域,具体涉及一种布雷默浪丹口服药物组合物及其应用领域。
背景技术:
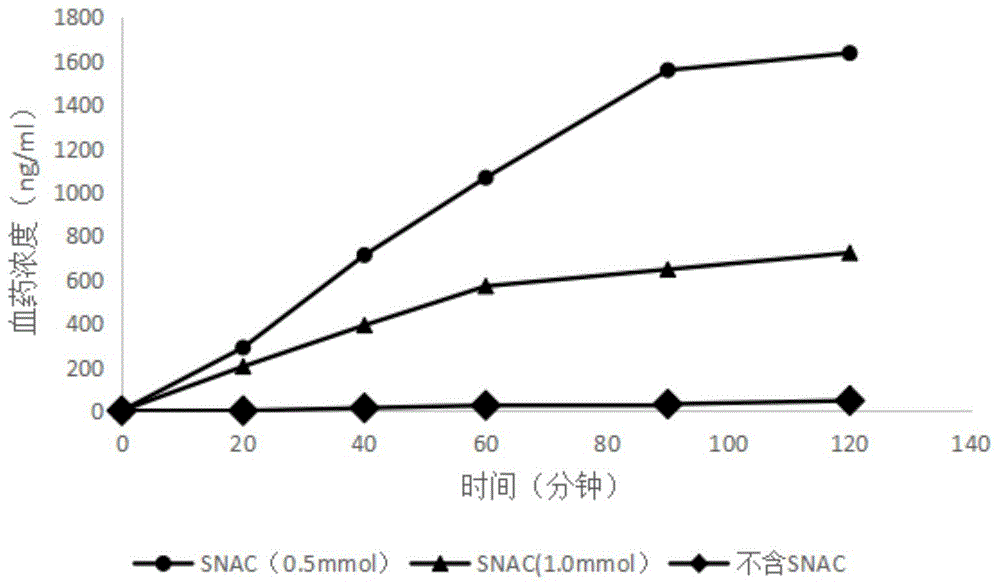
:多肽和蛋白质药物在临床上绝大多数通过肌肉注射、静脉注射或者皮下注射的方式给药,药物学家一直致力于这类药物口服制剂研究。现有研究认为蛋白质或者多肽在胃肠道的消化产物主要是多肽如二肽和三肽等。对于12个以下氨基酸组成的多肽,实现口服给药的可能性较大,而对于蛋白质,则难以预料。目前已知的多肽和蛋白质药物口服吸收的机制及途径包括:1)载体转运,小分子药物的转运以此为主;2)胞饮作用和m细胞途径;3)细胞旁路途径。影响多肽和蛋白质药物口服吸收的因素包括:1)相对分子质量;2)空间结构;3)理化性质;4)酸屏障、酶屏障和膜屏障。由于大多数多肽和蛋白质不耐酸,胃酸的ph值为1~3,当多肽药物通过胃时,一部分药物被水解失去生物活性,而且整个肠道ph环境复杂多变,一些多肽还容易发生ph依赖性水解,这成为口服吸收的第一道屏障。同时,胃肠道含有多种消化酶,主要包括:①腔道分泌的酶,如胃蛋白酶、胰蛋白酶和糜蛋白酶等;②刷状缘分泌的酶,如羧肽酶、氨肽酶、肽链内切酶和外切酶等,酶消化作用是导致多肽药物降解的主要原因。另外,小肠的上皮细胞附着一层水合凝胶,称为不流动水层,其下方是磷脂表面活性层,疏水性强,阻碍了多肽药物等亲水性分子向上皮细胞的扩散。其次,小肠上皮细胞膜的磷脂双分子层具有半透膜性质,允许脂溶性药物被动转运,而大分子以及亲水性药物需要通过主动转运才能跨膜进入细胞内。最后,阻止口服吸收的主要屏障是致密的肠上皮细胞膜,因为小肠细胞间隙仅为5nm,在不加任何吸收促进剂的情况下,只有分子量小的药物才能通过。文献报道的提高多肽和蛋白质药物口服吸收的策略包括化学修饰、使用吸收促进剂、使用酶抑制剂、制备纳米粒制剂载体、脂质体、微乳等制剂手段。布雷默浪丹(bremelanotide)是一种黑素皮质素受体激动剂,上市产品商品名:vyleesi,是一种皮下注射制剂,规格为1.75mg。布雷默浪丹是一种人工合成的环状七肽,羧基端为游离酸,氨基端形成乙酰化。中国专利申请cn104755094中公开了皮下注射1.25mg-1.75mg用于治疗女性性欲低下。同时,从申请人的公开研究文献报道情况可知,在早期临床试验中,该公司曾经使用鼻腔给药剂型开展临床,剂量为20mg(以碱基计)。布雷默浪丹已经在美国上市注射剂,用于女性性欲低下,采用皮下注射途径给药。说明书中报道,该药物的主要副作用是恶心、血压的升高,心率降低。分子结构多肽链部分成环状,提高了一定的稳定性。布雷默浪丹上市产品为注射剂,相比口服制剂,使用不够方便,依从性较差。研究人员一直在致力于开发服用更为方便的布雷默浪丹的组合物和药物制剂。美国专利申请us20180185440a1公开了包含布雷默浪丹和snac的口服胶囊剂,制备工艺复杂,没有阐述在试验动物中胃部吸收的情况,也没有阐述体外溶出度对于动物体内血药浓度达峰时间的影响,未阐述布雷默浪丹原料药粒径及各辅料对药物溶出度及药时曲线的影响,没有阐述与皮下注射制剂相当的体内药动学特征的雷默浪丹和snac的配比关系以及制剂组成。技术实现要素:为解决现有技术的不足,满足患者用药需求,本发明目的之一是提供一种布雷默浪丹口服药物组合物。本发明将布雷默浪丹与吸收促进剂组合,提高口服布雷默浪丹后的体内吸收和利用。布雷默浪丹(bremelanotide,pt-141)又称普美拉肽、布美兰肽、布美诺肽,是一种人工合成的环状七肽,羧基端为游离酸,氨基端形成乙酰化。美国专利us6579968和us6794489公开了布雷默浪丹,其结构式为ac-nle-cyclo-(asp-his-d-phe-arg-trp-lys)-oh,由melanotan-ii(ac-nle-cyclo-(asp-his-d-phe-arg-trp-lys)-nh2)开发而来,比melanotan-ii具有更强的药理活性。布雷默浪丹醋酸盐形式的结构式为:ac-nle-cyclo-(asp-his-d-phe-arg-trp-lys-oh)·xch3cooh;分子式为c50h68n14o10·xch3cooh(1≤x≤2),分子量1025.2(以游离碱计)。本发明中布雷默浪丹药物可以是游离碱的形式,也可以是醋酸盐的形式,可以是无水物,也可以是有水物或溶剂合物。优选本发明中的布雷默浪丹为醋酸盐形式的布雷默浪丹醋酸盐。吸收促进剂包括snac(8-(2-hydroxybenzamido)octanoicacidsodium),5-cnac(n-(5-chlorosalicyloyl)-8-aminocaprylicacid),4-cnab(4-[(4-chloro-2-hydroxy-benzoyl)amino]butanoicacid),snad(n-(10-[2-hydroxybenzoyl]-amino)decanoicacid),5-cnab(monosodiumn-(4-chlorosalicyloyl)-4-aminobutyrate)和4-moac(n-[8-(2-hydroxy-4-methoxy)benzoyl]aminocaprylicacid),优选为snac。snac(sodiumn-[8-(2-hydroxybenzoyl)amino]caprylate,salcaprozatesodium),化学名为8-(2-羟基苯甲酰氨基)辛酸钠(cas号:203787-91-1),本发明中简称为:snac。本发明中snac可以是无定形的,也可以是多种晶型中的一种或其混合,或无定形与一种或多种特定晶型的混合。本发明的口服药物组合物中,包括布雷默浪丹和吸收促进剂,且包括粘合剂、赋形剂和润滑剂中的一种或多种。优选地,所述吸收促进剂为8-(2-羟基苯甲酰氨基)辛酸钠;所述布雷默浪丹与8-(2-羟基苯甲酰氨基)辛酸钠的重量比为3.2~12:12~18;所述布雷默浪丹的重量以游离碱形式计。优选地,布雷默浪丹与snac的重量比为4.8~12:12~18;优选地,所述布雷默浪丹和8-(2-羟基苯甲酰氨基)辛酸钠的重量比为8~12:12~18;更优选地,所述布雷默浪丹和8-(2-羟基苯甲酰氨基)辛酸钠的重量比为8~12:15。最优选布雷默浪丹与snac的重量比为10:15。上述布雷默浪丹为治疗有效量的布雷默浪丹。“治疗有效量”是指以本发明的组合物对于治疗、预防、减轻或改善疾病的症状或生理功能有效的量。优选含有本发明药物组合物的单位制剂中布雷默浪丹的量为5mg-200mg;进一步优选为20mg-120mg。优选地,本发明所述布雷默浪丹物料的粒径<180μm,所述8-(2-羟基苯甲酰氨基)辛酸钠粒径<124μm;更优选地,所述布雷默浪丹物料的粒径d90<56μm,所述8-(2-羟基苯甲酰氨基)辛酸钠粒径d90<8.6μm。优选地,所述组合物还包括粘合剂、赋形剂和润滑剂中的一种或多种;优选地,其中,粘合剂选自聚维酮或羟丙基甲基纤维素;更优选地,粘合剂为聚维酮k30和聚维酮k90中的一种或两种;更优选地,粘合剂为聚维酮k30。优选地,所述赋形剂选自微晶纤维素、淀粉、乳糖、糊精和磷酸氢钙中的一种或几种;优选地,所述赋形剂为微晶纤维素。优选地,所述润滑剂选自硬脂酸镁、硬脂富马酸钠中的一种或两种;优选地,所述润滑剂为硬脂酸镁。优选地,所述粘合剂为布雷默浪丹与8-(2-羟基苯甲酰氨基)辛酸钠总重量的0.1%~10%;所述布雷默浪丹的重量以游离碱形式计。优选地,所述粘合剂为布雷默浪丹与8-(2-羟基苯甲酰氨基)辛酸钠总重量的0.5%~5%,更优选为0.5%~2.5%;优选地,所述赋形剂为布雷默浪丹与8-(2-羟基苯甲酰氨基)辛酸钠总重量的0.2%~200%,所述布雷默浪丹的重量以游离碱形式计;优选为1%~150%,更优选为2%~100%。优选地,所述润滑剂为布雷默浪丹与8-(2-羟基苯甲酰氨基)辛酸钠总重量的0.1%~10%,所述布雷默浪丹的重量以游离碱形式计。优选为0.2%~5%,更优选为0.5%~2.0%。优选地,所述组合物的单一剂量或多剂量含有32~120mg布雷默浪丹和120~180mg的8-(2-羟基苯甲酰氨基)辛酸钠;优选地,所述组合物的单一剂量或多剂量含有80~120mg布雷默浪丹和150mg的8-(2-羟基苯甲酰氨基)辛酸。本发明的药物组合物中,还可以含有甜味剂和香精中的一种或多种。本发明的药物组合物含有甜味剂时,甜味剂为布雷默浪丹与snac总重量的0.1%~15%,优选为0.2%~10%,更优选为0.5%~5%。优选地,甜味剂包括三氯蔗糖、甜菊糖苷、阿斯巴甜等,优选为三氯蔗糖。本发明的药物组合物含有香精时,香精为布雷默浪丹与snac总重量的0.1%~2%,所述布雷默浪丹的重量以游离碱形式计。优选为0.1%~1%,更优选为0.1%~0.5%。优选地,香精包括香蕉香精、树莓香精、牛油香精、香兰素等,优选为香兰素。本发明药物组合物的一个具体实施方式中,本发明药物组合物含有布雷默浪丹、snac、粘合剂、赋形剂和润滑剂,布雷默浪丹与snac的重量比为3.2~12:12~18,粘合剂为布雷默浪丹与snac总重量的0.1%~10%,赋形剂为布雷默浪丹与snac总重量的0.2%~200%,润滑剂为布雷默浪丹与snac总重量的0.1%~10%。本发明药物组合物的一个具体实施方式中,本发明药物组合物含有布雷默浪丹、snac、粘合剂、赋形剂和润滑剂,布雷默浪丹与snac的重量比为8~10:12~18,粘合剂为布雷默浪丹与snac总重量的0.1%~5%,赋形剂为布雷默浪丹与snac总重量的1%~150%,润滑剂为布雷默浪丹与snac总重量的0.1%~10%。本发明药物组合物的一个具体实施方式中,本发明药物组合物含有布雷默浪丹、snac、粘合剂、赋形剂和润滑剂,布雷默浪丹与snac的重量比为8~10:12~18,粘合剂为布雷默浪丹与snac总重量的0.1%~10%,赋形剂为布雷默浪丹与snac总重量的0.2%~200%,润滑剂为布雷默浪丹与snac总重量的0.1%~10%,粘合剂为聚维酮k30或聚维酮k90,赋形剂为微晶纤维素,润滑剂为硬脂酸镁或硬脂富马酸钠。本发明药物组合物的一个具体实施方式中,本发明药物组合物含有布雷默浪丹、snac和粘合剂,布雷默浪丹与snac的重量比为8~10:12~18,粘合剂为布雷默浪丹与snac总重量的0.1%~10%,不含有赋形剂和润滑剂。本发明药物组合物的一个具体实施方式中,本发明药物组合物含有布雷默浪丹、snac、粘合剂和润滑剂,布雷默浪丹与snac的重量比为8~10:12~18,粘合剂为布雷默浪丹与snac总重量的0.1%~10%,润滑剂为布雷默浪丹与snac总重量的0.1%~10%,不含有赋形剂。本发明的另一目的是提供一种包含上述口服药物组合物的布雷默浪丹口服制剂。本发明的布雷默浪丹口服制剂,可以是任何适于口服的剂型。优选本发明的口服制剂为片剂、胶囊剂、颗粒剂或口服溶液;更优选为胶囊剂或颗粒剂。本发明的布雷默浪丹口服制剂,含有治疗有效量的布雷默浪丹和snac,选择性地含有粘合剂、赋形剂和润滑剂中的一种或多种,其中布雷默浪丹与snac的重量比为3.2~12:12~18。本发明的布雷默浪丹口服制剂,可以是任何适于口服的剂型。优选本发明的口服制剂为片剂、胶囊剂、颗粒剂或口服溶液,更优选为胶囊剂或颗粒剂。本发明的布雷默浪丹口服制剂含有粘合剂时,粘合剂为布雷默浪丹与snac总重量的0.1%~10%,优选为0.5%~5%,更优选为0.5%~2.5%。粘合剂包括聚维酮,羟丙基甲基纤维素等,优选为聚维酮中的一种或者两种以上型号混合,更优选聚维酮k-30。本发明的布雷默浪丹口服制剂含有赋形剂时,赋形剂为布雷默浪丹与snac总重量的0.2%~200%,优选为0.2%~150%,更优选为0.2%~100%。赋形剂包括微晶纤维素、淀粉、乳糖、糊精、磷酸氢钙等,优选赋形剂为微晶纤维素。本发明的布雷默浪丹口服制剂含有润滑剂时,润滑剂为布雷默浪丹与snac总重量的0.1%~10%,优选为0.2%~5%,更优选为0.5%~2%。润滑剂包括硬脂酸镁、硬脂富马酸钠,优选润滑剂为硬脂酸镁。本发明的布雷默浪丹口服制剂中,优选布雷默浪丹经过筛分,布雷默浪丹物料的粒径,采用显微镜观测颗粒的长径,粒径小于180微米,更优选粒径d90小于56微米。本发明的布雷默浪丹口服制剂中,优选snac经过筛分处理,snac的粒径,采用显微镜观测颗粒的长径,粒径小于124微米,更优选粒径d90小于8.6微米。本发明的布雷默浪丹口服制剂中,还可以含有甜味剂和香精中的一种或多种。本发明的布雷默浪丹口服制剂含有甜味剂时,甜味剂为布雷默浪丹与snac总重量的0.1%~15%,优选为0.2%~10%,更优选为0.5%~5%。甜味剂包括三氯蔗糖、甜菊糖苷、阿斯巴甜等,优选为三氯蔗糖。本发明的布雷默浪丹口服制剂含有香精时,香精为布雷默浪丹与snac总重量的0.1%~2%,优选为0.1%~1%,更优选为0.1%~0.5%。香精包括香蕉香精、树莓香精、牛油香精、香兰素等,优选为香兰素。优选本发明的布雷默浪丹口服制剂,含有治疗有效量的布雷默浪丹、snac和粘合剂,其中布雷默浪丹与snac的重量比为3.2~12:12~18,粘合剂为布雷默浪丹与snac总重量的0.1%~10%。更优选,本发明的布雷默浪丹口服制剂,含有治疗有效量的布雷默浪丹、snac、粘合剂和润滑剂,其中布雷默浪丹与snac的重量比为8~10:12~18,粘合剂为布雷默浪丹与snac总重量的0.1%~10%,润滑剂为布雷默浪丹与snac总重量的0.1%~10%。进一步优选,本发明的布雷默浪丹口服制剂,含有治疗有效量的布雷默浪丹、snac、粘合剂、赋形剂和润滑剂,其中布雷默浪丹与snac的重量比为8~10:12~18,粘合剂为布雷默浪丹与snac总重量的0.1%~10%,赋形剂为布雷默浪丹与snac总重量的0.2%~200%,润滑剂为布雷默浪丹与snac总重量的0.1%~10%。进一步优选,本发明的布雷默浪丹口服制剂,含有治疗有效量的布雷默浪丹、snac、粘合剂、赋形剂和润滑剂,其中布雷默浪丹与snac的重量比为8~10:15,粘合剂为布雷默浪丹与snac总重量的0.1%~10%,赋形剂为布雷默浪丹与snac总重量的0.2%~200%,润滑剂为布雷默浪丹与snac总重量的0.1%~10%。本发明的布雷默浪丹口服制剂,优选单一剂量或多剂量含有32~120mg布雷默浪丹和120~180mgsnac,进一步优选单一剂量或多剂量含有80~120mg布雷默浪丹和120~180mgsnac,更优选单一剂量或多剂量含有80~120mg布雷默浪丹和150mgsnac。优选地,上述提到的布雷默浪丹的重量以游离碱形式计。单一剂量是指可用于给药的最小制剂单位,例如,片剂的一片或划痕片可掰开的半片;胶囊剂的一粒胶囊;颗粒剂的一个最小包装或可服用的最小量;口服溶液指每次服用的量,或其可量取的一部分。本发明中“单一剂量”可以与“单位剂量”具有相同的意思,也可以指药品的剂量规格。多剂量是指多个单一剂量。由本发明的口服药物组合物可以采用本领域常用技术制备,例如将药物组合物中各成份按照相应比例和用量混合即得。本发明的布雷默浪丹口服制剂,可以采用常用的方法制备。例如可以采用药剂学中本专业人员理解的粉末直接混合技术,压制片剂或者灌装胶囊;可以采用干法制粒技术压制片剂或者灌装胶囊,或者作为颗粒剂使用;可以采用湿法制粒技术压制片剂、或者制备胶囊剂,或者制备颗粒剂;可以将本发明中的组合物添加水,作为口服溶液使用。本发明的布雷默浪丹口服制剂可以采用本发明的口服药物组合物制备。通常认为,多肽类药物对胃酸及胃蛋白酶存在的环境,是不稳定的,易降解。本发明研究人员通过研究发现,布雷默浪丹和snac组合时在大鼠胃液和人工胃液中相对稳定。布雷默浪丹与吸收促进剂组合形成的口服药物组合物,能明显提高口服布雷默浪丹后的体内吸收和利用,snac做为吸收促进剂时具有很好的提高布雷默浪丹体内吸收的效果。在大鼠在体吸收试验中,证实snac可以促进布雷默浪丹在胃部、小肠的吸收。本发明研究人员发现,snac有效地提升了布雷默浪丹在大鼠小肠灌流中的吸收程度,体现在血液中布雷默浪丹浓度的大幅度提升(相比于未使用snac的结果)。令人意外的是,随着snac浓度的增加,从0.5mmol到1.0mmol,大鼠体内吸收的布雷默浪丹的量有减少的趋势,并未随着snac用量的增加,吸收程度增加。snac促进大分子吸收的机制尚不完全明确,有文献报道在用量10mm的浓度下,机制是可逆性的增加了细胞间的通透性,使得分子量小于10k道尔顿的分子增加透过的量。本发明研究人员发现,snac有效的提升了布雷默浪丹在大鼠胃部灌流中的吸收程度,体现在血液中布雷默浪丹有较高的血药浓度水平(相比于未使用snac的结果)。证实布雷默浪丹在snac存在的情况下,在大鼠胃部有较好的吸收程度,且snac浓度为1.0mmol时比0.5mmol时布雷默浪丹的吸收程度更好。本发明研究人员惊奇地发现,含有布雷默浪丹与snac的组合物中并非snac用量越高促进布雷默浪丹的体内吸收效果越好。同时snac的用量越少越有利于口服药物组合物制备成口服制剂,有利于服用药物后的安全性。在布雷默浪丹为有效治疗量时,布雷默浪丹与snac的重量比为3.2~12:12~18时能取得较为理想的布雷默浪丹的体内吸收效果;更优选布雷默浪丹与snac的重量比为8~12:12~18,进一步优选布雷默浪丹与snac的重量比为8~12:15。在本发明的具体实施方式中,snac用量相同的情况下,布雷默浪丹20mg时的相对吸收程度不如80mg和120mg高。可见在布雷默浪丹和snac的组合物中,不是snac的相对用量越高吸收效果越好。本发明提供的布雷默浪丹口服药物组合物,与上市的皮下注射剂相比制备工艺简单,避免了使用注射器给药装置,避免注射剂的微生物与细菌内毒素方面的潜在危险,解决了很多患者对于注射剂依从性差的问题。在beagle犬口服后,本发明的布雷默浪丹口服药物组合物与皮下注射剂型比较,绝对生物利用度可大于1.0%,该数据优于之前有关研究的绝对生物利用度数据。从药物有效性的角度,口服布雷默浪丹为20-200mg的本发明药物组合物有可能替代注射1.75mg布雷默浪丹注射剂。在本发明的一个具体实施方式中,beagle犬口服含100mg的布雷默浪丹的本发明口服药物组合物后,cmax约为424.79ng/ml,auc0-lastt为686.80h·ng/ml。在本发明的一个具体实施方式中,本发明口服药物组合物制备的制剂在体外溶出度试验中(参照中国药典2020版四部通则931中溶出度和释放度测定方法第一法或者第二法装置,转速50rpm,0.1m盐酸为释放介质)15分钟的溶出度不低于标示量的85%,并且各测定制剂单元之间的相对标准差小于10%(rsd<10%)。口服普通制剂在15分钟内溶出度大于85%,则可判定不同制剂批次溶出度曲线的相似性,这一观点被广泛认可,并在众多药品研发法规和文献中有所表述。本发明药物组合物和口服制剂中使用崩解剂、粘合剂、润滑剂,以及控制布雷默浪丹和snac的粒径,有利于改善药物的溶出行为。药物在体外的溶出行为,可很大程度的影响药物在体内的吸收速度与程度,也就是说,快速溶出的制剂,在体内的药物释放速度也较快,体现在药动学参数上,表现为较小的达峰时间tmax,较高的血药浓度cmax。制剂在体外溶出度的均一性,也影响制剂在体内释放的均一性。本发明的口服制剂的一个具体实施方中,体外的溶出度测定实验选择中国药典2020年版规定的溶出度测定装置第一法,或者溶出度测定装置第二法时,搅拌桨或者转蓝装置的转速为50rpm,选择0.1m盐酸溶液900ml作为溶出度测定的介质,在5,10,15,30,45,60分钟取样,测定制剂的溶出度。本发明口服制剂在15分钟,溶出度大于85%。本发明口服制剂的各制剂单位的溶出度均匀程度,在15分钟或30分钟或45分钟或60分钟时,6粒制剂单位的溶出度数值的相对标准偏差小于10%(rsd<10%)。本发明口服制剂的具体实施方式中,口服制剂在beagle犬体内吸收程度与布雷默浪丹注射剂(皮下注射,1.75mg/0.3ml)相比,本发明口服制剂的绝对生物利用度大于1.0%。本发明的再一目的是提供上述口服药物组合物或由上述药物组合物制成的口服制剂在治疗女性性欲低下的产品中的应用。本发明的有益效果:(1)snac有效地提升了布雷默浪丹在大鼠小肠灌流中的吸收程度,有效的提升了布雷默浪丹在大鼠胃部灌流中的吸收程度;(2)含有布雷默浪丹与snac的组合物中并非snac用量越高,其促进布雷默浪丹的体内吸收效果越好。同时snac的用量越少越有利于口服药物组合物制备成口服制剂,有利于服用药物后的安全性。在布雷默浪丹为有效治疗量时,布雷默浪丹(以碱基计)与snac的重量比为3.2~12:12~18时能取得较为理想的布雷默浪丹的体内吸收效果;更优选布雷默浪丹(以碱基计)与snac的重量比为8~12:12~18,进一步优选布雷默浪丹(以碱基计)与snac的重量比为8~12:15。(3)本发明提供的布雷默浪丹口服药物组合物,与上市的皮下注射剂相比制备工艺简单,避免了使用注射器给药装置,避免注射剂的微生物与细菌内毒素方面的潜在危险,解决了很多患者对于注射剂依从性差的问题。(4)本发明的布雷默浪丹口服药物组合物与皮下注射剂型比较,绝对生物利用度可大于1.0%。从药物有效性的角度,阐述了与皮下注射制剂相当的体内药动学特征的雷默浪丹和snac的配比关系以及制剂组成,口服布雷默浪丹为20-200mg的本发明药物组合物有可能替代注射1.75mg布雷默浪丹注射剂。(5)本发明药物组合物和口服制剂中使用崩解剂、粘合剂、润滑剂,以及控制布雷默浪丹和snac的粒径,有效地改善药物的溶出行为,本发明口服制剂在15分钟,溶出度大于85%,各批次间溶出均匀。附图说明图1为不同snac用量时大鼠体内布雷默浪丹血药浓度对比(大鼠在体小肠吸收);图2为不同snac用量时大鼠体内布雷默浪丹血药浓度对比(大鼠在体胃部吸收);图3为实施例20,21,22给予beagle犬后体内血药浓度-时间曲线。具体实施方式以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的药物原料、辅料、试剂材料等,如无特殊说明,均为市售购买产品。布雷默浪丹使用醋酸盐,折算碱基后使用。本发明在进行口服组合物研究时,首先研究了布雷默浪丹在人工胃液与人工肠液中的稳定性(实施例3),以及布雷默浪丹与不同相对量的snac的组合物在大鼠小肠灌流与大鼠胃部的吸收程度(实施例1、实施例2)。具体如下:实施例1大鼠在给药前禁食16小时,但可自由饮水。腹腔注射麻醉后,将大鼠置于加热灯下,使体温保持在37℃左右,腹部正中切口暴露肠道。结扎胆管后,用磷酸盐缓冲液(ph7.4)冲洗肠道,剩余缓冲液用空气排出。用聚乙烯管在小肠两端插管。灌注含吸收促进剂的药物溶液或者仅仅含有药物的溶液,体积为200ml,溶液为krebs-ringer溶液,配制方法为称取nacl7.8g,kcl0.35g,cacl20.37g,nahco31.37g,nah2po40.32g,mgcl20.02g,葡萄糖1.4g,用少量水溶解,其中cacl2单独溶解后逐滴加入,葡萄糖临用加入,溶解后用纯化水定容至1l,即得。保持灌流溶液在37℃,通过小肠的近端部分的中空开口直接引入肠中,给药溶液保温循环。暴露颈静脉,在含药溶液循环20,40,60,90,120分钟时,通过直接穿刺肝素注射器采集0.3毫升血样。立即以12000转/分钟的速度离心5分钟,以获得血浆,冰冻储存作进一步分析。灌流溶液中加入布雷默浪丹,或者布雷默浪丹与snac。选择吸收促进剂两个浓度水平,进行试验设计。每个试验采用3只大鼠试验,另外测定不含有吸收促进剂的布雷默浪丹的灌流液的吸收。组方见表1,试验结果见图1。表1布雷默浪丹与snac组合物加入量由试验结果可见,snac在0.5mmol/200ml,1.0mmol/200ml灌流液的浓度下,均有效的提升了布雷默浪丹在大鼠小肠灌流中的吸收程度,体现在血液中布雷默浪丹浓度的大幅度提升(相比于未使用snac的结果)。令人比较意外的是,随着snac浓度的增加,从0.5mmol到1.0mmol,大鼠体内吸收的布雷默浪丹的量有减少的趋势。snac促进大分子吸收的机制尚不完全明确,有文献报道在用量10mm的浓度下,机制是可逆性的增加了细胞间的通透性,使得分子量小于10k道尔顿的分子增加透过的量。实施例2大鼠在给药前禁食16小时,但可自由饮水。腹腔注射麻醉后,将大鼠置于加热灯下,使体温保持在37℃左右,腹部正中切口暴露胃部。在胃部两端切口,聚乙烯管在胃部两端插管,用磷酸盐缓冲液(ph7.4)冲洗胃部,剩余缓冲液用空气排出。灌注含吸收促进剂的药物溶液或者仅仅含有药物的溶液,体积为200ml,溶液为krebs-ringer溶液,配制方法同实施例1。保持灌流溶液在37℃,通过导管给药的溶液保温循环。暴露颈静脉,在含药循环液开始循环后20,40,60,90,120分钟时,通过直接穿刺肝素注射器采集0.3毫升血样。立即以12000转/分钟的速度离心5分钟,以获得血浆,冰冻储存作进一步分析。灌流溶液中加入布雷默浪丹,或者布雷默浪丹与snac。选择snac两个浓度水平,进行试验设计。每个试验采用3只大鼠试验,另外测定不含有snac的布雷默浪丹的灌流液的吸收。组方见表2。表2布雷默浪丹与snac组合物加入量未添加吸收促进剂的布雷默浪丹药物溶液,在120分钟内未测出血液内药物浓度。试验结果见图2。多肽类药物在胃部通常认为对胃蛋白酶和盐酸较为敏感,易发生降解,影响吸收。从实施例2可见,不添加吸收促进剂,布雷默浪丹在在体大鼠胃部基本没有吸收,血液中无法检测到药物。snac在0.5mmol/200ml,1.0mmol/200ml灌流液的浓度下,均有效的提升了布雷默浪丹在大鼠胃部灌流中的吸收程度,体现在血液中布雷默浪丹有较高的血药浓度水平(相比于未使用吸收促进剂的结果)。证实布雷默浪丹在上述吸收促进剂存在的情况下,在大鼠胃部有较好的吸收程度。实施例3配制人工胃液(参考美国药典配制方法)与人工肠液(参照中国药典2020年版中收录的含胰酶的ph值6.8的磷酸缓冲液配制方法)。称取布雷默浪丹适量,分别用人工胃液和人工肠液溶解成0.1mg/ml的溶液,放置在37℃水浴中。采用高效液相色谱法,检测人工胃液和人工肠液中布雷默浪丹的含量。检测方法:高效液相色谱法,c18柱,检测波长215nm;柱温30℃;流速1.0ml/min;进样体积:20ul;样品浓度0.1mg/ml;流动相a含1%三氟乙酸的乙腈溶液,流动相b含1%三氟乙酸的水溶液;梯度洗脱程序见表3:表3流动相梯度洗脱程序表时间流动相a流动相b0分钟25%75%25分钟50%50%30分钟100%0%35分钟25%75%40分钟25%75%从测定结果中布雷默浪丹主峰的峰面积变化情况来看,4小时内,人工胃液中布雷默浪丹色谱峰面积基本没有变化,0,1,2,3,4小时的5个时间点色谱峰面积的相对标准差rsd=1.59%。令人意外的发现该药物对人工胃液情况下较为稳定。而在人工肠液中,4小时内布雷默浪丹色谱峰面积降低了5%,0,1,2,3,4小时的5个时间点色谱峰面积的相对标准差为3%。认为布雷默浪丹在人工肠液比在人工胃液中更加不稳定。为使药物的口服起效速度尽可能与皮下注射的效果一致,需要口服制剂在胃部快速释放布雷默浪丹。实施例4-6实施例4-6的处方组成见下表4,以单位制剂中物料的质量表示。表4实施例4-6的处方组成实施例4:取商业化购买的布雷默浪丹、snac,物料不做粉碎处理,按照处方组成称取,混合5分钟,装入0号胶囊,每粒装入约160mg。实施例5:取商业化购买的布雷默浪丹、snac,物料不做粉碎处理,按照处方组成称取,混合5分钟,装入0号胶囊,每粒装入约230mg。实施例6:布雷默浪丹、snac粉碎处理,布雷默浪丹过80目筛,snac过100目筛,按照处方组成称取,混合5分钟,装入0号胶囊,每粒装入约230mg。溶出度测定方法:选择中国药典2020年版规定的溶出度测定装置第一法,转蓝装置的转速为50rpm,采用0.1m盐酸溶液900ml作为溶出度测定的介质,在5,10,15,30,45分钟取样,测定溶出度。测定方法采用实施例3中所述的高效液相色谱法。试验结果见表5:表5实施例4-6溶出度测定结果(均值及相对标准差rsd,n=6)实施例4和实施例5两个实施例都没有处理物料粒径。在15分钟时,溶出度均小于85%,并且各个胶囊之间的溶出度差异较大,实施例6的物料经过粉碎处理,药物和snac的d90小于56、8.6微米,溶出度结果看,除5分钟时,溶出度略有增加外,15分钟溶出度低于85%。从物料的粉体学特点看,实施例4,5的物料没有粉碎,流动性较好,但颗粒的大小差异较大,大规模生产时,存在混合不均一的风险。并且不控制粒径,容易引起产品批间差异变化较大。实施例7-10湿法制粒工艺是针对湿度、温度稳定物质,改善粉体流动性的常用工艺,通过添加粘合剂制粒,添加润滑剂助流达到改善流动性的目的。常用的粘合剂有低粘度的羟丙甲纤维素、聚维酮类化合物。常用的润滑剂包括硬脂酸镁、硬脂富马酸钠等。实施例7-10的处方组成见下表5,以单个制剂加入的物料表示,单位:mg。表5实施例7-10处方组成制备方法:雷默浪丹和snac粉碎,药物和snac的d90小于56、8.6微米。取两种物料,按照处方设计分别加入聚维酮k-30或者k-90,加水制粒,过18目筛制粒,40-60℃干燥,20目整理,加入硬脂酸镁或者硬脂富马酸钠,混合2分钟。装入胶囊。测定溶出度。溶出度测定方法:选择中国药典2020年版规定的溶出度测定装置第一法,转蓝装置的转速为50rpm,选择0.1m盐酸溶液900ml作为溶出度测定的介质,在5,10,15,30,45分钟取样,测定溶出度。测定方法采用实施例3中所述的高效液相色谱法。试验结果件表6:表6实施例7-10溶出度测定结果(均值/相对标准差,n=6)试验结果可见,布雷默浪丹的物料粒径,对于溶出度有影响。为了改善物料的流动性,适合于胶囊的灌装,对物料进行了湿法制粒,以聚维酮k-90作为粘合剂(实施例10),溶出度明显比聚维酮k-30为粘合剂(实施例8)缓慢。经过制粒后,药物的溶出需要经过颗粒的崩解后来达到,预期制粒的胶囊会比不制粒灌装的胶囊的相同时间点的溶出度数值小,但实际结果出乎意料,采用聚维酮k-30为粘合剂的制粒灌装胶囊,溶出度比物料直接灌装胶囊的相同时间点溶出度数值大。硬脂富马酸钠作为一种亲水性的润滑剂,与硬脂酸镁相比较,在物料助流性方面作用相似,在上述试验里,体现在5分钟药物的较快的溶出,但最终结果却出乎意料,硬脂酸镁作为润滑剂的实施例7,溶出程度要比硬脂富马酸钠效果好(实施例8,9)。经过使用聚维酮k-30制粒,添加硬脂酸镁助流后,采用湿法制粒工艺,胶囊的溶出度极大得到改善,15分钟内溶出度大于85%。实施例11-19布雷默浪丹与snac粉碎后使用,药物和snac的d90小于56、8.6微米。实施例11-19的处方组成见下表,以单个制剂加入的物料表示,单位:mg。表7实施例11-19处方组成制备方法:实施例11-19按照处方配比称取布雷默浪丹、8-(2-羟基苯甲酰氨基)辛酸钠、微晶纤维素(如处方中有),聚维酮k-30,混合5分钟,加水适量,制粒,过18目筛。40-60摄氏度干燥后,加入硬脂酸镁,混合2分钟,装入00号胶囊壳,(实施例15,18装两粒0号胶囊)得到胶囊制剂。溶出度测定方法:选择中国药典2020年版规定的溶出度测定装置第一法,转蓝装置的转速为50rpm,选择0.1m盐酸溶液900ml作为溶出度测定的介质,在15,30分钟取样,测定溶出度。测定方法采用实施例3中所述的高效液相色谱法。试验结果见表8:表8实施例11-19溶出度测定结果beagle犬口服给药,给予实施例11-19的胶囊剂,在给药前,所有动物禁食12小时,不禁水。给药前1h至给药后1h内禁止饮水,其他时间可按需饮水。分别于给药前(0min)、给药后5min,15min,30min,45min,1h,2h,3h,4h,6h、8h由前肢静脉采血约2ml,置于装有edta-k2的采血管中,轻轻颠倒混匀,并于1h内离心,4℃(2-8℃)离心10min(1700g)后分离血浆样本。所有离心后血浆样本取约1ml血浆置于聚丙烯冻存管中。离心后2小时内可将血浆样本置于-20℃(-10至-30℃)冰箱中暂存,并在24小时内转移至-80℃(-60至-90℃)超低温冰箱中保存,也可以直接置于-80℃超低温冰箱保存。采用高效液相色谱仪串联质谱仪测定beagle犬血浆样品中布雷默浪丹的浓度,由软件analyst1.6.3(absciex)进行分析。血药浓度达峰时间tmax,峰浓度cmax,以及药时曲线下面积auc0-∝结果见下表9:表9实施例11-19药代动力学指标结果通过观察数据发现,9个实施例的血药浓度达峰时间tmax均在0.5-1.0小时之间,布雷默浪丹和snac的用量变化,对于达峰时间没有影响。归其原因可能由于9种制剂均在15分钟内溶出度大于85%,属于在盐酸介质中快速溶出行为,因此体内达峰时间接近。在没有肠溶保护性辅料的使用下,制剂在15分钟内溶出度大于85%,达到尽快在胃内溶出的条件下,snac可以促进布雷默浪丹的吸收。实施例11-19,布雷默浪丹制剂在beagle犬体内可达到cmax为40.2-415.2ng/ml;auc可以达到71.5-989.0h*ng/ml。snac用量相同的情况下,布雷默浪丹20mg时的相对吸收效果不如80mg和120mg。相同的布雷默浪丹给药剂量下,snac的用量提高,cmax和auc并没有必然提高,显示并不是snac用量越高吸收效果越好。在能实现预期效果的情形下,采用较低剂量的吸收促进剂snac,具有安全性优势,也利于制备制剂,有利于患者服用尽量少的药物。实施例20-22实施例20-22的处方组成见下表10。表10实施例20-22的处方组成实施例20:布雷默浪丹粉碎,粒径d90=56μm,8-(2-羟基苯甲酰氨基)辛酸钠粉碎,粒径d90=8.6μm。按照处方量,称取布雷默浪丹,8-(2-羟基苯甲酰氨基)辛酸钠,微晶纤维素,聚维酮k-30,三氯蔗糖,混合3分钟,加水适量制粒,18目筛,40-60℃下干燥至干燥失重小于3%,过20目整粒,加入香兰素,混合2分钟,装入包装袋,得到颗粒剂,装量每袋500mg。实施例21:布雷默浪丹粉碎,粒径d90=56μm,8-(2-羟基苯甲酰氨基)辛酸钠粉碎,粒径d90=8.6μm。按照处方量,称取布雷默浪丹,8-(2-羟基苯甲酰氨基)辛酸钠,微晶纤维素,聚维酮k-30,混合3分钟,加水适量18目筛制粒,40-60℃下干燥至干燥失重小于3%,过20目整粒,加入硬脂酸镁,混合2分钟,装入0号胶囊壳,得到胶囊剂。实施例22:西林瓶,胶塞,铝盖清洗干净,烘干。称取处方量布雷默浪丹,甘油,一起加入小烧杯中,加水,搅拌溶解、均匀。测定ph值。如有必要,用盐酸或者氢氧化钠溶液(0.5m)调节ph值4.0-6.0之间。分装至西林瓶中,压塞,压铝盖。121摄氏度灭菌15分钟。冷却。得到注射剂。浓度为1.75mg(以布雷默浪丹碱基计算)/0.3ml。测定了实施例20-22在beagle犬体内的药动学特征,试验采用犬6只,随机、开放、三制剂、三周期、三交叉试验设计,两次给药间隔的清洗期至少为5天。实施例22为注射剂,皮下注射1.75mg/0.3ml;实施例20为口服颗粒剂,规格:80mg/0.5g,口服给药0.5g(10ml温水冲服,30ml温水送服3次,冲洗瓶壁保证药物完全送服)。实施例21为胶囊剂,规格:100mg/粒,口服1粒(每粒约2ml水送服)。犬雌雄各半,在给药前,所有动物禁食12小时,不禁水。给药前1h至给药后1h内禁止饮水,其他时间可按需饮水。分别于给药前(0min)、给药后5min,15min,30min,45min,1h,2h,3h,4h,6h、8h由前肢静脉采血约2ml,置于装有edta-k2的采血管中,轻轻颠倒混匀,并于1h内离心,4℃(2-8℃)离心10min(1700g)后分离血浆样本。所有离心后血浆样本取约1ml血浆置于聚丙烯冻存管中。离心后2小时内可将血浆样本置于-20℃(-10至-30℃)冰箱中暂存,并在24小时内转移至-80℃(-60至-90℃)超低温冰箱中保存,也可以直接置于-80℃超低温冰箱保存。采用高效液相色谱仪串联质谱仪测定beagle犬血浆样品中布雷默浪丹的浓度,由软件analyst1.6.3(absciex)进行分析。血药浓度达峰时间tmax,峰浓度cmax,药时曲线下面积auc0-∝。试验结果见表11,不同时间点的体内血药浓度,单位(ng/ml)。表11实施例20-22不同时间点的体内血药浓度试验结果可见,在达峰时间tmax方面,实施例20为颗粒剂,在给药前溶散于水中,给犬灌胃,吸收速度快,达峰时间约0.25小时,皮下注射达峰时间0.5小时,口服胶囊剂达峰时间0.75小时。验证了溶出度控制,是保证tmax达到预期区间的假设。实施例20,21在15分钟时,采用转蓝法,50rpm测定的溶出度分别为92%,90%,rsd均小于10%。实施例22的cmax为429.83ng/ml,口服胶囊剂100mg,cmax约为424.79ng/ml,与皮下注射水平相当。比颗粒剂(口服80mg)的浓度要高。在auc方面,口服胶囊剂auc0-t为686.80hng/ml;实施例20颗粒剂为548.20hng/ml,实施例22皮下注射的数值为662.42hng/ml。折算口服给药的剂量后,口服制剂的绝对生物利用度大于1.0%。实施例23-28表12实施例23-24处方组成及占比表13实施例25-26处方组成及占比表14实施例27-28处方组成及占比布雷默浪丹粉碎,粒径d90=56μm,8-(2-羟基苯甲酰氨基)辛酸钠(简称snac)粉碎,粒径d90=8.6μm。按照检验报告,布雷默浪丹折算醋酸盐含量后,对应碱基80mg,100mg,120mg,实际投料分别为85mg,106mg,127.5mg。按照处方量,称取布雷默浪丹,8-(2-羟基苯甲酰氨基)辛酸钠,微晶纤维素,聚维酮k-30,混合3分钟,加水适量制粒,过18目筛制粒,40-60℃下干燥至干燥失重小于3%,过20目整粒,加入硬脂酸镁,混合2分钟,装入0号胶囊壳,得到胶囊剂。实施例23-28采用中国药典2020版溶出度测定第一法的装置,在0.1mhcl介质900ml中,转速50rpm,15分钟溶出度都大于标示量的85%。参照实施例21中,给予beagle犬口服胶囊剂,分别于给药前(0min)、给药后5min,15min,30min,45min,1h,2h,3h,4h,6h、8h由前肢静脉采血约2ml,按照实施例21的血样处理办法处置,采用高效液相色谱仪串联质谱仪测定beagle犬血浆样品中布雷默浪丹的浓度,由软件analyst1.6.3(absciex)进行分析。血药浓度达峰时间tmax,峰浓度cmax,药时曲线下面积auc0-t试验结果见下表15:表15实施例23-28药代动力学指标结果实施例29-30表16实施例29-30处方组成(mg/单位制剂)布雷默浪丹粉碎,粒径d90=56μm,8-(2-羟基苯甲酰氨基)辛酸钠(简称snac)粉碎,粒径d90=8.6μm。按照检验报告,布雷默浪丹折算醋酸盐含量后,对应碱基100mg。按照处方量,称取布雷默浪丹,8-(2-羟基苯甲酰氨基)辛酸钠,微晶纤维素,聚维酮k-30,混合3分钟,加水适量制粒,过18目筛制粒,40-60℃下干燥至干燥失重小于3%,过20目整粒,加入硬脂酸镁,混合2分钟,装入00号胶囊壳,实施例29装1粒,实施例30装2粒。得到胶囊剂。实施例29-30采用中国药典2020版溶出度测定第一法的装置,在0.1mhcl介质900ml中,转速50rpm,实施例29取1粒,实施例30取2粒,15分钟溶出度都大于标示量的85%。表17实施例29-30溶出度结果时间(分钟)实施例29实施例301597%86%3099%95%数据可见,在给药剂量80mg-120mg之间,snac使用量120-180mg之间,口服布雷默浪丹胶囊,在beagle犬体内cmax和auc0-t与皮下注射1.75mg(实施例22)相比,比值在80.71%-112.83%、88.99%-111.29%之间,可认为口服制剂与注射剂有相同的效果。上述详细说明是针对本发明其中之一可行实施例的具体说明,该实施例并非用以限制本发明的专利范围,凡未脱离本发明所为的等效实施或变更,均应包含于本发明技术方案的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1