用于治疗法布里病的方法和组合物与流程
用于治疗法布里病的方法和组合物
1.相关申请的交叉引用
2.本技术要求2019年1月4日提交的美国临时申请号62/788,439的权益,该申请的公开内容通过引用整体并入。
3.序列表
4.本技术包含序列表,该序列表已经以ascii格式以电子方式提交,并且据此通过引用整体并入。于2019年12月3日创建的所述ascii副本命名为8325018840sl.txt且大小为10,636字节。
技术领域
5.本公开属于用基因疗法预防和/或治疗法布里病的领域。
背景技术:
6.α
‑
半乳糖苷酶a(gla)基因编码溶酶体水解酶,即α
‑
半乳糖苷酶a(α
‑
gal a)。α
‑
半乳糖苷酶是一种催化寡糖和多糖的末端α
‑
半乳糖基部分水解的酶。
7.法布里病(fabry disease)是一种由gla基因突变引起的x连锁溶酶体贮积病。缺乏α
‑
gal a活性引起其主要底物即球三糖神经酰胺(gb3)及其脱乙酰化可溶形式即球三糖神经鞘氨醇(lyso
‑
gb3)的进行性、系统性积聚。这些底物的长期积聚导致肾病、皮肤病、心脏病、角膜营养不良(例如角膜和晶状体混浊)和/或脑血管疾病,并且预期寿命缩短。根据突变和残留的α
‑
gal a酶水平,该疾病在儿童期/青春期以经典早发法布里病形式呈现或在以后的生活中以减弱(成年)形式呈现。经典法布里病发生在残留酶活性<5%时(arends等人,2017),并且通常发生在男性中。早期症状可包括周期性肢端感觉异常、血管角质瘤、角膜和晶状体混浊、进行性肾功能不全、心脏病和脑血管事件。法布里病的减弱形式或成年形式通常仅累及一个器官系统,通常是心脏或肾脏。
8.在经典形式和成年形式中,现行护理标准是使用重组α
‑
gal a、(半乳糖苷酶β或等效物)或伴侣疗法的酶替代疗法(ert),该酶替代疗法仅可用于其突变受它作用的患者。将重组α
‑
gal a输注到血流允许经由甘露糖
‑6‑
磷酸受体介导的摄取(交叉矫正)转移到次级组织。然而,ert中使用的重组α
‑
gal a的半衰期很短(在血浆中大约1小时)(clarke等人,2007)需要终生输注,并且在很大比例的患者中有输注有关反应的相关风险(clarke等人2007),其中一些反应是严重的。另外,很大百分比的患者最终会生成针对重组酶的抗体,这可能影响ert酶的活性,因此可能无法从诸如肾脏等器官中清除所有底物(linthorst等人,2004)。
9.正在开发具有较长半衰期的重组α
‑
gal a产品,其施用频率可能较低。然而,预计这些仍将需要长期施用,并且有输注有关反应的相关风险和/或由于中和抗体而无活性,并且α
‑
gal a水平仍会随时间变化而显著波动。
10.因此,需要解决法布里病中未满足的需求的替代疗法。
技术实现要素:
11.本文公开了一种在细胞中表达至少一种α半乳糖苷酶a(α
‑
gal a)蛋白的方法。在一些实施方案中,所述方法包括向所述细胞施用包含突变的wpre序列、任选地mut6突变的wrpe序列和编码至少一种α
‑
gal a蛋白的gla转基因的表达构建体,使得所述α
‑
gal a蛋白在所述细胞中表达。
12.在一些实施方案中,所述表达构建体包含野生型gla序列或密码子优化的gla序列。
13.在一些实施方案中,所述表达构建体包含以下的一种或多种:增强子、启动子、内含子、编码信号肽和/或聚腺苷酸化信号的序列,其中所述突变的wpre序列、任选地所述mut6突变的wrpe序列以及编码至少一种α
‑
gal a蛋白的所述gla转基因位于所述信号肽和编码所述聚腺苷酸化信号的所述序列之间。
14.在一些实施方案中,所述表达构建体包含seq id no:9的序列。
15.在一些实施方案中,所述细胞在患有法布里病的受试者中。
16.在一些实施方案中,所述细胞在雄性受试者中。
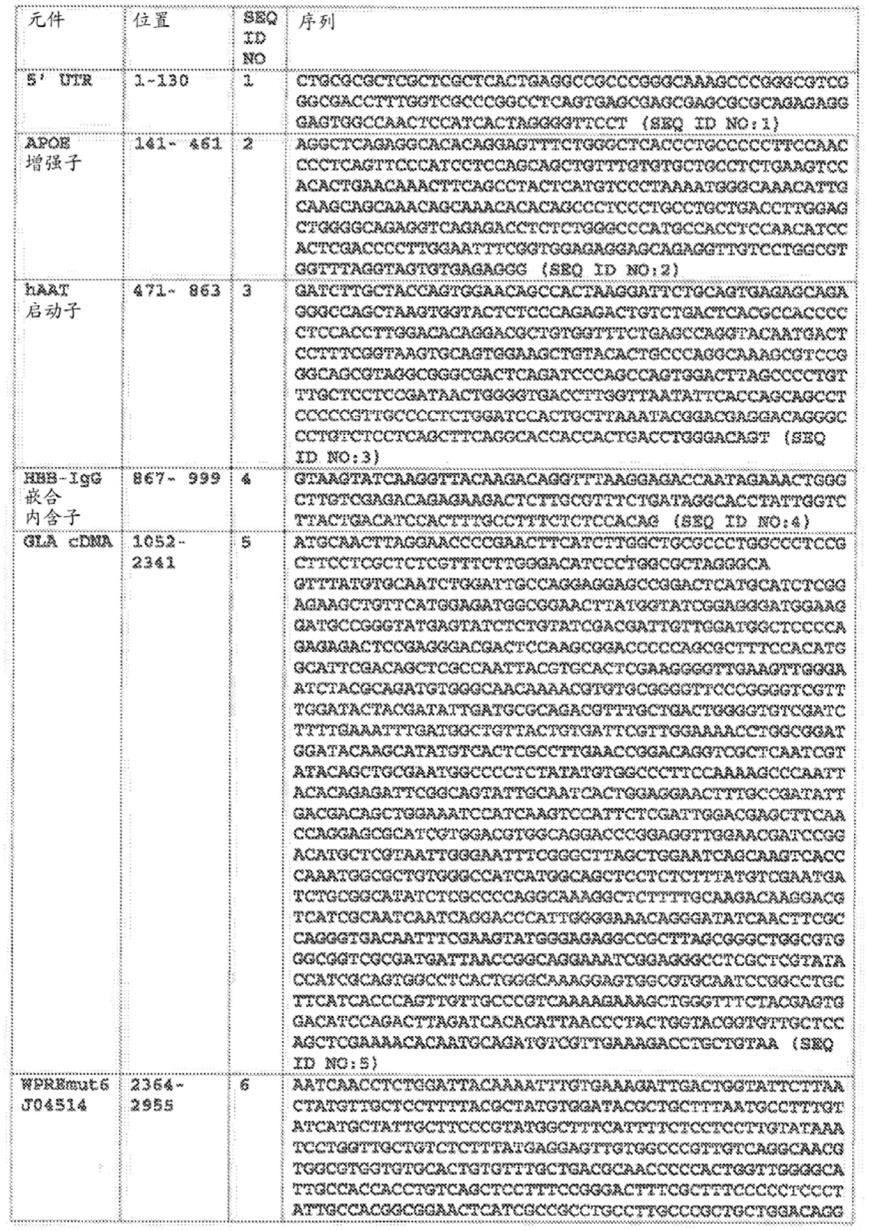
17.在一些实施方案中,所述表达构建体在药学上可接受的载剂中施用。
18.在一些实施方案中,所述药学上可接受的载剂包括含有cacl2、mg cl2、nacl、蔗糖和kolliphor(泊洛沙姆)p 188的磷酸盐缓冲盐水。
19.在一些实施方案中,所述表达构建体序列包括如表1所示的序列,并且其中所述表达构建体通过aav病毒载体递送至细胞。
20.在一些实施方案中,aav病毒载体血清型是aav2/6。
21.在一些实施方案中,所述表达构建体以约5.0e+12至1.0e+14个载体基因组/千克(vg/kg)的剂量施用于受试者。
22.在一些实施方案中,将所述表达构建体施用于受试者的肝脏。在其它实施方案中,所述表达载体通过静脉内输注施用于受试者。在还有其它实施方案中,仅将一剂表达构建体施用于所述受试者。
23.在一些实施方案中,在施用所述表达构建体之前和/或期间向所述受试者施用免疫抑制剂。在一些实施方案中,免疫抑制剂包括泼尼松。
24.在一些实施方案中,至少一种α半乳糖苷酶a(α
‑
gal a)蛋白的表达持续至少3个月、至少9个月或至少12个月。
25.在一些实施方案中,与未治疗的受试者相比,由所述转基因表达的所述α
‑
gal a蛋白使所述受试者中的鞘糖脂的量减少至少约2倍至约9倍。
26.在一些实施方案中,与未治疗的受试者相比,由所述转基因表达的所述α
‑
gal a蛋白使受试者中的鞘糖脂的量减少至少约80%。
27.在一些实施方案中,由所述转基因表达的所述α
‑
gal a蛋白使所述受试者的血浆、肝脏、心脏、肾脏或脾脏中的一种或多种中的鞘糖脂的量减少。
28.在一些实施方案中,与施用了在sf9细胞系统中制造的所述表达构建体的受试者中的gla水平相比,在hek293细胞系统中制造的所述表达构建体在所述受试者中提供的gla水平高约21倍。
29.在一些实施方案中,受试者中的α
‑
gal a蛋白活性比生理正常值/野生型高约100
倍至1,500倍。
30.在一些实施方案中,由所述转基因表达的α
‑
gal a蛋白在所述受试者的肾脏、肝脏和心脏中具有活性。
31.在一些实施方案中,所述gla转基因保持在染色体外而未整合到所述细胞的基因组中。
32.在一些实施方案中,施用一种或多种裂解受试者肝脏细胞中的内源性白蛋白基因的核酸酶,使得所述转基因整合到所述白蛋白基因中并由所述白蛋白基因表达。
33.呈现了通过本文所述的方法制备的包含外源gla转基因的基因修饰细胞。在一些实施方案中,所述细胞是干细胞或前体细胞。在一些实施方案中,所述细胞是肝脏细胞或肌肉细胞。在一些实施方案中,所述gla转基因保持在染色体外而未整合到所述细胞的基因组中。在一些实施方案中,gla转基因整合到所述细胞的基因组中。
34.还呈现了一种预防、抑制或治疗法布里病或与法布里病相关的一种或多种症状的方法。所述方法可包括向有需要的受试者施用表达构建体,所述表达构建体包含突变的wpre序列、任选地mut6突变的wrpe序列和编码至少一种α
‑
gal a蛋白的gla转基因。
35.在一些实施方案中,所述症状包括以下的一种或多种:高于正常或基线的gb3水平、高于正常或基线的lyso
‑
gb3水平、肾病、心脏病、肢端感觉异常、血管角质瘤、胃肠道疼痛、角膜和晶状体混浊或脑血管疾病。如本文所述,基线可意指任何起始测量值,即,在施用特定治疗之前取得的测量值。在一些实施方案中,受试者是雄性并且具有小于约5%的α
‑
gal a酶活性。在一些实施方案中,所述表达构建体包含野生型gla序列或密码子优化的gla序列。在一些实施方案中,所述表达构建体还包含以下的一种或多种:增强子、启动子、内含子、编码信号肽和/或聚腺苷酸化信号的序列,其中所述突变的wpre序列、任选地所述mut6突变的wrpe序列以及编码至少一种α
‑
gal a蛋白的所述gla转基因位于所述信号肽和编码所述聚腺苷酸化信号的所述序列之间。在一些实施方案中,所述表达构建体在药学上可接受的载剂中施用。在一些实施方案中,所述药学上可接受的载剂包含含有cacl2、mg cl2、nacl、蔗糖和kolliphor(泊洛沙姆)p 188的磷酸盐缓冲盐水。
36.在其它实施方案中,所述表达构建体序列包括如表1所示的序列,并且其中所述表达构建体通过aav病毒载体递送至受试者的细胞。在一些实施方案中,aav病毒载体血清型是aav2/6。
37.在一些实施方案中,所述表达构建体以约5.0e+12至1.0e+14个载体基因组/千克(vg/kg)的剂量施用于受试者。在一些实施方案中,将所述表达构建体施用于受试者的肝脏。在一些实施方案中,所述表达载体通过静脉内输注施用于受试者。在一些实施方案中,仅将一剂表达构建体施用于所述受试者。
38.在一些实施方案中,在施用所述表达构建体之前和/或期间向受试者施用免疫抑制剂。在一些实施方案中,免疫抑制剂包括泼尼松。在一些实施方案中,至少一种α半乳糖苷酶a(α
‑
gal a)蛋白的表达持续至少3个月、至少9个月或至少12个月。
39.在其它实施方案中,与未治疗的受试者相比,由所述转基因表达的所述α
‑
gal a蛋白使所述受试者中的鞘糖脂的量减少至少约3倍至约9倍。
40.在一些实施方案中,与未治疗的受试者相比,由所述转基因表达的所述α
‑
gal a蛋白使受试者中的鞘糖脂的量减少至少约80%。
41.在一些实施方案中,由所述转基因表达的所述α
‑
gal a蛋白使所述受试者的血浆、肝脏、心脏、肾脏或脾脏中的一种或多种中的鞘糖脂的量减少。
42.在一些实施方案中,所述表达构建体是在hek293细胞系统中制造的并且其中所述受试者中的gla水平与施用了在sf9细胞系统中制造的所述表达构建体的受试者中的gla水平相比高21倍。
43.在一些实施方案中,受试者中的α
‑
gal a蛋白活性比正常值/野生型高约100倍至1,500倍。
44.在一些实施方案中,由所述转基因表达的α
‑
gal a蛋白在所述受试者的肾脏、肝脏和心脏中具有活性。
45.在一些实施方案中,所述gla转基因保持在染色体外而未整合到所述受试者的细胞的基因组中。
46.在一些实施方案中,所述方法包括施用一种或多种裂解受试者肝脏细胞中的内源性白蛋白基因的核酸酶,使得所述转基因整合到所述白蛋白基因中并由所述白蛋白基因表达。
47.本文描述了包含表达构建体的组合物,所述表达构建体包含突变的wpre序列、任选地mut6突变的wrpe序列以及编码所述至少一种α
‑
gal a蛋白的gla转基因,所组合物用于治疗法布里病。
48.在一些实施方案中,所述组合物包括药学上可接受的载剂。如权利要求56所述的组合物,其中所述药学上可接受的载剂包含cacl2、mg cl2、nacl、蔗糖和kolliphor(泊洛沙姆)p 188。
49.在一些实施方案中,所述组合物包括野生型gla序列或密码子优化的gla序列。
50.在一些实施方案中,所述组合物包括以下的一种或多种:增强子、启动子、内含子、编码信号肽和/或聚腺苷酸化信号的序列,其中所述突变的wpre序列、任选地所述mut6突变的wrpe序列以及编码至少一种α
‑
gal a蛋白的所述gla转基因位于所述信号肽和编码所述聚腺苷酸化信号的所述序列之间。
51.在一些实施方案中,所述组合物包括如表1所示的组合物并且其中所述表达构建体通过aav病毒载体递送至细胞。在一些实施方案中,所述组合物包括aav病毒载体血清型aav2/6。
52.在一些实施方案中,所述组合物包括包含约5.0e+12至1.0e+14个载体基因组/受试者千克(vg/kg)的表达构建体。
53.在一些实施方案中,所述组合物包括包含seq id no:9的序列的表达构建体。
54.还呈现了一种产生用于治疗法布里病的α
‑
gal a蛋白的方法,所述方法包括根据权利要求1
‑
4中任一项所述的方法在分离的细胞中表达所述α
‑
gal a蛋白,以及分离由所述细胞产生的所述α
‑
gal a蛋白。
55.呈现了一种递送载体,所述递送载体包含突变的wrpe序列,任选地mut6 wpre序列和gla转基因,所述递送载体用于本文所述的方法中。
56.在一些实施方案中,所述递送载体是病毒载体或脂质纳米颗粒(lnp)。在一些实施方案中,所述病毒载体包含aav2/6并且其中所述病毒载体将所述表达构建体递送至至少50%、至少60%、至少70%或至少80%的细胞。
57.本文还呈现了前述权利要求中任一项所述的表达构建体、aav载体和/或基因修饰细胞用于治疗法布里病的用途。在一些实施方案中,所述增强子包含seq id no:2,所述启动子包含seq id no:3,所述内含子包含seq id no:4,所述gla转基因包含seq id no:5,所述突变的wpre序列包含seq id no:6,以及所述聚腺苷酸化信号包含seq id no.7。
58.在一些实施方案中,组合物包括seq id no:2的增强子、seq id no:3的启动子、seq id no:4的内含子、seq id no:5的gla转基因、seq id no:6的突变的wpre序列以及seq id no.7的聚腺苷酸化信号。
附图说明
59.图1a示出了描绘编码gla基因的构建体(命名为变体#4)的示意图。变体#4构建体包括增强子(例如,apoe);启动子(例如,haat);内含子序列(例如,hbb
‑
igg);信号肽(例如,gla);gla编码序列(例如,“glaco”);和聚腺苷酸化信号(例如,bgh)。
60.图1b示出了描绘编码gla基因的构建体(命名为变体#21)的示意图,该构建体包括突变的土拨鼠肝炎病毒转录后调控元件(wpre)(也称为“mut 6”或“wpremut6 v1”)。变体#21构建体还包括增强子(例如,apoe);启动子(例如,haat);内含子序列(例如,hbb
‑
igg);信号肽(例如,gla);gla编码序列(例如,“glaco”);和聚腺苷酸化信号(例如;bgh)。
61.图2示出了指示用变体#4构建体处理的指定第2组至第4组中的单个gla敲除(glako)小鼠或对照动物中85天内的血浆gla活性的图表。第1组用配制缓冲液(“配制品”)处理。第2组用2.0e+12vg/kg剂量的构建体处理,第3组用5.0e+12vg/kg剂量的构建体处理,并且第4组用5.0e+13vg/kg剂量的构建体处理。
62.图3示出了指示用表达构建体(变体#4表达构建体)处理的指定第2组至第4组中的glako小鼠或对照动物中85天内的血浆gla活性的图表。第1组施用配制缓冲液(“配制品”)。第2组用2.0e+12vg/kg剂量的构建体处理,第3组用5.0e+12vg/kg剂量的构建体处理,并且第4组用5.0e+13vg/kg剂量的构建体处理。
63.图4a是示出了用变体#4表达构建体处理的指定动物组或对照动物的肝脏裂解物中的α
‑
gal a活性的图表。第2组施用2.0e+12vg/kg,第3组施用5.0e+12vg/kg,并且第4组施用5.0e+13vg/kg。
64.图4b是示出了用表达构建体(变体#4表达构建体)处理的指定动物组或对照动物的肾脏裂解物中的α
‑
gal a活性的图表。第2组用2.0e+12vg/kg剂量的构建体处理,第3组用5.0e+12vg/kg剂量的构建体处理,并且第4组用5.0e+13vg/kg剂量的构建体处理。
65.图4c是示出了用表达构建体(变体#4表达构建体)处理的指定动物组或对照动物的心脏裂解物中的α
‑
gal a活性的图表。第2组施用2.0e+12vg/kg,第3组施用5.0e+12vg/kg,并且第4组施用5.0e+13vg/kg。
66.图5a是示出了在用表达构建体(变体#4表达构建体)处理的指定glako小鼠中或对照动物中在处理后91天血浆、脾脏、肝脏、心脏和肾脏中的lyso
‑
gb3底物浓度的图表。对于每个组织,从左到右的条形示出了接受配制缓冲液的第1组动物,接受2.0e+12vg/kg剂量的构建体的第2组(10只动物);接受5.0e+12vg/kg剂量的构建体的第3组(9只动物);以及接受5.0e+13vg/kg剂量的构建体的第4组(20只动物)。如图所示,在测试的所有组织中,与对照组1相比,第2组至第4组中的lyso
‑
gb3底物浓度较低。虚线还示出了定量下限(lloq)。
67.图5b是示出了用表达构建体(变体#4)处理的指定动物组或对照动物中血浆、脾脏、肝脏、心脏和肾脏中的gb3水平的图表。对于每个组织,从左到右的条形示出了接受配制缓冲液的第1组动物,接受2.0e+12vg/kg剂量的构建体的第2组(10只动物);接受5.0e+12vg/kg剂量的构建体的第3组(9只动物);以及接受5.0e+13vg/kg剂量的构建体的第4组(20只动物)。如图所示,在测试的所有组织中,与对照组1相比,第2组至第4组中的gb3底物浓度较低。虚线还示出了定量下限(lloq)。
68.图6a是示出了用变体#4表达构建体处理的指定动物组或对照动物中血浆、脾脏、肝脏、心脏和肾脏中残余的gb3和lyso
‑
gb3底物的百分比的图表。
69.图6b是示出了用变体#4表达构建体处理的指定动物组或对照动物中血浆、脾脏、肝脏、心脏和肾脏中残余的gb3和lyso
‑
gb3底物的百分比的图表。
70.图7a是示出了用cdna变体#4构建体或cdna变体#21构建体(如图1a和图1b所示)处理的人hepg2细胞上清液中的体外α
‑
gal a活性的图表。与使用构建体变体#4作为表达构建体时的活性相比,使用包含wpre序列的表达构建体(如图1b中描绘的构建体变体#21),以300,000aav vg/个细胞处理的细胞中转基因活性增加至少约9倍。与使用构建体变体#4作为表达构建体时的活性相比,使用包含wpre序列的表达构建体(如图1b中描绘的变体#21),以100,000aav vg/个细胞处理的细胞中转基因活性增加至少约7倍。
71.图7b是示出了用cdna变体#4构建体或cdna变体#21构建体(如图1a和图1b所示)处理的诱导多能肝细胞(“icell肝细胞”)上清液中的体外α
‑
gal a活性的图表。与使用变体#4作为表达构建体时的活性相比,使用包含wpre序列的表达构建体(如图1b中描绘的变体#21),以30,000aav vg/个细胞处理的细胞中转基因活性增加至少约4倍。与使用变体#4作为表达构建体时的活性相比,使用包含wpre序列的表达构建体(如图1b中描绘的变体#21),以100,000aav vg/个细胞处理的细胞中转基因活性增加至少约3倍。
72.图8是示出了在用2.0e+12vg/kg或5e+11vg/kg剂量的变体#21构建体或用2.0e+12vg/kg或5e+11vg/kg剂量的变体#4构建体或用配制缓冲液处理的野生型小鼠血浆中随构建体剂量增加而增加的gla a活性的图表。
73.图9是描绘c57bl/6小鼠在用5.0e+13vg/kg剂量的变体#21构建体,5.0e+12vg/kg剂量的变体#21构建体,5.0e+13vg/kg剂量的变体#4构建体,5.0e+12vg/kg剂量的变体#4构建体,或配制缓冲液处理后29天内的α
‑
gal a血浆活性的图表。如图所示,变体#21构建体可以在c57bl/6小鼠中产生超过生理正常值1,500倍的血浆α
‑
gal a活性水平。
74.图10是用5.0e+13vg/kg剂量的变体#4构建体处理的glako小鼠肝脏样品中针对aav载体基因组染色的原位dna杂交图像。靶向非编码序列。在该样品中,57.5%的肝脏细胞在处理后90天针对aav载体基因组染色呈阳性。
75.图11是用6.0e+13vg/kg剂量的变体#4构建体处理的野生型非人灵长类动物(nph)的肝脏样品中针对aav载体基因组染色的原位dna杂交图像。靶向非编码序列。在该样品中,57.5%的肝脏细胞在处理后60天针对aav载体基因组染色呈阳性。
76.图12a是示出了用2e+12vg/kg、5e+12vg/kg、5e+13vg/kg剂量的变体#4构建体或用作为对照的配制缓冲液处理的glako小鼠中含有hgla cdna的肝细胞的百分比的图表。
77.图12b是示出了用6e+12vg/kg、1e+13vg/kg、3e+13vg/kg、6e+13vg/kg剂量的变体#4构建体或用作为对照的配制缓冲液处理的食蟹猴nhp中含有hgla cdna的肝细胞的百分比
的图表。
78.图12c是示出了用2e+12vg/kg、5e+12vg/kg、5e+13vg/kg剂量的变体#4构建体或用作为对照的配制缓冲液(“0”)处理的单个glako小鼠中含有hgla cdna的肝脏细胞的百分比的图表。
79.图12d是示出了用6e+12vg/kg、1e+13vg/kg、3e+13vg/kg、6e+13vg/kg剂量的变体#4构建体或用作为对照的配制缓冲液(“0”)处理的单个食蟹猴nhp中含有hgla cdna的肝细胞的百分比的图表。
80.图13a和图13b是示出了用6.0e+12vg/kg剂量的变体#4构建体或用配制缓冲液处理的单独动物的nhp血浆hgla活性对比蛋白质浓度的图表。
81.图13c和图13d是示出了用1.0e+13vg/kg或3.0e+13vg/kg剂量的变体#4构建体处理的单独动物的nhp血浆hgla活性对比蛋白质浓度的图表。
82.图13e和图13f是示出了用6.0e+13vg/kg或6.0e+13vg/kg剂量的不含免疫抑制剂的变体#4构建体处理的单独动物的nhp血浆hgla活性对比蛋白质浓度的图表。
83.图14是用6.0e+12vg/kg、1.0e+13vg/kg、3.0e+13vg/kg、6.0e+13vg/kg、6.0e+13vg/kg剂量的不含免疫抑制剂的变体#4构建体或用配制缓冲液处理后第60天,来自单独动物的nhp肝脏样品中的hgla和相应mrna水平的蛋白质印迹(western blot)分析。如图所示,在大多数样品中,hgla蛋白质水平随构建体剂量增加而蛋白质水平与mrna水平相关。
具体实施方式
84.本文公开了用于治疗或预防法布里病的方法和组合物。说明书提供了用于引入编码在患有法布里病的受试者中缺乏或表达不足的蛋白质的gla转基因,使得该基因在肝脏中表达并且表达治疗性(替代)蛋白质的方法和组合物。说明书还描述了细胞(例如,前体或成熟rbc、ipsc或肝脏细胞)的改变,使其产生高水平的治疗剂,并且将这些改变的细胞群引入患者中将提供需要的蛋白质。转基因可编码在有需要的患者中治疗有益的期望蛋白质或结构rna。
85.用腺相关病毒(aav)载体的基因治疗在临床前和临床试验中都显示出有效地将治疗性转基因输送到肝脏的巨大前景,有报道称b型血友病的转基因表达水平稳定长达六年(lheriteau e,davidoff e,nathwani ac.haemophilia gene therapy:progress and challenges.blood rev.2015年9月;29(5):321
‑
8)。
86.一个特别有前景的领域是能够将转基因添加到细胞中,使该细胞表达先前没有在该细胞中产生或产生未达最佳的产物。该技术的使用实例包括插入编码治疗性蛋白质的基因、插入编码在细胞或个体中由于某种原因缺乏的蛋白质的编码序列以及插入编码结构核酸诸如微小rna的序列。
87.可以以多种方式将转基因引入并保持在细胞中。按照“cdna”方法,将转基因引入细胞中,使得转基因保持在染色体外而未整合到细胞的染色质中。转基因可以保持在环状载体(例如质粒或非整合病毒载体,诸如aav或慢病毒)上,其中载体可以包括转录调控序列,诸如启动子、增强子、聚a信号序列、内含子和剪接信号(美国专利号10,143,760)。
88.转基因可以以多种方式递送到细胞中,使得转基因整合到细胞自身的基因组中并保持在那里。近年来,已经开发了一种转基因整合策略,该策略使用位点特异性核酸酶的裂
解来靶向插入到选定的基因组基因座中(参见,例如,共同拥有的美国专利7,888,121)。核酸酶(诸如锌指核酸酶(zfn))、转录激活因子样效应核酸酶(talen)或核酸酶系统(诸如rna导向的crispr/cas系统)(利用工程化向导rna),对靶向的基因具有特异性并且可以加以利用,使得转基因构建体通过同源定向修复(hdr)或在非同源末端连接(nhej)驱动过程中通过末端捕获而插入。参见,例如,美国专利号9,877,988;9,816,074;9,616,090;9,873,894;9,597,357;9,567,573;9,458,205;9,447,434;9,394,545;9,255,250;9,222,105;9,206,404;9,200,266;9,045,763;9,005,973;9,150,847;8,956,828;8,945,868;8,895,264;8,771,985;8,703,489;8,586,526;8,106,255;6,534,261;6,599,692;6,503,717;6,689,558;7,067,317;7,262,054;7,888,121;7,972,854;7,914,796;7,951,925;8,110,379;8,409,861;美国专利公开20030232410和20050064474,其公开内容通过引用整体并入。
89.转基因可以整合到高度表达的安全港位置,诸如白蛋白基因(参见美国专利号9,394,545)。已将这种方法称为体内蛋白质替代平台或ivprp。按照这种方法,经由核酸酶介导的靶向插入将转基因插入到安全港(例如,白蛋白)基因中,其中转基因的表达由白蛋白启动子驱动。将转基因工程改造成包含信号序列以帮助由转基因编码的蛋白质的分泌/排泄。
[0090]“安全港”基因座包括诸如人细胞中的aavs1、hprt、白蛋白和ccr5基因以及鼠类细胞中的rosa26等基因座。参见,例如,美国专利号9,877,988;9,567,573;9,447,434;9,394,545;9,222,105;9,206,404;9,150,847;8,895,264;8,771,985;8,106,255;7,888,121;7,972,854;7,914,796;7,951,925;8,110,379;8,409,861;和8,586,526;美国专利公开20030232410和20060063231。与依赖转基因随机整合的经典整合方法相比,核酸酶介导的整合提供了改进转基因表达、提高安全性和表达持久性的前景,因为它允许精确的转基因定位,将基因沉默或附近致癌基因活化的风险降至最低。美国公开号20180117181中描述了核酸酶介导的编码治疗性法布里蛋白的基因的转基因插入。
[0091]
虽然将转基因递送到靶细胞是完全制定这项技术必须克服的一个障碍,但另一个必须攻克的问题是确保在转基因插入细胞并表达后,这样编码的基因产物必须到达生物体的必要位置,并制成足够的局部浓度才能有效。对于以缺乏蛋白质或存在异常的非功能性蛋白质为特征的疾病,递送转基因编码的野生型蛋白质可能非常有帮助。
[0092]
溶酶体贮积病(lsd)是一类罕见的代谢单基因疾病,其特征在于缺乏通常牵涉废弃脂质、糖蛋白和粘多糖的分解的功能性单独溶酶体蛋白。这些疾病的特征在于这些化合物在细胞中的累积,因为由于特定酶的功能失常,无法将它们加工再利用。最常见的实例是高歇氏病(gaucher’s disease)(葡糖脑苷脂酶缺乏症
‑
基因名称:gba)、法布里病(α半乳糖苷酶a缺乏症
‑
gla)、亨特氏病(hunter’s disease)(艾杜糖醛酸
‑2‑
硫酸酯酶缺乏症
‑
ids)、赫尔勒氏病(hurler’s disease)(α
‑
l艾杜糖醛酸酶缺乏症
‑
idua)、庞贝氏病(pompe’s disease)(α
‑
葡萄糖苷酶(gaa))和尼曼匹克病(niemann
‑
pick’s disease)(鞘磷脂磷酸二酯酶1缺乏症
‑
smpd1)。将所有组合在一起时,lsd在人口中的发病率约为7000名新生儿中有1例。另请参见,美国专利号9,877,988和9,956,247以及美国公开号20160060656。
[0093]
例如,法布里病是一种由α
‑
半乳糖苷酶a酶(α
‑
gala)缺乏引起的鞘糖脂代谢的x连锁病症。它与包括球三糖神经酰胺(也称为gl
‑
3和gb3)和球三糖神经鞘氨醇(lyso
‑
gb3)、半乳糖苷神经酰胺和b族物质在内的鞘糖脂的进行性沉积相关。该疾病的症状多种多样并且
可包括灼烧、刺痛(肢端感觉异常)或剧烈疼痛发作,剧烈疼痛发作称为“法布里危机”,可持续数分钟到数天。其它症状包括出汗受损、运动耐力低、红紫色皮疹(称为血管角质瘤)、眼睛异常、胃肠道问题、心脏问题(诸如心脏肥大和心脏病发作)、肾脏问题(可导致肾衰竭)和cns问题以及一般情况。法布里病患者的预期寿命大大缩短。
[0094]
目前对法布里病的治疗可涉及酶替代疗法(ert),使用两种不同的人α
‑
gala制剂,即半乳糖苷酶β或半乳糖苷酶α,对于患者而言这需要昂贵且耗时的输注(通常在约0.2
‑
1mg/kg之间),每两周一次。此类治疗治疗仅仅是为了治疗症状而不是治愈性的。因此,必须在患者的余生中给予他们这些蛋白质的重复给药,并且潜在地可能产生针对所注射的蛋白质的中和抗体。
[0095]
此外,不良反应与ert相关,包括免疫反应,诸如在用α
‑
gala制剂治疗的受试者中产生抗α
‑
gala抗体。事实上,50%用半乳糖苷酶α治疗的雄性和88%用半乳糖苷酶β治疗的雄性产生了α
‑
gala抗体。重要的是,那些抗体中有很大一部分是中和抗体,因此会降低治疗的治疗效果(meghdari等人(2015)plos one 10(2):e0118341.doi:10.1371/journal.pone.0118341)。另外,ert并不能阻止所有患者的疾病进展。
[0096]
因此,所述方法和组合物可用于从转基因中,例如通过病毒载体递送的或插入到任何基因座(例如,高度表达的白蛋白基因座)中的cdna构建体表达一种或多种治疗有益的α
‑
gala蛋白来替代法布里病中有缺陷和/或缺乏的酶。另外,本说明书提供了通过将转基因序列插入细胞(诸如肝细胞)中高度表达的基因座中来治疗法布里病(包括减轻法布里病的一种或多种症状)的方法和组合物。本公开中包括用于经由病毒载体将编码α
‑
gala的转基因递送至有需要的受试者的肝脏的方法和组合物,其中可以经由注射到外周静脉系统中或经由直接注射到肝定向血管(例如,门静脉)中来引入病毒。所述方法和组合物可用于诱导转基因插入安全港基因座(例如白蛋白)或者可用于在肝细胞中引起病毒cdna构建体的染色体外维持。在任何一种情况下,转基因都高度表达并为有需要的法布里病患者提供治疗益处。
[0097]
另外,可以将转基因引入患者来源的细胞,例如患者来源的诱导多能干细胞(ipsc)或其它类型的干细胞(胚胎或造血干细胞)中用于最终植入。特别有用的是将治疗性转基因插入造血干细胞中以植入有需要的患者体内。随着干细胞分化为成熟细胞,它们将含有高水平的治疗性蛋白质以递送到组织。
[0098]
总则
[0099]
除非另有说明,否则本文公开的方法的实践以及本文公开的组合物的制备和使用采用本领域技术范围内的分子生物学、生物化学、染色质结构和分析、计算化学、细胞培养、重组dna和相关领域中的常规技术。这些技术在文献中有充分的解释。参见,例如,sambrook等人molecular cloning:a laboratory manual,第2版,cold spring harbor laboratory press,1989和第3版,2001;ausubel等人,current protocols in molecular biology,john wiley&sons,new york,1987和定期更新;系列methods in enzymology,academic press,san diego;wolffe,chromatin structure and function,第3版,academic press,san diego,1998;methods in enzymology,vol.304,“chromatin”(p.m.wassarman和a.p.wolffe编辑),academic press,san diego,1999;以及methods in molecular biology,第119卷,“chromatin protocols”(p.b.becker编辑)humana press,totowa,
98/53060;wo 02/016536和wo 03/016496。
[0108]“选择的”锌指蛋白或tale是一种未在自然界中发现的蛋白质,其产生主要来自经验过程,诸如噬菌体展示、相互作用陷阱或杂交选择。参见例如,专利号8,586,526;5,789,538;us 5,925,523;us 6,007,988;us 6,013,453;us 6,200,759;wo 95/19431;wo 96/06166;wo 98/53057;wo 98/54311;wo 00/27878;wo 01/60970;wo 01/88197;wo 02/099084。
[0109]“重组”是指两个多核苷酸之间遗传信息交换的过程。出于本公开的目的,“同源重组(hr)”是指例如在经由同源定向修复机制修复细胞中的双链断裂期间发生的此类交换的特殊形式。该过程需要核苷酸序列同源性,使用“供体”分子以成为“靶”分子(即,经历双链断裂的分子)的修复模板,并且不同地称为“非交换型基因转换”或“短道基因转换”,因为它导致遗传信息从供体向靶标转移。不希望受任何特定理论的束缚,此类转移可涉及在断裂的靶标与供体之间形成的异源双链体dna的错配矫正,和/或其中供体用于重新合成将成为靶标的一部分的遗传信息的“合成依赖链退火”,和/或相关过程。这种专化hr常常导致靶分子序列的改变,使得供体多核苷酸的一部分或全部序列并入到靶多核苷酸中。
[0110]
在本公开的方法中,如本文所述的一种或多种靶向核酸酶在靶序列(例如,细胞染色质)的预定位点产生双链断裂,并且与断裂区域中的核苷酸序列具有同源性的“供体”多核苷酸可以引入到细胞中。已证实双链断裂的存在有助于供体序列的整合。供体序列可以物理整合,或可替代地,供体多核苷酸用作经由同源重组修复断裂的模板,导致将供体中的全部或部分核苷酸序列引入到细胞染色质中。因此,细胞染色质中的第一序列可以被改变,并且在某些实施方案中,可以被转化为供体多核苷酸中存在的序列。因此,术语“替代(replace)”或“替代(replacement)”的使用可以理解为表示一个核苷酸序列被另一个核苷酸序列替代,(即,信息意义上的序列替代),而不一定需要一个多核苷酸被另一个多核苷酸物理或化学替代。
[0111]
在本文所述的任何方法中,另外的锌指或talen蛋白对可用于细胞内另外的靶位点的另外双链裂解。
[0112]
在用于细胞染色质中目标区域中的序列的靶向重组和/或替代和/或改变的方法的某些实施方案中,通过与外源“供体”核苷酸序列的同源重组来改变染色体序列。如果存在与断裂区域同源的序列,则细胞染色质中存在双链断裂会刺激此类同源重组。
[0113]
在本文所述的任何方法中,第一核苷酸序列(“供体序列”)可以含有与目标区域中的基因组序列同源但不相同的序列,从而刺激同源重组以在目标区域中插入不相同的序列。因此,在某些实施方案中,供体序列与目标区域中的序列同源的部分与被替代的基因组序列表现出约80%至99%(或介于之间的任何整数)的序列同一性。在其它实施方案中,供体与基因组序列之间的同源性高于99%,例如供体与超过100个连续碱基对的基因组序列之间仅有1个核苷酸不同。在某些情况下,供体序列的非同源部分可以含有目标区域中不存在的序列,以便将新序列引入目标区域中。在这些情况下,非同源序列的侧翼通常是50
‑
1,000个碱基对(或介于之间的任何整数值)或大于1,000的任意数目的碱基对的序列,这些序列与目标区域中的序列同源或相同。在其它实施方案中,供体序列与第一序列非同源并且通过非同源重组机制插入基因组中。
[0114]
本文所述的任何方法均可用于通过靶向整合破坏一个或多个目标基因的表达的
供体序列而部分或完全灭活细胞中的一个或多个靶序列。还提供了具有部分或完全灭活的基因的细胞系。
[0115]
此外,如本文所述的靶向整合方法也可用于整合一个或多个外源序列。外源核酸序列可以包含例如一个或多个基因或cdna分子,或任何类型的编码或非编码序列,以及一个或多个控制元件(例如,启动子)。另外,外源核酸序列可以产生一种或多种rna分子(例如,小发夹rna(shrna)、抑制性rna(rnais)、微小rna(mirna)等)。
[0116]“裂解”是指dna分子共价骨架的断裂。可通过各种各样的方法来开始裂解,所述方法包括但不限于磷酸二酯键的酶水解或化学水解。单链裂解和双链裂解均是可能的,并且双链裂解可由于两个相异单链裂解事件而发生。dna裂解可导致平端或交错端产生。在某些实施方案中,融合多肽用于靶向双链dna裂解。
[0117]“裂解半结构域”是连同第二多肽(相同或不同)一起形成具有裂解活性(优选双链裂解活性)的复合物的多肽序列。术语“第一和第二裂解半结构域”;“+和
‑
裂解半结构域”和“左右裂解半结构域”可互换使用,是指二聚化的裂解半结构域对。
[0118]“工程化裂解半结构域”是已经修饰以便与另一个裂解半结构域(例如,另一个工程化裂解半结构域)形成专性异源二聚体的裂解半结构域。参见,通过引用整体并入本文的美国专利号7,888,121;7,914,796;8,034,598和8,823,618。
[0119]
术语“序列”是指任何长度的核苷酸序列,可以是dna或rna;可以是线性的、环状的或分支的,并且可以是单链的或双链的。术语“供体序列”是指插入基因组中的核苷酸序列。供体序列可以是任何长度,例如长度介于2至10,000个核苷酸之间(或介于之间或以上的任何整数值),优选长度介于约100至1,000个核苷酸之间(或介于之间的任何整数),更优选长度介于约200至500个核苷酸之间。
[0120]“疾病相关基因”是在单基因疾病中以某种方式存在缺陷的基因。单基因疾病的非限制性实例包括严重联合免疫缺陷病、囊性纤维化、血友病、溶酶体贮积病(例如高歇氏病、赫尔勒氏病、法布里病、尼曼匹克病、戴萨克斯病(tay
‑
sach’s disease)等)、镰状细胞性贫血和地中海贫血。
[0121]“染色质”是包含细胞基因组的核蛋白结构。细胞染色质包含核酸(主要是dna)和蛋白质(包括组蛋白和非组蛋白染色体蛋白)。大多数真核细胞染色质以核小体的形式存在,其中核小体核包含大约150个与八聚体缔合的dna碱基对,八聚体包含组蛋白h2a、h2b、h3和h4中的每一种各两个;并且接头dna(长度可变,取决于生物体)在核小体核之间延伸。组蛋白h1分子通常与接头dna缔合。出于本公开的目的,术语“染色质”意在涵盖所有类型的细胞核蛋白,原核和真核细胞核蛋白。细胞染色质包括染色体染色质和游离染色质两种。
[0122]“染色体”是包含细胞的全部或部分基因组的染色质复合物。细胞的基因组常常以其核型为特征,核型是构成细胞基因组的所有染色体的集合。细胞的基因组可以包含一条或多条染色体。
[0123]“游离体”是复制核酸、核蛋白复合物或包含不属于细胞染色体核型的一部分的核酸的其它结构。游离体的实例包括质粒和某些病毒基因组。
[0124]“靶位点”或“靶序列”是定义结合分子将结合的核酸部分的核酸序列,前提是存在足够的结合条件。
[0125]“外源”分子是通常不存在于细胞中但可以通过一种或多种遗传方法、生物化学方
法或其它方法引入细胞中的分子。“细胞中的正常存在”是相对于细胞的特定发育阶段和环境条件确定的。因此,例如,仅在肌肉胚胎发育期间存在的分子相对于成体肌肉细胞是外源分子。类似地,热休克诱导的分子相对于非热休克细胞是外源性分子。外源分子可包括例如功能异常的内源分子的功能型式或功能正常的内源分子的功能异常型式。
[0126]
除其它外,外源分子可以是小分子,诸如通过组合化学方法生成的小分子,或大分子,诸如蛋白质、核酸、碳水化合物、脂质、糖蛋白、脂蛋白、多糖,上述分子的任何修饰衍生物,或包含一种或多种上述分子的任何复合物。核酸包括dna和rna,可以是单链的或双链的;可以是线性的、分支的或环状的;并且可以是任意长度。核酸包括那些能够形成双链体的核酸,以及形成三链体的核酸。参见,例如,美国专利号5,176,996和5,422,251。蛋白质包括但不限于dna结合蛋白、转录因子、染色质重塑因子、甲基化dna结合蛋白、聚合酶、甲基化酶、去甲基化酶、乙酰化酶、去乙酰化酶、激酶、磷酸酶、整合酶、重组酶、连接酶、拓扑异构酶、促旋酶和解旋酶。
[0127]
外源分子可以是与内源分子相同类型的分子,例如,外源蛋白质或核酸。例如,外源核酸可包含感染性病毒基因组、引入细胞中的质粒或游离体或通常不存在于细胞中的染色体。将外源分子引入细胞中的方法是本领域技术人员已知的并且包括但不限于脂质介导的转移(即脂质体,包括中性脂质和阳离子脂质)、电穿孔、直接注射、细胞融合、粒子轰击、磷酸钙共沉淀、deae
‑
葡聚糖介导的转移和病毒载体介导的转移。外源分子也可以是与内源分子相同类型的分子,但源自与该细胞所源自的不同物种。例如,可以将人核酸序列引入最初源自小鼠或仓鼠的细胞系中。
[0128]
相比之下,“内源”分子是在特定环境条件下在特定发育阶段通常存在于特定细胞中的分子。例如,内源核酸可包括染色体,线粒体、叶绿体或其它细胞器的基因组,或天然存在的游离核酸。另外的内源分子可包括蛋白质,例如转录因子和酶。
[0129]“融合”分子是其中两个或更多个亚单位分子优选共价连接的分子。亚单位分子可以是相同化学类型的分子或者可以是不同化学类型的分子。第一类融合分子的实例包括但不限于融合蛋白(例如,zfp或tale dna结合结构域与一个或多个活化结构域之间的融合体)和融合核酸(例如,编码上文描述的融合蛋白的核酸)。第二类融合分子的实例包括但不限于形成三链体的核酸与多肽之间的融合体,以及小沟结合物与核酸之间的融合体。
[0130]
融合蛋白在细胞中的表达可以通过将融合蛋白递送至细胞或通过将编码融合蛋白的多核苷酸递送至细胞而引起,其中多核苷酸被转录,并且转录产物被翻译,以生成融合蛋白。反式剪接、多肽裂解和多肽连接也可牵涉细胞中的蛋白质表达。用于将多核苷酸和多肽递送至细胞的方法在本公开的别处呈现。
[0131]
处于本公开的目的,“基因”包括编码基因产物的dna区域(参见下文),以及调控基因产物的产生的所有dna区域,而不论此类调控序列是否与编码序列和/或转录序列相邻。因此,基因包括但不一定限于,启动子序列、终止子、翻译调控序列诸如核糖体结合位点和内部核糖体进入位点、增强子、沉默子、绝缘子、边界元件、复制起点、基质附着位点以及基因座控制区。
[0132]“基因表达”是指将基因中所含的信息转换为基因产物。基因产物可以是基因的直接转录产物(例如mrna、trna、rrna、反义rna、核酶、结构rna或任何其它类型的rna)或通过mrna翻译产生的蛋白质。基因产物还包括通过诸如加帽、聚腺苷酸化、甲基化和编辑等过程
修饰的rna,以及通过例如甲基化、乙酰化、磷酸化、泛素化、adp
‑
核糖基化、肉豆蔻化和糖基化修饰的蛋白质。
[0133]“gla基因”编码a
‑
半乳糖苷酶,这是一种分解球三糖神经酰胺的酶。gla基因的遗传突变导致a
‑
半乳糖苷酶的酶功能缺陷。gla基因位于xq22.1处,它是x染色体第22.1位的长(q)臂。gla基因也可称为agal_human、半乳糖苷酶α、α
‑
d
‑
半乳糖苷酶a、α
‑
d
‑
半乳糖苷酶、半乳糖水解酶、α
‑
半乳糖苷酶、α
‑
半乳糖苷酶a、神经酰胺三己糖苷酶、gala、半乳糖苷酶、α或melilibase。
[0134]
基因表达的“调节”是指基因活性的变化。表达的调节可包括但不限于基因活化、基因优化和基因阻遏。基因组编辑(例如,裂解、改变、灭活、随机突变)可用于调节表达。基因灭活是指与不包括如本文所述的zfp、tale或crispr/cas系统的细胞相比,基因表达的任何减少。因此,基因灭活可能是部分的或完全的。
[0135]“目标区域”是细胞染色质的任何区域,例如基因或基因内的或基因相邻的非编码序列,其中期望结合外源分子。结合可以用于靶向dna裂解和/或靶向重组的目的。例如,目标区域可以存在于染色体、游离体、细胞器基因组(例如,线粒体、叶绿体)或感染性病毒基因组中。目标区域可以处于基因的编码区域内,处于转录的非编码区域,诸如前导序列、尾端序列或内含子内,或处于非转录区域内,在编码区域的上游或下游。目标区域的长度可以小到单个核苷酸对或长达2,000个核苷酸对,或任何整数值的核苷酸对。
[0136]“真核”细胞包括但不限于真菌细胞(诸如酵母)、植物细胞、动物细胞、哺乳动物细胞和人细胞(例如,肝细胞、肌肉细胞、rbc、t细胞等),包括干细胞(多能(pluripotent)干细胞和多潜能(multipotent)干细胞)。
[0137]“红血球”(rbc)或红细胞是源自造血干细胞的终末分化细胞。它们缺少核酸酶和大多数细胞器。rbc含有血红蛋白,将氧气从肺部运载到外周组织。事实上,单独rbc中的33%是血红蛋白。它们还将细胞在新陈代谢过程中产生的co2运载出组织,并在呼气时运载回肺部释放。rbc是在骨髓中响应于肾脏释放促红细胞生成素(epo)介导的血液性缺氧而产生的。epo导致原成红细胞的数目增加并缩短rbc完全成熟所需的时间。大约120天后,由于rbc不含细胞核或任何其它再生能力,因此所述细胞通过肝脏、脾脏和淋巴结中巨噬细胞的吞噬活性从循环中去除(~90%)或通过血浆中的溶血从循环中去除(~10%)。巨噬细胞吞噬后,rbc的化学组分在巨噬细胞的液泡内由于溶酶体酶的作用被分解。体外或体内的rbc可以起源于如本文所述的基因修饰的干细胞或rbc前体细胞。
[0138]“分泌组织”是动物体内将产物从单个细胞分泌到通常源自上皮的某一类型的管腔中的那些组织。定位至胃肠道的分泌组织的实例包括排列在肠道、胰腺和胆囊上的细胞。其它分泌组织包括肝脏、与眼睛相关的组织和粘膜,诸如唾液腺、乳腺、前列腺、垂体腺和内分泌系统的其它成员。另外,分泌组织包括能够分泌的组织类型的单个细胞。
[0139]
术语“操作性连接(operative linkage)”和“操作性地连接(operatively linked)”(或“可操作地连接(operably linked)”)可互换使用,指两个或更多个组件(诸如序列元件)的并列,其中组件排列成使得两个组件都正常发挥作用并且允许至少一个组件可以调节施加在其它组件中的至少一个上的功能的可能性。举例来说,如果转录调控序列响应于一种或多种转录调控因子的存在或不存在而控制编码序列的转录水平,则转录调控序列诸如启动子与编码序列操作性地连接。转录调控序列通常与编码序列顺式操作性地连
接,但不必与编码序列直接相邻。例如,增强子是与编码序列操作性地连接的转录调控序列,即使它们不是连续的。
[0140]
关于融合多肽,术语“操作性地连接”可以指这样的事实,即每个组件在与其它组件连接时执行如同它没有如此连接时相同的功能。例如,对于其中zfp、tale或cas dna结合结构域与活化结构域融合的融合多肽,如果在融合多肽中,zfp或tale dna结合结构域部分能够结合其靶位点和/或其结合位点,同时活化结构域能够上调基因表达,则zfp或tale dna结合结构域和活化结构域处于操作性连接。对于其中zfp或tale dna结合结构域与裂解结构域融合的融合多肽,如果在融合多肽中,zfp或tale dna结合结构域部分能够结合其靶位点和/或其结合位点,同时裂解结构域能够裂解在靶位点附近的dna,则zfp或tale dna结合结构域和裂解结构域处于操作性连接。
[0141]
蛋白质、多肽或核酸的“功能片段”是其序列与全长蛋白质、多肽或核酸不同但保留与全长蛋白质、多肽或核酸相同功能的蛋白质、多肽或核酸。功能片段可具有比相应天然分子更多、更少或相同数目的残基,和/或可含有一个或多个氨基酸或核苷酸取代。用于确定核酸功能(例如,编码功能,与另一种核酸杂交的能力)的方法是本领域众所周知的。类似地,用于确定蛋白质功能的方法也是众所周知的。例如,多肽的dna结合功能可以例如通过过滤结合、电泳迁移率改变或免疫沉淀测定法来确定。dna裂解可通过凝胶电泳测定。参见ausubel等人,同上。蛋白质与另一种蛋白质相互作用的能力可以例如通过遗传学和生物化学的共免疫沉淀、双杂交测定法或互补来确定。参见,例如,fields等人(1989)nature 340:245
‑
246;美国专利号5,585,245和国际专利公开号wo 98/44350。
[0142]“载体”能够将基因序列转移到靶细胞。通常,“载体构建体”、“表达载体”、“基因转移载体”和“表达构建体”意指能够引导目标基因的表达并且抗原将基因序列转移到靶细胞的任何核酸构建体。因此,该术语包括克隆和表达媒介物,以及整合载体。
[0143]“报告基因”或“报告序列”是指产生优选但不一定在常规测定法中易于测量的蛋白质产物的任何序列。合适的报告基因包括但不限于编码介导抗生素抗性(例如,氨苄青霉素抗性、新霉素抗性、g418抗性、嘌呤霉素抗性)的蛋白质的序列,编码有色或荧光或发光蛋白(例如,绿色荧光蛋白、增强型绿色荧光蛋白、红色荧光蛋白、荧光素酶)和介导增强的细胞生长和/或基因扩增的蛋白质(例如,二氢叶酸还原酶)的序列。表位标签包括例如flag、his、myc、tap、ha或任何可检测的氨基酸序列的一个或多个拷贝。“表达标签”包括编码报告因子的序列,其可以与期望的基因序列可操作地连接以便监测目标基因的表达。
[0144]
术语“受试者”和“患者”可互换使用并且是指哺乳动物(诸如人患者和非人灵长类以及诸如兔、狗、猫、大鼠、小鼠的实验动物)和其它动物。因此,如本文所用,术语“受试者”或“患者”意指可向其施用本文所述的改变的细胞和/或由本文所述的改变的细胞产生的蛋白质的任何哺乳动物患者或受试者。本公开的主题包括具有lsd的那些。
[0145]
本文公开了用于治疗和/或预防法布里病的方法和组合物。本公开描述了将转基因序列插入合适的靶细胞(例如,来自患有法布里病的受试者的细胞)中的方法,其中转基因编码治疗所述疾病的至少一种蛋白质(例如,至少一种α
‑
gala蛋白质)。所述方法可以是体内的(将转基因序列递送至活受试者的细胞)或离体的(将修饰的细胞递送至活受试者)。本公开还描述了用表达系统转染和/或转导合适的靶细胞的方法,使得编码α
‑
gala的转基因表达治疗所述疾病(例如,减轻与所述疾病相关的一种或多种症状)的蛋白质。α
‑
gala蛋
白可以从靶细胞中排泄(分泌),使其能够影响未携带转基因的其它细胞或被所述其它细胞吸收(交叉矫正)。本公开还提供了用于产生细胞(例如,成熟细胞或未分化细胞)的方法,所述细胞产生高水平的α
‑
gala,其中将这些改变的细胞群引入患者中将会提供所需要的蛋白质以治疗疾病或病症。另外,提供了用于产生细胞(例如成熟细胞或未分化细胞)的方法,所述细胞产生高活性形式(治疗性)的α
‑
gala,其中在患者中引入或产生这些改变的细胞群将提供所需要的蛋白质活性以治疗法布里病(例如,减少或消除一种或多种症状)。如本文所述产生的高活性形式的α
‑
gala也可以从如本文所述的细胞中分离并使用技术人员已知的标准酶替代程序施用于有需要的患者。
[0146]
本文描述了用于表达至少一种α半乳糖苷酶a(α
‑
gal a)蛋白的方法和组合物。所述组合物和方法可用于体外、体内或离体,并且包括向所述细胞施用编码至少一种α
‑
gal a蛋白的gla转基因(例如,具有野生型或密码子优化的gla序列的cdna),使得α
‑
gal a蛋白在所述细胞中表达。在某些实施方案中,所述细胞在患有法布里病的受试者中。在本文所述的任何方法中,可将转基因施用于受试者的肝脏。任选地,所述方法还包括施用一种或多种裂解受试者肝脏细胞中的内源性白蛋白基因的核酸酶,使得所述转基因整合到所述白蛋白基因中并由所述白蛋白基因表达。在本文所述的任何方法中,与未治疗的受试者或用配制缓冲液或其它载剂治疗的受试者相比,由转基因表达的α
‑
gal a蛋白可以使受试者中的鞘糖脂的量减少至少约2倍。gla转基因还可包含附加元件,包括例如信号肽和/或一种或多种控制元件。在某些实施方案中,gla转基因(例如,cdna构建体)还包括野生型或工程化的wpre序列,例如zanta
‑
boussif等人(2009)gene therapy 16:605
‑
619和美国专利号10,179,918中描述的包含wpre mut6突变的突变wpre序列。在一些实施方案中,mut6突变是在j04514 wpre元件中产生的,而在其它实施方案中,它们是在j02442.1 wpre中产生的(ong等人(2017)doi.org/10.1101/126904)。在某些实施方案中,gla表达构建体包含如图1b所示的构建体(变体#21)。与不包括wpre序列的表达构建体相比,如本文所述的含wpre的表达构建体引起转基因表达和活性提高(例如,表达或活性增加1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更多倍)。在某些实施方案中,表达构建体是表1中所示的表达构建体。
[0147]
一方面,本公开描述了在受试者的细胞中表达编码一种或多种矫正gla转基因的转基因的方法。可以将转基因插入合适的靶细胞(例如,血细胞、肝脏细胞、脑细胞、干细胞、前体细胞等)的基因组中,使得由该矫正转基因编码的α
‑
gala产物稳定整合到细胞的基因组中(也称为“ivprp”方法)或者,可替代地,可以将转基因保持在细胞染色体外(也称为“cdna”方法)。在一个实施方案中,将矫正gla转基因(稳定地或在染色体外)引入细胞系的细胞中,用于体外产生替代蛋白,然后可以将(任选纯化和/或分离的)蛋白质施用给受试者以治疗患有法布里病的受试者(例如,通过减少和/或消除与法布里病相关的一种或多种症状)。在某些实施方案中,与未治疗的受试者相比,由该矫正转基因编码的α
‑
gala产物使受试者组织中的α
‑
gala活性增加任何量,例如增加约2至约2000倍(或介于之间的任何值),包括但不限于2至100倍(或介于之间的任何值,包括10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍)、100至500倍(或介于之间的任何值)、500至1000倍(或介于之间的任何值)或1000至2000倍或更多倍。
[0148]
另一方面,本文描述了治疗患有法布里病的受试者的离体或体内方法(例如,通过减少和/或消除与法布里病相关的一种或多种症状),所述方法包括将gla转基因插入到如
本文所述的细胞中(cdna和/或ivprp方法),使得在患有法布里病的受试者中产生所述蛋白质。在某些实施方案中,gla转基因是如表1所示的构建体的一部分。
[0149]
在某些实施方案中,包含gla转基因的分离的细胞可用于治疗有需要的患者,例如通过将所述细胞施用于患有法布里病的受试者。在其它实施方案中,将矫正gla转基因插入体内的靶组织,使得体内产生替代蛋白。在一些实施方案中,将矫正转基因插入到靶组织中细胞的基因组中,而在其它优选实施方案中,将矫正转基因插入到靶组织的细胞中并保持在细胞染色体外。在本文所述的任何方法中,表达的α
‑
gala蛋白可以从细胞中排泄以作用于次要靶标或被次要靶标吸收,包括被其它组织中缺少gla转基因的其它细胞(例如经由输出到血液中)吸收(交叉矫正)。在一些情况下,主要和/或次要靶组织是肝脏。在其它情况下,主要和/或次要靶组织是大脑。在其它情况下,主要和/或次要靶标是血液(例如,脉管系统)。在其它情况下,主要和/或次要靶标是骨骼肌。
[0150]
在某些实施方案中,本文所述的方法和组合物用于减少沉积在患有法布里病的受试者的组织中的鞘糖脂的量,所述鞘糖脂包括球三糖基神经酰胺(也称为gl
‑
3和gb3)和球三糖神经鞘氨醇(lyso
‑
gb3)、半乳糖苷神经酰胺。在某些实施方案中,与未治疗的受试者相比,由该矫正转基因编码的α
‑
gala产物使受试者组织中的鞘糖脂减少任何量,例如减少约2至约100倍(或介于之间的任何值),包括但不限于2至100倍(或介于之间的任何值,包括10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍)。在某些实施方案中,与未治疗的受试者相比,由该矫正转基因编码的α
‑
gala产物使受试者组织中的鞘糖脂减少任何量,例如至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或约100%。
[0151]
在本文所述的任何方法中,矫正gla转基因包含功能性gla基因的野生型序列,而在其它实施方案中,矫正gla转基因的序列以某种方式改变以给予增强的生物学活性(例如,优化密码子以增加生物学活性和/或改变转录和翻译调控序列以改善基因表达)。在一些实施方案中,修饰gla基因以改善表达特征。此类修饰可包括但不限于插入翻译起始位点(例如甲硫氨酸)、添加优化的kozak序列、插入信号肽和/或密码子优化。在一些实施方案中,所述信号肽可以选自白蛋白信号肽、f.ix信号肽、ids信号肽和/或α
‑
gala信号肽。
[0152]
在某些方面,供体是cdna供体。cdna供体通常包括增强子序列、启动子序列、内含子序列、信号肽、gla编码序列、聚腺苷酸化信号和任选地野生型或突变的wpre序列。图1a和图1b中示意性地示出了非限制性的示例性cdna供体。
[0153]
任何启动子、增强子、内含子、信号肽、gla编码序列或聚a序列和任选的wpre序列可以是可用于cdna构建体中的序列。在一些实施方案中,增强子和/或启动子具有肝脏特异性,例如由人apoe增强子和人α1
‑
抗胰蛋白酶(haat)启动子组成(miao ch等人(2000)mol.ther.1(6):522
‑
532(200))。在一些实施方案中,肝脏特异性启动子包含一个或多个apoe增强子序列(例如,1、2、3和/或4;参见okuyama等人(1996)hum gen ther 7(5):637
‑
45)。在一些实施方案中,启动子与内含子连接。在一些实施方案中,内含子是hbb
‑
igg嵌合内含子,其包含来自人β
‑
珠蛋白基因的第一内含子的5’供体位点和来自免疫球蛋白基因重链可变区的内含子的分支3’受体位点。在一些实施方案中,apoe/haat启动子在肝细胞、预期靶组织中具有特异性和高度活性,但在非肝脏细胞和组织类型中无活性;从而减少或阻止在非靶组织中的表达和活性。在某些实施方案中,信号肽包含gla信号肽并且聚腺苷酸化信号包含spa51或bgh聚a序列。任选的wpre序列可以是任何野生型或突变的wpre序列。参
见,例如,美国专利号10,179,918。在某些实施方案中,wpre序列包括突变的wpre,诸如mut6 wpre序列。
[0154]
本文所述的cdna表达载体可以经由任何合适的载体递送,所述合适的载体包括病毒载体,诸如任何血清型的aav(例如,aav2、aav6或aav2/6)。
[0155]
在某些实施方案中,表达序列(即,表达载体或表达构建体)包含图1b中描述的并且如下面表1中所示的变体#21的元件和序列。
[0156]
表1:变体#21的cdna元件和完整序列
[0157]
[0158]
[0159][0160]
表1的包含wpre序列的表达构建体可以很容易地以临床规模生产并且已证实会表现出与不包括wpre序列的表达构建体相比提高的gla活性,例如提高至少约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍、约10倍、约11倍、约12倍、约13倍、约14倍、约15倍、约16倍、约17倍、约18倍、约19倍、约20倍。
[0161]
另一方面,本文描述了一种核酸酶(例如,zfn、zfn对、talen、talen对和/或crispr/cas系统)表达载体,其包含与启动子可操作地连接的编码如本文所述的一种或多种核酸酶的多核苷酸。在一个实施方案中,表达载体是病毒载体。再一方面,本文描述了一种gla表达载体,其包含与启动子可操作地连接的编码如本文所述的α
‑
gala的多核苷酸。在一个实施方案中,表达是病毒载体。
[0162]
另一方面,本文描述了一种宿主细胞,其包含如本文所述的一种或多种核酸酶(例如,zfn、zfn对、talen、talen对和/或crispr/cas系统)表达载体和/或α
‑
gala表达载体。所述宿主细胞可以用一种或多种核酸酶表达载体稳定转化或瞬时转染或其组合。在一些实施方案中,所述宿主细胞是肝脏细胞。
[0163]
在其它实施方案中,提供了用如本文所述的治疗性gla转基因,例如使用如本文所述的核酸酶(例如,zfn、zfn对、talen、talen对和/或crispr/cas系统)(或编码所述核酸酶的一种或多种载体),以及在用核酸酶靶向裂解后插入基因中的“供体”序列或gla转基因替代任何靶基因中的基因组序列的方法。gla序列可以存在于携带核酸酶(或其组分)的载体中,存在于单独的载体(例如,ad、aav或lv载体或mrna)中,或者可替代地,可以使用不同的核酸递送机制将其引入细胞中。这样将供体核苷酸序列插入靶基因座(例如,高度表达的基因、疾病相关基因、其它安全港基因等)中导致gla转基因在靶基因座(例如,白蛋白、珠蛋白等)的内源遗传控制元件的控制下表达。在一些方面,将gla转基因例如插入靶基因(例如,白蛋白)中导致完好的α
‑
gala蛋白序列的表达并且缺少由靶标(例如,白蛋白)编码的任何氨基酸。在其它方面,表达的外源α
‑
gala蛋白是融合蛋白并且包含由gla转基因和由将gla转基因插入其中的内源基因座编码的氨基酸(例如,来自内源靶基因座,或者可替代地,来自转基因上编码靶基因座序列的序列)。靶标可以是任何基因,例如安全港基因诸如白蛋白
基因、aavs1基因、hprt基因;ccr5基因;或高度表达的基因,诸如rbc前体细胞中的珠蛋白基因(例如,β珠蛋白或γ珠蛋白)。在一些情况下,内源序列将存在于外源α
‑
gala蛋白的氨基(n)端部分,而在其它情况下,内源序列将存在于外源α
‑
gala蛋白的羧基(c)端部分。在其它情况下,内源序列将存在于α
‑
gala外源蛋白的n端和c端部分。在一些实施方案中,内源序列编码在α
‑
gala蛋白从细胞中分泌的过程中被去除的分泌信号肽。内源序列可以包括全长野生型或突变体内源序列,或者可替代地,可以包括部分内源氨基酸序列。在一些实施方案中,内源基因
‑
转基因融合体位于细胞内的内源基因座处,而在其它实施方案中,将内源序列
‑
转基因编码序列插入基因组内的另一基因座中(例如,gla
‑
转基因序列插入白蛋白、hprt或ccr5基因座中)。在一些实施方案中,使gla转基因表达,使得治疗性α
‑
gala蛋白产物保留在细胞(例如,前体细胞或成熟细胞)内。在其它实施方案中,gla转基因与膜蛋白的胞外结构域融合,使得在表达时,转基因α
‑
gala融合将导致治疗性蛋白的表面定位。在一些方面,经编辑的细胞还包含跨膜蛋白以将细胞运输至特定组织类型。一方面,跨膜蛋白包含抗体,而在其它方面,跨膜蛋白包含受体。在某些实施方案中,细胞是前体(例如,cd34+或造血干细胞)或成熟rbc(起源于如本文所述的经基因修饰的产生gal的细胞)。在一些方面,转基因上编码的治疗性α
‑
gala蛋白产物被输出到细胞外以影响缺少转基因的细胞或被缺少转基因的细胞吸收。在某些实施方案中,细胞是肝脏细胞,其将治疗性α
‑
gala蛋白释放到血流中以作用于远端组织(例如肾脏、脾脏、心脏、脑部、皮肤等)。
[0164]
在一个实施方案中,gla转基因在插入白蛋白基因座中后从白蛋白启动子表达。如果将转基因插入体内肝细胞中,则由gla转基因编码的生物制品可释放到血流中。在一些方面,通过静脉内施用将gla转基因在病毒载体中递送至体内肝脏中。在一些实施方案中,供体gla转基因包含在α
‑
gala编码序列之前的kozak共有序列(kozak(1987)nucl acid res 15(20):8125
‑
48),使得表达的产物缺少白蛋白信号肽。在一些实施方案中,供体α
‑
gala转基因含有替代信号肽,例如来自白蛋白、ids或f9基因的信号肽,代替天然gla信号序列。
[0165]
在又一方面,本文提供了用于将核酸序列位点特异性整合到内源基因座(例如,疾病相关的、高度表达的内源基因座,诸如肝脏细胞中的白蛋白基因座或染色体的rbc前体细胞中的珠蛋白基因座),例如位点特异性整合到非人胚胎的染色体中的方法。在某些实施方案中,所述方法包括:(a)为非人胚胎注射(i)至少一种dna载体,其中该dna载体包含位于待整合的编码α
‑
gala的核酸序列的侧翼的上游序列和下游序列,和(ii)至少一种多核苷酸分子,该多核苷酸分子编码至少一种识别靶基因座中的整合位点的核酸酶(锌指、zfn对、tale核酸酶、talen对或crispr/cas系统),并且(b)培养所述胚胎以允许表达核酸酶(zfn、talen和/或crispr/cas系统,其中通过核酸酶引入整合位点的双链断裂经由与dna载体的同源重组得以修复,以便将所述核酸序列整合到染色体中。在一些实施方案中,编码核酸酶的多核苷酸是rna。
[0166]
核酸酶
[0167]
任何核酸酶均可用于本文所述方法的方面的实践中,包括但不限于至少一种zfn、talen、归巢核酸内切酶和下述系统,所述系统包含可用于体内裂解携带转基因的供体分子的crispr/cas和/或ttago向导rna和用于裂解细胞基因组的核酸酶,使得转基因以靶向方式整合到基因组中。因此,本文描述了包含裂解选定基因的一种或多种核酸酶的组合物,所述裂解导致基因的基因组修饰(例如,裂解的基因中的插入和/或缺失)。在某些实施方案
中,所述核酸酶中的一种或多种是天然存在的。在其它实施方案中,所述核酸酶中的一种或多种是非天然存在的,即在dna结合分子(也称为dna结合结构域)和/或裂解结构域中经工程改造。例如,可以改变天然存在的核酸酶的dna结合结构域以与选定的靶位点结合(例如,经工程改造以与选定的靶位点结合的crispr/cas的zfp、tale和/或sgrna)。在其它实施方案中,核酸酶包含异源dna结合结构域和裂解结构域(例如,锌指核酸酶;tal效应结构域dna结合蛋白;具有异源裂解结构域的大范围核酸酶dna结合结构域)。在其它实施方案中,核酸酶包括系统,诸如ttago系统的crispr/cas。
[0168]
dna结合结构域
[0169]
在某些实施方案中,本文所述的组合物和方法采用大范围核酸酶(归巢核酸内切酶)dna结合结构域与供体分子结合和/或与细胞基因组中的目标区域结合。天然存在的大范围核酸酶识别15
‑
40个碱基对的裂解位点并且通常分为四个家族:laglidadg家族(作为seq id no:10公开的“laglidadg”)、giy
‑
yig家族、his
‑
cyst盒家族和hnh家族。示例性的归巢核酸内切酶包括i
‑
scei、i
‑
ceui、pi
‑
pspi、pi
‑
sce、i
‑
sceiv、i
‑
csmi、i
‑
pani、i
‑
sceii、i
‑
ppoi、i
‑
sceiii、i
‑
crei、i
‑
tevi、i
‑
tevii和i
‑
teviii。它们的识别序列是已知的。另请参见美国专利号5,420,032;美国专利号6,833,252;belfort等人(1997)nucleic acidsres.25:3379
–
3388;dujon等人(1989)gene 82:115
–
118;perler等人(1994)nucleic acids res.22,1125
–
1127;jasin(1996)trends genet.12:224
–
228;gimble等人(1996)j.mol.biol.263:163
–
180;argast等人(1998)j.mol.biol.280:345
–
353和the new england biolabs catalogue。另外,可以工程改造归巢核酸内切酶和大范围核酸酶的dna结合特异性以结合非天然靶位点。参见,例如,chevalier等人(2002)molec.cell 10:895
‑
905;epinat等人(2003)nucleic acids res.31:2952
‑
2962;ashworth等人(2006)nature 441:656
‑
659;paques等人(2007)current gene therapy7:49
‑
66;美国专利号8,021,867。归巢核酸内切酶和大范围核酸酶的dna结合结构域可以在整个核酸酶的背景下改变(即,使得核酸酶包括同源裂解结构域)或者可以与异源裂解结构域融合。
[0170]
在其它实施方案中,本文所述的方法和组合物中使用的核酸酶中的一种或多种的dna结合结构域包含天然存在的或工程化的(非天然存在的)tal效应dna结合结构域。参见,例如,通过引用整体并入本文的美国专利号8,586,526。已知黄单胞菌属(xanthomonas)的植物病原菌会在重要的作物植物中引起许多疾病。黄单胞菌的致病性取决于保守iii型分泌(t3s)系统,该系统将超过25种不同的效应蛋白注入植物细胞中。在这些注射的蛋白质中有转录激活因子样(tal)效应子,其模拟植物转录激活因子并操纵植物转录组(参见kay等人(2007)science 318:648
‑
651)。这些蛋白质含有dna结合结构域和转录活化结构域。表征最充分的tal效应子之一是来自野油菜黄单胞菌(xanthomonas campestgris pv.vesicatoria)的avrbs3(参见bonas等人(1989)mol gen genet 218:127
‑
136和wo2010079430)。tal效应子含有串联重复序列的集中结构域,每个重复序列含有大约34个氨基酸,这是这些蛋白质的dna结合特异性的关键。另外,它们还含有核定位序列和酸性转录活化结构域(综述参见schornack s等人(2006)j plant physiol 163(3):256
‑
272)。另外,已经在植物病原菌青枯雷尔氏菌(ralstonia solanacearum)中发现了两个基因,命名为brg11和hpx17,在青枯雷尔氏菌生物变种1菌株gmi1000和生物变种4菌株rs1000中与黄单胞菌的avrbs3家族同源(参见heuer等人(2007)appl and envir micro 73(13):4379
‑
4384)。这些基因在核苷酸序列上彼此98.9%相同,但不同之处在于hpx17重复结构域中有1,575bp的缺失。然而,两种基因产物与黄单胞菌的avrbs3家族蛋白的序列同一性均小于40%。参见,例如,通过引用整体并入本文的美国专利号8,586,526。
[0171]
这些tal效应子的特异性取决于串联重复序列中发现的序列。重复序列包含大约102bp,并且重复序列通常彼此91
‑
100%同源(bonas等人,同上)。重复序列的多态性通常位于位置12和13,并且位置12和13的高变双残基(rvd)的同一性与tal效应子的靶序列中的连续核苷酸的同一性之间似乎存在一一对应关系(参见moscou和bogdanove,(2009)science 326:1501以及boch等人(2009)science326:1509
‑
1512)。在实验上,已经确定了这些tal效应子的用于dna识别的自然密码,因此位置12和13的hd序列导致与胞嘧啶(c)结合,ng与t结合,ni与a、c、g或t结合,nn与a或g结合,并且ing与t结合。这些dna结合重复序列已组装成具有新的组合和重复序列数目的蛋白质,以产生能够与新序列相互作用并激活植物细胞中非内源性报告基因的表达的人工转录因子(boch等人,同上)。工程化的tal蛋白已连接到foki裂解半结构域,以产生在酵母报告基因测定(基于质粒的靶标)中表现出活性的tal效应结构域核酸酶融合体(talen)。参见,例如,美国专利号8,586,526;christian等人((2010)genetics epub 10.1534/genetics.110.120717)。
[0172]
在某些实施方案中,用于细胞基因组的体内裂解和/或靶向裂解的核酸酶中的一种或多种的dna结合结构域包含锌指蛋白。优选地,锌指蛋白是非天然存在的,因为它经工程改造为与选择的靶位点结合。参见,例如,参见,例如,beerli等人(2002)nature biotechnol.20:135
‑
141;pabo等人(2001)ann.rev.biochem.70:313
‑
340;isalan等人(2001)nature biotechnol.19:656
‑
660;segal等人(2001)curr.opin.biotechnol.12:632
‑
637;choo等人(2000)curr.opin.struct.biol.10:411
‑
416;美国专利号6,453,242;6,534,261;6,599,692;6,503,717;6,689,558;7,030,215;6,794,136;7,067,317;7,262,054;7,070,934;7,361,635;7,253,273;7,888,121;7,972,854;和美国专利公开号20050267061,其全部通过引用整体并入本文。
[0173]
与天然存在的锌指蛋白相比,工程化的锌指结合结构域可具有新颖的结合特异性。工程化方法包括但不限于合理设计和各种类型的选择。合理设计包括(例如)使用包含三重(或四重)核苷酸序列和单个锌指氨基酸序列的数据库,其中每个三重或四重核苷酸序列与锌指的结合所述具体三重或四重序列的一个或多个氨基酸序列相关。参见,例如,通过引用整体并入本文的共同拥有的美国专利6,453,242和6,534,261。
[0174]
包括噬菌体展示和双杂交系统在内的示例性选择方法在美国专利5,789,538;5,925,523;6,007,988;6,013,453;6,410,248;6,140,466;6,200,759;和6,242,568;以及wo 98/37186;wo 98/53057;wo 00/27878;和wo 01/88197中公开。此外,已在例如共同拥有的wo 02/077227中描述了对于锌指结合结构域的结合特异性的增强。
[0175]
另外,如这些和其它参考文献中所公开的,锌指结构域和/或多指锌指蛋白可使用任何合适的接头序列(包括例如5个或更多个氨基酸长的接头)连接在一起。对于示例性接头序列,另请参见美国专利号8,772,453;6,479,626;6,903,185;和7,153,949。本文所述的蛋白质可在蛋白质的单独锌指之间包括合适的接头的任何组合。
[0176]
靶位点的选择;zfp和用于设计和构建融合蛋白(以及编码融合蛋白的多核苷酸)的方法是本领域技术人员已知的并且在美国专利号6,140,081;5,789,538;6,453,242;6,
534,261;5,925,523;6,007,988;6,013,453;6,200,759;wo 95/19431;wo 96/06166;wo 98/53057;wo 98/54311;wo 00/27878;wo 01/60970;wo 01/88197;wo 02/099084;wo 98/53058;wo 98/53059;wo 98/53060;wo 02/016536和wo 03/016496中进行了详细描述。
[0177]
另外,如这些和其它参考文献中所公开的,锌指结构域和/或多指锌指蛋白可使用任何合适的接头序列(包括例如5个或更多个氨基酸长的接头)连接在一起。对于6个或更多个氨基酸长的示例性接头序列,另请参见美国专利号6,479,626;6,903,185;和7,153,949。本文所述的蛋白质可在蛋白质的单独锌指之间包括合适的接头的任何组合。
[0178]
在某些实施方案中,dna结合结构域是crispr/cas核酸酶系统的一部分,包括例如单向导rna(sgrna)。参见,例如,美国专利号8,697,359和9,873,894。编码所述系统的rna组分的crispr(成簇的规则间隔短回文重复序列)基因座,以及编码蛋白质的cas(crispr相关)基因座(jansen等人,2002.mol.microbiol.43:1565
‑
1575;makarova等人,2002.nucleic acids res.30:482
‑
496;makarova等人,2006.biol.direct 1:7;haft等人,2005.plos comput.biol.1:e60)构成crispr/cas核酸酶系统的基因序列。微生物宿主中的crispr基因座含有crispr相关(cas)基因以及能够对crispr介导的核酸裂解特异性编程的非编码rna元件的组合。
[0179]
ii型crispr是表征最充分的系统之一并分四个连续步骤实现靶向dna双链断裂。第一,从crispr基因座转录两个非编码rna,pre
‑
crrna阵列和tracrrna。第二,tracrrna与pre
‑
crrna的重复区域杂交并介导将pre
‑
crrna加工成含有单个间隔区序列的成熟crrna。第三,成熟的crrna:tracrrna复合物经由crrna上的间隔区与靶dna上靠近前间区序列邻近基序(pam)的前间区序列之间的沃森
‑
克里克(watson
‑
crick)碱基配对将cas9引导至靶dna,这是靶标识别的附加要求。最后,cas9介导靶dna的裂解,以在前间区序列中产生双链断裂。crispr/cas系统的活性包括三个步骤:(i)将外来dna序列插入crispr阵列中以防止在称为“适应”的过程中的未来攻击,(ii)相关蛋白质的表达,以及阵列的表达和加工,然后是(iii)rna介导的对外来核酸的干扰。因此,在细菌细胞中,几种所谓的“cas”蛋白涉及crispr/cas系统的天然功能并在诸如插入外来dna等功能中发挥作用。
[0180]
在某些实施方案中,cas蛋白可以是天然存在的cas蛋白的“功能衍生物”。天然序列多肽的“功能衍生物”是与天然序列多肽具有共同的定性生物学特性的化合物。“功能衍生物”包括但不限于天然序列的片段和天然序列多肽及其片段的衍生物,条件是它们与相应的天然序列多肽具有共同的生物学活性。本文考虑的生物学活性是功能衍生物将dna底物水解成片段的能力。术语“衍生物”涵盖多肽的氨基酸序列变体、其共价修饰和融合体。cas多肽或其片段的合适衍生物包括但不限于cas蛋白或其片段的突变体、融合体、共价修饰。cas蛋白,包括cas蛋白或其片段以及cas蛋白或其片段的衍生物,可从细胞获得或化学合成或通过这两种程序的组合获得。所述细胞可以是天然产生cas蛋白的细胞,或天然产生cas蛋白并经基因工程改造以更高表达水平产生内源性cas蛋白或从外源引入的核酸产生cas蛋白的细胞,所述核酸编码与内源性cas相同或不同的cas。在一些情况下,所述细胞并非天然产生cas蛋白,而是经基因工程改造为产生cas蛋白的。除了cas蛋白以外和/或代替cas蛋白使用的rna导向的核酸酶的其它非限制性实例包括2类crispr蛋白,诸如cpf1。参见,例如zetsche等人(2015)cell 163:1
‑
13。
[0181]
在弗朗西斯氏菌属(francisella spp)中鉴定的crispr
‑
cpf1系统是2类crispr
‑
cas系统,在人细胞中介导稳健的dna干扰。尽管在功能上是保守的,但cpf1和cas9在包括它们的向导rna和底物特异性在内的许多方面存在差异(参见fagerlund等人,(2015)genom bio 16:251)。cas9和cpf1蛋白之间的主要区别在于cpf1不利用tracrrna,因此只需要crrna。fncpf1 crrna长42
‑
44个核苷酸(19个核苷酸的重复序列和23
‑
25个核苷酸的间隔区)并且含有单个茎环,该茎环耐受保留二级结构的序列变化。另外,cpf1 crrna明显短于cas9所需的~100个核苷酸的工程化sgrna,并且fncpfl的pam需求是置换链上的5
′‑
ttn
‑3′
和5
′‑
cta
‑3′
。虽然cas9和cpf1在靶dna中均产生双链断裂,但是cas9使用其ruvc和hnh样结构域在向导rna的种子序列内产生平端切割,而cpf1使用ruvc样结构域在种子外产生交错切割。由于cpf1远离关键种子区域产生交错切割,nhej不会破坏靶位点,因此确保cpf1可以继续切割同一位点,直到发生所期望的hdr重组事件。因此,在本文所述的方法和组合物中,应理解术语“cas”包括cas9和cfp1蛋白。因此,如本文所用,“crispr/cas系统”是指crispr/cas和/或crispr/cfp1系统两者,包括核酸酶和/或转录因子系统两者。
[0182]
在一些实施方案中,dna结合结构域是ttago系统的一部分(参见swarts等人,同上;sheng等人,同上)。在真核生物中,基因沉默是由argonaute(ago)蛋白家族介导的。在该范例中,ago与小(19
‑
31个核苷酸)rna结合。这种蛋白质
‑
rna沉默复合物经由小rna与靶标之间的沃森
‑
克里克碱基配对识别靶rna,并且经核酸内切裂解靶rna(vogel(2014)science 344:972
‑
973)。相比之下,原核ago蛋白与小的单链dna片段结合并且可能起到检测和去除外来(通常是病毒的)dna的功能(yuan等人,(2005)mol.cell 19,405;olovnikov等人(2013)mol.cell 51,594;swarts等人,同上)。示例性的原核ago蛋白包括来自超嗜热菌(aquifex aeolicus)、类球红细菌(rhodobacter sphaeroides)和嗜热栖热菌(thermus thermophilus)的那些。
[0183]
表征最充分的原核ago蛋白之一是来自嗜热栖热菌(t.thermophilus)的原核ago蛋白(ttago;swarts等人,同上)。ttago与具有5'磷酸基团的15个核苷酸或13
‑
25个核苷酸的单链dna片段缔合。这种由ttago结合的“向导dna”用于引导蛋白质
‑
dna复合物结合第三方dna分子中的沃森
‑
克里克互补dna序列。一旦这些向导dna中的序列信息允许鉴定靶dna,则ttago
‑
向导dna复合物就会裂解靶dna。此类机制也得到了ttago
‑
向导dna复合物结构的支持,同时与其靶dna结合(g.sheng等人,同上)。来自类球红细菌(rsago)的ago具有类似的特性(olivnikov等人,同上)。
[0184]
可以将任意dna序列的外源向导dna负载到ttago蛋白上(swarts等人,同上)。由于ttago裂解的特异性是由向导dna引导,因此与外源的、研究者指定的向导dna形成的ttago
‑
dna复合物将引导ttago靶dna裂解成互补的研究者指定的靶dna。通过这种方式,人们可以在dna中产生有靶向的双链断裂。使用ttago
‑
向导dna系统(或来自其它生物体的直系同源ago
‑
向导dna系统)允许靶向裂解细胞内的基因组dna。此类裂解可以是单链的或双链的。对于哺乳动物基因组dna的裂解,优选使用为在哺乳动物细胞中表达而优化的ttago密码子型式。此外,可能优选用体外形成的ttago
‑
dna复合物处理细胞,其中ttago蛋白与细胞穿透肽融合。此外,可能优选使用经由诱变而改变的ttago蛋白型式,以在37摄氏度下具有提高的活性。ttago
‑
rna介导的dna裂解可用于影响一系列结果,包括使用本领域中用于dna断裂开发的标准技术进行的基因敲除、靶向基因添加、基因矫正、靶向基因缺失。
[0185]
因此,核酸酶包含dna结合结构域,该结构域与期望将供体(转基因)插入其中的任
何基因中的靶位点特异性结合。
[0186]
裂解结构域
[0187]
任何合适的裂解结构域都可以与dna结合结构域操作性地连接以形成核酸酶。例如,zfp dna结合结构域已与核酸酶结构域融合以阐述zfn
–
一种功能实体,其能够通过其工程化(zfp)dna结合结构域识别其预期的核酸靶标,并导致dna在zfp结合位点附近经由核酸酶活性被切割。参见,例如,kim等人(1996)proc natl acad sci usa 93(3):1156
‑
1160。术语“zfn”包括一对二聚化以裂解靶基因的zfn。最近,zfn已用于多种生物体的基因组修饰。参见,例如,美国专利号7,888,121;8,409,861;8,106,255;和9,447,434。同样,tale dna结合结构域已与核酸酶结构域融合以产生talen。参见,例如,美国专利号8,586,526。还描述了包含与dna结合并与裂解结构域(例如,cas结构域)缔合以诱导靶向裂解的单一向导rna(sgrna)的crispr/cas核酸酶系统。参见,例如,美国专利号8,697,359和8,932,814以及美国专利号9,873,894。
[0188]
如上所述,裂解结构域可以与dna结合结构域,例如来自核酸酶的锌指dna结合结构域和裂解结构域或来自核酸酶的talen dna结合结构域和裂解结构域;来自核酸酶(crispr/cas)的sgrna dna结合结构域和裂解结构域;和/或来自不同核酸酶的大范围核酸酶dna结合结构域和裂解结构域异源。异源裂解结构域可以从任何核酸内切酶或核酸外切酶获得。可从中得到裂解结构域的示例性核酸内切酶包括但不限于限制性核酸内切酶和归巢核酸内切酶。参见,例如,2002
‑
2003catalogue,new england biolabs,beverly,ma;和belfort等人(1997)nucleic acids res.25:3379
‑
3388。已知裂解dna的其它酶(例如,s1核酸酶;绿豆核酸酶;胰腺dna酶i;微球菌核酸酶;酵母ho核酸内切酶;另请参见linn等人(编辑)nucleases,cold spring harbor laboratory press,1993)。这些酶(或其功能片段)中的一种或多种可用作裂解结构域和裂解半结构域的来源。
[0189]
类似地,裂解半结构域可源自如上所述需要二聚化才有裂解活性的任何核酸酶或其部分。一般而言,如果融合蛋白包含裂解半结构域,则裂解需要两种融合蛋白。可替代地,可以使用包含两个裂解半结构域的单一蛋白质。两个裂解半结构域可以源自相同的核酸内切酶(或其功能片段),或者每个裂解半结构域可以源自不同的核酸内切酶(或其功能片段)。另外,两种融合蛋白的靶位点优选相对于彼此布置,使得两种融合蛋白与其各自靶位点的结合将裂解半结构域置于彼此的某一空间取向上,允许裂解半结构域例如通过二聚化形成功能性裂解结构域。因此,在某些实施方案中,靶位点的近边缘被5
‑
8个核苷酸或15
‑
18个核苷酸隔开。然而,任何整数个核苷酸或核苷酸对都可以介于两个靶位点之间(例如,2至50个核苷酸对或更多个)。一般而言,裂解位点位于靶位点之间。
[0190]
限制性核酸内切酶(限制酶)存在于许多物种中,能够与dna(在识别位点处)进行序列特异性结合,并且在结合位点处或附近裂解dna。某些限制酶(例如,iis型)在从识别位点去除的位点处裂解dna,并具有可分开的结合结构域和裂解结构域。例如,iis型酶foki催化dna的双链裂解,在一条链上距其识别位点9个核苷酸处,在另一条链上距其识别位点13个核苷酸处。参见,例如,美国专利5,356,802;5,436,150和5,487,994;以及li等人(1992)proc.natl.acad.sci.usa 89:4275
‑
4279;li等人(1993)proc.natl.acad.sci.usa 90:2764
‑
2768;kim等人(1994a)proc.natl.acad.sci.usa 91:883
‑
887;kim等人(1994b)j.biol.chem.269:31,978
‑
31,982。因此,在一个实施方案中,融合蛋白包含来自至少一种
iis型限制酶的裂解结构域(或裂解半结构域)和一个或多个可以被或可以不被工程改造的锌指结合结构域。
[0191]
其裂解结构域可与结合结构域分开的示例性iis型限制酶是fok i。这种特殊的酶作为二聚体具有活性。bitinaite等人(1998)proc.natl.acad.sci.usa 95:10,570
‑
10,575。因此,出于本公开的目的,所公开的融合蛋白中使用的fok i酶的部分被认为是裂解半结构域。因此,对于使用锌指
‑
fok i融合体进行的细胞序列的靶向双链裂解和/或靶向替代,可以使用各自包含foki裂解半结构域的两种融合蛋白来重建具有催化活性的裂解结构域。可替代地,也可以使用含有锌指结合结构域和两个fok i裂解半结构域的单个多肽分子。在本公开的别处提供了使用锌指
‑
fok i融合体进行靶向裂解和靶向序列改变的参数。
[0192]
裂解结构域或裂解半结构域可以是蛋白质的保留裂解活性或保留多聚化(例如,二聚化)以形成功能性裂解结构域的能力的任何部分。
[0193]
示例性的iis型限制酶在美国专利7,888,121中有描述,该专利整体并入本文。另外的限制酶也含有可分开的结合结构域和裂解结构域,并且这些是本公开所涵盖的。参见,例如,roberts等人(2003)nucleic acids res.31:418
‑
420。
[0194]
在某些实施方案中,裂解结构域包含一个或多个工程化裂解半结构域(也称为二聚化结构域突变体),所述裂解半结构域最小化或防止同型二聚化,例如美国专利号8,772,453;8,623,618;8,409,861;8,034,598;7,914,796;和7,888,121中所述;所有这些专利的公开内容通过引用整体并入本文。foki的位置446、447、479、483、484、486、487、490、491、496、498、499、500、531、534、537和538处的氨基酸残基全部是影响foki裂解半结构域二聚化的靶标。
[0195]
形成专性异源二聚体的foki的示例性工程化裂解半结构域包括一对,其中第一裂解半结构域包括在foki的位置490和538的氨基酸残基处的突变并且第二裂解半结构域包括在氨基酸残基486和499处的突变。
[0196]
因此,在一个实施方案中,490处的突变用lys(k)替代glu(e);538处的突变用lys(k)替代iso(i);486处的突变用glu(e)替代gln(q);并且位置499处的突变用lys(k)替代iso(i)。具体地说,本文所述的工程化裂解半结构域通过以下方式制备:使一个裂解半结构域中的位置490(e
→
k)和538(i
→
k)突变以产生命名为“e490k:i538k”的工程化裂解半结构域(“kk”)并且使另一个裂解半结构域中的位置486(q
→
e)和499(i
→
l)突变以产生命名为“q486e:i499l”的工程化裂解半结构域(“el”)。本文所述的工程化裂解半结构域是其中异常裂解被最小化或消除的专性异源二聚体突变体。美国专利号7,914,796和8,034,598,其公开内容通过引用整体并入。在某些实施方案中,工程化裂解半结构域包含位置486、499和496(相对于野生型foki编号)的突变,例如用glu(e)残基替代位置486处的野生型gln(q)残基,用leu(l)残基替代位置499处的野生型iso(i)残基以及用asp(d)或glu(e)残基替代位置496处的野生型asn(n)残基的突变(也分别称为“eld”和“ele”结构域)。在其它实施方案中,工程化裂解半结构域包含位置490、538和537(相对于野生型foki编号)的突变,例如用lys(k)残基替代位置490处的野生型glu(e)残基,用lys(k)残基替代位置538处的野生型iso(i)残基以及用lys(k)残基或arg(r)残基替代位置537处的野生型his(h)残基的突变(也分别称为“kkk”和“kkr”结构域)。在其它实施方案中,工程化裂解半结构域包含位置490和537(相对于野生型foki编号)的突变,例如用lys(k)残基替代位置490处的野生型glu(e)
残基,以及用lys(k)残基或arg(r)残基替代位置537处的野生型his(h)残基的突变(也分别称为“kik”和“kir”结构域)。参见,例如,美国专利号8,772,453。在其它实施方案中,工程化裂解半结构域包含“sharkey”突变(参见guo等人,(2010)j.mol.biol.400(1):96
‑
107)。
[0197]
可以使用任何合适的方法制备本文所述的工程化裂解半结构域,例如,如美国专利号8,623,618;8,409,861;8,034,598;7,914,796;和7,888,121中所述,通过野生型裂解半结构域(fok i)的定点诱变。
[0198]
方法和组合物也用于增加核酸酶对对于其预期靶标相对于其它非预期裂解位点(称为脱靶位点)的特异性(参见美国专利公开号20170218349和20180087072)。因此,本文所述的核酸酶可在其dna结合结构域骨架区中的一个或多个中包含突变和/或在其核酸酶裂解结构域中包含一个或多个突变。这些核酸酶可以包括zfp dna结合结构域(“zfp骨架”)内可以与dna骨架上的磷酸非特异性相互作用的氨基酸的突变,但它们不包括dna识别螺旋的变化。因此,zfp可以包括zfp骨架中的阳离子氨基酸残基的突变,这些阳离子氨基酸残基对于核苷酸靶标特异性是不需要的。在一些实施方案中,zfp骨架中的这些突变包括使阳离子氨基酸残基突变为中性或阴离子氨基酸残基。在一些实施方案中,zfp骨架中的这些突变包括使极性氨基酸残基突变为中性或非极性氨基酸残基。在优选的实施方案中,在相对于dna结合螺旋的位置(
‑
5)、(
‑
9)和/或位置(
‑
14)处产生突变。在一些实施方案中,锌指可在(
‑
5)、(
‑
9)和/或(
‑
14)处包含一个或多个突变。在其它实施方案中,多指锌指蛋白中的一个或多个锌指可在(
‑
5)、(
‑
9)和/或(
‑
14)中包含突变。在一些实施方案中,(
‑
5)、(
‑
9)和/或(
‑
14)处的氨基酸(例如精氨酸(r)或赖氨酸(k))突变为丙氨酸(a)、亮氨酸(l)、ser(s)、asp(n)、glu(e)、tyr(y)和/或谷氨酰胺(q)。
[0199]
在某些实施方案中,工程化裂解半结构域源自foki核酸酶结构域,并且在相对于野生型全长foki编号的氨基酸残基416、422、447、448和/或525中的一处或多处包含突变。在一些实施方案中,将氨基酸残基416、422、447、448和/或525中的突变引入如上所述的foki“eld”、“ele”、“kkk”、“kkr”、“kk”、“el”、“kik”、“kir”中。
[0200]
此外,本文描述了通过独立滴定核酸酶复合物的工程化裂解半结构域配偶体来增加裂解活性的特异性的方法。在一些实施方案中,两个配偶体(半裂解结构域)的比率以1:2、1:3、1:4、1:5、1:6、1:8、1:9、1:10或1:20的比率,或介于之间的任何值给出。在其它实施方案中,两个配偶体的比率大于1:30。在其它实施方案中,两个配偶体以选择为不同于1:1的比率来配置。当单独使用或组合使用时,本文公开的方法和组合物通过降低脱靶裂解活性而在靶向特异性方面提供令人惊讶和出乎意料的增加。这些实施方案中使用的核酸酶可以包括zfn、一对zfn、talen、一对talen、crispr/cas、crispr/dcas和ttago,或其任何组合。
[0201]
可替代地,核酸酶可以使用所谓的“分裂酶”技术在体内在核酸靶位点处组装(参见,例如美国专利公开号20090068164)。此类分裂酶的组件可以在单独的表达构建体上表达,或者可以连接在一个开放阅读框中,其中各个组件例如被自裂解2a肽或ires序列分开。组件可以是单独的锌指结合结构域或大范围核酸酶核酸结合结构域的结构域。
[0202]
可以在使用前对核酸酶的活性进行筛选,例如在美国专利号8,563,314中描述的基于酵母的染色体系统中。核酸酶的表达可以受组成型启动子或诱导型启动子(例如半乳糖激酶启动子)的控制,所述启动子在棉子糖和/或半乳糖的存在下活化(去阻抑)而在葡萄糖的存在下受阻抑。
[0203]
cas9相关的crispr/cas系统包含两个rna非编码组件:tracrrna和含有被相同的同向重复序列(dr)分隔开的核酸酶向导序列(间隔区)的pre
‑
crrna阵列。为了使用crispr/cas系统完成基因组工程,这些rna的两种功能都必须存在(参见cong等人,(2013)sciencexpress 1/10.1126/science 1231143)。在一些实施方案中,tracrrna和pre
‑
crrna经由单独的表达构建体或作为单独的rna提供。在其它实施方案中,构建嵌合rna,其中工程化的成熟crrna(赋予靶标特异性)与tracrrna(提供与cas9的相互作用)融合以产生嵌合cr
‑
rna
‑
tracrrna杂交体(也称为单向导rna)。(参见jinek同上和cong,同上)。
[0204]
靶位点
[0205]
如上文详细描述的,dna结构域可以经工程改造以与基因座(例如白蛋白或其它安全港基因)中选择的任何序列结合。与天然存在的dna结合结构域相比,工程化dna结合结构域可以具有新颖的结合特异性。工程化方法包括但不限于合理设计和各种类型的选择。合理设计包括(例如)使用包含三重(或四重)核苷酸序列和单独(例如,锌指)氨基酸序列的数据库,其中每个三重或四重核苷酸序列与dna结合结构域的结合所述具体三重或四重序列的一个或多个氨基酸序列相关。参见,例如,通过引用整体并入本文的共同拥有的美国专利6,453,242和6,534,261。也可以进行tal效应结构域的合理设计。参见,例如,美国专利号8,586,526。
[0206]
适用于dna结合结构域的示例性选择方法(包括噬菌体展示和双杂交系统)公开于美国专利5,789,538;5,925,523;6,007,988;6,013,453;6,410,248;6,140,466;6,200,759;和6,242,568;以及wo98/37186;wo 98/53057;wo 00/27878;wo 01/88197和gb 2,338,237中。
[0207]
靶位点的选择;用于设计和构建融合蛋白(以及编码融合蛋白的多核苷酸)的核酸酶和方法是本领域技术人员已知的并且在美国专利号7,888,121和8,409,891中有详细描述,所述专利通过引用整体并入本文。
[0208]
另外,如这些和其它参考文献中所公开的,dna结合结构域(例如,多指锌指蛋白)可使用任何合适的接头序列(包括例如5个或更多个氨基酸的接头)连接在一起。对于6个或更多个氨基酸长的示例性接头序列,参见,例如,美国专利号9,567,609;6,479,626;6,903,185;和7,153,949。本文所述的蛋白质可包括介于蛋白质的单独dna结合结构域之间的合适的接头的任何组合。
[0209]
供体
[0210]
如上所述,提供了用于将外源序列(也称为“供体构建体”或“供体序列”或“供体”)引入受试者中,例如以矫正突变基因或增加编码法布里病中缺少或有缺陷的蛋白质(例如,α
‑
gala)的基因的表达的方法和组合物。
[0211]
显而易见的是,供体序列通常与其所处的基因组序列不同。供体序列可以含有侧翼是两个同源区域(“同源臂”)的非同源序列,以允许目标位置处的有效hdr。另外,供体序列可包含含有与细胞染色质中的目标区域不同源的序列的载体分子。供体分子可以含有几个与细胞染色质同源的不连续区域。例如,对于目标区域中通常不存在的序列的靶向插入,所述序列可以存在于供体核酸分子中并且侧翼是与目标区域中的序列同源的区域。
[0212]
本文描述了靶向插入编码α
‑
gala蛋白的转基因以插入选定位置的方法。gla转基因可编码全长α
‑
gala蛋白或者可编码截短的α
‑
gala蛋白。用于插入的多核苷酸也可称为
“
外源”多核苷酸、“供体”多核苷酸或分子或“转基因”。图1a和图1b中示出了非限制性的示例性gla供体构建体。
[0213]
供体多核苷酸可以是单链和/或双链的dna或rna,并且可以以线性或环状形式引入细胞中。参见,例如,美国专利号8,703,489和9,255,259。一个或多个供体序列也可以含在dna mc内,后者可以以环状或线性形式引入细胞中。参见,例如,美国专利公开号20140335063。如果以线性形式引入,供体序列的末端可通过本领域技术人员已知的方法来保护(例如,免受核酸外切降解)。例如,将一个或多个双脱氧核苷酸残基添加至线性分子的3'末端和/或将自互补寡核苷酸连接至一端或两端。参见,例如,chang等人(1987)proc.natl.acad.sci.usa 84:4959
‑
4963;nehls等人(1996)science272:886
‑
889。用于保护外源多核苷酸免受降解的另外方法包括但不限于添加末端氨基和使用修饰的核苷酸间键,例如像硫代磷酸酯、氨基磷酸酯和o
‑
甲基核糖或脱氧核糖残基。
[0214]
可将多核苷酸引入到细胞中作为病毒或非病毒载体分子的一部分,所述载体分子具有另外的序列例如像复制起点、启动子和编码抗生素耐药性的基因。而且,供体多核苷酸可以作为裸核酸、作为与试剂诸如脂质体或泊洛沙姆复合的核酸引入,或者可以通过病毒(例如腺病毒、aav、疱疹病毒、逆转录病毒、慢病毒和整合酶缺陷型慢病毒(idlv))递送。
[0215]
可以插入供体使其表达受整合位点处的内源启动子驱动,所述内源启动子即驱动将供体插入其中的内源基因(例如,高度表达的白蛋白、aavs1、hprt等)表达的启动子。然而,显然供体可以包含启动子和/或增强子,例如组成型启动子或诱导型或组织特异性启动子。在一些实施方案中,供体保持在细胞中的表达质粒中,使得基因在染色体外表达。
[0216]
供体分子可以插入内源基因中,使得所有、一些或没有内源基因表达。例如,如本文所述的转基因可以插入白蛋白或其它基因座中,使得一些(编码溶酶体酶的转基因的n端和/或c端)或没有内源白蛋白序列表达,例如表达为与编码α
‑
gala蛋白的转基因的融合体。在其它实施方案中,将转基因(例如,具有或不具有诸如白蛋白的附加编码序列)整合到任何内源基因座,例如安全港基因座中。
[0217]
当内源序列(内源性的或转基因的一部分)与转基因一起表达时,内源序列(例如,白蛋白等)可以是全长序列(野生型或突变型)或部分序列。优选地,内源序列是有功能的。这些全长或部分序列(例如,白蛋白)的功能的非限制性实例包括增加由转基因(例如,治疗性基因)表达的多肽的血清半衰期和/或充当承载体。
[0218]
此外,虽然不是表达所必需的,但是外源序列也可包括转录或翻译调控序列,例如,启动子、增强子、绝缘子、内部核糖体进入位点、编码2a肽的序列和/或聚腺苷酸化信号。
[0219]
与转基因连接的外源序列还可包括信号肽以帮助所编码的蛋白质的加工和/或分泌。这些信号肽的非限制性实例包括来自白蛋白、ids和因子ix的那些。
[0220]
在某些实施方案中,外源序列(供体)包含目标蛋白质和作为其融合配偶体的膜蛋白的胞外结构域的融合体,使融合蛋白定位于细胞表面。这允许由转基因编码的蛋白质潜在地在血清中起作用。在法布里病的情况下,由转基因编码的α
‑
gala酶作用于血清中从其在细胞(例如,rbc)表面的位置积聚的代谢产物。另外,如果rbc如同正常的降解过程一样被脾巨噬细胞吞噬,则在巨噬细胞吞噬细胞时形成的溶酶体将会使膜结合的融合蛋白在天然更有利于该酶的ph下暴露于溶酶体中高浓度的代谢产物。潜在融合配偶体的非限制性实例示于下面的表2中。
[0221]
表2:潜在融合配偶体的实例
[0222][0223]
在一些情况下,表达构建体可包含已经修饰的内源gla基因。例如,可以对内源基因进行密码子优化。此外,虽然针对酶替代疗法的抗体反应相对于所讨论的特定治疗性酶和单独患者而异,但在用野生型α
‑
gala酶替代治疗的许多法布里病患者中已经观察到显著的免疫反应。当与没有转基因的受试者相比,转基因增加了蛋白质的量(和/或其活性)时,认为该转基因提供了治疗性蛋白质。另外,这些抗体与治疗功效的相关性也是可变的(参见katherine ponder,(2008)j clin invest 118(8):2686)。因此,本文所述的方法和组合物可以包括生成与野生型gla相比具有经修饰的序列的表达构建体,所述修饰包括但不限于在已知是内源免疫反应的引发表位的位点产生功能性沉默的氨基酸变化的修饰,和/或使得由此类序列产生的多肽具有较低免疫原性的截短。
[0224]
由于大脑中缺失的α
‑
gala酶的缺少,法布里病患者常常有神经系统后遗症。不幸的是,由于血脑屏障的不可渗透性,往往难以经由血液将治疗剂递送至大脑。因此,所述方法和组合物可以连同增加治疗剂向大脑中递送的方法一起使用,包括但不限于引起脑毛细血管细胞之间紧密连接瞬时打开的方法,诸如通过使用高渗甘露醇溶液的颈动脉内施用、聚焦超声的使用和缓激肽类似物的施用而进行的瞬时渗透破坏(matsukado等人(1996)neurosurgery 39:125)。可替代地,可以将治疗剂设计为利用受体或转运机制向大脑中特异性转运。可以使用的特定受体的实例包括转铁蛋白受体、胰岛素受体或低密度脂蛋白受体相关蛋白1和2(lrp
‑
1和lrp
‑
2)。已知lrp会与一系列分泌性蛋白(诸如apoe、tpa、pai
‑
1等)相互作用,因此将来自这些蛋白质之一的lrp的识别序列融合可以在治疗性蛋白质在肝脏中表达并分泌到血流中之后,促进酶转运到大脑中(参见gabathuler,(2010)同上)。
[0225]
细胞
[0226]
还提供了包含外源gla转基因(整合的或染色体外的)的基因修饰细胞(例如,干细
胞、前体细胞、肝脏细胞、肌肉细胞等),包括通过本文所述的方法制备的细胞。这些细胞可用于向患有法布里病的受试者提供α
‑
gal a蛋白,例如通过将一个或多个所述细胞施用于有需要的受试者,或者可替代地,通过分离由所述细胞产生的α
‑
gal a蛋白并将所述蛋白质施用给有需要的受试者(酶替代疗法)。可替代地,可以通过施用如本文所述的表达构建体在受试者中体内产生所述细胞。因此,提供了经分离且体内基因修饰的细胞。还提供了包含gla转基因的载体(例如,病毒载体,诸如aav或ad或脂质纳米颗粒),用于本文所述的任何方法中,包括用于法布里病的治疗中。
[0227]
在本文所述的任何方法中,可以使用核酸酶将gla转基因插入靶细胞的基因组中。合适的核酸酶的非限制性实例包括锌指核酸酶(zfn)、talen(转录激活因子样蛋白核酸酶)和/或crispr/cas核酸酶系统,其包括与细胞基因组中的目标区域(例如,疾病相关基因、高度表达的基因、白蛋白基因或其它安全港基因)中的靶位点结合的dna结合分子以及一个或多个核酸酶结构域(例如,裂解结构域和/或裂解半结构域)。裂解结构域和裂解半结构域可以从例如各种限制性核酸内切酶、cas蛋白和/或归巢核酸内切酶获得。在某些实施方案中,锌指结构域识别红血前体细胞(rbc)中白蛋白基因或珠蛋白基因中的靶位点。参见,例如,通过引用整体并入本文的美国专利号9,877,988。在其它实施方案中,核酸酶(例如,zfn、talen和/或crispr/cas系统)结合和/或裂解安全港基因,例如ccr5基因、ppp1r12c(也称为aavs1)基因、白蛋白、hprt或rosa基因。参见,例如,美国专利号9,877,988;9,567,573;9,447,434;9,394,545;9,222,105;9,206,404;9,150,847;8,895,264;8,771,985;8,106,255;7,888,121;7,972,854;7,914,796;7,951,925;8,110,379;8,409,861;和8,586,526;美国专利公开20030232410和20060063231。核酸酶(或其组件)可以作为编码本文所述的一种或多种核酸酶(例如,zfn、talen和/或crispr/cas系统)的多核苷酸提供。多核苷酸可以是例如mrna。在一些方面,mrna可以经化学修饰(参见例如kormann等人,(2011)nature biotechnology 29(2):154
‑
157)。在其它方面,mrna可以包含arca帽(参见美国专利7,074,596和8,153,773)。在其它实施方案中,mrna可以包含未修饰的和经修饰的核苷酸的混合物(参见美国专利公开20120195936)。在还有其它实施方案中,mrna可以包含wpre元件(参见美国专利号10,179,918)。
[0228]
在另一方面,描述了具有期望的gla转基因(任选地使用核酸酶整合的)的基因修饰细胞(例如干细胞、前体细胞、肝脏细胞、肌肉细胞等)。在一些方面,然后扩增编辑的干细胞或前体细胞并且可以诱导其离体分化为成熟的编辑细胞,然后将所述细胞给予患者。因此,可以使用起源于如本文所述的经基因编辑(修饰)的产生gla的干细胞或前体细胞的细胞。在其它方面,在骨髓移植中给予编辑的前体(例如,cd34+干细胞),在成功植入后,编辑的前体增殖产生编辑的细胞,然后在体内分化和成熟,并且含有从gla转基因表达的生物制品。在一些实施方案中,将编辑的cd34+干细胞静脉内给予患者,使得编辑的细胞迁移至骨髓、分化和成熟,产生α
‑
gal a蛋白。在其它方面,编辑的干细胞是肌肉干细胞,然后将肌肉干细胞引入肌肉组织中。在一些方面,工程化核酸酶是锌指核酸酶(zfn)(术语“zfn”包括一对zfn),而在其它方面,核酸酶是tale核酸酶(talen)(术语“talen”包括一对talen),以及在其它方面,使用crispr/cas系统。可以将核酸酶工程改造为对安全港基因座、与疾病相关的基因或在细胞中高度表达的基因具有特异性。仅作为非限制性实例,安全港基因座可以是aavs1位点、ccr5基因、白蛋白或hprt基因,而疾病相关基因可以是编码α
‑
半乳糖苷酶a的
gla基因。
[0229]
gla转基因可以是全长的或经修饰的并且可以在染色体外表达或者可以使用一种或多种核酸酶以靶向方式整合到细胞基因组中。与随机整合不同,核酸酶介导的靶向整合确保将转基因整合到指定基因中。转基因可以整合到靶基因中的任何位置。在某些实施方案中,转基因整合在核酸酶结合位点和/或裂解位点处或附近,例如在裂解位点和/或结合位点上游或下游的1
‑
300碱基对(或介于之间的任何数目的碱基对)以内,更优选在裂解位点和/或结合位点任一侧的1
‑
100个碱基对(或介于之间的任何数目的碱基对)以内,甚至更优选地在裂解位点和/或结合位点的任一侧的1至50个碱基对(或介于之间的任何数目的碱基对)以内。在某些实施方案中,整合的序列不包括任何载体序列(例如,病毒载体序列)。
[0230]
任何细胞类型都可以如本文所述进行基因修饰为包含转基因,包括但不限于细胞或细胞系。如本文所述的基因修饰细胞的其它非限制性实例包括t细胞(例如,cd4+、cd3+、cd8+等);树突细胞;b细胞;自体(例如,患者来源的)、肌肉细胞、脑细胞等。在某些实施方案中,所述细胞是肝脏细胞并且经体内修饰。在某些实施方案中,所述细胞是干细胞,包括异源多能、全能或多潜能干细胞(例如,cd34+细胞、诱导多能干细胞(ipsc)、胚胎干细胞等)。在某些实施方案中,如本文所述的细胞是源自患者的干细胞。
[0231]
本文所述的细胞可用于例如通过体内疗法治疗和/或预防受试者的法布里病,所述受试者患有该病症。还提供了离体疗法,例如当核酸酶修饰的细胞可以扩增然后使用标准技术重新引入患者体内时。参见,例如,tebas等人(2014)new eng j med 370(10):901。在干细胞的情况下,在输注到受试者体内后,也发生这些前体在体内分化为表达功能蛋白的细胞(来自插入的供体)。
[0232]
还提供了包含如本文所述的细胞的药物组合物。另外,细胞可以在施用于患者之前冷冻保存。
[0233]
递送
[0234]
本文所述的cdna表达构建体、核酸酶、编码这些核酸酶的多核苷酸、供体多核苷酸和/或组合物(例如细胞、蛋白质、多核苷酸等)可以通过任何合适的方式在体内或离体递送。
[0235]
递送如本文所述的核酸酶的方法例如在美国专利号6,453,242;6,503,717;6,534,261;6,599,692;6,607,882;6,689,558;6,824,978;6,933,113;6,979,539;7,013,219;和7,163,824中有描述,所有这些专利的公开内容通过引用整体并入本文。
[0236]
还可以使用含有编码锌指、talen和/或cas蛋白中的一种或多种的序列的载体递送如本文所述的表达构建体和/或核酸酶。可以使用任何载体系统,包括但不限于质粒载体、逆转录病毒载体、慢病毒载体、腺病毒载体、痘病毒载体、疱疹病毒载体和腺相关病毒载体等。另请参见,美国专利号6,534,261;6,607,882;6,824,978;6,933,113;6,979,539;7,013,219;和7,163,824,所述专利通过引用整体并入本文。此外,显而易见的是,这些载体中的任何一种都可以包含治疗所需的序列中的一种或多种。因此,将一种或多种核酸酶和供体构建体引入细胞中时,所述核酸酶和/或供体多核苷酸可携带在相同载体或不同载体上。当使用多个载体时,每个载体可包含编码一种或多种核酸酶和/或供体构建体的序列。
[0237]
常规的基于病毒和非病毒的基因转移方法可用于在细胞(例如,哺乳动物细胞)和靶组织中引入cdna表达构建体或编码核酸酶和/或表达构建体的核酸。非病毒载体递送系
统包括dna质粒、裸核酸和与递送媒介物诸如脂质体或泊洛沙姆复合的核酸。病毒载体递送系统包括dna和rna病毒,其在递送至细胞后具有附加型或整合基因组。有关基因治疗程序的综述,参见anderson,science 256:808
‑
813(1992);nabel和felgner,tibtech 11:211
‑
217(1993);mitani和caskey,tibtech 11:162
‑
166(1993);dillon,tibtech 11:167
‑
175(1993);miller,nature 357:455
‑
460(1992);van brunt,biotechnology 6(10):1149
‑
1154(1988);vigne,restorative neurology and neuroscience 8:35
‑
36(1995);kremer和perricaudet,british medical bulletin 51(1):31
‑
44(1995);haddada等人,在current topics in microbiology and immunology中,doerfler和(编辑)(1995);以及yu等人,gene therapy 1:13
‑
26(1994)。
[0238]
核酸的非病毒递送方法包括电穿孔、脂质转染、显微注射、生物弹道、病毒体、脂质体、免疫脂质体、聚阳离子或脂质:核酸偶联物、裸dna、人工病毒粒子和试剂增强的dna摄取。使用例如sonitron 2000系统(rich
‑
mar)的声孔法也可用于递送核酸。
[0239]
其它示例性的核酸递送系统包括由amaxa biosystems(cologne,germany)、maxcyte,inc.(rockville,maryland)、btx molecular delivery systems(holliston,ma)和copernicus therapeutics inc提供的那些(参见例如us6008336)。在例如美国专利号5,049,386;4,946,787;和4,897,355)中描述了脂质转染并且脂质转染试剂是商业销售的(例如,transfectam
tm
和lipofectin
tm
)。适于多核苷酸的有效受体识别脂质转染的阳离子脂质和中性脂质包括felgner、wo 91/17424、wo 91/16024的那些。
[0240]
脂质:核酸复合物(包括靶向脂质体诸如免疫脂质复合物)的制备是本领域技术人员众所周知的(参见,例如,crystal,science 270:404
‑
410(1995);blaese等人,cancer gene ther.2:291
‑
297(1995);behr等人,bioconjugate chem.5:382
‑
389(1994);remy等人,bioconjugate chem.5:647
‑
654(1994);gao等人,gene therapy 2:710
‑
722(1995);ahmad等人,cancer res.52:4817
‑
4820(1992);美国专利号4,186,183、4,217,344、4,235,871、4,261,975、4,485,054、4,501,728、4,774,085、4,837,028和4,946,787)。
[0241]
还可以使用纳米颗粒例如脂质纳米颗粒(lnp)递送本文所述的cdna和/或核酸酶组合物。参见例如,lee等人(2016)am j cancer res 6(5):1118
‑
1134;美国专利号10,166,298;以及美国公开号20180185516。
[0242]
另外的递送方法包括将待递送的核酸包装到engeneic递送载体(edv)中的使用。使用双特异性抗体将这些edv特异性递送到靶组织,其中所述抗体的一条臂对靶组织具有特异性,而另一条臂对edv具有特异性。抗体将edv带到靶细胞表面,然后通过内吞作用将edv带入细胞中。一旦处于细胞中,内容物就会释放(参见macdiarmid等人(2009)nature biotechnology 27(7):643)。
[0243]
使用基于rna或dna病毒的系统来递送编码工程化zfp的核酸,利用了高度进化的过程,将病毒靶向体内的特定细胞并将病毒有效载荷运送到细胞核。病毒载体可以直接施用于受试者(体内),或者它们可以用于处理体外细胞,并将修饰的细胞施用于受试者(离体)。用于递送zfp的常规的基于病毒的系统包括但不限于用于基因转移的逆转录病毒载体、慢病毒载体、腺病毒载体、腺相关病毒载体、牛痘病毒载体和单纯疱疹病毒载体。用逆转录病毒、慢病毒和腺相关病毒基因转移方法可以整合到宿主基因组中,常常引起插入的转基因的长期表达。另外,在许多不同的细胞类型和靶组织中都已经观察到高转导效率。
[0244]
逆转录病毒的趋向性可以通过掺入外来包膜蛋白来改变,从而扩增靶细胞的潜在目标群体。慢病毒载体是能够转导或感染非分裂细胞并且通常产生高病毒滴度的逆转录病毒载体。逆转录病毒基因转移系统的选择取决于靶组织。逆转录病毒载体由具有长达6
‑
10kb外来序列的包装能力的顺式作用长末端重复序列组成。最小的顺式作用ltr足以复制和包装载体,然后用于将治疗基因整合到靶细胞中以提供永久性转基因表达。广泛使用的逆转录病毒载体包括基于鼠白血病病毒(mulv)、长臂猿白血病病毒(galv)、猿猴免疫缺陷病毒(siv)、人免疫缺陷病毒(hiv)及其组合的那些(参见,例如buchscher等人,j.virol.66:2731
‑
2739(1992);johann等人,j.virol.66:1635
‑
1640(1992);sommerfelt等人,virol.176:58
‑
59(1990);wilson等人,j.virol.63:2374
‑
2378(1989);miller等人,j.virol.65:2220
‑
2224(1991))。
[0245]
在优选瞬时表达的应用中,可以使用基于腺病毒的系统。基于腺病毒的载体能够在许多细胞类型中具有非常高的转导效率并且不需要细胞分裂。使用此类载体,已经获得了高滴度和高水平的表达。这种载体可以在相对简单的系统中大量产生。腺相关病毒(“aav”)载体还用于转导具有靶核酸的细胞,例如,用于核酸和肽的体外产生,以及用于体内和离体基因治疗程序(参见例如,west等人,virology160:38
‑
47(1987);美国专利号4,797,368;wo 93/24641;kotin,human gene therapy 5:793
‑
801(1994);muzyczka,j.clin.invest.94:1351(1994)。重组aav载体的构建在许多出版物中有所描述,所述出版物包括美国专利号5,173,414;tratschin等人,mol.cell.biol.5:3251
‑
3260(1985);tratschin等人,mol.cell.biol.4:2072
‑
2081(1984);hermonat和muzyczka,pnas 81:6466
‑
6470(1984);以及samulski等人,j.virol.63:03822
‑
3828(1989)。
[0246]
目前至少有六种病毒载体方法可用于临床试验中的基因转移,这些方法利用涉及通过插入辅助细胞系的基因对缺陷载体的互补以生成转导因子的程序。
[0247]
plasn和mfg
‑
s是已用于临床试验的逆转录病毒载体的实例(dunbar等人,blood 85:3048
‑
305(1995);kohn等人,nat.med.1:1017
‑
102(1995);malech等人,pnas 94:22 12133
‑
12138(1997))。pa317/plasn是在基因治疗试验中使用的第一种治疗载体。(blaese等人,science 270:475
‑
480(1995))。已观察到mfg
‑
s包装载体的转导效率为50%或更高。(ellem等人,immunol immunother.44(1):10
‑
20(1997);dranoff等人,hum.gene ther.1:111
‑
2(1997)。
[0248]
重组腺相关病毒载体(raav)是一种有前景的替代性基因递送系统,它基于有缺陷的非致病性细小病毒即2型腺相关病毒。所有载体均源自仅保留转基因表达盒侧翼的aav 145bp反向末端重复序列的质粒。由于整合到经转导的细胞的基因组中引起的有效基因转移和稳定转基因递送是该载体系统的关键特征。(wagner等人,lancet 351:9117 1702
‑
3(1998),kearns等人,gene ther.9:748
‑
55(1996))。也可以使用其它aav血清型,以非限制性实例而言包括aav1、aav3、aav4、aav5、aav6、aav8、aav 8.2、aav9和aav rh10和假型aav,诸如aav2/8、aav2/5和aav2/6。
[0249]
aav可以通过多种不同的方法以临床规模制造。可以使用的系统的实例包括(1)哺乳动物细胞中的质粒dna转染,(2)稳定哺乳动物细胞系的ad感染,(3)用重组单纯性疱疹病毒(rhsv)感染哺乳动物细胞,以及(4)用重组杆状病毒感染昆虫细胞(sf9细胞)(综述参见penaud
‑
budloo等人(2018)mol ther methods clin dev.8:166
–
180)。
[0250]
复制缺陷型重组腺病毒载体(ad)可以高滴度产生,并且容易感染多种不同的细胞类型。大多数腺病毒载体经工程改造,使得转基因替代ad e1a、e1b和/或e3基因;随后,复制缺陷型载体在人293细胞中繁殖,所述细胞反式提供缺失基因的功能。ad载体可以在体内转导多种类型的组织,包括非分裂的、分化细胞,诸如肝脏、肾脏和肌肉中发现的那些细胞。常规的ad载体具有较大的承载能力。在临床试验中使用ad载体的实例涉及通过肌内注射进行抗肿瘤免疫接种的多核苷酸疗法(sterman等人,hum.gene ther.7:1083
‑
9(1998))。在临床试验中使用腺病毒载体进行基因转移的其它实例包括rosenecker等人,infection 24:1 5
‑
10(1996);sterman等人,hum.gene ther.9:71083
‑
1089(1998);welsh等人,hum.gene ther.2:205
‑
18(1995);alvarez等人,hum.gene ther.5:597
‑
613(1997);topf等人,gene ther.5:507
‑
513(1998);sterman等人,hum.gene ther.7:1083
‑
1089(1998)。
[0251]
包装细胞用于形成能够感染宿主细胞的病毒颗粒。此类细胞包括包装腺病毒的293细胞和包装逆转录病毒的ψ2细胞或pa317细胞。基因治疗中使用的病毒载体通常由生产细胞系生成,该生产细胞系将核酸载体包装到病毒颗粒中。载体通常含有包装和随后整合到宿主中(如果适用)所需的最小病毒序列,其它病毒序列被编码待表达的蛋白质的表达盒替代。缺失的病毒功能由包装细胞系反式提供。例如,基因治疗中使用的aav载体通常仅具有来自aav基因组的反向末端重复(itr)序列,这些序列是包装和整合到宿主基因组中所需的。将病毒dna包装在细胞系中,该细胞系含有编码其它aav基因即rep和cap的辅助质粒,但缺少itr序列。所述细胞系也用作为辅助因子的腺病毒感染。辅助病毒促进aav载体的复制和来自辅助质粒中的aav基因的表达。由于缺少itr序列,辅助质粒未大量包装。可以通过例如腺病毒比aav更敏感的热处理来减少腺病毒的污染。
[0252]
在许多基因治疗应用中,期望基因治疗载体以高度特异性递送至特定组织类型。因此,可以通过使配体表达为与病毒外表面上的病毒外壳蛋白的融合蛋白将病毒载体修饰为对给定细胞类型具有特异性。选择对已知存在于目标细胞类型上的受体具有亲和力的配体。例如,han等人,proc.natl.acad.sci.usa 92:9747
‑
9751(1995),报道称可以将moloney鼠白血病病毒修饰为表达与gp70融合的人调蛋白(heregulin),并且重组病毒感染某些表达人表皮生长因子受体的人乳腺癌细胞。这一原理可以扩展到其它病毒
‑
靶细胞对,其中靶细胞表达受体而病毒表达包含细胞表面受体的配体的融合蛋白。例如,可以将丝状噬菌体工程改造为展示对几乎任何选择的细胞受体都具有特异性结合亲和力的抗体片段(例如,fab或fv)。虽然以上描述主要适用于病毒载体,但同样的原理也适用于非病毒载体。可以将此类载体工程改造为含有有利于特定靶细胞摄取的特定摄取序列。
[0253]
可以通过施用给单独患者体内递送基因治疗载体,通常通过全身施用(例如,静脉内、腹膜内、肌肉内、皮下或颅内输注)或局部施加,如下所述。可替代地,可以将载体递送至离体细胞,诸如从单个患者移出的细胞(例如,淋巴细胞、骨髓抽吸物、组织活检)或万能供体造血干细胞,接着通常在选择已并入了所述载体的细胞之后将所述细胞重新植入患者体内。
[0254]
含有核酸酶和/或供体构建体(表达构建体)的载体(例如,逆转录病毒、腺病毒、脂质体等)也可以直接施用于生物体进行体内细胞转导。可替代地,可以施用裸dna。施用是通过通常用于将分子引入与血液或组织细胞的最终接触的任何途径,包括但不限于注射、输注、局部施加和电穿孔。施用此类核酸的合适方法是可用的并且为本领域技术人员众所周
知,并且虽然可以使用不止一种途径施用特定组合物,但特定途径常常可以提供比另一途径更直接和更有效的反应。
[0255]
适合引入本文所述的多核苷酸的载体包括非整合慢病毒载体(idlv)。参见,例如,ory等人(1996)proc.natl.acad.sci.usa 93:11382
‑
11388;dull等人(1998)j.virol.72:8463
‑
8471;zuffery等人(1998)j.virol.72:9873
‑
9880;follenzi等人(2000)nature genetics 25:217
‑
222。
[0256]
药学上可接受的载剂部分取决于所施用的特定组合物,以及用于施用该组合物的特定方法。因此,有多种合适的药物组合物制剂可用,如下所述(参见,例如,remington’s pharmaceutical sciences,第17版,1989)。
[0257]
显然可以使用相同或不同的系统递送编码核酸酶的序列和供体构建体。例如,供体多核苷酸可由质粒携带,而所述一种或多种核酸酶可由aav载体携带。此外,不同的载体可以通过相同或不同的途径施用(肌内注射、尾静脉注射、其它静脉内注射、腹腔内施用和/或肌内注射。载体可以同时递送或以任何先后顺序递送。
[0258]
离体和体内施用的制剂包括呈液体形式的悬浮液或乳化液体。活性成分常常与药学上可接受且与活性成分相容的赋形剂混合。合适的赋形剂包括例如水、盐水、葡萄糖、甘油、乙醇等及其组合。另外,所述组合物可含有少量辅助物质,诸如润湿剂或乳化剂、ph缓冲剂、稳定剂或增强药物组合物的有效性的其它试剂。
[0259]
应用
[0260]
本文公开的方法考虑了对法布里病(例如溶酶体贮积病)的治疗和/或预防。治疗可以包括将疾病相关的矫正gla转基因插入细胞中的安全港基因座(例如白蛋白)中以表达所需的酶并释放到血流中。编码α
‑
gala的矫正转基因可以编码野生型蛋白质或经修饰的蛋白质;和/或可以包含密码子优化的gla转基因;和/或其中表位可以去除而不改变蛋白质功能的转基因。在一些情况下,所述方法包括将表达编码α
‑
gala的转基因的游离体插入细胞中以表达所需的酶并释放到血流中。插入分泌细胞诸如肝细胞中以将产物释放到血流中是特别有用的。所述方法和组合物还可用于其中期望在造血干细胞中提供编码一种或多种治疗剂的gla转基因,使得源自(起源于)这些细胞的成熟细胞(例如,rbc)含有治疗性α
‑
gala蛋白的任何情况。这些干细胞可以在体外或体内分化,并且可以源自可用于所有患者的万能供体类型的细胞。另外,这些细胞可以含有跨膜蛋白来运输体内的细胞。治疗还可以包括使用含有治疗性转基因的患者细胞,其中细胞离体发育,然后将其重新引入回患者体内。例如,可以经由骨髓移植将含有合适的编码α
‑
gala的转基因的hsc插入患者体内。可替代地,也可以将已经使用编码α
‑
gala的转基因进行编辑的干细胞诸如肌肉干细胞或ipsc注射到肌肉组织中。
[0261]
因此,该技术可用于其中患者由于问题(例如,表达水平方面的问题或表达为亚功能或无功能的蛋白质的问题)而在一些蛋白质中有缺陷的情况。特别有用的是转基因的表达以矫正或恢复患有法布里病的受试者的功能。
[0262]
通过非限制性实例而言,实现了生产功能性α
‑
gal a蛋白以替代有缺陷或缺失的α
‑
gal a蛋白的不同方法并用于治疗法布里病。可以将编码蛋白质的核酸供体插入安全港基因座(例如白蛋白或hprt)中并使用外源启动子或使用存在于安全港的启动子表达。特别有用的是在肝脏细胞中的白蛋白基因座中插入gla转基因,其中gla转基因还包含编码信号
肽的序列,该信号肽介导表达的α
‑
gal a蛋白从肝脏细胞分泌到血流中。可替代地,可以使用供体来原位矫正有缺陷的基因。可将期望的编码α
‑
gala的转基因插入cd34+干细胞中并在骨髓移植期间返回到患者体内。最后,可以将核酸供体插入cd34+干细胞的β珠蛋白基因座处,使得源自该细胞的成熟红细胞具有高浓度的由核酸供体编码的生物制品。然后含有生物制品的rbc可以经由跨膜蛋白(例如受体或抗体)靶向正确的组织。另外,rbc可以经由电致敏化离体致敏,使它们在暴露于能量源后更容易受到破坏(参见wo2002007752)。
[0263]
在一些应用中,可以通过使用本文所述的方法和组合物敲除内源基因。这方面的实例包括敲除异常基因调节子或异常疾病相关基因。在一些应用中,异常内源基因可以在功能上或原位被该基因的野生型型式替代。还可以改变插入的基因以提高治疗性α
‑
gala蛋白的表达或降低其免疫原性。在一些应用中,插入的编码α
‑
gala的转基因是增加其向选定组织(诸如大脑)的转运的融合蛋白。
[0264]
应当认识到,合适的gla供体不限于以下举例说明的那些,而是包括任何gla转基因。
[0265]
本公开还提供了用于产生携带用于治疗法布里病的α
‑
gala治疗性蛋白质的细胞(例如,rbc)的方法和组合物,所述治疗性蛋白质可以作为同种异体产物普遍用于所有患者。例如,这允许开发用于治疗法布里病患者的单一产品。这些承载体可包含跨膜蛋白以帮助细胞运输。一方面,跨膜蛋白包含抗体,而在其它方面,跨膜蛋白包含受体。
[0266]
在一些实施方案中,gla转基因供体被转染或转导到细胞中以用于转基因的附加体或染色体外维持。在一些方面,gla转基因供体维持在包含调控结构域的载体上以调控转基因供体的表达。在一些情况下,调控转基因表达的调控结构域是所表达的转基因的内源结构域,而在其它情况下,调控结构域是转基因异源的。在一些实施方案中,gla转基因维持在病毒载体上,而在其它实施方案中,其维持在质粒或小环上。在一些实施方案中,病毒载体是aav、ad或lv。在其它方面,包含转基因供体的载体递送至体内合适的靶细胞,使得当转基因供体载体递送至肝细胞时,由转基因供体编码的α
‑
gala治疗性蛋白质释放到血流中。
[0267]
在另一个实施方案中,本公开描述了其中已插入gla转基因的前体细胞(肌肉干细胞、祖细胞或cd34+造血干细胞(hspc)细胞),使得源自这些前体的成熟细胞含有高水平的由转基因编码的α
‑
gala产物。在一些实施方案中,这些前体是诱导多能干细胞(ipsc)。
[0268]
在一些实施方案中,所述方法可以在转基因动物系统体内使用。在一些方面,转基因动物可用于模型开发,其中转基因编码人α
‑
gala蛋白。在一些情况下,转基因动物可以敲除相应的内源基因座,从而允许开发体内系统,在该系统中可以独立研究人蛋白质。此类转基因模型可用于筛选目的,以鉴定可与目标人蛋白质相互作用或修饰目标人蛋白质的小分子或大生物分子或其它实体。在一些方面,将gla转基因整合到选定基因座(例如,高度表达的基因座或安全港基因座)中进入干细胞(例如,胚胎干细胞、诱导多能干细胞、肝干细胞、神经干细胞等)或通过本文所述的任何方法和本领域中的标准方法获得的非人动物胚胎中,然后将胚胎植入,使得活体动物出生。然后将动物饲养至性成熟并使其产生后代,其中至少一些后代包含整合的gla转基因。
[0269]
在任何前述实施方案中,所述方法和化合物可以与其它治疗剂组合用于治疗患有法布里病的受试者。在一些实施方案中,所述方法和组合物包括使用分子伴侣(hartl等人(2011)nature 465:324
‑
332)以确保法布里蛋白的正确折叠。在一些方面,所述伴侣可以选
自众所周知的伴侣蛋白,诸如at1001(benjamin等人(2012)mol ther 20(4):717
‑
726)、at2220(khanna等人(2014)plos one 9(7):e102092,doi:10.1371)和migalastat(benjamin等人(2016)genet med doi:10.1038/gim.2016.122)。在一些方面,所述方法和组合物与允许穿过血脑屏障的方法和组合物组合使用。在其它方面,所述方法和组合物与已知阻抑受试者免疫反应的化合物组合使用。
[0270]
还提供了包含如本文所述的核酸酶系统和/或gla供体的试剂盒。所述试剂盒可包含编码一种或多种核酸酶(zfn、zfn对、talen、talen对和/或crispr/cas系统)的核酸,(例如包含在合适的表达载体中的rna分子或zfn、talen和/或crispr/cas系统编码基因)、供体分子、编码单向导rna的表达载体、合适的宿主细胞系、用于执行本文公开的方法的说明等。
[0271]
根据本公开的整体,这些和其它方面对于技术人员来说将是显而易见的。
[0272]
除非本文另有定义,否则连同本公开使用的科学和技术术语应具有本领域普通技术人员通常所理解的含义。下面描述了示例性的方法和材料,但是与本文所述的那些相似或等效的方法和材料也可用于本公开的实践或测试中。在有冲突的情况下,将以包括定义在内的本说明书为准。通常,连同本文所述的心脏病学、医学、药物与药物化学以及细胞生物学使用的命名法和心脏病学、医学、药物与药物化学以及细胞生物学的技术是本领域众所周知和常用的那些。酶促反应和纯化技术根据制造商的说明书进行,如本领域中通常实现的或如本文所述那样。此外,除非上下文另有要求,否则单数术语应包括复数且复数术语应包括单数。在说明书和实施方案的通篇中,词语“具有(have)”和“包含(comprise)”或变形诸如“具有(has)”、“具有(having)”、包含(comprises)”或包括所规定的整数或整数的组,但不排除任何其它整数或整数的组。本文提及的所有出版物和其他参考文献都通过引用整体并入。虽然本文引用了许多文件,但这种引用并不构成承认这些文件中的任何文件形成了本领域公知常识的一部分。如本文所用,术语“大约”或“约”,正如适用于一个或多个目标值那样,是指与规定参考值相似的值。在某些实施方案中,除非另有规定或另外从上下文中显而易见,所述术语是指落入规定参考值任一方向(大于或小于)的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更小的范围内的一系列值。
[0273]
为了更好地理解本发明,列出以下实施例。这些实施例仅用于说明的目的,而并不解释为以任何形式限制本发明的范围。
[0274]
实施例1
[0275]
用变体#4表达构建体治疗的glako小鼠的高血浆α
‑
gal a活性持续3个月
[0276]
将如图1a所示的变体#4表达构建体的样品施用给雄性glako小鼠以评价单次静脉内(iv)剂量后的药效学活性和生物分布。
[0277]
glako雄性小鼠在研究开始时为8
‑
12周龄。动物(n=10
‑
20只雄性/组)在第1天接受包含磷酸盐缓冲盐水(pbs)的配制缓冲液(所述磷酸盐缓冲盐水含有cacl2、mgcl2、nacl、蔗糖和kolliphor(泊洛沙姆)p 188)(对照小鼠))或接受三种剂量水平之一的变体#4表达载体(分别为2.0e+12、5.0e+12或5.0e+13vg/kg;n=10只/组)作为单次200μl尾静脉内施用。监测小鼠3个月。图2中呈现了单独小鼠的药代动力学评价结果(血浆α
‑
gal a活性)并且图3中呈现了组平均(平均值+sd)。如图所示,血浆α
‑
gal a活性与aav/构建体剂量成比例。另外,血浆α
‑
gal a活性达到野生型(非突变)受试者的生理正常值或α
‑
gal a活性的超过300倍。(图3中的*表示由于性能过高而去除了一个离群值)。
[0278]
使用临床规模的制造工艺一次性施用递增量的缺少wpre的aav hgla cdna(变体#4),并且到研究第15天引起血浆α
‑
gala的超生理表达(超过野生型的300倍),耐受良好,并且在注射后3个月稳定。在肝脏、心脏和肾脏中实现了α
‑
gala活性的剂量依赖性增加,gb3/lyso
‑
gb3相应减少。
[0279]
肝脏产生的α
‑
gal a分泌到血流中并被次级组织吸收。图4a示出肝脏裂解物中的组织α
‑
gal a活性。图4b示出肾脏裂解物中的组织α
‑
gal a活性。图4c示出了心脏裂解物中的组织α
‑
gal a活性。
[0280]
实施例2
[0281]
高水平的α
‑
gal a活性导致法布里底物的相应减少
[0282]
将变体#4构建体制剂以0vg/kg、2.0e+12vg/kg、5.0e+12vg/kg或5.0e+13vg/kg的剂量静脉内施用于glako小鼠,以评价小鼠血浆和组织中的法布里底物水平。在给药后第91天尸体剖检时收获组织,并使用lc
‑
ms测定α
‑
gal a底物gb3(同种型c22:0和c24:0)及其脱酰基化形式lyso
‑
gb3的水平。简言之,将组织称重并在组织破坏流体(5%meoh、95%水和0.1%乙酸)中以5ml流体/mg组织的比率机械破碎。然后将10μl血浆或组织浆液添加到硅化管中的90μl沉淀溶剂(有内标n
‑
二十三酰神经酰胺三己糖苷(c23:0,matrya)掺入溶液中的meoh),涡旋并于室温下放置在振荡板上30分钟。然后将样品离心,并将10μl样品添加到玻璃lc
‑
ms小瓶中的90μl单一空白基质(dmso/meoh 1:1+0.1%fa)中。分析样品的gb3链长24:0(这是glako小鼠中存在的主要gb3种类),并根据由神经酰胺三己糖苷(gb3,matreya)组成的标准曲线进行测量。
[0283]
使用作为内标的葡糖基鞘氨醇(matreya)和溶血神经酰胺三己糖苷(lyso
‑
gb3,matreya)以类似的方式测量球三糖神经鞘氨醇(globotriaosylsphingosine)(lyso
‑
gb3)以创建标准曲线。如图例所示,数据代表9至20只动物/组的平均值+sd。经由质谱法测量选定的鼠血浆和组织中的法布里底物球三糖基神经酰胺(globotriaosylceramide)(gb3)。
[0284]
α
‑
gal a的持续产生应该能够减少和潜在清除法布里病底物gb3和lyso
‑
gb3。如图5a和图5b所示,在血浆、肝脏、心脏、肾脏和脾脏中发现法布里底物gb3和lyso
‑
gb3水平的剂量相关降低。如图5b所示,与制剂对照组中的动物样品相比,高剂量组中的大多数动物样品的组织gb3水平降低80%或更多。
[0285]
如图6a所示,在高剂量水平下,心脏和肾脏中的gb3水平降低至未治疗动物的约10%。如图6b所示,在受治疗的受试者中,gb3水平低于定量下限水平。
[0286]
实施例3
[0287]
变体#21表达载体在体外和体内产生血浆α
‑
gal a活性。
[0288]
在用变体#4或变体#21表达载体转导后,在各种小鼠、食蟹猴和人原代细胞和细胞系中评估分泌的人α
‑
gal a的水平和活性。变体#4或变体#21表达载体是在1)hek293细胞或2)sf9昆虫细胞系中产生的。
[0289]
使用标准技术并如美国公开号20180117181中所述转导hepg2细胞和ipsc来源的肝细胞(icell肝细胞)。简言之,将细胞以每孔不同的密度接种并以范围为100,000至600,000vg变体#21表达构建体或变体#4表达构建体/个细胞的感染复数(moi)转导。在第3天至第7天收集上清液样品并通过α
‑
gal a荧光活性测定和在研究结束时(第6天或第7天)收集的细胞沉淀中评估α
‑
gal a酶活性。
[0290]
cdna方法可以包括使用aav递送的表达构建体,该表达构建体包含与haat启动子连接的apoe增强子(okuyama等人(1996)hum gene ther 7(5):637
‑
45)、hbb
‑
igg内含子(一种嵌合内含子,由人β珠蛋白基因的第一个内含子的5'
‑
供体位点及免疫球蛋白基因重链可变区的内含子的分支和3'
‑
受体位点组成)、信号肽、编码序列(其中该编码序列任选地经密码子优化)和牛生长激素(例如,bgh或spa51)聚a信号序列。
[0291]
将hepg2/c3a细胞(也称为“hepg2”细胞)(atcc,crl 10741)维持在含有厄尔平衡盐(earle’s salts)和l谷氨酰胺(corning)以及10%胎牛血清(fbs)(life technologies)和1x青霉素链霉素谷氨酰胺(life technologies)的最小必需培养基(mem)中并在37℃和5%co2下孵育。细胞每3至4天传代一次。
[0292]
对于转导,将细胞冲洗并用0.25%胰蛋白酶/2.21mm edta(corning)进行胰蛋白酶处理,然后使其重悬于生长培养基中。将一小等分试样与台盼蓝溶液0.4%(w/v)按1:1混合在磷酸盐缓冲盐水(pbs;corning)中并在tc20自动细胞计数器(bio rad)上计数。将细胞以2e5/ml的密度重悬于生长培养基中,并以每孔0.5ml培养基中1e5接种到24孔板(corning)中。将重组aav2/6颗粒以适当的感染复数(moi)与生长培养基混合并添加到细胞中。gla cdna构建体的moi为3e4、1e5、3e5或1e6 vg/个细胞。
[0293]
转导后,将细胞留在培养物中6
‑
10天。在第3、5、7和10天(如果适用)收集上清液并更换为新鲜培养基。在最后的上清液收集步骤之后,如上所述将细胞进行胰蛋白酶处理并重悬,然后离心以产生细胞沉淀,用pbs洗涤,并于
‑
80c储存。
[0294]
使用合成底物4
‑
甲基伞形酮
‑
α
‑
d
‑
吡喃半乳糖苷(4mu
‑
α
‑
gal,sigma)在荧光测定法中评估α
‑
gala活性。
[0295]
简言之,将10微升hepg2细胞培养上清液与溶解在磷酸盐缓冲液(0.1m柠檬酸盐/0.2m磷酸盐缓冲液,ph 4.6,1%triton x
‑
100)中的40μl 5mm 4mu
‑
α
‑
gal混合。将反应物在37℃下孵育,并通过添加100μl 0.5m甘氨酸缓冲液(ph 10.3)终止。通过使用spectramax gemini xs荧光读数器(molecular devices,sunnyvale ca)测量荧光(ex365/em450)来确定4甲基伞形酮(4mu)的释放。
[0296]
使用4mu的连续2倍稀释液生成标准曲线。所得数据用对数对数曲线拟合;使用该最佳拟合曲线计算试样中4mu的浓度。将酶活性表示为每ml细胞培养上清液每小时测定孵育时间释放的nmol 4mu(nmol/hr/ml)。
[0297]
转到图7a和图7b,变体#21表达构建体在体外具有比aav gla变体#4表达载体提高的α
‑
gal a效力。如图7a所呈现,在hepg2细胞中,上清液中的α
‑
gal a活性增加约4倍至约9倍。如图7b所呈现,在ipsc来源的人肝细胞中,上清液中的活性增加约3倍至约5倍。
[0298]
将编码人gla cdna(hgla)的附加型aav(血清型2/6)载体以不同剂量施用于动物,所述载体由缺少(变体#4)或包括突变wpre序列(变体#21)的肝脏特异性启动子驱动。图8显示在用2.0e+12vg/kg或5e+11vg/kg剂量的变体#21构建体或用2.0e+12vg/kg或5e+11vg/kg剂量的变体#4构建体或用配制缓冲液处理的野生型小鼠血浆中gla a活性随构建体剂量增加而增加。结果表明,野生型小鼠的血浆活性在28天内提高约7倍至约9倍。
[0299]
在野生型c57bl/6小鼠中使用两种不同的aav剂量(携带cdna供体的aav)的1个月研究中,将表达构建体变体#4与包括wpre序列的cdna构建体(变体#21)进行比较。上表1示出了所用构建体的完整序列。包含具有wpre序列的cdna的构建体在研究第28天产生的血浆
α
‑
gala活性水平比施用相同剂量的初始(不含wpre的)cdna的小鼠平均高7倍。
[0300]
与变体#4(不包括wpre)相比,使用变体#21(包括wpre的构建体)观察到经处理的hepg2细胞上清液中gla活性增加4至9倍,并且与变体#4(不包括wpre)相比,使用变体#21(包括wpre的构建体)观察到源自诱导多能细胞(icell)的肝细胞上清液中gla活性增加3至5倍。另外,与变体#4(不包括wrpe)相比,在用变体#21(包括wrpe的构建体)处理的小鼠中观察到血浆gla活性增加7至9倍。
[0301]
在这些研究中观察到的高水平α
‑
gala活性,以及伴随glako小鼠模型关键组织中积聚的gb3/lyso
‑
gb3显著减少,证明aav介导的肝细胞靶向在受试者中产生治疗水平的人α
‑
gala,包括经由允许快速有效地生产治疗性载体的临床规模的制造过程。
[0302]
治疗水平的用于治疗法布里病的α
‑
gal a蛋白是使用cdna方法(包括按照表达载体的临床规模生产)在体内生成的。
[0303]
下面图9和表3中呈现的结果证明变体#21表达构建体在体内产生高达生理正常值(野生型)1,500倍的血浆α
‑
gal a活性。通过以5.0e+12和5.0e+13vg/kg尾静脉注射向c57bl/6小鼠施用变体#4表达构建体。通过以5.0e+12、5.0e+13和5.0e+14尾静脉注射向c57bl/6小鼠施用变体#21表达构建体(未示出)。在给药前一周和第8、15、22和29天收集血浆样品,稍后通过荧光测定法评价α
‑
gal a酶活性。数据点代表每剂量的平均反应+/
‑
sd。测定定量下限(lloq)为2.5nmol/hr/ml。
[0304]
表3.第29天的血浆α
‑
gal a活性
[0305][0306]
图9说明了c57bl/6小鼠在用5.0e+13vg/kg剂量的变体#21构建体、5.0e+12vg/kg剂量的变体#21构建体、5.0e+13vg/kg剂量的变体#4构建体、5.0e+12vg/kg剂量的变体#4构建体或配制缓冲液处理后29天内的α
‑
gal a血浆活性。
[0307]
与体外数据一致,在施用在hek293细胞对比sf9细胞系统中制造的变体#4表达构建体的动物中血浆和肝脏gla水平更高(高达21倍)。
[0308]
实施例4
[0309]
用变体#4表达载体处理在glako小鼠和非人灵长类动物中导致高水平的肝细胞转导
[0310]
为了评价静脉内施用变体#4表达构建体后肝细胞中表达构建体拷贝的水平,通过basescope
tm
原位杂交(ish)评价来自动物亚组的福尔马林固定的石蜡包埋(ffpe)肝脏样品。ish染色后,用halo
tm
软件进行定量图像分析。靶向非编码序列。管家基因探针ppib(亲环蛋白b)用作样品qc的阳性对照标志物并评价组织样品中的rna质量。细菌基因dapb用作阴性对照。获得所有样品的半定量分数(0
‑
4级)以评估样品质量并确定qc通过/失败。样品的
ppib(亲环蛋白b;管家基因控制)分数主要为3,表明rna质量良好。dapb(细菌基因控制)分数大多为0,表明没有或可忽略非特异性背景。将特异性dna染色信号鉴定为细胞核中的黑色(红色)点状点。将样品用吉尔苏木精(gill’s hematoxylin)复染,显示为浅灰色(蓝色)。
[0311]
图10中呈现了施用5.0+13vg/kg变体#4表达载体的glako小鼠的肝脏在不同放大倍数下的代表性ish图像。图11中呈现了施用6.0+13vg/kg变体#4表达载体的nhp的肝脏ish染色在不同放大倍数下的代表性图像。将特异性dna染色信号鉴定为细胞核中的黑灰色点状点。将样品用吉尔苏木精浅灰色复染。如图所示,57.5%的小鼠肝细胞对表达载体呈阳性,有2.34个点/细胞,并且在图10的代表性样品中h分数为126.82。令人印象深刻的是,72.9%的nhp肝细胞对表达构建体呈阳性,有3.20个点/细胞,并且在图11的代表性样品中h分数为175.39。
[0312]
总体而言,对于评估的包括阳性细胞%、平均点数/细胞和h分数在内的所有参数而言,观察到小鼠肝脏细胞中的剂量反应关系。为了确定h分数,基于每个细胞的点数将细胞分为5个区间,然后根据加权公式通过合计每个区间中的细胞百分比来计算。
[0313]
图12a中示出了用2e+12vg/kg、5e+12vg/kg、5e+13vg/kg剂量的变体#4构建体或用作为对照的配制缓冲液处理的glako小鼠中含有hgla cdna的glako小鼠肝细胞的百分比。图12c中示出了单独受试者中含有hgla cdna的肝细胞的百分比。类似地,图12b是说明了用6e+12vg/kg、1e+13vg/kg、3e+13vg/kg、6e+13vg/kg剂量的变体#4构建体或用作为对照的配制缓冲液处理的食蟹猴nhp中含有hgla cdna的肝细胞的百分比的图表。图12d示出了单独nhp受试者的含有hgla cdna的肝细胞的百分比。
[0314]
测量肝脏中的hgla dna构建体水平的原位杂交研究显示了小鼠和nhp肝细胞中的剂量
‑
反应关系并证实了dna向细胞核的转移。在小鼠中高剂量(5.0e+13vg/kg)得到28%至58%范围的阳性染色细胞,并且在nhp研究中高剂量(6.0e+13vg/kg;有免疫抑制)得到61%至73%范围的阳性染色细胞。另一种nhp(无免疫抑制)得到49%的阳性染色细胞。
[0315]
实施例5
[0316]
一次性静脉内施用变体#4表达构建体后食蟹猴nhp中的α
‑
gal a蛋白和酶活性
[0317]
在nhp中评价变体#4表达构建体的药理学和毒理学作用。以0(n=2)、6.0e+12、1.0e+13、3.0e+13或6.0e+13vg/kg向雄性食蟹猴(n=3只/组)施用单次静脉内剂量的变体#4表达构建体。为了减轻对表达载体和/或人α
‑
gal a的可能免疫反应,动物在表达构建体施用前接受利妥昔单抗(10mg/kg;静脉内)并且在整个研究期间每天接受甲基泼尼松龙(10mg/kg;肌内)。另一组以最高剂量(6.0e+13vg/kg)接受变体#4表达构建体,但未接受免疫抑制施用。使用的变体#4表达构建体是在gmp临床制造过程中使用杆状病毒/sf9细胞平台制造的。
[0318]
在给药前(5个时间点)和第7、14、21、28、35、42、49和56天收集血液并加工成血浆。评估这些血浆样品中的人α
‑
gal a蛋白水平和α
‑
gal a活性。在第56天尸体检剖时,收集4个肝脏区段(左右侧叶各2个区段)和2个脾脏区段,用于评估α
‑
gal a活性。结果示于图13a至图13f。
[0319]
通常到第7天检测循环α
‑
gal a蛋白质水平和血浆α
‑
gal a活性,蛋白质水平和活性在第7天至第21天之间达到峰值,并且没有明确的剂量反应。与施用具有免疫抑制的变体#4表达构建体的动物相比,施用无免疫抑制的变体#4表达构建体的动物通常具有较低水
平的α
‑
gal a蛋白质和活性。这种强剂量反应的缺少及α
‑
gal a活性和蛋白质水平的清除与针对人α
‑
gal a(一种施用给动物的人蛋白)的新兴免疫反应一致,正如通过抗人α
‑
gal a抗体的存在所确认的那样。尽管人α
‑
gal a水平降低,但一些动物仍维持高水平的人α
‑
gal a(活性和蛋白质)。在一只高剂量动物(6.0e+13is)中,在第56天测得的水平为193nmol/hr/ml,而在经媒介物处理的动物中无法检测到水平(<10nmol/hr/ml)。在一些动物中这种反应的瞬时性很可能与对人α
‑
gal a酶(施用给动物的人蛋白)的预期免疫反应有关。
[0320]
另外,在nhp研究中通过qpcr方法评价了用于载体脱落分析的样品。在一些经变体#4处理的动物的唾液、尿液和粪便中测量到低水平的hgla载体,直到第4天(尿液)或第14天(唾液、粪便)。在第60天,在这些生物流体中未检测到hgla载体水平。
[0321]
实施例6
[0322]
nhp肝脏中的hgla和相应mrna水平
[0323]
在用6.0e+12vg/kg、1.0e+13vg/kg、3.0e+13vg/kg、6.0e+13vg/kg、6.0e+13vg/kg剂量的不含免疫抑制剂的变体#4构建体或用配制缓冲液处理后第60天,对来自单独动物的nhp肝脏样品中的hgla和相应mrna水平进行蛋白质印迹分析。如图14所示,在大多数样品中,hgla蛋白质水平随构建体剂量增加而蛋白质水平与mrna水平相关。
[0324]
实施例7
[0325]
变体#21表达构建体在人中的安全性、耐受性和药效学评估
[0326]
将进行一项研究以评估变体#21表达构建体在人中的安全性和耐受性。另外,还将测量α
‑
gal a的药效学及其底物在血浆、尿液和组织中的存在情况。也可以评价随时间推移,变体#21表达构建体对接受ert的受试者的ert施用、肾功能、免疫反应和病毒载体dna脱落的影响。
[0327]
总体而言,变体#21表达构建体和变体#4表达构建体在法布里病小鼠模型(glako)、野生型(c56bl/6)小鼠和食蟹猴nhp中耐受良好。在glako小鼠中,没有与单次静脉内施用高达5.0e+13vg/kg(测试的最高剂量水平)的变体#4表达构建体相关的不利发现。在c57bl/6小鼠中,初步分析显示变体#21表达构建体在高达测试的最高剂量1.5e+14vg/kg时耐受良好。在nhp中,变体#21表达构建体相关发现仅限于未接受免疫抑制治疗的动物(6.0e+13vg/kg)。这些发现由淋巴组织和脾脏中的淋巴细胞性增加组成,并且可能和与hgla和/或raav2/6施用有关的免疫反应一致。在这些研究中,未观察到副作用的水平(noael)为6.0e+13vg/kg,无论是否用免疫抑制方案,这都是测试的最高剂量水平。
[0328]
该研究使用编码人α
‑
gal a的cdna的重组(例如,raav2/6)载体构建体。该载体构建体编码肝脏特异性启动子,并且raav2/6表现出肝脏嗜性,因此在单次剂量施用后提供了在法布里病受试者中肝脏长期稳定产生α
‑
gal a的潜力。可以使用各种aav血清型,包括aav2、5、6和8。选择raav2/6血清型用于这里以及上面描述的基于先前的nhp数据的实例,所述数据显示aav2/6主要是嗜肝性的,与aav2/8具有相似的生物分布,并且aav2/6和aav2/8载体产生相似水平的循环fix转基因表达。在其中3项研究试验中,从13名给药研究产品的受试者中收集了初步临床安全性数据,并且表明这种aav2/6血清型的输注耐受良好(数据未示出)。
[0329]
在静脉内施用了编码hgla cdna的raav2/6的法布里病小鼠模型中的研究显示生成治疗水平(超过野生型的300倍)的α
‑
gal a。用表达载体进行的一次性处理将输注相关反
应的发生率降至最低。在人中产生治疗水平的α
‑
gal a可以减少和潜在地清除法布里病底物gb3和lyso
‑
gb3,并且可以降低由于酶持续产生而发展出对所产生的酶的抗体的风险,而不是用ert所观察到的峰值和低谷。将变体#21表达构建体设计为在患有法布里病的受试者中提供治疗水平的α
‑
gal a的稳定、长期产生。人体内α
‑
gal a的持续产生可以减少和清除法布里病底物gb3和lyso
‑
gb3。
[0330]
研究评价
[0331]
评价可能包括治疗期间出现的不良事件(teae)的发生率、常规血液学、化学和肝功能、生命体征、ecg和echo、连续甲胎蛋白(afp)测试和肝脏mri(或等效成像)以监测任何肝脏肿块的形成。另外,可以在1年内的特定时间点测量以下各项与基线相比的变化:血浆中的α
‑
gal a活性;血浆中的gb3水平;血浆中的lyso
‑
gb3水平;(或等效ert)输注的频率;通过血液中肌酐水平计算的估计肾小球滤过率(egfr);通过心脏磁共振成像(mri)测量的左心室质量、尿液中的总蛋白及白蛋白与肌酐的比率;在组织中测得的α
‑
gal a和gb3水平;在组织和尿液中测得的底物水平;尿液中肾功能的生物标志物;通过简易疼痛量表(bpi)、止痛药使用频率测得的神经性疼痛;通过胃肠(gi)症状评定量表测量的gi症状;美因茨严重程度评分指数(mssi);通过sf
‑
36问卷测量的患者报告的生活质量(qol)结果;对raav2/6和α
‑
gal a的免疫反应;并且可以通过血液、血浆、唾液、尿液、粪便和精液中的载体基因组水平来测量raav载体清除率。
[0332]
受试者纳入和排除标准
[0333]
研究受试者可以包括≥18岁的患有经典法布里病的男性受试者。应招募患有经典法布里病的男性受试者,以确保任何残留的酶水平不会干扰对cdna转基因产生的酶水平的测量。
[0334]
更具体地,受试者纳入标准可以包括:(1)具有典型法布里病的诊断记录的受试者,所述典型法布里病定义为血浆或白细胞中的α
‑
gal a活性<5%并且具有典型法布里病的以下一种或多种症状特征:i)角膜涡状营养不良,ii)肢端感觉异常,iii)无汗症,iv)血管角质瘤(如果有记录的丛集脐周血管角质瘤,则单独的这种症状就足够了,因为它是经典法布里病的特殊病征体征);(2)正在接受ert(14天[
±
1天]方案)的受试者;或正在接受ert的,其gal a活性>5%的受试者;或ert初治的受试者;或ert伪初治且在同意前的过去6个月内未接受过ert治疗的受试者;(3)对于接受ert的受试者,ert应以稳定的剂量(定义为在同意前6个月内未漏服超过3剂ert)和方案(14天
±
1天,招募前至少3个月)施用;(4)具有指示经典法布里病的突变的受试者(即在数据库,诸如www.dbfgp.org中列出的);(5)α
‑
gal a谷活性低于测定正常范围下限的受试者;(6)≥约18岁的男性受试者;(7)性成熟的受试者必须同意使用避孕套并且从表达构建体施用时到研究治疗施用后至少3份连续精液样品为aav阴性以及研究治疗施用后至少90天,禁止捐精;以及(8)受试者签署书面知情同意书。
[0335]
对于没有记录的诊断性α
‑
gal a活性水平的受试者,应采集血样以测量α
‑
gal a活性水平(在血浆和/或白细胞中)。对于那些接受ert的受试者,必须在他们最后一次ert输注后至少13天(低谷)进行抽血。如果受试者的α
‑
gal a活性水平>5%且受试者正在接受ert,则该酶活性水平可能是由于最后一次ert输注残留的α
‑
gal a活性所致。在这种情况下,如果满足以下三个标准,则可以确认经典法布里病的诊断:
[0336]
a.经典法布里病的两种或更多种以下记录的症状特征:角膜涡状营养不良、肢端
感觉异常、无汗症、血管角质瘤。如果有记录的丛集脐周血管角质瘤,则单独的这种症状就足够了,因为它是经典法布里病的特殊病征体征;
[0337]
b.指示经典法布里病的突变(即在数据库,诸如www.dbfgp.org中列出的);和
[0338]
c.低谷时的α
‑
gal a活性低于测定正常范围的下限。
[0339]
在可筛查时进行法布里病基因测序,以确认受试者在gla基因中具有突变。可以对血液或唾液样品进行该测定。如果可用,可以使用在研究之前获得的基因测序结果。
[0340]
可以在筛查时进行hiv、hav、hbv、hcv和tb测试。诊断出hiv或具有活性hav、hbv、hcv或tb感染证据的受试者可能没有资格参加本研究。
[0341]
可以在筛查时测量aav6的中和抗体水平,以评估受试者预先存在的对aav6的免疫反应。预先存在的aav6中和抗体升高的受试者可能没有资格参加本研究。如果在筛查后3个月内未完成给药,则应重复aav6的血清中和测定。
[0342]
如果可用,则可以使用在研究之前获得的血浆或白细胞中的诊断性α
‑
gal a活性水平结果。对于没有记录的诊断性α
‑
gal a活性水平的受试者,应采集血样以测量α
‑
gal a活性水平(在血浆和/或白细胞中)。对于那些接受ert的受试者,应该在他们最后一次ert输注后至少13天进行抽血。
[0343]
可以获得胸部x光片(也称为胸部pa射线照片)以评价受试者的总体健康状况和研究资格。除非医学上有指示,否则可以使用在研究招募6个月内拍摄的胸部x光片来确定受试者的资格。应对每个受试者进行体格检查并且至少应包括:一般外观,头、眼、耳、鼻和喉(heent);以及心血管、皮肤、呼吸、胃肠道、肌肉骨骼和神经系统。
[0344]
受试者排除标准可包括以下受试者:(1)据现场调查员和医学监测员的意见,已知对ert无反应(例如,接受ert时没有记录到底物水平降低);(2)正在进行米加司他(migalastat)(galafold
tm
)的当前治疗或在知情同意的3个月内进行先前治疗,(3)对aav(例如,aav6)有阳性中和抗体反应,(4)患有据现场调查员和医学监测员的意见预计会损害研究观察期间的安全性或有效性评价的并发疾病;(5)具有≤60ml/min/1.73m2的egfr;(6)纽约心脏协会iii级或更高级别;(7)有通过定量聚合酶链反应(qpcr)测量的甲型肝炎病毒(hav)、乙型肝炎病毒(hbv)、丙型肝炎病毒(hcv)(阴性hcv
‑
dna)或人免疫缺陷病毒(hiv)活动性感染者或有结核病(tb)活动性感染;(8)在知情同意6个月内有诸如继发性脂肪变性、非酒精性脂肪肝炎(nash)和肝硬化、胆管炎、胆道疾病等肝病史;吉尔伯特综合征(gilbert’s syndrome)除外;异常循环afp的受试者;(9)对于接受ert的受试者,在同意前6个月内对ert治疗有近期或持续的超敏反应,据现场调查员和医学监测员的意见对ert有显著输注反应所体现的;(10)通过以下一项或多项确认的肝脏炎症的标志物或肝功能障碍的显性或隐性原因:(i)白蛋白≤3.5g/dl;(ii)总胆红素>正常上限(uln)且直接胆红素≥0.5mg/dl;(iii)碱性磷酸酶(alp)>2.0x uln;(iv)丙氨酸氨基转移酶(alt)>1.5x uln;(11)在过去6个月内有全身(静脉内或口服)免疫调节剂或类固醇使用史(允许局部治疗,例如哮喘或湿疹)(在与医学监测员讨论后可允许偶尔使用全身性类固醇);(12)有使用糖皮质激素进行免疫抑制的禁忌症;(13)有除非黑色素瘤皮肤癌以外的恶性肿瘤病史;(14)有酗酒或滥用药物史;(15)在同意前的最后3个月内参与过先前的研究性介入药物或医疗设备研究(如同railroad试验中的植入式循环记录仪除外);(16)接受过基因治疗产品的先前治疗;(17)已知对st
‑
920制剂的组分过敏;(18)据现场调查员和医学监测员的意见会使受
试者不适合参与研究的任何其它原因
[0345]
伴随药物
[0346]
可以容许所有药物,除具有潜在肝毒性的那些药物外。研究期间不应服用肝毒性剂,诸如双氯芬酸、胺碘酮、氯丙嗪、氟康唑、异烟肼、利福平(rifampin)、丙戊酸、高剂量的对乙酰氨基酚(4
‑
8g/天)等,以及肝毒性草药补充剂,诸如千里光(senecio)/猪屎豆(crotalaria)、茶中的石蚕属植物、浓密常绿阔叶灌丛(chaparral)、金不换(jin bu huan)、麻黄(中草药)等。对于接受ert的受试者,在招募前应以稳定的剂量(定义为在一致前的过去6个月内未漏服超过3剂ert)和方案(14天
±
1天,持续至少3个月前)施用ert。除非受试者进行ert戒断,否则他们在研究期间应按照护理标准继续以稳定的剂量和方案(14天
±
1天)接受ert。
[0347]
剂量队列
[0348]
起始剂量将为5.0e+12vg/kg,并且任何剂量升级到下一剂量水平都将在审查来自前一队列和/或其它使用基于raav2/6的体内疗法的临床试验的数据后,并且基于安全监测委员会(smc)的建议,该委员会可以包括外部主题专家、研究医学监测员和现场调查员(视情况而定)。如本文所用,smc成员将具有适当的医学和科学专业知识,并将提供对研究的安全性监督。另外,根据观测到的给药受试者的酶活性水平和安全性特征,smc可能建议将剂量升级到3.0e+13vg/kg的中间剂量水平,比队列2中的剂量增加3倍而不是增加5倍达到队列3中的5.0e+13vg/kg剂量。也可以考虑约1.0e+14vg/kg的剂量。表4中示出了三个剂量队列。
[0349]
表4.剂量队列
[0350][0351]
*raav=重组腺相关病毒
[0352]
将招募满足所有纳入/排除标准的≥18岁的受试者。在smc审查后,至少两名受试者将分配到3个剂量队列中的每一个队列中,任何队列都可能扩充额外的4名成年受试者,总共多达18名受试者。可以经由静脉内输注施用表达载体。在每个队列中,治疗将交错进行,以致每名随后的受试者在前一名受试者给药后至少约2周之前不能输注。在前一队列中的最后一名受试者给药后至少约4周之前,并且在smc已审查了整个先前队列的安全性数据之前,不可出现剂量升级到下一剂量水平。
[0353]
在研究招募前接受了ert的受试者,除非他们进行ert戒断,否则应在研究期间继续接受ert并且按照护理标准保持目前的剂量和方案(14天
±
1天)。对于接受ert的受试者,将协调酶和底物水平的基线测试,使得可以在上午低谷时在2个单独的场合采集样品,低谷定义为前一次ert输注后14天(+/
‑
1天)。先前将在筛查期间采用另外的时间点,因此,有3个时间点来评估基因治疗施用前低谷时的α
‑
gal a残留水平。这3个样品应在低谷时采集,并且优选在白天的同一时间(例如上午)采集,以将可能影响酶水平的非特异性因素减到最
少。
[0354]
为了将对raav衣壳蛋白的潜在免疫反应减到最少,避免在肝损伤的情况下失去转基因表达并保护肝功能,可以在表达载体输注前约2天开始预防性施用泼尼松或等效皮质类固醇,并且在长达约20周的时期内可以逐渐减量。
[0355]
可以使用注射泵或静脉内输注泵注射表达载体(参见study pharmacy manual)。总体积将取决于受试者的队列分配和基线体重(kg)。当受试者在医院或急症护理机构时,可以通过静脉内导管以受控的速度施用表达载体,同时监测受试者的生命体征(体温、心率、呼吸率和血压),受试者可以在表达载体输注完成后,留观至少24小时。当所有生命体征稳定并且任何不良事件(ae)已消退或根据研究人员的判断认为受试者得以稳定时,受试者可以出院。
[0356]
输注表达载体后,可在第8天;第2、4、6、8、12、16、20、24、28、32、36、40、44、48和52周进行研究就诊。第28、32、40、44和48周的研究就诊进行的评估不需要在临床现场进行评价,因此可以远程进行。ae和伴随药物的评估可以通过电话远程进行。
[0357]
可以在受试者服用泼尼松或等效的皮质类固醇的同时进行肝脏测试(ast、alt、ggt、总胆红素和直接胆红素、alp、ldh、白蛋白和总蛋白水平)以在表达载体输注后约前20周内每周两次监测aav介导的免疫原性,并且可以远程进行。当可能时,用于肝脏测试的血样可以间隔2
‑
4天抽取,第一周除外,可以在第2天和第8天就诊时抽取血样。随后可以在停止免疫抑制后的4周(第21
‑
24周)每周进行一次肝脏测试,之后每月进行一次以配合研究就这(第28
‑
52周)。
[0358]
如果,尽管用泼尼松或等效的皮质类固醇预先治疗,但是有alt升高的证据,则所述剂量的泼尼松或等效皮质类固醇将会继续(泼尼松1mg/kg[最大60mg]或等效物;口服或静脉内注射和/或视情况增加,并且可以每周评估两次肝酶,直到肝酶正常化,然后按照方案进行评估。
[0359]
对于每个队列中的前2名受试者,治疗可以交错进行,以便每名随后的受试者在前一受试者观察至少2周之前不会输注。在前一队列中的2名受试者给药后至少4周之前,并且在smc已审查了先前队列中2名受试者的安全性数据之前,不可出现剂量升级到下一剂量水平。
[0360]
如果满足任何停止规则,则可以暂停给药和剂量升级。
[0361]
通过使用编码人α
‑
gal a的cdna的raav载体,用表达载体进行的治疗可以消除对ert的需要,从而导致法布里病受试者中α
‑
gal a的长期、肝脏特异性表达。与基线相比,将密切监测进行ert戒断的受试者的任何ae、生命体征、安全性实验室评价以及α
‑
gala和底物的水平与基线相比的任何变化。应在4周后考虑ert戒断,以便允许足够的时间进行肝脏靶细胞的转导。将密切监测进行ert戒断的受试者的任何临床症状(包括疲劳和神经性疼痛)、任何ae、生命体征、安全性实验室评价(包括肝功能测试)以及α
‑
gal a和底物(gb3和lyso
‑
gb3)与基线相比的任何变化。ert戒断可由现场调查员在与发起人协商后自行决定,并且应考虑愿意并满足以下标准的受试者:
[0362]
(1)st
‑
920施用后≥4周;
[0363]
(2)病情稳定,并且在现场调查员的判断下可以耐受暂时停止ert;
[0364]
(3)同意增加安全性监测和额外的实验室测试,直到ert戒断随访;
[0365]
(4)ert戒断随访后不需要重新启动ert。然而,可以基于临床情况或根据现场调查员的判断随时重新启动ert。
[0366]
如果先前不成功,可以重复ert戒断,条件是如果受试者愿意,这可以在前一次尝试后至少12周进行,并且可以由现场调查员自行决定并且是在与发起人协商后进行。
[0367]
每个受试者的研究参与持续时间可长达76周,分为长达8周的筛查,长达12周的基线和给药后52周的随访。计划增加9到12个月。应鼓励受试者参加长达4年的额外的单独长期随访研究。
[0368]
如果满足以下任何标准,则应暂停研究招募,并且smc可召开会议就适当的行动方案提出建议:(1)与表达载体制剂至少有合理的因果关系可能性的任何一种3级或更高级别的不良事件;(2)与表达载体制剂至少有合理的因果关系可能性的严重不良事件(sae);(3)人受试者的死亡;(4)恶性肿瘤的发展。
[0369]
治疗期间出现的不良事件(ae)可以总体和按剂量队列进行汇总。对于每个受试者,每个ae的最大报告严重程度可按严重程度等级用于汇总。另外,可以汇总与研究治疗相关的所有sae和ae。对于其它安全性评价,可以汇总每个时间点的数据。可以针对连续参数计算相对于基线值的变化并按时间点汇总。还可以为选定的参数构建移动表。
[0370]
应测量血浆中的α
‑
gal a活性,以评估α
‑
gal a是否正在产生并具有活性。可以对血浆、血清、全血、干血斑、白细胞或其它血液组分进行α
‑
gal a水平测量。对于那些接受ert的受试者,应在低谷期获得样品,低谷期定义为前一次施用ert后14天(
±
1天)。也可以在整个研究过程中获得另外的样品,以便我们进一步了解酶的药代动力学,并确保在ert之前获得的样品处于低谷期。
[0371]
gb3是在法布里病中由于α
‑
gal a缺乏而在血管、组织和器官中积聚的一种类型的鞘糖脂。在该研究的整个过程中,可以测量血浆、尿液和其它组织中的gb3水平,以评价施用治疗的影响和α
‑
gal a水平。对于那些接受ert的受试者,应在低谷期获得样品,低谷期定义为前一次施用ert后14天(
±
1天)。
[0372]
lyso
‑
gb3是底物gb3的可溶性形式。在该研究的整个过程中,可以测量血浆、尿液和其它组织中的lyso
‑
gb3水平,以评价施用治疗的影响和α
‑
gal a水平。对于那些接受ert的受试者,应在低谷期获得样品,低谷期定义为前一次施用ert后14天(
±
1天)。
[0373]
在每个采样时间点,α
‑
gal a以及gb3和lyso
‑
gb3水平的实际值和相对于基线的变化可以使用描述性统计进行汇总,并按剂量队列随时间变化绘图。对于进行ert戒断的受试者,可以使用年化总剂量和输注次数来评价和汇总从ert戒断前到ert戒断后ert输注频率和剂量的变化。也可以分析ert戒断的持续时间。在不同样品(血浆、唾液、尿液、粪便和精液)中通过载体基因组测量的aav清除率可以按剂量队列随时间变化绘图。
[0374]
如图1a所示,raav载体包含变体#21hgla表达盒(3321bp),该表达盒包括驱动hgla转基因表达的肝脏特异性调控元件。hgla转基因受来自人载脂蛋白e(apoe)基因的增强子和肝脏控制区以及人α
‑1‑
抗胰蛋白酶(haat)启动子的控制。apoe增强子和haat启动子在肝脏(预期的靶组织)中具有特别高度的活性,但在非肝脏细胞和组织类型中无活性,从而阻止hgla在非靶组织中的表达和活性。经修饰的嵌合内含子(hbb
‑
ighgla转基因包含密码子优化的hglaα
‑
gal a酶。
[0375]
变体#21含有突变形式的土拨鼠肝炎病毒(whv)转录后调控元件(wpremut6)。
wpremut6是一个592bp的dna序列,其含有whv x蛋白的启动子区,接着是截短形式的x蛋白本身,在推定的启动子区和x蛋白开放阅读框的起始密码子中具有点突变,以防止x蛋白表达(mut6)。聚a序列是牛生长激素聚腺苷酸化信号的衍生物。添加wpremut6元件导致α
‑
gal a蛋白产量增加。实际上,与变体#4表达构建体(缺少wpremut6元件)相比,变体#21表达构建体具有更强的效力。
[0376]
变体#21表达构建体可以在含有cacl2、mgcl2、nacl、蔗糖和kolliphor(泊洛沙姆)p 188的磷酸盐缓冲盐水(pbs)中以大约1.0e+13vg/ml配制,以2ml或5ml或10ml等体积装入小瓶中,并在≤
‑
65℃下储存。小瓶具有带翻盖的铝制密封件。
[0377]
可以使用sf9昆虫细胞/重组杆状病毒(sf9/rbv)表达系统将表达构建体raav载体与衣壳血清型aav2/6一起包装。可替代地,可以使用哺乳动物表达系统,例如hek293,将表达构建体raav载体与衣壳血清型aav2/6一起包装。
[0378]
在法布里病小鼠模型、野生型小鼠和食蟹猴nhp中的研究证明了在用变体#21表达载体处理后安全地产生持久且潜在有效水平的α
‑
gal a的可行性。
[0379]
在小鼠中在高达1.5e+14vg/kg的剂量水平下和在nhp中在高达6.0e+13vg/kg的剂量水平下(分别是给予的最高剂量水平),未发现副作用。因此,5.0e+12vg/kg的临床起始剂量得到小鼠中30倍的安全剂量倍数和nhp中12倍的安全剂量倍数的支持。
[0380]
基于在给予了2.0e+12vg/kg的法布里病小鼠中注意到的显著药效学反应,预计在人受试者中在5.0e+12vg/kg的剂量下有可测量的α
‑
gal a水平。
[0381]
本文提及的所有专利、专利申请和出版物据此通过引用整体并入。
[0382]
虽然为了清楚理解的目的已经通过说明和举例的方式相当详细地提供了公开内容,但是对于本领域技术人员而言显而易见的是,可以在不脱离本公开的精神或范围的情况下实践各种变化和修改。因此,前面的描述和实例不应被解释为限制性的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1