药物组合物的制作方法
1.本发明涉及药学领域,特别是涉及用于口服施用的药物组合物,所述药物组合物包含颗粒,其中所述颗粒包含惰性基质、混合物,所述混合物包含非胆汁酸法尼醇x受体(fxr)激动剂,例如2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐、和至少一种粘合剂。本发明还涉及药物组合物,所述药物组合物包含非胆汁酸法尼醇x受体(fxr)激动剂,例如2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸或其药学上可接受的盐、和另一种活性药物成分。本发明还涉及用于制备所述用于口服施用的药物组合物的方法;并且涉及所述药物组合物在制造药物中的用途。
背景技术:
[0002]
核受体构成转录调节蛋白的超家族,这些转录调节蛋白共享结构和功能特性并充当受体,例如类固醇、类维生素a、维生素d、和甲状腺激素(evans等人science[科学]1988,240,889)。所述类法尼醇x受体(fxr)是核激素受体超家族的成员,并且主要在肝、肾和肠中表达(seol等人mol.endocrinol.[分子内分泌学]1995,9,72
‑
85;forman等人cell[细胞]1995,81,687
‑
693)。类法尼醇x受体与类视黄醇x受体(rxr)作为异二聚体发挥作用,并且结合靶基因的启动子中的效应元件,从而调节基因转录。fxr
‑
rxr异二聚体以最高亲和力结合反向重复
‑
1(ir
‑
1)效应元件,其中共有受体结合六聚体被一个核苷酸隔开。fxr是相互关联的过程的一部分,其中fxr被胆汁酸(胆固醇代谢的终产物)激活(makishima等人,science[科学]1999,284,1362
‑
1365;parks等人science[科学]1999,284,1365
‑
1368;wang等人moi.cell.[分子细胞]1999,3,543
‑
553),胆汁酸用于抑制胆固醇分解代谢(urizar等人j.biol.chem.[生物化学杂志]2000,275,39313
‑
39317)。作为针对非酒精性脂肪性肝炎(nash)的治疗剂,已经探索了fxr激动剂。
[0003]
具体的非胆汁酸fxr激动剂2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐,本文中称为化合物(a)。本发明还涉及:
[0004][0005]
wo 2012/087519中第一次披露了所述化合物(第125页的表中的实例1,化合物1
‑
ib),并且它也被称为ljn452,并且它的国际非专有药名(inn)为“卓匹非索(tropifexor)”。所述化合物可以用于治疗fxr介导的疾病或障碍。需要提供商业上可行的药物组合物,所述
药物组合物包含2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐。
[0006]
此外,已经探索了以下类别的化合物或治疗剂,用来介导代谢功能障碍:胰高血糖素样肽1(glp
‑
1)受体激动剂(glp
‑
1ra)和二肽基肽酶
‑
4(dpp4)抑制剂、过氧化物酶体增殖物激活受体(ppar)激动剂、乙酰辅酶a羧化酶(acc)抑制剂、甲状腺激素受体β(trβ)激动剂、酮己糖激酶(khk)抑制剂、二酰基甘油酰基转移酶2(dgat2)抑制剂、以及钠
‑
葡萄糖连接的转运蛋白(sglt)抑制剂。
[0007]
其他相关靶标和药剂包括:抗炎剂(例如趋化因子受体2/5(ccr2/5)拮抗剂)、和抗纤维化剂(例如半乳凝素
‑
3抑制剂以及赖氨酰氧化酶样2(loxl 2)抑制剂)。
[0008]
因为nafld和nash的病理生理学是复杂的,并且可能涉及多个冗余的途径,所以需要提供可以解决这些复杂病症的不同方面同时展示可接受的安全性和/或可容许性特性的针对非酒精性脂肪肝病(nafld)、nash和纤维化/硬化的治疗。
附图说明
[0009]
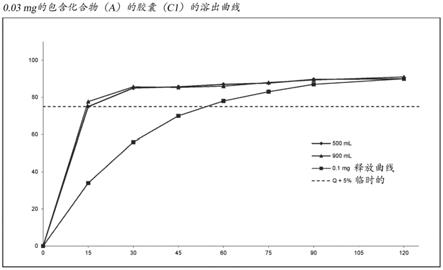
图1显示了包含0.03mg如本文所披露的化合物(a)的胶囊(c1)的溶出曲线(500ml和900ml容器体积)。
[0010]
图2显示了包含0.16mg化合物(a)的胶囊(c2)的溶出曲线(900ml容器体积)。
[0011]
图3显示了相对于干混胶囊配制品,以最低和最高压缩力压缩的包含具有0.03mg的具有如本文所披露的化合物(a)的配制品5(f5)和配制品6(f6)的片剂的溶出曲线(0.1mg释放曲线)。
[0012]
图4显示了相对于干混胶囊配制品,以最低和最高压缩力压缩的包含具有0.03mg的具有如本文所披露的化合物(a)的配制品5(f5)和配制品6(f6)的片剂的溶出曲线(0.1mg释放曲线)。
[0013]
图5显示了乳糖、配制品6(f6)和密封包衣的配制品2(f2s)的常见共混物的xrpd衍射图。
[0014]
图6显示了针对密封包衣的配制品2(f2s)获得的dsc热分析图。
[0015]
图7显示了密封包衣的配制品2(f2s)的粒度分布(psp)。
[0016]
图8显示了包含化合物(a)的密封包衣的片剂配制品的配制品6(f6)的片剂共混物的粒度分布(psp)。
[0017]
图9显示了在5μm下,乳糖(惰性基质不具有化合物(a))的sem分析。
[0018]
图10显示了在5μm下,配制品2(f2)的sem分析。
[0019]
图11显示了在100μm下,配制品2(f2)的sem分析。
[0020]
图12显示了在100μm下,密封包衣的配制品2(f2s)的sem分析。
[0021]
图13显示了在20μm下,配制品2(f2s)的sem分析。
[0022]
图14显示了在20μm下,密封包衣的配制品2(f2s)的sem分析。
[0023]
图15显示了在10μm分辨率下,密封包衣的配制品2(f2s)的表面拉曼映射(surface raman mapping)。
[0024]
图16显示了在20μm分辨率下,密封包衣的配制品2(f2s)的表面拉曼映射。
[0025]
图17显示了比较结晶的和非晶形的化合物(a)与配制品2(f2)中的化合物(a)的拉曼光谱(raman spectra)(0cm
‑
1777cm
‑1范围)。
[0026]
图18显示了在狗体内,不同配制品中的化合物(a)随时间变化的平均血浆浓度。
技术实现要素:
[0027]
针对非胆汁酸fxr激动剂,例如2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐(本文的化合物(a)),设计药物组合物、药物剂型、以及用于制备药物组合物的商业上可行的方法是尤其具有挑战性的。此非胆汁酸fxr激动剂是高度有效的活性药物成分(api),被生物药剂学分类系统分类为iv类化合物,例如差的可溶解和差的可渗透的化合物。此外,此非胆汁酸fxr激动剂是难以配制的,这是由于它的理化特性和它的高效价。以可靠并且稳健的方式找到适合的药物组合物,证明是具有挑战性的。例如,由于它的非常高的效价,所以需要低剂量(亚毫克或微克),产生了不想要的配制问题,例如含量均匀性,以及另外的制造困难,特别是当以更大制造规模实践时。此外制剂,此非胆汁酸fxr激动剂具有低水溶性并且证明很难将化合物与常规赋形剂混合以提供有效组合物(归因于配制品的不稳定、不可预测的溶出速率、以及可变的生物利用度)。因此,需要开发克服上述问题的适合并且稳健的固体药物组合物。
[0028]
鉴于上述困难和考虑,出人意料地发现用来制备稳定的药物组合物的方式,所述稳定的药物组合物允许制备药物组合物,所述药物组合物包含少量的活性化合物,避免了任何含量均匀性或制造问题。
[0029]
在一个方面,本发明涉及用于口服施用的药物组合物,所述药物组合物包含(a)惰性基质,以及(b)混合物,所述混合物包含2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐、和至少一种粘合剂。
[0030]
在一个方面,本发明涉及用于口服施用的药物组合物,所述药物组合物包含颗粒,其中所述颗粒包含(a)惰性基质,以及(b)混合物,所述混合物包含2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐、和至少一种粘合剂。
[0031]
分别单独或组合概述于以下项目中的本发明的各方面、有利特征和优选的实施例有助于解决本发明的目的。
[0032]
项目a1.一种用于口服施用的药物组合物,所述药物组合物包含颗粒,其中所述颗粒包含(a)惰性基质,以及(b)混合物,所述混合物包含2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐、和至少一种粘合剂。
[0033]
项目a2.根据项目a1所述的药物组合物,其中2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐呈非晶形、结晶形式、或其混合物。
[0034]
项目a3.根据项目a1至a2所述的药物组合物,其中2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸是游离形式。
[0035]
项目a4.根据项目a1至a3所述的药物组合物,其中将所述(b)混合物分散到所述(a)惰性基质上,所述混合物包含2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐、和至少一种粘合剂。
[0036]
项目a5.根据项目a1至a3所述的药物组合物,其中将所述(a)惰性基质用所述(b)混合物包衣,所述混合物包含2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐、和至少一种粘合剂。
[0037]
项目a6.根据项目a1至a5中任一项所述的药物组合物,其中所述(a)惰性基质包括选自由以下组成的组的材料:乳糖、微晶纤维素、甘露醇、蔗糖、淀粉、颗粒状亲水性气相法二氧化硅、或其混合物。
[0038]
项目a7.根据项目a1至a6中任一项所述的药物组合物,其中所述粘合剂选自由以下组成的组:聚乙烯吡咯烷酮、羟丙基纤维素、羟丙甲纤维素、羧甲基纤维素、甲基纤维素、羟乙基纤维素、羧基乙基纤维素、羧甲基羟乙基纤维素、聚乙二醇、聚乙烯醇、虫胶、聚乙烯醇
‑
聚乙二醇共聚物、或其混合物。
[0039]
项目a8.根据项目a1至a7中任一项所述的药物组合物,其中所述颗粒进一步包含外部(c)密封包衣层。
[0040]
项目a9.根据项目a1至a8中任一项所述的药物组合物,其中所述外部(c)密封包衣层选自由以下组成的组:羟丙基甲基纤维素、聚乙烯吡咯烷酮、羟丙基纤维素、羧甲基纤维素、甲基纤维素、羟乙基纤维素、羧基乙基纤维素、羧甲基羟乙基纤维素、聚乙二醇、聚乙烯醇、或其混合物。
[0041]
项目a10.根据项目a1至a9中任一项所述的药物组合物,其中任选地在至少一种药学上可接受的赋形剂存在下,将所述颗粒进一步配制成最终剂型,并且其中所述最终剂型是胶囊、片剂、微型片剂、药囊、或直条药包(stickpack)。
[0042]
项目a11.根据项目10所述的药物组合物,其中所述最终剂型是胶囊或片剂。
[0043]
项目a12.根据项目a1至a11中任一项所述的药物组合物,所述药物组合物包含至少一种另外的活性药物成分。
[0044]
项目a13.根据项目a1至a12中任一项所述的药物组合物,其中所述最终剂型包含量为约0.01mg至约2mg的2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐。
[0045]
项目a14.一种用于制备根据项目a1至a13中所限定的用于口服施用的药物组合物的方法,所述方法包括以下步骤:
[0046]
(i)将所述(b)混合物与至少一种粘合剂,以及任选地与至少一种极性质子溶剂混合,所述混合物包含2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐,以及
[0047]
(ii)将所述混合物(i)添加至所述颗粒的所述(a)惰性基质。
[0048]
项目a15.根据项目a14所述的方法,其中所述至少一种极性质子溶剂选自由以下组成的组:有机溶剂、水、或其混合物。
[0049]
项目a16.根据项目a15所述的方法,其中所述有机溶剂选自由以下组成的组:甲醇、乙醇、异丙醇、正丙醇、正丁醇、或其混合物。
[0050]
项目a17.根据项目a16所述的方法,其中所述有机溶剂是乙醇。
[0051]
项目a18.根据项目a14至a17所述的方法,其中在20℃至130℃的温度下去除所述溶剂。
[0052]
项目a19.根据项目a14至a18所述的方法,其中将步骤(i)的所述混合物分散到所述(a)惰性基质上。
[0053]
项目a20.根据项目a14至a18中任一项所述的方法,其中将所述(a)惰性基质用步骤(i)的所述混合物包衣。
[0054]
项目a21.根据项目a14至a20中任一项所述的方法,所述方法进一步包括以下步骤:将外部(c)密封包衣层添加到所述颗粒上。
[0055]
项目a22.根据项目a14至a21中任一项所述的方法,所述方法包括以下步骤:进一步添加至少一种另外的活性药物成分。
[0056]
项目a23.根据项目a14至a22中任一项所述的方法,所述方法进一步包括通过任选地将所述颗粒与至少一种药学上可接受的赋形剂混合,制备所述最终剂型。
[0057]
项目a24.根据项目a14至a23中任一项所述的方法,其中所述至少一种药学上可接受的赋形剂选自由以下组成的组:乳糖、甘露醇、微晶纤维素、磷酸二钙、聚乙烯吡咯烷酮、羟丙基甲基纤维素、交联羧甲基纤维素钠、交聚维酮、淀粉乙醇酸钠、胶态二氧化硅、硬脂酸镁、硬脂酰富马酸钠、或其混合物。
[0058]
项目a25.根据项目a14至a24中任一项所述的方法,其中所述最终剂型被胶囊化或压片。
[0059]
项目a26.一种用于制备悬浮液的方法,所述方法包括将所述(b)混合物与水混合,所述混合物包含2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐、和至少一种粘合剂。
[0060]
项目a27.一种用于制备可分散溶液的方法,所述方法包括将所述(b)混合物与有机溶剂混合,所述混合物包含2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐、和至少一种粘合剂。
[0061]
项目a28.一种固体分散体,所述固体分散体包含2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐、和至少一种粘合剂。
[0062]
项目a29.一种可分散溶液,所述可分散溶液包含2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐、和至少一种粘合剂,所述可分散溶液在有机溶剂中。
[0063]
项目a30.根据项目a1至a13中任一项所述的药物组合物,所述药物组合物用作药
物。
[0064]
项目a31.根据项目a1至a13中任一项所述的药物组合物,所述药物组合物用于治疗胆汁淤积、肝内胆汁淤积、雌激素诱发型胆汁淤积、药物诱发型胆汁淤积、妊娠胆汁淤积、肠外营养相关胆汁淤积、原发性胆汁性肝硬化(pbc)、非酒精性脂肪性肝病(nafld)、非酒精性脂肪性肝炎(nash)、肝硬化、酒精诱发型肝硬化、囊胞性纤维症或肝纤维化,优选原发性胆汁性肝硬化(pbs)或非酒精性脂肪性肝炎(nash)。
[0065]
项目a32.根据项目a1至a13中所限定的用于口服施用的药物组合物用于制造针对以下的药物的用途:胆汁淤积、肝内胆汁淤积、雌激素诱发型胆汁淤积、药物诱发型胆汁淤积、妊娠胆汁淤积、肠外营养相关胆汁淤积、原发性胆汁性肝硬化(pbc)、非酒精性脂肪性肝病(nafld)、非酒精性脂肪性肝炎(nash)、肝硬化、酒精诱发型肝硬化、囊胞性纤维症或肝纤维化,优选原发性胆汁性肝硬化(pbs)或非酒精性脂肪性肝炎(nash)。
[0066]
项目a33.一种用于口服施用的药物组合物,所述药物组合物包含(a)惰性基质,以及(b)混合物,所述混合物包含2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐、和至少一种粘合剂。
[0067]
项目a34.根据项目a1至a13和a33中任一项所述的药物组合物,其中基于2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐的量,所述惰性基质以从约16倍w/w至约6400倍w/w、从约100倍w/w至约3200倍w/w、从约400倍w/w至约1600倍w/w、从约800倍w/w至约1200倍w/w、或从约900倍w/w至约1000倍w/w的量存在。
[0068]
项目a35.根据项目a1至a13、a33和a34中任一项所述的药物组合物,其中基于2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐的量,所述惰性基质以约100倍w/w、约300倍w/w、约500倍w/w、约600倍w/w、约700倍w/w、约800倍w/w、约900倍w/w、约1000倍、约1200倍w/w、或约1500倍w/w的量存在。
[0069]
项目a36.根据项目a1至a13、a33至a35中任一项所述的药物组合物,其中基于2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐的量,所述(b)混合物中的所述至少一种粘合剂以从约0.5倍w/w至约300倍w/w、从约1倍至约150倍w/w、从约10倍w/w至100倍w/w、从25倍w/w至约75倍w/w、或从约40倍w/w至约60倍w/w的量存在。
[0070]
项目a37.根据项目a1至a13、a33至a36中任一项所述的药物组合物,其中所述粘合剂是聚乙烯吡咯烷酮。
[0071]
项目a38.根据项目a1至a13、a33至a37中任一项所述的药物组合物,其中基于2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐的量,所述粘合剂以从约10倍w/w至约100倍w/w、或约50倍w/w的量存在。
[0072]
项目a39.根据项目a1至a13、a33至a38中任一项所述的药物组合物,其中2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环
[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐以相对于所述药物组合物的重量从约0.05%w/w至约2.5%w/w、从约0.07%w/w至约2%w/w、从约0.08%w/w至约1%w/w、从约0.09%w/w至约0.5%w/w、或从约0.1%w/w至约0.25%w/w的量存在。
具体实施方式
[0073]
本发明提供包含含有少量化合物a的化合物a的组合物。在一个实施例中,将包含化合物a的组合物直接加工成最终剂型。
[0074]
在另一个实施例中,至少一种另外的活性药物成分化合物(b)在剂型中与化合物a组合。将化合物(b)通过包含化合物b的组合物引入。化合物b可以是固体或液体。因此,包含化合物b的组合物可以是颗粒、颗粒剂、分散体(固体或液体)、片剂、微型片剂、珠粒、微丸、溶液或其混合物。包含化合物b的组合物可以与包含化合物a的组合物组合,从而形成包含化合物a和b的组合物,然后将其处理成最终剂型。
[0075]
包含化合物a的组合物
[0076]
低剂量的非胆汁酸fxr激动剂,例如2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐(如本文所披露的化合物(a))的有效配制品,证明是困难的。例如,观察到难以衡量少量的非胆汁酸fxr激动剂、含量均匀性、配制品、溶出速率和生物利用度问题。最终,这些问题影响了药物组合物的制造过程和体内性能。
[0077]
出人意料的是,发现可以通过以下克服那些挑战:制备用于口服施用的药物组合物,所述药物组合物包含(a)惰性基质,以及(b)混合物,所述混合物包含非胆汁酸fxr激动剂、和至少一种粘合剂。根据本披露,所述非胆汁酸fxr激动剂是2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐(化合物(a))。
[0078]
在一个方面,本发明的用于口服施用的药物组合物是颗粒剂。
[0079]
在另一个方面,本发明提供了用于口服施用的药物组合物,所述药物组合物包含颗粒,其中所述颗粒包含(a)惰性基质,以及(b)混合物,所述混合物包含化合物(a)(2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐)、和至少一种粘合剂。
[0080]
根据本发明,化合物(a)可以按它的游离形式存在。如本文所述的,化合物(a)还可以按结晶形式、非晶形、或其混合物存在。
[0081]
在另一个方面,本发明还提供了口服施用的药物组合物,所述药物组合物包含(a)惰性基质,以及(b)混合物,所述混合物包含非胆汁酸fxr激动剂、和至少一种粘合剂。根据本披露,所述非胆汁酸fxr激动剂是2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐(化合物(a))。
[0082]
根据本发明,药物组合物包含(a)惰性基质,向所述惰性基质上添加(b)混合物,所述混合物包含化合物(a)、和至少一种粘合剂。(a)惰性基质包含不与以下发生化学反应的材料:(b)混合物,所述混合物包含化合物(a)、和至少一种粘合剂。(a)惰性物质,例如本领
域已知的药学上可接受的赋形剂不与活性物质发生化学的或物理的相互作用。任选地,还可以将(a)惰性基质用层包衣,从而在配制过程期间,保护(a)惰性基质免于可能发生的任何不想要的化学的或物理的相互作用。任选地,还可以用可接受的赋形剂(例如粘合剂)处理(a)惰性基质,从而赋予惰性物质某些令人希望的工艺质量,例如粒度和可流动性。(a)惰性基质可以包括选自由以下组成的组的材料:乳糖、微晶纤维素、甘露醇、蔗糖、淀粉、颗粒状亲水性气相法二氧化硅、酒石酸、或其混合物。优选地,所述材料可以包括选自由以下组成的组的材料:乳糖、微晶纤维素、甘露醇、蔗糖、淀粉、颗粒状亲水性气相法二氧化硅、或其混合物。更优选地,所述材料是乳糖、或甘露醇。基于化合物(a)的量,惰性基质可以按以下量存在:从约16倍w/w至约6400倍w/w、从约100倍w/w至约3200倍w/w、从约400倍w/w至约1600倍w/w、从约800倍w/w至约1200倍w/w、从约900倍w/w至约1000倍w/w。在一个实施例中,基于化合物(a)或其药学上可接受的盐的量,惰性基质按以下量存在:约100倍w/w、约300倍w/w、约500倍w/w、约600倍w/w、约700倍w/w、约800倍w/w、约900倍w/w、约1000倍、约1200倍w/w、约1500倍w/w。
[0083]
对于(a)惰性物质或(b)混合物,适合的粘合剂例如可以选自但不限于由以下组成的组:乙酸纤维素、纤维素脂肪酸酯、纤维素硝酸酯(例如硝酸纤维素、硝酸毛料、硝棉胶)、纤维素醚、乙基纤维素、羧甲基纤维素(例如纤维素钠胶、纤维素胶)、甲基纤维素(例如甲基纤维素醚、泰乐士(tylose))甲基乙基纤维素、甲基羟丙基纤维素、聚乙烯吡咯烷酮、羟丙基纤维素、羟丙甲纤维素(hpmc)、羟乙基纤维素、羧基乙基纤维素、羧甲基羟乙基纤维素、聚乙二醇、聚乙烯醇、虫胶、聚乙烯醇
‑
聚乙二醇共聚物、或其混合物。优选地,所述粘合剂选自由以下组成的组:聚乙烯吡咯烷酮、羟丙基纤维素、羟丙甲纤维素、羧甲基纤维素、甲基纤维素、羟乙基纤维素、羧基乙基纤维素、羧甲基羟乙基纤维素、聚乙二醇、聚乙烯醇、虫胶、聚乙烯醇
‑
聚乙二醇共聚物、或其混合物。更优选地,所述粘合剂是聚乙烯吡咯烷酮(pvp)。
[0084]
基于化合物(a)或其药学上可接受的盐的量,(b)混合物中的至少一种粘合剂可以从约0.5倍w/w至约300倍w/w、从约1倍至约150倍、从约10倍w/w至100倍w/w、从25倍w/w至约75倍w/w、或从约40倍w/w至约60倍w/w的量存在。上述范围适用于如以上列出所有粘合剂。优选地,所述粘合剂是聚乙烯吡咯烷酮。优选地,基于化合物(a)的量,粘合剂以从约10倍w/w至约100倍w/w、从约25倍w/w至约75倍w/w、或从约40倍w/w至约60倍w/w的量存在。更优选地,基于化合物(a)或其药学上可接受的盐的量,粘合剂以约50倍w/w的量存在。
[0085]
根据本发明,可以使用本领域已知的不同技术,将(b)混合物添加到(a)惰性核心上,所述混合物包含化合物(a)、和至少一种粘合剂。例如,可以使用例如以下技术,可以将(a)惰性核心用(b)混合物喷雾或包衣:喷雾干噪、喷雾分层、喷雾分散、喷雾包衣、流化床干燥、流化床包衣、具有喷嘴的造粒机、或它们的那些喷雾技术的组合。优选地,将(b)混合物分散到(a)惰性基质上,所述混合物包含化合物(a)、和至少一种粘合剂。在另一个优选的方面,将(a)惰性基质用(b)混合物包衣,所述混合物包含化合物(a)、和至少一种粘合剂。优选地,将(b)混合物分散或包衣到作为离散颗粒的(a)惰性核心上,所述混合物包含化合物(a)、和至少一种粘合剂,由此提供用于速溶的大表面积,尽管药物的可溶性很差。因此,可以实现化合物(a)的快的溶出速率。
[0086]
根据本发明的方面,如本文定义的颗粒任选地进一步包含外部(c)密封包衣层。外部(c)密封包衣层包含不与以下发生化学反应的材料:(b)混合物,所述混合物包含化合物
(a)、和至少一种粘合剂,并且在配制过程期间,保护(b)如本文定义的混合物免于例如与添加剂、药学上可接受的赋形剂、或任何另外的活性药物成分的可能发生的任何不想要的化学的或物理的相互作用。外部(c)密封包衣层还提供了另外的用于掩味的障碍。外部(c)密封包衣层还可以提供用于胃部(gastric或stomach)释放同时允许肠道(enteric或intestinal)释放的障碍。外部(c)密封包衣层包含例如羟丙基甲基纤维素(hpmc)、硬脂酸镁、聚乙烯吡咯烷酮、羟丙基纤维素、羧甲基纤维素、甲基纤维素、羟乙基纤维素、羧基乙基纤维素、羧甲基羟乙基纤维素、聚乙二醇、聚乙烯醇、邻苯二甲酸乙酸纤维素(cap)、乙酸偏苯三酸纤维素(cat)、羟丙基甲基纤维素邻苯二甲酸酯(hpmcp)、乙酸羟丙基甲基纤维素琥珀酸酯(hpmcas)、聚乙酸乙烯邻苯二甲酸酯(pvap)、甲基丙烯酸甲酯
‑
甲基丙烯酸共聚物、乙酸纤维素琥珀酸酯、脂肪酸、蜡、虫胶、海藻酸钠、玉米素、或其混合物。外部(c)密封包衣层包含例如羟丙基甲基纤维素、硬脂酸镁、聚乙烯吡咯烷酮、羟丙基纤维素、羧甲基纤维素、甲基纤维素、羟乙基纤维素、羧基乙基纤维素、羧甲基羟乙基纤维素、聚乙二醇、聚乙烯醇、或其混合物。优选地,外部(c)密封包衣层包含硬脂酸镁、羟丙基甲基纤维素、或其混合物。更优选地,用于外部(c)密封包衣层的材料是羟丙基甲基纤维素(hpmc)。
[0087]
用于外部(c)密封包衣层的材料可以按基于颗粒的总重量,约0.5%w/w至约6%w/w的量存在。优选地,按基于颗粒的总重量,1%w/w至约5%w/w的量存在。更优选地,按基于颗粒的总重量,约3%w/w的量存在。上述范围适用于如以上列出所有外部(c)密封包衣层材料。
[0088]
根据本发明,颗粒的尺寸对应于如本文所披露的(a)惰性基质,连同包衣的尺寸。例如,颗粒可以具有从约20μm至约500μm的尺寸。优选地,颗粒可以具有从约50μm至400μm的尺寸。更优选地,颗粒可以具有约100μm至约300μm的尺寸。例如,通过激光衍射方法测量粒度(例如粒度分布(psd))。例如,使用本文所披露的仪器和方法测量粒度。
[0089]
本发明的另外的方面提供了一种用于制备用于口服施用的药物组合物的方法,所述方法包括以下步骤:
[0090]
(i)将所述(b)混合物与至少一种如本文定义的粘合剂,以及任选地与至少一种如本文定义的极性质子溶剂混合,所述混合物包含化合物(a)(2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐);和
[0091]
(ii)将所述混合物(i)添加至如本文定义的(a)惰性基质。
[0092]
本发明的另外的方面提供了一种用于制备用于口服施用的药物组合物的方法,所述方法包括以下步骤:
[0093]
(i)将所述(b)混合物与至少一种如本文定义的粘合剂,以及任选地与至少一种如本文定义的极性质子溶剂混合,所述混合物包含化合物(a)(2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐);和
[0094]
(ii)将所述混合物(i)添加至如本文定义的(a)惰性基质,
[0095]
其中当所述极性质子溶剂存在时,在约20℃至约130℃的温度下将其去除。优选地,在约50℃至约110℃的温度下去除极性质子溶剂。更优选地,在约70℃至约100℃的温度下。
[0096]
本发明的另外的方面提供了一种用于制备用于口服施用的药物组合物的方法,所述药物组合物包含如本文定义的颗粒,所述方法包括以下步骤:
[0097]
(i)将所述(b)混合物与至少一种如本文定义的粘合剂,以及任选地与至少一种如本文定义的极性质子溶剂混合,所述混合物包含化合物(a)(2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐);和
[0098]
(ii)将所述混合物(i)添加至如本文定义的颗粒的(a)惰性基质。
[0099]
药物组合物可包含化合物(a),其中化合物(a)相对于药物组合物的总干重以从约0.05%w/w至约2.5%w/w、从约0.07%w/w至约2%w/w、从约0.08%w/w至约1%w/w、从约0.09%w/w至约0.5%w/w、或从约0.1%w/w至约0.25%w/w的化合物(a)存在。例如,相对于组合物的总干重以约0.05%、约0.06%、约0.07%、约0.08%、约0.09%、约0.1%、约0.11%、约0.12%、约0.13%、约0.14%、约0.15%、约0.16%、约0.17%、约0.18%、约0.19%、约0.20%、约0.3%、约0.5%、约1%、约1.5%、约2%或约2.5%w/w。优选地,相对于药物组合物的总干重,化合物(a)以从约0.05%至约0.25%,或从约0.08%至约0.15%w/w存在。
[0100]
至少一种极性质子溶剂包括有机溶剂、水、或其混合物。适合的质子极性有机溶剂可以选自例如但不限于甲醇、乙醇、异丙醇、正丙醇、正丁醇、仲丁醇、异丁醇、叔丁醇、己醇、硝基甲烷、或其混合物。优选地,有机溶剂选自由以下组成的组:甲醇、乙醇、异丙醇、正丙醇、正丁醇、或其混合物。更优选地,质子极性溶剂是水、乙醇、或其混合物。特别地,有机溶剂是乙醇。任选地,在约20℃至约130℃的温度下蒸发至少一种极性质子溶剂。优选地,在约50℃至约110℃的温度下去除至少一种极性质子溶剂。更优选地,在约70℃至约100℃的温度下。
[0101]
本发明的另一个方面涉及一种用于制备用于口服施用的药物组合物的方法,所述药物组合物包含如本文定义的颗粒,所述方法包括以下步骤:
[0102]
(i)将所述(b)混合物与至少一种如本文定义的粘合剂,以及任选地与至少一种如本文定义的极性质子溶剂混合,所述混合物包含化合物(a)(2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐);和
[0103]
(ii)将所述混合物(i)添加至如本文定义的颗粒的(a)惰性基质;
[0104]
其中当所述极性质子溶剂存在时,在约20℃至约130℃的温度下将其去除。优选地,在约50℃至约110℃的温度下去除极性质子溶剂。更优选地,在约70℃至约100℃的温度下。
[0105]
本发明的另一个方面涉及一种用于制备用于口服施用的药物组合物的方法,所述药物组合物包含如本文定义的颗粒,所述方法包括以下步骤:
[0106]
(i)在如本文定义的有机溶剂、水、或其混合物存在下,将所述(b)混合物与至少一种如本文定义的粘合剂混合,所述混合物包含化合物(a)(2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐);和
[0107]
(ii)将所述混合物(i)添加至如本文定义的颗粒的(a)惰性基质。
[0108]
本发明的另一个方面涉及一种用于制备如本文定义的用于口服施用的药物组合物的方法,其中将步骤(i)的混合物分散到(a)惰性基质上。
[0109]
本发明的仍另一个方面涉及一种用于制备如本文定义的用于口服施用的药物组合物的方法,其中将(a)惰性基质用步骤(i)的混合物包衣。
[0110]
本发明的另外的方面涉及一种用于制备如本文定义的用于口服施用的药物组合物的方法,所述方法进一步包括将外部(c)密封包衣层添加到所述颗粒上的步骤。
[0111]
如本文定义的(c)密封包衣层防止颗粒和任何可能用于制备最终剂型的活性的或非活性的物质之间的化学
‑
物理相互作用。
[0112]
本发明的另一个方面涉及一种用于制备用于口服施用的药物组合物的方法,所述药物组合物包含如本文定义的颗粒,所述方法包括例如以下步骤:
[0113]
(i)在乙醇存在下,将所述(b)混合物与至少一种粘合剂混合,所述混合物包含化合物(a),优选地所述粘合剂是聚乙烯吡咯烷酮,从而获得溶液;
[0114]
(ii)将来自步骤(i)的溶液添加到颗粒的(a)惰性基质上,优选地,(a)惰性基质是乳糖或甘露醇;和
[0115]
(iii)任选地,将外部(c)密封包衣层添加到所述颗粒上,优选地,(c)密封包衣层是羟丙甲纤维素(hpmc)。
[0116]
本发明的另一个方面提供了一种用于制备可分散溶液的方法,所述方法包括如本文定义的,将所述(b)混合物与有机溶剂混合,所述混合物包含2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐、和至少一种粘合剂。优选地,有机溶剂是乙醇。
[0117]
本发明的另一个方面涉及在有机溶剂中的一种可分散溶液,所述可分散溶液包含2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐、和至少一种粘合剂。
[0118]
本发明的另一个方面涉及一种用于制备用于口服施用的药物组合物的方法,所述药物组合物包含如本文定义的颗粒,所述方法包括例如以下步骤:
[0119]
(i)在水存在下,将所述(b)混合物与至少一种粘合剂混合,所述混合物包含化合物(a),优选地所述粘合剂是聚乙烯吡咯烷酮,从而获得悬浮液;
[0120]
(ii)将来自步骤(i)的悬浮液添加至颗粒的(a)惰性基质,优选地(a)惰性基质包括选自由以下组成的组的材料:乳糖、微晶纤维素、甘露醇、蔗糖、淀粉、颗粒状亲水性气相法二氧化硅、或其混合物;和
[0121]
(iii)任选地,将外部(c)密封包衣层添加到所述颗粒上,优选地,并且(c)密封包衣层是羟丙甲纤维素(hpmc)。
[0122]
本发明的另一个方面提供了一种用于制备悬浮液的方法,所述方法包括如本文定义的,将所述(b)混合物与水混合,所述混合物包含2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐、至少一种粘合剂。
[0123]
本发明的另一个方面涉及在水中的一种固体分散体,所述固体分散体包含如本文
定义的2
‑
[(1r,3r,5s)
‑3‑
({5
‑
环丙基
‑3‑
[2
‑
(三氟甲氧基)苯基]
‑
1,2
‑
噁唑
‑4‑
基}甲氧基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基]
‑4‑
氟
‑
1,3
‑
苯并噻唑
‑6‑
甲酸、或其药学上可接受的盐、和至少一种粘合剂。
[0124]
本发明的另一个方面还提供了如本文定义的一种方法,所述方法包括进一步添加至少一种另外的活性药物成分的步骤。
[0125]
本发明的另一个方面提供了一种方法,述方法进一步包括通过将所述颗粒与至少一种药学上可接受的赋形剂混合,制备最终剂型。至少一种药学上可接受的赋形剂可以例如选自由以下组成的组:乳糖、甘露醇、微晶纤维素、磷酸二钙、聚乙烯吡咯烷酮、羟丙基甲基纤维素、交联羧甲基纤维素钠、交聚维酮、淀粉乙醇酸钠、胶态二氧化硅、硬脂酸镁、硬脂酰富马酸钠、或其混合物。优选地,赋形剂可以选自由以下组成的组:甘露醇、交联羧甲基纤维素钠、胶态二氧化硅、硬脂酸镁、或其混合物。
[0126]
包含化合物a的药物组合物(具有或不具有粘合剂、惰性基质、或其他赋形剂)以下被称为包含化合物a的组合物。在一个实施例中,化合物(a)或其药学上可接受的盐相对于包含化合物a的组合物的总重量以从约0.05%至约2.5%、从约0.07%至约2%、从约0.08%至约1%、从约0.09%至约0.5%,或从约0.1%至约0.25%w/w存在。例如,相对于包含化合物a的组合物的总重量以约0.05%、约0.06%、约0.07%、约0.08%、约0.09%、约0.1%、约0.11%、约0.12%、约0.13%、约0.14%、约0.15%、约0.16%、约0.17%、约0.18%、约0.19%、约0.20%、约0.3%、约0.5%、约1%、约1.5%、约2%或约2.5%w/w。优选地,化合物(a)或其药学上可接受的盐相对于包含化合物a的组合物的总重量以从约0.05%至约0.25%,或从约0.08%至约0.15%w/w存在。
[0127]
包含化合物b的组合物
[0128]
本发明提供了组合物,例如固体组合物,所述组合物包含化合物b。不具体限制化合物b的身份。在一些情况下,化合物b自身是两种或更多种活性药物成分的组合。化合物b可以是固体或液体。因此,包含化合物b的组合物可以是颗粒、颗粒剂、分散体(固体或液体)、片剂、微型片剂、珠粒、微丸、溶液或其混合物。
[0129]
化合物b可以选自以下类别的活性药物成分:胰高血糖素样肽1(glp
‑
1)受体激动剂(glp
‑
1ra)、二肽基肽酶
‑
4(dpp4)抑制剂、过氧化物酶体增殖物激活受体(ppar)激动剂、乙酰辅酶a羧化酶(acc)抑制剂、甲状腺素受体β(trβ)激动剂、酮己糖激酶(khk)抑制剂、二酰基甘油酰基转移酶2(dgat2)抑制剂、钠
‑
葡萄糖共转运体(sglt)抑制剂、抗炎剂(例如趋化因子受体2/5(ccr2/5)拮抗剂)、以及抗纤维化剂(例如半乳凝素
‑
3抑制剂以及赖氨酰氧化酶样2(loxl2)抑制剂)。
[0130]
除了化合物b,组合物可以具有一种或多种另外的成分,例如一种或多种粘合剂、一种或多种填充剂、一种或多种崩解剂、或一种或多种润滑剂。还可以存在进一步另外的成分,尽管应理解,不需要具体的另外的成分。
[0131]
在以上包含化合物a的组合物的上下文中讨论了一种或多种粘合剂。
[0132]
当使用时,一种或多种填充剂可以包括以下中的至少一种:乳糖、微晶纤维素、无水磷酸氢钙、二水磷酸氢钙、磷酸三钙、纤维素粉末、碳酸镁、硫酸钙、淀粉、滑石、蔗糖、葡萄糖、甘露醇、羟丙基甲基纤维素、羟丙基纤维素、羧甲基纤维素、果糖、木糖醇、山梨糖醇及其组合。
[0133]
当使用时,一种或多种崩解剂可以包括以下中的至少一种:交联聚乙烯吡咯烷酮、交联羧甲基纤维素钠、和羟基乙酸淀粉钠。例如,一种或多种崩解剂可以是交联羧甲基纤维素钠。并没有具体限制一种或多种崩解剂(例如交联羧甲基纤维素钠)与化合物b的重量比。例如,按组合物的重量计,一种或多种崩解剂可以按从约2%至约10%的量存在,例如约4%至约8%、或约6%。
[0134]
当使用时,一种或多种润滑剂可以包括以下中的至少一种:滑石、二氧化硅、硬脂酸甘油酯、硬脂酸镁、或硬脂酸。例如,一种或多种润滑剂可以是硬脂酸镁。按组合物的重量计,一种或多种润滑剂可以按从约0.25%至约5%的量存在,例如从约0.75%至约3%、或约1.25%。
[0135]
在remington:the science and practice of pharmacy[雷明顿:药物科学与实践]中列出了可以使用的进一步另外的成分,出于所有目的通过引用将其全部内容并入本文。
[0136]
以上讨论的含有化合物b的组合物以下被称为包含化合物b的组合物(含有化合物b,具有或不具有其他赋形剂)。
[0137]
包含化合物a和b的组合物
[0138]
本发明还提供了含有化合物a和b的固定剂量组合。如以上讨论,证明低剂量的化合物a或其药学上可接受的盐的有效配制品是困难的。本发明通过利用包含化合物a的组合物和包含作为中间体的化合物b的组合物,克服了以下中存在的困难:配制含有化合物a和b二者的固定剂量组合的组合物。在转化为最终剂型之前,固定剂量组合的组合物以下被称为包含化合物a和b的组合物。
[0139]
本发明提供了包含化合物a的相容组合物和包含化合物b的组合物。两者的自由组合允许根据希望的药物的和/或治疗的效果,按希望的比例存在化合物a和化合物b。相容性允许容易从包含化合物a和b的组合物制备单位剂型或多剂型。
[0140]
作为实例,包含化合物a的组合物和包含化合物b的组合物按比例组合(例如混合或共混),以便实现希望的治疗效果。在组合物过程中,也可以混合以上讨论的粘合剂、填充剂、崩解剂、润滑剂、和其他另外的成分中的一种或多种。不具体限制组合的方法。
[0141]
剂型
[0142]
药物组合物可以直接转化为最终剂型,所述药物组合物包含组合物,所述组合物包含化合物(a)。可替代地,如以上详细讨论的,包含化合物(a)的组合物可以与包含化合物b的组合物组合,从而形成包含化合物a和b的组合物,然后将其处理成最终剂型。
[0143]
本发明的另一个方面提供了如本文定义的一种方法,其中最终剂型被胶囊化或压片。
[0144]
如本文所披露,药物组合物旨在以单位剂型或多剂型向人和动物口服施用,例如像胶囊、小胶囊、粉末、微丸、颗粒剂、片剂、微型片剂、药囊、小袋、或直条药包。如以上描述,药物组合物可以含有化合物(a)或还具有化合物(b)。优选地,单位剂型或多剂型例如是胶囊、片剂、微型片剂、药囊、小袋、或直条药包。更优选地,药物组合物处于胶囊、或片剂的形式。可以通过以下实现这一点:将如本文定义的药物组合物与稀释剂、润滑剂、粘合剂、崩解剂、和/或吸收剂、着色剂、风味剂和甜味剂混合。
[0145]
可以使用本领域已知的技术,制备包含如本文定义的本发明的颗粒或组合物的胶
囊。适合的胶囊可以选自软明胶胶囊、硬壳胶囊、硬明胶胶囊、基于植物的壳胶囊、基于羟丙甲纤维素(hpmc)的胶囊、或其混合物。如本文所述的药物组合物可以存在为硬明胶胶囊、软明胶胶囊、硬壳胶囊、或硬植物壳胶囊、羟丙甲纤维素(hpmc)胶囊,其中药物组合物进一步与惰性固体稀释剂,例如碳酸钙、磷酸钙、或基于纤维素的赋形剂混合。由称为本体和帽的两件式外部明胶壳制成硬明胶胶囊。壳可以包含植物或动物明胶(例如基于猪肉、牛肉、或鱼肉的明胶)、水、一种或多种增塑剂、以及可能地一些防腐剂。胶囊可以容纳包含非胆汁酸fxr激动剂(例如化合物(a))、至少一种粘合剂、和任选地赋形剂的处于粉末、非常小的微丸、或颗粒的形式的干混合物。壳可以是透明的、不透明的、有色的、或调味的。可以通过本领域熟知的技术,用肠道和/或胃部抗性或延迟释放包衣材料将含有颗粒的胶囊包衣,从而实现例如在胃肠道中更大的稳定性,或从而实现希望的释放速率。可以制备具有任何尺寸(例如尺寸000至5)的硬明胶胶囊。
[0146]
可以使用本领域已知的技术,制备包含如本文定义的本发明的颗粒的片剂。适合的片剂可以含有与适合制造片剂的无毒药物混合的颗粒。这些赋形剂是例如惰性稀释剂,例如碳酸钙、碳酸钠、乳糖(例如乳糖sd)、甘露醇(例如甘露醇dc)、碳酸镁、高岭土、纤维素(例如微晶纤维素、粉末状纤维素)、磷酸钙、或磷酸钠;造粒剂和崩解剂,例如,交联羧甲基纤维素钠、交聚维酮、淀粉乙醇酸钠、玉米淀粉、或海藻酸;光滑剂,例如气相二氧化硅(例如);结合剂(例如像甲基纤维素、羧甲基纤维素、聚乙烯吡咯烷酮、淀粉、明胶、或阿拉伯胶);以及润滑剂,例如硬脂酸镁、硬脂酰富马酸钠、硬脂酸或滑石。可以使用多种已知方法,例如像在自由球中混合或滚筒共混,混合与无毒药物混合的颗粒的混合物。可以使用本领域已知的压片技术(例如像单冲杆压机、双冲杆压机、旋转式压片机、或在辊压设备上进行压缩),将与无毒药物混合的颗粒的混合物压缩成片剂。施加从而形成片剂的压缩力可以是允许获得片剂的任何适合的压缩力,施加的压缩可以在0.5kn至50kn之间,优选地在1kn至30kn之间。片剂可以是未包衣的或通过已知技术包衣,从而延迟在胃肠道中的崩解和吸收,并且由此提供持续更长时间段的持续作用。例如,可以将片剂用适合的聚合物或常规包衣材料包衣,从而实现例如在胃肠道中更大的稳定性,或从而实现希望的释放速率,例如,可以将片剂用羟丙甲纤维素(hpmc)、硬脂酸镁、聚乙二醇(peg)、聚乙烯醇(pva)、opadry或其混合物包衣。例如,可以采用时间延迟材料,如单硬脂酸甘油酯或二硬脂酸甘油酯。可以制备具有任何性状或尺寸的片剂,并且它们可以是不透明的、有色的、或调味的。
[0147]
描绘药物组合物的制造过程的流程图显示在以下方案1中,所述药物组合物包含化合物(a)。
[0148][0149]
方案1:制造过程流程图
[0150]
可以预处理惰性基质,例如乳糖,从而提供颗粒剂,使得例如粒度在可接受的范围内。预处理可以采用足够的粘合剂,例如hpmc和聚乙烯吡咯烷酮。预处理造粒可以是干法或湿法。然后将api(例如化合物a)层压到如以上描述的预处理的惰性基质上。
[0151]
如本文所披露,非胆汁酸fxr激动剂,例如化合物(a),单独地或与第二活性药物成分组合,按对于治疗的患者,在不存在不希望的副作用的情况下,足以发挥治疗上有用的效果的量存在于药物组合物中。由于化合物(a)的高效价,所以低剂量是优选的。每个单位剂量含有预定量的化合物(a),足以产生希望的治疗效果。如本文所披露,每个单位剂量适合人和动物受试者,单独包装,并且可以其分数或倍数施用。多剂型是包装在单个容器中以分开的单位剂型施用的多个相同的单位剂型。多剂型的实例包括小瓶、泡壳、或瓶。
[0152]
根据本发明,化合物(a)或其药学上可接受的盐可以按低量存在于用于口服施用的药物组合物中。在本发明的一个方面,涉及用于口服施用的药物组合物,其中最终剂型包含化合物(a)或其药学上可接受的盐,量为约0.01mg至约2mg、约0.03mg至约1.5mg、约0.05mg至约1mg、或约0.07mg至约0.09mg。优选地,低量的非胆汁酸fxr激动剂,例如化合物(a),是约0.01mg、或约0.02mg、或约0.03mg、或约0.04mg、或约0.05mg、或约0.06mg、或约0.07mg、或约0.08mg、或约0.09mg、或约0.1mg、或约0.12mg、或约0.14mg、或约0.15mg、或约0.2mg、或约0.25mg、或约0.5mg、或约0.8mg、或约1mg、或约1.2mg、或约1.4mg、或约1.5mg、或约1.8mg、或约2mg。更特别地,量是约0.01mg、或是约0.03mg、或是约0.09mg、或是约0.1mg、或是约0.12mg、或是约0.14mg、或是约0.25mg、或是约0.5mg、或是约1mg、或是约1.5mg、或量是约2mg。更优选地,量是约0.01mg、或是约0.03mg、或是约0.09mg、或是约0.1mg、或是约0.5mg、或量是约2mg。
[0153]
本发明的另外的方面涉及如本文定义的用于口服施用的药物组合物,所述药物组合物按治疗有效量包含至少一种另外的活性药物成分化合物(b)。
[0154]
用途
[0155]
如本文所披露,用于口服施用的药物组合物可用作例如用作治疗fxr介导的病症或障碍,例如像胆汁淤积、肝内胆汁淤积、雌激素诱发型胆汁淤积、药物诱发型胆汁淤积、妊娠胆汁淤积、肠外营养相关胆汁淤积、原发性胆汁性肝硬化(pbc)、非酒精性脂肪性肝病(nafld)、非酒精性脂肪性肝炎(nash)、肝硬化、酒精诱发型肝硬化、囊胞性纤维症或肝纤维化的药物。具体而言,本披露提供了所述药物组合物在治疗原发性胆汁性肝硬化(pbs)或非酒精性脂肪性肝炎(nash)中的用途。
[0156]
因此,从本发明的药物组合物制备的用于口服施用的最终剂型可用作例如用作治疗fxr介导的病症或障碍,例如像胆汁淤积、肝内胆汁淤积、雌激素诱发型胆汁淤积、药物诱发型胆汁淤积、妊娠胆汁淤积、肠外营养相关胆汁淤积、原发性胆汁性肝硬化(pbc)、非酒精性脂肪性肝病(nafld)、非酒精性脂肪性肝炎(nash)、肝硬化、酒精诱发型肝硬化、囊胞性纤维症或肝纤维化的药物。具体而言,本披露提供了所述药物组合物在治疗原发性胆汁性肝硬化(pbs)或非酒精性脂肪性肝炎(nash)中的用途。
[0157]
如本文所披露,本发明的另一个方面还提供了药物组合物在制造用于胆汁淤积、肝内胆汁淤积、雌激素诱发型胆汁淤积、药物诱发型胆汁淤积、妊娠胆汁淤积、肠外营养相关胆汁淤积、原发性胆汁性肝硬化(pbc)、非酒精性脂肪性肝病(nafld)、非酒精性脂肪性肝炎(nash)、肝硬化、酒精诱发型肝硬化、囊胞性纤维症或肝纤维化,优选原发性胆汁性肝硬化(pbs)或非酒精性脂肪性肝炎(nash)的药物中的用途。具体而言,本披露提供了所述药物组合物在治疗原发性胆汁性肝硬化(pbs)或非酒精性脂肪性肝炎(nash)中的用途。
[0158]
本发明的另一方面还提供了在有需要的患者中治疗疾病或障碍的方法,其中所述疾病或障碍是胆汁淤积、肝内胆汁淤积、雌激素诱发型胆汁淤积、药物诱发型胆汁淤积、妊娠胆汁淤积、肠外营养相关胆汁淤积、原发性胆汁性肝硬化(pbc)、非酒精性脂肪性肝病(nafld)、非酒精性脂肪性肝炎(nash)、肝硬化、酒精诱发型肝硬化、囊胞性纤维症或肝纤维化的药物。所述方法包括向患者施用有效量的药物组合物或最终剂型的步骤。
[0159]
定义
[0160]
术语“类法尼醇x受体”或“fxr”是指此类受体的所有哺乳动物形式,包括,例如可变剪接异构体和天然存在的异构体(huber等人gene[基因],2002,290,35)。代表性的类法尼醇x受体种类包括而非限制,大鼠(genbank登录号nm_021745)、小鼠(genbank登录号nm_009108)、和人类(genbank登录号nm_005123)形式的受体。
[0161]
术语“非胆汁酸fxr激动剂”是指直接结合并且上调非胆汁酸fxr的活性的药剂。特别地,术语“激动剂”是指通过将非内源性配体与受体结合而触发至少一种反应的药剂。激动剂可以直接或间接与本身调节受体活性的第二种药剂作用。激动剂还可以通过调节一种或多种调节患者某些细胞中fxr mrna或fxr蛋白的量的药剂的活性来间接起作用。
[0162]
术语“药学上可接受的盐”是指可以例如作为酸加成盐形成,优选与有机酸或无机酸形成。出于分离或纯化的目的,还可能使用药学上不可接受的盐,例如苦味酸盐或高氯酸盐。对于治疗用途,仅使用药学上可接受的盐或游离化合物(适用于药物制剂形式的情况下),并且因此这些是优选的。术语“药学上可接受的”是指那些适合用于与人类和动物组织接触使用而没有过多的毒性、刺激、过敏反应、其他问题或并发症,与合理的益处/风险比相称的化合物、材料、组合物和/或剂型。
[0163]
任何疾病或障碍的术语“治疗(“treat”、“treating”或“treatment”)”是指减轻所述疾病或障碍(即,减缓、阻止或减少所述疾病或其至少一个临床症状的发展),是指防止或延迟所述疾病或障碍的发作或发展或进展。另外,这些术语是指减轻或缓解至少一种身体参数、包括不能被患者辨别的那些,并且还是指在身体上(例如,可辨别的症状的稳定化)或在生理上(例如,身体参数的稳定化)或二者调节疾病或障碍。
[0164]
如本文所用,术语“约”旨在提供数字范围端点的灵活性,条件是给定值可以“略高于”或“略低于”端点,以解释在不同仪器、样品和样品制剂之间进行的测量中可见的差异。所述术语通常意指在给定值或范围的10%以内,优选5%以内,并且更优选1%以内。
[0165]
术语“药物组合物”或“配制品”在本文中可互换使用,并且涉及含有要施用于哺乳动物,例如人类,以预防、治疗或控制影响所述哺乳动物的具体疾病或病症的治疗化合物的物理混合物。术语也涵盖,例如在高温和高压下形成的紧密物理混合物。
[0166]
术语“口服施用”代表任何施用方法,其中可通过口服途径,通过吞服、咀嚼或吸入口服剂型来施用治疗化合物。此类口服剂型传统上旨在在口腔和/或颊腔以下的胃肠道中实质上释放和/或递送活性药剂。
[0167]
如本文所用,术语“治疗有效量”是指将引发受试者的生物或医学响应的量,例如改善症状、减轻病症、减慢或延迟疾病进展等。术语“治疗有效量”还指当施用至受试者时,化合物的量对于至少部分减轻和/或改善病症、障碍、或疾病而言,是有效的。术语“有效量”意指主题化合物的量,所述量将产生由研究人员、医生或其他临床医师正在寻求的细胞、组织、器官、系统、动物或人的生物或医学响应。
[0168]
除非另有说明,否则本文中以开放式和非限制性的意义使用术语“包含(包括)”。在一个更受限的实施例中,“包含(包括)”可以由不再开放的“由
……
组成”代替。在最受限制的版本中,它可以仅包括特征步骤或各个实施例中列出的值。
[0169]
如本文所用,术语“低剂量”、“低剂量强度”或“少量”可以互换使用,并且是指少量的活性药物成分,范围从约0.001mg至约10mg的量,优选地范围从约0.1mg至约2mg的量。
[0170]
如本文所用,术语“一个或多个颗粒”一个或多个颗粒,所述颗粒包含(a)惰性基质,以及(b)混合物,所述混合物包含化合物(a)、和至少一种粘合剂。如本文所披露的惰性基质,连同包衣,限定了颗粒的尺寸。例如,颗粒可以具有从约20μm至约500μm的尺寸。优选地,颗粒可以具有从约50μm至400μm的尺寸。更优选地,颗粒可以具有约100μm至约300μm的尺寸。例如,使用如本文所述的设备,通过激光衍射方法测量粒度(例如粒度分布(psd))。
[0171]
如本文所用,术语“惰性基质”是指物质或材料不与反应性物质发生化学的或生物的反应,并且将不分解。
[0172]
如本文所用,术语“粘合剂”具有它在制药学领域中已经确立的含义。它是指在化合物(a)沉积其情况下,或在作为使得能够形成颗粒剂并且确保可以形成具有需要的机械强度的颗粒剂的紧密结合的促进因素的压片的情况下,与活性药物成分(本文称为化合物(a))一起添加的、例如粘附至惰性基质颗粒的非活性物质。本文提到的所有粘合剂按适合药物用途的质量使用,并且在如以下实例中所示的不同商标名下可商购:
[0173]
‑
聚乙烯吡咯烷酮(inn ph.eur.)在商品名聚维酮k30或pvp k30下可商购(大约分子量50 000)。
[0174]
‑
虫胶(inn ph.eur.)是通过在不同树上的昆虫紫胶虫(laccifer lacca kerr)、
紫胶蚧(kerria lacca kerr)、胶虫(tachardia lacca)、小干果虫(coccus lacca)和介壳虫(carteria lacca)中的雌性排泄出的可商购树脂。虫胶组合物如下:46%紫胶桐酸(hoch2(ch2)5chohchoh(ch2)7cooh)、27%紫胶酸(环二羟基二甲酸及其同系物)、5%开醇酸(ch3(ch2)
10
(choh)4cooh)、1%紫御醇酸(c
14
h
28
(oh)(cooh))、2%蜡醇和酸的酯、7%未鉴定的天然物质(例如着色物质等)、和12%未鉴定的多元酯。
[0175]
‑
聚乙烯醇(inn ph.eur.)在商品名polyviol或pva下可商购(大约分子量28 000至40 000)。
[0176]
‑
聚乙二醇(ph.eur.)在商品名peg
‑
n下可商购,其中“n”是环氧乙烷单位(eo单位)数(大约分子量高达20 000)。
[0177]
‑
聚乙烯醇
‑
聚乙二醇共聚物也称为聚乙烯醇
‑
peg共聚物。
[0178]
缩写
[0179]
%w/w
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
百分比重量比重量
[0180]
alt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
丙氨酸转氨酶
[0181]
api
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
活性药物成分
[0182]
av
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
合格值
[0183]
bmi
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
体质指数
[0184]
c4
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ7‑
羟基
‑4‑
胆甾烯
‑3‑
酮
[0185]
cap
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
邻苯二甲酸乙酸纤维素
[0186]
cat
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙酸偏苯三酸纤维素
[0187]
cu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
含量均匀性
[0188]
dad
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二极管阵列检测器
[0189]
dsc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
差示扫描量热法
[0190]
fgf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
成纤维细胞生长因子
[0191]
fxr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
类法尼醇x受体
[0192]
g/min
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
克/分钟
[0193]
ggt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
γ
‑
谷氨酰转移酶
[0194]
hcl
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
盐酸
[0195]
hdl
‑
c
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
高密度脂蛋白胆固醇
[0196]
hpmc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
羟丙甲纤维素/羟丙基甲基纤维素
[0197]
hpmcas
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
羟丙基甲基纤维素邻苯二甲酸酯
[0198]
inci
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
化妆品成分的国际术语
[0199]
inn
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
国际非专有药名
[0200]
kg/g/mg/ng/μg
ꢀꢀꢀ
千克/克/毫克/纳克/微克
[0201]
kn
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
千牛顿
[0202]
lc(%)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
标示量的百分比
[0203]
ldl
‑
c
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
低密度脂蛋白胆固醇
[0204]
lfc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
肝脂肪含量
[0205]
los
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
干燥失重
[0206]
m3/h
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
立方米/小时
[0207]
mbar
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫巴
[0208]
ml/l
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫升/升
[0209]
mri
‑
pdff
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
磁共振成像
‑
质子密度脂肪分数
[0210]
n
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
正常
[0211]
nafld
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
非酒精性脂肪性肝病
[0212]
nash
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
非酒精性脂肪性肝炎
[0213]
℃
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
摄氏度
[0214]
pbc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
原发性胆汁性肝硬化
[0215]
peg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
聚乙二醇
[0216]
ph.eur.
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
欧洲药典(第9版)
[0217]
psd
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
粒度分布
[0218]
pva
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
聚乙烯醇
[0219]
pvap
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
聚乙酸乙烯邻苯二甲酸酯
[0220]
q(%)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
释放的活性物的量
[0221]
q.s
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
足量
[0222]
rh
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
相对湿度
[0223]
rsd
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
相对标准偏差
[0224]
sec/msec
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
秒/毫秒
[0225]
sem
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
扫描电子显微镜
[0226]
tfa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三氟乙酸
[0227]
tg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甘油三酸脂
[0228]
usp
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国药典
[0229]
uv
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
紫外线
[0230]
w/v
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
重量比体积
[0231]
w/w
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
重量比重量
[0232]
xrpd
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
x射线粉末衍射
[0233]
实例
[0234]
以下实例说明本发明,并提供对本发明的披露内容的支持,而本发明不限制本发明的范围。
[0235]
分析细节
[0236]
·
溶出条件:在0.1n hcl中的包含的0.5%w/v月桂基硫酸钠的介质中,在37.0
±
0.5℃的温度下,使用usp ii(桨叶)装置进行溶出分析。在900ml容器或在500ml容器中进行分析。
[0237]
·
测定和降解:使用以下进行分析
[0238]
柱:agilent pursuit xrs 3μm c18 150x3mm,柱温30℃
[0239]
检测:uv或dad
[0240]
梯度:洗脱液a:在水中的0.05%tfa/洗脱液b:0.05%乙腈
[0241][0242]
·
含量均匀性:使用以下进行含量均匀性分析:
[0243]
柱:kinetex xb
‑
c18%5μm 150x4.6,柱温30℃。
[0244]
检测:uv或dad
[0245]
洗脱液a:在水中的0.05%tfa/洗脱液b:0.05%乙腈(没有梯度)。
[0246]
·
xrpd:使用单色cu(kα)
‑
辐射,使用装备有cu x线球管和pixcel检测器系统的panalytical xpert pro衍射仪进行x射线粉末衍射(xrpd)分析。在环境温度下,保持在低密度聚乙烯膜之间,按传输模式分析约20mg的每种材料。仪器参数如下:
[0247]
样品制备传输箔
[0248]
范围:3
‑
40
°
2θ度
[0249]
步长:0.013
°
[0250]
计数次数:(步长时间)约90s
[0251]
运行时间:20min
[0252]
入射光学索勒狭缝:0.02rad
[0253]
镜子:光束cu w/si聚焦mpd
[0254]
发散狭缝:1/2
°
[0255]
防散射狭缝:1/2
°
[0256]
无光束衰减器、掩模或滤镜
[0257]
衍射光学检测器:pixcel
[0258]
索勒狭缝:大0.02rad
[0259]
防散射狭缝:as狭缝7.5mm pixcel
[0260]
·
dsc:使用perkin elmer jade dsc系统进行差示扫描量热法(dsc)分析。将样品称重到铝盘中并且将盖卷曲到位。使用10℃/分钟的加热速率,在氮气环境下,将样品从约30℃加热至300℃。
[0261]
·
psd:使用装备有aero s干燥分散单元和微盘的malvern粒度分析仪3000(ms3000)确定粒度分布。仪器参数如下:
[0262]
透镜/测量范围:0.01μm
‑
3500μm
[0263]
分析灵敏度:正常
[0264]
计算模型:mie(材料折射率:1.540,吸收:0.01)
[0265]
颗粒类型:非球形模式
[0266]
减光过滤:是_减光限制:0.10
‑
6.00%
[0267]
进料速度:45%
[0268]
分散器压力:2.2bar
[0269]
自动开始测量:是_背景测量:20秒
[0270]
样品测量:10秒
[0271]
·
拉曼光谱:使用633nm和氦氖激光(hene)35mw,在witec alpha300共聚焦拉曼成像系统上记录拉曼光谱。仪器参数如下:
[0272]
激光波长:532
[0273]
激光强度(ma):22
[0274]
积分时间(s):0.6
[0275]
物镜:40x/0.6korr
[0276]
光栅值:600
[0277]
光学分辨率(μm):1
[0278]
实例1:不具有外部密封包衣层的包含化合物(a)的组合物的制备:
[0279]
通过首先将粘合剂聚乙烯吡咯烷酮(聚维酮k30)、如本文定义的化合物(a)溶解在如本文定义的极性质子溶剂中,从而提供api溶液,制备组合物。在流化床干燥器中,通过顶部喷雾,将所述制备的api溶液喷雾到惰性基质,例如乳糖或上。然后干燥混合物从而去除溶剂,从而提供包含化合物(a)的组合物(在这种情况下为颗粒)。下表1、1a、和2说明了颗粒的组成。
[0280]
表1:从乙醇溶液制备包含化合物(a)的组合物。配制品1和2分别含有0.06%和0.1%w/w(干燥基重)的化合物(a)。
[0281][0282]
*然后蒸发乙醇。
[0283]
表1a:从乙醇溶液制备包含化合物(a)的组合物。配制品1a和2a各自含有0.15%w/w(干燥基重)的化合物(a)。
[0284][0285]
*然后蒸发乙醇。
[0286]
表2:制备的包含化合物(a)的组合物形成含有2%w/w的化合物(a)的水性悬浮液。
[0287][0288]
*已经蒸发水。干燥失重(lod)<2%后处理。
[0289]
**惰性基质可以是
[0290]
可替代地,用羟丙基甲基纤维素水溶液预处理惰性基质,例如乳糖或从而实现粒度均匀性。表2a显示了用hpmc的5%水溶液处理喷雾干燥的乳糖的实例。然后按适当浓度,用化合物(a)层压此类表面处理的惰性基质的颗粒剂,并且干燥,从而实现相对于组合物的总干重,0.1%至0.15%的化合物(a)的荷载水平。
[0291]
表2a:喷雾干燥的乳糖的预处理,从而提供颗粒状乳糖。
[0292][0293]1在制造过程期间去除。
[0294]
然后将预处理的(颗粒状)乳糖用根据下表2b的api包衣,从而提供包含0.1%w/w(干燥基重)的化合物(a)的组合物。
[0295]
表2b:从颗粒状乳糖制备包含0.1%w/w的化合物(a)的组合物。
[0296][0297][0298]1在制造过程期间去除。
[0299]
实例2:具有密封包衣的包含化合物(a)的组合物的制备:
[0300]
根据实例1中披露的配制实例(f1、f2、f3和f4)中任一项制备包含化合物(a)的组合物,然后进行密封包衣。
[0301]
通过将hpmc的5%w/w水溶液喷雾到按照配制品2(f2)(参见表1)制备的颗粒上,进行密封包衣,从而实现3%的理论增重。包含外部密封包衣的配制品2(f2)在本文称为配制品f2s。
[0302]
在喷雾期间,每30分钟进行目视审查,从而确保在该过程期间不发生聚集。
[0303]
实例3:胶囊配制品
[0304]
为了评估每个批次的含量均匀性,将包含化合物(a)的密封包衣的颗粒(例如,如实例2中所披露的)胶囊化到尺寸1胶囊中。除非另有说明,否则术语“胶囊”是指硬明胶胶囊。
[0305]
·
包含30μg的化合物(a)的胶囊(c1):为了制造含有30μg的化合物(a)的最终剂型,例如胶囊,将51.7mg的来自实例1的颗粒(配制品1(f1))与1%硬脂酸镁共混,并且填充到胶囊尺寸1中。化合物(a)的总重量(药物负荷)为胶囊的0.058%。相应地调节填充重量。
[0306]
·
包含160μg的化合物(a)的胶囊(c2):按相同方式,使用与1%硬脂酸镁共混并且填充到胶囊尺寸1中的166.7mg的来自实例1的颗粒(配制品2(f2)),制造含有160μg剂量的化合物(a)的最终剂型(例如胶囊)。化合物(a)的总重量(药物负荷)为胶囊的0.096%。相应地调节填充重量。
[0307]
基于从以上概述的实例确立的最终组成和工艺参数,使用相同条件制造验证性胶囊批次,用于稳定性评估。分别关于以下进行测定试验:
[0308]
‑
不具有密封包衣层的包含化合物(a)的颗粒(f1和f2)
[0309]
‑
包含化合物(a)和密封包衣的颗粒(f1s和f2s)
[0310]
使用mg2 labby封装机进行封装。按30个计数,将胶囊包装到瓶中,用于稳定性研究。来自验证性批次的结果,包括含量均匀性(cu)结果,显示在以下表3和表4中:
[0311]
表3:30μg胶囊(c1)批次的含量均匀性结果
[0312][0313]
表4:160μg胶囊(c2)批次的含量均匀性结果
[0314]
[0315][0316]
如从表3和表4中可见,对于填充胶囊的30μg和160μg剂量强度二者,含量均匀性结果很好地处于可接受的范围内。这证明开发了可调比例的并且商业上可行的方法。此外,在40℃/75%rh下,对于物理的(溶出)和化学的完整性的二者,测试了两种胶囊强度(c1和c2)的稳定性,持续长达12周,并且发现是稳定的,没有明显的动态趋势。
[0317]
评估溶出性能从而确保溶出曲线与胶囊中的干共混物配制品(化合物(a)、乳糖、交聚维酮、硬脂酸镁)的溶出曲线匹配。通过常规方法测量溶出速率。在图1和2中,在120分钟的过程中绘制了c1、c2和含有包含0.1mg化合物(a)的干共混物的胶囊的溶出速率(%)。如图1和图2中可见,在15分钟时间点,两种剂量强度产生的溶出大于干共混物配制品的溶出的两倍。因此,药物组合物的胶囊配制品具有以下优点:为配制品提供快的溶出速率,在20分钟或更短时间内,约80%或更高的溶出速率。该溶出速率符合速释配制品的规格,其溶出速率由“q+5%临时”表示。
[0318]
实例4:片剂配制品和稳定性数据
[0319]
如以上在实例2和实例3中所披露的,使用具有密封包衣层的配制品2(f2s)开发片剂急性。初步调查是鉴定指示直接压缩方法的可调比例的并且商业上可行的片剂配制品是可行的。使用常用共混方法评估两种配制品,并且用来覆盖本文提到的广泛剂量范围。如以下实例中概述的,两种组合物的压缩曲线几乎是相同的。
[0320]
表5:片剂配制品
[0321][0322]
*药物负荷化合物a=0.097%
[0323]
按更大规模,按两种剂量强度制造配制品6,并且使用标准褐色膜包衣将其膜包衣。是由卡乐康公司(colorcon)制造的完整膜包衣系统,并且它是在干浓缩物中组合了聚合物、增塑剂和色素的卡乐康公司的定制一步系统。在表6(下文)中披露了来自这些批次的分析结果,并且描绘在图3和图4中。
[0324]
表6膜包衣片剂的溶出和含量均匀性结果
[0325]
[0326][0327]
评估溶出性能从而确保溶出曲线与干共混物配制品(胶囊化到胶囊中的化合物(a),与实例3相同)的溶出曲线匹配。通过常规方法测量溶出速率。图3和图4总结了在不同压缩力(2kn和11kn)下压缩的包含以上配制品(配制品5和配制品6)的片剂的溶出曲线。对于胶囊配制品观察到的快速溶出(参见图1和图2)不受将共混物压缩到片剂中的影响。出人意料的是,用片剂配制品观察到的溶出速率甚至比胶囊配制品的溶出速率更快。如图3和图4中可见,片剂配制品具有以下优点:为配制品提供在20分钟或更短时间内约85%或更高的溶出速率。
[0328]
将使用配制品6制造的两种强度(30μg和160μg)进行膜包衣,并且在相应膜包衣片剂(如表6中所见的片剂1(t1)和片剂2(t2))上进行稳定性测定。结果描绘在以下表7和表8中。
[0329]
表7:片剂1(t1)的测定稳定性数据
[0330][0331]
*根据(usp<711>和ph.eur.2.9.3)90分钟后q=70%
[0332]
表8:片剂2(t2)的测定稳定性数据
[0333][0334]
*根据(usp<711>和ph.eur.2.9.3)90分钟后q=70%
[0335]
24周后,如表7和表8所示,稳定性结果证实了药物产品的稳定性,并且未观察到降解。如表7和表8中可见,甚至在那些条件下,膜包衣片剂的溶出性能也没有受损。
[0336]
实例5:dsc、psd、xrpd、sem分析和拉曼光谱学
[0337]
针对用于开发包含化合物(a)的片剂配制品的材料(如在配制品5和配制品6中所描绘),进行差示扫描量热法(dsc)、粒度分布(psd)和x射线粉末衍射(xrpd)、扫描电子显微镜(sem)分析、以及拉曼光谱学。这些实验有助于表征并且确定化合物(a)的物理性质。
[0338]
图5显示了作为惰性基质的乳糖(可商购的
‑
喷雾干燥的级别)、密封包衣的配制品2(本文称为f2s)、以及根据表5,配制品6制备的常用共混物的xrpd衍射图。一起比较所有峰值,并且最终共混物的衍射图中存在的另外的峰值可以归因于甘露醇dc(约11.5、14.6、16.8、18.8、20.5、21.1、21.7、23.4、25.9、26.1、29.5、30.6、33.6、33.7、33.9、和36.1
°
(2θ度))。
[0339]
图6显示了按10℃/分钟,从约30℃至300℃,用于确定密封包衣的配制品2(f2s)的热廊线的dsc热分析图。热分析图显示了两种不同的吸热,这可能可归因于多种组分的熔融。第一吸热是(起始温度约134℃)是宽的,显示出伸舌峰和拖尾峰二者,表明存在至少3种组分。在约240℃下,趋向第二吸热结束,分解是明显的。针对样品产生的热数据报道在下表9中。
[0340]
表9:针对密封包衣的配制品f2(f2s)获得的dsc热数据
[0341][0342]
图7和图8显示了使用干燥分散体,通过激光衍射确定的密封包衣的配制品2(f2s)和配制品6(f6)的粒度分布。一式三份,针对每种样品进行粒度分析。针对dv10、dv50和dv90确定的平均粒度数据报道在下表10中:
[0343]
表10:针对根据配制品2(f2)和配制品6制备的颗粒确定的粒度
[0344][0345]
由于0.1%的极低药物浓度,并且存在其他赋形剂,尤其是在用于片剂剂型的共混物中,所以xrpd和dsc结果不能单独区分化合物(a)的物理性质。鉴于这一点,进行另外的调查,例如sem分析。
[0346]
针对以下样品进行sem分析:
[0347]
·
乳糖(可商购的
‑
喷雾干燥的级别)
[0348]
·
如本文所披露的配制品2
[0349]
·
密封包衣的配制品2(f2s)
[0350]
以上批次的每一个的sem图像显示在图9至14中。相对于图9中不具有化合物(a)的乳糖,在图10中,化合物(a)的晶体是可见的,图11至14显示了两种不同的分辨率下,如本文所披露的配制品2(f2)和密封包衣的配制品f2(f2s)的外观。与不具有密封包衣层的配制品2(f2)的颗粒相比,配制品2(f2s)的密封包衣的颗粒具有光滑表面。这证明密封包衣是有效的。
[0351]
为了证实药物的结晶性质,调查了拉曼显微镜和分析,从而确定在(a)惰性基质(在此情况下是乳糖)上的空间分布。此研究旨在确定一旦分散到惰性基质上,在配制品2(f2)(0.1%的药物负荷和pvpk30作为粘合剂)中,化合物(a)的空间分布。将适合量的颗粒沉积爱搜显微镜载玻片上,并且进行单表面拉曼映射(150x 150μm2‑
1μm分辨率/0.6s秒积分时间)。
[0352]
扫描样品表面并且跨越扫描区域的映射拉曼光谱显示了清楚限定的(微粒样)区域,其中光谱可能与结晶化合物a相关,而中间的那些区域,拉曼光谱仅与赋形剂(粘合剂、载体)相关(如图15和图16中所见)。
[0353]
从纯化合物(a)制备结晶化合物(a)和非晶形化合物(a)的样品,并且用作对比参考。
[0354]
‑
根据本领域熟知的结晶技术,制备结晶化合物(a)。
[0355]
‑
非晶形化合物(a)制备如下:将30mg化合物(a)溶解在2个单独小瓶中的1.5ml的二噁烷中。将小瓶在干冰中速冻。使用本领域熟知的技术,将冷冻干燥进行过夜,直至获得非晶形化合物(a)。使用xrpd/dsc分析非晶形样品。
[0356]
通过拉曼光谱学分析那些样品(参见图17,所谓的“化合物(a)结晶参考”和“化合物(a)非晶形参考”)。将参考结晶化合物(a)和非晶形化合物(a)的拉曼光谱与从配制品2(f2)提取的化合物(a)的拉曼光谱进行比较。如图17中可见,根据配制品2(f2),将化合物(a)层压到惰性基质(例如乳糖)上,显示出在特征拉曼峰值位置方面,与“化合物(a)结晶参考”的拉曼指纹的清楚关联。因此,显示在药物组合物中,化合物(a)还可以按结晶形式存在。
[0357]
实例6:用于治疗非酒精性脂肪性肝炎的化合物(a)
‑
来自阶段2b研究flight
‑
fxr的基于基线体质指数的期中结果。
[0358]
flight
‑
fxr(nct02855164)是阶段2的、随机化的、多中心的、安慰剂对照的实验,具有适应性设计,用来评估在患有nash(非酒精性脂肪性肝炎)的患者中,化合物(a)的功效。下文提供了来自化合物(a)60μg、化合物(a)90μg、和安慰剂臂的数据。
[0359]
将患者分为两个亚组:更低bmi亚组(bmi<30kg/m2(亚裔)或<35kg/m2(非亚裔))和更高bmi亚组(bmi≥30kg/m2(亚裔)或≥35kg/m2(非亚裔))。
[0360]
研究目标如下:
[0361]
‑
为了通过bmi亚组,确定针对肠道中的fxr靶标接合的标志(fgf19)的化合物(a)随时间的剂量反应关系。
[0362]
‑
为了通过bmi亚组,确定针对肝脏炎症的标志(丙氨酸氨基转移酶[alt])、靶标接合和氧化应激的标志(γ谷氨酰转移酶[ggt])、并且针对通过磁共振成像质子密度脂肪分数(mri
‑
pdff)测量的肝脏脂肪含量(lfc)的变化,化合物(a)在12周时的剂量反应关系。
[0363]
‑
为了通过bmi亚组确定脂质谱。
[0364]
表11:研究群体
[0365]
[0366][0367]
60μg化合物(a)、90μg化合物(a)、和安慰剂的结果和功效
[0368]
表12(下文)显示了在每个治疗臂中观察到的结果。
[0369]
表12:通过bmi亚组(其中n为总患者数),功效的标志物的几何平均百分率变化(fgf19(在第6周,从给药前到给药后4小时),和从基线到第12周的所有其他参数))
[0370][0371][0372]
bmi<30kg/m2(亚裔)或<35kg/m2(非亚裔);bmi≥30kg/m2(亚裔)或≥35kg/m2(非亚裔);
§
通过mri
‑
pdff测量
[0373]
·
化合物(a)对靶标接合的标志的影响:fgf19:在第6周时进行fgf19的评估。在两个bmi亚组中,与给药前相比,给药后4小时观察到fgf19水平的剂量反应增加。在第6周,在
更低bmi亚组中,从给药前的fgf19的几何平均百分率变化(60μg的化合物(a)=360.2,并且90μg的化合物(a)=585.8)高于在更高bmi亚组中的平均百分率变化(60μg的化合物(a)=276.9,并且90μg的化合物(a)=446.9)。
[0374]
·
化合物(a)对肝脏炎症的标志的影响:alt:在来自两个bmi亚组的患者中,用90μg的化合物(a)剂量观察到从基线的alt水平的快速并且持续的下降,在具有更低bmi的组中更显著。
[0375]
·
化合物(a)对ggt,氧化应激的标志的影响:在两个bmi亚组中,用化合物(a)观察到ggt水平的剂量反应降低,在具有更低bmi的组中更显著。在第12周,相比在更高bmi亚组中,60μg的化合物(a)(
‑
38.4)和90μg的化合物(a)(
‑
48.7),在更低bmi中,用60μg的化合物(a)(
‑
47.0)和90μg的化合物(a)(
‑
61.3),ggt的几何平均百分率变化更高。
[0376]
·
化合物(a)对肝脏脂肪含量的影响:在第12周,与更高bmi亚组(安慰剂=
‑
5.5;化合物(a)60μg=
‑
12.9,并且(a)90μg=
‑
11.4),在更低bmi亚组中的所有臂中,平均百分率变化更大(安慰剂=
‑
13.1;化合物(a)60μg=
‑
19.9,并且化合物(a)90μg=
‑
18.8)。相比更高bmi亚组,在更低bmi亚组中,具有肝脏脂肪含量(lfc)的绝对降低>5%的患者的比例更高。
[0377]
·
化合物(a)对c4的影响:在第12周,在所有化合物(a)治疗组中,观察到7
‑
羟基
‑4‑
胆甾烯
‑3‑
酮(c4)的降低。在更高bmi亚组中,此降低更明显。然而,c4经历了日变化,因此bmi对c4的影响造成了进一步调查。
[0378]
只要涉及包含化合物(a)的配制品的安全性,不良事件(包括瘙痒)的发生率就是臂之间课比较的。在两个bmi亚组中,脂质谱是可比较的。在两个bmi亚组中,来自此阶段2b研究的前两部分的期中结果提供了化合物(a)的靶标接合、抗炎、和抗脂肪变性效果的证据。然而,在更低bmi亚组中,化合物(a)对alt、ggt、和lfc的影响更明显。研究还显示,在两个亚组中,脂质谱是可比较的,并且在研究中,跨越治疗臂,事件(包括瘙痒)的比率是可比较的。在更高bmi亚组中,按体重接受更低剂量,更低反应的一致趋势支持测试更高化合物(a)剂量(例如140μg和200μg/天)。
[0379]
实例7:在健康人类受试者中,在[
14
c]化合物(a)的单次1
‑
mg口服给药后,化合物(a)的吸收、分布、代谢、和排泄
[0380]
在将[
14
c]化合物(a)单次1
‑
mg口服给药至四个健康人类受试者后,研究化合物(a)的吸收、分布、代谢、和排泄。确定了[
14
c]化合物(a)相关放射性的排泄速率和途径,以及血浆中化合物(a)的和总放射性的药物代谢动力学曲线。阐明了在人体中[
14
c]化合物(a)的关键生物转化途径和清除机制。通过312小时收集期,用在排泄物中回收的大约94%的施用剂量实现了质量平衡。与放射性相关的化合物(a)的粪便排泄起主要作用(大约65%的总剂量),而尿排泄略微起次要作用(大约29%的总剂量)。在口服施用1mg[
14
c]化合物(a)至人类受试者,母体化合物(a)达到33.5ng/ml的最大浓度(cmax),具有4小时的中位tmax(达到最大浓度的时间),并且在血浆中,以13.5小时的半衰期(t
1/2
)消除。在血浆中发现未改变的化合物(a)是主要药物相关组分(大约92%的放射性)。分别在大约2%和大约5%的总药物放射性暴露下,在循环中观察到两种次要氧化代谢物。化合物(a)主要经由代谢消除,其中多于68%的剂量作为排泄物中的代谢物回收。氧化代谢似乎是化合物(a)的主要清除途径,因为在人类排泄物中观察到的大部分放射性由氧化代谢物组成。主要阶段1氧化途径包括:1)
氧化的o
‑
脱烷基化;2)在苯基环丙基异唑部分处的氧化;3)在苯并噻唑和稠合环结构处的氧化。还在人类排泄物中观察到含有至氧化产物的多个氧化修饰和/或葡糖醛酸化的代谢物。
[0381]
实例8:体内pk
[0382]
根据以下方法在雄性比格狗中评估化合物(a)药物产品的pk曲线:
[0383]
原料药:化合物(a);
[0384]
药物产品:s1
‑
硬明胶胶囊,s2
‑
软明胶胶囊,以及s3
‑
薄膜衣片,根据以下组成:
[0385][0386][0387][0388]
物种、品系、性别:比格狗,雄性(n=4),杂交;
[0389]
施用途径:口服(给药前30分钟五肽胃泌素预处理(6μg/kg i.m.));
[0390]
饲养状态:给药前禁食过夜。样品采集4小时后再给动物喂食;
[0391]
剂量:30μg/动物/剂量;
[0392]
采集的样本:k2‑
edta血液(血浆分析);
[0393]
采样时间点:给药后0.25、0.5、1、2、3、5、8、24、28和32小时;
[0394]
样品分析:lc
‑
ms/ms带正电喷雾电离。
[0395]
pk结果总结在下表13中。
[0396]
表13:本发明某些实施例的pk特性
[0397][0398]
a
中值[范围]。
[0399]
三个实例的平均血浆浓度曲线如图18所示。如实例3和4中所示,本发明提供了相对于干共混物组合物具有优异的化合物(a)体外溶出曲线的组合物。如此处所证明的,优异的溶出表现为在狗体内更高的生物利用度上。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1