包含非吸收性抗生物质及粘土矿物的复合物的用于根除耐抗生素幽门螺杆菌的口服药物组合物的制作方法
1.本发明涉及包含非吸收性抗生物质及粘土矿物的复合物的用于根除幽门螺杆菌的口服药物组合物。并且,本发明涉及包含非吸收性抗生物质及粘土矿物的复合物的用于根除幽门螺杆菌的口服试剂盒。
背景技术:
2.幽门螺杆菌为给胃黏膜带来影响的革兰氏阴性微好氧螺旋形细菌,可以粘附在人类胃的上皮细胞上发现。耐药性幽门螺杆菌株是治疗失败的最常见原因。全世界人口中约50%的人口为幽门螺杆菌阳性,发展中国家的发病率达80%至90%,发达国家的发病率也有35%至40%。自1998年韩国国内首次发布有关幽门螺杆菌根除治疗的建议后,迄今一次治疗的标准三联疗法仍是联合给药克拉霉素、阿莫西林、胃酸抑制剂的方法。该标准三联疗法的根除效果目前只有70%左右,表现出非常低的效果,但至今尚未开发出比现有的三联疗法更好的治疗方法,因此,尽管根除效果低,仍在建议将三联疗法用作一次治疗的方法(korean j gastroenterol 2013;62:3-26)。包括上述标准三联疗法在内的以往的治疗方法要经过口服给药的抗生素在胃部溶解后在肠道吸收,通过血管移动后最终在胃黏膜释放来根除幽门螺杆菌的过程(图1)。然而,以上述方式给药的抗生素由于经肠道吸收后在胃黏膜释放起到根除作用,因此,抗生素会经由全身,会带来由抗生素引起副作用的危险及对患者的负担。
[0003][0004]
蒙皂石为以2个由al、mg、fe组成的八面体薄片位于由si、al、fe组成的四面体薄片的上部和下部来以三明治形状结合,由此组成一个单元层(2∶1层)的叶状硅酸盐矿物质。蒙皂石的单元层具有负电荷,这是由具有4价正电荷的四面体si被具有3价正电荷的al或者fe同晶置换(isomorphic substitution)或者具有3价正电荷的八面体al或者fe
3+
被具有2价正电荷的mg或者fe
2+
同晶置换而产生的。通过单元层中产生的负电荷来在单元层与单元层之间诱导阳离子,这意味着蒙皂石可以用作药物载体(carrier)。因此,利用蒙皂石作为药物递送工具近来备受瞩目,据许多研究报告,为了控制盐酸多奈哌齐(donepezil)、林可霉素(lincomycin)、醋酸洗必泰(chlorhexidine acetate)及四环素(tetracycline)等的传递及释放而使用插入有药物的蒙皂石混合物。
[0005][0006]
氨基糖苷(aminoglycosides)类抗生素是用于治疗革兰氏阴性细菌的代表性的抗生素,但没有口服药剂而只能用作注射剂,因此尚未用在幽门螺杆菌根除的治疗。在部分研究中确认到,氨基糖苷类对幽门螺杆菌的体外活性评估中保持较低的最小抑菌浓度。在被测试的氨基糖苷类中,活性最高的为庆大霉素、妥布霉素(tobramycin)及奈替米星(netilmicin),分别具有0.25mg/l~0.5mg/l的mic90值及0.125mg/l~1.00mg/l的mic50值(brenciaglia mi,fornara am,scaltrito mmet al.activity of amoxicillin,
metronidazole,bismuth salicylate and six aminoglycosides against helicobacter pylori.jchemother 1996;8:52-4)。但口服给药氨基糖苷类时,几乎不在胃肠道中吸收,因此,至今仍只以胃肠外给药的方式使用。(turnidge j.pharmacodynamics and dosing of aminoglycosides.infect dis clin northam2003;17:503-28)。并且,至今尚无在氨基糖苷类抗生素实际的体内评估中表现出根除效果的报告。
[0007][0008]
于是,本发明人在研究口服给药后在胃肠道中有效根除方式的幽门螺杆菌根除剂的过程中,确认到本发明的用于根除幽门螺杆菌的组合物不是以在肠道内吸收后通过血管在胃中释放的方式,而是以口服给药后经过食道到达胃的抗生素粘附于胃黏液层来有效根除幽门螺旋杆菌,从而完成了本发明。
技术实现要素:
[0009]
技术问题
[0010]
本发明的目的在于,提供口服给药后涂敷于胃黏膜来起作用的用于根除幽门螺杆菌的组合物。技术方案
[0011]
为了实现上述目的,本发明提供包含非吸收性抗生物质及粘土矿物的复合物的用于根除幽门螺杆菌的口服药物组合物。并且,本发明提供包含非吸收性抗生物质及粘土矿物的复合物的用于根除幽门螺杆菌的口服试剂盒。发明的效果
[0012]
本发明的药物组合物及试剂盒包含板状粘土传递体,能够涂敷于胃黏膜,可以靶向治疗胃黏膜。并且,具有在酸碱度低的胃内环境中减少抗生素破坏、使对肠内细菌的影响最小化的优点。
附图说明
[0013]
图1示出通过以往的三联疗法的幽门螺杆菌的根除过程。
[0014]
图2示出本发明非吸收性抗生物质及粘土矿物的复合物对幽门螺杆菌的根除过程。
[0015]
图3示出庆大霉素-蒙皂石复合物(s-gen)的幽门螺杆菌根除活性。左上端的圆盘:蒙皂石;右上端的圆盘:s-gen;下面的圆盘:庆大霉素。
[0016]
图4示出奈替米星-蒙皂石复合物(s-net)的幽门螺杆菌根除活性。左边的圆圈:蒙皂石;右边的圆圈:s-net。
[0017]
图5为用于在体内确认抗-幽门螺杆菌药效的实验方案。上述实验方案包括在c57bl/6小鼠中接种幽门螺杆菌、感染发展以及接下来的治疗。
[0018]
图6为利用组1至组8进行有关幽门螺杆菌感染的治疗效果的研究后进行胃黏膜组织聚合酶链式反应(pcr)的结果。
[0019]
图7示出幽门螺杆菌对多种抗生素的耐药率。
[0020]
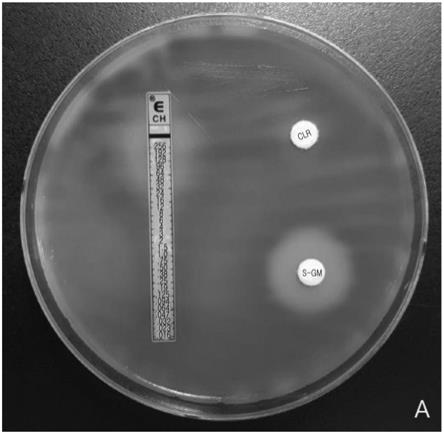
图8a为在耐克拉霉素菌株中比较克拉霉素(clr)圆盘与s-gm圆盘在体外的根除效果的结果。
[0021]
图8b为在耐克拉霉素菌株中比较克拉霉素(clr)圆盘与s-gm圆盘在体外的根除效果的结果。
具体实施方式
最佳实施方式
[0022]
本发明提供包含非吸收性抗生物质及粘土矿物的复合物的用于根除耐抗生素幽门螺杆菌的口服药物组合物。
[0023]
上述药物组合物还可以包含β-内酰胺类抗生素。
[0024]
上述药物组合物还可以包含胃酸抑制剂。
[0025]
上述非吸收性抗生物质可以为氨基糖苷类化合物。
[0026]
上述粘土矿物可以为蒙皂石类粘土矿物。
[0027]
上述药物组合物可以在口服给药上述非吸收性抗生物质及粘土矿物的复合物后经过食道到达胃后粘附于胃黏液层来释放抗生物质。
[0028]
上述药物组合物可以具有脲酶抑制活性。
[0029]
上述药物组合物可以是用于预防或者治疗幽门螺杆菌引起的胃肠疾病的药物组合物。
[0030]
上述耐抗生素幽门螺杆菌可以为耐克拉霉素的幽门螺杆菌。
[0031][0032]
并且,本发明提供包含非吸收性抗生物质及粘土矿物的复合物的用于根除耐抗生素幽门螺杆菌的口服试剂盒。
[0033]
上述试剂盒还可以包含β-内酰胺类抗生素。
[0034]
上述试剂盒还可以包含胃酸抑制剂。
[0035]
上述耐抗生素幽门螺杆菌可以为耐克拉霉素的幽门螺杆菌。
[0036][0037]
本发明涉及包含非吸收性抗生物质及粘土矿物的复合物的用于根除幽门螺杆菌的口服药物组合物。
[0038][0039]
并且,本发明涉及包含非吸收性抗生物质及粘土矿物的复合物的用于根除耐抗生素幽门螺杆菌的口服药物组合物。
[0040][0041]
并且,本发明涉及包含非吸收性抗生物质及粘土矿物的复合物的用于根除幽门螺杆菌的口服试剂盒。
[0042][0043]
并且,本发明涉及包含非吸收性抗生物质及粘土矿物的复合物的用于根除耐抗生素幽门螺杆菌的口服试剂盒。
[0044][0045]
并且,本发明涉及幽门螺杆菌的根除方法,包括向对象给药本发明的药物组合物的步骤。
[0046][0047]
并且,本发明涉及耐抗生素幽门螺杆菌的根除方法,包括向对象给药本发明的药
物组合物的步骤。
[0048][0049]
并且,本发明涉及预防或者治疗耐抗生素幽门螺杆菌引起的胃肠疾病的方法,包括向对象给药本发明的药物组合物步骤。
[0501][0051]
以下,详细说明本发明。
[0052][0053]
非吸收性抗生物质
[0054]
本发明的非吸收性抗生物质以与粘土矿物的复合物的形态口服给药后经过食道到达胃时涂敷于胃黏膜。从涂敷在胃黏膜的复合物中释放上述抗生物质来根除幽门螺杆菌。
[0055][0056]
本发明的非吸收性抗生物质在口服给药复合物后,若不在胃中用于幽门螺杆菌的根除,则不被吸收而是排泄出去,从而减轻抗生素的副作用及对患者的负担。并且,在此情况下,本发明的非吸收性抗生物质为与粘土矿物结合的复合物形态,因此对肠内细菌的影响小,在胃酸条件下最小化抗生素的破坏。
[0057][0058]
本发明的吸收性抗生物质不受特别限制,可以为氨基糖苷类化合物。
[0059][0060]
本发明的氨基糖苷类化合物可以为庆大霉素(gentamicin)、妥布霉素(tobramycin)、阿米卡星(amikacin)、新霉素(neomycin)、奈替米星(netilmicin)等,优选地,可以为庆大霉素。
[0061][0062]
粘土矿物
[0063]
通常,粘土矿物具有由硅片(silica sheet)与铝片(alumina sheet)结合形成的结晶单元层叠的层状结构,即,板状结构,在如上所述的粘土矿物中的具有层间膨胀性的粘土矿物中,在结晶单元之间不存在氢键,结晶单元之间的结合力较弱,因此当在这些结晶单元之间吸入水分时,会发生膨胀。因此,即使具有较大尺寸的离子也可以轻松进入具有层间膨胀性的粘土矿物的结晶单元之间。另一方面,在具有层间膨胀性的粘土矿物中,具有4价正电荷的四面体si被具有3价正电荷的al或者fe同晶置换或者具有3价正电荷的八面体al或者fe
3+
被具有2价正电荷的mg或者fe
2+
同晶置换而产生负的层电荷,但在层与层之间或者在表面结合有钙离子(ca
2+
)、镁离子(mg
2+
)、钠离子(na
+
)、钾离子(k
+
)等阳离子,因此整体上呈电中性。
[0064][0065]
本发明的粘土矿物具有板状结构,具体地,具有层间膨胀性,是可以在内部插入抗生物质来用作传递体的粘土矿物。本发明的粘土矿物可以为蒙皂石类矿物,例如,可以为蒙脱石(montmorillonite)或者膨润土(bentonite)、贝德石(beidellite)、绿脱石(nontronite)、皂石(saponite)、水辉石(hectorite)等。
[0066][0067]
非吸收性抗生物质及粘土矿物的复合物
[0068]
在本发明的非吸收性抗生物质及粘土矿物的复合物中,粘土矿物用作向胃黏液层传递上述非吸收性抗生物质的传递体,即,载体。上述复合物为在粘土矿物内插入非吸收性抗生物质的结构。口服给药上述非吸收性抗生物质及粘土矿物的复合物后经过食道到达胃后涂敷于胃黏液层来释放抗生物质(图2)。即,本发明的复合物不经过口服给药后经过食道到达胃后溶解抗生物质,溶解的抗生物质移动至肠中吸收后经过血管移动后通过胃黏膜释放来根除幽门螺杆菌的过程来根除。
[0069][0070]
本发明的粘土矿物为片状结构,能够涂敷在胃黏液层(黏膜),药物担载能力优秀,因此能够靶向治疗胃黏液层。并且,能够在患处有效保持最小抑菌浓度(mic),从而减轻患者对抗生物质的负担。
[0071][0072]
本发明的非吸收性抗生物质及粘土矿物的复合物可以利用本发明所属技术领域公开的常规方法制备。迄今许多论文等公开了结合粘土矿物与药物的复合物的制备方法,本发明所属技术领域的普通技术人员可以适当利用这些方法制备本发明的复合物。例如,本发明的非吸收性抗生物质及粘土矿物的复合物可以通过作为参照而包括于本发明的韩国授权专利第10-1541876号的方法来制备。在此情况下,本发明的复合物可以通过包括如下步骤的复合物的制备方法来制备,即,包括:通过离子交换膜将具有膨胀性网格结构的粘土矿物微粒子的分散溶液及抗生物质溶液分别向相互分离的第一空间及第二空间供应并保持第一时间长的时间的步骤;以及从上述第二空间去除上述抗生物质溶液后向上述第二空间供应抗生物质离子洗涤溶液的步骤。
[0073][0074]
β-内酰胺类抗生素
[0075]
本发明的非吸收性抗生物质及粘土矿物的复合物可以与β-内酰胺类抗生素和/或胃酸抑制剂一起向对象给药。因此,除了非吸收性抗生物质及粘土矿物的复合物以外,本发明的药物组合物及试剂盒还可以包含β-内酰胺类抗生素及胃酸抑制剂。
[0076][0077]
上述β-内酰胺类抗生素可以为青霉素、甲氧西林(methicillin)、氨苄西林(ampicillin)、阿莫西林、头孢菌素、碳青霉烯类等,优选地,可以为阿莫西林。
[0078][0079]
胃酸抑制剂
[0080]
本发明的非吸收性抗生物质及粘土矿物的复合物可以与β-内酰胺类抗生素和/或胃酸抑制剂一起向对象给药。本发明的胃酸抑制剂为质子泵抑制剂。本发明的胃酸抑制剂只要是通常用作胃酸抑制剂的就不受特别限制。例如,本发明的胃酸抑制剂可以为奥美拉唑(omeprazole)、埃索美拉唑(esomeprazole)、雷贝拉唑(rabeprazole)、兰索拉唑(lansoprazole)、泮托拉唑(pantoprazole)等。若使用本发明药物组合物或者试剂盒的对象的胃虚弱或者胃酸分泌过度,则可以联合给药胃酸抑制剂与非吸收性抗生物质及粘土矿物的复合物。
[0081][0082]
试剂盒
[0083]
本发明的试剂盒包含非吸收性抗生物质及粘土矿物的复合物。优选地,本发明的
试剂盒还包含β-内酰胺类抗生素和/或胃酸抑制剂。本发明的试剂盒是用于根除幽门螺杆菌的口服试剂盒。
[0084][0085]
药物组合物
[0086]
本发明的药物组合物包含非吸收性抗生物质及粘土矿物的复合。优选地,本发明的药物组合物还包含β-内酰胺类抗生素和/或胃酸抑制剂。
[0087][0088]
口服给药后本发明的药物组合物的上述非吸收性抗生物质及粘土矿物的复合物经过食道到达胃后涂敷于胃黏液层来释放抗生物质。上述药物组合物具有脲酶抑制活性,可以是用于预防或者治疗幽门螺杆菌引起的胃肠疾病的药物组合物。
[0089][0090]
本发明的药物组合物可以是用于预防或者治疗幽门螺杆菌引起的胃肠疾病的药物组合物。上述幽门螺杆菌引起的胃肠疾病可以为胃肠道损伤、胃炎、胃溃疡、十二指肠溃疡、胃炎、胃癌或者malt淋巴瘤。
[0091][0092]
本发明的药物组合物可以包含0.01重量百分比至80重量百分比的上述非吸收性抗生物质及粘土矿物的复合物、β-内酰胺类抗生素和/或胃酸抑制剂。但是,这可以根据给药人员的需要增减,可以根据年龄、饮食、营养状态、疾病进展程度而适当地增减。本发明所属技术领域的普通技术人员可以适当地确定上述非吸收性抗生物质及粘土矿物的复合物、β-内酰胺类抗生素和/或胃酸抑制剂在本发明的药物组合物中的比例,即,组成。
[0093][0094]
本发明的药物组合物可以口服给药,能够以常规药品制剂的形态使用。优选的药剂学制剂由片剂、硬质或软质胶囊、液剂、悬浮剂、糖浆、咀嚼片等之类的口服制剂,上述药剂学制剂可以使用药剂学上可接受的载体,例如,在口服制剂的情况下,可以使用赋形剂、结合剂、崩解剂、滑泽剂、可溶剂、悬浮化剂、保存剂或者增量剂等来制备。
[0095][0096]
本发明的药物组合物的给药剂量可以根据患者的状态、年龄、性别及并发症等多种因素通过专家来确定,成人通常能够以0.1mg~10g/kg的剂量的给用,优选地,能够以10mg~5g/kg的剂量给用。并且,单位剂型可以包含一天的剂量,或者一天剂量的1/2、1/3或者1/4的剂量,可以一天给药1次至6次。但在以保健及卫生为目的或者以健康调节为目的服用的情况下,上述剂量可以为上述范围以下,可以通过负责医生进行适当的调节。
[0097][0098]
幽门螺杆菌引起的疾病
[0099]
本发明的药物组合物及试剂盒可以用于预防、改善或治疗幽门螺杆菌引起的疾病。上述幽门螺杆菌引起的疾病可以为胃肠道损伤、胃炎、胃溃疡、十二指肠溃疡、胃炎、胃癌或者malt淋巴瘤。上述幽门螺杆菌可以为常规幽门螺杆菌,可以为耐抗生素幽门螺杆菌。在此情况下,耐抗生素幽门螺杆菌可以为耐克拉霉素的幽门螺杆菌。本发明的药物组合物及试剂盒对耐克拉霉素的幽门螺杆菌具有根除活性。
[0100][0101]
治疗方法或者根除方法
[0102]
本发明涉及幽门螺杆菌的根除方法,包括向对象口服给药本发明的药物组合物的步骤。并且,本发明涉及耐抗生素幽门螺杆菌的根除方法,包括向对象口服给药本发明的药物组合物的步骤。并且,本发明涉及预防、改善或者治疗幽门螺杆菌引起的疾病的方法,包括向对象口服给药本发明的药物组合物的步骤。并且,本发明涉及预防、改善或者治疗耐抗生素幽门螺杆菌引起的疾病的方法,包括向对象口服给药本发明的药物组合物的步骤。
[0103][0104]
上述对象可以为诊断患有幽门螺杆菌感染的哺乳动物,或者是怀疑患有幽门螺杆菌感染的哺乳动物。并且,上述对象可以为诊断患有耐抗生素幽门螺杆菌感染的哺乳动物,或者是怀疑患有耐抗生素幽门螺杆菌感染的哺乳动物。上述哺乳动物包括人类。因此,本发明的治疗方法可以治疗已感染耐抗生素幽门螺杆菌的对象或者怀疑感染耐抗生素幽门螺杆菌,比以往的幽门螺杆菌根除用药品的治疗对象范围更广。并且,本发明的根除方法还可以根除耐抗生素幽门螺杆菌,因此比以往的幽门螺杆菌根除用药品的治疗对象范围更广。
[0105][0106]
耐抗生素幽门螺杆菌
[0107]
本发明的非吸收性抗生物质及粘土矿物的复合物或者包含上述复合物的药物组合物对耐抗生素幽门螺杆菌具有根除活性。优选地,上述耐抗生素幽门螺杆菌为耐克拉霉素的幽门螺杆菌。例如,上述耐抗生素幽门螺杆菌可以为单独对克拉霉素有耐药性的幽门螺杆菌,可以为同时对克拉霉素及甲硝唑(metronidazole)有耐药性的幽门螺杆菌,或者除克拉霉素以外还对选自甲硝唑、四环素、左氧氟沙星(levofloxacin)等中一种以上抗生素有耐药性,即,对多种抗生素有耐药性的幽门螺杆菌。幽门螺杆菌对阿莫西林(amoxicillin)的耐药性小于10%,相反,近来幽门螺杆菌对克拉霉素的耐药性呈上升趋势,克拉霉素耐药性成为幽门螺杆菌根除治疗失败的主要原因。因此,具有耐克拉霉素的幽门螺杆菌根除活性的本发明的非吸收性抗生物质及粘土矿物的复合物或者包含上述复合物的药物组合物尤其对以往根除治疗失败的对象有效。
[0108][0109]
参照详细后述的实施例,可以明确理解本发明的优点、特征以及实现它们的方法。但是,本发明不限于以下公开的实施例,而是能够以多种不同的形式实现,提供这些实施例仅仅是为了使本发明的公开得以完整,并且向本发明所属技术领域的普通技术人员充分地告知本发明的范畴,本发明仅由发明要求保护范围定义。
[0110][0111]
材料及方法
[0112]
实验伦理
[0113]
得到韩国仁川的国家消化系统疾病保健产品开发功效评价中心(national center of efficacy evaluation for the development of health products targeting digestive disorders)的动物保护与利用委员会(the institutional animal care and use committee)的认可后对大鼠进行动物实验。小鼠实验通过韩国圆光大学药学院的动物保护与利用委员会的审查并得到认可。小鼠根据益山的圆光大学的用于利用及管理动物的指南及管制进行处理,供应充足的水和标准实验食物。
[0114][0115]
统计分析
[0116]
数据以平均值
±
标准差(sd)的方式表示,实验组利用非参数曼-惠特尼u(mann-whitney-u)检验来比较。利用minitab统计软件程序(minitab inc.公司,宾夕法尼亚州,美国)对检验比率取95%cis。若两个值的95%ci不重叠,则将其视作显著不同。将p值《0.05视为具有统计学意义。利用社会科学统计软件包(statistics package for social science)(spss 12.0 for windows;spss inc.公司,芝加哥,伊利诺伊州,美国)分析结果。
[0117][0118]
实验例1.抗生物质-粘土矿物复合物的根除活性
[0119]
1-1.抗生物质的插入
[0120]
利用bio basic inc.公司生产的美国药典(united states pharmacopeia,usp)等级的硫酸庆大霉素制备庆大霉素溶液(2mg/ml)。
[0121][0122]
ca-蒙皂石(smectite)是通过提纯韩国庆北地区的膨润土制备的。作为庆大霉素-蒙皂石复合物的s-gen(插入庆大霉素的蒙皂石混合物)是在每克ca-蒙皂石混合250ml的庆大霉素溶液后用力搅拌24小时来制备的。在本说明书中,作为庆大霉素-蒙皂石复合物的术语s-gen(插入庆大霉素的蒙皂石混合物)可以与术语s-gm可以互换使用。混合后,在50℃的温度下使用5l的蒸馏水透析混合物8小时,反复该过程3次到4次,直到使用pbcl2无法检出硫酸根离子为止。将透析2天至3天的混合物溶液冷冻干燥来获得混合物粉末。从混合物释放的庆大霉素的量通过批量释放测试来确定,在此情况下,向相同的100mg的混合物粉末反复加入25ml的ph 1.2的溶液。利用液相色谱质谱联用(lc-ms)测定上层液中庆大霉素的浓度。液相色谱(lc)分析是利用thermo scientific ics系统进行的。微谱(ms)分析是利用电喷雾离子化和thermo scientific msq plus的单四极杆(quadrupole)质谱仪进行的。确认到1小时内释放的庆大霉素的总量为每100mg混合物的5.0mg。
[0123][0124]
另一方面,以相同的方法使用萘替米星替代庆大霉素来制备作为奈替米星-蒙皂石复合物的s-net。
[0125][0126]
1-2.在体外评估根除活性
[0127]
评估了s-gen及s-net的根除活性。将幽门螺杆菌涂敷于培养基(红色)后,将试样制备为圆盘形态放置于培养基上来检测根除功效。在此情况下,圆盘周围的红色消失表明具有根除功效。
[0128][0129]
结果,确认到庆大霉素-蒙皂石复合物(s-gen)及奈替米星-蒙皂石复合物(s-net)都具有幽门螺杆菌的根除活性(图3及图4,图3的左侧上端:蒙皂石;右侧上端:s-gen;下侧:庆大霉素;图4的左侧:蒙皂石;右侧:s-net)。
[0130][0131]
实验例2.涂敷大鼠的胃黏膜
[0132]
从韩国乌山的samtako ltd.公司购入7周龄的雄性sprague-dawley大鼠(体重220g
±
20%)用于胃黏膜涂敷测试。在实验24小时前使大鼠禁食。在使10只大鼠分为两个
组,分别服用10ml/kg(150mg/kg)的蒙皂石或者s-gen,1小时后实施安乐死。为了分析胃黏膜的涂敷效率,沿着大鼠的胃沿胃大弯(greater curvature)切除、切开并固定(pinned)。根据下述式1计算胃分布比例。
[0133][0134]
式1
[0135]
胃分布比例(%)={胃分布区域(cm2)/胃全部区域(cm2)}
×
100
[0136][0137]
比例及区域是利用leica application suite v4(leica microsystems ltd.公司,韩国)分析的。胃分布比例以平均值(
±
标准差)表示。
[0138][0139]
实验例3.在体内的抗-幽门螺杆菌药效
[0140]
3-1.实验动物的接种
[0141]
从日本静冈的japan slc inc.公司购入4周龄的雄性c57bl/6小鼠用于评估抗-幽门螺杆菌。在实验开始时,小鼠为5周龄,体重为18g至20g。使用幽门螺杆菌ss1用于接种。在布鲁氏菌血琼脂(merck公司,德国)中以微好氧(10%co2、85%n2以及5%o2)、37℃的条件培养细菌72小时。为了在体内评估抗-幽门螺杆菌,在实验前使80只小鼠适应1周。
[0142][0143]
适应1周后,使动物禁食12小时,使用0.5ml的2.0
×
109cfu/ml的幽门螺杆菌悬液感染70只,以每隔48小时通过口服摄取方式给药到胃内,每周给药3次。将接种当日记为第0天,之后记为第1天至第21天。将未感染的组用作正常对照组,接受相等体积的磷酸盐缓冲溶液(pbs)及蒸馏水。
[0144][0145]
3-2.实验动物的处理
[0146]
将小鼠以10只为一组分为8组,最后一次接种后休息1周。
[0147]
组1:正常组,未感染的小鼠。
[0148]
组2:未处理组,接受蒸馏水。
[0149]
组3:使用阿莫西林(14.25mg/kg)、克拉霉素(clarithromycin)(7.15mg/kg)及胃酸抑制剂(质子泵抑制剂(proton pump inhibitor,ppi))(在以400μmol/kg的量接受质子泵抑制剂的所有组中使用奥美拉唑)处理,用作阳性对照组。
[0150]
组4:使用阿莫西林(14.25mg/kg)、庆大霉素(4mg/kg)及质子泵抑制剂(400μmol/kg)处理。
[0151]
组5:使用阿莫西林(14.25mg/kg)、s-gen(78mg/kg)及质子泵抑制剂(400μmol/kg)处理。
[0152]
组6:使用庆大霉素(4mg/kg)及质子泵抑制剂(400μmol/kg)处理。
[0153]
组7:使用s-gen(78mg/kg)及质子泵抑制剂(400μmol/kg)。
[0154]
组8:使用阿莫西林(14.25mg/kg)及质子泵抑制剂(400μmol/kg)处理。
[0155][0156]
以一天一次连续口服给药7天的方式进行上述处理。为了确认感染的小鼠中幽门螺杆菌的血清学状态,在处理前使用酶联免疫吸附测定(elisa)试剂盒(cusabio biotech co.公司,美国)确认了幽门螺杆菌免疫球蛋白g(igg)的水平。
[0157][0158]
实验例4.确认细菌
[0159]
最后一次给药12小时后,对小鼠实施安乐死并提取胃组织。为了在幽门中进行胃黏膜的弯曲杆菌样生物(campylobacter-like organism,clo)检测及有关及幽门螺杆菌的聚合酶链式反应,进行活体检查。进而,在每只小鼠的直肠及大肠中收集0.5g的大便并悬浮于相同体积的蒸馏水中,过滤后用于幽门螺杆菌抗原(ag)检查及进行大便中幽门螺杆菌的聚合酶链式反应。
[0160][0161]
4-1.clo检侧
[0162]
使用clo试剂盒(asan pharmaceutical co.公司,首尔,韩国)分析幽门部的胃黏膜样品,为了检测脲酶(urease)活性,在37℃的温度下培养12小时。反应(颜色变化)时颜色为淡黄色看作阴性,颜色为暗红色看作阳性。反应分数从0到3,0表示没有颜色变化,1表示淡红色,2表示淡紫色,3表示暗红色。
[0163][0164]
4-2.胃黏膜中幽门螺杆菌的聚合酶链式反应
[0165]
利用珠磨/苯酚提取方法(kim b-j,lee s-h,lyum-a et al.identification of mycobacterial species by comparative sequence analysis of the rna polymerase gene(rpob).j clin microbiol 1999;37:1714-20)制备幽门螺杆菌脱氧核糖核酸(dna)。将细菌悬液放入装有200μl的苯酚、三氯甲烷、异戊醇(50∶49∶1)及200μl(调节体积(paced volume))的玻璃珠(直径0.1mm;biospec products公司,巴特尔斯维尔,俄克拉何马州,美国)的2.0ml的螺旋盖微型离心管。使用微型珠磨机(beater)(biospec products公司)震动离心管30秒钟,为了相分离,进行了离心分离(15分钟,12000g)。之后,将水相(aqueous phase)移到其他干净的离心管中,加入10μl的3m的醋酸钠及250μl的非常冷的无水(absolute)乙醇。为了使dna沉淀,将混合物在-20℃的温度下保持10分钟。将获得的dna颗粒溶解于60μl的三乙二胺四乙酸(tris-edta)缓冲液(ph 8.0)中,将其用作用于聚合酶链式反应的模板dna。聚合酶链式反应时使用accupower pcr premix(bioneer公司,大田,韩国)进行的。首次变性/活化步骤(5分钟,95℃)后,将dna(50ng)在20μl的体积中利用下述引物进行变性(60秒钟,94℃)、退火(60秒钟,62℃)及延伸(90秒钟,72℃),进行35个周期来扩增:幽门螺杆菌-特异性urea及urec,正义50-tgatgctccactacgctgga-30(序列1)及反义50-gggtatgcacggttacgagt-30(序列2)(预想产物265bp)(kim yb,kim st,lee sw et al.the influence of number of gastroscopic biopsy specimens on follow-up campylobacter-like organism(clo)test.korean j gastroenterol 2000;35:422-8)及甘油醛-3-磷酸脱氢酶(gapdh)、正义50-tggggtgatgctggtgctg-ag-30(序列3)及反义50-ggtttctc caggcggcatgtc-30(序列4)(预想产物497bp)(kundu p,mukhopadhyay ak,patra r et al.cag pathogenicity is and independent up-regulation of matrix metalloproteinases-9 and
ꢀ‑
2 secretion andexpression in mice by helicobacter pylori感染.j biol chem2006;281:34651-62)。在1.5%的琼脂糖凝胶中通过电泳来分析聚合酶链式反应产物。
[0166][0167]
4-3.检查小鼠大便中的幽门螺杆菌抗原
[0168]
使用商业上可利用的sd bioline幽门螺杆菌抗原试剂盒(standard diagnostics公司)根据制造商的指南评估了幽门螺杆菌抗原。在室温下将标本(250mg)与稀释溶液一同培养30分钟,然后将100μl放入幽门螺杆菌抗原测试装置。15分钟后查看结果。一条红线表示阴性,两条红线表示幽门螺杆菌阳性结果(moon d-i,shin e-h,oh h-g et al.usefulness of a helicobacter pylori stool antigen test for diagnosing h.pylori infected c57bl/6mice.lab anim res 2013;29:27-32)。
[0169][0170]
4-4.小鼠大便中幽门螺杆菌的聚合酶链式反应
[0171]
使用accuprep stool dna extraction kit(bioneer公司,大田,韩国)根据制造商的指南从大便样本中提取基因组dna。(lee j-u,jung k,kim o.absence of vertical transmission of helicobacter pylori in an experimental murine model.jvetsci 2006;7:225-8)。将序列1及序列2的引物对用于扩增幽门螺杆菌-特异性urea及urec(265bp)(kim yb,kim st,lee sw et al.the influence of number of gastroscopic biopsy specimens on follow-up campylobacter-like organism(clo)test.korean j gastroenterol 2000;35:422-8)。将模板dna(50ng)及20pmol的各引物放入包含1u的taq dna聚合酶、250μm的各脱氧核糖核苷三磷酸、50mm的tris-hcl(ph 8.3)、40mm的kcl、1.5mm的mgcl2及凝胶加载染料的聚合酶链式反应混合物试管中。使用蒸馏水将体积调节为20μl。在95℃的温度下进行5分钟的初始变性后,对反应混合物实施35个扩增周期(在94℃的温度下60秒钟、62℃的温度下60秒钟以及在72℃的温度下90秒钟),之后72℃的温度下延伸10分钟(geneamp 9700,perkin elmer公司,美国)。
[0172][0173]
在1.5%的琼脂糖凝胶中对聚合酶链式反应产物进行电泳(lee h-a,park y-s,kimo.prevalence of helicobacter species in feces of dogs using polymerase chain reaction analysis.lab anim res 2007;23:339-44)。
[0174][0175]
实验例5.炎性细胞因子的定量化
[0176]
为了分析第21天的白细胞介素8(il-8)及肿瘤坏死因子α(tnf-α),通过向小鼠的眼(ophthalmic)静脉丛(venous plexus)内插入肝素化的(heparinized)微型血细胞比容(microhaematocrit)管来获取血浆。利用小鼠酶联免疫吸附测定试剂盒(r&dsystems,minneapolis公司,明尼苏达州,美国)检测血浆白细胞介素8及肿瘤坏死因子α的水平。
[0177][0178]
实验例6.s-gen在体内根据处理条件的抗-幽门螺杆菌药效
[0179]
6-1.实验动物的接种
[0180]
从日本静冈的japan slc inc.公司购入雄性c57bl/6小鼠用于评估抗-幽门螺杆菌。使4周龄的小鼠适应后,在1周内使用幽门螺杆菌ss1经3次使其感染并保持2周,之后,将试验物质以规定的剂量悬浮后在每天的同一时间对小鼠以10ml/kg的剂量口服给药。在情况下,以一天一次的方式口服给药7天。
[0181]
6-2.实验动物的处理
[0182]
将小鼠以10只为一组分为5组,最后一次接种后休息1周。
[0183]
正常对照组:vehicle(没有感染),给药磷酸盐缓冲溶液。接受10mg/kg的蒸馏水。
[0184]
阴性对照组:vehicle(感染幽门螺杆菌),接受10mg/kg的蒸馏水。
[0185]
试验组1:(感染幽门螺杆菌)amx(14.25mg/kg/day),clr(14.3mg/kg/day),ppi(138mg/kg/day)。
[0186]
试验组2:(感染幽门螺杆菌)amx(14.25mg/kg/day),s-gm(202mg/kg/day),ppi(138mg/kg/day)(在此情况下,庆大霉素8mg/kg)。
[0187]
试验组3:(感染幽门螺杆菌)amx(14.25mg/kg/day),s-gm(101mg/kg/day)。
[0188][0189]
其中,amx:阿莫西林;clr:克拉霉素;s-gm:插入庆大霉素的蒙皂石混合物;ppi:胃酸抑制剂。
[0193][0194]
实验例7.s-gm对耐抗生素幽门螺杆菌的根除效果
[0195]
7-1.评估抗生素耐药率
[0196]
检测了现在临床上实际用于幽门螺杆菌根除治疗的抗生素(阿莫西林、克拉霉素、甲硝唑、左氧氟沙星、四环素)和与蒙皂石制备为复合物来用作新型治疗剂的非吸收性抗生素的候选组(庆大霉素、奈替米星、妥布霉素、阿米卡星)在体外的最小抑菌浓度(in vitro mic),确认mic50、mic90。为此,使用了在1265名患者样本中获得的187个培养阳性临床菌株。
[0197][0198]
7-2.在体外评估根除活性
[0199]
评估了s-gm及克拉霉素对耐克拉霉素菌株(克拉霉素的最小抑菌浓度:48mg/l)的根除活性。将耐克拉霉素的幽门螺杆菌涂敷于培养基(红色)后,将试样制备为圆盘形态放置于培养基上来检测根除功效。在此情况下,圆盘周围的红色消失表明具有根除功效。
[0200][0201]
结果
[0202]
实验例2的结果
[0203]
涂敷大鼠的胃黏液层
[0204]
选择10ml/kg(150mg/kg)的实验条件,考虑到药物从混合物中释放的时间,在口服给药1小时后对实验大鼠实施安乐死。s-gen表现出60.2%(
±
14.3%)的涂敷比例。
[0205][0206]
实验例3的结果
[0207]
体内的抗-幽门螺杆菌评估
[0208]
为了评估s-gen在体内对幽门螺杆菌的药效,制备了幽门螺杆菌感染模型(图5)。并且,为了确认幽门螺杆菌感染,在处理前后确认了幽门螺杆菌免疫球蛋白g的水平(表1:各组中幽门螺杆菌免疫球蛋白g的血浆浓度)。
[0209][0210]
表1
[0211]
amx:阿莫西林;clr:克拉霉素;gen:庆大霉素。a数据以70只感染的小鼠(组2至8)的平均值
±
标准差的方式表示。*表示与组1显著不同(p<0.01),**表示与组2显著不同(p<0.01)。
[0217][0218]
实验例4的结果
[0219]
胃黏膜的幽门螺杆菌聚合酶链式反应及clo检测
[0220]
在小鼠中,通过在胃内反复接种幽门螺杆菌来形成胃黏膜的clo检测的阳性反应(红色)(表2:处理后胃黏膜clo检测结果)。
[0221][0222]
表2组aclo检测阴性的动物的百分比(95%cib)clo值组1100(72.2-100.0)0.0
±
0.0组20(0.0-27.6)3.0
±
0.0组370(39.7-89.2)*0.9
±
1.5*组460(31.2-83.1)*1.2
±
1.6*组580(49.0-94.3)*0.6
±
1.3*组650(23.7-76.3)1.5
±
1.6组760(31.2-83.1)*1.2
±
1.6*组860(31.2-83.1)*1.2
±
1.6*
[0223][0224]
a:各组由10只小鼠组成。
[0225]
b:发生率(incidence percentage)(95%ci)是通过minitab统计程序计算的。
[0226]
*表示与组2显著不同(p<0.05)。
[0227][0228]
胃黏膜的治愈率(100-阳性反应)从组3至组8分别为70%、60%、80%、50%、60%及60%。组5的clo分数在感染幽门螺杆菌的组中最低,比组2的弯曲杆菌样分数显著低。
[0229][0230]
在1.5%的琼脂糖凝胶中对幽门螺杆菌-特异性urea及urec(265bp)的聚合酶链式反应产物进行电泳并可视化(图6)。
[0231][0232]
治愈率是以与通过clo检测确认的方式相同的方式确认的。
[0233][0234]
小鼠大便中幽门螺杆菌抗原及聚合酶链式反应
[0235]
为了在大便中检测幽门螺杆菌,使用了大便抗原试剂盒。在组2中观察到阳性结果,而在其他组中继续观察到阴性结果。
[0236][0237]
为了在幽门螺杆菌-感染的小鼠中评估治疗效果,进行了幽门螺杆菌聚合酶链式反应(表3:处理后大便中幽门螺杆菌的聚合酶链式反应分析)。治愈率在组3(标准治疗)及组5(使用阿莫西林/s-gen/质子泵抑制剂治疗)中分别为90%及100%。
[0238][0239]
表3组a通过大便聚合酶链式反应的阴性动物的百分比(95%cib)组1100(72.2-100.0)组20(0-27.6)组390(60.0-98.2)*组480(49.0-94.3)*组5100(72.2-100.0)*组670(39.7-89.2)*组780(49.0-94.3)*组870(39.7-89.2)*
[0240]
a:各组由10只小鼠组成。
[0241][0242]
182b:发生率(incidence percentage)(95%ci)是通过minitab统计程序计算的。
[0243]
*表示与组2显著不同(p<0.05)。
[0244][0245]
实验例5的结果
[0246]
炎性细胞因子的定量化
[0247]
为了确认包含s-gen的抗-幽门螺杆菌给细胞因子的生成带来的影响,在小鼠中检测了炎性细胞因子的血浆浓度(表4)。治疗组中的白细胞介素8及肿瘤坏死因子α的水平较组2显著低(表4:白细胞介素8及肿瘤坏死因子α的血浆浓度)。组5的白细胞介素8及肿瘤坏死因子α的血浆水平在处理组中最低。
[0248][0249]
表4组a白细胞介素8浓度(μg/ml)肿瘤坏死因子α(μg/ml)组13.73
±
0.82*16.14
±
4.99*组27.71
±
0.6644.43
±
6.23组34.12
±
0.45*23.59
±
0.48**组43.98
±
0.21*23.20
±
2.52**组53.57
±
0.38*17.65
±
3.21**
组64.24
±
0.42*24.30
±
1.84**组74.08
±
0.25*18.76
±
1.33**组84.52
±
0.36*22.13
±
3.59**
[0250]
数据以每组10只小鼠的平均值
±
标准差的方式表示(μg/ml)。
[0251]
a:各组由10只小鼠组成。
[0252]
*表示与组2显著不同(p<0.05)
[0253]
**表示与组2显著不同(p<0.01)
[0254][0255]
实验例6的结果
[0256]
在实验例6中处理的实验动物如下述表5所示。
[0257][0258]
表5
[0259]
[一次给药剂量](**一天给药一次)
[0260]
[261-264]amx:阿莫西林,clr:克拉霉素,s-gm:插入庆大霉素的蒙皂石混合物,ppi:胃酸抑制剂。
[0265][0266]
血中幽门螺杆菌(h.pylori)免疫球蛋白g抗体滴度
[0267]
1)确认是否感染幽门螺杆菌及用于组构成的检测结果
[0268]
通过酶联免疫吸附测定方法测定幽门螺杆菌抗体并以平均值及标准差计算的结果显示,非感染组的平均值为0.04
±
0.01,感染组的平均值为0.10
±
0.10。感染组的幽门螺杆菌抗体与非感染组相比增加至150.0%,统计学上显著上升了(p<0.05)(表6)。
[0268][0269]
表6 幽门螺杆菌免疫球蛋白g检测非感染组0.04
±
0.01感染组0.10
±
0.10*
[0271][0272]
感染1周后幽门螺杆菌抗体免疫球蛋白g检测值
[0273]
数据以平均值
±
标准差的方式表示。统计学分析是通过sigma plot statistic进行的。*表示与非感染组比较,*p《0.05。
[0274][0275]
2)最终幽门螺杆菌抗体免疫球蛋白g测定结果
[0276]
解剖检查时在血液中测定幽门螺杆菌抗体并以平均值及标准差的方式计算的结
果,非感染组(正常对照组):0.33
±
0.13,作为感染对照组的阴性对照组:0.63
±
0.29,试验组1(amx+clr+ppi给药组):0.27
±
0.07,试验组2(amx+s-gm+ppi给药组):0.19
±
0.04,试验组3(amx+s-gm给药组):0.22
±
0.06。
[0277][0278]
感染幽门螺杆菌的阴性对照组中测定的幽门螺杆菌抗体与没有感染幽门螺杆菌的作为非感染组的正常对照组上升了90.9%以上,确认在统计学上显著地保持了幽门螺杆菌的感染(p《0.01)。作为阳性对照物质的试验组1(amx+clr+ppi给药组)的幽门螺杆菌抗体与阴性对照组相比在统计学上显著减少57.1%(p《0.01)。作为试验物质组的试验组2(amx+s-gm+ppi给药组)及试验组3(amx+s-gm给药组)中的幽门螺杆菌抗体与阴性对照组相比分别在统计学上显著减少69.8%及65.1%(p《0.01)。作为试验物质组的试验组2和试验组3与作为阳性对照组的试验组1分别在统计学上显著减少29.6%、18.5%,尤其试验组2的减少效果突出(p《0.01,p《0.05)。
[0279][0280]
胃组织病理学分析结果
[0281]
解剖检查后摘出为组织并用肉眼观察的结果,在非感染组(正常对照组)与作为感染组的阴性对照组及试验组1至试验组3中均未观察到特异变化。组织病理结果,对在胃组织中观察所见的黏膜上皮细胞消失(damage of the surface epithelium)、炎症细胞浸润(inflammatory cell infiltration)及黏膜下水肿(submucosal edema)进行分数化。各项目均未观察到为0分,轻微(mild)为0.5分,中等(moderate)为1分。
[0282][0283]
结果,在正常对照组中观察到上皮细胞消失为0.10
±
0.21分,炎症细胞浸润为0.15
±
0.24分,黏膜下水肿为0.10
±
0.32分,总分数(total score)为0.35
±
0.41分。在阴性对照组中观察到上皮细胞消失为0.65
±
0.34分,炎症细胞浸润为0.40
±
0.32分,黏膜下水肿为0.55
±
0.37,总分数为1.60
±
0.81。在试验组1(amx+clr+ppi给药组)中观察到上皮细胞消失为0.30
±
0.42分,炎症细胞浸润为0.40
±
0.46分,黏膜下水肿为0.60
±
0.46分,总分数为1.30
±
1.14分。在试验组2(amx+s-gm+ppi给药组)中观察到上皮细胞消失为0.30
±
0.35分,炎症细胞浸润为0.15
±
0.24分,黏膜下水肿为0.35
±
0.34分,总分数为0.80
±
0.79分。在试验组3(amx+s-gm+ppi给药组)中观察到上皮细胞消失为0.60
±
0.39分,炎症细胞浸润为0.40
±
0.46,黏膜下水肿为0.65
±
0.41分,总分数为1.65
±
1.11分(表7)。
[0284][0285]
表7
gm+ppi给药组)为70%,在试验组3(amx+s-gm给药组)为10%,试验组2表现出最佳治疗率(表8)。
[0301][0302]
表8
[0303][0304]
实验例7的结果
[0305]
不同抗生素的耐药率
[0306]
克拉霉素的耐药率显出很高的29.8%,而临床上不常用于幽门螺杆菌根除的左氧氟沙星的耐药性则显出最高的37.2%。因此判断克拉霉素不适合用在制备粘土矿物复合物。在作为用于粘土矿物复合物的候选抗生素组的氨基糖苷类抗生素中,在以最小抑菌浓度1μg/ml为基准时,庆大霉素和奈替米星表现出比较低的最小抑菌浓度和耐药率(分别为2.78%、1.43%),因此判断为适当的候选抗生素组。但妥布霉素(tobramycin,tob)的耐药率为36.3%,阿米卡星(amikacin,amk)的耐药率为61.3%,因此判断为不适于候选抗生素组(图7)。amx:阿莫西林,clr:克拉霉素,mtz:甲硝唑,tet:四环素,lev:左氧氟沙星,gm:庆大霉素,net:奈替米星,tob:妥布霉素,amk:阿米卡星。
[0307][0308]
对克拉霉素耐药菌的根除效果
[0309]
在体外评估了对耐克拉霉素的幽门螺杆菌的根除效果。经过两次反复试验的结果,庆大霉素-蒙皂石复合物(s-gm)在圆盘周围出现了净区(clear zone)。因此确认庆大霉素-蒙皂石复合物(s-gm)对耐克拉霉素的幽门螺杆菌具有根除活性。相反,克拉霉素(clr)未在圆盘周围出现净区。2次反复的试验显出相同的结果,各结果如图8a及图8b所示。(图8a及图8b:上端:clr:克拉霉素,下端:s-gen:庆大霉素-蒙皂石复合物)。
[0310][0311]
分析实验结果
[0312]
在本发明中,在小鼠模型中评估了s-gen的抗-幽门螺杆菌药效。本发明的实验结果证明,与包括现在作为治疗幽门螺杆菌的国际性标准三联(triple)疗法在内的其他治疗方法相比,在减少小鼠胃中的幽门螺杆菌负载方面,s-gen具有相当改善的抗微生物药效。
[0313][0314]
本发明人开发s-gen并评估了其是否对幽门螺杆菌感染的治疗有效。幽门螺杆菌主要生活在粘附于胃黏膜上皮表面的黏液层内。因此,为了有效治疗,s-gen须穿过上述黏
液层并留在胃壁上(on)。在本发明中,s-gen很好地分布在末端的胃壁(on),观察到有60.2%的s-gen的存在,这表明s-gen在1小时内就有效形成了驻留。该结果表明s-gen可以用于对幽门螺杆菌的直接根除。
[0315][0316]
在处理后使用胃黏膜进行的幽门螺杆菌聚合酶链式反应及clo检测的结果中,组5在治疗的组中表现出最高的治愈率(80%)。并且,组5的clo值在治疗的组中最低(0.6
±
1.3)。在组5中明确了抗-幽门螺杆菌药效。在治疗幽门螺杆菌感染后通过大便进行幽门螺杆菌聚合酶链式反应检查的情况下,只在组5中连续观察到阴性结果。因此,通过s-gen三联治疗所赋予的优秀的抗-幽门螺杆菌活性可以说明其直接的根除效果,以及与以往的抗生素的其他治疗方法相比,更长时间地涂敷于胃黏膜而更持续地发挥根除效果。
[0317][0318]
有趣的是,s-gen-治疗的小鼠在治疗幽门螺杆菌-感染后,与未治疗的小鼠相比,具有显著减少的幽门螺杆菌-诱导的促炎性(proinflammatory)细胞因子(白细胞介素8及肿瘤坏死因子α)。白细胞介素聚集中性粒细胞来促进炎症,肿瘤坏死因子α与白细胞介素1β(il-1β)一起诱导胃泌素的分泌,这说明在幽门螺杆菌-诱导的高胃泌素血症(hypergastrinaemia)及炎症反应中,这些细胞因子起了作用。对幽门螺杆菌的免疫反应会引发疾病。因此,通过在此观察的现象可以预想促炎症反应的减少就是在减少应对组织损伤的永久化负责的炎症反应。与其他治疗方法相比,s-gen治疗后具有更好的抗-幽门螺杆菌效果,并且可以通过早期清除集群化(colonization)来减少胃的炎症。
[0319][0320]
在本发明中,使用s-gen的治疗没有给小鼠的体重带来影响。这证明口服给药蒙皂石的安全性,并表明庆大霉素未通过胃黏膜吸收。
[0321][0322]
本发明人通过对抗幽门螺杆菌证明了s-gen的强效抗微生物活性及s-gen在胃黏膜层中的长期涂敷效果。s-gen处理的小鼠比起通过包含胃酸分泌抑制剂的二联(double)或者三联疗法治疗的小鼠或者未治疗的小鼠,在体内减少了细菌负担。并且追加了直接根除效果,s-gen通过抑制促炎症细胞因子的生产来帮助减少炎症反应。
[0323][0324]
并且,可以确认将s-gen与β-内酰胺类抗生素及胃酸抑制剂一起给药时,幽门螺杆菌的根除效果比只将s-gen与β-内酰胺类抗生素一起给药时的根除效果显著高。
[0325][0326]
而且,幽门螺杆菌对作为临床上广泛使用的抗生素的克拉霉素的耐药率高达29.8%,但s-gen对耐克拉霉素的幽门螺杆菌仍具有根除活性,因此判断s-gen对使用克拉霉素得不到根除效果的患者也有效。
[0327][0328]
序列表的说明
[0329]
序列1为用于扩增幽门螺杆菌-特异性urea及urec的正义引物的碱基序列。
[0330]
序列2为用于扩增幽门螺杆菌-特异性urea及urec的反义引物的碱基序列。
[0331]
序列3为用于扩增甘油醛-3-磷酸脱氢酶的正义引物的碱基序列。
[0332]
序列4为用于扩增甘油醛-3-磷酸脱氢酶的反义引物的碱基序列。
[0333]
产业上的可利用性
[0334]
本发明的药物组合物及试剂盒包含板状粘土传递体,能够涂敷于胃黏膜,可以靶向治疗胃黏膜。并且,具有在酸碱度低的胃内环境中减少抗生素破坏、使对肠内细菌的影响最小化的优点。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1