使用IL-33拮抗剂的方法与流程
使用il-33拮抗剂的方法
1.本技术要求于2019年11月4日提交的欧洲专利申请号19206984.7的优先权。上述申请通过援引以其全文并入本文。
技术领域
2.本披露涉及一种用于预防或治疗上皮生理学异常或egfr介导的疾病的il-33拮抗剂,以及相应的预防或治疗方法,这些方法包括向有需要的患者施用il-33拮抗剂。
背景技术:
3.白介素33(il-33),也称为il-1f11,是il-1细胞因子家族的成员。il-33是270个氨基酸的蛋白质,其由两个结构域组成:同源结构域和细胞因子(il-1样)结构域。同源结构域含有核定位信号(nls)。已知il-33以不同的形式存在:还原形式(redil-33)和氧化形式(oxil-33)。先前的研究已经显示,还原形式在生理条件下被快速氧化以形成至少一个氧化形式的二硫键,并且该两种形式可能具有不同的结合模式和作用。
4.先前发现,il-33的还原形式与st2结合,并且实际上是th2细胞和肥大细胞表达的st2受体的唯一已知配体。还原型il-33通过结合st2,随后活化nfkb和map激酶路径来刺激靶细胞,从而产生细胞因子和趋化因子诸如il-4、il-5和il-13来促进炎症。可溶性st2(sst2)被认为是阻止还原型il-33信号传导的诱饵受体。
5.最近发现,il-33的氧化形式也具有生理作用。发现氧化型il-33不结合st2,而是与晚期糖基化终产物受体(rage)结合,并通过此替代路径进行信号传导。
6.il-33作为治疗靶标引起了人们极大的兴趣,这主要是由于现在已知的还原形式具有刺激st2并产生强烈的炎症性作用的能力。但是,对氧化型il-33路径作为治疗靶标的研究和兴趣很少,这部分是由于其后来的发现,以及由于rage具有许多配体且其下游相互作用尚未得到充分的了解。
7.本文更详细地描述了由氧化型il-33刺激产生的这些下游rage相互作用中的至少一种。已经惊讶地发现,rage与上皮生长因子受体(egfr)复合,作为氧化型il-33路径的一部分。还原型il-33迅速转化为氧化型il-33,然后该氧化型il-33与rage结合并与egfr复合以刺激egfr活性。egfr参与的惊讶发现的重要之处在于egfr是涉及上皮生理学异常方面的多种疾病的关键治疗靶标。
8.由于此发现,据信可以与il-33的任何形式结合的拮抗剂可以有效地阻止氧化型il-33的信号传导。此可以是直接通过与氧化型il-33本身结合,或间接通过抑制还原型il-33向氧化型il-33的转化,此两者又均阻止rage的刺激和egfr的刺激。此egfr刺激的减少将在任何egfr介导的疾病中,但特别是在egfr被过度刺激的病症中具有治疗益处。
9.已知egfr对上皮生理学具有多种稳态作用。egfr刺激增加上皮细胞分化,增加上皮细胞迁移,并增加上皮粘膜产生。据信,抑制egfr介导的信号传导将治疗或预防存在上皮生理学异常的障碍,诸如气道上皮组织重塑异常或粘液过度产生。
10.先前已将il-33与气道中的组织重塑相关联(li等人,jaci,2014 134:1422-32;
vannella等人,sci transl med[科学转化医学],337ra65;allinne等人,jaci,2019,144:1624-37)。然而,此被认为是通过自保持扩增环(self-perpetuating amplification loop)间接发生的,通过该自保持扩增环il-33信号传导上调il-33及其同源受体st2两者的表达,从而引起慢性st2轴信号传导。先前尚未建立或提出il-33本身直接影响气道上皮生物学,因为通过st2产生的活性是由上面表达st2的先天细胞,诸如巨噬细胞和2型先天淋巴样细胞介导的。
[0011]
如上所述,本披露基于以下发现:il-33也通过不同的机制:rage-egfr路径直接起作用以直接影响上皮生理学。此新理解很重要,因为其可以用于扩展il-33拮抗剂的治疗应用以治疗更多疾病、更多疾病症状和更多患者。通过靶向il-33直接控制和抑制il-33介导的egfr介导的信号传导的治疗机会先前尚未实现。
[0012]
本技术的披露内容首次显示,使用il-33拮抗剂可以通过直接抑制rage/egfr介导的oxil-33活性来直接影响受损的上皮修复反应,减少上皮杯状细胞的分化和增殖,减少粘液产生,并改进患有上皮生理学异常的患者(诸如患有copd或支气管炎的患者)的粘膜纤毛运动。因此,本文提出的研究支持il-33拮抗剂在直接预防或治疗典型地由egfr介导的作用引起,因此存在于egfr介导的疾病中的上皮生理学异常中的治疗用途。
技术实现要素:
[0013]
根据第一方面,提供了一种il-33拮抗剂,该il-33拮抗剂用于通过调节或抑制rage-egfr介导的作用来预防或治疗上皮生理学异常。
[0014]
根据替代的第一方面,提供了一种预防或治疗患者的上皮生理学异常的方法,该方法包括:向有需要的患者施用有效量的il-33拮抗剂以调节或抑制rage-egfr介导的作用。
[0015]
根据替代的第一方面,提供了il-33拮抗剂在制备用于预防或治疗上皮生理学异常的药物中的用途。
[0016]
根据第二方面,提供了一种il-33拮抗剂,该il-33拮抗剂用于预防或治疗egfr介导的疾病。
[0017]
根据替代的第二方面,提供了一种预防或治疗患者的egfr介导的疾病的方法,该方法包括:向有需要的患者施用有效量的il-33拮抗剂。
[0018]
根据替代的第二方面,提供了il-33拮抗剂在制备用于预防或治疗egfr介导的疾病的药物中的用途。
[0019]
根据第三方面,提供了一种il-33拮抗剂,该il-33拮抗剂用于通过改进上皮生理学来预防或治疗疾病。
[0020]
根据替代的第三方面,提供了一种通过改进患者的上皮生理学来预防或治疗呼吸疾病的方法,该方法包括:向有需要的患者施用有效量的il-33拮抗剂。
[0021]
根据替代的第三方面,提供了il-33拮抗剂在制备用于通过改进上皮生理学来预防或治疗呼吸疾病的药物中的用途。
[0022]
根据第四方面,提供了一种il-33拮抗剂,该il-33拮抗剂用于通过抑制egfr介导的作用来预防或治疗疾病。
[0023]
根据替代的第四方面,提供了一种通过抑制患者的egfr介导的作用来预防或治疗
33和还原型il-33/sst2复合物。
[0035]
如本文所用的
‘
st2介导的信号传导/作用’是指如下il-33/st2系统,其中由st2识别还原型il-33促进了细胞表面上与il-1racp的二聚,并且在细胞内促进了受体复合组分myd88、traf6和irak1-4向胞内tir结构域的募集。因此,st2依赖性信号传导/作用可以通过扰动il-33与st2的相互作用或可替代地通过中断与il-1racp的相互作用而被中断和减弱。
[0036]
如本文所用的“rage-egfr介导的信号传导/作用”是指氧化型il-33/rage-egfr系统,其中由rage识别氧化型il-33促进了细胞膜内与egfr的复合。因此,rage-egfr介导的信号传导/作用可以通过扰动氧化型il-33与rage的相互作用,或通过中断还原型il-33向氧化型il-33的转化而被中断和减弱。
[0037]
如本文所用的
‘
减弱......的活性’是指减少或抑制相关活性或停止相关活性。通常,减弱和抑制在本文中可互换使用。
[0038]
应注意,术语“一个/种(a或an)”实体是指一个/种或多个/种所述实体;例如,“抗il-33抗体”应理解为表示一种或多种抗il-33抗体。因此,术语“一个/种(a或an)”、“一个/种或多个/种”和“至少一个/种”在本文中可互换使用。
[0039]
如本文中所用,术语“治疗(treat或treatment)”是指治疗性处理和防治性或预防性措施,其中目标是预防或减缓(减轻)不希望的生理变化或障碍。有益的或所希望的临床结果包括但不限于症状缓解、疾病程度减轻、疾病状态稳定化(即,未恶化)、疾病进展延迟或减缓、疾病状态改善或缓和以及减轻(无论是部分减轻还是全部减轻),无论是可检测的还是不可检测的。“治疗”还可以意指如与未接受治疗时的预期存活相比,延长存活。需要治疗的那些包括已患有病症或障碍的那些以及易于患上病症或障碍的那些或打算预防病症或障碍的那些。
[0040]“受试者”或“个体”或“动物”或“患者”或“哺乳动物”意指需要诊断、预后或治疗的任何受试者,特别是哺乳动物受试者,除非受试者被定义为
‘
健康受试者’的情况。哺乳动物受试者包括人;家畜;农场动物;诸如狗、猫、豚鼠、兔子、大鼠、小鼠、马、牛、母牛等。
[0041]
il-33拮抗剂
[0042]
本披露涉及il-33拮抗剂的医学用途,特别是通过抑制il-33介导的egfr信号传导来预防或治疗疾病的医学用途。在特定的情况下,本披露涉及il-33拮抗剂用于预防或治疗可在egfr介导的疾病中发现的上皮生理学异常的用途。
[0043]
如本文所用的
‘
il-33拮抗剂’是指减弱il-33活性,例如还原型il-33活性、氧化型il-33活性或两者的活性的任何试剂。适合地,il-33拮抗剂对还原型和/或氧化型il-33具有特异性。适合地,该减弱通过结合还原或氧化形式的il-33进行。适合地,在拮抗剂减弱还原型il-33活性和氧化型il-33活性的情况下,该减弱通过与还原形式的il-33结合(即,通过与还原型il-33结合)进行。
[0044]
适合地,il-33拮抗剂是结合分子或其片段。
[0045]
本披露的“结合分子”或“抗原结合分子”在其最广泛意义上是指特异性结合抗原决定簇的分子。适合地,结合分子与il-33,特别是还原型il-33或氧化型il-33特异性结合。
[0046]
适合地,结合分子可以选自:抗体、其抗原结合片段、适体、参考抗体分子的至少一个重链或轻链cdr以及来自一个或多个参考抗体分子的至少六个cdr。
[0047]
适合地,il-33拮抗剂是抗体或其结合片段。适合地,il-33拮抗剂是抗il-33抗体
或其结合片段。适合地,抗il-33抗体或其结合片段与il-33,特别是还原型il-33或氧化型il-33特异性结合。
[0048]
如本文所用的“抗体”是指如下文更详细论述的免疫球蛋白分子,特别是全长抗体或包含全长抗体的分子,例如dvd-ig分子等。
[0049]“其结合片段”与“其抗原结合片段”可互换,且指抗体片段的表位/抗原结合片段,其例如包含结合区,特别是包含6个cdr,诸如重链可变区中的3个cdr和轻链可变区中的3个cdr。
[0050]
适合地,抗体或其结合片段选自:天然、多克隆、单克隆、多特异性、小鼠、人、人源化、灵长类动物化或嵌合抗体或其结合片段。适合地,抗体或其结合片段可以是表位结合片段,例如fab
′
和f(ab
′
)2、fd、fv、单链fv(scfv)、二硫键连接的fv(sdfv)、包含vl或vh结构域的片段或fab表达文库产生的片段。适合地,抗体或其结合片段可以是微抗体、双抗体、三抗体、四抗体或单链抗体。适合地,抗体或其结合片段是单克隆抗体。scfv分子在本领域是已知的,并且描述于例如美国专利号5,892,019中。
[0051]
本披露的免疫球蛋白或抗体分子可以是任何类型(例如,igg、ige、igm、igd、iga和igy)、类别(例如,igg1、igg2、igg3、igg4、iga1和iga2等)或子类别的免疫球蛋白分子。
[0052]
适合地,il-33拮抗剂通过抑制氧化型il-33的形成适合地抑制氧化型il-33的活性。适合地,il-33拮抗剂抑制还原型il-33转化为氧化型il-33。
[0053]
适合地,il-33拮抗剂是还原型il-33拮抗剂。换句话说,il-33拮抗剂减弱了还原型il-33的活性。适合地,该减弱通过与还原型il-33结合来进行。适合地,通过与还原型il-33结合,所述拮抗剂还因阻止该还原型il-33转化为氧化型il-33形式而抑制/减弱了氧化型il-33的活性
[0054]
适合地,抑制氧化型il-33的活性下调或关闭了rage依赖性信号传导和/或rage介导的作用。适合地,该抑制下调或关闭了rage-egfr依赖性信号传导和/或rage-egfr介导的作用。适合地,该抑制下调或关闭了egfr依赖性信号传导。适合地,该抑制下调或关闭了egfr介导的作用。特别地,已经显示与还原型il-33结合的il33拮抗剂可以阻止氧化型il-33与rage结合,从而抑制rage-egfr信号传导。
[0055]
适合地,抑制氧化型il-33的活性下调或阻止了rage-egfr复合。适合地,该抑制下调或阻止了egfr活化,适合地,rage介导的egfr活化。
[0056]
适合地,il-33拮抗剂具有上述所有抑制作用。适合地,还原型il-33拮抗剂具有上述所有抑制作用。
[0057]
适合地,il-33拮抗剂是还原型il-33结合分子或其片段。适合地,il-33拮抗剂是还原型il-33抗体或其结合片段,适合地,抗还原型il33抗体或其结合片段。
[0058]
适合地,该结合分子或其片段以小于以下的结合亲和力(kd)与redil-33结合:小于5x10-2
m、10-2
m、5x10-3
m、10-3
m、5x10-4
m、10-4
m、5x10-5
m、10-5
m、5x10-6
m、10-6
m、5x10-7
m、10-7
m、5x10-8
m、10-8
m、5x10-9
m、10-9
m、5x10-10
m、10-10
m、5x10-11
m、10-11
m、5x10-12
m、10-12
m、5x10-13
m、10-13
m、5x10-14
m、10-14
m、5x10-15
m或10-15
m。适合地,与redil-33的结合亲和力小于5x10-14
m(即,0.05pm)。适合地,使用动力学排除测定(kinexa)或biacore
tm
,适合地使用kinexa,使用诸如wo 2016/156440(参见例如,实例11)中所述的方案测量结合亲和力,该文献在此通过全文引用并入。以此结合亲和力与redil-33结合的结合分子似乎与redil-33足够紧密
地结合,以阻止结合分子/redil-33复合物在生物学相关的时间范围内解离。不希望被理论束缚,认为此结合强度阻止了在抗体/抗原复合物在体内降解之前释放抗原,使得redil-33不被释放并且不能进行从redil-33向oxil-33的转化。因此,结合分子当以此结合亲和力与redil-33结合时,可以通过阻止oxil-33的形成来抑制或减弱oxil-33的活性,从而抑制rage信号传导。
[0059]
适合地,结合分子或其片段可以以大于或等于103m-1
sec-1
、5x103m-1
sec-1
、104m-1
sec-1
或5x104m-1
sec-1
的结合速率(k(on))与redil-33特异性结合。例如,本披露的结合分子可以以大于或等于105m-1
sec-1
、5x105m-1
sec-1
、106m-1
sec-1
或5x106m-1
sec-1
或107m-1
sec-1
的结合速率(k(on))与redil-33或其片段或变体结合。适合地,k(on)速率大于或等于107m-1
sec-1
。
[0060]
适合地,结合分子或其片段可以以小于或等于5x10-1
sec-1
、10-1
sec-1
、5x10-2
sec-1
、10-2
sec-1
、5x10-3
sec-1
或10-3
sec-1
的解离速率(k(off))与redil-33特异性结合。例如,可以称本披露的结合分子以小于或等于5x10-4
sec-1
、10-4
sec-1
、5x10-5
sec-1
、10-5
sec-1
、5x10-6
sec-1
、10-6
sec-1
、5x10-7
sec-1
或10-7
sec-1
的解离速率(k(off))与redil-33或其片段或变体结合。适合地,k(off)速率小于或等于10-3
sec-1
。il-33是响应于炎症刺激迅速且以高浓度释放的警报蛋白细胞因子。释放至胞外环境中后约5-45分钟,redil-33被转化为氧化型。因此,为了阻止redil-33转化为oxil-33,本文所述的结合分子可以以这些k(on)和/或k(off)速率与redil-33结合。不希望受理论束缚,认为这些k(on)/k(off)速率确保结合分子可以在redil-33转化为oxil-33之前与redil-33快速结合,从而减少了oxil-33的形成,从而减弱了rage信号传导,适合地减弱了rage/egfr信号传导,从而减弱了rage/egfr介导的作用。
[0061]
适合地,il-33结合分子可以竞争性地抑制il-33与结合分子33_640087-7b的结合(如wo 2016/156440中所述)。适合地,wo 2016/156440描述了33_640087-7b以特别高的亲和力与redil-33结合并且减弱了st-2和rage依赖性il-33信号传导。因此,竞争性抑制il-33与结合分子33_640087-7b的结合的结合分子极有可能抑制redil-33和oxil-33信号传导两者,因此特别适用于本文所述的方法。
[0062]
如果结合分子或其片段以在某种程度上阻断参考抗体与给定表位结合的程度与该表位结合,则称该结合分子或其片段竞争性抑制参考抗体与该表位的结合。竞争性抑制可通过本领域已知的任何方法确定,例如固相测定(诸如竞争elisa测定)、解离增强镧系荧光免疫测定(珀金埃尔默公司(perkin elmer))和放射性配体结合测定。例如,技术人员可以通过使用体外竞争结合测定,诸如wo 2016/156440实例1中所述的htrf测定的衍生测定来判定结合分子或其片段是否竞争与redil-33结合,该文献在此通过引用并入。例如,技术人员可以用供体荧光团标记表1的重组抗体,并将多种浓度与固定浓度的受体荧光团标记的redil-33样品混合。随后,可以测量每个样品内供体与受体荧光团之间的荧光共振能量转移,以确定结合特征。为了阐明竞争性结合分子,技术人员可以首先将各种浓度的测试结合分子与固定浓度的表1的标记抗体混合。当将混合物与标记的il-33一起孵育时,与仅标记抗体的阳性对照相比,fret信号的减少指示竞争性结合il-33。可以称结合分子或其片段将参考抗体与给定表位的结合竞争性抑制至少90%、至少80%、至少70%、至少60%或至少50%。
[0063]
在一些实施例中,结合分子选自以下抗il-33抗体中的任一种:33_640087-7b(如
wo 2016/156440中所述)、称为埃托克单抗(etokimab)的anb020(如wo 2015/106080中所述)、9675p(如us 2014/0271658中所述)、a25-3h04(如us 2017/0283494中所述)、ab43(如wo 2018/081075中所述)、il33-158(如us 2018/0037644中所述)、10c12.38.h6.87y.581 lgg4(如wo 2016/077381中所述)或其结合片段,这些文献中的每一个均通过引用并入本文中。这些抗体均如表1中所提及。
[0064]
适合地,il-33拮抗剂是包含选自表1的可变重链结构域(vh)和可变轻链结构域(vl)对的互补决定区(cdr)的抗体或抗原结合片段。对1对应于wo 2016/156440中所述的33_640087-7b的vh和vl结构域序列。对2-7对应于us 2014/0271658中所述的抗体的vh和vl结构域序列。对8-12对应于us 2017/0283494中所述的抗体的vh和vl结构域序列。对13对应于wo 2015/106080中所述的anb020的vh和vl结构域序列。对14-16对应于wo 2018/081075中所述的抗体的vh和vl结构域序列。对17对应于us 2018/0037644中所述的il33-158的vh和vl结构域序列。对18对应于wo 2016/077381中所述的10c12.38.h6.87y.581 lgg4的vh和vl结构域序列。
[0065]
表1:示例性抗il-33抗体vh和vl对
[0066]
[0067]
[0068]
[0069][0070]
适合地,il-33拮抗剂是包含以下的抗体或抗原结合片段:包含seq id no:1的序列的重链可变区(hcvr)的互补决定区(cdr),和包含seq id no:19的序列的轻链可变区(lcvr)的互补决定区(cdr)。这些cdr对应于源自33_640087-7b的cdr(如wo2016/156440中所述),这些cdr结合还原型il-33并抑制其转化为氧化型il-33。33_640087-7b在wo 2016/
156440中进行了完整描述,该文献以引用的方式并入本文中。
[0071]
适合地,il-33拮抗剂是包含以下的抗体或抗原结合片段:包含seq id no:7的序列的重链可变区(hcvr)的互补决定区(cdr),和包含seq id no:25的序列的轻链可变区(lcvr)的互补决定区(cdr)。这些cdr对应于源自抗体9675p的cdr。9675p在us 2014/0271658中进行了完整描述,该文献以引用的方式并入本文中。
[0072]
适合地,il-33拮抗剂是包含以下的抗体或抗原结合片段:包含seq id no:11的序列的重链可变区(hcvr)的互补决定区(cdr),和包含seq id no:29的序列的轻链可变区(lcvr)的互补决定区(cdr)。这些cdr对应于源自抗体a25-3h04的cdr。a25-3h04在us 2017/0283494中进行了完整描述,该文献以引用的方式并入本文中。
[0073]
适合地,il-33拮抗剂是包含以下的抗体或抗原结合片段:包含seq id no:13的序列的重链可变区(hcvr)的互补决定区(cdr),和包含seq id no:31的序列的轻链可变区(lcvr)的互补决定区(cdr)。这些cdr对应于源自抗体anb020的cdr。anb020在wo 2015/106080中进行了完整描述,该文献以引用的方式并入本文中。
[0074]
适合地,il-33拮抗剂是包含以下的抗体或抗原结合片段:包含seq id no:16的序列的重链可变区(hcvr)的互补决定区(cdr),和包含seq id no:34的序列的轻链可变区(lcvr)的互补决定区(cdr)。这些cdr对应于源自抗体ab43的cdr。ab43在wo 2018/081075中进行了完整描述,该文献以引用的方式并入本文中。
[0075]
适合地,il-33拮抗剂是包含以下的抗体或抗原结合片段:包含seq id no:17的序列的重链可变区(hcvr)的互补决定区(cdr),和包含seq id no:35的序列的轻链可变区(lcvr)的互补决定区(cdr)。这些cdr对应于源自抗体il33-158的cdr。il33-158在us 2018/0037644中进行了完整描述,该文献以引用的方式并入本文中。
[0076]
适合地,il-33结合分子是包含以下的抗体或抗原结合片段:包含seq id no:18的序列的重链可变区(hcvr)的互补决定区(cdr),和包含seq id no:36的序列的轻链可变区(lcvr)的互补决定区(cdr)。这些cdr对应于源自抗体10c12.38.h6.87y.581 lgg4的cdr。10c12.38.h6.87y.581 lgg4在wo 2016/077381中进行了完整描述,该文献以引用的方式并入本文中。
[0077]
适合地,技术人员已知本领域中可用于鉴定抗体或其抗原结合片段的重链和轻链可变区内的cdr的方法。适合地,技术人员可以例如进行基于序列的注释。cdr之间的区域通常高度保守,因此,可以使用逻辑规则来确定cdr位置。技术人员可以使用用于常规抗体的一组基于序列的规则(pantazes和maranas,protein engineering,design and selection[蛋白质工程化、设计和选择],2010),可替代地或另外,他还可以基于多序列比对来完善规则。可替代地,技术人员可以使用blast+的blastp指令将抗体序列与根据kabat、chothia或imgt方法操作的公众可获得的数据库进行比较,以鉴定最类似的注释序列。这些方法中的每一种均设计了独特的残基编号方案,根据该编号方案对高变区残基进行编号,然后根据某些关键位置确定六个cdr中的每一个的起始和结束。在例如与最类似的注释序列比对后,可以将cdr从注释序列外推至非注释序列,从而鉴定cdr。适合的工具/数据库是:例如kabat数据库、kabatman、scalinger、imgt、abnum。
[0078]
适合地,il-33拮抗剂是包含选自表1的可变重链结构域(vh)和可变轻链结构域(vl)对的抗体或抗原结合片段。
[0079]
适合地,il33抗体或其抗原结合片段包含seq id no:1的序列的vh结构域和seq id no:19的序列的vl结构域。
[0080]
适合地,il33抗体或其抗原结合片段包含seq id no:7的序列的vh结构域和seq id no:25的序列的vl结构域。
[0081]
适合地,il33抗体或其抗原结合片段包含seq id no:11的序列的vh结构域和seq id no:29的序列的vl结构域。
[0082]
适合地,il33抗体或其抗原结合片段包含seq id no:13的序列的vh结构域和seq id no:31的序列的vl结构域。
[0083]
适合地,il33抗体或其抗原结合片段包含seq id no:16的序列的vh结构域和seq id no:34的序列的vl结构域。
[0084]
适合地,il33抗体或其抗原结合片段包含seq id no:17的序列的vh结构域和seq id no:35的序列的vl结构域。
[0085]
因此,适合地,il-33拮抗剂是如下结合分子,该结合分子可以包含例如独立地选自seq id no:1、7、11、13、16、17和18的重链可变区中的3个cdr。
[0086]
适合地,il-33拮抗剂是包含根据seq id no:1的重链可变区中的3个cdr的结合分子。
[0087]
适合地,il-33拮抗剂是如下结合分子,该结合分子可以包含独立地选自seq id no:19、25、29、31、34、35和36的轻链可变区中的3个cdr。
[0088]
适合地,il-33拮抗剂是包含根据seq id no:19的轻链可变区中的3个cdr的结合分子。
[0089]
因此,适合地,il-33拮抗剂是如下结合分子,该结合分子可以包含例如独立地选自seq id no:1、7、11、13、16、17和18的重链可变区中的3个cdr,以及例如独立地选自seq id no:19、25、29、31、34、35和36的轻链可变区中的3个cdr。
[0090]
因此,适合地,il-33拮抗剂是如下结合分子,该结合分子包含根据seq id no:1的重链可变区中的3个cdr,以及根据seq id no:19的轻链可变区中的3个cdr。
[0091]
因此,适合地,il-33拮抗剂是可以包含可变重链结构域(vh)和可变轻链结构域(vl)的结合分子,该结合分子具有分别具有序列seq id no:37、38和39的vh cdr 1-3,其中一个或多个vhcdr具有3个或更少的单个氨基酸取代、插入和/或缺失。
[0092]
因此,适合地,il-33拮抗剂是包含vh结构域的结合分子,该vh结构域包含分别具有seq id no:37、seq id no:38和seq id no:39的vhcdr 1-3。
[0093]
因此,适合地,il-33拮抗剂是包含vh结构域的结合分子,该vh结构域包含分别由seq id no:37、seq id no:38和seq id no:39组成的vhcdr 1-3。
[0094]
因此,适合地,il-33拮抗剂是可以包含可变重链结构域(vh)和可变轻链结构域(vl)的结合分子,该结合分子具有分别具有seq id no:40、41和42的序列的vl cdr 1-3,其中一个或多个vlcdr具有3个或更少的单个氨基酸取代、插入和/或缺失。
[0095]
因此,适合地,il-33拮抗剂是包含vl结构域的结合分子,该vl结构域包含分别具有seq id no:40、seq id no:41和seq id no:42的vlcdr 1-3。
[0096]
因此,适合地,il-33拮抗剂是包含vl结构域的结合分子,该vl结构域包含分别由seq id no:40、seq id no:41和seq id no:42组成的vlcdr 1-3。
[0097]
因此,适合地,il-33拮抗剂是如下结合分子,该结合分子可以包含具有seq id no:37的序列的vhcdr1、具有seq id no:38的序列的vhcdr2、具有seq id no:39的序列的vhcdr3、具有seq id no:40的序列的vlcdr1、具有seq id no:41的序列的vlcdr2和具有seq id no:42的序列的vlcdr3。
[0098]
因此,适合地,il-33拮抗剂是包含vh和vl的抗体或其结合片段,其中vh具有与根据seq id no:1、7、11、13、16、17和18的vh至少90%,例如91%、92%、93%、94%、95%、96%、97%、98%、99%或100%一致的氨基酸序列。
[0099]
因此,适合地,il-33拮抗剂是包含vh和vl的抗体或其结合片段,其中vh具有与根据seq id no:1的vh至少90%,例如91%、92%、93%、94%、95%、96%、97%、98%、99%或100%一致的氨基酸序列。
[0100]
因此,适合地,il-33拮抗剂是包含vh和vl的抗体或其结合片段,其中上文披露的vh具有如下序列,其中框架中的1、2、3或4个氨基酸缺失、用不同氨基酸插入和/或独立地替换。
[0101]
因此,适合地,il-33拮抗剂是包含vh和vl的抗体或其结合片段,其中vl具有与根据seq id no:19、25、29、31、34、35和36的vl至少90%.例如91%、92%、93%、94%、95%、96%、97%、98%、99%或100%一致的氨基酸序列。
[0102]
因此,适合地,il-33拮抗剂是包含vh和vl的抗体或其结合片段,其中vl具有与根据seq id no:19的vl至少90%,例如91%、92%、93%、94%、95%、96%、97%、98%、99%或100%一致的氨基酸序列。
[0103]
因此,适合地,il-33拮抗剂是包含vh和vl的抗体或其结合片段,其中上文披露的vl具有如下序列,其中框架中的1、2、3或4个氨基酸独立地缺失、用不同氨基酸插入和/或替换。
[0104]
因此,适合地,il-33拮抗剂是包含vh和vl的抗体或其结合片段,其中vh具有与根据seq id no:1、7、11、13、16、17和18的vh至少90%,例如91%、92%、93%、94%、95%、96%、97%、98%、99%或100%一致的氨基酸序列,并且vl具有与根据seq id no:19、25、29、31、34、35和36的vl至少90%,例如91%、92%、93%、94%、95%、96%、97%、98%、99%或100%一致的氨基酸序列。
[0105]
因此,适合地,il-33拮抗剂是包含vh和vl的抗体或其结合片段,其中vh具有由seq id no:1、7、11、13、16、17和18组成的氨基酸序列,并且vl具有由seq id no:19、25、29、31、34、35和36组成的氨基酸序列。
[0106]
因此,适合地,il-33拮抗剂是包含vh和vl的抗体或其结合片段,其中vh具有由seq id no:1组成的氨基酸序列,并且vl具有由seq id no:19组成的氨基酸序列。
[0107]
组合物和施用
[0108]
本文所述的医学用途和方法中的il-33拮抗剂可以以药物组合物的形式施用至患者。
[0109]
适合地,本文中对“il-33拮抗剂”的任何提及也可以指包含il-33拮抗剂的药物组合物。适合地,药物组合物可以包含一种或多种il-33拮抗剂。
[0110]
适合地,il-33拮抗剂可以以药物有效量施用以用于体内治疗如本文中治疗方面的医学用途和方法中所定义的上皮生理学异常、或egfr介导的疾病、或呼吸疾病。
[0111]
适合地,应将il-33拮抗剂的“药物有效量”或“治疗有效量”理解为是指足以实现与il-33有效结合并实现益处,例如改善如本文中医学用途/方法中所述的疾病或病症的症状的量。
[0112]
适合地,il-33拮抗剂或其药物组合物可以根据前述治疗方法/医学用途以足以产生治疗效果的量施用至人或其他动物。
[0113]
适合地,il-33拮抗剂或其药物组合物可以按常规剂型施用至此种人或其他动物,该剂型通过根据已知技术将il-33拮抗剂与常规药学上可接受的载体或稀释剂组合来制备。
[0114]
本领域技术人员应认识到,药学上可接受的载体或稀释剂的形式和特征通过与其组合的活性成分的量、施用途径以及其他熟知变量来确定。本领域技术人员将进一步了解,包含一种或多种il-33拮抗剂的混合物可以被证明是特别有效的。
[0115]
可以与载体材料组合以产生单一剂型的il-33拮抗剂的量将根据所治疗的受试者和特定的施用方式而变化。适合地,药物组合物可以以单次剂量、多次剂量或经确定时间段以输注形式施用。适合地,也可以调整剂量方案以提供最佳期望反应(例如,治疗性或防治性反应)。
[0116]
适合地,il-33拮抗剂经配制以便促进il-33拮抗剂的施用并提升其稳定性。
[0117]
适合地,药物组合物经配制以包含药学上可接受的无毒性无菌载体,诸如生理盐水、无毒性缓冲剂、防腐剂等。
[0118]
适合地,药物组合物可以包含药学上可接受的载体,包括例如水;离子交换剂;氧化铝;硬脂酸铝;卵磷脂;血清蛋白,诸如人血清白蛋白;缓冲物质,诸如磷酸盐;甘氨酸;山梨酸;山梨酸钾;饱和植物脂肪酸的偏甘油酯混合物;水、盐或电解质,诸如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐;胶态二氧化硅;三硅酸镁;聚乙烯吡咯烷酮;纤维素基物质;聚乙二醇;羧甲基纤维素钠;聚丙烯酸酯;蜡;聚乙烯-聚氧丙烯嵌段聚合物;聚乙二醇和羊毛脂。
[0119]
适合地,药物组合物可以包括无菌水性或非水性溶液、悬浮液和乳液。非水性溶剂的实例是丙二醇、聚乙二醇、植物油诸如橄榄油和可注射有机酯诸如油酸乙酯。水性载体包括例如水、醇性/水性溶液、乳液或悬浮液,包括盐水和缓冲介质。
[0120]
适合地,药学上可接受的载体包括但不限于0.01-0.1m且优选0.05m磷酸盐缓冲液或0.8%盐水。其他常见的胃肠外载体包括磷酸钠溶液、林格氏右旋糖(ringer
′
s dextrose)、右旋糖和氯化钠、乳酸林格氏液(lactated ringer
′
s)或不挥发性油。静脉内载体包括流体和营养补充剂、电解质补充剂,诸如基于林格氏右旋糖的那些等。还可以存在防腐剂以及其他添加剂,诸如像抗微生物剂、抗氧化剂、螯合剂和惰性气体等。
[0121]
适合地,用于可注射用途的药物组合物可以包括无菌水溶液(在可溶于水时)或分散液和用于临时制备无菌可注射溶液或分散液的无菌粉末。在此类情况下,组合物必须是无菌的并且必须具有达到容易注射的程度的流动性。在制造和存储条件下它应当是稳定的,并且将被保存以防止微生物(诸如细菌和真菌)的污染作用。适合地,载体可以是含有以下的溶剂或分散介质,例如:水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)及其适合的混合物。可以例如通过使用涂层(诸如卵磷脂)、通过在分散液的情况下维持所需颗粒大小以及通过使用表面活性剂来维持适当的流动性。
[0122]
用于本文披露的治疗方法的适合配制品描述于remington
′
s pharmaceutical sciences[雷明顿氏药物科学](麦克出版公司(mack publishing co.))第16版(1980)。
[0123]
适合地,阻止微生物的作用可以通过各种抗细菌剂和抗真菌剂,例如对羟苯甲酸酯、三氯叔丁醇、苯酚、抗坏血酸、硫柳汞等来实现。在许多情况下,在药物组合物中适合地包括等渗剂(例如,糖)、多元醇(诸如甘露醇、山梨醇)或氯化钠。可以通过在组合物中包括延迟吸收的试剂(例如,单硬脂酸铝和明胶)来实现可注射组合物的延长吸收。
[0124]
适合地,无菌可注射溶液可以通过在具有本文所列举的成分之一或组合的适当溶剂中掺入所需量的活性化合物(例如,il-33拮抗剂,单独地或与其他活性剂组合),视需要随后过滤灭菌来制备。通常,通过将活性化合物并入无菌媒剂来制备分散液,该无菌媒剂含有基础分散介质以及来自以上列举的所需其他成分。在用于制备无菌可注射溶液的无菌粉末的情况下,制备方法可以是真空干燥和冷冻干燥,这些方法产生活性成分的粉末以及来自其以前的无菌过滤溶液的任何其他期望成分。
[0125]
将il-33拮抗剂或其药物组合物施用至有需要的受试者的方法是本领域技术人员所熟知的或容易由本领域技术人员来确定的。
[0126]
适合地,il-33拮抗剂或其药物组合物的施用途径可以是例如口服、胃肠外、吸入或局部。适合地,如本文使用的术语胃肠外包括例如静脉内、动脉内、腹膜内、肌内、皮下、经直肠或经阴道施用。
[0127]
适合地,il-33拮抗剂或其药物组合物可以按可接受的剂型(包括例如,胶囊、片剂、水性悬浮液或溶液)口服施用。
[0128]
适合地,il-33拮抗剂或其药物组合物可以通过经鼻气雾剂或吸入施用。使用苄醇或其他适合的防腐剂、提高生物利用度的吸收促进剂和/或其他常规增溶剂或分散剂,可以将此类组合物制成盐水中的溶液。
[0129]
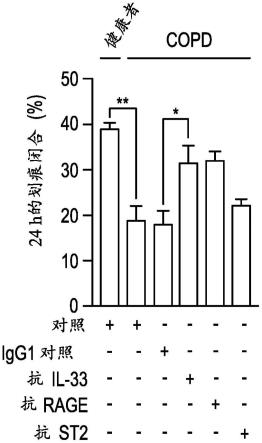
适合地,胃肠外配制品可以是单次推注剂量、输注或加载推注剂量,随后是维持剂量。这些组合物可以按特定的固定或可变的间隔施用,例如每天一次,或基于“根据需要”施用。
[0130]
适合地,将il-33拮抗剂或其药物组合物直接递送至疾病或病症例如上皮生理学异常的部位,从而增加患病组织对治疗剂的暴露。适合地,将il-33拮抗剂或其药物组合物直接施用至疾病或病症的部位。因此,适合地,将il-33拮抗剂或其药物组合物施用至上皮生理学异常、egfr介导的疾病或呼吸疾病的部位。
[0131]
在一个实施例中,将il-33拮抗剂或其药物组合物施用至呼吸道。适合地通过鼻内施用。适合地通过鼻内吸入。适合地,il-33拮抗剂或其药物组合物可以在吸入器装置中提供。适合的吸入器装置是本领域熟知的。
[0132]
在一个实施例中,提供了一种包含il-33拮抗剂或其药物组合物的吸入器,该吸入器用于预防或治疗如本文中所定义的病症或疾病。
[0133]
因此,适合地,将il-33拮抗剂或其药物组合物配制成液体组合物。适合地,其呈可以气雾化的液体组合物的形式。
[0134]
在一个实施例中,il-33拮抗剂或其药物组合物以气雾剂形式提供。
[0135]
适合地,可以将上文所述的用于制备本文所述的药物组合物的组分以试剂盒的形式包装和出售。此种试剂盒适合地具有标签或包装说明书以指示相关药物组合物可用于治
疗患有或倾向于患有疾病或障碍的受试者。
[0136]
适合地,将液体配制品用组分处理,填充至容器诸如安瓿、袋子、瓶子、注射器或小瓶中,并根据本领域中已知的方法密封在无菌条件下。适合地,容器可以被加压,适合地,其可以是气雾剂容器。这些容器可以被包括在上述试剂盒中。适合地,试剂盒可以进一步包含吸入器装置。适合地,吸入器装置包含本文所述的il-33拮抗剂或药物组合物,或可操作以包含上述可包含本文所述的il-33拮抗剂或药物组合物的容器。
[0137]
上皮生理学异常
[0138]
本披露涉及il-33拮抗剂用于预防或治疗上皮生理学异常中的医学用途。
[0139]
如本文所用的“上皮生理学异常”是指人体上皮功能的任何异常。人体上皮功能包括:充当保护下方组织的屏障;调节和交换组织与腔之间的化学实体;将化学物质分泌到腔中;以及感觉。这些功能中任一种的异常均可能具有破坏性的生理作用。上皮存在于身体的多种组织中,包括皮肤、呼吸道、胃肠道、生殖道、泌尿道、外分泌腺和内分泌腺,因此,上皮内的异常可能涉及多种疾病或病症。适合地,上皮是气道上皮,并且上皮生理学异常是气道上皮生理学异常。
[0140]
如本文所用的“异常”是指与健康受试者中的功能相比所述功能的差异,典型地与健康受试者中的功能相比,所述功能增加或减少。
[0141]
适合地,上皮选自:鳞状、立方、柱状和假复层上皮。适合地,上皮是柱状上皮。
[0142]
适合地,上皮是纤毛上皮。适合地,上皮是纤毛柱状上皮。适合地,上皮生理学异常是纤毛柱状上皮生理学异常。
[0143]
适合地,上皮生理学异常包括上皮细胞迁移异常。适合地,上皮生理学异常可以包括上皮细胞迁移减少。适合地,上皮生理学异常可以包括上皮细胞增殖异常。适合地,上皮生理学异常可以包括上皮细胞增殖减少。
[0144]
适合地,上皮细胞迁移的减少导致上皮修复划痕的能力受损。适合地,上皮生理学异常包括划痕修复受损。划痕修复受损可能包括划痕闭合受损和划痕细胞密度降低。
[0145]
适合地,上皮生理学异常的治疗可以包括增加或改进上皮细胞迁移。适合地,上皮生理学异常的治疗可以包括增加或改进上皮划痕修复。适合地,上皮生理学异常的治疗可以包括增加或改进划痕闭合。适合地,上皮生理学异常的治疗可以包括增加或改进划痕细胞密度。
[0146]
适合地,上皮生理学异常是异常粘膜纤毛生理学。
[0147]
如本文所用的“粘膜纤毛生理学异常”是指上皮的特定粘膜纤毛作用的功能异常。上皮的粘膜纤毛作用的功能异常可能是由于对粘膜纤毛功能关键的纤毛柱状细胞和/或杯状细胞的功能异常。适合地,粘膜纤毛生理学异常是由于杯状细胞的功能异常。
[0148]
如本文所用的“粘膜纤毛”是指上皮内的纤毛柱状细胞和杯状柱状细胞分泌和移动粘液的功能。上皮的粘膜纤毛作用可以包括:杯状细胞增殖;杯状细胞分化;粘液分泌;粘液成分调节;和/或粘液的运动或清除。
[0149]
在一个实施例中,提供了一种il-33拮抗剂,该il-33拮抗剂用于预防或治疗粘膜纤毛生理学异常,诸如上皮的粘膜纤毛生理学异常。
[0150]
在一个实施例中,提供了一种预防或治疗患者的粘膜纤毛生理学异常,诸如上皮的粘膜纤毛生理学异常的方法,该方法包括:向有需要的患者施用有效量的il-33拮抗剂。
[0151]
粘膜纤毛生理学异常可以包括上皮的纤毛柱状细胞或杯状细胞的任何异常功能。适合地,粘膜纤毛生理学异常包括:粘液产生异常;杯状细胞分化异常;杯状细胞增殖异常;上皮厚度异常;粘液清除异常;和/或粘液组成异常。
[0152]
适合地,粘液产生异常包括muc5ac产生异常。适合地,杯状细胞分化异常包括muc5ac+杯状细胞分化异常。适合地,杯状细胞增殖异常包括muc5ac+杯状细胞增殖异常。适合地,上皮厚度异常包括上皮的总组织区域中muc5ac
+
杯状细胞的量异常。
[0153]
适合地,粘膜纤毛生理学异常包括:杯状细胞数量增加;粘液产生增加;杯状细胞分化增加;上皮厚度增加;和/或粘液清除减少。
[0154]
适合地,粘液产生增加包括muc5ac产生增加。适合地,杯状细胞分化增加包括muc5ac+杯状细胞分化增加。适合地,杯状细胞增殖增加包括muc5ac+杯状细胞增殖增加。适合地,上皮厚度增加包括上皮的总组织区域中muc5ac
+
杯状细胞的量增加。
[0155]
适合地,muc5ac产生增加由muc5ac基因表达增加引起。适合地,粘膜纤毛生理学异常包括上皮细胞中muc5ac基因表达的增加。适合地,粘膜纤毛生理学异常包括上皮的杯状细胞中muc5ac的表达增加。
[0156]
适合地,粘膜纤毛生理学异常包括粘液组成的变化。此种变化可以包括粘液中含有的不同粘液化合物的比率增加或减少、一种或多种特定粘液化合物增加或减少或者粘液的浓度或厚度增加或减少。
[0157]
粘液组成的变化可以包含不同粘蛋白的比率增加或减少,诸如粘蛋白muc5ac和muc5b的比率增加或减少。
[0158]
粘液组成的变化可以包含粘蛋白的浓度增加或减少。适合地,粘液组成的变化包含粘蛋白5ac的浓度减少。适合地,粘液组成的变化包含具有上调的muc5ac表达的杯状细胞的数量减少。
[0159]
粘液中含有的粘蛋白的此类变化可以如wo 2018/204598中所述进行测量和计算,该文献通过引用并入本文中。
[0160]
适合地,粘液组成异常包括muc5ac∶muc5b的比率增加。适合地,粘液组成异常包括粘液中含有的muc5ac增加。适合地,粘液组成异常包括粘液厚度增加。
[0161]
粘膜纤毛生理学异常可以包含以上症状中的任何一种或多种的组合。
[0162]
适合地,上皮生理学异常包括组织重塑异常,诸如上皮重塑异常。适合地,上皮生理学异常包括组织重塑增加。适合地,上皮生理学异常包括上皮重塑增加。
[0163]
上皮生理学异常可以包含以上症状中的任何一种或多种的组合。
[0164]
治疗或预防上皮生理学异常,或治疗或预防粘膜纤毛生理学异常可以包含:
[0165]
改进或增加粘膜纤毛清除;
[0166]
减少或抑制粘液产生;
[0167]
抑制粘液组成异常;
[0168]
减少或抑制上皮重塑;和/或
[0169]
减少或抑制杯状细胞的分化和/或增殖。
[0170]
适合地,减少或抑制粘液产生包含减少或抑制muc5ac产生。因此,适合地,该治疗或预防减少或抑制了muc5ac产生。
[0171]
适合地,抑制粘液组成异常可以包含恢复正常的粘液组成。适合地,此可以包含减
少muc5ac∶muc5b的比率。因此,适合地,该治疗或预防减少了muc5ac∶muc5b的比率。适合地,该预防或治疗抑制或减少了粘液中的muc5ac。适合地,该预防或治疗减少了粘液的厚度。
[0172]
适合地,减少或抑制杯状细胞的分化和/或增殖包含减少或抑制muc5ac
+
杯状细胞的分化或增殖。因此,适合地,该治疗或预防减少或抑制了muc5ac
+
杯状细胞的分化或增殖。
[0173]
适合地,减少或抑制上皮重塑包含减少呼吸上皮的厚度。因此,适合地,该治疗或预防减少了呼吸上皮的厚度。
[0174]
适合地,减少或抑制上皮重塑包含减少了上皮的总组织区域中muc5ac
+
杯状细胞的量。因此,适合地,该治疗或预防减少或抑制了上皮的总组织区域中muc5ac
+
杯状细胞的数量。
[0175]
改进或增加粘膜纤毛清除包含改进或增加粘膜纤毛运动。因此,适合地,该治疗或预防改进或增加了粘膜纤毛运动。
[0176]
适合地,上皮是呼吸上皮。适合地,上皮生理学异常是呼吸上皮中的上皮生理学异常。
[0177]
在一个实施例中,提供了一种il-33拮抗剂,该il-33拮抗剂用于治疗呼吸疾病中的上皮生理学异常。
[0178]
在一个实施例中,提供了一种预防或治疗患有呼吸疾病的患者的上皮生理学异常的方法,该方法包括:向有需要的患者施用有效量的il-33拮抗剂。
[0179]
适合的呼吸疾病如本文别处所定义。
[0180]
适合地,上皮生理学异常是呼吸上皮中的粘膜纤毛生理学异常。
[0181]
在一个实施例中,提供了一种il-33拮抗剂,该il-33拮抗剂用于预防或治疗呼吸上皮中的粘膜纤毛生理学异常。
[0182]
在一个实施例中,提供了一种预防或治疗患者的呼吸上皮的粘膜纤毛生理学异常的方法,该方法包括:向有需要的患者施用有效量的il-33拮抗剂。
[0183]
适合地,上皮生理学异常是呼吸疾病中的粘膜纤毛生理学异常。
[0184]
在一个实施例中,提供了一种il-33拮抗剂,该il-33拮抗剂用于预防或治疗呼吸疾病中的粘膜纤毛生理学异常。
[0185]
在一个实施例中,提供了一种预防或治疗患有呼吸疾病的患者的粘膜纤毛生理学异常的方法,该方法包括:向有需要的患者施用有效量的il-33拮抗剂。
[0186]
适合地,上皮生理学异常存在于呼吸道中。适合地,上皮生理学异常是呼吸道的上皮生理学异常。适合地,上皮生理学异常是呼吸道的粘膜纤毛生理学异常。
[0187]
呼吸道包括上呼吸道和下呼吸道。典型地,上呼吸道包括鼻道、鼻旁窦、咽和喉。典型地,下呼吸道包括气管、支气管、细支气管、肺泡管和肺泡。
[0188]
适合地,上皮生理学异常是下呼吸道,诸如支气管的上皮生理学异常。
[0189]
适合地,上皮生理学异常是下呼吸道的上皮生理学异常。适合地,上皮生理学异常是支气管的上皮生理学异常。适合地,下呼吸道上皮生理学异常是下呼吸道的粘膜纤毛生理学异常。适合地,下呼吸道的粘膜纤毛生理学异常是支气管的粘膜纤毛生理学异常。
[0190]
在一个实施例中,提供了一种il-33拮抗剂,该il-33拮抗剂用于预防或治疗下呼吸道的粘膜纤毛生理学异常。
[0191]
在一个实施例中,提供了一种预防或治疗患者的下呼吸道的粘膜纤毛生理学异常
的方法,该方法包括:向有需要的患者施用有效量的il-33拮抗剂。
[0192]
在一个实施例中,提供了一种il-33拮抗剂,该il-33拮抗剂用于预防或治疗支气管的粘膜纤毛生理学异常。
[0193]
在一个实施例中,提供了一种预防或治疗患者的支气管的粘膜纤毛生理学异常的方法,该方法包括:向有需要的患者施用有效量的il-33拮抗剂。
[0194]
egfr信号传导
[0195]
本披露基于如下发现:氧化型il-33与rage结合,从而又与egfr复合并起破坏上皮稳态的作用。使用il-33拮抗剂可以抑制氧化型il-33的信号传导,从而抑制rage的活化并抑制rage-egfr复合。本文披露的数据证明,阻止rage-egfr复合物的形成阻止了il-33介导的egfr信号传导,并恢复了正常的上皮生理学。
[0196]
适合地,il-33拮抗剂抑制氧化型il-33信号传导。
[0197]
适合地,il-33拮抗剂抑制氧化型il-33与rage的结合。
[0198]
适合地,il-33拮抗剂抑制rage-egfr复合物的形成。适合地,il-33拮抗剂抑制氧化型il33-rage-egfr复合物的形成。
[0199]
适合地,il-33拮抗剂抑制egfr的聚类。适合地,il-33拮抗剂抑制egfr在细胞膜中的聚类。适合地,il-33拮抗剂抑制egfr的内在化。适合地,il-33拮抗剂抑制rage和egfr在细胞膜内的共定位。适合地,il-33拮抗剂抑制rage-egfr复合物的内在化。
[0200]
适合地,il-33拮抗剂抑制egfr的活化。适合地,il-33拮抗剂抑制egfr的磷酸化。
[0201]
适合地,il-33拮抗剂抑制rage-egfr介导的作用。适合地,il-33拮抗剂抑制由rage-egfr复合物介导的作用。适合地,il-33拮抗剂抑制由氧化型il33-rage-egfr复合物介导的作用。
[0202]
适合地,il-33拮抗剂抑制egfr信号传导。适合地,il-33拮抗剂抑制rage-egfr信号传导。适合地,il-33拮抗剂抑制氧化型il33-rage-egfr信号传导。
[0203]
适合地,il-33拮抗剂抑制氧化型il-33与rage的结合,从而抑制rage-egfr复合,从而抑制rage-egfr介导的作用,诸如下游信号传导。
[0204]
适合地,il-33拮抗剂抑制il-33介导的egfr作用。适合地,il-33拮抗剂抑制il-33介导的egfr信号传导。适合地,il-33拮抗剂抑制氧化型il-33介导的egfr作用。适合地,il-33拮抗剂抑制氧化型il-33介导的egfr信号传导。适合地,il-33拮抗剂抑制氧化型il-33介导的rage-egfr作用。适合地,il-33拮抗剂抑制氧化型il-33介导的rage-egfr信号传导。
[0205]
适合地,rage-egfr介导的作用由rage-egfr复合物引起,适合地由氧化型il-33-rage-egfr复合物引起。
[0206]
适合地,此类作用可以典型地包括下游信号传导,该下游信号传导在本文中可以被称为egfr信号传导或rage-egfr信号传导。适合地,此种egfr信号传导可以包括磷酸化和/或趋化因子释放。
[0207]
适合地,此种egfr信号传导包括egfr的磷酸化和随后egfr路径中的组分诸如egfr、plc、jnk、mapk/erk 1/2、p38和stat5的磷酸化。适合地,egfr信号传导包括酪氨酸激酶诸如jnk、mapk/erk、p38的磷酸化。
[0208]
适合地,egfr信号传导包括趋化因子诸如il-8的释放增加。
[0209]
因此,适合地,il-33拮抗剂抑制egfr介导的磷酸化和/或趋化因子释放。
[0210]
因此,适合地,il-33拮抗剂抑制egfr路径中组分的磷酸化。适合地,il-33拮抗剂抑制以下中的任一种的磷酸化:egfr、plc、jnk、mapk/erk 1/2、p38和stat5。适合地,il-33拮抗剂抑制egfr介导的以下中的任一种的磷酸化:egfr、plc、jnk、mapk/erk 1/2、p38和stat5。适合地,il-33拮抗剂抑制酪氨酸激酶的磷酸化。适合地,il-33拮抗剂抑制酪氨酸激酶的磷酸化,这些酪氨酸激酶选自:jnk、mapk/erk、p38。适合地,il-33拮抗剂抑制egfr介导的酪氨酸激酶的磷酸化,这些酪氨酸激酶选自:jnk、mapk/erk和p38。
[0211]
因此,适合地,il-33拮抗剂抑制趋化因子的释放。适合地,il-33拮抗剂抑制il-8的释放。适合地,il-33拮抗剂抑制egfr介导的趋化因子的释放。适合地,il-33拮抗剂抑制egfr介导的il-8的释放。
[0212]
在一个实施例中,提供了一种il-33拮抗剂,该il-33拮抗剂用于预防或治疗egfr介导的疾病。
[0213]
在另一个实施例中,il-33拮抗剂可以用于通过抑制egfr介导的作用来预防或治疗呼吸疾病。
[0214]
此外,il-33拮抗剂可以用于预防或治疗egfr介导的疾病中的上皮生理学异常。
[0215]
在一个实施例中,提供了一种il-33拮抗剂,该il-33拮抗剂用于通过改进上皮生理学异常来预防或治疗egfr介导的疾病。
[0216]
适合地,egfr介导的疾病是rage-egfr介导的疾病。
[0217]
适合地,egfr介导的作用是rage-egfr介导的作用。
[0218]
适合地,egfr介导的作用是rage-egfr介导的信号传导。
[0219]
适合地,il-33拮抗剂抑制egfr介导的作用。适合地,il-33拮抗剂通过抑制egfr介导的作用来治疗或预防疾病或病症。
[0220]
适合地,il-33拮抗剂抑制rage-egfr介导的作用。适合地,il-33拮抗剂通过抑制rage-egfr介导的作用来治疗或预防疾病或病症。
[0221]
如本文所述的“rage-egfr介导的作用”是指由rage与egfr在细胞膜中复合和所导致的异常egfr活性引起的任何生理学作用。rage-egfr介导的作用还可以包括和/或在本文中称为
‘
rage-egfr信号传导’,任选地
‘
rage-egfr介导的信号传导’。此类rage-egfr介导的作用典型地在上皮中可见,并以上皮生理学异常的形式存在。上皮生理学异常在上文中定义,但可以包括对以下的负面影响:屏障完整性;组织与腔之间化学实体的调节和交换;化学物质向腔中的分泌;以及感觉。
[0222]
适合地,rage-egfr介导的疾病和/或作用的特征为egfr活性异常。适合地,rage-egfr介导的疾病和/或作用的特征为rage-egfr信号传导异常。适合地,rage-egfr介导的作用和/或rage-egfr信号传导是rage-egfr介导的疾病的特征。
[0223]
适合地,rage-egfr介导的疾病可以是特征为上皮生理学异常的疾病。
[0224]
适合地,rage-egfr介导的疾病可以是特征为呼吸上皮中的上皮生理学异常的疾病。
[0225]
适合地,rage-egfr介导的疾病可以是特征为粘膜纤毛生理学异常的疾病。
[0226]
适合地,rage-egfr介导的疾病可以是特征为呼吸上皮中的粘膜纤毛生理学异常的疾病。
[0227]
适合的rage-egfr介导的疾病可以选自下文定义的呼吸疾病中的任一种。
[0228]
呼吸疾病
[0229]
本披露涉及il-33拮抗剂用于通过以下来预防或治疗呼吸疾病的医学用途:改进上皮生理学或调节egfr介导的作用,适合地,抑制egfr介导的作用,适合地,抑制rage/egfr介导的作用。
[0230]
适合地,上皮生理学异常可能是呼吸疾病的症状。因此,适合地,il-33拮抗剂可以用于治疗或预防特征为上皮生理学异常的呼吸疾病。
[0231]
如在另一个实施例中所定义,提供了一种il-33拮抗剂,该il-33拮抗剂用于通过改进上皮生理学来预防或治疗呼吸疾病。
[0232]
上皮生理学异常如本文别处所定义。
[0233]
适合地,改进上皮生理学可以包含改进上皮生理学异常。
[0234]
上文描述了改进上皮生理学异常的适合手段。
[0235]
适合地,通过改进上皮生理学异常来治疗呼吸疾病可以包含:
[0236]
改进或增加粘膜纤毛清除;
[0237]
减少或抑制粘液产生;
[0238]
抑制粘液组成异常;
[0239]
减少或抑制上皮重塑异常;和/或
[0240]
减少或抑制杯状细胞的分化或增殖。
[0241]
上文结合上皮生理学异常的治疗或预防提供了关于这些作用中的每一个的其他细节,并且在此可以与呼吸疾病的治疗组合。
[0242]
适合地,egfr活性异常可能是呼吸疾病的症状。因此,适合地,il-33拮抗剂可以用于治疗或预防特征为egfr活性异常的呼吸疾病。
[0243]
如在另一个实施例中所定义,提供了一种il-33拮抗剂,该il-33拮抗剂用于通过抑制egfr介导的作用来预防或治疗呼吸疾病。
[0244]
egfr介导的作用如本文别处所定义。
[0245]
适合地,呼吸疾病是下呼吸疾病,适合地,呼吸疾病是影响气管、支气管、细支气管、肺泡管和/或肺泡的疾病。适合地,呼吸疾病是支气管疾病。
[0246]
适合地,呼吸疾病可以选自:copd;支气管炎;肺气肿;支气管扩张,诸如cf-支气管扩张或非cf-支气管扩张;哮喘;哮喘与copd重叠(aco)。
[0247]
适合地,呼吸疾病是copd。适合地,呼吸疾病是支气管炎性copd。支气管炎性copd是copd的一种特定形式,其中患有copd的患者中存在慢性支气管炎。由于肺功能下降更快,症状增加以及继发感染的风险增加,支气管炎性copd引起的死亡率高于copd。特别地,支气管炎性copd患者具有较高的总粘蛋白浓度并且粘液分泌过多。因此,通过il-33拮抗剂抑制egfr活性并改进粘膜纤毛生理学的发现,支气管炎性copd患者可以特别受益于用本文所述的il-33拮抗剂治疗。
[0248]
适合地,出于相同的原因,呼吸疾病可以是支气管炎性哮喘。
[0249]
在一个实施例中,提供了一种il-33拮抗剂,该il-33拮抗剂用于预防或治疗支气管炎性copd。
[0250]
在一个实施例中,提供了一种预防或治疗患者的支气管炎性copd的方法,该方法包括:向有需要的患者施用有效量的il-33拮抗剂。
[0251]
st2信号传导
[0252]
尽管本披露涉及il-33拮抗剂抑制rage-egfr介导的信号传导和作用的医学用途,但是已经知道il-33拮抗剂可以抑制st2介导的信号传导和作用。因此,本文所述的医学用途设想了egfr介导的作用和st2介导的作用两者的调节。
[0253]
适合地,il-33拮抗剂用于通过调节egfr介导的作用和st2介导的作用来预防和治疗上皮生理学异常。适合地,il-33拮抗剂用于通过抑制egfr介导的作用和st2介导的作用来预防和治疗上皮生理学异常。适合地,il-33拮抗剂用于通过抑制rage/egfr介导的作用和st2介导的作用来预防和治疗上皮生理学异常。上皮生理学异常如本文别处所定义。
[0254]
适合地,il-33拮抗剂用于通过调节egfr介导的作用和st2介导的作用来预防和治疗egfr介导的疾病。适合地,il-33拮抗剂用于通过抑制egfr介导的作用和st2介导的作用来预防和治疗egfr介导的疾病。适合地,il-33拮抗剂用于通过抑制rage/egfr介导的作用和st2介导的作用来预防和治疗egfr介导的疾病。egfr介导的疾病如本文别处所定义。
[0255]
适合地,st2介导的作用包括炎症。因此,适合地,il-33拮抗剂用于通过调节egfr介导的作用和st2介导的作用来预防和治疗st2介导的疾病。适合地,il-33拮抗剂用于通过抑制egfr介导的作用和st2介导的作用来预防和治疗st2介导的疾病。适合地,il-33拮抗剂用于通过抑制rage/egfr介导的作用和st2介导的作用来预防和治疗st2介导的疾病。适合的st2介导的疾病可以包括特征为炎症的疾病。适合的st2介导的疾病可以包括炎症性疾病。
[0256]
st2介导的疾病或炎症性疾病可以包括:copd;过敏性障碍,诸如哮喘、慢性鼻腔鼻窦炎、食物过敏、湿疹和皮炎;纤维增生性疾病,诸如肺纤维化;肺嗜酸性粒细胞增多;胸膜恶性肿瘤;类风湿关节炎;胶原血管病;动脉粥样硬化性血管病;荨麻疹;炎症性肠病;克罗恩氏病(crohn
′
s diseases);乳糜泻病;系统性狼疮;进行性全身性硬化;韦格纳肉芽肿(wegner
′
s granulomatosis);败血性休克;以及白塞病(bechet
′
s disease)。
[0257]
适合地,st2介导的疾病或炎症性疾病是呼吸疾病。适合地,st2介导的疾病或炎症性疾病存在于如上文所定义的呼吸道中。
[0258]
适合地,il-33拮抗剂另外用于预防和治疗炎症或炎症性疾病。适合地,il-33拮抗剂可以另外用于预防和治疗st2介导的炎症或st2介导的炎症性疾病。
[0259]
适合地,st2介导的疾病和egfr介导的疾病重叠。换句话说,st2介导的作用和egfr介导的作用,适合地,rage-egfr介导的作用,有助于疾病病理学。有利地,据信单一il-33拮抗剂的医学用途可以抑制由il-33活化rage和st2两者。因此,单一il-33拮抗剂可以同时治疗rage-egfr介导的疾病和st2介导的疾病两者。
[0260]
在一个实施例中,提供了一种il-33拮抗剂,该il-33拮抗剂用于预防或治疗上皮生理学异常和炎症。在一个实施例中,提供了一种预防或治疗患者的上皮生理学异常和炎症的方法,该方法包括:施用有效量的il-33拮抗剂。
[0261]
适合地,上皮生理学异常和炎症可能是呼吸疾病的症状。因此,关于这些症状的治疗和预防的陈述可以在呼吸疾病的背景下进行,并且可以适合地包含治疗或预防呼吸疾病中的上皮生理学异常和炎症。
[0262]
在一个实施例中,提供了一种il-33拮抗剂,该il-33拮抗剂用于预防或治疗egfr介导的疾病和st2介导的疾病。
[0263]
在一个实施例中,提供了一种预防或治疗患者的egfr介导的疾病和st2介导的疾病的方法,该方法包括:施用有效量的il-33拮抗剂。
[0264]
适合地,il-33拮抗剂是还原型il-33拮抗剂。适合地,还原型il-33拮抗剂如上文所定义。
[0265]
适合地,il-33拮抗剂如上文所定义。适合地,il-33拮抗剂是33_640087-7b。
[0266]
可替代地,可以将不同il-33拮抗剂以组合疗法的形式使用,以抑制由il-33活化rage和st2两者。因此,设想il-33拮抗剂的组合同时治疗rage-egfr介导的疾病和st2介导的疾病两者。
[0267]
适合地,呼吸疾病如上文所定义。适合地,呼吸疾病的特征为egfr活性异常和st2活性异常。
[0268]
因此,适合地,在一个实施例中,提供了用于预防或治疗上皮生理学异常的第一il-33拮抗剂与用于预防或治疗炎症的第二il-33拮抗剂的组合。
[0269]
因此,适合地,在一个实施例中,提供了一种预防或治疗患者的上皮生理学异常和炎症的方法,该方法包括:施用有效量的第一il-33拮抗剂与有效量的第二il-33拮抗剂的组合。
[0270]
因此,适合地,在一个实施例中,提供了用于预防或治疗egfr介导的疾病的第一il-33拮抗剂与用于预防或治疗st2介导的疾病的第二il-33拮抗剂的组合。
[0271]
因此,适合地,在一个实施例中,提供了一种预防或治疗患者的egfr介导的疾病和st2介导的疾病的方法,该方法包括:施用有效量的第一il-33拮抗剂与有效量的第二il-33拮抗剂的组合。
[0272]
适合地,第一il-33拮抗剂用于预防或治疗上皮生理学异常和/或egfr介导的疾病。
[0273]
适合地,第二il-33拮抗剂用于预防或治疗炎症和/或st2介导的疾病。
[0274]
适合地,第一和第二il-33拮抗剂不同。
[0275]
适合地,第一il-33拮抗剂如上文所定义。适合地,第二il-33拮抗剂可以是已知抑制st2介导的作用的任何其他il-33拮抗剂。适合地,第二il-33拮抗剂也如上文所定义。
[0276]
适合地,第一拮抗剂可以是还原型或氧化型il-33拮抗剂。适合地,第二il-33拮抗剂是还原型il-33拮抗剂。
[0277]
适合地,il-33拮抗剂中的至少一种是33_640087-7b。适合地,第一拮抗剂是33_640087-7b。
[0278]
适合地,第一和第二il-33拮抗剂可以组合施用。适合地,第一il-33拮抗剂和第二il-33拮抗剂可以同时或在不同时间组合施用。适合的剂量方案可以由医学专业人员确定。
[0279]
这些陈述同样适用于上文提及的医学用途/治疗方法,在该医学用途/治疗方法中也可以预防或治疗st-2介导的疾病。
[0280]
可替代地,在其他实施例中,可以将il-33拮抗剂与st2抑制剂组合施用。适合地,st2抑制剂可以不是il-33拮抗剂,但是可以通过其他方式抑制st2受体。适合地,st2抑制剂可以起治疗或预防如上文所鉴定的st2介导的疾病的作用。
[0281]
因此,在一个实施例中,提供了一种用于治疗或预防上皮生理学异常的il-33拮抗剂与用于治疗或预防炎症的st2抑制剂的组合。
[0282]
在一个实施例中,提供了一种预防或治疗患者的上皮生理学异常和炎症的方法,该方法包括:施用有效量的il-33拮抗剂与有效量的st2抑制剂的组合。
[0283]
适合地,上皮生理学异常和炎症可能是呼吸疾病的症状。因此,关于这些症状的治疗和预防的陈述可以在呼吸疾病的背景下进行,并且可以适合地包含治疗或预防呼吸疾病中的上皮生理学异常和炎症。
[0284]
因此,在一个实施例中,提供了一种用于治疗或预防egfr介导的疾病的il-33拮抗剂与用于治疗或预防st2介导的疾病的st2抑制剂的组合。
[0285]
在一个实施例中,提供了一种预防或治疗患者的egfr介导的疾病与st2介导的疾病的组合的方法,该方法包括:施用有效量的il-33拮抗剂与有效量的st2抑制剂的组合。
[0286]
适合地,il-33拮抗剂如本文别处所定义。适合的egfr介导的疾病和st2介导的疾病如本文别处所定义。
[0287]
适合地,st2抑制剂可以是本领域中已知的任何此种抑制剂,例如gsk3772847(在wo 2013/165894中描述)和rg6149(wo 2013/173761),两个文献均通过引用并入本文中。
[0288]
适合地,il-33拮抗剂和st2抑制剂可以组合施用。适合地,il-33拮抗剂和st2抑制剂可以同时或在不同时间组合施用。适合的剂量方案可以由医学专业人员确定。
[0289]
患者
[0290]
将这些方法和医学用途针对患者或受试者进行实践。患者可以是需要鉴定、诊断或治疗生理学病症或疾病诸如上皮生理学异常、egfr介导的疾病或呼吸疾病的患者。
[0291]
适合地,患者可以是人类。患者可以正在经历医学护理,或是需要医学护理的个体。适合地,患者是男性或女性。适合地,患者是成人或儿童。
[0292]
适合地,在本文所述的方法中,适合的患者可以是被认为患有上皮生理学异常,或egfr介导的疾病或呼吸疾病的患者。例如,适合的患者可能具有与此类病症一致的症状。
[0293]
可替代地,本文所述方法的背景下的适合患者可以是被认为具有产生上皮生理学异常、或egfr介导的疾病或呼吸疾病的风险的患者。例如,此种患者可能已经与患有此种病症的个体接触,可能患有相关病症,或者可能满足与所述病症相关的风险因素,如吸烟、老龄,过敏等。
[0294]
实施例
[0295]
本披露的部分可以通过以下实施例来表征,其中:
[0296]
实施例1描述了一种il-33拮抗剂,该il-33拮抗剂用于通过抑制egfr介导的作用来预防或治疗疾病。
[0297]
实施例2描述了用于根据实施例1所述使用的il-33拮抗剂,其中该egfr介导的作用是rage-egfr介导的作用。
[0298]
实施例3描述了用于根据实施例1或2所述使用的il-33拮抗剂,其中该egfr介导的作用是rage-egfr介导的信号传导。
[0299]
实施例4描述了用于根据实施例1-3中任一项所述使用的il-33拮抗剂,其中该疾病是呼吸疾病。
[0300]
实施例5描述了用于根据实施例1-4中任一项所述使用的il-33拮抗剂,其中该疾病的特征为上皮生理学异常和/或egfr活性异常。
[0301]
实施例6描述了用于根据实施例1-5中任一项所述使用的il-33拮抗剂,其中该疾
病选自:copd;支气管炎;肺气肿;支气管扩张,诸如cf-支气管扩张或-cf-支气管扩张;哮喘;或哮喘与copd重叠(aco)。
[0302]
实施例7描述了用于根据实施例4-6中任一项所述使用的il-33拮抗剂,其中该呼吸疾病是支气管炎性copd。
[0303]
实施例8描述了用于根据实施例1-7中任一项所述使用的il-33拮抗剂,其中该治疗:改进粘液清除;抑制粘液产生异常;抑制上皮重塑异常;和/或抑制杯状细胞分化异常。
[0304]
实施例9描述了用于根据任何前述实施例所述使用的il-33拮抗剂,其中该il-33拮抗剂抑制氧化型il-33的活性。
[0305]
实施例10描述了用于根据任何前述实施例所述使用的il-33拮抗剂,其中该il-33拮抗剂阻止氧化型il-33与rage结合,从而抑制rage-egfr信号传导。
[0306]
实施例11描述了用于根据任何前述实施例所述使用的il-33拮抗剂,其中该il-33拮抗剂是抗il-33抗体或其抗原结合片段,优选抗还原型il-33抗体或抗原其结合片段。
[0307]
实施例12描述了用于根据实施例11所述使用的il-33拮抗剂,其中该抗il-33抗体或其抗原结合片段包含选自表1的可变重链结构域(vh)和可变轻链结构域(vl)对的互补决定区(cdr)。
[0308]
实施例13描述了用于根据实施例12所述使用的il-33拮抗剂,其中该抗il-33抗体或其抗原结合片段包含选自表1的可变重链结构域(vh)和可变轻链结构域(vl)对。
[0309]
实施例14描述了用于根据实施例11-13中任一项所述使用的il-33拮抗剂,其中该抗il-33抗体或其抗原结合片段包含具有seq id no:37的序列的vhcdr1、具有seq id no:38的序列的vhcdr2、具有seq id no:39的序列的vhcdr3、具有seq id no:40的序列的vlcdr1、具有seq id no:41的序列的vlcdr2和具有seq id no:42的序列的vlcdr3。
[0310]
实施例15描述了用于根据实施例11-14中任一项所述使用的il-33拮抗剂,其中该il-33拮抗剂是抗il33抗体或其抗原结合片段,该抗il33抗体或其抗原结合片段包含seq id no:1的序列的vh结构域和seq id no:19的序列的vl结构域。
附图说明
[0311]
将参考下图,以举例的方式描述实施例,其中:
[0312]
图1:显示了对于map激酶磷酸化抗体阵列上的每个检测测定,与未处理的对照相比,激酶磷酸化的增加倍数的灰度热图。还原型il-33(分别为il-33-01和il-33-16)没有引起任何高于基线的信号。oxil-33(氧化型il-33-01)使多种激酶的磷酸化增加;
[0313]
图2:显示了受体酪氨酸激酶(rtk)活性阵列上每种刺激条件的信号模式。oxil-33,而非分别而言还原型il33-01和il33-16,在rtk阵列上触发了对应于表皮生长因子受体(egfr)的阳性信号。点强度与受体酪氨酸激酶磷酸化有关;
[0314]
图3a:显示了在用增加浓度的il-33或egfr配体刺激的正常人支气管上皮(nhbe)细胞中的pegfr(tyr1068)活性。oxil-33,而非还原型il-33(il33-01),类似于egf、hb-egf和tgfα促进egfr的磷酸化;
[0315]
图3b:显示了在用增加浓度的il-33或egfr配体刺激的a549细胞中的pegfr(tyr1068)活性。oxil-33(氧化型il-33-01),而非还原型il-33(il-33-01),以类似于nhbe细胞中可见的模式类似于egf、hb-egf和tgfα促进了egfr的磷酸化。
[0316]
图3c:显示了在用增加浓度的il-33、egfr配体或rage配体刺激的a549细胞中的pegfr(tyr1068)活性。oxil-33,而非野生型(wt)il-33(il-33-01)、c->s突变的(mut)il-33(il-33-16)或rage配体类似于egf促进了egfr的磷酸化;
[0317]
图4:显示如通过蛋白质印迹所分析,氧化型il-33诱导参与egfr路径的多个分子(egfr、plc、akt、jnk、erk 1/2、p38)的磷酸化;
[0318]
图5:显示通过增加抗egfr抗体的剂量,与同种型对照相比,减少了由oxil-33-01诱导的stat5磷酸化;
[0319]
图6:显示用抗egfr进行免疫沉淀,随后通过蛋白质印迹检测egfr、rage或il-33。在用oxil-33进行nhbe刺激后,il-33和rage与egfr共沉淀,这表明期形成了复合物。与egf相比,rage对于oxil-33信号传导复合物似乎是唯一的;
[0320]
图7a:显示oxil-33直接与rage结合。hmgb1是一种已知的rage配体,并且在本研究中可作为阳性对照;
[0321]
图7b:显示oxil-33不直接与egfr结合(但已知的egfr配体egf直接与egfr结合)。但是,当将rage与oxil-33组合添加到此测定时,则可见egfr结合;
[0322]
图8:显示在指定时间点用oxil-33活化后,在野生型和rage缺陷型a549细胞中,用抗egfr或抗rage进行的免疫沉淀,随后进行egfr、rage和il-33的蛋白质印迹;
[0323]
图9:显示oxil-33-01诱导的stat5磷酸化被抗rage抗体而非抗st2抗体减少;
[0324]
图10:显示egf和氧化型il33(oxil33)诱导egfr-gfp a549细胞中的egfr聚集和内在化。刺激5分钟后显示代表性图像。直方图显示在用egf和oxil-33处理的细胞中非聚类区中egfr的消耗(直方图钟形峰左移),以及这些细胞中由于聚类而引起的饱和像素数量增加(强度255)。
[0325]
图11:显示用单独的培养基(未刺激的对照)、30ng/ml il-33-01、30ng/ml il-33-16、30ng/ml氧化型il-33或30ng/ml egf刺激24h后,nhbe和dhbe的il-8分泌的增加倍数。条形图显示了来自4个nhbe和3个dhbe供体的均值和sem;
[0326]
图12a:显示了用还原型il-33、oxil-33或egf处理后a549细胞的相对划痕愈合密度。条形图显示了每种条件下6次技术重复的均值和sem;
[0327]
图12b:显示了用还原型il-33、oxil-33或egf处理后nhbe细胞的相对划痕愈合密度。条形图显示了每种条件下6次技术重复的均值和sem;
[0328]
图13:显示了在抗st2、抗rage或抗egfr存在下,用单独的培养基(未刺激的对照)、还原型il-33、氧化型il-33或氧化型il-33处理的nhbe细胞的划痕闭合百分比。条形图显示了每种条件下6次技术重复的均值和sem;
[0329]
图14:显示了在经和不经氧化型il-33刺激下,来自健康受试者、吸烟者和copd的人支气管上皮细胞中的相对划痕愈合密度;
[0330]
图15:显示了与dhbe copd细胞(n=5个供体)和用igg1对照、抗il-33(33_640087-7b)、抗rage(m4f4)和抗st2处理的dhbe相比,nhbe细胞(n=5个供体)24小时的划痕闭合(%)。条形图显示了n=5个独立供体的均值和sem;
[0331]
图16a:显示了来自健康供体的ali培养物的基底(p63+;蓝色)、纤毛(α微管蛋白;紫色)和杯状(粘蛋白5ac+粘蛋白b;黄色)细胞的代表性免疫组织化学染色。
[0332]
图16b:显示了用抗il-33(33_640087-7b)或同种型对照抗体处理7天后,使用halo
软件对各种上皮细胞类型的免疫组织化学的定量;显示的数据是来自n=2-3个独立供体的均值和sem。
[0333]
图16c:显示了用抗il-33(33_640087-7b)或同种型对照抗体处理7天后,使用halo软件对杯状细胞的定量;显示的数据是来自n=2-3个独立供体的均值和sem。
[0334]
图17:显示了来源于健康者(1个供体)或copd者(1个供体)的ali培养物中的独立粘蛋白(粘蛋白5ac和粘蛋白5b)的示例性染色,以及用抗il-33(33_640087-7b)处理7天后copd培养物中的粘蛋白染色减少。
[0335]
图18:显示了tsne图,这些tsne图说明了与未处理相比,来自用抗il-33处理的独立供体的copd ali培养物中发现的细胞亚型的不同比例。
[0336]
图19a:显示了检测来自正常供体的ali培养物中杯状细胞的代表性流式细胞术等高线图。muc5b在x轴上,并且muc5ac在y轴上。用蛋白质处理ali培养物7天。用还原型il-33(il-33[c->s])处理不会使杯状细胞增加至高于基线。oxil-33(氧化型il-33-01)使杯状细胞百分比增加,il-13也如此。已知il-13可增加ali培养物中的杯状细胞,并在本研究中用作阳性对照。象限中的数字显示总群体数的百分比:左上象限中是muc5ac单阳性杯状细胞,右下象限中是muc5b单阳性杯状细胞,并且右上象限中是muc5ac和muc5b双阳性杯状细胞。
[0337]
图19b:显示了来自正常供体(n=6)的ali培养物的合并流式细胞术数据,这些数据显示了杯状细胞(合并的muc5ac单阳性、muc5b单阳性以及muc5ac和muc5b双阳性杯状细胞)占总上皮群体数的百分比。还原型il-33(il-33[c->s])不会使杯状细胞增加至高于基线。oxil-33(氧化型il-33-01)与il-13一样使杯状细胞百分比增加。小提琴图显示了所有数据点和中位数。
[0338]
图19c:显示了来自正常供体(n=6)的ali培养物的合并流式细胞术数据,这些数据显示了muc5ac单阳性杯状细胞。还原型il-33(il-33[c->s])不会使杯状细胞增加至高于基线。oxil-33(氧化型il-33-01)与il-13一样使杯状细胞百分比增加。小提琴图显示了所有数据点和中位数。
[0339]
图19d:显示了来自正常供体(n=4)的ali培养物的合并rt-qpcr数据,这些数据显示了muc5ac mrna的倍数变化。还原型il-33(il-33[c->s])没有增加muc5ac mrna。oxil-33(氧化型il-33-01)与il-13一样引起muc5ac mrna增加。小提琴图显示了所有数据点和中位数。
[0340]
图20a:显示了来自健康供体的ali培养物的基底(p63+;紫色)、纤毛(α微管蛋白;深青色)和杯状(muc5ac+muc5b;黄色)细胞的代表性免疫组织化学染色。还原型il-33(il-33[c->s])在视觉上未能增加杯状细胞。oxil-33(氧化型il-33-01)引起杯状细胞的可见增加。
[0341]
图20b:显示了使用halo软件从免疫组织化学图像(每个条件最少n=3个供体)对粘蛋白5ac+粘蛋白5b区域(总上皮组织区域%)进行的定量。与未处理的和还原型il-33处理的对照相比,oxil-33和il-13增加了粘蛋白染色的区域。
[0342]
图21a:显示了检测来自copd供体的ali培养物中杯状细胞的代表性流式细胞术等高线图。如所描绘,muc5b在x轴上,并且muc5ac在y轴上。用抗体处理ali培养物7天。抗il-33(33_640087-7b)处理减少了总杯状细胞数量。象限中的数字显示总群体数的百分比:左上
16或il-33[c->s])的cdna分子,并将其克隆至pjexpress 411(dna 2.0)中。修饰野生型(wt)和突变型il-33编码序列以在蛋白质的n末端含有10xhis、avitag和因子xa蛋白酶切割位点(mhhhhhhhhhhaaglndifeaqkiewheaaiegr seq id no:43)。通过转化大肠杆菌bl21(de3)细胞产生n末端标签化的his10/avitag il33-01(wt,seq id no:44)和n末端标签化的his10/avitag il33-16(wt,seq id no:45)。在37℃下,在自体诱导培养基(overnight express
tm
自体诱导系统1,默克密理博公司(merck millipore),71300-4)中培养转化的细胞18小时,随后通过离心收获细胞且储存在-20℃下。将细胞再悬浮于含有完全无edta的蛋白酶抑制剂混合物片剂(罗氏公司(roche),11697498001)和50u/ml全能核酸酶(benzonase)(默克密理博公司,70746-3)的2x dpbs中,并通过超声处理裂解。通过在4℃下以50,000x g离心30min来使细胞裂解物变澄清。通过固定的金属亲和色谱法,以5ml/min加载到用2x dpbs、1mm dtt平衡的histrap excel柱(ge医疗公司(ge healthcare),17371205)上来从上清液中纯化il-33蛋白。用2x dpbs、1mm dtt、20mm咪唑(ph 7.4)洗涤柱以去除杂质,然后用2x dpbs、0.1%triton x-114洗涤以去除固定的内毒素蛋白。用2x dpbs、1mm dtt、20mm咪唑(ph 7.4)进一步洗涤后,将样品用2x dpbs、1mm dtt、400mm咪唑(ph 7.4)洗脱。通过尺寸排阻色谱法,使用在2x dpbs中的hiload superdex 75 26/600pg柱(ge医疗公司,28989334),以2.5ml/min进一步纯化il-33。通过sds page分析峰级分。将含有纯il-33的级分合并,并且通过280nm下的吸光度来确定浓度。通过sds-page分析最终样品。
[0358]
为产生未标签化的il-33,使n末端标签化的his10/avitag il33与每毫克蛋白质10个单位因子xa(ge医疗公司,27084901)在室温下在2x dpbs缓冲液中一起孵育1小时。在2x dpbs中,在hiload 16/600superdex 75pg柱(ge医疗公司,28989333)上,以1ml/min的流速使用sec色谱法来纯化未标签化的il-33。
[0359]
2.氧化型il-33(oxil-33)的产生和纯化
[0360]
通过在60%imdm培养基(无酚红)、40%dpbs中稀释至0.5mg/ml的最终浓度,并在37℃下孵育18小时,将还原型il33-01氧化。通过将样品加载到hitrap capto q impres阴离子交换柱(ge医疗公司,17547055)上,从样品中去除氧化过程中产生的聚集体。加载之前,通过添加1m tris(ph 9.0)直至ph达到8.3并添加5m nacl至125mm的最终浓度来修饰样品-在这些加载条件下,聚集体与柱结合并且单体oxil-33流过而没有结合并被收集。通过在22℃下与因子xa(neb,p8010l)以每50μg oxil-33 1μg因子xa的最终浓度孵育120min来从oxil-33切割标签。为了消耗具有任何剩余还原型il-33的样品,将与人igg1 fc-his6融合的可溶性人st2s胞外结构域与样品在22℃下孵育30min,并结合还原型il-33。将样品在截留值为3,000da的离心浓缩器中进行浓缩,并以2ml/min的流速加载到hiload superdex 75 26/600pg柱(ge医疗公司,28989334)上,从而将单体oxil-33与其他样品组分分离。合并含有纯oxil-33的级分并浓缩,并且通过uv吸收光谱法在280nm下测定样品的最终浓度。最终产品质量通过sds-page、hp-sec和rp-hplc进行评估。
[0361]
3.人st2 ecd的克隆、表达和纯化
[0362]
通过pcr用引物扩增编码不含内源信号肽(氨基酸残基19-328)的st2的天然存在的st2s可溶性同型(uniprot登录号q01638-2)的cdna,这些引物编码与gibson组装相容的延伸序列和与st2s编码序列的n端融合的cd33信号肽。类似地扩增具有c末端his6-标签的
c-digit上可视化,并使用image lite studio定量。
[0368]
表2
[0369][0370]
与野生型(il-33)和il-33的c->s(il-33[c->s])还原形式(分别为il33-01和il33-16)相比,氧化型il33-01(oxil-33)活化了与受体酪氨酸激酶(rtk)参与的路径一致的多个关键信号传导分子(图1)。
[0371]
6.il-33的氧化形式活化了表皮生长因子受体(egfr)
[0372]
为了尝试和鉴定被oxil-33活化的受体酪氨酸激酶(rtk),使用71rtk阵列进行筛选。rtk磷酸化抗体阵列试剂盒(ab193662)购自艾博抗公司,并根据制造商的说明书进行实验。培养nhbe,并以1x106个/2ml接种在6孔板(康宁公司costar,3516)中的培养基[begm(龙沙公司cc-3171)和补充试剂盒(龙沙公司cc-4175)]中。将细胞在37℃,5%co2下孵育18-24小时。此后,吸出培养基,并将细胞用1ml pbs洗涤两次,随后添加饥饿培养基(无补充试剂盒的begm(龙沙公司cc-3171))。然后在刺激前将这些板在37℃、5%co2下再孵育18-24小时。遵循先前对于map激酶阵列所述的相同步骤,将细胞活化(表2的活化剂),裂解,并且每个阵列膜使用250μg总蛋白。按照制造商的说明书执行所有后续步骤。将膜在licor c-digit上可视化,并使用image lite studio定量。未检测到对还原的野生型(il-33)或c->s(il-33[c->s1)il-33(分别为il33-01和il33-16)的反应。但是,oxil-33(氧化型il-33-01)在rtk阵列上触发了与表皮生长因子受体(egfr)相对应的阳性信号(图2)。
[0373]
通过其他方法证实了oxil-33(氧化型il-33-01)刺激egfr信号传导的能力。活化后,将egfr在tyr1068处磷酸化,并且此磷酸-egfr可以使用均相fret(荧光共振能量转移)(均相时间分辨荧光,齐斯博国际公司(cisbio international))测定(cisbio试剂盒#64eg1peh)检测到。简言之,将nhbe以5x105个/100μl铺在96孔板(康宁公司costar,3598)中的培养基[begm(龙沙公司cc-3171)和补充试剂盒(龙沙公司cc-4175)]中。将这些板在37℃,5%co2下孵育18-24小时。此后,吸出培养基,并将细胞用0.2ml pbs洗涤两次,随后添加饥饿培养基(无补充试剂盒的begm(龙沙公司cc-3171))。然后将板在37℃,5%co2下再孵育18-24小时,随后用增加浓度的il-33-01、il-33-16和oxil-33(氧化型il-33-01)以及egfr配体(表2和表3)刺激,接着放回37℃,5%co2下的孵育箱后维持10min。吸出培养基,并且每孔用50μl裂解缓冲液(齐斯博公司,64eg1peh)替换。然后按照制造商的说明书(齐斯博公司,64eg1peh)进行测定。使用envision读板仪(珀金埃尔默公司)在620nm和665nm发射波长下读取时间分辨荧光。通过计算665/620nm比率和使用graphpad prism软件通过使用四参数对数方程进行曲线拟合确定的ec50值来分析数据。
[0374]
表3
[0375][0376]
类似地,使用如本节先前提及的htrf测定评定上皮细胞系a549中的egfr磷酸化。简言之,从atcc获得a549,并在补充有1%青霉素/链霉素和10%fbs的rpmi glutamax培养基中培养。用急性酶(paa,#l1 1-007)收获细胞,以5x105个/100μl接种到96孔板中,并在37℃,5%co2下孵育18-24小时。然后将孔用100μl pbs洗涤两次,随后添加100μl饥饿培养基(补充有1%青霉素/链霉素的rpmi glutamax培养基),并在37℃,5%co2下孵育18-24小时。用增加浓度的il-33-01、il-33-16和oxil-33-01(氧化型il-33-01的同义词)、egfr配体和rage配体刺激细胞(表2和表3),随后放回37℃,5%co2下的孵育箱后维持10min。吸出培养基,并且每孔用50μl裂解缓冲液(齐斯博公司,64eg1peh)替换。然后按照制造商的说明书(齐斯博公司,64eg1peh)进行测定。使用envision读板仪(珀金埃尔默公司)在620nm和665nm发射波长下读取时间分辨荧光。通过计算665/620nm比率和使用graphpad prism软件通过使用四参数对数方程进行曲线拟合确定的ec50值来分析数据。
[0377]
在nhbe和a549细胞两者中,oxil-33均类似于真正的激动剂egf促进egfr的磷酸化(图3)。此未被测试的其他rage配体重复。
[0378]
7.信号传导组件的蛋白质印迹
[0379]
进行了蛋白质印迹实验,以进一步研究响应于oxil-33(氧化型il33-01),egfr信号传导复合物的哪些元件被活化。如以上在第5节所述,将nhbe培养并铺在6孔培养皿中。血清饥饿后,用oxil-33(30ng/ml)刺激细胞5至240分钟之间。然后吸出培养基,并用冰冷的pbs洗涤细胞,随后添加150μl裂解缓冲液[1x lds样品缓冲液(赛默公司,np0008)、10mm mgcl2(vwr,7786-30-3)、2.5%β-巯基乙醇(西格玛公司(sigma),m6250)和0.4μg/ml全能核酸酶(密理博公司,70746)]。将细胞在冰上放置10min,随后将裂解物转移至1.5ml管中,并加热至90℃后维持5min。将溶液转移至新的1.5ml管中,并在4-12%sds-page凝胶(赛默公司,nw04127box)上在mes运行缓冲液(b0002)中运行10μl样品以及5μl蛋白梯(伯乐公司(biorad),1610374)。使用transblot turbo(伯乐公司)将凝胶转移到pvdf膜(伯乐公司,1704156)上。将pvdf膜在含有5%脱脂奶粉(marvel)的pbs-吐温(tween)溶液中阻断10分
钟。然后将膜与一级抗体在含有5%bsa的pbs-吐温中在4℃下孵育过夜。然后将膜用pbs-吐温洗涤五次,接着在室温下在含有5%脱脂奶粉的pbs-吐温中与hrp标签化的二级抗体一起孵育1小时。然后用pbs-吐温将膜洗涤五次,随后添加ecl(伯乐公司,1705062)并用licor c-digit可视化。
[0380]
结果显示,oxil-33-01活化了几种egfr信号传导组件(图4)
[0381]
8.ox-il-33诱导stat-5磷酸化,这被egfr中和ab阻断
[0382]
接下来试图确定是否可以通过阻止与egfr结合来抑制oxil33介导的stat5活化。简言之,在补充有1%青霉素/链霉素和10%fbs的rpmi glutamax培养基中培养a549细胞。用急性酶收获细胞,以5x105个/100μl接种到96孔板中,并在37℃,5%co2下孵育18-24小时。然后将孔用100μl pbs洗涤两次,随后添加100μl饥饿培养基(补充有1%青霉素/链霉素的rpmi glutamax培养基),并在37℃,5%co2下孵育18-24小时。将抗egfr抗体(克隆la1(05-101,密理博公司)或同种型对照(mab002,r&d系统公司)以剂量依赖性方式添加至孔中,并将板放回孵育箱后维持30min。然后用氧化型il-33(30ng/ml)刺激板30min,随后按照制造商的说明书,使用磷酸-stat5 elisa试剂盒裂解缓冲液(85-86112-11,赛默飞世尔科技公司(thermofischer scientific))裂解并显影,接着读取450nm下的吸光度。如图5所示,用oxil-33-01活化的细胞呈现出stat5磷酸化,该stat5磷酸化在存在抗egfr抗体的情况下会降低(图5)。
[0383]
实例2-氧化型il-33诱导egfr和rage之间的复合物形成
[0384]
9.oxil-33诱导egfr和rage之间的复合物形成
[0385]
为了理解rage和egfr如何参与促进oxil-33的信号传导,进行了免疫沉淀实验以探索信号传导复合物。首先,使抗egfr抗体与dynabead共价偶联。按照制造商的说明书,将两个100μg小瓶的抗egfr抗体(r&d系统公司,af231)与40mg dynabead(赛默公司,14311d)一起孵育,并共价偶联。成功偶联后,将珠粒以30mg/ml再悬浮于pbs中,并保持在4℃下。
[0386]
从龙沙公司获得nhbe(cc-2540),并且将冷冻小瓶以每培养皿1x106个细胞直接接种到15cm培养皿(赛默公司,157150)中。根据制造商的方案,将nhbe维持在完全begm培养基(龙沙公司)中1个月,其中每三天更换一次培养基,直到细胞达到汇合为止。将这些板在37℃,5%co2下孵育此时间段。在刺激前一天,将板用20ml pbs洗涤两次,随后添加15ml饥饿培养基(无补充试剂盒的begm(龙沙公司cc-3171))。然后将板在37℃,5%co2下再孵育18-24小时,随后用单独的培养基(未刺激的对照)、30ng/ml还原型il-33-01、30ng/ml氧化型il-33-01或30ng/ml egf刺激,并放回37℃,5%co2后维持10min。吸出培养基,并用冰冷的pbs洗涤板两次,随后每15cm培养皿添加1ml含有磷酸酶和蛋白酶抑制剂(赛默公司,78440)的裂解缓冲液(艾博抗公司,ab152163)。将细胞刮入裂解缓冲液中,随后转移至2ml蛋白lobind管(艾本德公司(eppendorf),z666513)中,并通过在4℃下以14,000rpm离心变得澄清。使用bca试剂盒(赛默公司,23225)测定蛋白质浓度,并用裂解缓冲液将所有蛋白质提取物标准化至3mg/ml。将6mg总蛋白提取物在具有100μl抗egfr dynabead(如上所述)的2ml洁净lobind管中孵育。然后将管放置在4℃下的立式圆筒形混合机上5h。使用磁铁(伯乐公司,1614916)将dynabead固定,吸出蛋白质提取物,并用2ml洗涤缓冲液1(50mm tris-hcl ph 7.5(赛默公司,15567027)、0.5%tritonx100(西格玛公司,x100)、0.3m nacl)替换。将此再重复四次。然后用洗涤缓冲液2(50mm tris-hcl ph 7.5)以相同方式将珠粒再洗涤十次。在
最后的洗涤步骤之后,将50mm含50μl 1%rapigest(w/v)(沃特世公司(waters),186001861)的tris-hcl ph8.0添加到珠粒中,并在60℃下加热10min。然后将上清液转移至新的lobind 2ml管中。再将100μl 50mm tris-hcl ph8.0添加到树脂中并混合,随后将其与第一次洗脱物组合。然后添加tcep(西格玛公司,646547)至最终浓度为5mm,并将样品在60℃下加热10min。然后通过在黑暗中在室温下添加碘乙酰胺(西格玛公司,16125)至10mm使洗脱液烷基化20min。通过添加dtt(西格玛公司,d5545)至10mm淬灭烷基化。然后添加tris-hcl缓冲液50mm ph8.0,得到500μl的最终样品体积。每管添加0.5μg胰蛋白酶(普洛麦格公司(promega),v5111),并在30℃下在400rpm的振荡平台上将样品消化过夜。然后将样品用三氟乙酸(西格玛公司,302031)酸化至最终浓度为2.0%(v/v),并在37℃下孵育1h时。然后将样品以14,000rpm离心30min,并将上清液转移至新的2ml lobind管中。然后按照制造商的说明书通过c18柱(赛默公司,87784)处理样品。然后使用speed-vac干燥样品,随后储存在-20℃下。然后通过肽质量指纹质谱法(pmf-lc-ms)分析样品。使用scaffold软件分析结果。
[0387]
在所有4种条件下均类似地检测到了egfr,表明免疫沉淀在所有样品中均表现良好。与用il33-01(il-33)或egf处理的样品相比,在用oxil-33处理的样品中检测到rage和il-33,表明在信号传导期间oxil-33和rage与egfr相关。与先前用oxil-33和egf在这些细胞中活化egfr的观察结果一致,用这些配体刺激后,检测到先前报道的参与egfr信号传导和内吞作用的蛋白质,但不是还原型il33-01(表4)。
[0388]
表4显示了用还原型il-33-01(il-33)、oxil-33(氧化型il-33-01)或egf刺激的nhbe的lcms分析。用oxil-33刺激后,检测到il-33和rage与egfr复合,但用还原型il33-01(il-33)或egf刺激后未检测到。括号指示对于每种蛋白质鉴定的独特肽的数量。
[0389]
表4
[0390][0391][0392]
为了证实这些观察结果,还对根据上述方案制备的细胞裂解物进行了免疫沉淀和蛋白质印迹。确定nhbe蛋白提取物的浓度后,将3mg总蛋白与6μg抗egfr抗体(r&d系统公司,af231)一起在1.5ml管中孵育,并放置在4℃下的立式圆筒形混合机(end-over-end mixer)上2.5h。然后将1.5mg蛋白a/g磁珠(赛默公司,88802)添加到每个管中,随后将管放回4℃后
在混合下再维持1h。然后用磁铁(伯乐公司,1614916)收集珠粒,并用500μl(50mm tris(ph 7.5)、1%tritonx和0.25m nacl)洗涤三次,并用500ul 10mm tris(ph 7.5)洗涤一次。然后使用35μl具有还原剂(赛默公司,np0004)的lds样品缓冲液(赛默公司,np0008)从磁珠释放蛋白质,并在95℃下加热5分钟。将溶液转移至新的1.5ml管中,并在4-12%sds-page凝胶(赛默公司,nw04127box)上在mes运行缓冲液(b0002)中运行10μl样品以及5μl蛋白梯(伯乐公司(biorad),1610374)。使用transblot turbo(伯乐公司)将凝胶转移到pvdf膜(伯乐公司,1704156)上。将pvdf膜在含有5%脱脂奶粉(marvel)的pbs-吐温(tween)溶液中阻断10分钟。然后将膜与一级抗体(抗egfr(细胞信号传导技术公司(cell signaling technology),2232)、抗rage(细胞信号传导技术公司,6996)或抗il-33(r&d系统公司,af3625))在含有5%bsa的pbs-吐温中在4℃下孵育过夜。然后将膜用pbs-吐温洗涤五次,接着在室温下在含有5%脱脂奶粉的pbs-吐温中与抗兔hrp标签化的二级抗体(细胞信号传导技术公司,7074)或抗山羊hrp标签化的二级抗体(r&d系统公司,haf109)一起孵育1小时。然后用pbs-吐温将膜洗涤五次,随后添加ecl(伯乐公司,1705062)并用licor c-digit可视化。蛋白质印迹证实在oxil-33存在下rage与egfr共沉淀,而在egf刺激下未检测到rage(图6)。这些发现揭露,rage和egfr是氧化型il-33信号传导复合物的功能部分。
[0393]
10.oxil-33需要rage与egfr形成复合物
[0394]
上述实验显示,oxil-33是引起下游信号传导的egf受体(egfr)复合物的配体。本节中的实验经设计以判定oxil-33是否是rage或egfr的直接结合配体。为了更多地了解有关信号传导复合物的形成并评定oxil-33是否直接与egfr相互作用,使用elisa形式探索oxil-33与rage、st2-fc和egfr的结合。
[0395]
蛋白质和修饰:遵循制造商的方案使用生物素连接酶(bira)(avidty,bulk bira)将含有avitag序列基序(glndifeaqkiewhe seq id no:46)的蛋白质生物素化。遵循制造商的方案使用ez连接磺基-nhs-lc-生物素(赛默公司/皮尔斯公司(pierce),21335)经由游离胺将本文所用的所有修饰的无avitag的蛋白质生物素化。表5是所用生物素化蛋白质的清单。
[0396]
表5.
[0397]
试剂生物素化的egf(赛默公司)avitag-人asgpravitag_il-33-01(还原型il-33)avitag_il-33-01(氧化型il-33)avitag_il-33-16hmgb1
[0398]
在室温下用100μl/孔生物素化的抗原(10μg/ml,pbs中)涂布抗生蛋白链菌素板(赛墨科技公司(thermo scientific),ab-1226)后维持1小时。将板用200μl pbs-t(pbs+1%(v/v)吐温-20)洗涤3次,并用300μl/孔阻断缓冲液(含1%bsa的pbs(西格玛公司,a9576))阻断1小时。将板用pbs-t洗涤3次。将rage-fc(r&d系统公司#1145-rg)或st2-fc(r&d系统公司#523-st)在含pbs的阻断缓冲液中稀释至10μg/ml,添加至相关孔中,并在室温下孵育1小时。可替代地,在存在或不存在含10μg/ml未标签化的rage(义翘神州生物公司
(sino biological),11629-hcch)的pbs的情况下,添加100μl含10μg/ml egfr-fc(r&d系统公司#344-er-050)的pbs后维持1小时。将板用200μl pbs-t洗涤3次。然后在室温下用100μl/孔在阻断缓冲液中1∶10000稀释的抗人igg hrp(西格玛ao170,5.1mg/ml)检测rage-fc、st2-fc和egfr-fc持续1小时。将板用pbs-t洗涤3次且用100μl/孔tmb(西格玛公司,t0440)显影。用50μl/孔的0.1m h2so4淬灭反应。在cytation gen5或类似设备上读取450nm下的吸光度。结果显示,oxil-33呈现出与rage明显相互作用(图7a),而oxil-33与egfr的直接结合可忽略(图7b)。仅通过向此测定中添加srage可观察到egfr与oxil-33结合(图7b)。如果用oxil-33取代真正的rage激动剂hmgb1,则此不能重现(图7b)。
[0399]
使用rage缺陷型细胞系进一步证实了oxil-33触发的egfr信号传导中需要rage。如下产生敲除rage的a549细胞系:
[0400]
产生哺乳动物质粒,其含有红色荧光蛋白(rfp)的表达载体、靶向ager的外显子3的指导rna(tgaggggattttccggtgcseq id no:47)和cas9内切核酸酶。通过使a549细胞在t-175烧瓶中在f12k坚果混合物(吉博科公司(gibco),补充有10%fbs和1%青霉素/链霉素)中生长两天来产生a549条件培养基。将消耗的培养基从a549取出,过滤,并在新鲜的吉博科公司f12k坚果混合物(补充有20%fbs和1%青霉素/链霉素)中5倍稀释。将a549以2x105个细胞/ml接种到三个t-75烧瓶中,共15ml,并置于37℃,5%co2孵育箱中过夜。使用1.6ml f12k坚果混合物(补充1%青霉素/链霉素)以及8μg ager指导rna质粒和22.5μg pei(波利塞斯公司(polysciences),23966-2)制备转染混合物。然后将混合物涡旋10秒,并在室温下放置15min。接着将0.75ml转染混合物添加到每个t-75烧瓶中。将烧瓶放回孵育箱后维持两天。然后使用急性酶分离a549细胞,转移到含1%fbs的pbs中,并根据rfp在96孔培养皿中的表达,在aria细胞分选仪(bd)上分选单个细胞。每3-5天用条件培养基喂养细胞。细胞超过50%汇合后,将其转移到24孔板中并使其生长。此升级过程一直持续到每个成功的克隆被分到t15烧瓶中。然后将细胞分到12孔板中,并生长直至超过50%汇合,随后分析基因组pcr的成功敲除情况。使每孔的细胞在100μl dna裂解缓冲液(维亚根生物技术公司(viagen bitoech),301-c,补充有0.3μg/ml蛋白酶k)中裂解。将这些样品在55℃下孵育4小时,随后在85℃下孵育15min。使用具有以下序列的正向和反向引物进行rage的pcr:正向-gttgcagcctcccaacttc(seq id no:48),反向-aatgaggccagtggaagtca(seq id no:49)。反应和循环的设定如下:反应体积为50μl[25μl q5聚合酶混合物、2.5μl正向引物(10μm储备液)、2.5μl反向引物(10μm储备液)、2μl模板dna裂解物、18μl无核酸酶的水]。进行pcr反应,其中在98℃下进行初始变性30秒,随后进行如下35个如下循环:在98℃下5秒,在57℃下10秒以及在72℃下20秒,随后最后一步在72℃下2分钟。将4μl pcr产物与6μl无核酸酶的水和2μl 6x dna加载缓冲液(赛默科技公司,r0611)混合。将样品在90v下在1%琼脂糖凝胶(1∶10000sybr safe)上运行1小时,随后在versadoc成像仪上可视化。然后遵循制造商的方案,使用qiaquick pcr纯化试剂盒(凯杰公司(qiagen),28104)清理其余的pcr产物。使用nanodrop测量dna-50浓度。发送几个克隆(从结果中选择)进行内部测序。结果显示在克隆rage09和rage10中成功插入了终止密码子。
[0401]
为了确定rage对oxil-33介导的egfr信号传导的必要性,然后对a549和rage缺陷型a549细胞进行了免疫沉淀和蛋白质印迹。简言之,用oxil-33-01在各时间点(0-15分钟)活化细胞系。随后进行egfr或rage的免疫沉淀,然后遵循第9节中详述的相关实验方案用抗
rage、抗egfr和抗il-33进行蛋白质印迹。结果显示rage在与oxil-33和egfr形成复合物中的关键作用(图8)
[0402]
11.氧化型il-33诱导stat5磷酸化,该stat5磷酸化被rage阻断,但未被st2中和抗体阻断
[0403]
为了证实oxil-33信号传导中rage的重要性优于st2,测试了阻断抗体。简言之,在补充有1%青霉素/链霉素和10%fbs的rpmi glutamax培养基中培养a549。用急性酶收获细胞,以5x105个/100μl接种到96孔板中,并在37℃,5%co2下孵育18-24小时。然后将孔用100μl pbs洗涤两次,随后添加100μl饥饿培养基(补充有1%青霉素/链霉素的rpmi glutamax培养基),并在37℃,5%co2下孵育18-24小时。将抗rage(m4f4;wo 2008137552);抗st2(af532;rnd系统公司)或同种型对照(mab002,r&d系统公司)以剂量依赖性方式添加至孔中,并将板放回孵育箱后维持30min。然后用氧化型il-33(30ng/ml)刺激板30min,随后按照制造商的说明书,使用磷酸-stat5 elisa试剂盒裂解缓冲液(85-86112-11,赛默飞世尔科技公司)裂解并显影,接着读取450nm下的吸光度。如图9所示,用oxil-33-01活化的细胞呈现出stat5磷酸化,该stat5磷酸化在存在抗rage抗体而非抗st2抗体的情况下会降低(图9)。
[0404]
实例3-oxil-33触发上皮细胞中egfr的内在化
[0405]
接下来研究了与egf相比,oxil-33是否诱导egfr动力学变化。
[0406]
12.egf内在化的共聚焦实验
[0407]
此实验旨在利用共聚焦成像研究用egf、il-33的还原或氧化形式刺激后上皮细胞中egfr的动力学。将egfr-gfp a549上皮细胞系(西格玛公司,cll1141-1vl)以20000个细胞/ml的浓度(rpmi培养基+10%fcs+pen/strep)铺板,每24孔玻璃底板1ml(格雷内尔公司(greiner),662892)。与绿色荧光蛋白(gfp)连接的egf受体可以追踪egfr膜动力学和内在化。用pbs洗涤细胞一次,并在rpmi培养基(无fcs)中孵育。饥饿24小时后,用rpmi洗涤细胞,并与0.5ml rpmi培养基以及cellmask(英杰公司(invitrogen)c10046)深红以1∶5000稀释度一起孵育。进行膜标记用处理之前用cellmask对细胞进行短暂染色,并在共聚焦处理时立即以1帧/min进行实时成像,以记录egfr-gfp的动力学。将细胞在37℃下染色5分钟,用pbs洗涤一次,并用200ng/ml浓度的oxil-33(氧化型il-33-01)或il-33-16以0.5ml无血清rpmi/孔刺激。立即以40x油物镜,1min/帧,5叠间隔2μm拍摄共聚焦图像,持续25分钟(添加蛋白质后约30分钟)。gfp信号的中断(虚线)图谱指示受体在膜上聚类和内在化。在实时成像的不同时间点产生膜区(被cellmask遮盖)和胞内区(被倒置的cellmask遮盖,未显示)的像素强度直方图,显示了非聚类区中egfr的消耗(直方图钟形峰左移),以及通过聚类引起的饱和像素数量增加(强度255)。oxil-33诱导egf受体的聚类和内在化,但egf刺激引起最明显的egfr聚类。相反,il-33的还原形式(il-33-16)在egfr细胞分布方面未呈现出大的变化(图10)。
[0408]
实例4-类似于egf,oxil-33诱导上皮细胞分泌il-8
[0409]
13.通过oxil-33进行的il-8的选择性分泌
[0410]
根据制造商的方案,将来自健康受试者(nhbe;龙沙公司cc-2540)和慢性阻塞性肺病(copd)(dhbe;龙沙公司00195275)的人支气管上皮细胞在完全begm培养基(龙沙公司)中维持一个月,其中每三天更换一次培养基直到细胞达到汇合。用急性酶收获细胞,并以
5x105个/100μl接种在96孔板(康宁公司3596)中的培养基中。将这些板在37℃,5%co2下孵育18-24小时。此后,吸出培养基,并将细胞用100μl pbs洗涤两次,随后添加饥饿培养基(无补充有1%青霉素/链霉素的补充试剂盒的begm(龙沙公司cc-3171))。然后将板在37℃,5%co2下再孵育18-24小时,随后用单独的培养基(未刺激的对照)、30ng/ml还原型il-33-01、30ng/ml il-33-16、30ng/ml氧化型il-33-01或30ng/ml egf刺激,并放回37℃,5%co2。刺激后24小时,收集上清液并使用多重测定(mesoscale discovery k15047d-2)评价趋化因子产生。如图11中所示,与未刺激的细胞(单独的培养基)相比,用oxil-33活化后,nhbe和dhbe的il-8分泌增加4倍。其他趋化因子(tarc、mip-1a、mip1b、mcp4、mcp1、ip10、嗜酸细胞活化趋化因子(eotaxin)、嗜酸细胞活化趋化因子-3、mdc-未显示数据)未观察到大的差异。
[0411]
实例5-oxil-33损害深层单层上皮培养物中的划痕修复反应
[0412]
14.与egf相反,oxil-33损害a549和nhbe细胞中的划痕闭合
[0413]
从atcc获得a549,并在补充有1%青霉素/链霉素和10%fbs的rpmi glutamax培养基中培养。用急性酶(paa,#l11-007)收获细胞,以5x105个/100μl接种到96孔板中,并在37℃,5%co2下孵育18-24小时。然后将孔用100μl pbs洗涤两次,随后添加100μl饥饿培养基(补充有1%青霉素/链霉素的rpmi glutamax培养基),并在37℃,5%co2下孵育18-24小时。使用woundmakertm(埃森生物科学公司(essen bioscience))划去细胞,然后将孔用200μl pbs洗涤2次,随后添加补充有0.1%fbs(v/v)和1%(v/v)青霉素/链霉素的、含有指定刺激的rpmi glutamax培养基或单独的培养基(未刺激的对照)、30ng/ml还原型il-33-01、30ng/ml氧化型il-33-01或30ng/ml egf,并放回37℃,5%co2。将板放置在incucytezoom中以在48小时内进行划痕愈合成像和分析。通过incucyte zoom软件中的划痕愈合算法计算相对划痕密度。
[0414]
从龙沙公司获得nhbe(cc-2540),并根据制造商的方案维持在完全begm培养基[begm(龙沙公司cc-3171)和补充试剂盒(龙沙公司cc-4175)]中。用急性酶收获细胞,并以5x105个/100μl接种在96孔imagelock板(赛多利斯公司(sartorius),4379)中的培养基中。将这些板在37℃,5%co2下孵育18-24小时。此后,吸出培养基,并将细胞用100μl pbs洗涤两次,随后添加饥饿培养基(无补充有1%青霉素/链霉素的补充试剂盒的begm(龙沙公司cc-3171))。然后在产生划痕前将这些板在37℃、5%co2下再孵育18-24小时。使用woundmakertm(埃森生物科学公司)划去细胞,然后将孔用200μl pbs洗涤2次,随后添加补充有0.1%fbs(v/v)和1%(v/v)青霉素/链霉素的、含有指定刺激的bebm培养基(龙沙公司)或单独的培养基(未刺激的对照)、30ng/ml还原型il-33-01、30ng/ml氧化型il-33-01或30ng/ml egf,并放回37℃,5%co2。将板放置在incucytezoom中以在48小时内进行划痕愈合成像和分析。通过incucyte zoom软件中的划痕愈合算法计算相对划痕密度。如图12所示,oxil-33抑制a549细胞(图12a)和nhbe细胞(图12b)的深层培养物中的划痕愈合,与观察到划痕细胞密度增加的egf有相反的作用。
[0415]
15.可以通过中和rage或egfr而非st2的抗体来阻止氧化型il-33对划痕闭合的损害
[0416]
为了了解oxil-33的这些功能作用是否通过rage/egfr介导,如第14节所述,但在中和不同受体组分的抗体存在下,在nhbe细胞中进行划痕测定。在10μg/ml抗st2(af532,r&d系统公司)、抗rage(m4f4,wo 2008137552)或抗egfr(克隆la1,05-101密理博)存在下,用
单独的培养基(未刺激的对照)、还原型il-33或氧化型il-33处理nhbe细胞。oxil-33,但不是还原型il-33,抑制划痕闭合。oxil-33的此作用可被抗rage和抗egfr而非抗st2逆转,再次证明rage和egfr是参与氧化型il-33信号传导路径的必需受体(图13)。
[0417]
实例6-抗il-33改进了深层培养物中copd细胞的表型
[0418]
16.oxil-33可以在划痕闭合测定中驱动健康的nhbe中的copd样反应
[0419]
接下来,研究了氧化型il-33在健康者、吸烟者和copd支气管上皮细胞中的作用。从龙沙公司获得nhbe(cc-2540)、来自吸烟者的nhbe(cc-2540)和dhbe(copd,00195275),并根据制造商的方案保持在完全begm培养基(龙沙公司)中。如在第14节中所述进行划痕测定。用单独的培养基(未刺激的对照)或30ng/ml氧化型il-33处理细胞。与来自健康受试者的细胞相比,来自吸烟者或copd的支气管上皮细胞显示的划痕闭合能力受损,这与用oxil-33处理健康细胞后观察到的损害类似(图14)。与健康细胞相比,在吸烟者和copd hbe细胞中,oxil-33不会进一步损害划痕闭合反应(图14)。
[0420]
17.通过rage/egfr路径阻断内源il-33可以改进copd基底细胞受损的划痕修复表型。
[0421]
由于已知上皮细胞会产生il-33,所以自分泌il-33分泌可能会导致在copd细胞中观察到的划痕修复表型受损。为了研究,在il-33中和存在下在来自copd的支气管上皮细胞中进行了划痕闭合测定。根据制造商的方案,将nhbe(龙沙公司cc-2540)和dhbe(龙沙公司,copd 00195275)维持在完全begm培养基(龙沙公司)中。用急性酶收获细胞,并以5x105个/100μl接种在96孔imagelock板(赛多利斯公司(sartorius),4379)中的培养基中。将这些板在37℃,5%co2下孵育18-24小时。此后,吸出培养基,并将细胞用100μl pbs洗涤两次,随后添加饥饿培养基(无补充有1%青霉素/链霉素的补充试剂盒的begm(龙沙公司cc-3171))。然后在产生划痕前将这些板在37℃、5%co2下再孵育18-24小时。使用woundmakertm(埃森生物科学公司)划去细胞,然后将孔用200μl pbs洗涤2次,随后添加含有10μg/ml抗il-33(33_640087-7b,描述于wo2016/156440中)、抗st2(af532,r&d系统公司)、抗rage(m4f4,wo2008137552)或nip228(igg1同种型对照)的补充有0.1%fbs(v/v)和1%(v/v)青霉素/链霉素的bebm培养基(龙沙公司),并放回37℃,5%co2。将板放置在incucytezoom中以在48小时内进行划痕愈合成像和分析。通过incucyte zoom软件中的划痕愈合算法计算相对划痕密度。如先前所观察到的,与来源于健康受试者的细胞相比,copd细胞的划痕闭合反应受损。抗il-33和抗rage而非抗st2能够将copd细胞的划痕闭合反应改进到与健康细胞类似的水平(图15),证明上皮细胞产生自分泌的il-33,其通过rage/egfr路径传导信号(图15)。
[0422]
实例7-抗il-33减少3d上皮培养物中的杯状细胞
[0423]
18.气道基底细胞的气液界面(ali)培养
[0424]
接下来,本发明人试图确定气液界面细胞培养物(“ali培养物”)中il-33信号传导的相关性。ali培养是基底细胞生长的一种方法,其中这些基底细胞的基底表面与培养基接触,并且顶部(顶端)细胞层暴露于空气。ali培养能够在体外产生类似于气管上皮的具有假复层上皮的粘膜纤毛表型的三维细胞结构。因此,ali培养物可以用于研究呼吸上皮的基本方面,诸如细胞间信号传导、疾病建模和呼吸再生。
[0425]
从北卡罗来纳大学(university of north carolina)和匹兹堡大学(university of pittsburgh)接收到具有来自健康对照或copd患者的冷冻肺基底细胞的冷冻小瓶。将细
胞融化并铺在涂有在1x pbs(马萨诸塞州沃尔瑟姆市吉博科公司(gibco,waltham,ma))中1∶70稀释的purecol i型牛胶原蛋白(加利福尼亚州圣地亚哥市高级生物基质公司(advanced biomatrix,san diego,ca))的t-75烧瓶上,并在epix培养基(276-201,马里兰州罗克维尔市普罗帕吉尼斯公司(propagenix,rockville,md))中生长。达到汇合后,将这些细胞分到适当数量的t-75烧瓶一次,随后收获以进行ali培养。含有12mm0.4μm聚酯膜插入物(costar,纽约州康宁公司)的ali培养用transwell通过用1∶70purecol溶液涂布插入物,并在37℃下孵育1-16小时之间来制备。去除purecol溶液,并将transwell放置在uv光下30分钟,然后用pbs洗涤。使用4ml胰蛋白酶溶液(赛默飞世尔公司,15400054)分离t-75烧瓶中的基底细胞。将细胞悬浮液添加到含有5ml fbs的50ml管中,然后在vicell计数器(加利福尼亚州布雷亚市贝克曼库尔特公司(beckman coulter,brea,ca))上计数,并以1,000rpm离心5分钟。然后将细胞以3.57x105个/ml的密度再悬浮于pneumacult ali培养基(不列颠哥伦比亚省温哥华市干细胞技术公司(stemcell tech,vancouver,bc))中,并将700μl分配到每个transwell上。将1ml ali培养基添加到插入物下方的空间中。使细胞处于ali培养基的深层,直到形成汇合和紧密连接(典型地7天),此时从顶侧去除培养基,使细胞分化2周,其中每隔一天在基底侧更换培养基一次。通过在供应至培养物基底侧的培养基中包括处理来将完全分化的培养物在无抗体下处理,用1μg/ml抗il-33(33_640087-7b)或1μg/ml nip228(igg1同种型对照)处理7天。每隔一天进行一次培养基(含有相关处理)更换。
[0426]
19.ihc三重染色(基底、杯状和纤毛)和定量
[0427]
如第18节中所述产生来自copd供体的ali培养物并处理。将ali上皮培养物在10%中性缓冲福尔马林(formalin)中固定24小时,并包埋在石蜡中。将石蜡切片(4um)封固在带正电荷的载玻片上,并通过连续的3重发色测定在ventana discovery ultra上染色。用细胞调节剂1(cc1)(目录号5424569001,罗氏公司)进行抗原修复,并用discovery抑制剂(目录号7017944001,罗氏公司)阻断内源过氧化物酶12min。在36℃下施加抗p63(克隆4a4)(目录号790-4509,瑞士巴塞尔市罗氏公司(roche,basel,switzerland))24min,并用小鼠抗hq(12min)(目录号7017782001,罗氏公司)和抗hq hrp(12min)(目录号7017936001,罗氏公司)可视化,并在teal底物(目录号8254338001,罗氏公司)中孵育12min。通过抗体变性步骤(100℃,24min),用细胞调节剂2(cc2)(目录号5424542001,罗氏公司),然后用以dako抗体稀释剂(目录号s3022)稀释的0.01μg/ml抗微管蛋白(目录号ab24610,英国剑桥市艾博抗公司)处理载玻片16min,用小鼠omnimap-hrp(目录号5269652001,罗氏公司)检测(8min),并用discovery purple底物(目录号7053983001,罗氏公司)可视化16min。将载玻片用cc2再进行抗体变性,然后施加1.1μg/ml兔抗粘蛋白5ac和7μg/ml兔抗粘蛋白5b(分别为目录号ab198294和目录号ab87376,艾博抗公司)的混合物20min,并用抗兔np(4min)(目录号7425317001,罗氏公司)、抗np-ap(8min)(目录号7425325001,罗氏公司)可视化,然后用discovery yellow(目录号7698445001,罗氏公司)可视化20min。将染色的载玻片用dawn洗涤剂冲洗,用苏木精(目录号5277965001,罗氏公司)复染,冲洗,用分级的乙醇和二甲苯系列脱水,并用永久封片剂(mounting media)封固。使用halo软件进行的定量显示,来源于用抗il-33治疗的健康供体的ali培养物中的杯状细胞减少(图16)。
[0428]
实例8-抗il-33调节来自copd的3d上皮培养物中的粘蛋白并改进粘液运动
[0429]
20.ihc双重if染色(粘蛋白5b+粘蛋白5ac)
[0430]
如第18节中所述产生来自copd供体的ali培养物并处理。将ali上皮培养物在10%中性缓冲福尔马林(formalin)中固定24小时,并包埋在石蜡中。将石蜡切片(4um)封固在带正电荷的载玻片上,并通过连续的2重免疫荧光测定在ventana discovery ultra上染色。用细胞调节剂1(cc1)进行抗原修复,用discovery抑制剂阻断内源过氧化物酶12min并用罗氏诊断公司(roche diagnostics)的s block(ruo)(目录号760-4212)阻断8min,并且在36℃下在用dako ab稀释剂s3022稀释的7μg/ml抗粘蛋白5b中孵育24min,并用抗兔hq(罗氏诊断公司目录号760-4815)检测4min且用抗hq-hrp(罗氏诊断公司目录号760-4820)检测8min。然后将样品与酪酰胺缀合物discovery fitc(罗氏诊断公司目录号760-232)一起孵育8min。在discovery ultra程序中选择了双重序列,并通过抗体变性步骤(100℃ 24min)用细胞调节剂2(cc2)处理样品,然后用discovery抑制剂(40c,24min)中和,随后在36℃下施加抗粘蛋白5ac,1.1μg/ml,20min。用抗兔-hq(罗氏诊断公司目录号760-4815)4min和抗hq-hrp(罗氏诊断公司目录号760-4820)8min检测粘蛋白5ac,并用酪酰胺缀合物discovery red610可视化8min。完成此步骤后,将染色的载玻片从discovery ultra自动染色机取出,并用dawn洗涤剂冲洗,然后用去离子水冲洗。将样品在1μg/ml在去离子水中稀释的4
′
,6-二脒基-2-苯基吲哚二盐酸盐(dapi核酸染料)(赛默飞世尔公司目录号d1306)中孵育2min。用去离子水冲洗样品,并在prolong gold antifade封片剂(赛默飞世尔公司,目录号p36930)存在下置放盖玻片,并储存在不透光的载玻片盒中。用zeiss lsm 880共聚焦显微镜(纽约州白原市卡尔蔡司显微镜有限责任公司(carl zeiss microscopy,llc,white plains,ny))对染色的载玻片成像。图17显示ali培养物的抗il-33处理可能引起copd培养物中不同粘蛋白的下调
[0431]
21.抗il-33逆转了copd ali培养物中观察到的受损的粘膜纤毛清除
[0432]
如第18节中所述产生来自copd供体的ali培养物并处理。然后将30μl在pbs中1∶33稀释的0.2μm fluospheres(赛默飞世尔公司,f8811)添加到顶端表面,并使用蔡司lsm800显微镜捕获fluosphere运动的短片,并且显示用抗il-33(33_640087-7b)而非对照抗体处理后粘膜纤毛运动增加。
[0433]
实例9-ali培养物的单细胞rna分析显示用抗il-33处理后杯状细胞变化
[0434]
如第18节中所述产生来自copd供体的ali培养物并处理。为了获得单细胞悬浮液,将过滤器插入物与0.25%胰蛋白酶在37℃下孵育5min。通过用pbs上下吸取洗涤来轻轻地从过滤器分离上皮细胞,然后转移到15ml falcon管中。将细胞在4℃下以1000rpm离心5min。去除上清液后,将细胞再悬浮于含0.4%bsa的pbs中,并将细胞浓度调节至1000个细胞/μl以进行测序。根据标准方案,将细胞悬浮液加载到chromium单细胞3
′
试剂盒中,以捕获5000至10.000个细胞/个通道。使用版本2化学法。遵循制造商的方案(chromium
tm
单细胞3
′
试剂盒,v2化学法)获得用于依诺米那测序(illumina sequencing)的单细胞3
′
文库。评定文库的质量(tapestation 4200,安捷伦公司(agilent)),然后在nextseq 500或novaseq 6000仪器(依诺米那公司(illumina))上测序。使用cell ranger 2.0版过程(10x genomics)进行初始数据处理。使用seurat包进行后处理,以排除低细胞质量和标准化。每个样品均作为独立数据进行分析,以捕获样品内异质性(细胞亚型)。使用t分布随机近邻嵌入(t-distributed stochastic neighbor embedding;tsne)实现聚类和可视化。copd中细胞类群的鉴定由标记基因指导。对于其他样品,手动检查初始类群,然后将seurat的标记转
移算法(label transfer algorithm)施加于亚型鉴定。对来自进行和未进行如第18节中所提及的抗il-33处理的copd ali培养物的细胞之间的每个类群进行muc5ac和muc5b基因表达分析。使用seurat产生热图和tsne图。图18显示了tsne图,这些tsne图说明了与未处理相比,用抗il-33(33_640087-7b)处理的ali培养物中发现的细胞亚型的不同比例。如图18所示,抗il-33处理后注意到muc5b高细胞减少。
[0435]
实例10-抗il-33减少了copd 3d上皮培养物中的杯状细胞
[0436]
22.气道基底细胞的气液界面(ali)培养
[0437]
为了定量和询问oxil-33在生理学相关的气液界面(ali)培养系统中的作用,开发了流式细胞术测定,该测定旨在区分杯状细胞类型(muc5ac相对于muc5b)与其余上皮群体(粘蛋白阴性)。
[0438]
从龙沙公司接收到具有来自健康(cc-2540)对照或copd(195275)患者的冷冻肺基底细胞的冷冻小瓶。将每个供体一个小瓶融化并铺在4个t-175烧瓶中的epix培养基(276-201,马里兰州罗克维尔市普罗帕吉尼斯公司)中。达到汇合后,将这些细胞在p2下以每个小瓶1e6个细胞冷冻。将p2下的细胞新加入2个t-75烧瓶中的epix培养基中,并生长直至80%汇合。含有12mm或6.5mm 0.4μm聚酯膜插入物(costar,纽约州康宁公司)的ali培养用transwell通过用1x胶原蛋白i溶液(celladhere
tm
胶原蛋白i-干细胞#07001,在dh2o中制备)涂布插入物,并在37℃下孵育1-16小时之间来制备。去除胶原蛋白i溶液,并用pbs洗涤transwell。用pbs洗涤t-75烧瓶中的基底细胞,并使用6ml胰蛋白酶溶液(龙沙公司胰蛋白酶继代培养包-#cc-5034)分离。用6ml胰蛋白酶中和溶液(龙沙公司胰蛋白酶继代培养包-#cc-5034)中和胰蛋白酶,并将细胞悬浮液添加到15ml管中,计数并以1200rpm离心5分钟。然后将细胞以8x105个/ml的密度再悬浮于pneumacult ali培养基(不列颠哥伦比亚省温哥华市干细胞技术公司)中,并将0.5ml分配到每个12mm transwell上,并且将0.25ml分配到每个6.5mm transwell上。将1ml ali培养基添加到12ml插入物下方的空间中,并且将0.5ml ali培养基添加到6.5mm插入物下方的空间中。使细胞处于ali培养基的深层,直到形成汇合和紧密连接(典型地7天),此时从顶侧去除培养基,使细胞分化3周,其中每个周一、周三和周五在基底侧更换培养基一次。对完全分化的正常培养物不处理,或通过在供应至培养物基底侧的培养基中包括处理(7天处理)来用还原型或氧化型未标签化的il33-01(30ng/ml)、未标签化的il33-16(30ng/ml)、il-13(10ng/ml)、egf(30ng/ml)或hmgb1(30ng/ml)处理7天。对完全分化的copd培养物不处理,或通过在供应至培养物基底侧的培养基中包括处理来用1μg/ml抗il-33(33_640087-7b)、1μg/ml nip228(igg1同种型对照)、10μg/ml mnip228、10μg/ml抗st2、1μg/ml抗rage或1μg/ml抗egfr处理7天。每个周一、周三和周五进行一次培养基更换(含有相关处理)。
[0439]
表6
[0440]
[0441][0442]
23.ali培养物中杯状细胞的facs分析
[0443]
处理7天后(表6),通过流式细胞术分析了6.5mm插入物上4周龄的正常对照或copd ali培养物。将200μl 37℃ pbs添加到每个transwell的顶端区(transwell表面),并放置在孵育箱中30min。将顶端洗液储存在-80℃下以进行粘蛋白分析。将150μl胰蛋白酶(龙沙公司胰蛋白酶继代培养包-#cc-5034)添加到顶端和基底外侧(在transwell下方)隔室中。将transwell放回孵育箱后维持30min。通过轻轻地上下吸取胰蛋白酶来分离ali。将150μl胰蛋白酶中和溶液(龙沙公司胰蛋白酶继代培养包-#cc-5034)添加到每个顶腔并混合。将细胞悬浮液移至u形90孔板,计数细胞并在4℃下以1200rpm离心5min。去除胰蛋白酶/tns,并向每个孔中添加200μl活死染料(ebioscience
tm
可固定活力染料efluor
tm
780赛默公司65-0865-14,在pbs中1∶2000稀释)。将细胞再悬浮并在黑暗中在冰上孵育10min。将该板在4℃下以1200rpm离心5min,去除活死染料,并向每个孔中添加200μl pbs。将板在4℃下以1200rpm离心5min,去除pbs,并用200μl固定/渗透溶液(赛默公司00-5123和00-5223)替换。将板在黑暗中在冰上孵育40min。将板在4℃下以1200rpm离心5min,并去除溶液。将细胞再悬浮于300μl 1x渗透溶液(赛默公司00-8333)中。将来自每个孔的5e4个细胞添加到在4℃下以1200rpm离心5min的新96孔u底板中,并将细胞再悬浮于50μl 1x渗透溶液中。50μl抗体染色混合物(1∶400的抗muc5ac和1∶800的抗muc5b)或相同稀释度的同种型染色混合物。将板在黑暗中在冰上孵育30min。将板在4℃下以1200rpm离心5min,并去除溶液。用pbs洗涤细胞,离心,然后再悬浮于150μl pbs中。然后在bd facsymphony
tm
上采集数据,并使用flowjo软件分析。
[0444]
表7
[0445][0446]
24.ali培养物的qpcr/批量rna测序分析。
[0447]
处理7天后(表6),使6.5mm插入物上4周龄的正常对照或copd ali培养物裂解以进行rna分析。首先将200μl 37℃ pbs添加到每个ali顶端表面,并将板放回孵育箱后维持30min。将顶端洗液储存在-80℃下以进行粘蛋白分析。使用magmax
tm-96总rna分离试剂盒(赛默公司,am1830)来裂解ali培养物并提取rna。然后使用high-capacity rna-to-cdna
tm
试剂盒(赛默公司,4388950)使用rna合成cdna。从而将9μl的每种rna样品与10μl的2x rt缓
冲剂混合物和1μl的20x rt酶混合物在pcr管(赛默公司,am12230)中孵育,置于赛默循环仪(thermo cycler)上,并且在37℃下孵育60分钟。通过加热至95℃后维持5分钟并保持在4℃下来终止反应。向含有20μl cdna的每个管添加60μl无核酸酶的水(赛默公司,750024)。为进行rt-qpcr,将4μl cdna与5μl taqman快速高级预混液(赛默公司,4444557)、0.5μl muc5ac fam探针(赛默公司,hs01365616_m1)和0.5μl gapdh vic探针(赛默公司,hs02786624_g1)一起添加到带有条形码的microamp
tm enduraplate
tm
光学384孔透明反应板(赛默公司,4483273)中。将板密封并短暂离心,随后使用quantstudio
tm 7 flex实时pcr系统(赛默公司)进行分析。然后通过根据未处理的正常对照将数据归一化来计算δ-δ-ct。
[0448]
oxil-33而非还原型il-33使杯状细胞数量增加,特别是muc5ac+杯状细胞亚群(图19a至19c)。相应地,如通过qpcr所判断,用oxil-33处理后,muc5ac mrna的拷贝增加(图19d)。
[0449]
25.ihc三重染色(基底、杯状和纤毛)和定量
[0450]
接下来,评价了来自ali免疫组织化学的定量图像分析。如第22节:气道基底细胞的气液界面(ali)培养中所述产生来自copd供体的ali培养物并处理。将ali上皮培养物在10%中性缓冲福尔马林(formalin)中固定24小时,并包埋在石蜡中。将石蜡切片(4um)封固在带正电荷的载玻片上,并通过连续的3重发色测定在ventana discovery ultra上染色。用细胞调节剂1(ultra cc1)(目录号5424569001,罗氏公司)进行抗原修复,并用discovery抑制剂(目录号7017944001,罗氏公司)阻断内源过氧化物酶12min。施加抗p63(克隆4a4)(目录号790-4509,瑞士巴塞尔市罗氏公司)24min,并用抗小鼠hq(12min)(目录号7017782001,罗氏公司)和抗hq hrp(12min)(目录号7017936001,罗氏公司)可视化,并与discovery purple试剂盒(目录号07053983001,罗氏公司)一起孵育12min。通过抗体变性步骤(92℃,24min),用细胞调节剂2(ultra cc2)(目录号5424542001,罗氏公司),然后用以dako抗体稀释剂(目录号s3022)稀释的抗微管蛋白(目录号ab24610,英国剑桥市艾博抗公司)(载玻片上的浓度为0.003μg/ml)处理载玻片16min,用小鼠omnimap-hrp(目录号5269652001,罗氏公司)检测(8min),并用discovery teal hrp试剂盒(目录号82544338001,罗氏公司)可视化。将载玻片用cc2再进行抗体变性,然后施加1.1μg/ml(分配器浓度)兔抗粘蛋白5ac和7μg/ml(分配器浓度)兔抗粘蛋白5b(分别为目录号ab198294和目录号ab87376,艾博抗公司)的混合物20min,并用抗兔np(4min)(目录号7425317001,罗氏公司)、抗np-ap(8min)(目录号7425325001,罗氏公司)可视化,然后用discovery yellow试剂盒(目录号7698445001,罗氏公司)可视化20min。将染色的载玻片用苏木精ii(8min)(目录号5277965001,罗氏公司)和蓝化试剂(4min)(目录号5266769001,罗氏公司)复染色,用洗碗洗涤剂冲洗,用分级的乙醇和二甲苯系列脱水,并用永久封片剂封固。
[0451]
在halo v3.1(indica labs)中对ihc图像进行分析,其中首先对这些图像进行手动注释,以排除焦点和组织损伤区。习得了一种随机森林分类器,以识别上皮并将其与跨膜和载玻片背景分离。为进行纤毛区域定量,习得了另一种随机森林分类器,以粗略检测微管蛋白染色,随后使用算法区域定量(area quantificatio)v2.1.7进行精细检测。为进行粘蛋白区域定量,直接使用区域定量v2.1.7来检测染色。为进行基底(p63+)细胞计数,使用算法cytonuclear 2.0.9基于核染色对细胞进行分段,通过计数p63阳性核进一步检测基底细
胞。所有定量方法均经过人识别验证,并且准确性超过90%。
[0452]
与先前的发现一致,oxil-33深刻影响杯状细胞(muc5ac+b)的数量(图20a和20b)。
[0453]
总之,这些研究显示oxil-33在促进肺上皮内杯状细胞分化方面发挥了作用。此表明长期暴露于ox-il33的上皮向杯状增生表型发展,这对肺功能产生负面影响。
[0454]
26.用阻断剂逆转copd杯状表型
[0455]
copd的一个重要标志是由于杯状细胞和粘液分泌的增加而引起的粘液过量(gohy等人,2019 sci rep[科学通讯]9:17963)。为了研究氧化型il-33是否可以在杯状copd表型中发挥直接作用,建立了来自copd供体的ali培养物,其中读数如第22-25节中所述。
[0456]
在抗il-33(33-640087_7b)、抗rage或抗egfr中和抗体存在下培养copd ali。所有三种处理均使muc5ac+杯状细胞数量减少(图21a至21d)。没有处理影响ali培养物的活力(图21e),这证实了该处理现象不是假象或抗体毒性的结果。与先前的结果一致,抗st2处理未引起杯状细胞数量减少,进一步证明此是由il-33,主要是ox-il-33,通过oxil-33-rage-egfr路径直接介导的疾病表型。在免疫组织化学分析中进一步证实了抗il-33抗体(33-640087_7b)对copd ali的作用,其中在成对分析中,阻断il-33使杯状细胞数量减少(图22a和22b)。用抗il-33抗体(33-640087_7b)处理后,copd ali培养物的上皮类似于健康上皮,如图20a所示。
[0457]
最后,使用elisa测量了来自健康和copd ali培养物的顶端粘液中释放的muc5ac和muc5b。为了定量从ali培养物中释放的粘蛋白,根据制造商的方案,通过免疫测定(诺伟司(novus)nbp2-76703)分析了顶端上清液中muc5ac的水平。将样品在样品稀释剂中1∶2000稀释,并从重组muc5ac蛋白标准曲线外推出浓度。如图23所示,与来自健康供体的ali相比,来自copd患者的ali培养物释放的muc5ac水平增加(图23a)。用外源oxil-33处理使得健康ali培养物的粘蛋白分泌增加(图23b)。在copd ali供体中,粘蛋白水平的增加通过用抗il-33(33_640087_7b)阻断而减少,该抗il-33抑制从ali培养物释放的muc5ac蛋白水平,但抗st2或同种型mab对照不抑制(图23c)。
[0458]
总体而言,本实例突出了氧化型il-33在肺中上皮细胞分化失调中的作用。结果表明,在不受控制的情况下,氧化型il-33可能是一些copd表型中所见的杯状细胞增生和粘液产生过多的原因。因此,用oxil-33信号传导轴拮抗剂,诸如抗il-33、抗rage或抗egfr结合分子治疗,可能通过恢复正常的上皮生理学,例如通过减少杯状细胞数量和减少粘液产生过多,而对copd患者可能具有巨大的治疗益处。
[0459]
其他序列
[0460]
除了表1中列出的序列,我们还提供以下其他cdr序列:
[0461]
seq id no 37:syams
[0462]
seq id no 38:gisaidqstyyadsvkg
[0463]
seq id no 39:qkfmqlwggglrypfgy
[0464]
seq id no 40:sgegmgdkyaa
[0465]
seq id no 41:rdtkrps
[0466]
seq id no 42:gviqdntgv
[0467]
n末端his10/avitag/因子xa蛋白酶切割位点
[0468]
seq id no 43:mhhhhhhhhhhaaglndifeaqkiewheaaiegr
[0469]
il-33-01
[0470]
seq id no 44:
[0471][0472]
seq id no 45:
[0473][0474]
avitag序列基序
[0475]
seq id no 46:glndifeaqkiewhe
[0476]
靶向rage外显子3的grna载体
[0477]
seq id no 47:tgaggggattttccggtgc
[0478]
rage正向引物
[0479]
seq id no 48:gttgcagcctcccaacttc
[0480]
rage反向引物
[0481]
seq id no 49:aatgaggccagtggaagtca
[0482]
人st2s(信号肽加有下划线)
[0483]
seq id no 50:
[0484][0485]
人st2s-huigg1 fc-his6(信号肽加有下划线)
[0486]
seq id no 51:
[0487][0488]
seq id no 52:
[0489]
his10/avitag人asgpr ecd(信号肽加有下划线,并且标签加有双下划线)
[0490]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1