用于T细胞受体鉴定的组合物和方法与流程
用于t细胞受体鉴定的组合物和方法
1.交叉引用
2.本技术要求提交于2019年11月19日的美国临时专利申请号62/937,595的权益,所述申请以引用的方式整体并入本文。
背景技术:
3.t细胞受体(tcr)负责识别抗原-主要组织相容性复合物,从而导致炎症反应的启动。存在许多t细胞亚型,包括细胞毒性t细胞和辅助t细胞。细胞毒性t细胞(也称为cd8+t细胞)杀伤异常细胞,例如病毒感染的细胞或肿瘤细胞。辅助t细胞(也称为cd4+t细胞)有助于其他免疫细胞的激活和成熟。细胞毒性t细胞和辅助t细胞两者均在识别特异性靶抗原后执行它们的功能,从而触发它们各自的反应。t细胞的抗原特异性可由t细胞表面上表达的tcr来定义。t细胞受体是由两条多肽链构成的异源二聚体蛋白,最常见的是α链和β链,但少数t细胞可以表达γ和δ链。tcr的特定氨基酸序列和所得三维结构定义了tcr抗原特异性和亲和力。任何个别t细胞的tcr链的氨基酸和编码dna序列在生物体的整个tcr库中几乎总是独特的或丰度非常低,因为存在大量可能的tcr序列。这种巨大的序列多样性在t细胞发育过程中通过多种细胞机制实现,并且可能是免疫系统对很多种潜在抗原作出反应的能力的关键方面。
4.分析tcr库可能有助于更好地理解免疫系统特征以及疾病的病因和进展,特别是那些具有未知抗原性触发物的疾病。
技术实现要素:
5.本文认识到需要开发以高通量方式从测序数据中鉴定tcr克隆的方法。
6.在一个方面,本公开提供了一种用于鉴定t细胞受体(tcr)的方法,所述方法包括:(a)提供表达多个tcr的多个t细胞,其中所述多个t细胞中的每个t细胞表达所述多个tcr中的tcr的一个同源对;(b)将编码每个t细胞的所述tcr的所述同源对的第一tcr链的第一多核苷酸和编码第二tcr链的第二多核苷酸配对,从而生成多个多核苷酸对;(c)将包含所述多个多核苷酸对的多核苷酸递送到多个受体细胞中,其中每个受体细胞包含包括所述多个多核苷酸对中的至少一个多核苷酸对的多核苷酸;(d)在所述多个受体细胞中表达所述多个多核苷酸对;(e)对所述多个受体细胞的tcr库进行测序并确定所述tcr库的tcr在所述多个受体细胞中的频率;(f)使所述多个受体细胞与一种或多种抗原接触,从而激活所述多个受体细胞的亚型中的标志物;(g)基于所述标志物分离所述多个受体细胞的所述亚型;(h)对所述多个受体细胞的所述亚型的tcr库进行测序并确定所述tcr库的tcr在所述多个受体细胞的所述亚型中的频率;和(i)鉴定在所述多个受体细胞的所述亚型中的频率高于其在所述多个受体细胞中的频率的tcr。
7.在一些实施方案中,所述tcr在所述多个受体细胞的所述亚型中的频率是其在所述多个受体细胞中的频率的至少1.5倍、1.8倍、2.0倍、2.5倍、3.0倍、4.0倍、4.5倍、5.0倍、5.5倍、6.0倍、6.5倍、7.0倍、7.5倍、8.0倍、8.5倍、9.0倍、9.5倍、10倍、15倍、20倍、30倍、40
倍、50倍、60倍、70倍、80倍、90倍、100倍或更多。在一些实施方案中,所述标志物是t细胞激活标志物。在一些实施方案中,所述标志物是报告蛋白。在一些实施方案中,所述报告蛋白是荧光蛋白。在一些实施方案中,所述标志物是细胞表面蛋白、细胞内蛋白或分泌蛋白。在一些实施方案中,所述标志物是所述细胞内蛋白或所述分泌蛋白,并且其中所述方法还包括在分离之前固定和/或透化所述多个受体细胞。在一些实施方案中,所述方法还包括使所述多个受体细胞与高尔基体阻滞剂接触。在一些实施方案中,所述分泌蛋白是细胞因子。在一些实施方案中,所述细胞因子是ifn-γ、tnf-α、il-17a、il-2、il-3、il-4、gm-csf、il-10、il-13、颗粒酶b、穿孔素或其组合。在一些实施方案中,所述细胞表面蛋白是cd39、cd69、cd103、cd25、pd-1、tim-3、ox-40、4-1bb、cd137、cd3、cd28、cd4、cd8、cd45ra、cd45ro、gitr、foxp3或其组合。在一些实施方案中,所述一种或多种抗原呈现在一种或多种抗原呈递细胞(apc)、mhc四聚物、纳米颗粒或其任何组合上。在一些实施方案中,所述一种或多种apc是或衍生自一种或多种分离自受试者的细胞。在一些实施方案中,所述一种或多种apc是一种或多种人工apc(aapc)。在一些实施方案中,所述一种或多种apc表达对于所述一种或多种apc为外源的mhc分子。在一些实施方案中,所述一种或多种apc是一种或多种癌细胞、肿瘤球、类肿瘤或其衍生物。在一些实施方案中,所述一种或多种apc包含编码抗原的dna或rna。在一些实施方案中,所述rna是mrna载体。在一些实施方案中,所述mrna载体是自扩增mrna。在一些实施方案中,所述一种或多种apc用所述一种或多种抗原脉冲。在一些实施方案中,所述一种或多种抗原衍生自一种或多种肿瘤抗原。在一些实施方案中,所述一种或多种肿瘤抗原是一种或多种肿瘤相关抗原(taa)或肿瘤特异性抗原(tsa)。在一些实施方案中,所述一种或多种抗原包括ny-eso-1、wt-1、ssx、mage-a3、prame、生存素、gp100、melan-a/mart-1、酪氨酸酶、psa、cea、乳腺珠蛋白、p53、her2/neu、htert、蛋白酶3、粘蛋白1或mage-a4。在一些实施方案中,所述一种或多种抗原包括遗传异常或表观遗传异常。在一些实施方案中,所述遗传异常包括点突变、融合、缺失、插入、移码、内含子包含(intron inclusion)或选择性剪接。在一些实施方案中,与健康细胞相比,癌细胞中的所述一种或多种抗原被上调(例如,所述抗原的表达水平被上调)。在一些实施方案中,所述方法还包括从所述多个受体细胞的所述tcr库或所述多个受体细胞的所述亚型的所述tcr库中选择在(i)中鉴定的所述tcr。在一些实施方案中,选择在(i)中鉴定的所述tcr包括扩增所述tcr。在一些实施方案中,(c)中的所述多核苷酸包含条形码。
8.在另一个方面,本公开提供了一种用于鉴定t细胞受体(tcr)的方法,所述方法包括:(a)提供表达多个tcr的多个t细胞,其中所述多个t细胞中的每个t细胞表达所述多个tcr中的tcr的一个同源对;(b)将编码每个t细胞的所述tcr的所述同源对的第一tcr链的第一多核苷酸和编码第二tcr链的第二多核苷酸配对,从而生成多个多核苷酸对;(c)将包含所述多个多核苷酸对的多核苷酸递送到第一多个受体细胞和第二多个受体细胞中,其中所述第一或所述第二多个受体细胞中的每个受体细胞包含包括所述多个多核苷酸对中的至少一个多核苷酸对的多核苷酸;(d)在所述第一和第二多个受体细胞中表达所述多个多核苷酸对;(e)使所述第一多个受体细胞与第一抗原接触,从而激活所述第一多个受体细胞的第一亚型的第一标志物,并且使所述第二多个受体细胞与第二抗原接触,从而激活所述第二多个受体细胞的第二亚型的第二标志物;(f)基于所述第一标志物分离所述第一亚型并且基于所述第二标志物分离所述第二亚型;(g)对所述第一多个受体细胞的所述第一亚型
的tcr库和所述第二多个受体细胞的所述第二亚型的tcr库进行测序,并确定所述tcr库的tcr在所述第一多个受体细胞的所述第一亚型中的频率和所述tcr库的tcr在所述第二多个受体细胞的所述第二亚型中的频率;和(h)鉴定在所述第一多个受体细胞的所述第一亚型中的频率高于其在所述第二多个受体细胞的所述第二亚型中的频率的tcr。
9.在一些实施方案中,所述tcr在所述第一多个受体细胞的所述第一亚型中的频率是其在所述第二多个受体细胞的所述第二亚型中的频率的至少1.5倍、1.8倍、2.0倍、2.5倍、3.0倍、4.0倍、4.5倍、5.0倍、5.5倍、6.0倍、6.5倍、7.0倍、7.5倍、8.0倍、8.5倍、9.0倍、9.5倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍或更多。在一些实施方案中,所述第一标志物和所述第二标志物相同。在一些实施方案中,所述第一标志物和所述第二标志物不同。在一些实施方案中,所述第二抗原和所述第一抗原不同源。在一些实施方案中,所述第一抗原和所述第二抗原衍生自相同的蛋白质。在一些实施方案中,所述第一抗原包含突变序列并且所述第二抗原包含野生型序列。在一些实施方案中,所述第一抗原衍生自癌细胞并且所述第二抗原衍生自健康细胞。在一些实施方案中,所述方法还包括,在接触之前,对所述多个受体细胞的tcr库进行测序,并确定所述tcr库的tcr在所述多个受体细胞中的频率。在一些实施方案中,所述方法还包括从所述第一多个受体细胞的tcr库或所述第一多个受体细胞的所述第一亚型的tcr库中选择在(h)中鉴定的所述tcr。在一些实施方案中,选择在(h)中鉴定的所述tcr包括扩增所述tcr。在一些实施方案中,(c)中的所述多核苷酸包含条形码。
10.在一些实施方案中,所述多个t细胞分离自受试者。在一些实施方案中,所述多个t细胞是肿瘤浸润性淋巴细胞。
11.在另一个方面,本公开提供了一种用于鉴定t细胞受体(tcr)的方法,所述方法包括:(a)提供表达多个tcr的多个细胞,所述多个细胞中的每个细胞表达所述多个tcr中的tcr,其中所述多个tcr包含至少5个不同的同源对并且包含来自多个v基因的v区,并且其中所述多个tcr对于所述多个细胞是外源的;(b)对所述多个细胞的tcr库进行测序,并确定所述tcr库的tcr在所述多个细胞中的频率;(c)使所述多个细胞与一种或多种抗原接触,从而激活所述多个细胞的亚型的标志物;(d)基于所述标志物分离所述多个细胞的所述亚型;(e)对所述多个细胞的所述亚型的tcr库进行测序,并确定所述tcr库的tcr在所述多个细胞的所述亚型中的频率;和(f)鉴定在所述多个细胞的所述亚型中的频率高于其在所述多个细胞中的频率的tcr。在一些实施方案中,所述方法还包括从所述多个细胞的所述tcr库或所述多个细胞的所述亚型的所述tcr库中选择在(f)中鉴定的所述tcr。在一些实施方案中,选择在(f)中鉴定的所述tcr包括扩增所述tcr。在一些实施方案中,编码(a)中的所述多个tcr中的tcr的序列包含条形码。
12.在另一个方面,本公开提供了一种用于鉴定t细胞受体(tcr)的方法,所述方法包括:(a)提供表达多个tcr的第一多个细胞和表达所述多个tcr的第二多个细胞,所述第一或所述第二多个细胞中的每个细胞都表达所述多个tcr中的tcr,其中所述多个tcr包含至少5个不同的同源对并且包含来自多个v基因的v区,并且其中所述多个tcr对于所述第一或所述第二多个细胞是外源的;(b)使所述第一多个细胞与第一抗原接触,从而激活所述第一多个细胞的第一亚型的第一标志物,并且使所述第二多个细胞与第二抗原接触,从而激活所述第二多个细胞的第二亚型的第二标志物;(c)基于所述第一标志物分离所述第一亚型并
且基于所述第二标志物分离所述第二亚型;(d)对所述第一多个细胞的所述第一亚型的tcr库和所述第二多个细胞的所述第二亚型的tcr库进行测序,并确定所述tcr库的tcr在所述第一多个细胞的所述第一亚型中的频率和所述tcr库的tcr在所述第二多个细胞的所述第二亚型中的频率;和(e)鉴定在所述第一多个细胞的所述第一亚型中的频率高于其在所述第二多个细胞的所述第二亚型中的频率的tcr。在一些实施方案中,所述方法还包括从所述第一多个细胞的tcr库或所述第一多个细胞的所述第一亚型的所述tcr库中选择在(e)中鉴定的所述tcr。在一些实施方案中,选择在(e)中鉴定的所述tcr包括扩增所述tcr。在一些实施方案中,编码(a)中的所述多个tcr中的tcr的序列包含条形码。
13.在一些实施方案中,所述频率通过tcr的测序读数除以所述tcr库的总测序读数来确定。在一些实施方案中,所鉴定的tcr是靶反应性tcr。
14.在另一个方面,本公开提供了一种药物组合物,所述药物组合物包含通过本文所述方法中的任一种鉴定的tcr或表达tcr的细胞。
15.以引用的方式并入
16.在本说明书中提及的所有公布、专利和专利申请均以引用的方式并入本文,其程度就如同每个单独的公布、专利或专利申请被具体和单独地指出以引用的方式并入一般。如果以引用的方式并入的出版物和专利或专利申请与说明书中包含的公开内容相矛盾,则说明书旨在取代和/或优先于任何这样的矛盾材料。
附图说明
17.本发明的新颖特征在所附权利要求中具体阐述。通过参考对其中利用本发明的原理的例示性实施方案作出阐述的以下详细描述以及附图(在本文中还称为“图(figure、fig.和figure)”)获得对本发明的特征和优点的更好理解,在附图中:
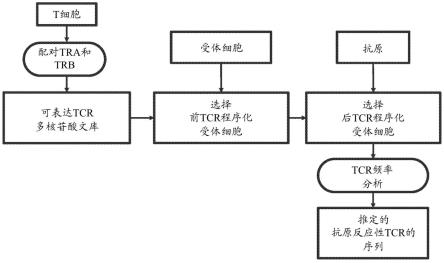
18.图1示出了本文所述的t细胞受体鉴定的示例工作流程。
19.图2示出了通过比较tcr在选择前池和选择后池中的频率来鉴定t细胞受体的示例工作流程。
20.图3示出了通过比较tcr在第一选择后池和第二选择后池中的频率来鉴定t细胞受体的示例工作流程。
21.图4示出了使用本文所述的方法鉴定t细胞受体的实验数据。数据显示了每个tcr在实际选择后多克隆tcr-t细胞(y轴)和选择前多克隆tcr-t细胞(x轴)中的频率。
22.图5示出了使用本文所述的方法鉴定t细胞受体的实验数据。数据显示了每个tcr在模拟选择后多克隆tcr-t细胞(y轴)和选择前多克隆tcr-t细胞(x轴)中的频率。
23.图6示出了使用本文所述的方法鉴定t细胞受体的实验数据。数据显示了tcr在“实际”共培养(y轴)和“模拟”共培养(x轴)中的富集因子。点的大小显示了tcr在选择前多克隆tcr-t细胞中的频率。
具体实施方式
24.在本公开中,除非另外特别说明,否则单数的使用包括复数。同样地,除非另外说明,否则“或”的使用意指“和/或”。类似地,“包含(comprise)”、“包含(comprises)”、“包含(comprising)”、“包括(include)”、“包括(includes)”和“包括(including)”并不旨在进行
限制。
25.术语“约”或“近似”意指由本领域普通技术人员测定的具体值处于可接受的误差范围内,这将部分取决于所述值的测量或测定方式,即,测量系统的限制性。例如,根据本领域的实践,“约”可意指在1个或多于1个标准偏差内。或者,“约”可意指给定值的至多20%、至多10%、至多5%或至多1%的范围。或者,特别是关于生物系统或过程,所述术语可意指在值的一个数量级以内,例如在5倍以内,并且更优选地在2倍以内。当特定值在申请和权利要求书中描述时,除非另外说明,否则应假定术语“约”意指在特定值的可接受误差范围内。
26.术语“免疫受体”是指免疫细胞产生以识别其靶标的受体蛋白或受体蛋白复合物。靶标可以是抗原或其一部分(例如,表位)。抗原可以是蛋白质或肽。靶标可以是mhc结合肽。免疫受体的实例包括b细胞受体(bcr)、抗体(可与“免疫球蛋白”互换使用)和t细胞受体(tcr)。
27.术语“免疫受体链”是指用作免疫受体的亚基的多肽。免疫受体链的实例包括免疫球蛋白(ig)的重链、免疫球蛋白的轻链、tcr的α链、tcr的β链、tcr的γ链、tcr的δ链。
28.术语“二分体免疫受体”是指由两个基因编码的多肽形成的免疫受体。在细胞中,这两个基因可能位于染色体的不同基因座或位于不同的染色体。这两个基因可以是重排基因,诸如v(d)j-重排基因。v(d)j重排基因可以通过称为v(d)j重组的机制生成,所述机制发生在初级淋巴器官中,并以几乎随机的方式重排可变(v)、连接(j)以及在一些情况下的多样性(d)基因区段。二分体免疫受体的实例包括但不限于bcr(由重排的重链基因和重排的轻链基因编码)、抗体(由重排的重链基因和重排的轻链基因编码)和tcr(由重排的tra基因编码和重排的trb基因编码,或由重排的trg基因和重排的trd基因编码)。
29.术语“源tcr表达细胞”是指其tcr可以被克隆到载体中进行表达的tcr表达细胞(例如,t细胞)。
30.术语“受体细胞”是指可以在功能上引入免疫受体表达载体(例如,tcr表达载体)的细胞。短语“功能性引入”意指免疫受体表达载体中编码的免疫受体可以在受体细胞中表达。受体细胞的实例包括但不限于cd45+细胞、t细胞、b细胞、巨噬细胞、自然杀伤(nk)细胞、干细胞、细菌细胞、酵母细胞和细胞系。
31.术语“富集”、“分离”、“分开”、“分选”、“纯化”、“选择”或它们的等同物可以互换使用,并且是指从样品中获得具有给定特性的子样品。例如,富集可以包括获得含有至少约2%、5%、10%、20%、30%、40%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%的所需细胞谱系或具有某种细胞表型的所需细胞(例如,表达所述细胞表型特有的某种细胞标志物基因或不表达所述细胞表型特有的某种细胞标志物基因)的细胞群体或细胞样品。
32.如本文所用,术语“tcr库”是指tcr的集合或文库。在一些情况下,样品或多个细胞的tcr库包含所述样品内的或由所述多个细胞表达的所有或基本上所有tcr。在一些情况下,样品或多个细胞的tcr库可以包含所述样品内的或由所述多个细胞表达的至少约80%、85%、90%、95%或100%的tcr。在一些情况下,样品或多个细胞的tcr库可以包含所述样品内的或由所述多个细胞表达的至少约80%、85%、90%、95%或100%的独特tcr。在各个方面,分析tcr库可以包括对编码tcr库的tcr的序列进行测序。
33.概述
34.源tcr表达细胞的多克隆群体可以转化为tcr程序化受体细胞的多克隆群体,其中tcr程序化受体细胞的工程化tcr库可以包含源tcr表达细胞的天然tcr库(例如,tcr链的同源对组合)。tcr的二分性质使常规技术难以完成这项任务。本文提供的方法可用于克服这些困难。与使用源tcr表达细胞相比,使用tcr程序化受体细胞可能有几个优点。例如,tcr程序化受体细胞可以大量制备,可以具有更理想的功能特征,可以处于更理想的表观遗传状态,可以具有更一致的遗传或表型背景,可以被工程化以表达其他剂来增强抗原依赖性刺激,或者可以被工程化以表达报告基因来帮助选择。tcr程序化受体细胞可用于鉴定推定的抗原反应性tcr。用于鉴定推定的抗原反应性tcr的方法可以包括在选择之前和/或之后确定特定tcr的频率。本文提供的方法可以克服与基于细胞标志物的常规选择方法相关连的限制(例如,假阳性)。例如,使用荧光激活细胞分选(facs)或磁激活细胞分选(macs)的细胞分选可能会产生假阳性,因为许多所选择的细胞可能表达细胞标志物,但可能对靶抗原没有反应性。使用本文提供的方法可以大大降低假阳性率并增加鉴定真正抗原反应性细胞的变化。
35.作为本文提供的方法的实例,tcr程序化受体细胞可以与一种或多种抗原(例如,与mhc复合的一种或多种抗原)接触。在与一种或多种抗原接触之后,tcr程序化受体细胞可以进行选择(例如,使用荧光激活细胞分选(facs)、磁激活细胞分选(macs)、淘选或其他方法)以获得选择tcr程序化受体细胞。可以对选择后tcr程序化受体细胞进行测序。测序读数可用于测量每个tcr的频率或相对丰度(参见图1至3中的“tcr频率分析”)。tcr的频率可以定义为编码tcr(例如,具有独特序列的tcr)的原始分子(例如,cdna)的数量除以在一个样品中观察到的所有原始分子的数量。tcr频率分析可用于鉴定推定的靶反应性tcr(例如,抗原反应性tcr)。在一些情况下,在选择之前,可以对tcr程序化受体细胞(例如,选择前tcr程序化受体细胞)进行测序并进行tcr频率分析。tcr在选择前池和选择后池中的频率可用于鉴定靶反应性tcr(图2)。在一些情况下,可以使选择前tcr程序化受体细胞与第一抗原和第二抗原接触,其中第二抗原可以是第一抗原的变体。与第一抗原相比,第二抗原可以含有一个或多个突变。在与第一和第二抗原接触之后,tcr程序化受体细胞可以进行选择以获得第一和第二选择后tcr程序化受体细胞的池。可以对第一和第二选择后tcr程序化受体细胞的池进行测序并进行tcr频率分析。tcr在第一池和第二池中的频率可用于鉴定靶反应性tcr(图3)。tcr程序化受体细胞和鉴定推定的抗原反应性或肿瘤反应性tcr的方法可用于各种应用。
36.本文提供的方法可用于从tcr群体中鉴定多个抗原反应性或肿瘤反应性tcr。本文提供的方法可用于从tcr群体中鉴定多个肿瘤反应性t细胞受体(tcr),其中tcr群体包括至少约20、30、50、100、1,000、10,000、100,000、1,000,000、10,000,000或更多个不同的同源对。表达多个同源tcr或其亚型的多个细胞可用于鉴定一个或多个肿瘤反应性tcr。多个同源tcr或其亚型对于多个细胞可以是外源的。多个tcr或其亚型可以包括至少5个、至少10个、至少15个或至少20个不同的同源对。在一些情况下,多个肿瘤反应性tcr或其亚型可包括大于或等于约5、10、20、30、40、50、60、100、200、300、400、500、1,000、1,500、2,000、2,500、3,000、3,500或4,000或更多个不同的同源对。多个肿瘤反应性tcr中的每个tcr可以对不同的表位或不同的蛋白质具有特异性,或者可以包含不同的(i)tcrαcdr3序列,(ii)tcrβcdr3可变结构域序列,(iii)tcrα可变结构域序列,(iv)tcrβ可变结构域序列,或(v)tcrα和
tcrβ可变结构域序列的组合。所述方法还可以包括从受试者分离表达tcr群体的t细胞群体。不同的tcr同源对可以包含来自至少5、10、15、20或更多个不同v基因的v区。
37.本文提供的方法可以从样品量小(诸如有至多约100,000、10,000、1,000、100或更少的细胞)的样品中鉴定抗原反应性或肿瘤反应性tcr。本文提供的鉴定抗原反应性或肿瘤反应性tcr的方法可以包括从受试者中分离表达t细胞受体(tcr)群体的t细胞群体,其中t细胞群体包括至多约1,000个细胞、10,000个细胞或100,000个细胞。
38.表达载体
39.来自源tcr表达细胞的tcr可用于生成可表达tcr多核苷酸文库并递送到受体细胞中进行表达。可表达tcr多核苷酸文库可以包括载体文库。可表达tcr多核苷酸文库的多核苷酸可以作为线性或环状核酸分子递送到受体细胞中。在一些情况下,多核苷酸可以通过电穿孔递送到受体细胞中。在一些情况下,多核苷酸可以通过载剂(诸如阳离子聚合物)递送到受体细胞中。
40.可以将编码tcr的多核苷酸分子递送到本文所述的受体细胞中。多核苷酸分子可以是脱氧核糖核酸(dna)、核糖核酸(rna)或其组合。多核苷酸分子可以是mrna。多核苷酸分子可以包括核酸的类似物。
41.编码tcr的多核苷酸分子可以包括tcr的完整编码序列或其一部分。编码tcr的多核苷酸分子可以包括tcr的同源对的编码序列,包括tcrα链、或tcrβ链、或tcrγ链、或tcrδ链。编码tcr的多核苷酸分子的长度可以为至少约200、300、400、500、600、700、800、900、1,000、2,000、3,000、4,000、5,000、6,000、7,000、8,000、9,000、10,000或更多个核苷酸。
42.编码tcr的多核苷酸分子可以通过载体递送到受体细胞中。载体可以出于确定载体效价以及转染或转导效率的目的包含标志物基因(例如,gfp)。在一些情况下,细胞可以以低感染复数(moi)诸如至少约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0或更高的moi进行转染或转导。在一些情况下,细胞可以以至多约3.0、2.9、2.8、2.7、2.6、2.5、2.4、2.3、2.2、2.1、2.0、1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1、1.0、0.9、0.8、0.7、0.6、0.5或更小的moi进行转染或转导。在一些情况下,可以将编码多个不同tcr的多核苷酸分子的文库递送到多个受体细胞中,使得个别受体细胞可以表达仅一个、两个、三个、四个、五个、六个、七个、八个或更多个tcr。在一些情况下,可以将编码多个不同tcr的多核苷酸分子的文库递送到多个受体细胞中,使得个别受体细胞可以表达至多约八个、七个、六个、五个、四个、三个、两个或一个tcr。在一些情况下,个别受体细胞可以表达仅一个tcr(例如,一个独特的tcr对)。例如,慢病毒载体或自扩增rna可用于将编码独特tcr的多核苷酸分子的一个拷贝递送到受体细胞中。又例如,可以通过任何可用的基因编辑技术(例如,crispr)将编码独特tcr的多核苷酸分子遗传性地敲入受体细胞的基因组中。
43.tcr可以由载体(诸如质粒、转座子(例如,睡美人(sleepingbeauty)、piggy bac)和病毒载体(例如,腺病毒载体、aav载体、逆转录病毒载体和慢病毒载体))表达。载体的其他实例包括穿梭载体、噬菌粒、粘粒和表达载体。质粒载体的非限制性实例包括puc、pbr322、pet、pbluescript及其变体。此外,载体可包含另外的表达控制序列(例如,增强子序列、kozak序列、聚腺苷酸化序列、转录终止序列等)、选择性标志物序列(例如,抗生素抗性基因)、复制起点等。在一些情况下,载体是引入受体细胞中的核酸分子,从而产生转化的
受体细胞。载体可包含允许其在受体细胞中复制的核酸序列,诸如复制起点。载体还可以包含一个或多个选择性标志物基因和其他遗传元件。载体可以是表达载体,其包含与允许tcr表达的序列可操作地连接的根据本公开的配对的tcr编码多核苷酸。载体可以是病毒或非病毒载体,诸如逆转录病毒载体(包括慢病毒载体)、腺病毒载体(包括其有复制能力、复制缺陷和无肠形式)、腺相关病毒(aav)载体、猿猴病毒40(sv-40)载体、牛乳头状瘤载体、爱泼斯坦-巴尔(epstein-barr)载体、疱疹载体、牛痘载体、莫洛尼鼠白血病(moloneymurine leukemia)载体、哈维鼠肉瘤病毒(harvey murine sarcoma virus)载体、鼠乳腺肿瘤病毒载体、劳斯肉瘤病毒(rous sarcoma virus)载体和非病毒质粒。杆状病毒载体可适用于在昆虫细胞中表达。
44.在一些实施方案中,载体是自扩增rna复制子,也称为自复制(m)rna(self-replicating(m)rna)、自复制(m)rna(self-replication(m)rna)、自扩增(m)rna或rna复制子。自扩增rna复制子是可以自我复制的rna。在一些实施方案中,自扩增rna复制子可在细胞内自我复制。在一些实施方案中,自扩增rna复制子编码rna聚合酶和目标分子。rna聚合酶可以是rna依赖性rna聚合酶(rdrp或rdrp)。自扩增rna复制子也可编码蛋白酶或rna加帽酶。在一些实施方案中,自扩增rna复制子载体属于或衍生自称为甲病毒的披膜病毒科(togaviridae)病毒,其可包括东方马脑炎病毒(eee)、委内瑞拉马脑炎病毒(vee)、沼泽地病毒、穆坎博病毒(mucambo virus)、皮克孙纳病毒(pixuna virus)、西部马脑炎病毒(wee)、辛德毕斯病毒、南非虫媒病毒86号、塞姆利基森林病毒、米德尔堡病毒、基孔肯雅病毒、奥-奈氏病毒(onyong-nyong virus)、罗斯河病毒、巴马森林病毒、盖他病毒、鹭山病毒、贝巴鲁病毒、马亚罗病毒、乌纳病毒、奥拉病毒、沃达罗河病毒、巴班肯病毒(babankivirus)、克泽拉格齐病毒(kyzylagach virus)、高地j病毒、摩根堡病毒、恩杜茂病毒、博吉河病毒(buggy creek virus)以及由国际病毒分类委员会(ictv)分类为甲病毒的任何其他病毒。在一些实施方案中,自扩增rna复制子是或含有减毒形式的甲病毒的部分,诸如vee tc-83疫苗株。在一些实施方案中,自扩增rna复制子载体是病毒的减毒形式,其允许目标分子的表达而对细胞没有致细胞病变或凋亡作用。在一些实施方案中,自扩增rna复制子载体已经在体外、体内、离体或在电脑中进行工程化或选择,用于在宿主细胞、靶细胞或生物体中的特定功能(例如,延长的或增加的tcr表达)。例如,携带自扩增rna复制子的不同变体的宿主细胞群体可以基于在不同时间点一种或多种目标分子(在自扩增rna复制子或宿主基因组中编码的)的表达水平来选择。在一些实施方案中,经选择的或工程化的自扩增rna复制子已被修饰成减少来自宿主细胞或生物体的i型干扰素反应、先天性抗病毒反应或适应性免疫反应,这导致rna复制子的蛋白质表达在宿主细胞、靶细胞或生物体中持续更长或以更高水平表达。在一些实施方案中,这种优化的自扩增rna复制子序列从具有所需表型性状(例如,与野生型株或疫苗株相比,目标分子的表达更高或更持久,或针对载体的先天性抗病毒免疫反应降低)的个别细胞或细胞群体获得。在一些实施方案中,携带所需或所选择的自扩增rna复制子序列的细胞从用包含自扩增rna复制子的治疗剂治疗后具有有益反应特征的受试者(例如人或动物)(例如完全缓解的精英反应者或受试者)获得。在一些实施方案中,自扩增rna复制子载体可以表达其他剂。在一些实施方案中,其他剂包括细胞因子,诸如il-2、il-12、il-15、il-10、gm-csf、tnfα、颗粒酶b或其组合。在一些实施方案中,其他剂能够通过直接影响tcr的表达或通过调节宿主细胞表型(例如,诱导细胞凋亡或扩增)
来调节tcr的表达。在一些实施方案中,自扩增rna复制子可含一个或多个亚基因组序列以产生一个或多个亚基因组多核苷酸。在一些实施方案中,亚基因组多核苷酸充当功能性mrna分子,用于通过细胞翻译机制进行翻译。亚基因组多核苷酸可以通过自扩增rna复制子上确定序列元件(例如亚基因组启动子或sgp)的功能产生,所述确定序列元件指导聚合酶由亚基因组序列产生亚基因组多核苷酸。在一些实施方案中,sgp被rna依赖性rna聚合酶(rdrp或rdrp)识别。在一些实施方案中,多个sgp序列存在于单个自扩增rna复制子上,并且可以位于编码tcr、tcr的成分或其他剂的亚基因组序列的上游。在一些实施方案中,可以修饰sgp序列的核苷酸长度或组成以改变亚基因组多核苷酸的表达特征。在一些实施方案中,不相同的sgp序列位于自扩增rna复制子上,使得对应的亚基因组多核苷酸的比率不同于sgp序列相同的情况。在一些实施方案中,不相同的sgp序列指导tcr和其他剂(例如细胞因子)的产生,使得它们相对于彼此以一定的比率产生,从而导致tcr表达增加、靶细胞扩增增加或更快而对靶细胞或宿主无细胞毒性作用,或减弱针对rna复制子的先天或适应性免疫反应。在一些实施方案中,亚基因组序列和sgp序列相对于彼此和基因组序列本身的位置可用于改变亚基因组多核苷酸相对于彼此的比率。在一些实施方案中,编码tcr的sgp和亚基因组序列可以位于编码其他剂的sgp和亚基因组区域的下游,使得tcr的表达相对于其他剂大幅增加。在一些实施方案中,rna复制子或sgp已被选择或工程化以表达最佳量的细胞因子,使得细胞因子促进t细胞的扩增或增强tcr的治疗效果,但不引起严重的副作用,诸如细胞因子释放综合征、细胞因子风暴或神经毒性。
45.在一些实施方案中,本文提供了包含编码tcrα链和tcrβ链的配对的tcr编码多核苷酸的载体。在一些实施方案中,本文提供了包含编码tcrγ链和tcrδ链的配对的tcr编码多核苷酸的载体。在一些实施方案中,载体是自扩增rna复制子、质粒、噬菌体、转座子、粘粒、病毒或毒粒。在一些实施方案中,载体是病毒载体。在一些实施方案中,载体衍生自逆转录病毒、慢病毒、腺病毒、腺相关病毒、疱疹病毒、痘病毒、α病毒、痘苗病毒、乙型肝炎病毒、人乳头瘤病毒或其假型。在一些实施方案中,载体是非病毒载体。在一些实施方案中,非病毒载体可以被配制成纳米颗粒、阳离子脂质、阳离子聚合物、金属纳米聚合物、纳米棒、脂质体、胶束、微泡、细胞穿透肽或脂球。
46.两条tcr链的表达可以由两个启动子或一个启动子驱动。在一些情况下,使用两个启动子。在一些情况下,两个启动子连同它们各自的两条链的蛋白编码序列可以以头对头、头对尾或尾对尾方向排列。在一些情况下,使用一个启动子。两个蛋白编码序列可以任选地框内连接,使得一个启动子可用于表达两条链。并且在此类情况下,两个蛋白编码序列可以以头对尾方向排列并且可以与核糖体结合位点(例如内部核糖体结合位点或ires)、蛋白酶切割位点或自加工切割位点(诸如编码2a肽的序列)连接以促进双顺反子表达。在一些情况下,两条链可以用肽接头连接,使得两条链可以表达为单链多肽。每条表达的链可以含有包含重排的v(d)j基因的完整可变结构域序列。每条表达的链可以含有完整的可变结构域序列,包括cdr1、cdr2和cdr3。每条表达的链可以含有完整的可变结构域序列,包括fr1、cdr1、fr2、cdr2、fr3和cdr3。在一些情况下,每条表达的链还可含有恒定结构域序列。
47.为了产生表达载体,可能需要向融合的tcr基因中加入其他序列。这些其他序列包括载体骨架(例如,载体在靶细胞或临时宿主(诸如大肠杆菌)中复制所需的元件)、启动子、ires、编码自切割肽的序列、终止子、辅助基因(诸如有效载荷)、以及配对的tcr编码多核苷
酸的部分序列(诸如编码恒定结构域的序列的部分)。
48.蛋白酶切割位点包括但不限于肠激酶切割位点:(asp)4lys;因子xa切割位点:ile-glu-gly-arg;凝血酶切割位点,例如leu-val-pro-arg-gly-ser;肾素切割位点,例如his-pro-phe-his-leu-val-ile-his;胶原酶切割位点,例如x-gly-pro(其中x是任何氨基酸);胰蛋白酶切割位点,例如arg-lys;病毒蛋白酶切割位点,诸如病毒2a或3c蛋白酶切割位点,包括但不限于来自小核糖核酸病毒的蛋白酶2a切割位点、甲型肝炎病毒3c切割位点、人鼻病毒2a蛋白酶切割位点、小核糖核酸病毒3蛋白酶切割位点;和半胱天冬酶蛋白酶切割位点,例如由激活的半胱天冬酶-3识别和切割的devd,其中切割发生在第二个天冬氨酸残基之后。在一些实施方案中,本公开提供了包含蛋白酶切割位点的表达载体,其中所述蛋白酶切割位点包含细胞蛋白酶切割位点或病毒蛋白酶切割位点。在一些实施方案中,第一蛋白质切割位点包含由弗林蛋白酶(furin);ipnv的vp4;烟草蚀刻病毒(tev)蛋白酶;鼻病毒的3c蛋白酶;pc5/6蛋白酶;pace蛋白酶、lpc/pc7蛋白酶;肠激酶;因子xa蛋白酶;凝血酶;基因酶i;mmp蛋白酶;芜菁花叶马铃薯y病毒(turnip mosaic potyvirus)的核内含体蛋白a(n1a);登革热4型黄病毒(dengue type 4 flaviviruses)的ns2 b/ns3、黄热病病毒的ns3蛋白酶;花椰菜花叶病毒的orf v;kex2蛋白酶;cb2;或2a识别的位点。在一些实施方案中,蛋白质切割位点是病毒内部可切割的信号肽切割位点。在一些实施方案中,病毒内部可切割的信号肽切割位点包括来自丙型流感病毒、丙型肝炎病毒、汉坦病毒、黄病毒或风疹病毒的位点。
49.包含在本公开的载体中的合适的ires元件可包含能够接合真核核糖体的rna序列。在一些实施方案中,本公开的ires元件为至少约250个碱基对、至少约350个碱基对或至少约500个碱基对。本公开的ires元件可衍生自生物体的dna,所述生物体包括但不限于病毒、哺乳动物和果蝇。在一些情况下,衍生ires元件的病毒dna包括但不限于小核糖核酸病毒互补dna(cdna)、脑心肌炎病毒(emcv)cdna和脊髓灰质炎病毒cdna。衍生ires元件的哺乳动物dna的实例包括但不限于编码免疫球蛋白重链结合蛋白(bip)的dna和编码碱性成纤维细胞生长因子(bfgf)的dna。衍生ires元件的果蝇dna的实例包括但不限于来自黑腹果蝇的触角足(antennapedia)基因。脊髓灰质炎病毒ires元件的其他实例包括例如脊髓灰质炎病毒ires、脑心肌炎病毒ires或甲型肝炎病毒ires。黄病毒ires元件的实例包括丙型肝炎病毒ires、gb病毒b ires或瘟病毒ires,包括但不限于牛病毒性腹泻病毒ires或经典猪瘟病毒ires。
50.自加工切割位点的实例包括但不限于内含肽序列;修饰的内含肽;刺猬序列;其他猪科序列;2a序列,例如衍生自口蹄疫病毒(fmdv)的2a序列;以及其各自的变体。
51.用于重组tcr表达的载体可以包含任何数量的启动子,其中所述启动子是组成型的、调节型的或诱导型的、细胞类型特异性的、组织特异性的或物种特异性的。其他实例包括四环素反应性启动子。载体可以是适于表达tcr的宿主细胞的复制子,并且它也可以包括在细菌细胞(例如大肠杆菌)中有功能的复制子。启动子可以是组成型或诱导型的,其中诱导与例如特定细胞类型或特定成熟水平相关联。或者,许多病毒启动子可能是合适的。启动子的实例包括β-肌动蛋白启动子、sv40早期和晚期启动子、免疫球蛋白启动子、人巨细胞病毒启动子、逆转录病毒启动子、延伸因子1a(ef-1a或ep-1α)启动子、磷酸甘油酸激酶(pgk)启动子和弗里德(friend)脾脏病灶形成性病毒启动子。启动子可以与或不与增强子缔合,
其中增强子可以与特定启动子天然缔合或与不同启动子缔合。
52.作为基因表达的宿主细胞的受体细胞可以是但不限于动物细胞,尤其是哺乳动物细胞,或者它可以是微生物细胞(细菌、酵母或真菌)或植物细胞。宿主细胞的实例包括昆虫培养细胞(诸如草地贪夜蛾(spodoptera frugiperda)细胞)、酵母细胞(诸如酿酒酵母(saccharomyces cerevisiae)或巴斯德毕赤酵母(pichia pastoris))、真菌(诸如里氏霉菌(trichoderma reesei)、曲霉属(aspergillus)、金黄担子菌属(aureobasidum)和青霉属(penicillium)物种)以及哺乳动物细胞(诸如cho(中国仓鼠卵巢)、bhk(幼仓鼠肾)、cos、293、3t3(小鼠)、vero(非洲绿猴)细胞),并且也可以使用各种转基因动物系统,包括但不限于猪、小鼠、大鼠、绵羊、山羊、牛。杆状病毒载体,尤其是acnpv载体,可用于本公开的单一orf tcr表达和切割,例如在昆虫细胞系中的多角体启动子或其他强启动子的调节控制下表达单一orf。哺乳动物细胞中使用的启动子可以是组成型的(疱疹病毒tk启动子;sv40早期启动子;劳斯肉瘤病毒启动子;巨细胞病毒启动子;小鼠乳腺肿瘤病毒启动子)或调节型的(例如金属硫蛋白启动子)。载体可以基于感染特定哺乳动物细胞的病毒,例如逆转录病毒、牛痘和腺病毒以及它们的衍生物。启动子包括但不限于巨细胞病毒、晚期腺病毒和牛痘7.5k启动子。烯醇化酶是组成型酵母启动子的一个实例,而醇脱氢酶是调节型启动子的一个实例。
53.具体启动子、转录终止序列和其他任选序列(诸如编码组织特异性序列的序列)的选择可以由在其中进行表达的细胞类型确定。所述细胞可以是细菌、酵母、真菌、哺乳动物、昆虫、鸡或其他动物细胞。
54.由tcr表达载体表达的tcr可以呈它们的天然形式或可以呈工程化形式。在一些情况下,工程化形式是单链tcr片段。在一些情况下,工程化形式是tcr-car。现有方法也可用于将功能序列(例如,接头、cd28 tm结构域)引入配对的tcr编码多核苷酸,以产生表达这些工程化形式的tcr的tcr表达载体。
55.源tcr表达细胞
56.tcr的两条链可以在信息上或物理上配对的源tcr表达细胞可以是各种细胞类型,来自各种生物体,并从各种组织或器官中分离。源tcr表达细胞可以从各种样品中获得。源tcr表达细胞可以产生tcr。源tcr表达细胞可以是免疫细胞。免疫细胞是指在功能上参与先天和/或适应性免疫反应的启动和/或执行的造血来源的细胞。源tcr表达细胞可以是淋巴细胞,例如肿瘤浸润性淋巴细胞(til)。源tcr表达细胞可以是t细胞。
57.源tcr表达细胞可以从各种样品中获得或分离。源tcr表达细胞可以是从各种样品中获得或分离的免疫细胞。样品可以从本文所述的各种来源或受试者获得。受体细胞也可以从本文所述的样品中获得。
58.在某些实施方案中,源tcr表达细胞可以从受试者或宿主(诸如人或其他动物,诸如已被免疫或罹患感染、癌症、自身免疫病状或任何其他疾病的人或其他动物)的血液样品或其他生物样品中分离,以鉴定具有潜在临床意义的病原体、肿瘤和/或疾病特异性抗体或tcr。例如,人可能被诊断患有疾病、表现出疾病症状、未诊断出患有疾病或未表现出疾病症状。例如,人可以是暴露于感染原(例如,病毒、细菌、寄生生物、朊病毒等)、抗原或疾病的人和/或能够针对所述传染原、抗原或疾病产生可用tcr的人。例如,动物可以是暴露于感染原(例如,病毒、细菌、寄生生物、朊病毒等)、抗原或疾病的动物和/或能够针对所述传染原、抗
原或疾病产生可用tcr的动物。来自经免疫的宿主的某些免疫细胞可以针对一种或多种研究的靶抗原和/或一种或多种未知抗原产生tcr。在本公开中,淋巴细胞池可以通过任何合适的方法富集所需的免疫细胞,所述方法诸如使用荧光激活细胞分选(facs)、磁激活细胞分选(macs)、淘选或其他筛选方法筛选和分选细胞以从样品中生成多个免疫细胞。
59.免疫细胞可以衍生自干细胞。干细胞可以是成体干细胞、胚胎干细胞,更特别的是非人干细胞、脐带血干细胞、祖细胞、骨髓干细胞、诱导多能干细胞、全能干细胞或造血干细胞。代表性的人干细胞可以是cd34+细胞。分离的免疫细胞可以是树突细胞、杀伤树突细胞、肥大细胞、自然杀伤(nk)细胞、nk t细胞或者选自由炎性t淋巴细胞、细胞毒性t淋巴细胞、调节性t淋巴细胞或辅助t淋巴细胞组成的组的t细胞。t细胞可以是cd4+t淋巴细胞、cd8+t淋巴细胞或cd4+cd8+t淋巴细胞。
60.在一些实施方案中,源tcr表达细胞可以是从未免疫的人或非人供体分离的免疫细胞。免疫可以触发任何免疫细胞产生va-vβ或vγ-vδ组合,其结合免疫原以增殖(克隆扩增)。然而,使用来自未免疫的受试者的脾细胞和/或免疫细胞或其他外周血淋巴细胞可以更好地呈现可能的tcr库,并且还允许使用任何动物物种构建后续tcr文库。
61.在一些情况下,源tcr表达细胞可以从外周血样品中获得。外周血细胞可以富集特定细胞类型(例如,cd4+细胞;cd8+细胞;免疫细胞;t细胞等)。外周血细胞也可以选择性地除去特定细胞类型(例如,单核细胞;红细胞;cd4+细胞;cd8+细胞;免疫细胞;t细胞、nk细胞等)。样品可包含至少约5、10、100、250、500、750、1000、2500、5000、10000、25000、50000、75000、10000、250000、500000、750000、1000000、2500000、5000000、7500000或10000000个表达不同tcr的免疫细胞亚群或个别免疫细胞。
62.在一些情况下,源tcr表达细胞可以从包含实体组织的组织样品中获得,其中非限制性实例包括来自脑、肝、肺、肾、前列腺、卵巢、脾脏、淋巴结(包括扁桃体)、甲状腺、胸腺、胰腺、心脏、骨骼肌、肠、喉、食道和胃的组织。其他非限制性来源包括骨髓、脐带血、来自感染部位的组织、腹水、胸腔积液、脾组织和肿瘤。在一些实施方案中,可以使用t细胞系。在一些实施方案中,细胞可以衍生自或获得自健康供体、诊断患有癌症的患者或诊断患有感染的患者。在一些实施方案中,细胞是呈现不同表型特征的混合细胞群体的一部分。
63.源tcr表达细胞可以是肿瘤浸润性淋巴细胞(til),例如肿瘤浸润性t细胞。til可以从患有癌症的器官中分离。可以从患有癌症的器官分离出一种或多种细胞,所述器官可以是脑、心脏、肺、眼、胃、胰腺、肾、肝、肠、子宫、膀胱、皮肤、头发、指甲、耳朵、腺体、鼻子、嘴、嘴唇、脾脏、牙龈、牙齿、舌头、唾液腺、扁桃体、咽、食道、大肠、小肠、直肠、肛门、甲状腺、胸腺、骨头、软骨、肌腱、韧带、肾上腺囊、骨骼肌、平滑肌、血管、血液、脊髓、气管、输尿管、尿道、下丘脑、垂体、幽门、肾上腺、卵巢、输卵管、子宫、阴道、乳腺、睾丸、精囊、阴茎、淋巴、淋巴结或淋巴管。一种或多种til可以来自脑、心脏、肝、皮肤、肠、肺、肾、眼、小肠或胰腺。til可以来自胰腺、肾、眼、肝、小肠、肺或心脏。一种或多种细胞可以是胰岛细胞,例如胰岛β细胞。在一些情况下,til可能来自消化道癌症。可以通过多种方式制备til培养物。例如,肿瘤可以从非癌性组织或坏死区域修剪。然后肿瘤可以被破碎成约2-3mm长。在一些情况下,肿瘤可以被破碎成大小为约0.5mm至约5mm、约1mm至约2mm、约2mm至约3mm、约3mm至约4mm或约4mm至约5mm。肿瘤碎片可以被酶促消化以获得单细胞混悬液,使用现有方法可以从其中分离淋巴细胞或t细胞。也可以利用培养基和细胞刺激剂诸如细胞因子在体外培养肿瘤碎片。
在一些情况下,il-2可用于从肿瘤碎片中扩增til。il-2的浓度可以是约6000iu/ml。il-2的浓度也可以是约2000iu/ml、3000iu/ml、4000iu/ml、5000iu/ml、6000iu/ml、7000iu/ml、8000iu/ml、9000iu/ml或高达约10000iu/ml。一旦til扩增,就可以对其进行体外测定以确定肿瘤反应性。例如,可以通过facs评价til的cd3、cd4、cd8和cd58表达。til还可以进行共培养、细胞毒性、elisa或elispot测定。在一些情况下,til培养物可以冷冻保存或进行快速扩增。细胞,诸如til,可以从发育阶段的供体中分离,包括但不限于胎儿、新生儿、青少年和成人。
64.一个或多个样品可以来自一个或多个来源。一个或多个样品可以来自两个或更多个来源。一个或多个样品可以来自一个或多个受试者。一个或多个样品可以来自两个或更多个受试者。一个或多个样品可以来自同一受试者。一个或多个受试者可以来自同一物种。一个或多个受试者可以来自不同物种。一个或多个受试者可以是健康的。一个或多个受试者可以患有疾病、病症或病状。
65.可以从患有病状的受试者获取样品。在一些实施方案中,从其获取样品的受试者可以是患者,例如癌症患者或怀疑患有癌症的患者。受试者可以是哺乳动物,例如人,并且可以是男性或女性。在一些实施方案中,女性是怀孕的。样品可以是肿瘤活检。活检可以由例如保健提供者进行,包括医师、医师助理、护士、兽医、牙医、脊医、急救人员、皮肤科医生、肿瘤科医生、肠胃科医生或外科医生。
66.受试者可能患有表达靶抗原的疾病。例如,所述疾病可以是癌症,包括b细胞淋巴瘤、急性淋巴母细胞白血病(all)、慢性淋巴细胞白血病、急性髓样白血病、肾上腺皮质癌(adrenocortical carcinoma)、肾上腺皮质癌(adrenal cortex cancer)、aids相关癌症、肛门癌、阑尾癌、星形细胞瘤、非典型畸胎样/横纹肌样瘤、基底细胞癌、胆管癌、肝外癌、膀胱癌、骨癌(包括尤因肉瘤和骨肉瘤和恶性纤维组织细胞瘤)、脑瘤、乳腺癌、伯基特淋巴瘤(burkitt lymphoma)、类癌瘤(胃肠道)、中枢神经系统不明原因原发癌、原发性淋巴瘤、宫颈癌、胆管癌、慢性淋巴细胞白血病(cll)、慢性骨髓性白血病(cml)、慢性骨髓增生性赘生物、结直肠癌、皮肤t细胞淋巴瘤、导管原位癌(dcis)、子宫内膜癌、食管尤因肉瘤、性腺外生殖细胞肿瘤、眼癌、眼内黑素瘤、视网膜母细胞瘤、输卵管癌、恶性骨纤维组织细胞瘤和骨肉瘤、胆囊癌、胃癌、胃肠道类癌瘤、胃肠道间质瘤(gist)、生殖细胞瘤(性腺外、卵巢、睾丸)、妊娠滋养细胞疾病、胶质瘤、毛细胞白血病、头颈癌、肝细胞(肝)癌、朗格汉斯细胞组织细胞增生症、霍奇金淋巴瘤、下咽癌、眼内黑素瘤、胰岛细胞瘤、胰腺神经内分泌肿瘤、卡波西肉瘤、肾癌、朗格汉斯细胞组织细胞增生症、喉癌、白血病、唇和口腔癌、肝癌(原发性)、肺癌、淋巴瘤、华氏巨球蛋白血症、男性乳腺癌、恶性骨纤维组织细胞瘤和骨肉瘤、黑素瘤、眼内(眼)黑素瘤、触细胞瘤、间皮瘤、恶性、隐匿原发性的转移性鳞状颈癌、口腔癌(mouth cancer)、多发性骨髓瘤/浆细胞赘生物、蕈样肉芽肿、骨髓增生异常综合征、骨髓增生异常/骨髓增生性赘生物和慢性骨髓增生性赘生物、慢性骨髓性白血病(cml)、急性髓样白血病(aml)、鼻腔和鼻窦癌、鼻咽癌、神经母细胞瘤、非霍奇金淋巴瘤、非小细胞肺癌、口腔癌(oral cancer)、唇和口腔癌和口咽癌、骨肉瘤和恶性骨纤维组织细胞瘤、卵巢癌、胰腺癌和胰腺神经内分泌肿瘤(胰岛细胞瘤)、副神经节瘤、鼻窦和鼻腔癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、垂体瘤、浆细胞赘生物/多发性骨髓瘤、妊娠和乳腺癌、原发性中枢神经系统(cns)淋巴瘤、原发性腹膜癌、前列腺癌、直肠癌、肾细胞(肾)癌、视网膜母细胞瘤、腮腺
癌、肉瘤、尤因肉瘤、卡波西肉瘤、骨肉瘤、横纹肌肉瘤、子宫肉瘤、希塞里综合征(s
é
zary syndrome)、皮肤癌、小细胞肺癌、小肠癌、软组织肉瘤、鳞状细胞癌、隐匿原发性的转移性鳞状颈癌、胃癌、t细胞淋巴瘤、皮肤癌、睾丸癌、咽喉癌、胸腺瘤和胸腺癌、甲状腺癌、肾盂输尿管移行细胞癌、输尿管和肾盂移行细胞癌、尿道癌、子宫癌、子宫内膜和子宫肉瘤、阴道癌、外阴癌、华氏巨球蛋白血症或维尔姆斯瘤。
67.在一些实施方案中,样品是流体,诸如血液、唾液、淋巴液、尿液、脑脊液、精液、痰、粪便或组织匀浆。在一些实施方案中,样品是唾液。在一些实施方案中,样品是全血。在一些实施方案中,为了获得足够量的细胞,抽取的血液量为至少约0.001、0.005、0.01、0.05、0.1、0.5、1、2、3、4、5、10、20、25、30、35、40、45或50ml。在一些情况下,可以将血液收集到含有镁螯合剂(包括但不限于edta)的设备中,并在4℃下储存。任选地,可以添加钙螯合剂,包括但不限于egta。在一些情况下,将细胞裂解抑制剂添加到血液中,所述细胞裂解抑制剂包括但不限于甲醛、甲醛衍生物、福尔马林、戊二醛、戊二醛衍生物、蛋白质交联剂、核酸交联剂、蛋白质和核酸交联剂、伯胺反应性交联剂、巯基反应性交联剂、巯基加成剂或二硫化还原剂、碳水化合物反应性交联剂、羧基反应性交联剂、光反应性交联剂或可切割交联剂。在一些实施方案中,可以使用酶处理(例如蛋白酶消化)从起始材料中去除非核酸材料。
68.多个样品可以包括至少2、3、4、5、10、20、30、40、50、60、70、80、90或100个或更多个样品。多个样品可以包括至少100、200、300、400、500、600、700、800、900或1000或更多个样品。多个样品可以包括至少约1000、2000、3000、4000、5000、6000、7000、8000个样品、9000或10,000个样品、或100,000个样品、或1,000,000个或更多个样品。多个样品可以包括至少约10,000个样品。
69.第一样品可以包含一个或多个细胞并且第二样品可以包含一个或多个细胞。第一样品的一个或多个细胞可以是与第二样品的一个或多个细胞相同的细胞类型。第一样品的一个或多个细胞可以是与多个样品的一个或多个不同细胞不同的细胞类型。
70.可以一并获得多个样品。可以同时获得多个样品。可以依次获得多个样品。多个样品可以在多年的过程中获得,例如获得一个或多个不同样品的100年、10年、5年、4年、3年、2年或1年。一个或多个样品可以在获得一个或多个不同样品的约一年内获得。一个或多个样品可以在获得一个或多个不同样品的12个月、11个月、10个月、9个月、8个月、7个月、6个月、4个月、3个月、2个月或1个月内获得。一个或多个样品可以在获得一个或多个不同样品的30天、28天、26天、24天、21天、20天、18天、17天、16天、15天、14天、13天、12天、11天、10天、9天、8天、7天、6天、5天、4天、3天、2天或1天内获得。一个或多个样品可以在获得一个或多个不同样品的约24小时、22小时、20小时、18小时、16小时、14小时、12小时、10小时、8小时、6小时、4小时、2小时或1小时内获得。一个或多个样品可以在获得一个或多个不同样品的约60秒、45秒、30秒、20秒、10秒、5秒、2秒或1秒内获得。一个或多个样品可以在获得一个或多个不同样品的少于一秒的时间内获得。
71.在一些实施方案中,来自具有特定表型的t细胞的tcr是目标。为实现这一目的,可以分离/富集/分选t细胞亚群。在一个实施方案中,可以选择表达以下中的一种或多种的t细胞群体:ifn-γ、tnf-α、il-17a、il-2、il-3、il-4、gm-csf、il-10、il-13、颗粒酶b和穿孔素,或其他适当的分子,例如其他细胞因子和转录因子,诸如t-bet、eomes、tcf1(人体内的tcf7)。用于筛选细胞表达的方法可以例如通过pct公开号:wo 2013/126712中描述的方法
来确定。在一些实施方案中,也表达一种或多种目标基因(例如ifn-γ、tnf-α、il-17a、il-2、il-3、il-4、gm-csf、il-10、il-13、颗粒酶b、穿孔素、t-bet、eomes、tcf1(人体内的tcf7)或其他细胞因子和转录因子)的来自t细胞的tcr序列可以通过单细胞rna测序获得。
72.t细胞可以从体外培养中获得。t细胞可以通过与组织或细胞接触在体外被激活或扩增。例如,从患者外周血中分离的t细胞可以与呈递肿瘤抗原的细胞(诸如肿瘤细胞、肿瘤组织、肿瘤球、肿瘤裂解物脉冲的apc或肿瘤mrna负载apc)共培养。呈递肿瘤抗原的细胞可以是用确定的抗原、一组确定的抗原或一组未确定的抗原(例如,肿瘤裂解物或总肿瘤mrna)脉冲的apc,或者被工程化以表达确定的抗原、一组确定的抗原或一组未确定的抗原。例如,在呈递确定的抗原的情况下,apc可以表达一个或多个小基因,所述小基因编码一个或多个具有已知序列的短表位(例如,长度为7至60个氨基酸)。apc还可以从含有编码两个或更多个表位的序列的载体中表达两个或更多个小基因。在呈递未确定的抗原的情况下,可以用肿瘤裂解物或总肿瘤mrna对apc进行脉冲。在共培养之前可以照射呈递肿瘤抗原的细胞。共培养可以在包含可以提供共刺激信号或细胞因子的试剂(例如,抗cd28抗体)的培养基中进行。此种共培养可以刺激和/或扩增肿瘤抗原反应性t细胞。可以使用本文所述的细胞表面标志物(例如,cd25、cd69、cd137)来选择或富集这些细胞。使用这种方法,可以从患者的外周血、扩增前的til或扩增后的til中预富集肿瘤抗原反应性t细胞。这些预富集的t细胞可用作输入,以使用本文所述的方法获得融合(或物理连接)的tcr,或使用单细胞rna-seq获得信息上配对的tcr序列。在一些情况下,预富集的t细胞可用作输入以进行任何其他方法来鉴定tcr的同源对,例如,通过使用单细胞条形码进行测序。使用此处描述的方法制备的抗原和apc也可用于接触tcr程序化受体细胞,用于本文件别处描述的各种选择方法。
73.当在此种体外培养中使用外周t细胞时,预富集的t细胞(例如,cd137+)可能含有在共培养期间获得标志物(例如cd137)表达的t细胞,并且也可能含有在抽血时已经表达所述标志物的t细胞。然而,后一种群体可能是肿瘤反应性的。这种方法可以提供一种更简单的替代方法来分离所描述的til。
74.在一些情况下,新鲜肿瘤可能无法用于分离活til,并且在此类情况下,可以从冷冻或固定的组织中分离细胞核。这些细胞核也可以用作配对的二分体免疫受体克隆过程(在这种情况下是配对的tcr克隆)的输入以获得融合的tcr多核苷酸文库,或者用作单细胞rnaseq的输入以获得信息上配对的tcr序列。
75.tcr的多样性
76.承载源tcr表达细胞的原始位点可能会影响配对的tcr编码多核苷酸库的特征,并且因此,会影响所得tcr表达载体和tcr程序化受体细胞的库。此种库的特征的一个方面可以是基因使用多样性。
77.在一些情况下,所述库可以含有超过2个、超过5个、超过10个、超过50个、超过100个、超过500个、超过1,000个、超过5,000个、超过10,000个、超过50,000个或超过100,000个v(d)j组合。在一些情况下,所述库可以含有超过2个、超过5个、超过10个、超过50个、超过100个、超过500个、超过1,000个、超过5,000个、超过10,000个、超过50,000个或超过100,000个不同的v(d)j组合。这是因为源tcr表达细胞的多克隆群体可能对v、d和j基因具有高度多样性使用,产生高度多样性v(d)j组合。
78.配对的tcr编码多核苷酸或tcr表达载体的vj组合可以由两条tcr链使用的v基因和j基因限定。配对的tcr编码多核苷酸或tcr表达载体的v(d)j组合可以由两条tcr链使用的v基因、d基因和j基因限定。例如,trav8-4/traj45/trbv29-1/trbj1-5可以限定配对的tcr的特定vj重组。给定tcr链的编码序列,可以使用诸如v-quest和mixcr的计算工具推导出v(d)j组合。
79.应注意的是,两个不同的配对的tcr表达多核苷酸(或两个不同的免疫受体表达载体)可能共享相同的v(d)j重组但具有不同的序列,这可能是因为(1)在v(d)j重组过程中,可能在v-d、d-j和v-j接合处发生随机插入和缺失,以及(2)通过诱变和基因合成可能人为产生序列变异,并且在基因合成过程中可能引入可变序列。例如,两个融合的tcr基因可能具有相同的vj重组,但具有不同的cdr3序列。配对的tcr表达多核苷酸或表达载体可以包含来自源tcr表达细胞的第一tcr链和第二tcr链的同源对组合(或细胞中的天然对组合)。多个配对的tcr表达多核苷酸或表达载体可以包含来自多个tcr表达细胞的第一tcr链和第二tcr链的多个同源对组合。源tcr表达细胞可以具有不同的克隆型,并且因此可以产生配对的tcr表达多核苷酸或表达载体的多克隆群体。将多克隆tcr表达载体递送到多个受体细胞中可以产生tcr程序化受体细胞的多克隆群体,其表达至少100个、至少1,000个、至少10,000个、至少100,000个、至少1,000,000个、至少10,000,000个或至少100,000,000个或更多个不同的tcr(或tcr的不同同源对组合)。不同的tcr中的每个都可以在配对的tcr表达多核苷酸中具有独特的序列。
80.这种多克隆特征可以将使用本公开中描述的方法获得的配对的tcr表达多核苷酸文库、表达载体文库和tcr程序化受体细胞的多克隆群体与先前报道的对应物区分开来。例如,使用现有方法,可以从一个或少数tcr编码序列、tcr结构域编码序列或配对的tcr表达多核苷酸开始,并使用诱变或易错pcr生成这些起始序列的大量变异以产生一个大型的配对的tcr表达多核苷酸文库。因此,这些文库可能含有一个或少数v(d)j基因组合。相比之下,使用本公开中描述的方法获得的配对的tcr表达多核苷酸文库、表达载体文库和tcr程序化受体细胞的多克隆群体可以含有超过约1,000个、超过约5,000个、超过约10,000个、超过约50,000个、超过约100,000个、超过约500,000个、超过约1,000,000个、超过约5,000,000个、或超过约10,000,000个序列并且可以含有超过约1,000个、超过约5,000个、超过约10,000个,超过约50,000个、超过约100,000个、超过约500,000个、超过约1,000,000个、超过约5,000,000个或超过约10,000,000个vj或vdj组合。在一些情况下,使用本公开中描述的方法获得的配对的tcr表达多核苷酸文库、表达载体文库和tcr程序化受体细胞的多克隆群体可以含有至少约50个、至少约100个、至少约200个、至少约500个、至少约1,000个、至少约2,000个、至少约5,000个、至少约10,000个、至少约100,000个、至少约1,000,000个或至少约10,000,000个vj或vdj组合。此外,使用本公开中描述的方法获得的配对的tcr表达多核苷酸文库、表达载体文库和免疫受体程序化受体细胞的多克隆群体可以含有至少10个、至少15个、至少20个或更多个不同的trav(tcrα链的v基因)亚组,和/或至少10个、至少15个、至少20个或更多个不同的trbv(tcrβ链的v基因)亚组。
81.受体细胞的来源
82.受体细胞(例如,tcr程序化受体细胞)可以来自各种来源。受体细胞可以是t细胞。用作受体细胞的t细胞可以从受试者获得(例如,原代t细胞)。在一些情况下,作为源tcr表
达细胞的t细胞从受试者获得。t细胞可以从本文所述的任何样品中获得。在一些情况下,受体t细胞从受试者获得。术语“受试者”是指生物体。例如,生物体可以是可在其中引发免疫反应的活生物体(例如,哺乳动物)。受试者的实例包括人、狗、猫、小鼠、大鼠及其转基因物种。t细胞可以从多种来源获得,包括外周血单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、感染部位的组织、腹水、胸腔积液、脾组织和肿瘤。在某些方面,可以使用t细胞系。t细胞可以是辅助t细胞、细胞毒性t细胞、记忆t细胞、调节t细胞、自然杀伤t细胞、αβt细胞或γδt细胞。在本公开的某些方面,t细胞可以使用多种技术(诸如ficoll
tm
分离)从自受试者处收集的血液单元中获得。来自个体循环血液的细胞可以通过单采获得。单采产品可能含有淋巴细胞,包括t细胞、单核细胞、粒细胞、b细胞、其他有核白细胞、红细胞和血小板。可以洗涤通过单采收集的细胞以去除血浆部分并将细胞置于适当的缓冲液或介质中用于后续的处理步骤。在一些情况下,可以用磷酸盐缓冲盐水(pbs)洗涤细胞。洗涤溶液可能缺乏钙或镁或其他二价阳离子。缺乏钙的初始激活步骤可能会导致放大的激活。洗涤步骤可以通过诸如根据制造商的说明使用半自动“流通式(flow-through)”离心机(例如,cobe 2991细胞处理器、baxter cytomate或haemonetics cell saver 5)的方法来完成。洗涤后,可将细胞重悬于多种生物相容性缓冲液中,例如像不含ca的pbs、不含mg的pbs、plasmalyte a或其他有或无缓冲液的盐水溶液。或者,可以去除单采样品中不需要的组分,并将细胞直接重悬于培养基中。
83.在一个方面,通过裂解红细胞并除去单核细胞,例如通过用percoll
tm
梯度离心或通过逆流离心淘析,从外周血淋巴细胞或组织中分离t细胞。当从组织中分离t细胞时(例如,从肿瘤组织中分离肿瘤浸润性t细胞),在裂解红细胞或除去单核细胞之前,将组织切碎或破碎以解离细胞。可以通过阳性或阴性选择技术进一步分离特定的t细胞亚群,诸如cd3+、cd28+、cd4+、cd8+、cd45ra+和cd45ro+t细胞。例如,可以通过与抗cd3/抗cd28(例如,3
×
28)缀合的珠(诸如dynabeads
tm m-450 cd3/cd28 t)一起孵育足以阳性选择所需t细胞的时间段来分离t细胞。在一个方面,时间段为约30分钟。在另一方面,时间段的范围为30分钟至36小时或更长以及其间的所有整数值。在另一方面,时间段为至少或等于约1、2、3、4、5或6小时。在又一方面,时间段为10至24小时。在一个方面,孵育时间段为约24小时。在与其他细胞类型相比t细胞很少的任何情况下,可以用更长的孵育时间来分离t细胞,诸如从肿瘤组织或免疫功能低下的个体中分离肿瘤浸润性淋巴细胞(til)。此外,使用更长的孵育时间可以提高捕获cd8+t细胞的效率。因此,通过简单地缩短或延长允许t细胞与抗cd3/抗cd28珠结合的时间和/或通过增加或降低珠与t细胞的比率,可以在培养起始或过程中的其他时间点选择支持或反对的t细胞亚群。此外,通过增加或降低珠或其他表面上的抗cd3和/或抗cd28抗体的比率,可以在培养起始或其他所需时间点选择支持或反对的t细胞亚群。在一些情况下,可以使用多轮选择。在某些方面,可以进行选择程序并且“未选择的”细胞(可能不与抗cd3/抗cd28珠结合的细胞)可以用于激活和扩增过程。“未选择”的细胞也可以进行其他轮的选择。
84.通过阴性选择富集t细胞群体可以用针对阴性选择的细胞独有的表面标志物的抗体组合来完成。一种示例方法是通过阴性磁免疫粘附或流式细胞术的细胞分选和/或选择,其使用针对存在于阴性选择的细胞上的细胞表面标志物的单克隆抗体的混合物。例如,为了通过阴性选择富集cd4+细胞,单克隆抗体混合物通常包含针对cd14、cd20、cd11b、cd16、
hla-dr和cd8的抗体。在某些方面,富集或阳性选择通常表达cd4+、cd25+、cd62lhi、gitr+和foxp3+的调节t细胞可能是有用的。或者,在某些方面,通过抗c25缀合的珠或其他类似的选择方法除去t调节细胞。
85.在一个实施方案中,可以选择表达以下中的一种或多种的t细胞群体:ifn-γ、tnf-α、il-17a、il-2、il-3、il-4、gm-csf、il-10、il-13、颗粒酶b和穿孔素,或其他适当的分子,例如其他细胞因子和转录因子,诸如t-bet、eomes、tcf1(人体内的tcf7)。用于筛选细胞表达的方法可以例如通过pct公开号:wo 2013/126712中描述的方法来确定。
86.为了通过阳性或阴性选择分离所需的细胞群体,可以改变细胞和表面(例如,颗粒诸如珠)的浓度。在某些方面,可以减少珠和细胞混合在一起的体积(例如,增加细胞浓度)以确保细胞和珠子的最大接触。例如,在一个方面,使用2十亿个细胞/ml的浓度。在另一个方面,使用1十亿个细胞/ml的浓度。在另一方面,使用大于100百万个细胞/ml。在另一方面,使用至少约10、15、20、25、30、35、40、45或50百万个细胞/ml的细胞浓度。在一些方面,使用至少约75、80、85、90、95或100百万个细胞/ml的细胞浓度。在一些方面,可以使用至少约125或150百万个细胞/ml的细胞浓度。使用高浓度可导致增加的细胞产量、细胞激活和细胞扩增。此外,使用高细胞浓度可以更有效地捕获可能弱表达目标靶抗原的细胞(诸如cd28阴性t细胞)或来自存在许多肿瘤细胞的样品(例如,白血病血液、肿瘤组织等)的细胞。此类细胞群体可能具有治疗价值。例如,使用高浓度的细胞可以更有效地选择可能具有较弱cd28表达的cd8+t细胞。
87.在一些情况下,可以使用较低浓度的细胞。通过显著地稀释t细胞和表面的混合物,可以最小化颗粒与细胞之间的相互作用。这可以选择表达将与颗粒结合的大量所需抗原的细胞。例如,cd4+t细胞可以表达更高水平的cd28,并且可以比稀释浓度的cd8+t细胞更有效地被捕获。在一些方面,使用的细胞浓度为至少约5
×
105个/ml、5
×
106个/ml或更高。在其他方面,使用的浓度可以为约1
×
105个/ml至1
×
106个/ml,以及其间的任何整数值。在其他方面,细胞可以在旋转器上以不同的速度在2℃-10℃或在室温下孵育不同的时间长度。
88.用于刺激的t细胞也可以在洗涤步骤后冷冻。冷冻和随后的解冻步骤可以通过去除细胞群体中的粒细胞和一定程度的单核细胞来提供更均匀的产品。在去除血浆和血小板的洗涤步骤之后,可以将细胞悬浮在冷冻溶液中。虽然许多冷冻溶液和参数在这种情况下是可用的,但可以使用的一种方法包括使用含有20%dmso和8%人血清白蛋白的pbs,或含有10%葡聚糖40和5%右旋糖、20%人血清白蛋白和7.5%dmso或者31.25%plasmalyte-a、31.25%右旋糖5%、0.45%nacl、10%葡聚糖40和5%右旋糖、20%人血清白蛋白和7.5%dmso的培养基,或其他含有hespan和plasmalyte a的合适细胞冷冻培养基。然后将细胞冷冻至-80℃并储存在液氮储罐的气相中。细胞可以通过立即在-20℃下或在液氮中不受控制地凝固来冷冻。在某些方面,如本文所述将冷冻保存的细胞解冻和洗涤,并在激活前在室温下静置一小时。
89.在本公开的情况下还考虑了在可能需要扩增细胞(例如,用于t细胞疗法的表达tcr的工程化细胞)之前的时间段从受试者收集血液样品或单采产品。因此,可以在任何必要的时间点收集要扩增的细胞来源,并且分离并冷冻所需的细胞诸如t细胞,以供之后在t细胞疗法中使用,用于将从t细胞疗法中受益的任何数量的疾病或病状,诸如本文所述的那些。在一些情况下,血液样品或单采产品取自大体健康的受试者。在某些方面,血液样品或
单采产品取自具有患病风险但尚未患病的大体健康的受试者,并且目标细胞被分离和冷冻以供之后使用。在某些方面,t细胞可以在之后扩增、冷冻和使用。在某些方面,样品是在如本文所述的特定疾病诊断后不久但在任何治疗之前从患者处收集的。在另一方面,细胞在任何数量的相关治疗模式之前从受试者的血液样品或单采产品中分离,所述治疗模式包括但不限于用剂(诸如那他珠单抗(natalizumab)、依法利珠单抗(efalizumab)、抗病毒剂)、化学疗法、放射疗法、免疫抑制剂(诸如环孢菌素(cyclosporin)、硫唑嘌呤(azathioprine)、甲氨蝶呤(methotrexate)、霉酚酸酯(mycophenolate)和fk506)、抗体或其他免疫清除剂(诸如campath、抗cd3抗体、环磷酰胺(cytoxan)、氟达拉滨(fludarabine)、环孢菌素、fk506、雷帕霉素(rapamycin)、霉酚酸(mycophenolic acid)、类固醇、fr901228)以及照射进行的治疗。
90.在本公开的另一方面,t细胞是在治疗后直接从患者处获得的,所述治疗给受试者留下功能性t细胞。就这一点而言,已经观察到,在某些癌症治疗,特别是使用损害免疫系统的药物治疗之后,在治疗后不久患者将正常从治疗中恢复的时间段期间,所获得的t细胞的质量可能是最佳的或改善了其体外扩增的能力。因此,在本公开的情况下考虑在此恢复阶段期间收集血细胞,包括t细胞、树突细胞或造血谱系的其他细胞。此外,在某些方面,动员(例如,用gm-csf动员)和调理方案可用于在受试者中产生有利于特定细胞类型的再繁殖、再循环、再生和/或扩增的条件,尤其是在治疗后的限定时间窗口期间。示例性细胞类型包括t细胞、b细胞、树突细胞和免疫系统的其他细胞。
91.除了从受试者处获得的原代t细胞外,用作受体细胞的t细胞还可以是细胞系细胞,例如细胞系t细胞。细胞系t细胞的实例包括但不限于jurkat、ccrf-cem、hpb-all、k-t1、tall-1、molt16/17和hut 78/h9。
92.受体细胞可以是t细胞、b细胞、nk细胞、巨噬细胞、中性粒细胞、粒细胞、嗜酸性粒细胞、红细胞、血小板、干细胞、ipsc或间充质干细胞。此外,受体细胞可以是细胞系细胞。细胞系可以是致瘤细胞系或人工永生化细胞系。细胞系的实例包括但不限于cho-k1细胞;hek293细胞;caco2细胞;u2-os细胞;nih 3t3细胞;nso细胞;sp2细胞;cho-s细胞;dg44细胞;k-562细胞、u-937细胞;mrc5细胞;imr90细胞;jurkat细胞;hepg2细胞;hela细胞;ht-1080细胞;hct-116细胞;hu-h7细胞;huvec细胞;和molt 4细胞。受体细胞可以是自体t细胞或同种异体t细胞。受体细胞可以是遗传修饰的或工程化的细胞。在一些实施方案中,受体细胞表达形成功能性tcr复合物所需的蛋白质(例如,cd3-γ、cd3-δ、cd3-ε、cd3-ζ)。在这些细胞中,外源tcr可以其天然形式表达。在一些实施方案中,受体细胞不表达形成功能性tcr复合物所需的所有蛋白质。在这些细胞中,外源tcr可以工程化形式表达。在一些情况下,工程化形式是单链tcr片段。在一些情况下,工程化形式是tcr-car。
93.抗原呈递细胞(apc)的制备
94.源tcr表达细胞或tcr程序化受体细胞可以与抗原呈递细胞(apc)共培养,使得apc呈递的抗原可以与tcr表达细胞或tcr程序化受体细胞(其可以是t细胞)表达的tcr接触。apc可以是人工apc(aapc)。apc可以是专业apc,诸如树突细胞、巨噬细胞或b细胞。apc可以是单核细胞或单核细胞衍生的树突细胞。aapc可以表达tcr和共刺激分子的配体,并且可以激活和扩增t细胞。aapc可被工程化以表达用于t细胞激活的任何基因。aapc可被工程化以表达用于t细胞扩增的任何基因。aapc可以是珠、细胞、蛋白质、抗体、细胞因子或任何组合。
aapc可将信号传递给可进行基因组移植的细胞群体。例如,aapc可以传递信号1、信号2、信号3或任何组合。信号1可以是抗原识别信号。例如,信号1可以是tcr与肽-mhc复合物的连接或激动性抗体针对cd3的结合,其可导致cd3信号-转导复合物的激活。信号2可以是共刺激信号。例如,共刺激信号可以是分别与icos-l、cd70和4-1bbl结合的抗cd28、诱导型共刺激因子(icos)、cd27和4-1bb(cd137)。信号3可以是细胞因子信号。细胞因子可以是任何细胞因子。细胞因子可以是il-2、il-7、il-12、il-15、il-21或其任何组合。
95.在一些情况下,aapc可用于刺激、激活和/或扩增细胞群体。在一些情况下,aapc可能不诱导同种特异性。在一些情况下,aapc可能不表达hla。aapc可被遗传修饰以稳定表达可用于激活和/或刺激的基因。在一些情况下,k562细胞可用于激活。k562细胞也可用于扩增。k562细胞可以是人红白血病细胞系。k562细胞可被工程化以表达目标基因。k562细胞可能不内源性表达hla i类、ii类或cd1d分子,但可表达icam-1(cd54)和lfa-3(cd58)。k562可以被工程化以向t细胞传递信号1。例如,k562细胞可以被工程化以表达hla i类。在一些情况下,k562细胞可以被工程化以表达其他分子,诸如b7、cd80、cd83、cd86、cd32、cd64、4-1bbl、抗cd3、抗cd3 mab、抗cd28、抗cd28mab、cd1d、抗cd2、膜结合的il-15、膜结合的il-17、膜结合的il-21、膜结合的il-2、截短的cd19或任何组合。在一些情况下,工程化k562细胞除了表达cd80和cd83外,还可表达膜形式的抗cd3 mab、克隆okt3。在一些情况下,工程化k562细胞除了表达cd80和cd83外,还可表达膜形式的抗cd3 mab、克隆okt3、膜形式的抗cd28mab。
96.在一些情况下,刺激t细胞可以用抗原和经照射的组织相容性apc(诸如饲养pbmc)进行。在一些情况下,可以使用非特异性有丝分裂原(诸如pha和同种异体饲养细胞)来使细胞生长。可以以40gy照射饲养pbmc。可以以约10gy至约15gy、约15gy至约20gy、约20gy至约25gy、约25gy至约30gy、约30gy至约35gy、约35gy至约40gy、约40gy至约45gy、约45gy至约50gy照射饲养pbmc。在一些情况下,仅用抗cd3和il-2刺激经照射的饲养细胞的对照烧瓶。
97.aapc可以是珠。球形聚苯乙烯珠可以用肽-mhc复合物和任选的抗cd28抗体包覆,并用于t细胞激活或刺激。珠可以具有任何大小。在一些情况下,珠可以为或者可以为约3微米和6微米。珠的大小可以为或者可以为约4.5微米。可以以任何细胞与珠的比率使用珠。例如,在每毫升1百万个细胞下可以使用3比1的珠与细胞的比率。aapc也可以是刚性球形颗粒、聚苯乙烯乳胶微珠、磁性纳米或微米颗粒、纳米级量子点、聚(乳酸-共-乙醇酸)(plga)微球、非球形颗粒、碳纳米管束、椭圆体plga微粒、纳米蠕虫、含有流体脂质双层的体系、2d支持的脂质双层(2d-slb)、脂质体、raftsomes/微区脂质体、slb颗粒或其任何组合。
98.在一些情况下,aapc可以扩增cd4t细胞。例如,aapc可被工程化以模拟hla ii类限制性cd4t细胞的抗原加工和呈递途径。k562可被工程化以表达hla-d、dpα链、dpβ链、ii、dmα、dmβ、cd80、cd83或其任何组合。例如,可以用hla限制性肽对工程化k562细胞进行脉冲,以便扩增hla限制性抗原特异性cd4t细胞。
99.在一些情况下,aapc的使用可以与外源性引入的细胞因子结合用于t细胞激活、扩增或任何组合。细胞也可以在体内扩增,例如在将基因组移植的细胞施用于受试者后在受试者的血液中扩增。
100.鉴定推定的抗原反应性tcr
101.本文提供的方法可用于从t细胞中鉴定抗原反应性tcr。可以从多个器官诸如外周
血、脾脏、淋巴结和肿瘤中筛选t细胞(例如,源tcr表达细胞),以鉴定识别特定mhc结合抗原或特定mhc结合抗原群体的tcr。使用本文所述的方法获得的多克隆tcr程序化受体细胞可以替代这些应用中的源tcr表达细胞。在这些应用中,受体细胞可以是细胞系细胞,诸如细胞系t细胞。细胞系t细胞的实例包括但不限于jurkat、ccrf-cem、hpb-all、k-t1、tall-1、molt 16/17和hut 78/h9。细胞系t细胞的内源tcr可以被灭活(例如,敲除或敲低)。例如,本文提供的方法可以包括提供表达多个tcr的多个t细胞(例如,源tcr表达细胞),其中多个t细胞中的每个t细胞可以表达多个tcr中的tcr的一个同源对。接下来,可以将编码每个t细胞的tcr的同源对的第一tcr链的第一多核苷酸和编码第二tcr链的第二多核苷酸配对,从而生成多个多核苷酸对。包含多个多核苷酸对的多核苷酸可以被递送到多个受体细胞(例如,tcr程序化受体细胞)中,其中每个受体细胞包含包括多个多核苷酸对中的至少一个多核苷酸对的多核苷酸。多核苷酸可以是多个多核苷酸对或多个多核苷酸对的拷贝。多核苷酸可以是包含多个多核苷酸对的序列的载体(例如,本文所述的表达载体)。多个多核苷酸对可以在多个受体细胞中表达。可以对多个受体细胞的tcr库进行测序,并且可以确定tcr库的tcr在多个受体细胞中的频率。接下来,可以使多个受体细胞与一种或多种抗原接触。在接触后,可以在多个受体细胞的亚型上激活标志物,并且可以基于标志物分离多个受体细胞的亚型。可以对多个受体细胞的亚型的tcr库进行测序,并且可以确定tcr库的tcr在多个受体细胞的亚型中的频率。在多个受体细胞的亚型中的频率高于其在多个受体细胞中的频率的tcr可以被鉴定为推定的靶反应性tcr。
102.本文所述的抗原可以是mhc结合抗原。在一些实施方案中,mhc结合抗原是肽mhc复合物(pmhc)、pmhc四聚物、pmhc低聚物。例如,pmhc可以在链霉亲和素支架上四聚化,或在各种化学支架上低聚化。在一些实施方案中,pmhc、pmhc四聚物、pmhc低聚物被荧光标记以有利于识别pmhc的多克隆tcr程序化受体细胞的facs分选。在一些实施方案中,pmhc、pmhc四聚物、pmhc低聚物可以结合到固体表面以有利于识别pmhc的多克隆tcr程序化受体细胞的富集。表面固体表面可以是颗粒、纳米颗粒、磁性颗粒或磁性纳米颗粒的固体表面。在一些实施方案中,mhc结合抗原呈递于细胞表面。在一些情况下,细胞是抗原呈递细胞(apc)。apc可以是专业apc,诸如树突细胞、巨噬细胞或b细胞。apc也可以是表达mhc或hla的其他细胞(例如人工apc)。例如,来自癌细胞系的细胞可以是apc。在一些实施方案中,apc可以被工程化以仅表达一个i类mhc等位基因。在一些实施方案中,apc可以被工程化以表达任意数量的i类mhc等位基因和ii类mhc等位基因,诸如从一个受试者中分离的所有i类或ii类mhc等位基因。受试者可以是人。人可以是患者。患者可以是癌症患者。
103.在一些实施方案中,mhc结合抗原的表位是明确限定的。例如,在pmhc四聚体中,表位肽可以化学合成。在一些实施方案中,mhc结合抗原的表位是未知的或未明确限定的。例如,抗原蛋白可以在apc中过表达,并且apc可以呈递多个表位。在另一个实例中,一小组蛋白质(例如,至少2种蛋白质、至少3种蛋白质、至少4种蛋白质、至少5种蛋白质、至少10种蛋白质、至少20种蛋白质、至少30种蛋白质、至少40蛋白质或至少50种蛋白质)可以在apc中过表达。在一些情况下,包含可能的表位的抗原片段可以在apc中过表达。例如,抗原可以是编码突变蛋白的部分的多肽,其中突变残基大致在多肽的中间。抗原也可以是编码异常表达的蛋白质的部分的多肽。此种多肽有时被称为合成长肽(slp)。编码此种多肽的多核苷酸有时被称为小基因。一系列5至20个小基因可以与长多肽链中的接头肽串联,有时被称为串联
小基因(tmg)。小基因可以是dna或rna并且可以呈多种形式(例如,质粒、病毒载体、mrna、rna复制子)。根据小基因的形式,可以通过诸如转染、转化、转导和电穿孔的方法将小基因池引入apc。小基因可以编码突变肽(例如,具有点突变)或由于其他遗传或表观遗传异常(诸如融合、缺失、插入、移码、内含子包含、选择性剪接或过表达)而在肿瘤中过表达的肽。可以通过现有技术的基因组、转录组和/或蛋白质组分析(诸如全外显子组测序(wes)、全基因组测序(wgs)、转录组测序(rna-seq)、mhc-肽洗脱质谱或其组合)在肿瘤样品中鉴定此类肽。在另一个实例中,未知数量的蛋白质可以在apc中过表达,并且在此类情况下,可以将cdna池递送(例如,使用本文所述的载体进行的转染、电穿孔或其他递送方法)到apc中。
104.在一些实施方案中,通过将抗原编码dna或mrna转染到apc中可以将抗原引入apc。在一些实施方案中,可以将抗原作为蛋白质添加到apc的培养基中。在一些实施方案中,可以将抗原作为肽添加到apc的培养基中。
105.抗原可以是靶抗原。抗原可以是肿瘤抗原。抗原可以包括肿瘤特异性抗原、肿瘤相关抗原、表达肿瘤特异性抗原的细胞、表达肿瘤相关抗原的细胞、肿瘤上的胚胎抗原、自体肿瘤细胞、肿瘤特异性膜抗原、肿瘤相关膜抗原、生长因子受体、生长因子配体或与癌症相关连的任何其他类型的抗原或抗原呈递细胞或材料。肿瘤抗原可以是肿瘤特异性抗原(tsa)。如本文所用,术语“tsa”是指肿瘤细胞独有的并且不存在于体内其他细胞上的抗原。肿瘤抗原可以是肿瘤相关抗原(taa)。如本文所用,术语“taa”是指不是肿瘤细胞独有的并且也在正常细胞上表达的抗原。抗原在肿瘤上的表达可以发生在使免疫系统能够对抗原作出反应的条件下。taa可以在肿瘤细胞上以高得多的水平表达。taa可以通过对患者的肿瘤细胞进行测序并鉴定仅在肿瘤中发现的突变蛋白来确定。这些抗原被称为“新抗原”。肿瘤抗原可以是上皮癌抗原、前列腺特异性癌抗原(psa)或前列腺特异性膜抗原(psma)、膀胱癌抗原、肺癌抗原、结肠癌抗原、卵巢癌抗原、脑癌抗原、胃癌抗原、肾细胞癌抗原、胰腺癌抗原、肝癌抗原、食道癌抗原、头颈癌抗原、结直肠癌抗原、淋巴瘤抗原、b细胞淋巴瘤癌抗原、白血病抗原、骨髓瘤抗原、急性淋巴母细胞白血病抗原、慢性髓样白血病抗原或急性骨髓性白血病抗原。抗原的实例包括但不限于1gh-igk、43-9f、5t4、791tgp72、9d7、亲环素(acyclophilin)c相关蛋白、甲胎蛋白(afp)、α-辅肌动蛋白-4、a3、a33抗体特异性抗原、art-4、b7、ba 733、bage、bcr-abl、β-连环蛋白、β-hcg、bre3-抗原、bca225、bing-4、brca1/2、btaa、ca125、ca 15-3\ca27.29\bcaa、ca195、ca242、ca-50、钙激活氯离子通道2、cage、cam43、camel、cap-1、碳酸酐酶ix、c-met、ca19-9、ca72-4、cam 17.1、casp-8/m、cccl19、cccl21、cd1、cd1a、cd2、cd3、cd4、cd5、cd8、cd11a、cd14、cd15、cd16、cd18、cd19、cd20、cd21、cd22、cd23、cd25、cd29、cd30、cd32b、cd33、cd37、cd38、cd40、cd40l、cd44、cd45、cd46、cd52、cd54、cd55、cd59、cd64、cd66a-e、cd67、cd68、cd70、cd70l、cd74、cd79a、cd79b、cd80、cd83、cd95、cd126、cd132、cd133、cd138、cd147、cd154、cdc27、cdk4、cdk4m、cdkn2a、cml6/6、co-029、ctla4、cxcr4、cxcr7、cxcl12、细胞周期蛋白b、hif-1a、结肠特异性抗原-p(csap)、cea(ceacams)、ceacam6、c-met、dam、e2a-prl、egfr、egfrviii、egp-1(trop-2)、egp-2、elf2-m、ep-cam、epha3、成纤维细胞生长因子(fgf)、fgf-5、纤连蛋白、flt-1、flt-3、叶酸受体、g250抗原、ga733vepcam、gage、gp100、gro-β、h4-ret、hla-dr、hm1.24、人绒毛膜促性腺激素(hcg)及其亚基、hmgb-1、缺氧诱导因子(hif-1)、hsp70-2m、hst-2、htgp-175、ia、igf-1r、ifn-γ、ifn-α、ifn-β、ifn-λ、il-4r、il-6r、il-13r、il-15r、il-17r、il-18r、il-2、il-6、
il-8、il-12、il-15、il-17、il-18、il-23、il-25、未成熟层粘连蛋白受体、胰岛素样生长因子-1(igf-1)、kc4-抗原、ksa、ks-1-抗原、ks1-4、lage-1a、le-y、ldr/fut、m344、ma-50、巨噬细胞迁移抑制因子(mif)、mage、mage-1、mage-3、mage-4、mage-5、mage-6、mart-1、mart-2、trag-3、mc1r、mcrp、mcp-1、间皮素、mip-1a、mip-1b、mif、mg7-ag、mov18、muc1、muc2、muc3、muc4、mucsac、muc13、muc16、mum-1/2、mum-3、myl-rar、nb/70k、nm23h1、numa、nca66、nca95、nca90、ny-eso-1、p多肽、p15、p16、p53、p185erbb2、p180erbb3、pam4抗原、胰腺癌粘蛋白、pd1受体(pd-1)、pd-1受体配体1(pd-l1)、pd-1受体配体2(pd-l2)、pi5、胎盘生长因子、p53、plagl2、pme117前列腺酸性磷酸酶、psa、prame、psma、p1gf、ilgf、ilgf-1r、il-6、il-25、rcas1、rs5、rage、rantes、ras、t101、sage、sap-1、5100、ssx-2、生存素、生存素-2b、sddcag16、ta-90\mac2结合蛋白、taal6、tac、tag-72、tgf-βrii、ig tcr、tlp、端粒酶、肌键蛋白、trail受体、trp-1、trp-2、tsp-180、tnf-α、tn抗原、thomson-friedenreich抗原、肿瘤坏死抗原、酪氨酸酶、vegfr、ed-b纤连蛋白、wt-1、xage、17-1a抗原、补体因子c3、c3a、c3b、c5a、c5、血管生成标志物bc1-2、bc1-6以及癌基因标志物和癌基因产物k-ras。
106.识别mhc结合抗原的tcr程序化受体细胞可以从不识别mhc结合抗原的tcr程序化受体细胞中选择。当tcr程序化受体细胞用于此目的(例如,富集或鉴定识别抗原的tcr)时,它们也可以称为tcr程序化报告细胞或tcr工程化报告细胞。选择可以基于与可溶的、荧光标记的或表面结合的pmhc、pmhc四聚物或pmhc低聚物的结合。选择可以基于在tcr程序化受体细胞接触mhc结合抗原之后所述细胞上标志物(例如,t细胞激活标志物)的表达。标志物可以是细胞表面标志物。细胞表面标志物可以是cd39、cd69、cd103、cd25、pd-1、tim-3、ox-40、4-1bb、cd137、cd3、cd28、cd4、cd8、cd45ra、cd45ro、gitr、foxp3以及其他t细胞激活标志物或其组合。选择可以基于钙流入。标志物可以是细胞内蛋白或分泌蛋白。细胞内蛋白可以是转录因子或者可以是磷酸化蛋白。分泌蛋白可以是细胞因子或趋化因子(例如,ifn-γ、tnf-α、il-17a、il-2、il-3、il-4、gm-csf、il-10、il-13、颗粒酶b、穿孔素或其组合)。当使用分泌蛋白作为标志物时,可以将蛋白质运输抑制剂添加到细胞中。蛋白质运输抑制剂可以是高尔基体阻滞剂。高尔基体阻滞剂可以是布雷菲德菌素a(brefeldin a)、莫能菌素(monensin)等。分泌蛋白可以是il-2、il-10、il-15、tnf-α或inf-γ。选择也可以基于报告基因表达或报告蛋白。报告蛋白可以是荧光蛋白(诸如gfp和mcherry)。报告基因可表达以在受tcr信号传导调节的转录因子的控制下。这些转录因子的实例包括但不限于ap-1、nfat、nf-κ-b、runx1、runx3等。如本文所述,在一些情况下,在选择之前,tcr程序化受体细胞的选择前池可包含至少约0.001%、0.01%、0.1%、0.2%、0.5%、0.8%、1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%、5%、5.5%、6%、6.5%、7%、7.5%、8%、8.5%、9%、9.5%、10%、15%、20%、25%或更多的靶反应性tcr。在一些情况下,tcr程序化受体细胞的选择前池可包含至多约30%、25%、20%、15%、10%、5%、3%、1%、0.5%、0.1%、0.01%或更少的靶反应性tcr。选择后,靶反应性tcr的百分比可以在tcr程序化受体细胞的选择后池中富集。tcr程序化受体细胞的选择后池可包含至少约1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%、5%、5.5%、6%、6.5%、7%、7.5%、8%、8.5%、9%、9.5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%或更多的靶反应性tcr。
107.在一些实施方案中,基于上述标准选择的tcr程序化受体细胞可以繁殖并再次进行选择,以便进一步富集识别mhc结合抗原的tcr。在一些实施方案中,从所选择的tcr程序
化受体细胞中分离的tcr表达载体中的融合的tcr多核苷酸可以被扩增并转化为tcr表达载体。并且这些tcr表达载体可用于获得新的tcr程序化受体细胞群体。这些细胞可以再次进行选择,以便进一步富集识别mhc结合抗原的tcr。
108.在不一定知道抗原、表位或呈递mhc的身份的情况下快速鉴定肿瘤反应性tcr可以在癌症免疫疗法中具有广泛的应用,并且可以通过本文所述的大规模平行tcr克隆技术或高通量tcr合成技术结合基于报告基因的选择方法来实现。
109.下面概述了基于报告基因的选择方法的示例方案。报告细胞系可以是t细胞系(例如,jurkat)。报告细胞系可以携带由tcr信号传导(例如nfat、nf-κ-b、nur77)控制的启动子驱动的报告基因(例如荧光蛋白或可染色的细胞表面蛋白)。任选地,报告细胞系的内源tcr可以被敲除。报告细胞可以用从t细胞(例如,肿瘤浸润性t细胞)群体获得的多克隆tcr表达慢病毒载体进行转导,其中一些t细胞是肿瘤反应性的(或肿瘤特异性的)。转导的报告细胞可以与肿瘤细胞、肿瘤组织、肿瘤球或被工程化以表达肿瘤基因的apc(自体apc或被工程化以表达自体mhc的同种异体apc)(即,肿瘤mrna负载的apc,其已被研究作为癌症疫苗)一起孵育。如果转导到报告细胞系中的tcr是肿瘤反应性的,则报告细胞中的报告基因或标志物基因可以以更高(或在一些情况下更低)水平表达,并且可以鉴定(例如,使用facs或macs选择/分离/富集)所述细胞。任选地,可以对鉴定的肿瘤反应性tcr进行测序。来自所分选的细胞的已经融合的tcr可以简单地进行pcr扩增并分批克隆到tcr表达载体中。任选地,例如通过挑选承载tcr表达载体的大肠杆菌(e.coli)菌落,可以获得个别tcr。
110.在一些实施方案中,所选择/分离/富集的报告基因阳性或标志物阳性细胞(例如,选择后tcr程序化受体细胞)不是纯粹的抗原反应性或肿瘤反应性的。然而,抗原反应性或肿瘤反应性细胞在所选择/分离/富集的tcr程序化受体细胞中的频率或相对丰度可能仍然高于在选择之前的tcr程序化受体细胞(例如,选择前tcr程序化受体细胞)中的频率或相对丰度。为了有利于鉴定抗原反应性或肿瘤反应性tcr,可以对选择后tcr程序化受体细胞的tcr库进行测序。在一些实施方案中,也可以对选择前tcr程序化受体细胞的tcr库进行测序。如果tcr在选择后tcr程序化受体细胞中的频率比所述tcr在选择前tcr程序化受体细胞中的频率高至少1.5倍、1.8倍、2.0倍、2.5倍、3.0倍、4.0倍、4.5倍、5.0倍、5.5倍、6.0倍、6.5倍、7.0倍、7.5倍、8.0倍、8.5倍、9.0倍、9.5倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍或更多倍,则所述tcr可被视为推定的抗原反应性或肿瘤反应性tcr。
111.在一些实施方案中,为了进一步确保tcr得以富集,可以进行阴性对照选择,因为tcr识别预期抗原而不是非预期抗原。提供预期抗原的选择可称为“预期选择”。在阴性对照选择中,可以提供一种或多种非预期抗原以结合在tcr程序化受体细胞上表达的tcr。例如,如果预期抗原是一组突变抗原(例如,新抗原),则非预期抗原可以是新抗原的野生型对应物。例如,新抗原的小基因序列可以编码序列teyklvvvga[d]gvgksaltiqliqn,它是kras g12d蛋白的片段,其中中括号中的“d”残基是突变残基。这种新抗原的野生型对应物可以是teyklvvvga[g]gvgksaltiqliqn,其中中括号中的“g”是野生型残基。可以通过分选(诸如facs和macs)来选择/分离/富集来自阴性对照选择的报告基因阳性或标志物阳性的tcr程序化受体细胞。如果tcr在来自预期选择的所选择/分离/富集的细胞中的频率大幅高于来自阴性对照选择的频率,则所述tcr可被视为推定的抗原反应性tcr。
[0112]
可以将编码新抗原的小基因池引入apc,所述apc可以与tcr程序化受体细胞混合。
可以通过分选(诸如facs和macs)来选择/分离/富集报告基因阳性或标志物阳性的tcr程序化受体细胞,从而产生第一选择后tcr程序化受体细胞群体。平行地,可以如下进行阴性对照选择。可以将编码新抗原的野生型对应物的小基因池引入另一批apc,所述apc可以与tcr程序化受体细胞混合。可以通过分选(诸如facs和macs)来选择/分离/富集报告基因阳性或标志物阳性的tcr程序化受体细胞,从而产生第二选择后tcr程序化受体细胞群体。如果tcr在第一选择后tcr程序化受体细胞中的频率比所述tcr在第二选择后tcr程序化受体细胞中的频率高至少1.5倍、1.8倍、2.0倍、2.5倍、3.0倍、4.0倍、4.5倍、5.0倍、5.5倍、6.0倍、6.5倍、7.0倍、7.5倍、8.0倍、8.5倍、9.0倍、9.5倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍或更多,则tcr可被视为推定的新抗原反应性tcr。
[0113]
作为另一个实例,可以将来自癌组织(例如,结肠癌组织)的扩增的总mrna引入一批apc以用于预期选择。平行地,可以将来自同一器官的健康组织(例如,健康结肠组织)的扩增的总mrna引入另一批apc以用于阴性对照选择。
[0114]
为了对tcr库进行测序并分析每个tcr在细胞群体中的频率,可以分析β链的cdr3序列或α链的cdr3序列或它们两者。可以扩增编码cdr3序列的核酸分子(例如,dna或mrna)以分析tcr库。
[0115]
例如,本文提供的方法可以包括提供表达多个tcr的多个t细胞,其中多个t细胞中的每个t细胞可以表达多个tcr中的tcr的一个同源对。接下来,可以将编码每个t细胞的tcr的同源对的第一tcr链的第一多核苷酸和编码第二tcr链的第二多核苷酸配对,以生成多个多核苷酸对。包含多个多核苷酸对的多核苷酸可以被递送到第一多个受体细胞和第二多个受体细胞中,其中第一或第二多个受体细胞中的每个受体细胞可以包含包括多个多核苷酸对的至少一个多核苷酸对的多核苷酸。多个多核苷酸对可以在第一和第二多个受体细胞中表达。第一多个受体细胞可以与第一抗原接触,从而激活第一多个受体细胞的第一亚型的第一标志物。第二多个受体细胞可以与第二抗原接触,从而激活第二多个受体细胞的第二亚型的第二标志物。第二抗原和第一抗原可能不同源。第一抗原和第二抗原可以衍生自相同的蛋白质。第一抗原可以包含突变序列,并且第二抗原可以包含野生型序列。第一抗原可以衍生自癌细胞,并且第二抗原可以衍生自健康细胞。例如,第一抗原可以是新抗原,并且第二抗原可以是野生型抗原。接下来,可以基于第一标志物分离第一亚型,并且可以基于第二标志物分离第二亚型。接下来,可以对第一多个受体细胞的第一亚型的tcr库和第二多个受体细胞的第二亚型的tcr库进行测序。可以确定tcr库的tcr在第一多个受体细胞的第一亚型中的频率以及tcr库的tcr在第二多个受体细胞的第二亚型中的频率。在第一多个受体细胞的第一亚型中的频率高于其在第二多个受体细胞的第二亚型中的频率的tcr可以被鉴定为推定的靶反应性tcr。任选地,所述方法还可以包括,在接触之前,对多个受体细胞的tcr库进行测序,并确定tcr库的tcr在多个受体细胞中的频率。
[0116]
本文所述的方法可以鉴定肿瘤反应性tcr,用于个性化tcr-t疗法或免疫监测测试以量化患者肿瘤组织或外周血中的肿瘤反应性t细胞。例如,可以从癌症患者获得肿瘤活检。外周或肿瘤浸润性t细胞也可以从同一患者处获得。使用现有方法可以选择/分离/富集表达某种标志物(例如,pd1、cd137、cd39、cd69、tim3)或其组合的t细胞。例如,使用本文所述的基于单细胞反应器的方法,可以将来自外周t细胞或其亚群的tcr克隆到tcr表达载体中。使用测序(例如,单细胞rna-seq)可以获得来自具有特定转录组特征的t细胞群体(例
如,幼稚样、耗尽、记忆、干细胞记忆或中央记忆tcf7+)的信息上配对的tcr序列。配对的tcr编码多核苷酸和tcr表达载体可以使用基因组装方法(诸如本文所述的tcr基因自组装方法)来合成。
[0117]
如本文所述,这些tcr继而可用于工程化tcr工程化报告细胞系(例如受体细胞)。同时,可以从外周血中扩增hla基因。不表达人hla的apc细胞系(例如,不表达或表达非常低水平的mhc的人细胞系(诸如k562和721.221)、非人灵长类动物细胞系(诸如cos-7)或敲除内源hla的人细胞系)可以被工程化以表达患者的hla基因。来自患者的自体apc(例如,单核细胞衍生的树突细胞、树突细胞、巨噬细胞和b细胞)也可以用作apc。来自肿瘤样品(例如,手术样品或活检)的全长mrna可以被分离、扩增并转染到上述自体或hla工程化同种异体apc以产生肿瘤mrna负载的apc。肿瘤样品可以是活检样品,诸如核芯活检或细针活检样品。这些样品可能具有小体积(例如,《1000mm3、《500mm3、《100mm3、《50mm3),因为即使是小体积的肿瘤样品也可以含有足够的待扩增的mrna。在一些情况下,肿瘤样品的体积可以等于或为最多约2000mm3、1000mm3、800mm3、500mm3、100mm3、50mm3或20mm 3
。因此,这种方法可适用于难以获得大型手术肿瘤样品的情况。tcr工程化报告细胞和肿瘤mrna负载的apc可以共同孵育,并且可以如上所述分离肿瘤反应性的报告基因表达细胞。可以对来自分离的细胞的tcr进行测序,以提供肿瘤反应性tcr的序列和丰度。可以发布包含此类信息的报告。这种方法可以与常规的tcr库分析相结合,以提高肿瘤反应性tcr丰度的准确性。本段中所述的获得工程化apc和肿瘤mrna负载的apc的方法也可以用于本公开其他地方所述的方法中。
[0118]
例如,鉴定多个靶反应性t细胞受体(tcr)的方法可以包括提供表达tcr群体的细胞群体。tcr群体对于细胞群体可能是外源的。tcr群体可以包含不同的同源对,例如,至少约5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、500、1,000、10,000、1,000,000个或更多个不同的同源对。tcr群体可以包含来自至少约2、5、10、15、20、25、30、35、40个或更多个不同v基因的v区。tcr群体可以包含至少100种不同的vj组合。所述方法还可以包括使细胞群体与一种或多种靶抗原接触,其中多个靶反应性tcr与一种或多种靶抗原结合。然后可以分离或富集多个靶反应性tcr。在一些情况下,可以分离或富集多个至少约5、10、15、20、30、50、100、200、300、400、500、600个或更多个靶反应性tcr。细胞群体可以是工程化细胞、未耗尽的细胞或未从患者分离的细胞。所述方法还可以包括使细胞群体与一种或多种靶抗原接触,其中多个靶反应性tcr可以与一种或多种靶抗原结合。然后可以分离或富集多个至少5个靶反应性tcr。tcr群体可以包含至少约100、200、500、1,000、10,000、100,000、1,000,000或10,000,000个不同的同源对。多个靶反应性tcr包含来自至少10个、至少15个、至少20个或更多个不同v基因的v区。在一些情况下,细胞群体与呈递一种或多种靶抗原的肿瘤细胞或抗原呈递细胞接触。靶抗原可以是肿瘤抗原或组织特异性抗原。一种或多种靶抗原可以与主要组织相容性复合物(mhc)复合。mhc可以是mhc四聚物。所述方法还可以包括将多个靶反应性tcr中的至少一种靶反应性tcr施用于受试者。在一些情况下,细胞群体中的细胞或工程化细胞可以包含报告基因。当细胞的tcr与所述一种或多种靶抗原中的靶抗原结合时,可以调节报告基因以发送信号。细胞群体或工程化细胞可以是细胞系细胞(例如,jurkat细胞)。
[0119]
例如,鉴定多个靶反应性t细胞受体(tcr)的方法可以包括提供表达多个tcr的多个t细胞。多个tcr可以包含至少5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、
90、95、100、500、1,000、10,000、1,000,000个或更多个不同的同源对,所述同源对包含来自至少约2、5、10、15、20、25、30、35个或更多个不同v基因的v区。所述方法还可以包括物理连接编码多个tcr中的每个tcr的tcrα(或γ)链的第一多核苷酸和编码tcrβ(或δ)链的第二多核苷酸,从而生成多个融合的多核苷酸。多个融合的多核苷酸可以在多个细胞中表达,其中多个细胞的亚型表达多个靶反应性tcr。多个细胞可以与一种或多种靶抗原接触以鉴定多个靶反应性tcr。表达多个靶反应性tcr的多个细胞的亚型可以与一种或多种靶抗原结合。可以分离或富集多个细胞的亚型,从而分离或富集多个靶反应性tcr。
[0120]
例如,鉴定多个靶反应性t细胞受体(tcr)的方法可以包括提供表达多个tcr的多个t细胞。多个tcr可以包含至少5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、500、1,000、10,000、1,000,000个或更多个不同的同源对,所述同源对包含来自至少2、5、10、15、20、25、30、35个或更多个不同v基因的v区。所述方法还可以包括在不使用任何条形码(例如单细胞条形码)的情况下对多个tcr的一个或多个同源对进行测序。例如,测序可以包括对多个tcr的一个或多个同源对的tcr链进行测序,其中tcr链不包含相同的条形码。然后可以例如以可溶形式或在多个细胞中表达编码多个tcr或其亚型的一个或多个同源对。用于表达一个或多个同源对的多个细胞可以是细胞系细胞。多个tcr或其亚型可以包括多个靶反应性tcr。然后可以使多个tcr与一种或多种靶抗原接触以鉴定靶反应性tcr。多个靶反应性tcr可以与一种或多种靶抗原结合,然后可以被分离或富集。在一些情况下,当鉴定tcr的同源对时,可以物理连接编码多个tcr中每个tcr的tcrα链的第一多核苷酸和编码tcrβ链的第二多核苷酸,从而生成多个融合的多核苷酸。所述方法还可以包括对多个tcr的一个或多个同源对进行测序。多个t细胞可以分离自受试者。多个t细胞可以是肿瘤浸润性t细胞。多个t细胞可以包括耗尽的t细胞。多个靶反应性tcr可以通过facs分离或富集。可以通过细胞表面标志物或细胞因子标志物分离多个靶反应性tcr。例如,可以通过使用对表面标志物诸如cd69、cd25或41bb具有特异性的抗体分离或富集靶反应性tcr,以通过facs进行分选。
[0121]
在一些情况下,可以将从样品中分离的多个t细胞在体外与例如呈递抗原的apc一培养并用所述apc刺激,并且可以富集多个t细胞的亚型。然后这些预富集的t细胞可以用于鉴定靶反应性tcr。例如,当从血液样品或pbmc样品中分离多个t细胞时,多个t细胞中的一小部分可能是靶反应性t细胞。在此类情况下,可以首先使多个t细胞与一种或多种靶抗原(例如,呈mhc四聚物形式或存在于细胞表面上)接触以激活t细胞。可以基于标志物(例如,表面标志物)来富集或分离多个t细胞的亚型,然后所述标志物可以用于本文所述的后续鉴定方法,包括融合同源tcr链。预富集的t细胞也可以进行其他方法来鉴定同源对,例如,使用测序。测序可以使用单细胞条形码(例如,将t细胞划分成单独的区室,对从单个细胞释放的核酸加条形码,对所述核酸进行测序并基于相同的条形码将来自单细胞的tcr链配对)。
[0122]
在一些情况下,本文提供的方法可以包括提供表达多个tcr的多个细胞,多个细胞中的每个细胞表达多个tcr中的tcr。多个tcr可以包含至少5、10、20、50个或更多个不同的同源对。在一些情况下,多个tcr还可以包含来自多个v基因的v区。多个tcr对于多个细胞可以是外源的。任选地,可以对多个细胞的tcr库进行测序,并且可以确定tcr库的tcr在多个细胞中的频率。多个细胞可以与一种或多种抗原接触,从而激活多个细胞的亚型的标志物。可以基于标志物分离多个细胞的亚型。接下来,在分离之后,可以对多个细胞的亚型的tcr
库进行测序,并且可以确定tcr库的tcr在多个细胞的亚型中的频率。在多个细胞的亚型中的频率高于其在多个细胞中的频率的tcr可以被鉴定为推定的靶反应性tcr。
[0123]
在一些情况下,本文提供的方法可以包括提供表达多个tcr的第一多个细胞和表达多个tcr的第二多个细胞,第一或第二多个细胞中的每个细胞表达多个tcr中的tcr。第一多个细胞和第二多个细胞可以来自同一样品。例如,第一多个细胞和第二多个细胞可以是同一样品的两个等分试样。多个tcr可以包含至少5、10、20、50个或更多个不同的同源对。在一些情况下,多个tcr还可以包含来自多个v基因的v区。多个tcr对于第一或第二多个细胞是外源的。接下来,可以使第一多个细胞与第一抗原接触,从而激活第一多个细胞的第一亚型的第一标志物,并且可以使第二多个细胞与第二抗原接触,从而激活第二多个细胞的第二亚型的第二标志物。可以基于第一标志物分离第一亚型,并且可以基于第二标志物分离第二亚型。可以对第一多个细胞的第一亚型的tcr库和第二多个细胞的第二亚型的tcr库进行测序。可以确定tcr库的tcr在第一多个细胞的第一亚型中的频率和tcr库的tcr在第二多个细胞的第二亚型中的频率。在第一多个细胞的第一亚型中的频率高于其在第二多个细胞的第二亚型中的频率的tcr可以被鉴定为推定的靶反应性tcr。频率可以通过特定tcr的测序读数除以tcr库的总测序读数来确定。在一些情况下,频率可以通过特定tcr的独特分子索引(umi)计数除以tcr库的总umi计数来确定。在使用标准方案制备测序文库时,可以将umi添加到待测序的核酸分子中。
[0124]
本文所述的鉴定的推定靶反应性tcr可以从tcr程序化受体细胞的选择前或选择后池中分离。在一些情况下,可以合成(例如,化学合成)鉴定的推定靶反应性tcr。在一些情况下,可以使用核酸扩增方法诸如拨出pcr(dial-out pcr)从选择前或选择后池中选择(例如,扩增或拨出)鉴定的推定靶反应性tcr。例如,在本文所述的各种情况下,编码tcr的多核苷酸(例如,可表达tcr多核苷酸文库的多核苷酸)可以包含条形码。条形码可以是池中特定tcr序列的独特条形码。可以任意设计条形码的序列。条形码的序列可被设计成避免常见的缺陷,诸如不需要的二级结构、限制性位点、与tcr基因中其他序列的相似性、或引物结合位点之间的相似性。条形码的长度可以为至少约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40个或更多个核苷酸。条形码可以是添加到配对的tcr序列的其他序列,或已包含在配对的tcr池的每个序列中的序列。例如,当使用本文所述的自组装生成配对的tcr时,连接序列或其部分可以用作条形码。又例如,当制备可表达tcr多核苷酸文库时,可以在载体中引入条形码序列。然后可以使用靶向条形码序列和共同序列的引物对来扩增鉴定的推定靶反应性tcr。
[0125]
配对tcr的方法
[0126]
从源tcr表达细胞中获得的多克隆tcr可以在物理或信息上配对。本文提供了用于配对tcr的方法的实例。
[0127]
基于单细胞反应器的方法
[0128]
来自源tcr表达细胞的tcr可以在单细胞反应器内配对(例如,物理融合)。单细胞反应器可以是区室,在其中来自单个生物颗粒(例如,单细胞)的目标分子可以与试剂反应或彼此反应。单细胞反应器可包含两种组分:(1)可以与来自单细胞的目标分子缔合的固体支持物,以及(2)用于发生生化反应的水性内容物。单细胞反应器中的目标分子可能会发生反应,在此期间来自不同细胞的目标分子不会彼此接触或混合。目标分子可以是核酸、蛋白
质或细胞中存在的其他分子。核酸可以是dna、rna、mrna、mirna、trna等。核酸可以编码免疫受体或免疫受体链。单细胞反应器可以是区室或容器。区室或容器可以是液滴、管、孔、阵列上的离散区域或硬化颗粒(例如,水凝胶颗粒)。
[0129]
在一个方面,用于制备融合的二分体免疫受体多核苷酸文库的方法可以包括:(a)生成多个容器,每个容器包含(1)细胞,其中所述细胞包含编码二分体免疫受体的第一肽链的第一核酸和编码二分体免疫受体的第二肽链的第二核酸,和(2)多个可聚合或可胶凝聚合物和/或单体;以及(b)聚合或胶凝多个可聚合或可胶凝聚合物和/或单体以形成多个硬化颗粒,多个硬化颗粒中的每个具有由聚合或胶凝的多个聚合物和/或单体构成的基体,其中多个硬化颗粒中的每个包含第一核酸的第一引物延伸产物和第二核酸的第二引物延伸产物;其中第一引物延伸产物和第二引物延伸产物嵌入或封闭在基体内,并且其中第一引物延伸产物和第二引物延伸产物的扩散受到限制。
[0130]
第一和第二引物延伸产物可以是逆转录(rt)产物、第二链合成(sss)产物或扩增产物。第一和/或第二引物延伸产物可以包含衔接子序列。在一些实施方案中,衔接子序列不能与第一或第二核酸分子杂交或互补。在一些实施方案中,第一和第二引物延伸产物编码可变结构域。在一些实施方案中,可变结构域包括cdr1、cdr2和cdr3。在一些实施方案中,第一和/或第二引物延伸产物还编码恒定结构域。
[0131]
在一些实施方案中,所述方法还包括裂解细胞以释放第一核酸和第二核酸。在一些实施方案中,所述方法还包括逆转录第一核酸和第二核酸。在一些实施方案中,逆转录通过使用rt引物进行。在一些实施方案中,rt引物与扩散限制剂连接,其中扩散限制剂限制rt引物在基体内的扩散。在一些实施方案中,所述方法还包括进行模板转换反应或sss反应。在一些实施方案中,所述方法还包括扩增第一核酸和第二核酸以生成第一和第二扩增产物。在一些实施方案中,对于第一或第二核酸中的每个,通过使用第一扩增引物和第二扩增引物进行扩增。在一些实施方案中,第一扩增引物与扩散限制剂连接,其中扩散限制剂限制第一扩增引物在基体内的扩散。
[0132]
在一些实施方案中,所述方法还包括洗涤多个硬化颗粒。在一些实施方案中,所述方法还包括洗涤多个硬化颗粒以允许试剂从多个硬化颗粒中扩散出来。在一些实施方案中,试剂包括rt引物、扩增引物、模板转换引物、sss引物或其任何组合。在一些实施方案中,所述方法还包括重复洗涤多个硬化颗粒。在一些实施方案中,所述方法还包括在洗涤步骤之后将多个硬化颗粒在油中乳化,从而形成其他多个容器,其他多个容器中的每个容器包含所述多个硬化颗粒中的单个硬化颗粒。在一些实施方案中,第一和第二引物延伸产物与扩散限制剂连接。在一些实施方案中,扩散限制剂是聚合物。在一些实施方案中,聚合物是聚丙烯酰胺、聚乙二醇或多糖。在一些实施方案中,扩散限制剂是颗粒。在一些实施方案中,颗粒的直径大于基体的孔径。在一些实施方案中,扩散限制剂是基体。在一些实施方案中,第一和第二引物延伸产物通过捕获剂连接至扩散限制剂。在一些实施方案中,捕获剂包含固定部分。在一些实施方案中,固定部分将捕获剂连接到扩散限制剂。
[0133]
在一些实施方案中,固定部分包含反应性基团。在一些实施方案中,捕获剂还包含靶向部分。在一些实施方案中,靶向部分是捕获寡核苷酸。在一些实施方案中,第一扩增引物包含与捕获寡核苷酸杂交的寡核苷酸序列。在一些实施方案中,第一和第二扩增产物包含与捕获寡核苷酸杂交的寡核苷酸序列,从而将第一和第二扩增产物与捕获剂连接,并因
此与扩散限制剂连接。在一些实施方案中,反应性基团是琥珀酰亚胺酯、酰胺、丙烯酰胺、酰基叠氮、酰基卤化物、酰基腈、醛、酮、烷基卤化物、烷基磺酸盐、酸酐、芳基卤化物、氮丙啶、硼酸酯、碳二亚胺、重氮烷、环氧化物、卤代乙酰胺、卤代铂酸盐、卤代三嗪、亚氨基酯、异氰酸酯、异硫氰酸酯、马来酰亚胺、亚磷酰胺、甲硅烷基卤化物、磺酸酯、磺酰基卤化物、胺、苯胺、硫醇、醇、苯酚、肼、羟胺、羧酸、二醇或杂环。在一些实施方案中,所述方法还包括连接第一扩增产物和第二扩增产物以在其他多个容器中的每个容器内形成融合的二分体免疫受体多核苷酸,从而生成具有多个融合的二分体免疫受体多核苷酸的融合的二分体免疫受体多核苷酸文库。在一些实施方案中,第一扩增产物和第二扩增产物通过连接或pcr连接在一起。在一些实施方案中,第一扩增产物和第二扩增产物通过磷酸二酯键连接在一起以形成连续多核苷酸。在一些实施方案中,第一扩增产物和第二扩增产物框内连接。
[0134]
在一些实施方案中,所述方法还包括从其他多个容器中释放多个融合的二分体免疫受体多核苷酸。在一些实施方案中,所述方法还包括环化多个融合的二分体免疫受体多核苷酸中的每个。在一些实施方案中,所述方法还包括将多个融合的二分体免疫受体多核苷酸中的每个插入载体中。在一些实施方案中,载体是自扩增rna复制子、质粒、噬菌体、转座子、粘粒、病毒或毒粒。在一些实施方案中,载体是病毒载体。在一些实施方案中,病毒载体衍生自逆转录病毒、慢病毒、腺病毒、腺相关病毒、疱疹病毒、痘病毒、α病毒、痘苗病毒、乙型肝炎病毒、人乳头瘤病毒或其假型。在一些实施方案中,载体是非病毒载体。在一些实施方案中,非病毒载体是纳米颗粒、阳离子脂质、阳离子聚合物、金属纳米聚合物、纳米棒、脂质体、胶束、微泡、细胞穿透肽或脂球。在一些实施方案中,二分体免疫受体是t细胞受体(tcr)。在一些实施方案中,tcr包含tcrα肽链和tcrβ肽链,或tcrγ肽链和tcrδ肽链。在一些实施方案中,细胞是免疫细胞。在一些实施方案中,免疫细胞是淋巴细胞。在一些实施方案中,淋巴细胞是t细胞。在一些实施方案中,t细胞是炎性t细胞、细胞毒性t细胞、调节t细胞、辅助t细胞、自然杀伤t细胞或其组合。在一些实施方案中,t细胞是cd4+t细胞或cd8+t细胞。在一些实施方案中,免疫细胞是从肿瘤组织或血液样品中分离的。在一些实施方案中,所述方法还包括将融合的二分体免疫受体多核苷酸递送到宿主细胞中。在一些实施方案中,融合的二分体免疫受体多核苷酸文库包含至少50、至少100、至少200、至少500、至少1,000、至少10,000、至少100,000、至少1,000,000或至少10,000,000个不同的融合的二分体免疫受体序列。在一些实施方案中,第一肽链和第二肽链是二分体免疫受体的同源对。在一些实施方案中,容器是液滴。在一些实施方案中,液滴是油包水液滴。在一些实施方案中,硬化颗粒是水凝胶颗粒。在一些实施方案中,聚合物是多糖、聚丙烯酰胺或其组合。在一些实施方案中,多糖是琼脂糖、透明质酸、羧甲基纤维素、壳聚糖或藻酸盐。在一些实施方案中,单体是丙烯酰胺或甲基丙烯酰胺单体。在一些实施方案中,聚合或胶凝的多种聚合物和/或单体包括琼脂糖和聚丙烯酰胺的混合物。在一些实施方案中,聚合或胶凝的多种聚合物和/或单体是交联的。在一些实施方案中,聚合或胶凝多个可聚合或可胶凝聚合物和/或单体包括使用引发剂。在一些实施方案中,引发剂是uv光或化学品。在一些实施方案中,聚合或胶凝多个可聚合或可胶凝聚合物和/或单体包括降低容器的温度。
[0135]
本文提供的方法可以在液体中进行,包括:(a)延伸与核酸分子杂交的第一寡核苷酸,从而形成第一延伸产物;(b)用包含第一引物和第二引物的引物组扩增第一延伸产物或其反向互补链,从而形成第一扩增产物;(c)在液体中生成聚合物基体以形成水凝胶颗粒,
从而限制第一扩增产物的扩散;以及(d)洗涤水凝胶颗粒,从而从水凝胶颗粒中除去第二引物。在一些实施方案中,第一引物或第一扩增产物与扩散限制剂连接。
[0136]
在一些情况下,在液体中进行的方法可以包括:(a)延伸与核酸分子杂交的第一寡核苷酸,从而形成第一延伸产物;(b)在液体中生成聚合物基体以形成水凝胶颗粒,从而限制第一延伸产物或其反向互补链的扩散;(c)洗涤水凝胶颗粒;以及(d)用包含第一引物和第二引物的引物组扩增第一延伸产物或其反向互补链,从而形成第一扩增产物。
[0137]
在一些实施方案中,第一寡核苷酸或第一延伸产物与扩散限制剂连接。在一些实施方案中,所述方法还包括延伸与其他核酸分子杂交的第二寡核苷酸。在一些实施方案中,核酸分子和其他核酸分子编码免疫受体的第一肽链和第二肽链,其中第一肽链和第二肽链是免疫受体的同源对。在一些实施方案中,扩散限制剂是聚合物或颗粒。在一些实施方案中,聚合物是聚丙烯酰胺、聚乙二醇或多糖。在一些实施方案中,颗粒的直径大于聚合物基体的孔径。在一些实施方案中,扩散限制剂是聚合物基体。在一些实施方案中,核酸分子是dna或rna。在一些实施方案中,核酸分子是基因组dna。在一些实施方案中,核酸分子是信使rna。在一些实施方案中,第一寡核苷酸是逆转录(rt)引物。在一些实施方案中,所述方法还包括用模板转换寡核苷酸延伸rt引物,从而生成具有模板转换寡核苷酸的反向互补序列的第一延伸产物。在一些实施方案中,所述方法还包括使用具有衔接子序列的第二链合成(sss)引物来合成第一延伸产物的反向互补链。在一些实施方案中,衔接子序列不能与核酸分子或第一延伸产物杂交或互补。在一些实施方案中,第一延伸产物包含衔接子序列。在一些实施方案中,核酸分子编码免疫受体的肽链。在一些实施方案中,所述方法还包括,在洗涤水凝胶颗粒之后或期间,使试剂与水凝胶颗粒接触,使得试剂扩散到水凝胶颗粒中。在一些实施方案中,试剂是寡核苷酸或酶。在一些实施方案中,酶是聚合酶。在一些实施方案中,所述方法还包括在洗涤后将水凝胶颗粒在油中乳化。
[0138]
在一些情况下,在液体中进行的方法可以包括:(a)形成多个液滴,其中多个液滴中的至少两个包含单细胞;(b)延伸与来自单细胞的第一核酸分子杂交的第一寡核苷酸,从而形成第一延伸产物;并且延伸与来自单细胞的第二核酸分子杂交的第二寡核苷酸,从而形成第二延伸产物;(c)用包含第一引物和第二引物的第一引物组扩增第一延伸产物或其反向互补链,从而形成第一组扩增产物;并且用包含第三引物和第四引物的第二引物组扩增第二延伸产物或其反向互补链,从而形成第二组扩增产物;以及(d)将第一组扩增产物中的扩增产物与第二组扩增产物中的扩增产物连接,其中连接包括在不存在第二和第四引物的情况下在液体中连接。
[0139]
在一些情况下,在液体中进行的方法可以包括:(a)形成多个液滴,其中多个液滴中的至少两个包含单细胞;(b)延伸与来自单细胞的第一核酸分子杂交的第一寡核苷酸,从而形成第一延伸产物;并且延伸与来自单细胞的第二核酸分子杂交的第二寡核苷酸,从而形成第二延伸产物;(c)用包含第一引物和第二引物的第一引物组扩增第一延伸产物或其反向互补链,从而形成第一组扩增产物;并且用包含第三引物和第四引物的第二引物组扩增第二延伸产物或其反向互补链,从而形成第二组扩增产物;(d)去除第二和第四引物;并且将第一组扩增产物中的扩增产物与第二组扩增产物中的扩增产物连接。
[0140]
在一些实施方案中,每个液滴包含多个可聚合或可胶凝聚合物和/或单体。在一些实施方案中,所述方法还包括在液体中生成聚合物基体以形成水凝胶颗粒,从而限制第一
组扩增产物和第二组扩增产物的扩散。在一些实施方案中,所述方法还包括洗涤水凝胶颗粒,从而从水凝胶颗粒中除去第二引物和第四引物。在一些实施方案中,连接包括在第一组和第二组扩增产物上生成粘性末端。在一些实施方案中,在扩增产物上生成粘性末端包括使用user酶。在一些实施方案中,连接包括杂交第一组和第二组的扩增产物。在一些实施方案中,连接包括连接第一组和第二组的扩增产物。在一些实施方案中,第一引物和第三引物是相同的引物。在一些实施方案中,第一引物、第三引物、第一组扩增产物或第二组扩增产物与扩散限制剂连接。
[0141]
在一些情况下,在液体中进行的方法可以包括:(a)形成多个液滴,其中多个液滴中的至少两个包含单细胞;(b)延伸与来自单细胞的第一核酸分子杂交的第一寡核苷酸,从而形成第一延伸产物;并且延伸与来自单细胞的第二核酸分子杂交的第二寡核苷酸,从而形成第二延伸产物;(c)在液体中生成聚合物基体以形成水凝胶颗粒,从而限制第一延伸产物和第二延伸产物的扩散;(d)用包含第一引物和第二引物的第一引物组扩增第一延伸产物或其反向互补链,从而形成第一组扩增产物;并且用包含第三引物和第四引物的第二引物组扩增第二延伸产物或其反向互补链,从而形成第二组扩增产物;以及(e)将第一组扩增产物中的扩增产物与第二组扩增产物中的扩增产物连接。
[0142]
在一些实施方案中,所述方法还包括在(c)之后洗涤水凝胶颗粒。在一些实施方案中,所述方法还包括使试剂与水凝胶颗粒接触,使得试剂扩散到水凝胶颗粒中。在一些实施方案中,试剂包括酶或寡核苷酸。在一些实施方案中,寡核苷酸包含第一引物组和/或第二引物组。在一些实施方案中,酶是聚合酶、连接酶、user酶或其组合。在一些实施方案中,所述方法还包括在洗涤后将水凝胶颗粒在油中乳化。在一些实施方案中,第一寡核苷酸或第二寡核苷酸与扩散限制剂连接。在一些实施方案中,第一寡核苷酸或第二寡核苷酸是rt引物。
[0143]
在一些实施方案中,所述方法还包括使用第二链合成(sss)引物来合成第一和/或第二延伸产物的反向互补链。在一些实施方案中,sss引物包含衔接子序列。在一些实施方案中,衔接子序列不能与第一和/或第二延伸产物杂交或互补。在一些实施方案中,所述方法还包括用模板转换寡核苷酸延伸rt引物。在一些实施方案中,单细胞是免疫细胞。在一些实施方案中,免疫细胞为t细胞或b细胞。在一些实施方案中,第一核酸分子和第二核酸分子是dna或rna。在一些实施方案中,dna是基因组dna。在一些实施方案中,rna是信使rna。在一些实施方案中,第一核酸分子编码免疫受体的第一肽链并且第二核酸分子编码免疫受体的第二肽链。在一些实施方案中,第一肽链和第二肽链是免疫受体的同源对。在一些实施方案中,第一肽链或第二肽链包含可变结构域。在一些实施方案中,可变结构域包括cdr1、cdr2、cdr3或其组合。在一些实施方案中,第一肽链或第二肽链包含恒定结构域。在一些实施方案中,第一肽链或第二肽链包含跨膜区和/或胞质尾。在一些实施方案中,免疫受体是b细胞受体。在一些实施方案中,免疫受体是t细胞受体。在一些实施方案中,扩散限制剂是聚合物或颗粒。在一些实施方案中,聚合物是聚丙烯酰胺、多糖或聚乙二醇。在一些实施方案中,颗粒的直径大于水凝胶颗粒的孔径。在一些实施方案中,扩散限制剂是聚合物基体。在一些实施方案中,连接包括在第一组和第二组扩增产物上生成粘性末端。在一些实施方案中,在扩增产物上生成粘性末端包括使用user酶。在一些实施方案中,连接包括杂交第一组和第二组的扩增产物。在一些实施方案中,连接包括连接第一组和第二组的扩增产物。
[0144]
本文提供的方法可以包括:(1)提供多个至少1,000个细胞,至少1,000个细胞中的每个细胞包含tcrα链和tcrβ链;(2)提供多个至少1,000个区室,至少1,000个区室中的每个区室包含固体支持物,其中固体支持物包含:(a)第一多核苷酸,包含第一共同序列、第二共同序列以及位于第一共同序列与第二共同序列之间的编码tcrα链的蛋白质编码序列,(b)第二多核苷酸,包含第三共同序列、第四共同序列以及位于第三共同序列与第四共同序列之间的编码tcrβ链的蛋白质编码序列,其中,每个区室中的tcrα链和tcrβ链是存在于多个细胞中的至少一个中的同源对,从而提供第一多个蛋白质编码序列(每个编码tcrα链)和第二多个蛋白质编码序列(每个编码tcrβ链);以及(3)物理连接每个区室中的第一多核苷酸和第二多核苷酸。在一些实施方案中,第一多个蛋白质编码序列包含至少10个trav亚组并且第二多个蛋白质编码序列包含至少10个trbv亚组。在一些实施方案中,至少1,000个区室中的每个区室包含来自所述多个至少1,000个细胞中的细胞。在一些实施方案中,区室是孔、微孔或液滴。在一些实施方案中,固体支持物是珠、水凝胶颗粒或者孔或微孔的表面。在一些实施方案中,第一共同序列、第二共同序列、第三共同序列或第四共同序列在多个至少1,000个区室中是相同的。
[0145]
用于物理连接tcr链的方法的其他细节可以在国际申请pct/us2019/046170中找到,所述申请以引用的方式整体并入本文。
[0146]
tcr基因自组装
[0147]
来自源tcr表达细胞的tcr可以例如使用测序在信息上配对。编码天然配对(或同源)的tcr的序列可使用各种方法鉴定,包括但不限于使用单细胞条形码和测序技术。获得编码天然配对的tcr的序列后,本文所述的组合物和方法可用于构建或组装一个或多个核酸序列,以快速、高通量和成本有效的方式在任何给定的宿主细胞中表达天然配对的tcr。所述一个或多个核酸序列可包括大于或等于约1、5、10、20、50、100、200、300、400、500、1,000、1,500、2,000、2,500、3,000、3,500、4,000、5,000、6,000、7,000、8,000、9,000、10,000、12,000、15,000、20,000、100,000、1,000,000、10,000,000个或更多个编码不同tcr的不同序列。
[0148]
在一个方面,用于生成多个核酸分子的方法可以包括:提供第一多个核酸分子,其中第一多个核酸分子中的核酸分子包含编码第一t细胞受体(tcr)链的第一cdr3和第二tcr链的第二cdr3的序列,其中第一cdr3和第二cdr3来自tcr链的同源对;提供第二多个核酸分子,其中第二多个核酸分子中的核酸分子包含衍生自tcr v基因的序列,其中核酸分子不包含编码恒定结构域的序列;以及使第一多个核酸分子与第二多个核酸分子接触,其中第一多个核酸分子中的核酸分子与第二多个核酸分子中的核酸分子连接以形成包含编码第一cdr3和第二cdr3的序列以及衍生自tcr v基因的序列的核酸分子,其中编码第一cdr3和第二cdr3的序列以及tcr v基因衍生自tcr链的同源对。
[0149]
在一些实施方案中,第一多个核酸分子中的每个核酸分子包含编码第一tcr链的不同第一cdr3和/或第二tcr链的不同cdr3的序列。在一些实施方案中,第二多个核酸分子中的每个核酸分子包含衍生自不同tcr v基因的序列。在一些实施方案中,第一多个核酸分子和第二多个核酸分子在同一区室中接触。在一些实施方案中,第一多个核酸分子中的核酸分子还包含连接序列,其中所述连接序列将第一多个核酸分子中的核酸分子与第二多个核酸分子中的核酸分子连接。在一些实施方案中,第二多个核酸分子中的核酸分子还包含
抗连接序列,所述抗连接序列与连接序列互补。在一些实施方案中,连接序列与抗连接序列杂交以将第一多个核酸分子中的核酸分子与第二多个核酸分子中的核酸分子连接。在一些实施方案中,连接序列是密码子多样化的,使得第一多个核酸分子中的核酸分子的连接序列不同于第一多个核酸分子中的其他核酸分子的其他连接序列。在一些实施方案中,第一多个核酸分子中的核酸分子还包含第一tcr链的第一j区和/或第二tcr链的第二j区。在一些实施方案中,(i)第一tcr链是tcrα链并且第二tcr链是tcrβ链,或(ii)第一tcr链是tcrγ链并且第二tcr链是tcrδ链。在一些实施方案中,tcr v基因是trav基因、trbv基因、trgv基因或trdv基因。在一些实施方案中,第二多个核酸分子中的核酸分子是双链核酸分子。在一些实施方案中,第二多个核酸分子中的核酸分子还包含编码自切割肽的一部分的序列。在一些实施方案中,抗连接序列是第二多个核酸分子中的核酸分子的突出端。在一些实施方案中,连接序列或抗连接序列的长度为至少3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、50、60、70、80、90、100、150、200个或更多个核苷酸。在一些实施方案中,所述方法还包括(i)延伸与第二多个核酸分子中的核酸分子杂交的第一多个核酸分子中的核酸分子的3'末端和/或(ii)延伸与第一多个核酸分子中的核酸分子杂交的第二多个核酸分子中的核酸分子的3'末端。在一些实施方案中,所述方法还包括将第一多个核酸分子中的核酸分子与第二多个核酸分子中的核酸分子连接。
[0150]
在一些实施方案中,所述方法还包括使包含编码第一cdr3和第二cdr3的序列以及衍生自tcr v基因的序列的核酸分子与限制酶接触以生成粘性末端。在一些实施方案中,所述方法还包括使包含编码第一cdr3和第二cdr3的序列以及衍生自tcr v基因的序列的核酸分子与包含编码恒定区或其部分的序列的其他核酸分子接触。在一些实施方案中,所述方法还包括将包含编码第一cdr3和第二cdr3的序列以及衍生自tcr v基因的序列的核酸分子通过粘性末端与其他核酸分子连接。在一些实施方案中,编码第一cdr3的序列和编码第二cdr3的序列相隔至多约100、90、80、70、60、50、40、30、20、10或5个核苷酸。在一些实施方案中,衍生自tcr v基因的序列包含编码fr1、cdr1、fr2、cdr2和fr3的序列。在一些实施方案中,衍生自tcr v基因的序列包含编码l-part1、l-part2、fr1、cdr1、fr2、cdr2和fr3的序列。
[0151]
在另一个方面,用于生成多个核酸分子(所述多个核酸分子中的每个编码t细胞受体(tcr)链或其区域)的方法可以包括:使第一多个核酸分子与第二多个核酸分子接触以生成第三多个核酸分子,所述第三多个核酸分子包含至少两个不同的核酸分子,其中所述至少两个不同的核酸分子中的每个具有编码不同tcr链或其区域的不同序列,并且其中所述至少两个不同的核酸分子在同一区室中生成。
[0152]
在一些实施方案中,第一多个核酸分子中的每个核酸分子包含编码tcr链的cdr3的序列。在一些实施方案中,第一多个核酸分子中的每个核酸分子包含tcr链的j区。在一些实施方案中,第二多个核酸分子中的每个核酸分子包含衍生自tcr链的tcr v基因的序列。在一些实施方案中,tcr v基因是人tcr v基因。在一些实施方案中,tcr v基因是人trav1-1、trav1-2、trav2、trav3、trav4、trav5、trav6、trav7、trav8-1、trav8-2、trav8-3、trav8-4、trav8-6、trav9-1、trav9-2、trav10、trav12-1、trav12-2、trav12-3、trav13-1、trav13-2、trav14、trav16、trav17、trav18、trav19、trav20、trav21、trav22、trav23、trav24、trav25、trav26-1、trav26-2、trav27、trav29、trav30、trav34、trav35、trav36、trav38-1、
trav38-2、trav39、trav40或trav41。在一些实施方案中,tcr v基因是人trbv2、trbv3-1、trbv4-1、trbv4-2、trbv4-3、trbv5-1、trbv5-4、trbv5-5、trbv5-6、trbv5-8、trbv6-1、trbv6-2、trbv6-3、trbv6-4、trbv6-5、trbv6-6、trbv6-8、trbv6-9、trbv7-2、trbv7-3、trbv7-4、trbv7-6、trbv7-7、trbv7-8、trbv7-9、trbv9、trbv10-1、trbv10-2、trbv10-3、trbv11-1、trbv11-2、trbv11-3、trbv12-3、trbv12-4、trbv12-5、trbv13、trbv14、trbv15、trbv16、trbv18、trbv19、trbv20-1、trbv24-1、trbv25-1、trbv27、trbv28、trbv29-1或trbv30。在一些实施方案中,衍生自tcr v基因的序列包含编码fr1、cdr1、fr2、cdr2和fr3的序列。在一些实施方案中,衍生自tcr v基因的序列包含编码l-part1、l-part2、fr1、cdr1、fr2、cdr2和fr3的序列。在一些实施方案中,tcr链是tcrα链、tcrβ链、tcrγ链或tcrδ链。在一些实施方案中,第一多个核酸分子中的每个核酸分子还包含编码其他tcr链的其他cdr3的其他序列。在一些实施方案中,第一多个核酸分子中的每个核酸分子包含其他tcr链的其他外j区。在一些实施方案中,tcr链和其他tcr链是tcr链的同源对。在一些实施方案中,多个核酸分子中的核酸分子编码不同的tcr或其部分。在一些实施方案中,第一多个核酸分子中的给定核酸分子包含连接序列,所述连接序列可用于将第一多个核酸分子中的给定核酸分子与第二多个核酸分子中的给定核酸分子连接。在一些实施方案中,第一多个核酸分子中的给定核酸分子和第二多个核酸分子中的给定核酸分子编码功能性tcr链或其部分。在一些实施方案中,第二多个核酸分子中的给定核酸分子包含抗连接序列,所述抗连接序列与第一多个核酸分子中的给定核酸分子的连接序列互补。在一些实施方案中,所述方法还包括将第一多个核酸分子中的给定核酸分子与第二多个核酸分子中的给定核酸分子连接。在一些实施方案中,连接包括使第一多个核酸分子中的给定核酸分子与第二多个核酸分子中的给定核酸分子杂交。在一些实施方案中,杂交包括使第一多个核酸分子中的给定核酸分子的连接序列与第二多个核酸分子中的给定核酸分子的抗连接序列杂交。在一些实施方案中,所述方法还包括(i)使用第一多个核酸分子中的给定核酸分子作为模板延伸第二多个核酸分子中的给定核酸分子的游离3'末端,和/或(ii)使用第二多个核酸分子中的给定核酸分子作为模板延伸第一多个核酸分子中的核酸分子的游离3'末端,以生成第三多个核酸分子中的核酸分子。在一些实施方案中,所述方法还包括将第一多个核酸分子中的给定核酸分子与第二多个核酸分子中的给定核酸分子连接。在一些实施方案中,所述方法还包括使第三多个核酸分子中的核酸分子与限制酶接触以生成粘性末端。在一些实施方案中,所述方法还包括使第三多个核酸分子中的核酸分子与其他核酸分子接触。在一些实施方案中,其他核酸分子编码tcr链的恒定区或其部分。在一些实施方案中,所述方法还包括将第三多个核酸分子中的核酸分子与其他核酸分子连接。在一些实施方案中,第三多个核酸分子中的至少五个(例如,在一些情况下,至少约6、7、8、9、10、20、30、40、50、60、70、80、90、100、200、300、400、500、1,000、2,000、3,000、4,000、5,000、10,000、20,000、30,000、40,000个或更多个)不同的核酸分子在同一区室中生成。在一些实施方案中,第三多个核酸分子中的至少十个不同的核酸分子在同一区室中生成。在一些实施方案中,同一区室是孔、管或液滴。
[0153]
在另一个方面,用于生成多个核酸分子的方法可以包括:(a)提供第一多个核酸分子,其中第一多个核酸分子中的核酸分子包含编码第一t细胞受体(tcr)链的第一cdr3和第二tcr链的第二cdr3的序列,其中第一cdr3和第二cdr3来自tcr链的同源对;(b)提供第二多
个核酸分子,其中第二多个核酸分子中的核酸分子包含衍生自tcr v基因的序列;以及(c)使第一多个核酸分子与第二多个核酸分子接触,其中第一多个核酸分子中的核酸分子与第二多个核酸分子中的核酸分子连接以形成包含编码第一cdr3和第二cdr3的序列以及衍生自tcr v基因的序列的线性核酸分子,其中编码第一cdr3和第二cdr3的序列以及tcr v基因衍生自tcr链的同源对。
[0154]
在另一个方面,用于生成多个核酸分子的方法可以包括:(a)提供第一多个核酸分子,其中第一多个核酸分子中的核酸分子包含(i)编码第一t细胞受体(tcr)链的第一cdr3和第二tcr链的第二cdr3的合成序列,和(ii)编码第三t细胞受体(tcr)链的第三cdr3和第四tcr链的第四cdr3的合成序列,其中第一cdr3和第二cdr3来自tcr链的第一同源对,并且其中第三cdr3和第四cdr3来自tcr链的第二同源对;(b)提供第二多个核酸分子,其中第二多个核酸分子中的核酸分子包含衍生自tcr v基因的序列;以及(c)使第一多个核酸分子与第二多个核酸分子接触,其中第一多个核酸分子中的核酸分子与第二多个核酸分子中的核酸分子连接以形成包含编码第一cdr3和第二cdr3的序列以及衍生自tcr v基因的序列的核酸分子,其中编码第一cdr3和第二cdr3的序列以及tcr v基因衍生自tcr链的同源对。
[0155]
在另一个方面,用于生成编码t细胞受体(tcr)链或其部分的核酸分子的方法可以包括:(a)提供至少一个核酸分子,其包含编码tcr链的cdr3的序列;(b)提供多个核酸分子,多个核酸分子中的每个包含衍生自tcr v基因的序列,其中多个核酸分子包含衍生自至少两个不同tcr v基因的至少两个不同的序列;以及(c)使(a)的至少一个核酸分子与(b)的多个核酸分子在同一区室中接触,其中(a)的至少一个核酸分子能够与多个核酸分子中的核酸分子连接,以生成包含编码所述cdr3的序列和衍生自至少两个不同tcr v基因中的一个的序列的第三核酸分子,从而生成编码tcr链或其部分的核酸分子。
[0156]
在一些实施方案中,至少一个核酸分子包含第一多个核酸分子,其中所述第一多个核酸分子中的每个核酸分子包含编码tcr链的cdr3的序列。在一些实施方案中,(a)的至少一个核酸分子能够与所述多个核酸分子中的核酸分子特异性地连接,所述多个核酸分子中的核酸分子包含衍生自至少两个不同tcr v基因中的任何单个给定tcr v基因的序列。在一些实施方案中,至少一个核酸分子还包含tcr链的j区。在一些实施方案中,第一多个核酸分子中的每个核酸分子还包含tcr链的j区。在一些实施方案中,所述至少两个tcr v基因是人tcr v基因或小鼠tcr v基因。在一些实施方案中,所述至少两个tcr v基因选自由人trav1-1、trav1-2、trav2、trav3、trav4、trav5、trav6、trav7、trav8-1、trav8-2、trav8-3、trav8-4、trav8-6、trav9-1、trav9-2、trav10、trav12-1、trav12-2、trav12-3、trav13-1、trav13-2、trav14、trav16、trav17、trav18、trav19、trav20、trav21、trav22、trav23、trav24、trav25、trav26-1、trav26-2、trav27、trav29、trav30、trav34、trav35、trav36、trav38-1、trav38-2、trav39、trav40和trav41组成的组。在一些实施方案中,所述至少两个tcr v基因选自由人trbv2、trbv3-1、trbv4-1、trbv4-2、trbv4-3、trbv5-1、trbv5-4、trbv5-5、trbv5-6、trbv5-8、trbv6-1、trbv6-2、trbv6-3、trbv6-4、trbv6-5、trbv6-6、trbv6-8、trbv6-9、trbv7-2、trbv7-3、trbv7-4、trbv7-6、trbv7-7、trbv7-8、trbv7-9、trbv9、trbv10-1、trbv10-2、trbv10-3、trbv11-1、trbv11-2、trbv11-3、trbv12-3、trbv12-4、trbv12-5、trbv13、trbv14、trbv15、trbv16、trbv18、trbv19、trbv20-1、trbv24-1、trbv25-1、trbv27、trbv28、trbv29-1和trbv30组成的组。在一些实施方案中,衍生自至少两个不同tcr v基因
的多个序列中的每个序列包含编码l-part1、l-part2、fr1、cdr1、fr2、cdr2和/或fr3的序列。在一些实施方案中,tcr链是tcrα链、tcrβ链、tcrγ链或tcrδ链。在一些实施方案中,至少一个核酸分子还包含编码其他tcr链的其他cdr3的其他序列。在一些实施方案中,至少一个核酸分子包含其他tcr链的其他j区。在一些实施方案中,编码cdr3的序列和编码其他cdr3的其他序列相隔至多100个核苷酸。在一些实施方案中,tcr链和其他tcr链是tcr链的同源对。在一些实施方案中,至少一个核酸分子包含连接序列,所述连接序列能够将至少一个核酸分子与多个核酸分子中的核酸分子连接以生成第三核酸分子。在一些实施方案中,至少一个核酸分子和多个核酸分子中的核酸分子编码功能性tcr链或其部分。在一些实施方案中,多个核酸分子中的核酸分子包含抗连接序列,所述抗连接序列与(a)的至少一个核酸分子的连接序列互补。在一些实施方案中,所述方法还包括将(a)的至少一个核酸分子和(b)的多个核酸分子中的核酸分子连接。在一些实施方案中,连接包括使(a)的至少一个核酸分子与(b)的多个核酸分子中的核酸分子杂交。在一些实施方案中,杂交包括使(a)的至少一个核酸分子的连接序列与(b)的多个核酸分子中的核酸分子的抗连接序列杂交。在一些实施方案中,所述方法还包括(i)使用(a)的至少一个核酸分子作为模板延伸多个核酸分子中的核酸分子的游离3'末端,和/或(ii)使用多个核酸分子中的核酸分子作为模板延伸(a)的至少一个核酸分子的游离3'末端,以生成第三核酸分子。在一些实施方案中,所述方法还包括将(a)的至少一个核酸分子与(b)的多个核酸分子中的核酸分子连接。在一些实施方案中,所述方法还包括使第三核酸分子与限制酶接触以生成粘性末端。在一些实施方案中,所述方法还包括使第三核酸分子与其他核酸分子接触。在一些实施方案中,其他核酸分子编码tcr链的恒定区或其部分。在一些实施方案中,所述方法还包括将第三核酸分子与其他核酸分子连接。在一些实施方案中,多个核酸分子(每个编码不同的tcr链或其部分)在同一区室中生成。在一些实施方案中,多个核酸分子中的至少五个不同的核酸分子在同一区室中生成。在一些实施方案中,多个核酸分子中的至少十个不同的核酸分子在同一区室中生成。在一些实施方案中,同一区室是孔、管或液滴。
[0157]
关于tcr基因组装方法的其他细节可以在国际申请pct/us2020/026558中找到,所述申请以引用的方式整体并入本文。
[0158]
药物组合物
[0159]
本公开还提供了药物组合物,其包含通过本文所述的方法鉴定的tcr或表达tcr的细胞以及一种或多种药学或生理学上可接受的载剂、稀释剂或赋形剂。此类组合物可包含缓冲剂,诸如中性缓冲盐水、磷酸盐缓冲盐水等;碳水化合物,诸如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或氨基酸,诸如甘氨酸;抗氧化剂;螯合剂,诸如edta或谷胱甘肽;辅助剂(例如氢氧化铝);和防腐剂。本公开的组合物可以被配制用于静脉内施用。
[0160]
本公开的药物组合物可以以适合待治疗(或预防)的疾病的方式施用。尽管适当的剂量可以通过临床试验来确定,但施用的量和频率可以根据诸如患者的病状以及患者疾病的类型和严重程度等因素来确定。
[0161]
药物组合物可以基本上不含例如没有可检测水平的污染物,例如选自由以下组成的组的污染物:内毒素、支原体、有复制能力的慢病毒(rcl)、p24、vsv-g核酸、hiv糖胺聚糖、残留的抗cd3/抗cd28包覆的珠、小鼠抗体、合并的人血清、牛血清白蛋白、牛血清、培养基组分、载体包装细胞或质粒组分、细菌和真菌。在一些情况下,细菌可以是选自由以下组成的
组中的至少一种:粪产碱杆菌(alcaligenes faecalis)、白色念珠菌(candida albicans,)、大肠杆菌(escherichia coli)、流感嗜血杆菌(haemophilus influenza)、脑膜炎奈瑟氏菌(neisseria meningitides)、铜绿假单胞菌(pseudomonas aeruginosa)、金黄色葡萄球菌(staphylococcus aureus)、肺炎链球菌(streptococcus pneumonia)、化脓性链球菌(streptococcus pyogenes)a组及其任何组合。
[0162]
实施例
[0163]
实施例1:高通量鉴定来自til的新抗原反应性tcr
[0164]
可以通过外科手术从癌症患者处取出肿瘤组织。外科手术后24小时内,可以将肿瘤组织在冰上切碎成0.5至3cm3。可以使用已建立的酶处理(例如,使用胶原酶和dna酶i)和任选地使用组织解离器械(诸如gentlemacs)获得单细胞混悬液。细胞过滤器可用于去除大碎片。可以使用facs分离单细胞(例如,活单细胞)。可以使用多种基于facs或macs的阳性选择或阴性选择方法分离t细胞(例如,活t细胞)。t细胞可用作各种测序方法的输入,以确定每个t细胞内配对的tcr链。各种测序方法包括但不限于sanger测序、高通量测序、合成测序、单分子测序、连接测序、rna-seq、下一代测序(ngs)、数字基因表达、克隆单微阵列、鸟枪法测序、maxim-gilbert测序或大规模平行测序。t细胞可用作单细胞rna-seq方法诸如indrop或dropseq的输入。简而言之,每个细胞将被包封在液滴或微孔中。每个细胞独有的多核苷酸条形码(例如,存在于逆转录引物或模板转换寡核苷酸上)将被引入来自同一细胞的许多mrna分子。可以获得每个细胞的α和β链的转录谱以及tcr序列,因为它们共享相同的多核苷酸条形码。因此,tcrα和β链序列在信息上是连接的。在一个典型的实验中,可以获得1,000至5,000个信息上配对的tcr序列。可以使用公开可用的软件包(诸如mixcr)从每个配对的tcr序列中提取trav基因同一性、cdr3-α序列、traj基因同一性、trbv基因同一性、cdr3-β序列和trbj基因同一性。此信息可用于设计编码所有1,000至5,000个tcr的配对的cdr3j寡核苷酸(oligo)的池。这些配对的cdr3j寡核苷酸可用于使用tcr基因组装方法合成配对的tcr编码多核苷酸的池,所述方法描述于美国临时专利申请号62/829,813、62/838,465和62/898,053以及国际申请pct/us2020/026558中,所述申请各自以引用的方式整体并入本文。可以使用诸如gibson组装或golden gate组装的方法将这种配对的tcr编码多核苷酸的池转化为慢病毒载体的池,其中全长tcrβ链和全长tcrα链通过p2a自切割肽连接,并且tcr由人ef1a启动子驱动。
[0165]
或者,不是在信息上配对tcrα链和β链并在体外合成配对的tcr,而是tcrα链和β链可以在每个单个t细胞的个别区室中连接。例如,多个t细胞中的每个t细胞可以被分隔在个别区室(诸如液滴或水凝胶颗粒)中,并且每个tcr链的mrna可以被逆转录和扩增。然后tcrα链和β链的扩增产物可以通过诸如连接或重叠pcr的方法物理连接。用于物理连接tcr链的方法描述于2018年8月13日提交的美国临时专利申请号62/718,227、2018年8月31日提交的美国临时专利申请号62/725,842、2018年9月18日提交的美国临时专利申请号62/732,898、2019年3月14日提交的美国临时专利申请号62/818,355和2019年3月26日提交的美国临时专利申请号62/823,831,以及国际申请pct/us2019/046170,所述申请各自以引用的方式整体并入本文。
[0166]
慢病毒载体可用于转导基于jurkat 76的报告细胞系(rosskopf等人,oncotarget 2017),其中tcr信号传导导致荧光蛋白的表达。转导可以在低感染复数(moi)下进行,使得
大多数转导的报告细胞仅表达一个tcr。tcr表达报告细胞可以被认为是tcr工程化报告细胞。这些细胞也可以被视为选择前tcr程序化受体细胞。可以分离这些细胞的等分试样的总dna或rna,并且可以扩增这些细胞的外源tcr基因座,并进行ngs以测量每个tcr在选择前tcr程序化受体细胞中的频率或相对丰度。
[0167]
切除的肿瘤组织的另一部分可用于制备基因组dna和rna,分别用于全外显子组测序(wes)和全转录组测序(rna-seq)。
[0168]
为了生成apc,可以考虑两个选择。自体apc可以通过将自体b细胞转化为b类淋巴母细胞(b-lcl),或通过将自体单核细胞分化为单核细胞衍生的树突细胞(mddc)来获得。或者,可以使用人工apc(aapc)。为此,患者的i类mhc基因的基因型可以从wes和转录组测序数据中获得。可以合成编码此类mhc基因的所有基因,并且可以用体外转录、酶加帽和酶聚腺苷酸化获得编码这些基因的mrna。可以将所得mrna电穿孔到缺乏内源mhc表达的aapc细胞系(例如,k562细胞系)中。k562细胞系可以被工程化以表达共刺激分子(butler和hirano,immunological reviews 2014)。
[0169]
小基因池、串联小基因或串联小基因池(其中每个小基因编码在肿瘤样品的wes和rna-seq中发现的25聚体突变肽,突变残基位于第13位)可以以质粒(pasetto等人,cancer immunol res.2016)或mrna(kreiter等人,j immunol.2008;sahin等人,nature 2017;lu等人,mol ther.2018)的形式制备,并转染或电穿孔到apc中。apc可以与上述tcr工程化报告细胞共培养。12至24小时后,荧光蛋白表达水平上调的报告细胞可通过facs进行分离。此选择可以被视为预期选择。这些分离的细胞可以被视为第一多个选择后tcr程序化受体细胞。
[0170]
另一个小基因池、串联小基因或串联小基因池(其中每个小基因编码上述突变肽的25聚体野生型对应物)可以类似地制备,并转染或电穿孔到apc中。apc可以与上述tcr工程化报告细胞共培养。12至24小时后,荧光蛋白表达水平上调的报告细胞可通过facs进行分离。这种选择可以被视为阴性对照选择。这些分离的细胞可以被视为第二多个选择后tcr程序化受体细胞。
[0171]
可以单独分离第一和第二多个选择后tcr程序化受体细胞的等分试样的总dna或rna,并且可以扩增这些细胞的外源tcr基因座,并进行ngs以测量每个tcr在第一和第二多个选择后tcr程序化受体细胞中的频率或相对丰度。
[0172]
从ngs数据来看,其在第一多个选择后tcr程序化受体细胞中的频率或相对丰度显著高于在选择前tcr程序化受体细胞和第二多个选择后tcr程序化受体细胞中的频率或相对丰度的tcr可以使用已建立的统计分析来鉴定。这些tcr可以被视为推定的新抗原反应性tcr。图3示出了tcr鉴定过程的工作流程。图3中的tcr频率分析包括比较与第一抗原接触后tcr在选择后tcr程序化受体细胞中的第一频率和与第二抗原接触后tcr在选择后tcr程序化受体细胞中的第二频率。
[0173]
实施例2:高通量鉴定来自til的肿瘤反应性tcr
[0174]
从肿瘤样品中分离t细胞(例如活t细胞)、在信息上连接tcrα链和tcrβ链的序列、获得配对的tcr编码多核苷酸的池、获得选择前tcr程序化受体细胞、获得每个tcr在选择前tcr程序化受体细胞中的频率或相对丰度的方法可以与实施例1中所述的相同。
[0175]
自体肿瘤球可以用作抗原呈递细胞。可以使用已建立的方法(sant等人,drug discov today technol.2017)从手术切除的肿瘤中获得肿瘤球。选择前tcr工程化报告细
胞可以与肿瘤球共培养,使tcr工程化报告细胞与肿瘤细胞的比率为1:1。可以在共培养物中添加抗cd28抗体以提供信号2。在共培养12至24小时后,可以如实施例1中所述分离具有升高水平的荧光蛋白的tcr工程化报告细胞。还可以如实施例1中所述获得每个tcr在选择后tcr程序化受体细胞中的频率。其在选择后tcr程序化受体细胞中的频率或相对丰度显著高于在选择前tcr程序化受体细胞中的频率或相对丰度的tcr可以使用已建立的统计分析来鉴定。这些tcr可以被视为推定的肿瘤反应性tcr。图1和图2示出了tcr鉴定过程的示例工作流程。图2中的tcr频率分析包括比较tcr在选择前tcr程序化受体细胞中的第一频率和tcr在选择后tcr程序化受体细胞中的第二频率。
[0176]
实施例3:从合成tcr文库中富集模型tcr
[0177]
为了评价本文所述的高通量筛选测定的可行性、敏感性和/或特异性,合成了约1000个全长可表达tcr的文库。在这个文库中,四个tcr是经过充分研究的具有已知靶标的tcr(也称为模型tcr),其余的主要是来自具有未知反应性的肿瘤样品的tcr。四个模型tcr是:
[0178]
(1)dmf4,其与hla-a*02:01限制性mart-1表位反应,
[0179]
(2)dmf5,其与和dmf4相同的hla-a*02:01限制性mart-1表位反应,但据报道具有更高的亲和力,
[0180]
(3)c4,其与hla-a*02:01限制性wt-1表位反应,和
[0181]
(4)c4-dlt,其与和c4相同的hla-a*02:01限制性wt-1表位反应,但据报道具有更高的亲和力。
[0182]
所有合成的tcr都具有鼠恒定区。此tcr文库被克隆到慢病毒载体中,并由ef-1α启动子驱动。慢病毒载体的骨架还含有由不同启动子驱动的yfp表达盒。使用此载体文库制备慢病毒颗粒混合物,并用于以约0.1的功能性感染复数(moi)感染来自供体的外周t细胞。换句话讲,对慢病毒颗粒进行滴定,使得感染后约10%的t细胞呈yfp阳性。这种低moi用于减少具有超过一个功能性整合在其基因组中的外源tcr的t细胞的出现。细胞表面上的鼠tcr恒定结构域被染色,并且在大多数yfp阳性细胞中仍很容易检测到鼠源化tcr,即使所述tcr仅由一个基因组基因座转录。yfp阳性cd8+细胞经过facs分选,并用抗cd3/cd28珠短暂扩增。这些工程化t细胞被称为多克隆tcr-t细胞,或选择前多克隆tcr-t细胞。在此实施例中,实验数据证实了不到1%的选择前多克隆tcr-t细胞呈cd137阳性。
[0183]
接下来,制备了两种型式的抗原呈递细胞。在第一种型式中,k562细胞用上述编码hla-a*02:01的mrna和编码mart-1表位和wt-1表位的mrna进行电穿孔。在第二种型式中,k562细胞用编码hla-a*02:01的mrna和编码无关抗原(或对照抗原)的mrna进行电穿孔。接下来,建立两个共培养。第一个共培养,称为“实际”共培养,包含多克隆tcr-t细胞和第一种型式的抗原呈递细胞。例如,“实际”共培养可以包含针对待鉴定tcr的靶抗原(例如,tsa或taa)。第二个共培养,称为“模拟”共培养,包含多克隆tcr-t细胞和第二种型式的抗原呈递细胞。共培养一天后,将cd137阳性t细胞从其他细胞中分选出来。这些从“实际”和“模拟”共培养中分选出来的细胞分别称为实际选择后多克隆tcr-t细胞和模拟选择后多克隆tcr-t细胞。
[0184]
通过ngs检查每个tcr在选择前、实际选择后和模拟选择后多克隆tcr-t细胞中的频率。为此,从分选的细胞中分离出总rna,并使用靶向鼠trbc结构域的基因特异性rt引物
进行逆转录(rt)。接下来,添加含有独特分子标识符(umi)的第二链合成(sss)引物。sss引物具有5'结构域、用作umi的8-nt随机序列和靶向合成tcr的5'utr的3'基因特异性结构域。在嗜热dna聚合酶(例如q5)的存在下进行变性、退火和延伸的一个热循环以完成第二链合成。接下来,使用一对靶向sss的5'结构域和鼠trbc结构域上的嵌套区域(即从rt引物嵌套)的引物来扩增合成的tcrβ链cdna。这些cdna是illumina ngs系统(例如miseq、miniseq、hiseq或nextseq)上的序列,以获得每个cdna分子上的cdr3β序列。共享相同umi和相同cdr3β的读数被数字折叠并作为原始cdna分子计数。省略了少于10个读数的原始cdna分子。tcr的频率可以定义为编码此tcr的原始cdna分子的数量除以在一个样品中观察到的所有原始cdna分子的数量。
[0185]
图4示出了每个tcr在实际选择后多克隆tcr-t细胞和选择前多克隆tcr-t细胞中的频率,其显示了“实际”共培养和分选后每个tcr的富集。向每个频率值添加了小的数字(1e-6
),使得可以在此图上以对数标度示出表示频率为零的点。向每个频率值添加了在0与1e-6
范围内的随机数,使得在x轴和y轴上具有相同频率值的表示不同tcr的点不完全重叠。可以看出,所有四种模型tcr显示在实际选择后多克隆tcr-t细胞中的频率比在选择前多克隆tcr-t细胞中高约10倍。相比之下,大多数其他tcr要么在实际选择后多克隆tcr-t中检测不到,要么频率低于在选择前多克隆tcr-t细胞中的频率10倍(例如,显示低于10倍的富集)。相比之下,在“模拟”共培养之后,除了dmf4,这些模型tcr没有显示富集(图5)。图5示出了每个tcr在模拟选择后多克隆tcr-t细胞(y轴)和选择前多克隆tcr-t细胞(x轴)中的频率。如图4所示,向每个频率值添加了小的数字(1e-6
)和噪声。值得注意的是,在我们先前的实验中,dmf4已经显示出相当大的非特异性结合,因为用dmf4工程化的t细胞在与用hla-a*02:01mrna转染的k562细胞在没有mart1抗原的情况下共培养后显示出cd137的上调。因此,在本实施例中观察到了dmf4在“模拟”共培养和分选中的不必要的富集。
[0186]
图6示出了tcr在“实际”共培养和“模拟”共培养中的富集因子。“实际”共培养中的富集因子可以定义为tcr在实际选择后多克隆tcr-t细胞中的频率除以在选择前多克隆tcr-t细胞中的频率。“模拟”共培养中的富集因子可以定义为tcr在模拟选择后多克隆tcr-t细胞中的频率除以在选择前多克隆tcr-t细胞中的频率。向所有频率值添加了小的数字(1e-6
)和在0与1e-6
之间的随机数,以有利于可视化。与图4和图5一致,模型tcr c4、c4-dlt和dmf5在“实际”共培养中显示了富集,而dmf4在“实际”和“模拟”共培养中均显示了富集。这些数据表明,可以使用本文所述的基于频率的筛选方法来鉴定功能性、抗原特异性tcr。
[0187]
虽然本文已经示出并描述了本发明的各种实施方案,但是本领域技术人员将显而易知此类实施方案仅以举例的方式提供。本发明并不旨在受说明书中提供的具体实例的限制。尽管已经参照前述说明书描述了本发明,但本文中实施方案的描述和说明并不意在被理解为限制意义。在不偏离本发明的情况下,本领域技术人员现将进行各种变型、变化和替换。此外,应当理解,本发明的所有方面不限于本文列出的具体描述、配置或相对比例,所述所有方面取决于各种条件和变量。应当理解,可将本文所述的本发明的实施方案的各种替代方案用于实施本发明。因此预期本发明还应涵盖任何此类替代、修改、变型或等同物。以下权利要求旨在限定本发明的范围,并且这些权利要求及它们的等同物范围内的方法和结构因此被涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1