一种药物口服剂型的制作方法
一种药物口服剂型
1.本发明涉及6-氯-2-乙基-n-(4-(4-(4-(三氟甲氧基)苯基)哌啶-1-基)苄基)咪唑并[1,2-a]吡啶-3-甲酰胺的新药物剂型,特别是其二甲苯磺酸盐形式的新药物剂型。
[0002]
结核病作为一种疾病每年继续导致数百万人死亡。化学疗法的不充分使用导致了越来越多的耐药病例。随着对所有目前已知药物具有极强耐药性的菌株的出现,这种情况可能会更糟。目前的化学疗法由通过中和一般信息途径和关键过程(例如rna聚合和蛋白质合成抑制)或者通过干扰分枝杆菌特异性细胞包膜合成而直接靶向结核分枝杆菌的化合物组成。最广泛使用的专用抗结核药异烟肼、乙硫异烟胺和吡嗪酰胺是第一种需要活化的前体药物。它们被给予患者服用,疗程数月。感染多药耐药结核分枝杆菌菌株的患者可能不得不接受长期联合治疗。
[0003]
wo 2011/113606描述了各种抗结核化合物及其在治疗细菌感染中的用途,包括化学上为6-氯-2-乙基-n-(4-(4-(4-(三氟甲氧基)苯基)哌啶-1-基)苄基)咪唑并[1,2-a]吡啶-3-甲酰胺的化合物“q203”。在pethe等人的出版物(nature medicine,19,1157-1160(2013)中,据报道该化合物通过干扰细菌能量代谢、抑制细胞色素bc1活性来对抗结核病,其中细胞色素bc1是合成atp所需的电子传递链的重要组成部分。
[0004]
虽然该化合物显示出未来治疗结核病和相关感染的前景,但是由于其在水溶液中的溶出度相当低,其给药受到了阻碍。这也使得制造该化合物的适当药物剂型变得困难。将其配制成合适的口服剂型的各种尝试均未成功。
[0005]
因此,本领域需要设计和提供适合口服并且允许通过摄入给药的药物剂型。
[0006]
本发明解决了这些以及相关的需要。
[0007]
在第一方面,本发明涉及6-氯-2-乙基-n-(4-(4-(4-(三氟甲氧基)苯基)哌啶-1)-基)苄基)咪唑并[1,2-a]吡啶-3-甲酰胺二甲苯磺酸盐的药物口服剂型,所述剂型包含以下混合物:
[0008]
a)包含6-氯-2-乙基-n-(4-(4-(4-(三氟甲氧基)苯基)哌啶-1-基)苄基)咪唑并[1,2-a]吡啶-3-甲酰胺二甲苯磺酸盐、至少一种晶内药学上可接受的赋形剂和增溶剂的颗粒;
[0009]
b)包围所述颗粒并包含至少一种粘合剂、至少一种润滑剂和至少一种崩解剂、以及任选的填料的共混物。
[0010]
在一种实施方式中,所述至少一种晶内药学上可接受的赋形剂选自粘合剂、填料以及这两者的组合。
[0011]
在一种实施方式中,所述颗粒a)由6-氯-2-乙基-n-(4-(4-(4-(三氟甲氧基)苯基)哌啶-1-基)苄基)咪唑并[1,2-a]吡啶-3-甲酰胺二甲苯磺酸盐、粘合剂、填料和增溶剂组成。
[0012]
在一种实施方式中,所述颗粒a)不含润滑剂且不含崩解剂或超级崩解剂。
[0013]
在一种实施方式中,所述颗粒a)中的粘合剂不是交联淀粉、微晶纤维素、交联纤维素、交联聚乙烯吡咯烷酮(交联聚维酮)、交联海藻酸、大豆多糖或硅酸钙。
[0014]
在一种实施方式中,所述颗粒a)中的粘合剂选自阿拉伯树胶、西黄蓍胶、明胶、蔗
糖、淀粉和非交联聚乙烯吡咯烷酮(pvp),优选地选自非交联聚乙烯吡咯烷酮(pvp)。
[0015]
在一种实施方式中,所述颗粒a)中的粘合剂以约0.1重量%至5重量%、优选地约0.2重量%至3.5重量%、更优选地约0.3重量%至3重量%的量存在于所述药物剂型中。
[0016]
在一种实施方式中,所述颗粒a)中的填料选自甘露醇、右旋糖、糊精、乳糖、山梨糖醇、蔗糖、肌醇,优选地是甘露醇。
[0017]
在一种实施方式中,所述颗粒a)中的填料以约1.5重量%至25重量%、优选地约1.75重量%至22.5重量%、更优选地约1.9重量%至20重量%的量存在于所述药物剂型中。
[0018]
在一种实施方式中,所述颗粒a)中的增溶剂选自d-α-生育酚聚乙二醇琥珀酸酯(维生素e-tpgs)、十二烷基硫酸钠(sls)、聚氧乙烯脱水山梨糖醇单油酸酯十六烷基三甲基溴化铵(ctab)、例如甘氨酸的氨基酸、聚乙二醇,优选地是d-α-生育酚聚乙二醇琥珀酸酯(维生素e-tpgs)。
[0019]
在一种实施方式中,所述颗粒a)中的增溶剂以约0.5重量%至8重量%、优选地约0.6重量%至7.5重量%、更优选地约0.68重量%至6.8重量%的量存在于所述药物剂型中。
[0020]
根据前述权利要求中任一项所述的药物口服剂型,其中所述颗粒包含,优选地由以下组成:6-氯-2-乙基-n-(4-(4-(4-(三氟甲氧基))苯基)哌啶-1-基)苄基)咪唑并[1,2-a]吡啶-3-甲酰胺二甲苯磺酸盐、为非交联聚乙烯吡咯烷酮(pvp)的粘合剂、为甘露醇的填料、以及为d-α-生育酚聚乙二醇琥珀酸酯(维生素e-tpgs)的增溶剂。
[0021]
在一种实施方式中,包围所述颗粒的所述共混物(b)中的至少一种粘合剂选自淀粉、微晶纤维素、聚维酮、羟丙基纤维素、羟丙基甲基纤维素及其组合,优选地是也具有崩解剂性质的粘合剂,更优选地是微晶纤维素。
[0022]
在一种实施方式中,包围所述颗粒的所述共混物b)中的至少一种粘合剂以约25重量%至50重量%、优选地约28重量%至45重量%、更优选地约30重量%至43重量%的量存在于所述药物剂型中。
[0023]
在一种实施方式中,包围所述颗粒的所述共混物b)中的至少一种润滑剂选自硬脂酸镁、硬脂酸钙、peg6000、硬脂基硬脂酸钠(sodium stearyl stearate)、十二烷基硫酸钠、胶体二氧化硅及其组合,其中,优选地,包围所述颗粒的所述共混物b)中的至少一种润滑剂是胶体二氧化硅和硬脂酸镁的组合。
[0024]
在一种实施方式中,包围所述颗粒的所述共混物b)中的至少一种润滑剂以约1重量%至5重量%、优选地约0.5重量%至4重量%、更优选地约0.75重量%至3.5重量%的量存在于所述药物剂型中,其中,当包围所述颗粒的所述共混物b)中的至少一种润滑剂是胶体二氧化硅和硬脂酸镁的组合时,所述胶体二氧化硅以约0.5重量%至3.5重量%、优选地约1重量%至2.5重量%、更优选地约2重量%的量存在于所述药物剂型中,并且其中在这样的组合中,所述硬脂酸镁以约0.1重量%至2重量%、优选地约0.5重量%至1.5重量%、更优选地约0.8重量%的量存在于所述药物剂型中。
[0025]
在一种实施方式中,包围所述颗粒的所述共混物b)中的至少一种崩解剂选自交联淀粉、例如羟基乙酸淀粉钠的羟基乙酸淀粉、微晶纤维素、交联纤维素、交联聚乙烯吡咯烷酮(交联聚维酮)、交联海藻酸、例如交联羧甲基纤维素钠或交联羧甲基纤维素钙的交联羧甲基纤维素、大豆多糖和硅酸钙。
[0026]
在一种实施方式中,包围所述颗粒的所述共混物b)中的至少一种崩解剂以约5重
量%至12重量%、优选地约7.5重量%至10重量%、更优选地约8重量%至8.5重量%的量存在于所述药物剂型中。
[0027]
在一种实施方式中,包围所述颗粒的所述共混物包含填料,其优选地与包含在所述颗粒中的填料相同。
[0028]
在一种实施方式中,包围所述颗粒的所述共混物中的填料以约25重量%至50重量%、优选地约27.5重量%至45重量%、更优选地约31重量%至43重量%的量存在于所述药物剂型中。
[0029]
在一种实施方式中,所述6-氯-2-乙基-n-(4-(4-(4-(三氟甲氧基)苯基)哌啶-1-基)苄基)咪唑并[1,2-a]吡啶-3-甲酰胺二甲苯磺酸盐以约1重量%至35重量%、优选地约2重量%至30重量%、更优选地约2.7重量%至27.5重量%的量存在于所述药物剂型中。
[0030]
在一种实施方式中,药物口服剂型包含以下混合物:
[0031]
a)包含所述剂型的约23重量%至30重量%的6-氯-2-乙基-n-(4-(4-(4-(三氟甲氧基)苯基)哌啶-1-基)苄基)咪唑并[1,2-a]吡啶-3-甲酰胺二甲苯磺酸盐、所述剂型的约15重量%至25重量%的甘露醇、所述剂型的约1重量%至5重量%的聚乙烯吡咯烷酮、所述剂型的约5重量%至8重量%的d-α-生育酚聚乙二醇琥珀酸酯(维生素e-tpgs)的颗粒;以及
[0032]
b)包围所述颗粒并且包含所述剂型的约30重量%至34重量%的微晶纤维素、所述剂型的约1重量%至3重量%的胶体二氧化硅、所述剂型的约0.5重量%至1.5重量%的硬脂酸镁、以及所述剂型的约7重量%至10重量%的交联羧甲基纤维素钠的共混物;
[0033]
或者
[0034]
c)包含所述剂型的约12重量%至15重量%的6-氯-2-乙基-n-(4-(4-(4-(三氟甲氧基)苯基)哌啶-1-基)苄基)咪唑并[1,2-a]吡啶-3-甲酰胺二甲苯磺酸盐、所述剂型的约8重量%至12重量%的甘露醇、所述剂型的约1重量%至2重量%的聚乙烯吡咯烷酮、所述剂型的约2重量%至5重量%的d-α-生育酚聚乙二醇琥珀酸酯(维生素e-tpgs)的颗粒;以及
[0035]
d)包围所述颗粒并且包含所述剂型的约30重量%至33重量%的微晶纤维素、所述剂型的约30重量%至33重量%的甘露醇、所述剂型的约0.5重量%至1.5重量%的硬脂酸镁、以及所述剂型的约7重量%至10重量%的交联羧甲基纤维素钠的共混物;
[0036]
或者
[0037]
e)包含所述剂型的约1重量%至5重量%的6-氯-2-乙基-n-(4-(4-(4-(三氟甲氧基)苯基)哌啶-1-基)苄基)咪唑并[1,2-a]吡啶-3-甲酰胺二甲苯磺酸盐、所述剂型的约1重量%至3重量%的甘露醇、所述剂型的约0.1重量%至0.5重量%的聚乙烯吡咯烷酮、所述剂型的约0.5重量%至0.8重量%的d-α-生育酚聚乙二醇琥珀酸酯(维生素e-tpgs)的颗粒;以及
[0038]
f)包围所述颗粒并且包含所述剂型的约40重量%至45重量%的微晶纤维素、所述剂型的约40重量%至45重量%的甘露醇、所述剂型的约0.5重量%至1.5重量%的硬脂酸镁、以及所述剂型的约7重量%至10重量%的交联羧甲基纤维素钠的共混物。
[0039]
在另一方面,本发明涉及一种制备如上限定的药物口服剂型的方法,其中所述方法包括:
[0040]
i.通过合适的制粒工艺使得如上所限定的所述颗粒a)的6-氯-2-乙基-n-(4-(4-(4-(三氟甲氧基)苯基)哌啶-1-基)苄基)咪唑并[1,2-a]吡啶-3-甲酰胺二甲苯磺酸盐及其
组分颗粒化,所述合适的制粒工艺优选地选自流化床制粒、高剪切制粒、流化床干燥、流化喷雾干燥、单锅制粒、蒸汽制粒、热粘附制粒、气动干法制粒、水分活化干法制粒、熔融制粒、冷冻制粒和泡沫制粒;
[0041]
ii.将步骤i.中获得的颗粒与如上限定的共混物的组分混合;
[0042]
iii.将步骤ii.中获得的混合物压制成药物剂型,优选地压制成片剂;并且,可选地
[0043]
iv.将步骤iii.中获得的剂型包衣。
[0044]
在又一方面,本发明涉及可通过如上限定的方法获得的药物口服剂型。
[0045]
在另一方面,本发明涉及根据本发明的药物口服剂型,其用于治疗细菌感染、优选地结核病或布鲁里溃疡。
[0046]
在又一方面,本发明还涉及治疗细菌感染、优选地结核病或布鲁里溃疡的方法,其中将所述药物剂型给药于有需要的患者。
[0047]
本发明人惊奇地发现可以将6-氯-2-乙基-n-(4-(4-(4-(三氟甲氧基)苯基)哌啶-1-基)苄基)咪唑并[1,2-a]吡啶-3-甲酰胺二甲苯磺酸盐(q203)配制成药物口服剂型。这种剂型可以通过提供高剂量均匀性的稳健制造工艺来生产。此外,根据本发明的实施方式的药物剂型可以设计成在水溶液中实现高度可再现的崩解和/或溶解。
[0048]
现在参考以下附图对本发明作进一步的描述,该附图用于说明而非限制本发明。
[0049]
更具体地,图1显示了下文所示的各种片剂制剂的q203溶出度曲线的比较。
[0050]
现在参考以下实施例对本发明作进一步的说明,这些实施例用于说明而非限制本发明。
实施例
[0051]
制备了含有q203作为活性成分的示例性制剂。为了确认样品的可制造性以验证我们的优势,按照以下通用步骤制备并生产了低浓度、中浓度和高浓度的q203片剂:制粒、混合、压制和包衣。
[0052]
实施例1
[0053]
制剂组成
[0054]
[0055][0056]
制剂制备工艺
[0057]
1.筛选q203、甘露醇、微晶纤维素、交联羧甲基纤维素钠、胶体二氧化硅和pvp k29/32。
[0058]
2.将#1粉末加入制粒机并混合。
[0059]
3.在水中加入维生素e-tpgs。
[0060]
4.混合并干燥。
[0061]
5.卸料并筛选颗粒。
[0062]
6.将颗粒、胶体二氧化硅、交联羧甲基纤维素钠和硬脂酸镁装入搅拌器。
[0063]
7.混合超过15分钟。
[0064]
8.卸料和压制片剂。
[0065]
实施例2
[0066]
制剂组成
[0067]
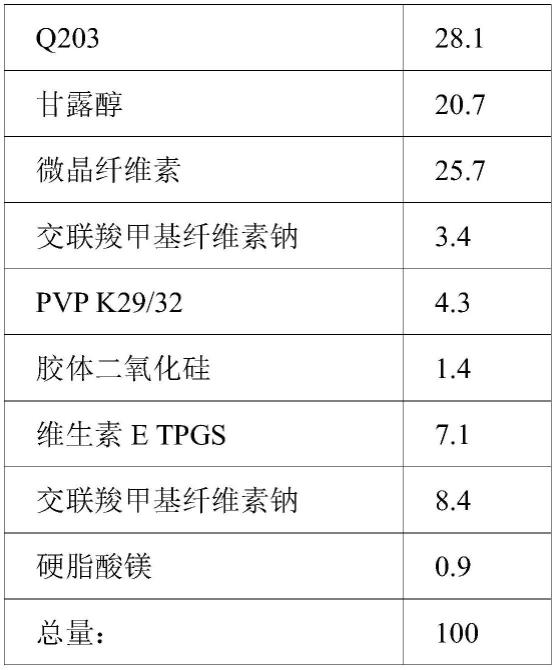
成分%含量q20328.1甘露醇20.7微晶纤维素12.8交联羧甲基纤维素钠3.4pvp k29/324.3胶体二氧化硅1.4维生素e tpgs7.1
微晶纤维素12.9交联羧甲基纤维素钠8.4硬脂酸镁0.9总量:100
[0068]
制剂制备工艺
[0069]
1.筛选q203、甘露醇、微晶纤维素、交联羧甲基纤维素钠、胶体二氧化硅和pvp k29/32。
[0070]
2.将#1粉末加入制粒机并混合。
[0071]
3.在水中加入维生素e-tpgs。
[0072]
4.混合并干燥。
[0073]
5.卸料并筛选颗粒。
[0074]
6.将颗粒、微晶纤维素、胶体二氧化硅、交联羧甲基纤维素钠和硬脂酸镁装入搅拌器。
[0075]
7.混合超过15分钟。
[0076]
8.卸料和压制片剂。
[0077]
实施例3
[0078]
制剂组成
[0079]
成分%含量q20313.6%甘露醇10.0%pvp k29/321.5%维生素e tpgs3.4微晶纤维素31.3甘露醇31.3交联羧甲基纤维素钠8.2硬脂酸镁0.8总量:100
[0080]
制剂制备工艺
[0081]
1.筛选q203、甘露醇和pvp k29/32。
[0082]
2.将#1粉末加入制粒机并混合。
[0083]
3.在水中加入维生素e-tpgs。
[0084]
4.混合并干燥。
[0085]
5.卸料并筛选颗粒
[0086]
6.将颗粒、微晶纤维素、甘露醇、交联羧甲基纤维素钠和硬脂酸镁装入搅拌器。
[0087]
7.混合超过15分钟。
[0088]
8.卸料和压制片剂。
[0089]
实施例4
[0090]
制剂组成
[0091]
成分%含量
q2032.8甘露醇2.1微晶纤维素1.3交联羧甲基纤维素钠0.3pvp k29/320.4胶体二氧化硅0.1维生素e tpgs0.7甘露醇41.3微晶纤维素41.3交联羧甲基纤维素钠8.4硬脂酸镁1.2总量:100
[0092]
制剂制备工艺
[0093]
1.筛选q203、甘露醇、微晶纤维素、交联羧甲基纤维素钠、胶体二氧化硅和pvp k29/32。
[0094]
2.将#1粉末加入制粒机并混合。
[0095]
3.在水中加入维生素e-tpgs。
[0096]
4.混合并干燥。
[0097]
5.卸料并筛选颗粒。
[0098]
6.将颗粒、甘露醇、微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁装入搅拌器。
[0099]
7.混合超过15分钟。
[0100]
8.卸料和压制片剂。
[0101]
实施例5
[0102]
q203溶出度曲线的比较
[0103]
使用usp装置2以75rpm和900ml的0.1n hcl进行药物释放试验,该试验用于研究37℃
±
0.5℃下的体外释放。在速释固体口服剂型溶出度试验指南中,对于为溶解缓慢或水溶性较差的药物的bcs 2类产品,建议对产品质量进行表征,以确保85%的溶出度。根据实施例2、3和4制造的q203片剂显示快速溶解;并且在所有三个批次中都观察到在15分钟时完全溶解(》90%)。因此这些制剂是合适的制剂并且实现了高度可再现的崩解和/或溶解。结果如下表和图1所示。(应该注意的是,溶出度》100%意味着这种溶出度高于溶出度试验中使用的相应对照制剂的溶出度。)
[0104]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1