使用靶向CD70的基因工程化T细胞的CD70+实体瘤疗法的制作方法
使用靶向cd70的基因工程化t细胞的cd70+实体瘤疗法
1.相关申请的交叉引用
2.本技术要求2019年11月13日提交的美国临时专利申请号62/934,975和2020年6月4日提交的美国临时专利申请号63/034,563的权益和优先权。每一个先前申请特此通过援引以其全文并入。
背景技术:
3.嵌合抗原受体(car)t细胞疗法使用基因修饰t细胞来更特异性且高效地靶向和杀伤癌细胞。从血液中收集t细胞之后,对细胞进行工程化以在其表面上包含car。可以使用crispr/cas9基因编辑技术将car引入t细胞中。将这些同种异体car t细胞注射至患者体内时,受体使t细胞能够杀伤癌细胞。
技术实现要素:
4.本披露至少部分地基于令人惊讶的发现,即抗cd70 car+t细胞减少各种皮下实体瘤异种移植物模型中的肿瘤负荷。还已证明本文所述的抗cd70 car t细胞展示出在再暴露于肿瘤细胞之后阻止肿瘤生长的长期体内功效。在再给药抗cd70 car t细胞之后也观察到肿瘤负荷的显著减少。此外,在接受car-t细胞的人受试者中观察到ctx130细胞分布、扩增和持久性。在接受ctx130细胞治疗的患有rcc(代表性cd70+实体瘤)的人患者中也观察到优异的治疗功效。
5.因此,本披露的方面提供了用于治疗cd70+实体瘤的方法,这些方法包括(i)对患有cd70+实体瘤的人患者进行淋巴细胞清除治疗,以及(ii)在步骤(i)之后向该人患者施用基因工程化t细胞群体(也称为car t细胞疗法)。
6.在一些实施例中,本文提供了一种用于治疗cd70+实体瘤的方法,该方法包括(i)对患有cd70+实体瘤的人患者进行第一淋巴细胞清除治疗;以及(ii)在步骤(i)之后向该人患者施用第一剂量的基因工程化t细胞群体,其中该基因工程化t细胞群体包含表达结合cd70的嵌合抗原受体(car)并且包含被破坏的β2m基因、被破坏的cd70基因和编码该car的核苷酸序列插入其中的被破坏的trac基因的t细胞。在一些实例中,该基因工程化t细胞群体是如本文披露的ctx130细胞。
7.在一些实施例中,步骤(i)中的该第一淋巴细胞清除治疗包括向该人患者每天静脉内共同施用30mg/m2的氟达拉滨和500mg/m2的环磷酰胺,持续三天。
8.在一些实施例中,在步骤(i)之前,该人患者不显示以下特征中的一种或多种:(a)临床状态显著恶化,(b)需要补充氧气以维持大于90%的饱和度水平,(c)不受控制的心律失常,(d)需要血管升压药支持的低血压,(e)活动性感染,以及(f)≥2级急性神经毒性。
9.在一些实施例中,在步骤(ii)之前约2-7天进行步骤(i)。在一些实施例中,通过将该基因工程化t细胞群体以该第一剂量静脉内施用至该人患者来进行步骤(ii),该第一剂量是约1x106个car
+
细胞至约1x109个car
+
细胞。在一些实例中,该第一剂量的范围可以为从约3x107至约9x108个car+细胞。
10.在一些实施例中,在步骤(ii)之前和在步骤(i)之后,该人患者不显示以下特征中的一种或多种:(a)活动性不受控制的感染,(b)与在步骤(i)之前的临床状态相比的临床状态恶化,以及(c)≥2级急性神经毒性。
11.在一些实施例中,本文披露的方法进一步包括(iii)在步骤(ii)之后监测该人患者的急性毒性的发展。在一些实施例中,急性毒性包括细胞因子释放综合征(crs)、神经毒性(例如,icans)、肿瘤溶解综合征(tls)、gvhd、中靶脱肿瘤毒性和/或不受控制的t细胞增殖。该中靶脱肿瘤毒性可以包括该基因工程化t细胞群体针对激活的t淋巴细胞、b淋巴细胞、树突状细胞、成骨细胞和/或肾小管样上皮细胞的活性。
12.在一些实施例中,本文披露的方法进一步包括在步骤(ii)数周之后,(iv)对该人患者进行第二淋巴细胞清除治疗,并且(v)向该人患者施用第二剂量的该基因工程化t细胞群体。在一些情况下,该人患者在步骤(ii)之后不显示以下中的一种或多种:(a)剂量限制性毒性(dlt),(b)在72小时内未消退至2级的4级crs,(c)》1级gvhd,(d)≥3级神经毒性,(e)活动性感染,(f)血流动力学不稳定,以及(g)器官功能障碍。该第二剂量的该基因工程化t细胞群体可以在该第一剂量之后约8周至约2年施用至该受试者。在一些情况下,该第二剂量可以在该第一剂量之后约6-10周施用至该受试者。在其他情况下,该第二剂量可以在该第一剂量之后约14-18周施用至该受试者。
13.在一些实施例中,步骤(iv)中的该第二淋巴细胞清除治疗包括向该人患者每天静脉内共同施用30mg/m2的氟达拉滨和500mg/m2的环磷酰胺,持续1-3天。
14.在一些实施例中,在步骤(iv)之后2-7天进行步骤(v)。在一些实施例中,通过将该基因工程化t细胞群体以该第二剂量静脉内施用至该人患者来进行步骤(v),该第二剂量是约1x106个car
+
细胞至约1x109个car
+
细胞。在一些实例中,该第一剂量的范围可以为从约3x107至约9x108个car+细胞。
15.在一些实施例中,该方法可以进一步包括在步骤(ii)之后约8周至约2年(例如,约14-18周),(vi)对该人患者进行第三淋巴细胞清除治疗,并且(vii)向该人患者施用第三剂量的该基因工程化t细胞群体。在一些情况下,该第二剂量的该基因工程化t细胞群体在步骤(ii)之后约8周至约两年(例如,约8-10周)施用。替代性地或另外,该第三剂量的该基因工程化t细胞群体可以在该第二剂量之后约8周至约2年施用至该受试者。在一些情况下,该第三剂量可以在该第二剂量之后约8-10周施用至该受试者。在其他情况下,该第三剂量可以在该第二剂量之后约14-18周施用至该受试者。
16.在一些实例中,该人患者在步骤(v)之后不显示以下中的一种或多种:(a)剂量限制性毒性(dlt),(b)在72小时内未消退至2级的4级crs,(c)》1级gvhd,(d)≥3级神经毒性,(e)活动性感染,(f)血流动力学不稳定,以及(g)器官功能障碍。
17.在一些实施例中,步骤(vi)中的该第三淋巴细胞清除治疗包括向该人患者每天静脉内共同施用30mg/m2的氟达拉滨和500mg/m2的环磷酰胺,持续1-3天。
18.在一些实施例中,在步骤(vi)之后2-7天进行步骤(vii)。在一些实施例中,通过将该基因工程化t细胞群体以该第三剂量静脉内施用至该人患者来进行步骤(vii),该第三剂量可以是约1x106个car
+
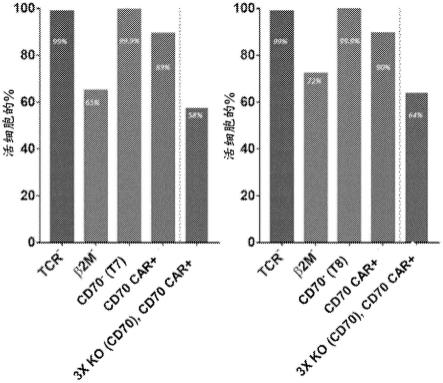
细胞至约1x109个car
+
细胞。在一些实例中,该第二剂量的范围可以为从约3x107至约9x108个car+细胞。
19.在一些实施例中,该人患者显示出疾病稳定或疾病进展。
20.在一些实施例中,该基因工程化t细胞群体的该第一剂量、该第二剂量和/或该第三剂量是约1x106个car
+
细胞、约3x107个car
+
细胞、约1x108个car
+
细胞或约1x109个car
+
细胞。在一些实例中,该基因工程化t细胞群体的该第一剂量、该第二剂量和/或该第三剂量是约1.5x108个car
+
细胞。在一些实例中,该基因工程化t细胞群体的该第一剂量、该第二剂量和/或该第三剂量是约3x108个car
+
细胞。在一些实例中,该基因工程化t细胞群体的该第一剂量、该第二剂量和/或该第三剂量是约4.5x108个car
+
细胞。在一些实例中,该基因工程化t细胞群体的该第一剂量、该第二剂量和/或该第三剂量是约6x108个car
+
细胞。在一些实例中,该基因工程化t细胞群体的该第一剂量、该第二剂量和/或该第三剂量是约7.5x108个car
+
细胞。在一些实例中,该基因工程化t细胞群体的该第一剂量、该第二剂量和/或该第三剂量是约9x108个car
+
细胞。在一些实例中,该基因工程化t细胞群体的该第一剂量、该第二剂量和/或该第三剂量是约1x109个car
+
细胞。
21.在一些实施例中,该基因工程化t细胞群体的该第一剂量与该基因工程化t细胞群体的该第二和/或第三剂量相同。在一些实施例中,该基因工程化t细胞群体的该第一剂量低于该基因工程化t细胞群体的该第二和/或第三剂量。
22.在一些实施例中,该人患者是成人。在一些实施例中,该人患者已经受过先前抗癌疗法。在一些实施例中,该先前抗癌疗法包括检查点抑制剂、酪氨酸激酶抑制剂、血管内皮因子(vegf)抑制剂或其组合。在一些实施例中,该cd70+实体瘤是复发性或难治性的。在一些实施例中,该人患者具有cd70+肿瘤细胞。在一些实施例中,该人患者在从该人患者获得的生物样品中具有cd70+肿瘤细胞。因此,在一些情况下,本文披露的任何方法可以进一步包括在步骤(i)之前,鉴定具有cd70+肿瘤细胞的人患者。
23.在一些实施例中,对该人患者进行抗细胞因子疗法。在一些实施例中,在用该基因工程化t细胞群体治疗之后对该人患者进行自体或同种异体造血干细胞移植。
24.在一些实施例中,该人患者具有以下特征中的一种或多种:(a)卡诺夫斯基(karnofsky)性能状态(kps)≥80%,(b)足够的器官功能,(c)未接受先前干细胞移植(sct),(d)未接受先前抗cd70剂或过继t细胞或nk细胞疗法,(e)没有对淋巴细胞清除疗法的已知禁忌症,(f)没有目前或过去具有症状性的恶性积液的t细胞或b细胞淋巴瘤,(g)没有噬血细胞性淋巴组织细胞增生症(hlh),(h)没有中枢神经系统恶性肿瘤或障碍,(i)没有不稳定型心绞痛、心律失常和/或心肌梗塞,(j)没有糖尿病,(k)没有不受控制的感染,(l)没有需要免疫抑制疗法的免疫缺陷障碍或自身免疫性障碍,以及(m)未接受实体器官移植或骨髓移植。
25.在一些实施例中,在该基因工程化t细胞群体的每次施用之后,监测该人患者的毒性的发展至少28天。在一些实施例中,如果观察到毒性的发展,则对该人患者进行毒性管理。
26.在一些实施例中,该结合cd70的car包含细胞外结构域、cd8跨膜结构域、4-1bb共刺激结构域和cd3ζ细胞质信号传导结构域,并且其中该细胞外结构域是结合cd70的单链抗体片段(scfv)。在一些实施例中,该scfv包含含有seq id no:49的重链可变结构域(vh)和含有seq id no:50的轻链可变结构域(v
l
)。在一些实施例中,该scfv包含seq id no:48。在一些实施例中,该car包含seq id no:46。
27.在一些实施例中,该被破坏的trac基因通过crispr/cas9基因编辑系统产生,该基
因编辑系统包括含有seq id no:8或9的间隔子序列的指导rna。在一些实施例中,该被破坏的trac基因具有由seq id no:8的间隔子序列靶向的区域或其一部分的缺失。
28.在一些实施例中,该被破坏的β2m基因通过crispr/cas9基因编辑系统产生,该基因编辑系统包括含有seq id no:12或13的间隔子序列的指导rna。
29.在一些实施例中,该被破坏的cd70基因通过crispr/cas9基因编辑系统产生,该基因编辑系统包括含有seq id no:4或5的间隔子序列的指导rna。
30.在一些实施例中,该cd70+实体瘤是肺癌、胃癌、卵巢癌、胰腺癌或前列腺癌。
附图说明
31.图1包括示出了在trac-/β2m-/cd70-/抗cd70 car
+
(即,3x ko,cd70car
+
)t细胞中的高效多基因编辑的图。
32.图2包括显示在trac-/β2m-/cd70-/抗cd70 car
+
t细胞群体中维持正常比例的cd4+和cd8+t细胞的图。
33.图3包括示出了在trac-/β2m-/cd70-/抗cd70 car
+
t细胞中的稳健细胞扩增的图。在3x ko(trac-/β2m-/cd70-)和2x ko(trac-/β2m-)抗cd70 car t细胞中定量活细胞总数。用cd70 sgrna t7或t8产生3x ko细胞。
34.图4包括示出了与2x ko(trac-/β2m-)抗cd70 car
+
t细胞相比,3x ko(trac-/β2m-/cd70-)抗cd70 car
+
t细胞对a498细胞的稳健细胞杀伤的图。
35.图5包括示出了在连续再激发之后抗cd70 car t细胞的a498细胞杀伤的图。利用了3x ko(trac-/β2m-/cd70-)和ctx130细胞开发批次(ctx130)抗cd70 car+t细胞。
36.图6a-6c包括示出了测试ctx130细胞开发批次(批次01)在cd70+肾细胞癌细胞的存在下的细胞因子分泌的结果的图。将ctx130细胞与cd70+(a498;图6a或achn;图6b)或cd70-(mcf7;图6c)靶细胞以所指示的比率共培养。未编辑的t细胞用作对照t细胞。确定ifn-γ(左)和il-2(右)水平。示出了生物学一式三份的平均值
±
标准偏差。
37.图7a-7c包括示出了在多种t细胞与靶细胞比率下测试ctx130细胞开发批次(批次01)针对cd70高(a498;图7a)、cd70低(achn;图7b)和cd70阴性(mcf7;图7c)细胞系的细胞杀伤活性的结果的图。每个数据点表示来自一式三份的数据
±
标准偏差。负值示出为零。
38.图8a-8h包括示出了各种类型的癌细胞上的cd70表达和抗cd70car-t细胞针对此类癌细胞的细胞毒性的图。图8a:如所指示的五个不同癌细胞系中的相对cd70表达。图8b:如所指示的三个不同癌细胞系中的相对cd70表达。图8c是示出了九个不同癌细胞系中的相对cd70表达的图。图8d是示出了使用三重敲除trac-/β2m-/cd70-/抗cd70 car
+
t细胞的针对具有不同水平的cd70表达的另外实体瘤细胞系的细胞杀伤活性(4:1、1:1或0.25:1效应物:靶细胞比率)的图。图8e包括示出了在24小时或96小时共培养时段之后使用三重敲除trac-/β2m-/cd70-/抗cd70car
+
t细胞的针对实体瘤细胞系的细胞杀伤活性的图。图8f-8h包括示出了在各种效应物:靶标比率下使用三重敲除trac-/β2m-/cd70-/抗cd70car
+
t细胞(3ko(cd70),cd70 car+)的针对cd70缺陷型慢性髓细胞性白血病(k562)细胞(图8f)、表达cd70的多发性骨髓瘤(mm.1s)细胞(图8g)和表达cd70的t细胞淋巴瘤(hut78)细胞(图8h)的细胞杀伤活性的图。
39.图9a-9d包括示出了在各种皮下肾细胞癌肿瘤异种移植物模型中测试ctx130细胞
的结果的图。图9a:皮下a498-nog模型。图9b:皮下786-o-nsg模型。图9c:皮下caki-2-nsg模型。图9d:皮下caki-1-nsg模型。在研究期间每周两次测量肿瘤体积。每个点表示平均肿瘤体积
±
标准误差。
40.图10包括示出了在肿瘤再激发的情况下测试ctx130细胞在皮下a498异种移植物模型中的功效的结果的图。使肿瘤生长到大约51mm3的平均大小,然后将荷瘤小鼠随机分成两组(n=5只/组)。将组1不治疗,而组2接受7x106个car+ctx130细胞并且组3接受8x106个car+trac-b2m-抗cd70 car t细胞。在第25天,开始肿瘤再激发,由此将5x106个a498细胞注射至治疗小鼠的左侧腹中且注射至新对照组(组4)中。在研究期间每周两次测量肿瘤体积。每个点表示平均肿瘤体积
±
标准误差。
41.图11包括示出了在再给药ctx130细胞的情况下测试ctx130细胞在皮下a498异种移植物模型中的功效的结果的图。当平均肿瘤大小达到平均大小为大约453mm3时,将小鼠不治疗或静脉内注射(n=5)8.6x106个car+ctx130细胞/小鼠。在第17和36天将组2小鼠分别用第二和第三剂量的8.6x106个car+ctx130细胞/小鼠治疗。在第36天将组3小鼠用第二剂量的8.6x106个car+ctx130细胞/小鼠治疗。在研究期间每周两次测量肿瘤体积。每个点表示平均肿瘤体积
±
标准误差。
42.图12a包括示出了设计用于评估暴露于3x ko(trac-/b2m-/cd70-)抗cd70 car t细胞的人卵巢肿瘤异种移植物模型(例如,skov-3肿瘤细胞)中肿瘤体积减少的实验的结果的图。图12b包括示出了设计用于评估暴露于3x ko(trac-/b2m-/cd70-)抗cd70 car t细胞的人非小细胞肺肿瘤异种移植物模型(例如,nci-h1975肿瘤细胞)中肿瘤体积减少的实验的结果的图。图12c包括示出了设计用于评估暴露于3x ko(trac-/b2m-/cd70-)抗cd70 car t细胞的人胰腺肿瘤异种移植物模型(例如,hs766t肿瘤细胞)中肿瘤体积减少的实验的结果的图。图12d包括示出了设计用于评估暴露于3x ko(trac-/b2m-/cd70-)抗cd70 car t细胞的人胃肿瘤异种移植物模型(例如,snu-1肿瘤细胞)中肿瘤体积减少的实验的结果的图。
43.图13是描绘用于评价向患有cd70+实体瘤的成人受试者的ctx130细胞施用的示例性临床研究设计的示意图。dlt:剂量限制性毒性;m:月;max:最大值;min:最小值。dlt评价期是ctx130输注之后的前28天。
44.本发明的一个或多个实施例的细节在以下说明书中阐述。根据以下附图和对若干实施例的详细描述,并且还根据所附权利要求,本发明的其他特征或优点将变得清楚。
具体实施方式
45.cd70是肿瘤坏死因子受体(tnfr)超级族成员cd27的ii型膜蛋白和配体(goodwin,(1993)cell[细胞],73,447-456),在人和小鼠两者中其健康组织表达分布限于激活的淋巴细胞以及树突状和胸腺上皮细胞的亚群(hintzen,(1994)the journal of immunology[免疫学杂志],152,1762-1773;grewal,(2008)expert opin ther targets[治疗目标的专家意见],12,341-51;coquet等人(2013)j exp med[实验医学杂志],210,715-728;tesselaar等人,(2003)j immunol[免疫学杂志],170,33-40)。树突状细胞表面上表达的cd70的连接与t细胞表达的cd27的连接产生了有助于tnf/tnfr对的t细胞激活和增殖特征的共刺激信号(watts,(2005)immunol[免疫学],23,23-68)。另外,cd70本身是在激活的淋巴细胞上经上调并且可以充当限制不受控制的t细胞扩增的检查点的信号传导分子(o’neill等人,
(2017)j immunol[免疫学杂志],199,3700-3710)。cd27是组成型表达的t细胞表面受体,并且cd27-cd70介导的淋巴细胞刺激主要由cd70的受限空间和时间表达模式控制。典型地,cd70在激活的淋巴细胞表面上保持最长数天(hintzen,(1994)the journal of immunology[免疫学杂志],152,1762-1773;lens,(1999)british journal of hematology[英国血液学杂志],106,491-503;nolte,(2009)immunological reviews[免疫学评论],229,216-31)。
[0046]
与其严格控制的正常组织表达相比,cd70通常以升高的水平表达于许多实体瘤中(flieswasser等人,cancers[癌症],11 1161,1-13,2019;grewal,(2008)expert opin ther targets[治疗目标的专家意见],12,341-51;wajant,2016expert opin ther targets[治疗目标的专家意见],20,959-73)。cd70在正常组织中的受限表达模式及其在各种恶性肿瘤中的广泛表达使其成为基于抗体的治疗剂的有吸引力的靶标。
[0047]
令人惊讶地,如本文披露的抗cd70 car+t细胞成功减少各种皮下cd70阳性实体瘤异种移植物模型中的肿瘤负荷,并且展示出在再暴露于肿瘤细胞之后阻止肿瘤生长的长期体内功效。具体地,抗cd70 car+t细胞显著减少了卵巢、肺、胰腺和胃异种移植物模型中的肿瘤负荷。在再给药抗cd70 car t细胞之后也观察到肿瘤负荷的显著减少。
[0048]
因此,在一些方面,本披露提供了抗cd70 car+t细胞(例如,ctx130细胞)用于治疗cd70阳性实体瘤的治疗性用途。抗cd70 car t细胞、产生此类细胞(例如,经由crispr方法)的方法以及用于制备本文披露的抗cd70 car+t细胞的组分和方法(例如,用于基因编辑的crispr方法及其中使用的组分)也在本披露的范围内。
[0049]
i.抗cd70同种异体car t细胞
[0050]
本文披露了抗cd70 car t细胞(例如,ctx130细胞),用于在治疗表达cd70的癌症(例如,cd70+实体瘤)中使用。在一些实施例中,抗cd70car t细胞是具有被破坏的trac基因、被破坏的b2m基因、被破坏的cd70基因或其组合的同种异体t细胞。在具体实例中,抗cd70 car t细胞表达抗cd70 car并且具有被破坏的内源性trac、b2m和cd70基因。可以使用本领域已知的任何合适的基因编辑方法来制备本文披露的抗cd70 car t细胞,例如使用锌指核酸酶(zfn)、转录激活因子样效应核酸酶(talen)或rna指导的crispr-cas9核酸酶(crispr/cas9;成簇规律间隔短回文重复序列相关9)来进行核酸酶依赖性靶向编辑。
[0051]
抗cd70 car t细胞的示例性基因修饰包括t细胞受体α恒定(trac)、β2m、cd70或其组合的靶向破坏。trac基因座的破坏导致t细胞受体(tcr)表达的丧失并且旨在降低移植物抗宿主病(gvhd)的概率,而β2m基因座的破坏导致主要组织相容性复合物i型(mhc i)蛋白表达的缺乏并且旨在通过降低宿主排斥的概率来改善持久性。cd70的破坏导致cd70表达的丧失,这防止了在插入cd70 car之前可能的细胞间兄弟相杀。抗cd70car的添加将修饰的t细胞定向至表达cd70的肿瘤细胞。
[0052]
抗cd70 car可以包含对cd70具有特异性的抗cd70单链可变片段(scfv),之后是与细胞内共信号传导结构域(例如,4-1bb共刺激结构域)和cd3ζ信号传导结构域融合的铰链结构域和跨膜结构域(例如,cd8铰链和跨膜结构域)。
[0053]
(i)嵌合抗原受体(car)
[0054]
嵌合抗原受体(car)是指人工免疫细胞受体,该人工免疫细胞受体经工程化以识别并结合不希望的细胞(例如,疾病细胞诸如癌细胞)表达的抗原。表达car多肽的t细胞被
称为car t细胞。car具有以非mhc限制性方式将t细胞特异性和反应性重定向至所选靶标的能力。非mhc限制性抗原识别赋予car-t细胞独立于抗原加工识别抗原的能力,从而绕开了肿瘤逃逸的主要机制。此外,当在t细胞上表达时,car有利地未与内源性t细胞受体(tcr)α和β链二聚化。
[0055]
有不同代的car,每一代都含有不同的组分。第一代car通过铰链和跨膜结构域将抗体衍生的scfv与t细胞受体的cd3ζ(ζ或z)细胞内信号传导结构域连接。第二代car并入另外的共刺激结构域(例如,cd28、4-1bb(41bb)或icos)以提供共刺激信号。第三代car含有与tcr cd3ζ链融合的两个共刺激结构域(例如,cd27、cd28、4-1bb、icos或ox40的组合)。maude等人,blood[血液].2015;125(26):4017-4023;kakarla和gottschalk,cancer j.[癌症杂志]2014;20(2):151-155)。不同代car构建体中的任一代都在本披露的范围内。
[0056]
一般地说,car是融合多肽,该融合多肽包含识别靶抗原的细胞外结构域(例如,抗体的单链片段(scfv)或其他抗体片段)和细胞内结构域,该细胞内结构域包含t细胞受体(tcr)复合物的信号传导结构域(例如,cd3ζ),并且在大多数情况下包含共刺激结构域。(enblad等人,human gene therapy[人基因疗法].2015;26(8):498-505)。car构建体可以进一步包含位于细胞外结构域与细胞内结构域之间的铰链和跨膜结构域,以及用于表面表达的n末端的信号肽。信号肽的实例包括mlllvtslllcelphpafllip(seq id no:52)和malpvtalllplalllhaarp(seq id no:53)。可以使用其他信号肽。
[0057]
(a)抗原结合细胞外结构域
[0058]
抗原结合细胞外结构域是当car在细胞表面表达时暴露于细胞外流体的car多肽的区域。在一些情况下,信号肽可以位于n末端,以促进细胞表面表达。在一些实施例中,抗原结合结构域可以是单链可变片段(scfv,其可以包含抗体重链可变区(vh)和抗体轻链可变区(v
l
)(以任一取向))。在一些情况下,vh和v
l
片段可以经由肽接头连接。在一些实施例中,接头包含亲水性残基,其中甘氨酸和丝氨酸的段用于柔性并且谷氨酸和赖氨酸的段用于增加溶解度。scfv片段保留了scfv片段衍生自的亲本抗体的抗原结合特异性。在一些实施例中,scfv可以包含人源化vh和/或v
l
结构域。在其他实施例中,scfv的vh和/或v
l
结构域是完全人的。
[0059]
抗原结合细胞外结构域可以对目的靶抗原,例如病理性抗原诸如肿瘤抗原具有特异性。在一些实施例中,肿瘤抗原是“肿瘤相关抗原”,是指免疫原性分子(诸如蛋白质),该免疫原性分子通常在肿瘤细胞中的表达水平高于非肿瘤细胞中的表达水平,其在非肿瘤细胞中可以完全不表达或仅以较低水平表达。在一些实施例中,被携带肿瘤的宿主的免疫系统识别的肿瘤相关结构被称为肿瘤相关抗原。在一些实施例中,如果肿瘤相关抗原由大多数类型的肿瘤广泛表达,则该肿瘤相关抗原是通用肿瘤抗原。在一些实施例中,肿瘤相关抗原是分化抗原、突变抗原、过表达的细胞抗原或病毒抗原。在一些实施例中,肿瘤抗原是“肿瘤特异性抗原”或“tsa”,是指肿瘤细胞特有的免疫原性分子,诸如蛋白质。肿瘤特异性抗原仅在肿瘤细胞中表达,例如在特定类型的肿瘤细胞中表达。
[0060]
在一些实例中,本文披露的car构建体包含能够结合cd70的scfv细胞外结构域。抗cd70 car的实例提供于以下实例中。
[0061]
(b)跨膜结构域
[0062]
本文披露的car多肽可以含有跨膜结构域,该跨膜结构域可以是跨膜的疏水性α螺
旋。如本文所用,“跨膜结构域”是指在细胞膜、优选真核细胞膜中热力学稳定的任何蛋白质结构。跨膜结构域可以提供含有其的car的稳定性。
[0063]
在一些实施例中,如本文提供的car的跨膜结构域可以是cd8跨膜结构域。在其他实施例中,跨膜结构域可以是cd28跨膜结构域。在又其他实施例中,跨膜结构域是cd8和cd28跨膜结构域的嵌合体。如本文提供的,可以使用其他跨膜结构域。在一些实施例中,跨膜结构域是含有fvpvflpakptttpaprpptpaptiasqplslrpeacrpaaggavhtrgldf acdiyiwaplagtcgvlllslvitlycnhrnr(seq id no:54)或iyiwaplagtcgvlllslvitly(seq id no:55)的序列的cd8a跨膜结构域。可以使用其他跨膜结构域。
[0064]
(c)铰链结构域
[0065]
在一些实施例中,铰链结构域可以位于car的细胞外结构域(包含抗原结合结构域)与跨膜结构域之间或者car的细胞质结构域与跨膜结构域之间。铰链结构域可以是起到将跨膜结构域连接至多肽链中的细胞外结构域和/或细胞质结构域的功能的任何寡肽或多肽。铰链结构域可以起到向car或其结构域提供柔性或防止car或其结构域的空间位阻的功能。
[0066]
在一些实施例中,铰链结构域可以包含多达300个氨基酸(例如,10至100个氨基酸或5至20个氨基酸)。在一些实施例中,一个或多个铰链结构域可以包含在car的其他区域中。在一些实施例中,铰链结构域可以是cd8铰链结构域。可以使用其他铰链结构域。
[0067]
(d)细胞内信号传导结构域
[0068]
任何car构建体均含有作为受体的功能性末端的一个或多个细胞内信号传导结构域(例如,cd3ζ,和任选地一个或多个共刺激结构域)。抗原识别后,受体聚簇,并且信号被传递至细胞。
[0069]
cd3ζ是t细胞受体复合物的细胞质信号传导结构域。cd3ζ包含三(3)个基于免疫受体酪氨酸的激活基序(itam),在t细胞与同源抗原接合后,它们将激活信号传递至t细胞。在许多情况下,cd3ζ提供初级t细胞激活信号,但不提供有完全能力的激活信号,该激活信号需要共刺激信号传导。
[0070]
在一些实施例中,本文披露的car多肽可以进一步包含一个或多个共刺激信号传导结构域。例如,cd28和/或4-1bb的共刺激结构域可以用于连同cd3ζ介导的初级信号传导传递完全的增殖/存活信号。在一些实例中,本文披露的car包含cd28共刺激分子。在其他实例中,本文披露的car包含4-1bb共刺激分子。在一些实施例中,car包含cd3ζ信号传导结构域和cd28共刺激结构域。在其他实施例中,car包含cd3ζ信号传导结构域和4-1bb共刺激结构域。在其他实施例中,car包含cd3ζ信号传导结构域、cd28共刺激结构域和4-1bb共刺激结构域。
[0071]
应当理解,本文所述的方法涵盖多于一种可用于产生表达car的基因工程化t细胞的合适的car,例如本领域已知的或本文披露的那些。实例可在例如wo 2019/097305 a2和wo 2019/215500中找到,每一个先前申请的相关披露内容通过援引并入本文以用于本文提及的目的和主题。
[0072]
例如,car结合cd70(也称为“cd70 car”或“抗cd70 car”)。结合cd70的示例性car的氨基酸序列提供于seq id no:46中。
[0073]
表1.示例性抗cd70 car构建体组分的序列。
[0074]
[0075]
[0076]
[0077]
[0078]
[0079][0080]
(ii)trac、b2m和/或cd70基因的敲除
[0081]
本文披露的抗cd70 car-t细胞可以进一步具有被破坏的trac基因、被破坏的b2m基因、被破坏的cd70基因或其组合。trac基因座的破坏导致t细胞受体(tcr)表达的丧失并且旨在降低移植物抗宿主病(gvhd)的概率,而β2m基因座的破坏导致主要组织相容性复合物i型(mhc i)蛋白表达的缺乏并且旨在通过降低宿主排斥的概率来改善持久性。cd70基因的破坏将最小化在产生抗cd70 car-t细胞中的兄弟相杀效应。此外,cd70基因的破坏意料不到地增加所得工程化t细胞的健康和活性。抗cd70 car的添加将修饰的t细胞定向至表达cd70的肿瘤细胞。
[0082]
如本文所用,术语“被破坏的基因”是指含有相对于野生型对应物的一个或多个突变(例如,插入、缺失或核苷酸取代等)以大大降低或完全消除编码的基因产物的活性的基因。该一个或多个突变可以位于非编码区,例如启动子区、调控转录或翻译的调控区、或内含子区中。替代性地,该一个或多个突变可以位于编码区中(例如,外显子中)。在一些情况
下,被破坏的基因不表达编码蛋白或表达大大降低的水平的编码蛋白。在其他情况下,被破坏的基因表达呈突变形式的编码蛋白,该编码蛋白没有功能性或具有大大降低的活性。在一些实施例中,被破坏的基因是不编码功能性蛋白质的基因。在一些实施例中,包含被破坏的基因的细胞不表达(例如,不在细胞表面表达)可检测水平(例如,通过抗体,例如,通过流式细胞术)的由该基因编码的蛋白质。不表达可检测水平的蛋白质的细胞可以称为敲除细胞。例如,如果使用特异性结合β2m蛋白的抗体在细胞表面不能检测到β2m蛋白,则具有β2m基因编辑的细胞可以认为是β2m敲除细胞。
[0083]
在一些实施例中,可以将被破坏的基因描述为包含相对于野生型对应物的突变片段。突变片段可以包含缺失、核苷酸取代、添加或其组合。在其他实施例中,可以将被破坏的基因描述为缺失野生型对应物中存在的片段。在一些情况下,缺失片段的5'端可以位于设计的指导rna(诸如本文披露的那些)所靶向的基因区域(称为中靶序列)内,并且缺失片段的3'端可以超出所靶向区域。替代性地,缺失片段的3'端可以位于所靶向区域内,并且缺失片段的5'端可以超出所靶向区域。
[0084]
在一些情况下,本文披露的抗cd70 car-t细胞中的被破坏的trac基因可以包含缺失,例如trac基因座的外显子1中的片段的缺失。在一些实例中,被破坏的trac基因包含含有seq id no:17的核苷酸序列的片段的缺失,该核苷酸序列是trac指导rna ta-1的靶位点。参见下面的序列表。在一些实例中,seq id no:17的片段可以被编码抗cd70 car的核酸替换。这种被破坏的trac基因可以包含seq id no:44的核苷酸序列。
[0085]
本文披露的抗cd70 car-t细胞中的被破坏的b2m基因可以使用crispr/cas技术产生。在一些实例中,可以使用下面序列表中提供的b2m grna。被破坏的b2m基因可以包含seq id no:31-36中任一个的核苷酸序列。参见下表4。
[0086]
替代性地或另外,本文披露的抗cd70 car-t细胞中的被破坏的cd70基因可以使用crispr/cas技术产生。在一些实例中,可以使用下面序列表中提供的cd70 grna。被破坏的cd70基因可以包含seq id no:37-42中任一个的核苷酸序列。参见下表5。
[0087]
(iii)示例性抗cd70 car t细胞
[0088]
在一些实例中,抗cd70 car t细胞是ctx130细胞,这些细胞是具有被破坏的trac基因、b2m基因和cd70基因的cd70定向性t细胞。ctx130细胞可以经由使用crispr/cas9(成簇规律间隔短回文重复序列/crispr相关蛋白9)基因编辑组分(sgrna和cas9核酸酶)的离体基因修饰产生。
[0089]
也在本披露的范围内的是抗cd70 car t细胞群体(例如,ctx130细胞群体),这些群体包含表达本文披露的抗cd70 car和被破坏的trac、b2m和cd70基因的基因工程化细胞(例如,crispr-cas9介导的基因编辑的);并且编码抗cd70 car的核苷酸序列插入trac基因座中。
[0090]
应当理解,基因破坏涵盖通过基因编辑产生的基因修饰(例如,使用crispr/cas基因编辑来插入或缺失一个或多个核苷酸)。如本文所用,术语“被破坏的基因”是指含有相对于野生型对应物的一个或多个突变(例如,插入、缺失或核苷酸取代等)以大大降低或完全消除编码的基因产物的活性的基因。该一个或多个突变可以位于非编码区,例如启动子区、调控转录或翻译的调控区、或内含子区中。替代性地,该一个或多个突变可以位于编码区中(例如,外显子中)。在一些情况下,被破坏的基因不表达编码蛋白或表达大大降低的水平的
编码蛋白。在其他情况下,被破坏的基因表达呈突变形式的编码蛋白,该编码蛋白没有功能性或具有大大降低的活性。在一些实施例中,被破坏的基因是不编码功能性蛋白质的基因。在一些实施例中,包含被破坏的基因的细胞不表达(例如,不在细胞表面表达)可检测水平(例如,通过抗体,例如,通过流式细胞术)的由该基因编码的蛋白质。不表达可检测水平的蛋白质的细胞可以称为敲除细胞。例如,如果使用特异性结合β2m蛋白的抗体在细胞表面不能检测到β2m蛋白,则具有β2m基因编辑的细胞可以认为是β2m敲除细胞。
[0091]
本文提供的实例描述了产生经编辑的t细胞,和将经编辑的t细胞工程化以表达结合cd70的嵌合抗原受体(car),从而产生表达抗cd70 car并且具有被破坏的内源性trac、β2m和cd70基因的抗cd70 car t细胞。
[0092]
在具体情况下,抗cd70 car+t细胞是ctx130细胞,这些细胞使用crispr技术破坏所靶向基因以及使用腺相关病毒(aav)转导递送car构建体来产生。crispr-cas9介导的基因编辑涉及三个指导rna(sgrna):cd70-7 sgrna(seq id no:2),其靶向cd70基因座;ta-1sgrna(seq id no:6),其靶向trac基因座;以及b2m-1sgrna(seq id no:10),其靶向β2m基因座。ctx130细胞的抗cd70 car由以下构成:对cd70具有特异性的抗cd70单链抗体片段(scfv),之后是与4-1bb和cd3ζ信号传导结构域的细胞内共信号传导结构域融合的cd8铰链和跨膜结构域。如此,ctx130是由使用crispr/cas9基因编辑组分(sgrna和cas9核酸酶)离体基因修饰的同种异体t细胞构成的cd70定向性t细胞免疫疗法。
[0093]
在一些实施例中,ctx130细胞群体中的至少50%可以不表达可检测水平的β2m表面蛋白。例如,群体中的至少55%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%的工程化t细胞可以不表达可检测水平的β2m表面蛋白。在一些实施例中,群体中的50%-100%、50%-90%、50%-80%、50%-70%、50%-60%、60%-100%、60%-90%、60%-80%、60%-70%、70%-100%、70%-90%、70%-80%、80%-100%、80%-90%或90%-100%的工程化t细胞不表达可检测水平的β2m表面蛋白。
[0094]
替代性地或另外,ctx130细胞群体中的至少50%可以不表达可检测水平的trac表面蛋白。例如,群体中的至少55%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%的工程化t细胞可以不表达可检测水平的trac表面蛋白。在一些实施例中,群体中的50%-100%、50%-90%、50%-80%、50%-70%、50%-60%、60%-100%、60%-90%、60%-80%、60%-70%、70%-100%、70%-90%、70%-80%、80%-100%、80%-90%或90%-100%的工程化t细胞不表达可检测水平的trac表面蛋白。
[0095]
在一些实施例中,ctx130细胞群体中的至少50%可以不表达可检测水平的cd70表面蛋白。例如,群体中的至少55%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少98%的工程化t细胞可以不表达可检测水平的cd70表面蛋白。在一些实施例中,群体中的50%-100%、50%-90%、50%-80%、50%-70%、50%-60%、60%-100%、60%-90%、60%-80%、60%-70%、70%-100%、70%-90%、70%-80%、80%-100%、80%-90%、90%-100%或95%-100%的工程化t细胞不表达可检测水平的cd70表面蛋白。
[0096]
在一些实施例中,ctx130细胞群体中的相当大的百分比可以包含多于一种基因编辑,这导致一定百分比的细胞不表达多于一种基因和/或蛋白质。
[0097]
例如,ctx130细胞群体中的至少50%可以不表达可检测水平的两种表面蛋白,例
如不表达可检测水平的β2m和trac蛋白、β2m和cd70蛋白或trac和cd70蛋白。在一些实施例中,群体中的50%-100%、50%-90%、50%-80%、50%-70%、50%-60%、60%-100%、60%-90%、60%-80%、60%-70%、70%-100%、70%-90%、70%-80%、80%-100%、80%-90%或90%-100%的工程化t细胞不表达可检测水平的两种表面蛋白。在另一个实例中,ctx130细胞群体中的至少50%可以不表达可检测水平的所有三种靶表面蛋白β2m、trac和cd70蛋白。在一些实施例中,群体中的50%-100%、50%-90%、50%-80%、50%-70%、50%-60%、60%-100%、60%-90%、60%-80%、60%-70%、70%-100%、70%-90%、70%-80%、80%-100%、80%-90%或90%-100%的工程化t细胞不表达可检测水平的β2m、trac和cd70表面蛋白。
[0098]
在一些实施例中,ctx130细胞群体可以包含多于一种基因编辑(例如,在多于一种基因中),该多于一种基因编辑可以是本文所述的编辑。例如,ctx130细胞群体可以包含经由crispr/cas技术使用指导rna ta-1(还参见表2,seq id no:6-7)被破坏的trac基因。替代性地或另外,ctx130细胞群体可以包含经由crispr/cas9技术使用b2m-1的指导rna(还参见表2,seq id no:10-11)被破坏的β2m基因。此类ctx130细胞可以包含β2m基因中的插入缺失,该β2m基因包含表4中列出的一个或多个核苷酸序列。例如,ctx130细胞群体可以包含经由crispr/cas技术使用指导rna cd70-7(还参见表2,seq id no:2-3)被破坏的cd70基因。此外,ctx130细胞群体可以包含cd70基因中的插入缺失,该cd70基因可以包含表5中列出的一个或多个核苷酸序列。
[0099]
在一些实例中,相对于未修饰的t细胞,ctx130细胞可以包含trac基因中的缺失。例如,ctx130细胞可以包含trac基因中片段agagcaacagtgctgtggcc(seq id no:17)或其一部分,例如包含1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18或19个连续碱基对的seq id no:17片段的缺失。在一些实施例中,ctx130细胞包含trac基因中包含seq id no:17片段的缺失。在一些实施例中,相对于未修饰的t细胞,工程化t细胞包含trac基因中seq id no:17的缺失。在一些实施例中,相对于未修饰的t细胞,工程化t细胞包含trac基因中包含seq id no:17的缺失。
[0100]
此外,ctx130细胞群体可以包含表达抗cd70 car诸如本文披露的那些(例如,seq id no:46)的细胞。抗cd70 car的编码序列可以插入trac基因座中的例如由指导rna ta-1(还参见表2,seq id no:6-7)靶向的区域处。在此类情况下,示例性抗cd70 car的氨基酸序列包括seq id no:46的氨基酸序列。
[0101]
在一些实施例中,ctx130细胞中的至少30%至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%是表达抗cd70 car的car+细胞。还参见wo 2019/097305 a2和wo 2019/215500,这些专利中的每一个的相关披露内容通过援引并入以用于本文提及的主题和目的。
[0102]
在具体实例中,本文披露的抗cd70 car-t细胞(例如,ctx130细胞)是具有≥30%car+t细胞、≤0.4%tcr+t细胞、≤30%b2m+t细胞和≤2%cd70+t细胞的t细胞群体。
[0103]
(iv)药物组合物
[0104]
在一些方面,本披露提供了药物组合物,这些药物组合物包含如本文披露的任何基因工程化抗cd70 car t细胞(例如,ctx130细胞)群体、和药学上可接受的载剂。此类药物
组合物可用于在人患者中的癌症治疗,该癌症治疗也在本文中披露。
[0105]
如本文所用,术语“药学上可接受的”是指在合理医学判断的范围内适于与受试者的组织、器官和/或体液接触使用而无过多毒性、刺激、变应性应答或其他问题或并发症,与合理的效益/风险比相称的那些化合物、材料、组合物和/或剂型。如本文所用,术语“药学上可接受的载剂”是指生理上相容的溶剂、分散介质、包衣、抗细菌剂、抗真菌剂、等渗剂和吸收延迟剂等。组合物可以包含药学上可接受的盐,例如酸加成盐或碱加成盐。参见例如,berge等人,(1977)j pharm sci[药物科学杂志]66:1-19。
[0106]
在一些实施例中,药物组合物进一步包含药学上可接受的盐。药学上可接受的盐的非限制性实例包括酸加成盐(由多肽的游离氨基与无机酸(例如,盐酸或磷酸)或有机酸(诸如乙酸、酒石酸、扁桃酸等)形成)。在一些实施例中,与游离羧基形成的盐衍生自无机碱(例如,氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁)或有机碱,诸如异丙胺、三甲胺、2-乙氨基乙醇、组氨酸、普鲁卡因等)。
[0107]
在一些实施例中,本文披露的药物组合物包含悬浮于冷冻保存溶液(例如,c55)中的基因工程化抗cd70 car-t细胞群体(例如,ctx130细胞)。用于在本披露中使用的冷冻保存溶液还可以包含腺苷、右旋糖、葡聚糖-40、乳糖酸、蔗糖、甘露醇、缓冲剂诸如n-)2-羟乙基)哌嗪-n'-(2-乙磺酸)(hepes)、一种或多种盐(例如,氯化钙、氯化镁、氯化钾、碳酸氢钾、磷酸钾等)、一种或多种碱(例如,氢氧化钠、氢氧化钾等)或其组合。冷冻保存溶液的组分可以溶解在无菌水中(注射质量)。任何冷冻保存溶液可以基本上不含血清(常规方法检测不到)。
[0108]
在一些情况下,可以将包含悬浮于冷冻保存溶液(例如,基本上不含血清)中的基因工程化抗cd70 car-t细胞群体诸如ctx130细胞的药物组合物置于储存小瓶中。
[0109]
包含任选地可以悬浮于如本文披露的冷冻保存溶液中的如本文也披露的基因工程化抗cd70 car t细胞群体(例如,ctx130细胞)的本文披露的任何药物组合物可以储存在如下环境中:不会显著影响未来使用的t细胞的活力和生物活性,例如,在通常应用于储存细胞和组织的条件下。在一些实例中,药物组合物可以在≤-135℃下储存在液氮的汽相中。在此类条件下储存一段时间后,在外观、细胞计数、活力、car
+
t细胞%、tcr
+
t细胞%、b2m
+
t细胞%和cd70
+
t%细胞方面没有观察到显著变化。
[0110]
在一些实施例中,本文披露的药物组合物可以是用于输注的悬浮液,该悬浮液包含本文披露的抗cd70 car t细胞(诸如ctx130细胞)。在一些实例中,悬浮液可以包含约25-85x106个细胞/ml(例如,50x106个细胞/ml),其中≥30%car+t细胞、≤0.4%tcr+t细胞、≤30%b2m+t细胞且≤2%cd70+t细胞。在一些实例中,悬浮液可以包含约25x106个car+细胞/ml。在具体实例中,药物组合物可以放置于小瓶中,每个小瓶包含约1.5x108个car+t细胞(诸如ctx130细胞)(例如,活细胞)。在其他实例中,药物组合物可以放置于小瓶中,每个小瓶包含约3x108个car+t细胞(诸如ctx130细胞)(例如,活细胞)。
[0111]
ii.抗cd70 car t细胞的制备
[0112]
可以使用本领域已知的任何合适的基因编辑方法来制备本文披露的基因工程化免疫细胞(例如,t细胞诸如ctx130细胞),例如使用锌指核酸酶(zfn)、转录激活因子样效应核酸酶(talen)或rna指导的crispr-cas9核酸酶(crispr/cas9;成簇规律间隔短回文重复序列相关9)来进行核酸酶依赖性靶向编辑。在具体实例中,通过crispr技术结合同源重组,
使用腺相关病毒载体(aav)作为供体模板,产生基因工程化免疫细胞(诸如ctx130细胞)。
[0113]
(i)crispr-cas9介导的基因编辑系统
[0114]
crispr-cas9系统是原核生物中天然存在的防御机制,该防御机制已被重新用作用于基因编辑的rna引导的dna靶向平台。它依赖于dna核酸酶cas9和两个非编码rna(crisprrna(crrna)和反式激活rna(tracrrna))来靶向dna的切割。crispr是成簇规律间隔短回文重复序列(一种在细菌和古细菌基因组中发现的dna序列家族)的缩写,这些重复序列含有与先前暴露于细胞的外源dna(例如,通过感染或攻击原核生物的病毒)具有相似性的dna片段(间隔子dna)。这些dna片段被原核生物用来在重新引入后,例如在随后的攻击中从相似的病毒中检测和破坏相似的外源dna。crispr基因座的转录导致包含间隔子序列的rna分子的形成,该rna分子缔合并靶向能够识别和切割外来的外源dna的cas(crispr相关)蛋白。已经描述了许多类型和种类的crispr/cas系统(参见例如,koonin等人,(2017)curr opin microbiol[微生物学最新观点]37:67-78)。
[0115]
crrna通过典型地与靶dna中的20个核苷酸(nt)序列的沃森-克里克碱基配对来驱动crispr-cas9复合物的序列识别和特异性。改变crrna中5’20nt的序列允许将crispr-cas9复合物靶向至特定基因座。如果靶序列后面是特定的短dna序列(序列为ngg)作为原型间隔子相邻基序(pam),则crispr-cas9复合物仅结合含有与crrna的前20nt序列匹配的dna序列。
[0116]
tracrrna与crrna的3'端杂交形成rna双链体结构,该双链体结构与cas9核酸内切酶结合形成催化活性的crispr-cas9复合物,该复合物然后可以切割靶dna。
[0117]
一旦crispr-cas9复合物在靶位点与dna结合,cas9酶内的两个独立的核酸酶结构域各自切割pam位点上游的dna链之一,从而留下双链断裂(dsb),在这里dna的两条链以碱基对(平末端)终止。
[0118]
crispr-cas9复合物在特定靶位点处与dna结合并形成位点特异性dsb之后,下一个关键步骤是修复dsb。细胞使用两种主要的dna修复途径来修复dsb:非同源末端连接(nhej)和同源定向修复(hdr)。
[0119]
nhej是一种稳健的修复机制,在包括非分裂细胞在内的大多数细胞类型中显现出高活性。nhej容易出错,并且通常会在dsb的位点导致在一个与几百个核苷酸之间的去除或添加,但此类修饰典型地《20nt。产生的插入和缺失(插入缺失)可以破坏基因的编码或非编码区域。替代性地,hdr使用内源性或外源性提供的长段同源供体dna来以高保真度修复dsb。hdr仅在分裂的细胞中有效,并且在大多数细胞类型中以相对较低的频率发生。在本披露的许多实施例中,nhej被作为自发的修复来利用。
[0120]
(a)cas9
[0121]
在一些实施例中,cas9(crispr相关蛋白9)核酸内切酶在用于制备如本文披露的基因工程化t细胞crispr方法中使用。cas9酶可以是来自酿脓链球菌(streptococcus pyogenes)的cas9酶,但也可以使用其他cas9同源物。应当理解,如本文提供的,可以使用野生型cas9或可以使用cas9的修饰形式(例如,cas9的演变形式,或cas9直向同源物或变体)。在一些实施例中,cas9包括酿脓链球菌衍生的cas9核酸酶蛋白,该核酸酶蛋白已被工程化为包含c末端和n末端sv40大t抗原核定位序列(nls)。所得的cas9核酸酶(snls-spcas9-snls)是162kda蛋白,该蛋白通过重组大肠杆菌发酵产生并通过色谱法纯化。spcas9氨基酸
序列可以作为uniprot登录号q99zw2找到,在本文中作为seq id no:1提供。
[0122]
cas9核酸酶的氨基酸序列(seq id no:1):
[0123]
mdkkysigldigtnsvgwavitdeykvpskkfkvlgntdrhsikknligallfdsgetaeatrlkrtarrrytrrknricylqeifsnemakvddsffhrleesflveedkkherhpifgnivdevayhekyptiyhlrkklvdstdkadlrliylalahmikfrghfliegdlnpdnsdvdklfiqlvqtynqlfeenpinasgvdakailsarlsksrrlenliaqlpgekknglfgnlialslgltpnfksnfdlaedaklqlskdtydddldnllaqigdqyadlflaaknlsdaillsdilrvnteitkaplsasmikrydehhqdltllkalvrqqlpekykeiffdqskngyagyidggasqeefykfikpilekmdgteellvklnredllrkqrtfdngsiphqihlgelhailrrqedfypflkdnrekiekiltfripyyvgplargnsrfawmtrkseetitpwnfeevvdkgasaqsfiermtnfdknlpnekvlpkhsllyeyftvyneltkvkyvtegmrkpaflsgeqkkaivdllfktnrkvtvkqlkedyfkkiecfdsveisgvedrfnaslgtyhdllkiikdkdfldneenediledivltltlfedremieerlktyahlfddkvmkqlkrrrytgwgrlsrklingirdkqsgktildflksdgfanrnfmqlihddsltfkediqkaqvsgqgdslhehianlagspaikkgilqtvkvvdelvkvmgrhkpeniviemarenqttqkgqknsrermkrieegikelgsqilkehpventqlqneklylyylqngrdmyvdqeldinrlsdydvdhivpqsflkddsidnkvltrsdknrgksdnvpseevvkkmknywrqllnaklitqrkfdnltkaergglseldkagfikrqlvetrqitkhvaqildsrmntkydendklirevkvitlksklvsdfrkdfqfykvreinnyhhahdaylnavvgtalikkypklesefvygdykvydvrkmiakseqeigkatakyffysnimnffkteitlangeirkrplietngetgeivwdkgrdfatvrkvlsmpqvnivkktevqtggfskesilpkrnsdkliarkkdwdpkkyggfdsptvaysvlvvakvekgkskklksvkellgitimerssfeknpidfleakgykevkkdliiklpkyslfelengrkrmlasagelqkgnelalpskyvnflylashyeklkgspedneqkqlfveqhkhyldeiieqisefskrviladanldkvlsaynkhrdkpireqaeniihlftltnlgapaafkyfdttidrkrytstkevldatlihqsitglyetridlsqlggd
[0124]
(b)指导rna(grna)
[0125]
如本文所述的crispr-cas9介导的基因编辑包括指导rna或grna的使用。如本文所用,“grna”是指可以将cas9定向至cd70基因或trac基因或β2m基因内的特定靶序列以在特定靶序列处进行基因编辑的基因组靶向核酸。指导rna至少包含与靶基因内用于进行编辑的靶核酸序列杂交的间隔子序列、和crispr重复序列。
[0126]
seq id no:2中提供了靶向cd70基因的示例性grna。还参见wo 2019/215500,其相关披露内容通过援引并入本文以用于本文提及的主题和目的。可以使用位于第19号染色体上的cd70基因序列(grch38:染色体19:6,583,183-6,604,103;ensembl;ensg00000125726)来设计其他grna序列。在一些实施例中,靶向cd70基因组区域的grna和cas9在cd70基因组区域中产生断裂,在cd70基因中产生插入缺失,从而破坏mrna或蛋白质的表达。
[0127]
seq id no:6中提供了靶向trac基因的示例性grna。还参见wo 2019/097305a2,其相关披露内容通过援引并入本文以用于本文提及的主题和目的。可以使用位于第14号染色体上的trac基因序列(grch38:第14号染色体:22,547,506-22,552,154;ensembl;ensg00000277734)设计其他grna序列。在一些实施例中,靶向trac基因组区域的grna和cas9在trac基因组区域中产生断裂,在trac基因中产生插入缺失,从而破坏mrna或蛋白质的表达。
[0128]
seq id no:10中提供了靶向β2m基因的示例性grna。还参见wo 2019/097305a2,其相关披露内容通过援引并入本文以用于本文提及的目的和主题。可以使用位于第15号染色体上的β2m基因序列(grch38坐标:染色体15:44,711,477-44,718,877;ensembl:
ensg00000166710)来设计其他grna序列。在一些实施例中,靶向β2m基因组区域的grna和rna指导的核酸酶在β2m基因组区域中产生断裂,在β2m基因中产生插入缺失,从而破坏mrna或蛋白质的表达。
[0129]
表2.sgrna序列和靶基因序列。
[0130]
[0131][0132]
*指示具有2
’‑
o-甲基硫代磷酸酯修饰的核苷酸。
[0133]“n”是指5’端处的间隔子序列。
[0134]
在ii型系统中,grna还包含称为tracrrna序列的第二rna。在ii型grna中,crispr重复序列和tracrrna序列彼此杂交形成双链体。在v型grna中,crrna形成双链体。在这两个系统中,双链体都结合定点多肽,使得指导rna和定点多肽形成复合物。在一些实施例中,靶向基因组的核酸由于其与定点多肽的缔合而为复合物提供了靶特异性。因此,靶向基因组的核酸定向定点多肽的活性。
[0135]
如本领域普通技术人员所理解的,每个指导rna设计为包含与其基因组靶序列互补的间隔子序列。参见jinek等人,science[科学],337,816-821(2012)和deltcheva等人,
id no:12中提供了靶向β2m基因的grna的示例性间隔子序列。
[0144]
本文披露的指导rna可以经由crrna中的间隔子序列靶向任何目的序列。在一些实施例中,指导rna的间隔子序列与靶基因中的靶序列之间的互补程度可以是约60%、65%、70%、75%、80%、85%、90%、95%、97%、98%、99%或100%。在一些实施例中,指导rna的间隔子序列与靶基因中的靶序列是100%互补的。在其他实施例中,指导rna的间隔子序列和靶基因中的靶序列可以包含多达10个错配,例如,多达9个、多达8个、多达7个、多达6个、多达5个、多达4个、多达3个、多达2个或多达1个错配。
[0145]
可以如本文提供的那样使用的grna的非限制性实例提供于wo 2019/097305a2和wo 2019/215500中,每一个先前申请的相关披露内容通过援引并入本文以用于本文提及的目的和主题。对于本文提供的任何grna序列,未明确指示修饰的那些意在涵盖未修饰的序列和具有任何合适的修饰的序列。
[0146]
本文披露的任何grna中的间隔子序列的长度可以取决于用于编辑也本文披露的任何靶基因的crispr/cas9系统和组分。例如,来自不同细菌物种的不同cas9蛋白具有不同的最佳间隔子序列长度。因此,间隔子序列的长度可以具有5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50或超过50个的核苷酸。在一些实施例中,间隔子序列的长度可以具有18-24个核苷酸。在一些实施例中,靶向序列的长度可以具有19-21个核苷酸。在一些实施例中,间隔子序列的长度可以包含20个核苷酸。
[0147]
在一些实施例中,grna可以是sgrna,其可以在sgrna序列的5'端包含20个核苷酸的间隔子序列。在一些实施例中,sgrna可以在sgrna序列的5’端包含少于20个核苷酸的间隔子序列。在一些实施例中,sgrna可以在sgrna序列的5’端包含超过20个核苷酸的间隔子序列。在一些实施例中,sgrna在sgrna序列的5’末端包含具有17-30个核苷酸的可变长度的间隔子序列。
[0148]
在一些实施例中,sgrna在sgrna序列的3’端不包含尿嘧啶。在其他实施例中,sgrna可以在sgrna序列的3’端包含一个或多个尿嘧啶。例如,sgrna可以在sgrna序列的3'端包含1-8个尿嘧啶残基,例如,在sgrna序列的3’端包含1、2、3、4、5、6、7或8个尿嘧啶残基。
[0149]
本文披露的任何grna(包括任何sgrna)可以是未修饰的。替代性地,它可以含有一个或多个修饰的核苷酸和/或修饰的主链。例如,修饰的grna(诸如sgrna)可以包含一个或多个2'-o-甲基硫代磷酸酯核苷酸,其可以位于5’端、3'端或这两端。
[0150]
在某些实施例中,多于一个的指导rna可以与crispr/cas核酸酶系统一起使用。每个指导rna可以含有不同的靶向序列,使得crispr/cas系统切割多于一种的靶核酸。在一些实施例中,一个或多个指导rna可以在cas9 rnp复合物中具有相同或不同的特性,诸如活性或稳定性。当使多于一个指导rna时,每个指导rna可以在相同或不同的载体上编码。用于驱动多于一个指导rna表达的启动子是相同或不同的。
[0151]
应当理解,在本文所述的方法中可以使用多于一种的合适的cas9和多于一个的合适的grna,例如本领域已知的或本文披露的那些。在一些实施例中,方法包括本领域已知的cas9酶和/或grna。实例可在例如wo 2019/097305a2和wo 2019/215500中找到,每一个先前申请的相关披露内容通过援引并入本文以用于本文提及的目的和主题。
[0152]
在一些实施例中,靶向trac基因组区域的grna在trac基因中产生插入缺失,该
trac基因包含选自表3中的序列的至少一个核苷酸序列。在一些实施例中,靶向trac基因组区域的grna(例如,seq id no:6)在trac基因中产生插入缺失,该trac基因包含选自表3中的序列的至少一个核苷酸序列。
[0153]
表3.经编辑的trac基因序列。
[0154][0155]
在一些实施例中,靶向β2m基因组区域的grna在β2m基因中产生插入缺失,该β2m基因包含选自表4中的序列的至少一个核苷酸序列。在一些实施例中,靶向β2m基因组区域的grna(例如,seq id no:10)在β2m基因中产生插入缺失,该β2m基因包含选自表4中的序列的至少一个核苷酸序列。
[0156]
表4.经编辑的β2m基因序列。
[0157][0158]
在一些实施例中,靶向cd70基因组区域的grna在cd70基因中产生插入缺失,该cd70基因包含选自表5中的序列的至少一个核苷酸序列。在一些实施例中,靶向cd70基因组区域的grna在cd70基因中产生插入缺失,该cd70基因包含选自表5中的序列的至少一个核苷酸序列。在一些实施例中,靶向cd70基因组区域的grna(例如,seq id no:2)在cd70基因中产生插入缺失,该cd70基因包含选自表5中的序列的至少一个核苷酸序列。
[0159]
表5.经编辑的cd70基因序列。
[0160][0161][0162]
(ii)用于将car构建体递送至t细胞的aav载体
[0163]
可以使用腺相关病毒(aav)将编码car构建体的核酸递送至细胞。aav是位点特异性整合到宿主基因组中并且因此可以递送转基因(诸如car)的小病毒。反向末端重复序列(itr)存在于aav基因组和/或目的转基因的侧翼,并且充当复制起点。aav基因组中还存在rep和cap蛋白,它们在转录时形成包封用于递送至靶细胞中的aav基因组的衣壳。这些衣壳上的表面受体赋予aav血清型,该aav血清型决定衣壳主要结合哪个靶器官并且因此决定aav将最高效地感染哪些细胞。目前已知十二种人aav血清型。在一些实施例中,用于在递送car编码核酸中使用的aav是aav血清型6(aav6)。
[0164]
出于多种原因,腺相关病毒是用于基因疗法的最常用病毒之一。首先,aav在施用至包括人在内的哺乳动物时不引起免疫应答。第二,将aav有效地递送至靶细胞,特别是在考虑选择合适的aav血清型时。最后,因为基因组可以在宿主细胞中持续存在而不整合,aav具有感染分裂和非分裂细胞的能力。这种特性使它们成为基因疗法的理想候选物。
[0165]
可以设计编码car的核酸,以插入宿主t细胞中的目的基因组位点中。在一些实施例中,靶基因组位点可以在安全港基因座中。
[0166]
在一些实施例中,编码car的核酸(例如,经由供体模板,其可以由病毒载体诸如腺相关病毒(aav)载体携带)可以被设计成使得它可以插入trac基因内的位置以破坏基因工程化t细胞中的trac基因并表达car多肽。trac的破坏导致内源性tcr的功能丧失。例如,trac基因中的破坏可以用核酸内切酶(诸如本文所述的那些)和靶向一个或多个trac基因组区域的一个或多个grna来产生。对trac基因和靶区域具有特异性的任何grna可用于此目的,例如本文披露的那些。
[0167]
在一些实例中,trac基因中的基因组缺失和由car编码区段的替换可以通过同源定向修复或hdr(例如,使用供体模板,其可以是病毒载体诸如腺相关病毒(aav)载体的一部分)来产生。在一些实施例中,trac基因中的破坏可以利用核酸内切酶(如本文披露的那些)和靶向一个或多个trac基因组区域的一个或多个grna并将car编码区段插入trac基因中来
产生。
[0168]
如本文披露的供体模板可以含有car的编码序列。在一些实例中,car编码序列的侧翼可以为两个同源区,以允许使用crispr-cas9基因编辑技术在目的基因组位置处(例如,在trac基因处)的高效hdr。在这种情况下,靶基因座处的dna的两条链都可以被crispr cas9酶切割,该酶由对靶基因座具有特异性的grna指导。然后发生hdr,以修复双链断裂(dsb)并插入编码car的供体dna。为了使此正确发生,将供体序列设计为具有与靶基因(诸如trac基因)中dsb位点周围的序列(下文为“同源臂”)互补的侧翼残基。这些同源臂充当dsb修复的模板,并使hdr成为基本无错误的机制。同源定向修复(hdr)的速率是突变与切割位点之间的距离的函数,因此选择重叠或附近的靶位点很重要。模板可以包括同源区侧翼的额外序列或者可以含有与基因组序列不同的序列,从而允许序列编辑。
[0169]
替代性地,供体模板可以与dna中的靶位置不具有同源区,并且可以通过在靶位点切割后通过nhej依赖性末端连接而整合。
[0170]
供体模板可以是单链和/或双链的dna或rna,并且可以以线性或环状形式引入细胞中。如果以线性形式引入,则可以通过本领域技术人员已知的方法保护供体序列的末端(例如,以防止核酸外切降解)。例如,将一个或多个双脱氧核苷酸残基添加至线性分子的3'末端和/或将自身互补的寡核苷酸连接至一端或两端。参见例如,chang等人,(1987)proc.natl.acad.sci.usa[美国国家科学院院刊]84:4959-4963;nehls等人,(1996)science[科学]272:886-889。保护外源多核苷酸免于降解的另外方法包括但不限于一个或多个末端氨基的添加和修饰的核苷酸间键联(例如像硫代磷酸酯、氨基磷酸酯和o-甲基核糖或脱氧核糖残基)的使用。
[0171]
可以将供体模板作为载体分子的一部分引入细胞中,该载体分子具有另外的序列,例如像复制起点、启动子和编码抗生素抗性的基因。此外,可以将供体模板作为裸核酸,作为与诸如脂质体或泊洛沙姆的试剂复合的核酸引入细胞中,或可以通过病毒(例如,腺病毒、aav、疱疹病毒、逆转录病毒、慢病毒和整合酶缺陷型慢病毒(idlv))递送。
[0172]
在一些实施例中,供体模板可以插入在内源启动子附近的位点(例如,下游或上游),使得其表达可以由内源启动子驱动。在其他实施例中,供体模板可以包含外源启动子和/或增强子,例如组成型启动子、诱导型启动子或组织特异性启动子,以控制car基因的表达。在一些实施例中,外源启动子是ef1α启动子。可以使用其他启动子。
[0173]
此外,外源序列还可以包括转录或翻译调控序列,例如启动子、增强子、隔离子、内部核糖体进入位点、编码2a肽的序列和/或聚腺苷酸化信号。iii.表达cd70的肿瘤的治疗
[0174]
在一些实施例中,本披露的t细胞被工程化为具有设计用于靶向cd70的嵌合抗原受体(car)。最初将cd70鉴定为cd27的配体,cd27是参与t细胞增殖和存活的共刺激受体。在病毒感染期间,cd70仅在引流淋巴结中一小部分的激活t细胞和抗原呈递细胞上发现。许多人肿瘤也表达cd70,包括但不限于实体癌,诸如乳腺癌、胃癌、卵巢癌和胶质母细胞瘤。由于其在正常组织上的受限表达模式(flieswasser等人,cancers[癌症],(2019)11:1611)以及在许多癌症中的过表达,cd70是有吸引力的治疗性靶标。可以如本文提供那样治疗的癌症(例如,实体瘤)的非限制性实例包括胰腺癌、胃癌、卵巢癌、宫颈癌、乳腺癌、甲状腺癌、鼻咽癌、非小细胞肺癌(nsclc)、胶质母细胞瘤、淋巴瘤和/或黑色素瘤。
[0175]
在一些方面,本文提供了用于使用如本文披露的任何抗cd70 car t细胞(诸如
ctx130细胞)群体治疗患有表达cd70的肿瘤(例如,cd70+实体瘤)的人患者的方法。
[0176]
此类治疗方法可以包括调理方案(淋巴细胞清除治疗),其包括向合适的人患者给予一剂或多剂的一种或多种淋巴细胞清除剂;和治疗方案(抗cd70 car t细胞疗法),其包括向人患者施用如本文披露的抗cd70 car t细胞(诸如ctx130细胞)群体。当适用时,可以向人患者给予多个剂量的抗cd70 car t细胞,并且可以在每个剂量的抗cd70 car t细胞之前向人患者应用淋巴细胞清除治疗。
[0177]
(i)患者群体
[0178]
人患者可以是期望诊断、治疗或疗法的任何人受试者。人患者可以是任何年龄。在一些实施例中,人患者是成人(例如,至少18岁的人)。在一些实施例中,人患者是儿童。在一些实施例中,人患者具有≥60kg的体重。
[0179]
待通过本文所述的方法治疗的人患者可以是患有cd70+实体瘤(例如,肺癌、胃癌、卵巢癌、胰腺癌、前列腺癌和/或其组合)、怀疑患有cd70+实体瘤或有患有cd70+实体瘤的风险的人患者。怀疑患有cd70+实体瘤的受试者可能显示出癌症的一种或多种症状,例如疲劳、皮肤下可以感觉到的肿块或增厚区域、体重变化(包括原因不明的体重减轻或体重增加)、皮肤变化(例如,皮肤的变黄、变暗或发红,不会愈合的疮或现有痣的变化)、肠或膀胱习惯的变化、持续性咳嗽或呼吸困难、吞咽困难、嘶哑、持久性消化不良或饭后不适、持久性原因不明的肌肉或关节疼痛、持久性原因不明的发热或盗汗或原因不明的出血或挫伤。
[0180]
有cd70+实体瘤的风险的受试者可以是具有cd70+实体瘤的一种或多种风险因素的受试者,例如年龄、吸烟、肥胖症、高血压、过度暴露于阳光、暴露于化学物质和/或病毒、家族史或遗传病症。需要抗cd70 car t细胞(例如,ctx130细胞)治疗的人患者可以通过常规医学检查,例如实验室测试、活检、成像测试(例如,磁共振成像(mri)扫描、计算机断层扫描(ct)、骨扫描、超声检查、正电子发射断层扫描(pet)和x射线)来鉴定。
[0181]
可以如本文提供那样治疗的cd70+实体瘤的实例包括胰腺癌、胃癌、卵巢癌、宫颈癌、乳腺癌、甲状腺癌、鼻咽癌、非小细胞肺癌(nsclc)、胶质母细胞瘤和/或黑色素瘤。
[0182]
在一些实施例中,待通过本文所述的方法治疗的人患者可以是患有包含表达cd70的肿瘤细胞的肿瘤(表达cd70的肿瘤)的人患者,该肿瘤可以通过本领域已知的任何方法,例如通过免疫测定(诸如免疫组织化学(ihc))或流式细胞术来鉴定。
[0183]
本文披露的任何方法可以进一步包括基于患者中cd70+肿瘤细胞的存在和/或水平鉴定适于同种异体抗cd70 car t疗法的人患者的步骤。
[0184]
待通过本文所述的方法治疗的人患者可以是患有晚期实体瘤,例如不可切除或转移性实体瘤的人患者。在一些实施例中,人患者可以患有在治疗后复发和/或对治疗产生抗性和/或对治疗无应答的实体瘤。待通过本文所述的方法治疗的人患者可以是已经进行最近先前治疗的人患者。替代性地,人患者可以未接受先前治疗。
[0185]
使用本文披露的方法治疗的任何人患者可以接受后续治疗。例如,对人患者进行抗细胞因子疗法。在另一个实例中,在用基因工程化t细胞群体治疗之后对人患者进行自体或同种异体造血干细胞移植。
[0186]
在一些实施例中,人患者患有复发性或难治性cd70+实体瘤。如本文所用,“难治性cd70+实体瘤”是指对治疗没有应答或对治疗产生抗性的cd70+实体瘤。如本文所用,“复发性cd70+实体瘤”是指在完全应答的时段后恢复的cd70+实体瘤。在一些实施例中,复发发生
在治疗之后。在其他实施例中,复发发生在治疗期间。应答的缺乏可以通过常规医疗实践确定。在一些实施例中,人患者患有复发性cd70+实体瘤。在一些实施例中,人患者患有难治性cd70+实体瘤。
[0187]
可以筛选人患者以确定患者是否有资格经受调理方案(淋巴细胞清除治疗)和/或治疗方案(抗cd70 car-t细胞疗法)。例如,有资格进行淋巴细胞清除治疗的人患者不显示以下特征中的一种或多种:(a)临床状态恶化,(b)需要补充氧气以维持大于90%的饱和度水平,(c)不受控制的心律失常,(d)需要血管升压药支持的低血压,(e)活动性感染,以及(f)≥2级急性神经毒性。在另一个实例中,有资格进行治疗方案的人患者不显示以下特征中的一种或多种:(a)活动性不受控制的感染,(b)与淋巴细胞清除治疗之前的临床状态相比的临床状态恶化,以及(c)≥2级急性神经毒性(例如,icans)。
[0188]
可以基于此类筛选结果筛选人患者并将其排除在调理方案和/或治疗方案之外。例如,如果患者满足以下排除标准中的任一种,则可以将人患者排除在调理方案和/或治疗方案之外:(a)用任何抗cd70靶向剂的先前治疗,(b)用任何car t细胞或任何其他修饰的t或自然杀伤(nk)细胞的先前治疗,(c)对任何淋巴细胞清除治疗或任何治疗方案的任何赋形剂的先前过敏反应,(d)来自脑脊液(csf)的可检测恶性细胞或指示脑转移瘤的磁共振成像(mri),(e)临床相关cns病变的病史或存在,(f)在筛选之前6个月内的不稳定型心绞痛、心律失常或心肌梗塞,以及(g)不受控制的、危及生命的急性细菌、病毒或真菌感染。在一些情况下,人患者可以没有具有6.5%或48mmol/ml的hba1c水平的糖尿病。
[0189]
可以筛选进行淋巴细胞清除治疗的人患者的接受一剂或多剂的本文披露的抗cd70 car t细胞(诸如ctx130细胞)的资格。例如,有资格进行抗cd70 car t细胞治疗的进行淋巴细胞清除治疗的人患者不显示以下特征中的一种或多种:(a)活动性不受控制的感染,(b)临床状态恶化,以及(c)≥2级急性神经毒性(例如,icans)。
[0190]
在抗cd70 car t细胞的每次给药后,可以监测人患者的急性毒性诸如细胞因子释放综合征(crs)、肿瘤溶解综合征(tls)、神经毒性、移植物抗宿主病(gvhd)、中靶脱肿瘤毒性和/或不受控制的t细胞增殖。该中靶脱肿瘤毒性可以包括该基因工程化t细胞群体针对激活的t淋巴细胞、b淋巴细胞、树突状细胞、成骨细胞和/或肾小管样上皮细胞的活性。在抗cd70car t细胞的每个剂量之后,可以监测人患者的毒性的发展至少28天。
[0191]
当人患者表现出急性毒性的一种或多种症状时,可以对人患者进行毒性管理。对表现出急性毒性的一种或多种症状的患者的治疗是本领域已知的。例如,可以向表现出crs症状(例如,心脏、呼吸和/或神经异常)的人患者施用抗细胞因子疗法。另外,可以向未表现出crs症状的人患者施用抗细胞因子疗法以促进抗cd70 car t细胞的增殖。
[0192]
替代性地或另外,当人患者表现出种急性毒性的一种或多症状时,可以终止对人患者的治疗。如果患者表现出一种或多种不良事件(ae)体征,例如,患者具有实验室发现异常和/或患者显示出疾病进展的体征,则也可以终止患者治疗。
[0193]
(ii)调理方案(淋巴细胞清除疗法)
[0194]
适于本文披露的治疗方法的任何人患者可以接受淋巴细胞清除疗法,以减少或清除受试者的内源性淋巴细胞。
[0195]
淋巴细胞清除是指内源性淋巴细胞和/或t细胞的破坏,该破坏常用于免疫移植和免疫疗法之前。淋巴细胞清除可以通过辐照和/或化学疗法来实现。“淋巴细胞清除剂”可以
是当施用至受试者时能够减少、清除或消除内源性淋巴细胞和/或t细胞的任何分子。在一些实施例中,将淋巴细胞清除剂以将淋巴细胞数量与施药物剂之前的淋巴细胞数量相比有效减少至少10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、96%、96%、97%、98%或至少99%的量施用。在一些实施例中,将淋巴细胞清除剂以有效减少淋巴细胞数量的量施用,使得受试者中的淋巴细胞数量低于检测限度。在一些实施例中,向受试者施用至少一种(例如,2、3、4、5或更多种)淋巴细胞清除剂。
[0196]
在一些实施例中,淋巴细胞清除剂是特异性杀伤淋巴细胞的细胞毒性剂。淋巴细胞清除剂的实例包括但不限于氟达拉滨、环磷酰胺、苯达莫司汀、5-氟尿嘧啶、吉西他滨、甲氨蝶呤、达卡巴嗪、马法兰、阿霉素、长春碱、顺铂、奥沙利铂、紫杉醇、多西他赛、伊立替康、依托泊甙磷酸酯、米托蒽醌、克拉屈滨、地尼白介素(denileukin diftitox)或dab-il2。在一些情况下,淋巴细胞清除剂可以伴随低剂量辐照。调理方案的淋巴细胞清除效果可以经由常规实践进行监测。
[0197]
在一些实施例中,本文所述的方法涉及包含一种或多种淋巴细胞清除剂例如氟达拉滨和环磷酰胺的调理方案。待通过本文所述的方法治疗的人患者可以在调理阶段的合适时段(例如,1-5天)内接受多个剂量的一种或多种淋巴细胞清除剂。在淋巴细胞清除期间,患者可以每天一次接受一种或多种淋巴细胞清除剂。在一个实例中,人患者每天接受约20-50mg/m2(例如,30mg/m2)的氟达拉滨,持续2-4天(例如,3天)和每天接受约300-600mg/m2(例如,500mg/m2)的环磷酰胺,持续2-4天(例如,3天)。在一个实例中,人患者每天接受约20-50mg/m2(例如,20mg/m2或30mg/m2)的氟达拉滨,持续2-4天(例如,3天)和每天接受约300-600mg/m2(例如,500mg/m2)的环磷酰胺,持续2-4天(例如,3天)。在另一个实例中,人患者每天接受约20-30mg/m2(例如,25mg/m2)的氟达拉滨,持续2-4天(例如,3天)和每天接受约300-600mg/m2(例如,300mg/m2或400mg/m2)的环磷酰胺,持续2-4天(例如,3天)。如果需要,环磷酰胺的剂量可以例如增加至多达1,000mg/m2。
[0198]
然后可以在如本文披露的淋巴细胞清除疗法之后的合适时段内向人患者施用任何抗cd70 car t细胞(诸如ctx130细胞)。例如,人患者可以在施用抗cd70 car+t细胞(例如,ctx130细胞)之前约2-7天(例如,2、3、4、5、6、7天)经受一种或多种淋巴细胞清除剂。
[0199]
由于同种异体抗cd70 car-t细胞(诸如ctx130细胞)可以提前制备,因此可以将如本文披露的淋巴细胞清除疗法在患有cd70+肿瘤的人患者被鉴定为适于本文披露的同种异体抗cd70 car-t细胞疗法之后的短时间窗口内(例如,在2周内)应用至该人患者。
[0200]
本文所述的方法涵盖向人患者再给药抗cd70 car+t细胞。在此类情况下,在再给药之前对人患者进行淋巴细胞清除治疗。例如,可以对人患者进行第一淋巴细胞清除治疗和第一剂量的ctx130,之后进行第二淋巴细胞清除治疗和第二剂量的ctx130。在另一个实例中,可以对人患者进行第一淋巴细胞清除治疗和第一剂量的ctx130、第二淋巴细胞清除治疗和第二剂量的ctx130以及第三淋巴细胞清除治疗和第三剂量的ctx130。
[0201]
在任何淋巴细胞清除步骤之前(例如,在初始淋巴细胞清除步骤之前或在联合再给药抗cd70 car t细胞(诸如ctx130细胞)的任何后续淋巴细胞清除步骤之前),可以筛选人患者的一种或多种特征以确定患者是否有资格进行淋巴细胞清除治疗。例如,在淋巴细胞清除之前,有资格进行淋巴细胞清除治疗的人患者不显示以下特征中的一种或多种:(a)临床状态显著恶化,(b)需要补充氧气以维持大于90%的饱和度水平,(c)不受控制的心律
失常,(d)需要血管升压药支持的低血压,(e)活动性感染,以及(f)≥2级急性神经毒性。
[0202]
淋巴细胞清除后,可以筛选人患者的一种或多种特征以确定患者是否有资格进行用抗cd70 car t细胞的治疗。例如,在抗cd70 car t细胞治疗之前和淋巴细胞清除治疗之后,有资格进行抗cd70 car t细胞治疗的人患者不显示以下特征中的一种或多种:(a)活动性不受控制的感染,(b)临床状态恶化,以及(c)≥2级急性神经毒性。
[0203]
(iii)抗cd70 car t细胞的施用
[0204]
本披露的方面提供了治疗cd70+实体瘤的方法,这些方法包括对人患者进行淋巴细胞清除治疗以及向人患者施用一定剂量的本文所述的基因工程化t细胞(例如,ctx130细胞)群体。
[0205]
施用抗cd70 car t细胞可以包括通过下述方法或途径将基因工程化t细胞群体放置(例如,移植)至人患者体内,该方法或途径使得将基因工程化t细胞群体至少部分定位于所需位点(诸如肿瘤位点),使得可以产生一种或多种所需效果。基因工程化t细胞群体可以通过任何适当的途径施用,该途径使得递送至受试者中的所需位置,在该位置中至少一部分植入的细胞或细胞组分保持活力。在施用至受试者之后细胞的活力期可以短至数小时(例如,二十四小时)至几天,至长达数年,或甚至受试者的寿命(即长期植入)。例如,在本文所述的一些方面,有效量的基因工程化t细胞群体可以经由全身性施用途径(诸如腹膜内或静脉内途径)施用。
[0206]
在一些实施例中,全身性施用基因工程化t细胞群体,这是指将细胞群体以不同于直接施用至靶位点、组织或器官的方式施用,使得其进入受试者的循环系统且从而经受代谢和其他类似过程。施用的合适模式包括注射、输注、滴注或摄取。注射包括但不限于静脉内、肌内、动脉内、鞘内、心室内、囊内、眶内、心内、真皮内、腹膜内、经气管、皮下、表皮下、关节内、被膜下、蛛网膜下、脊柱内、脊髓内和胸骨内注射和输注。在一些实施例中,途径是静脉内。
[0207]
有效量是指预防或减轻医学病症(例如,癌症)的至少一种或多种体征或症状所需的基因工程化t细胞群体的量,且涉及足以提供所需效果(例如,治疗患有医学病症的受试者)的基因工程化t细胞群体的量。有效量还包括足以预防或延迟疾病症状的发展、改变疾病症状的进程(例如但不限于减缓疾病症状的进展)或逆转疾病症状的量。应当理解,对于任何给定的情况,本领域的普通技术人员可以使用常规实验来确定适当的有效量。
[0208]
基因工程化t细胞群体的有效量可以包含约1x106个细胞至约1.0x109个car+细胞,例如约3.0x107个细胞至约1.0x109个细胞,这些细胞表达抗cd70 car(car
+
细胞),例如car
+
ctx130细胞。在一些实施例中,基因工程化t细胞群体的有效量可以包含约3.0x107个car+细胞至约9x108个细胞,这些细胞表达抗cd70 car,例如car+ctx130细胞。在一些实施例中,基因工程化t细胞群体的有效量可以包含至少3.0x108个car
+
ctx130细胞、至少4x108个car
+
ctx130细胞、至少4.5x10
8个
car
+
ctx130细胞、至少5x108个car
+
ctx130细胞、至少5.5x108个car
+
ctx130细胞、至少6x108个car
+
ctx130细胞、至少6.5x108个car
+
ctx130细胞、至少7x108个car
+
ctx130细胞、至少7.5x108个car
+
ctx130细胞、至少8x108个car
+
ctx130细胞、至少8.5x108个car
+
ctx130细胞或至少9x108个car
+
ctx130细胞。在一些实例中,car
+
ctx130细胞的量可以不超过1x109个细胞。
[0209]
在一些实施例中,如本文披露的基因工程化t细胞群体(例如,ctx130细胞)的有效
量的范围可以为从约3.0x107至约3x108个car
+
t细胞,例如约1x107至约1x108个car
+
t细胞或约1x108至约3x108个car
+
t细胞。在一些实施例中,如本文披露的基因工程化t细胞群体(例如,ctx130细胞)的有效量的范围可以为从约1.5x108至约3x108个car
+
t细胞。
[0210]
在一些实施例中,如本文披露的基因工程化t细胞群体(例如,ctx130细胞)的有效量的范围可以为从约3.0x108至约9x108个car
+
t细胞,例如约3.5x108至约6x108个car
+
t细胞或约3.5x108至约4.5x108个car
+
t细胞。在一些实施例中,如本文披露的基因工程化t细胞群体(例如,ctx130细胞)的有效量的范围可以为从约4.5x108至约9x108个car
+
t细胞。在一些实施例中,如本文披露的基因工程化t细胞群体(例如,ctx130细胞)的有效量的范围可以为从约4.5x108至约6x108个car
+
t细胞。在一些实施例中,如本文披露的基因工程化t细胞群体(例如,ctx130细胞)的有效量的范围可以为从约6x108至约9x108个car
+
t细胞。在一些实施例中,如本文披露的基因工程化t细胞群体(例如,ctx130细胞)的有效量的范围可以为从约7.5x108至约9x108个car
+
t细胞。
[0211]
在具体实例中,如本文披露的基因工程化t细胞群体(例如,ctx130细胞)的有效量可以包含约3.0x108个car
+
t细胞。例如,如本文披露的基因工程化t细胞群体(例如,ctx130细胞)的有效量可以包含约4.5x108个car
+
t细胞。在其他实例中,如本文披露的基因工程化t细胞群体(例如,ctx130细胞)的有效量可以包含约6x108个car
+
t细胞。在一些实例中,如本文披露的基因工程化t细胞群体(例如,ctx130细胞)的有效量可以包含约7.5x108个car
+
t细胞。在又其他实例中,如本文披露的基因工程化t细胞群体(例如,ctx130细胞)的有效量可以包含约9x108个car
+
t细胞。
[0212]
在一些实施例中,如本文披露的基因工程化t细胞群体(例如,ctx130细胞)的有效量的范围可以为从约3x108至约9x108个car
+
t细胞。在一些实施例中,如本文披露的基因工程化t细胞群体(例如,ctx130细胞)的有效量的范围可以为从约3x108至约7.5x108个car
+
t细胞。在一些实施例中,如本文披露的基因工程化t细胞群体(例如,ctx130细胞)的有效量的范围可以为从约3x108至约6x108个car
+
t细胞。在一些实施例中,如本文披露的基因工程化t细胞群体(例如,ctx130细胞)的有效量的范围可以为从约3x108至约4.5x108个car
+
t细胞。
[0213]
在一些实施例中,基因工程化t细胞群体的有效量可以包含一定剂量,例如包含约3.0x108个car
+
ctx130细胞至约9x108个car
+
ctx130细胞的剂量,例如本文披露的任何剂量或剂量范围的基因工程化t细胞群体。在一些实例中,有效量是4.5x106个car
+
ctx130细胞。在一些实例中,有效量是6x108个car
+
ctx130细胞。在一些实例中,有效量是7.5x108个car
+
ctx130细胞。在一些实例中,有效量是9x108个car
+
ctx130细胞。
[0214]
在一些实例中,可以向患有晚期cd70+实体瘤(例如,不可切除的或转移性cd70+实体瘤)或复发性/难治性cd70+实体瘤的患者给予合适剂量的ctx130细胞,例如约3x107至约6x108个car
+
ctx130细胞。可以向这种实体瘤患者施用约3x107个car
+
ctx130细胞。替代性地,可以向实体瘤患者施用约1x108个car
+
ctx130细胞。在另一个实例中,可以向实体瘤患者施用约3x108个car
+
ctx130细胞。在另一个实例中,可以向实体瘤患者施用约4.5x108个car
+
ctx130细胞。在另一个实例中,可以向实体瘤患者施用约6x108个car
+
ctx130细胞。在另一个实例中,可以向实体瘤患者施用约7.5x108个car
+
ctx130细胞。在另一个实例中,可以向实体瘤患者施用约9x108个car
+
ctx130细胞。
[0215]
在一些实例中,可以向患有晚期cd70+实体瘤(例如,不可切除的或转移性cd70+实体瘤)或复发性/难治性cd70+实体瘤的患者给予合适剂量的ctx130细胞,例如约9x109至约1.0x109个car
+
ctx130细胞。可以向这种实体瘤患者施用约9x109个car
+
ctx130细胞。替代性地,可以向实体瘤患者施用约1.0x109个car
+
ctx130细胞。
[0216]
在一些实施例中,将合适剂量的ctx130细胞由药物组合物的一个或多个小瓶施用,每个小瓶包含约1.5x108个car+ctx130细胞。在一些实施例中,将合适剂量的ctx130细胞由药物组合物的一个或多个小瓶施用,每个小瓶包含约3x108个car+ctx130细胞。在一些实施例中,施用至受试者的ctx130细胞的合适剂量是一倍或多倍的1.5x108个car+ctx130细胞,例如1倍、2倍、3倍、4倍、5倍或6倍的car+ctx130细胞。在一些实施例中,将合适剂量的ctx130细胞由药物组合物的一个或多个完全或部分小瓶施用。
[0217]
本文所述的抗cd70 car t细胞疗法的功效可以由熟练的临床医生确定。如果cd70+实体瘤的任何一种或所有体征或症状(举一个例子,以有益的方式改变cd70的水平(例如,降低至少10%))或其他临床上可接受的症状或标记物得到改善或减轻,则抗cd70 car t细胞疗法被视为“有效的”。功效还可以通过如通过住院治疗或需要医疗干预所评估的受试者恶化的失败(例如,cd70+实体瘤的进展停止或至少减缓)来测量。测量这些指标的方法是本领域技术人员已知的和/或本文所述的。治疗包括对人患者中cd70+实体瘤的任何治疗,并且包括:(1)抑制疾病,例如阻止或减缓症状的进展;或者(2)减轻疾病,例如引起症状消退;以及(3)预防或降低症状发展的可能性。
[0218]
本文所述的治疗方法涵盖重复淋巴细胞清除和抗cd70 car t细胞的再给药。在抗cd70 car t细胞的每次再给药之前,对患者进行另一次淋巴细胞清除治疗。抗cd70 car t细胞的剂量可以对于第一、第二和第三剂量是相同的。例如,第一、第二和第三剂量中的每一个是1x106个car+细胞、1x107个car+细胞、3x107个car+细胞、1x108个car+细胞、1.5x108个car+细胞、4.5x108个car
+
细胞、6x108个car
+
细胞、7.5x108个car
+
细胞、9.8x108个或1x109个car
+
细胞。在其他情况下,抗cd70 car t细胞的剂量可以随着剂量数增加而在car+细胞数上增加。例如,第一剂量是1x106个car+细胞,第二剂量是1x107个car+细胞,并且第三剂量是1x108个car+细胞。替代性地,car+细胞的第一剂量低于car+细胞的第二和/或第三剂量,例如,第一剂量是1x106个car+细胞并且第二和第三剂量是1x108个car+细胞。在一些实例中,抗cd70 car t细胞的剂量可以对于每个后续剂量增加1.5x108个car+细胞。
[0219]
在抗cd70 car t细胞的每次施用后可以评估患者的再给药。例如,在第一剂量的抗cd70 car t细胞后,如果人患者不显示以下中的一种或多种,则该患者可以有资格接受第二剂量的抗cd70 car t细胞:(a)剂量限制性毒性(dlt),(b)在72小时内未消退至2级的4级crs,(c)》1级gvhd,(d)≥3级神经毒性,(e)活动性感染,(f)血流动力学不稳定,以及(g)器官功能障碍。在另一个实例中,在第二剂量的抗cd70 car t细胞后,如果人患者不显示以下中的一种或多种,则人患者可以有资格接受第三剂量的ctx130:(a)剂量限制性毒性(dlt),(b)在72小时内未消退至2级的4级crs,(c)》1级gvhd,(d)≥3级神经毒性,(e)活动性感染,(f)血流动力学不稳定,以及(g)器官功能障碍。
[0220]
在一些实施例中,可以向如本文披露的人患者给予多个剂量的抗cd70car t细胞(例如,如本文披露的ctx130细胞),即再给药。可以向人患者总共给予至多三个剂量(即,不超过2次的再给药)。两个连续剂量之间的间隔可以是约8周至约2年。在一些实例中,如果患
者在第一剂量(或第二剂量)之后实现部分应答(pr)或完全应答(cr)并且随后在最后一次剂量的2年内进展,则可以向人患者再给药。在其他实例中,当人患者在最近剂量之后实现pr(而非cr)或疾病稳定(sd)时,可以向该患者再给药。还参见下面的实例11。
[0221]
抗cd70 car t细胞(诸如ctx130细胞)的再给药可以在抗cd70 car t细胞的第一剂量之后约8周至约2年发生。例如,抗cd70 car t细胞的再给药可以在抗cd70 car t细胞的第一剂量之后约8-10周发生。在其他实例中,抗cd70 car t细胞的再给药可以在抗cd70 car t细胞的第一剂量之后约14-18周发生。当向患者施用两个剂量时,可以在前一剂量之后8周至两年(例如,8-10周或14-18周)施用第二剂量。在一些实例中,可以向患者施用三个剂量。可以在第一剂量之后14-18周施用第三剂量,并且可以在第一剂量之后6-10周施用第二剂量。在一些情况下,两个连续剂量之间的间隔可以是约6-10周。
[0222]
在抗cd70 car t细胞的每次给药后,可以监测人患者的急性毒性诸如细胞因子释放综合征(crs)、肿瘤溶解综合征(tls)、神经毒性(例如,icans)、移植物抗宿主病(gvhd)、中靶脱肿瘤毒性和/或不受控制的t细胞增殖。该中靶脱肿瘤毒性可以包括该基因工程化t细胞群体针对激活的t淋巴细胞、b淋巴细胞、树突状细胞、成骨细胞和/或肾小管样上皮细胞的活性。也可以监测以下潜在毒性中的一种或多种:低血压、肾功能不全、噬血细胞性淋巴组织细胞增生症(hlh)、延长的细胞减少症和/或药物诱导的肝脏损伤。在抗cd70 car t细胞的每个剂量之后,可以监测人患者的毒性的发展至少28天。如果观察到毒性的发展,可以对人患者进行毒性管理。对表现出急性毒性的一种或多种症状的患者的治疗是本领域已知的。例如,可以向表现出crs症状(例如,心脏、呼吸和/或神经异常)的人患者施用抗细胞因子疗法。另外,可以向未表现出crs症状的人患者施用抗细胞因子疗法以促进抗cd70 car t细胞的增殖。
[0223]
本文所述的抗cd70 car t细胞治疗方法可以在已经受过先前抗癌疗法的人患者上使用。例如,可以将如本文所述的抗cd70 car t细胞施用至先前已用检查点抑制剂、酪氨酸激酶抑制剂、血管内皮生长因子抑制剂或其组合治疗过的患者。
[0224]
本文所述的抗cd70 car t细胞治疗方法也可以用于组合疗法中。例如,本文所述的抗cd70 car t细胞治疗方法可以与其他治疗剂共同使用,这些其他治疗剂用于治疗cd70+实体瘤,或用于增强基因工程化t细胞群体的功效和/或降低基因工程化t细胞群体的副作用。
[0225]
iv.用于治疗表达cd70的肿瘤的试剂盒
[0226]
本披露还提供了用于在用于治疗cd70+实体瘤的方法中使用如本文所述的抗cd70 car t细胞(诸如ctx130细胞)群体的试剂盒。此类试剂盒可以包括一个或多个容器,该一个或多个容器包含第一药物组合物和第二药物组合物以及药学上可接受的载剂,该第一药物组合物包含一种或多种淋巴细胞清除剂,该第二药物组合物包含任何核酸或基因工程化t细胞群体(例如,本文所述的那些)。
[0227]
在一些实施例中,试剂盒可以包括用于在本文所述的任何方法中使用的说明书。所包括的说明书可以包括向受试者施用第一和/或第二药物组合物以在人患者中实现预期活性的描述。试剂盒可以进一步包括基于鉴定人患者是否需要治疗来选择适于治疗的人患者的描述。在一些实施例中,说明书包括向需要治疗的人患者施用第一药物组合物和第二药物组合物的描述。
spring harbor laboratory press[冷泉港实验室出版社],1999);the antibodies[抗体](m.zanetti和j.d.capra编辑harwood academic publishers[哈伍德学术出版社],1995);dna cloning:a practical approach[dna克隆:实用方法],第i和ii卷(d.n.glover编辑1985);nucleic acid hybridization[核酸杂交](b.d.hames和s.j.higgins编辑(1985;transcription and translation[转录和翻译](b.d.hames和s.j.higgins编辑(1984;animal cell culture[动物细胞培养](r.i.freshney编辑(1986》;immobilized cells and enzymes[固定化细胞和酶](lrl press[lrl出版社],(1986;以及b.perbal,a practical guide to molecular cloning[分子克隆实用指南](1984);f.m.ausubel等人(编辑)。
[0233]
无需进一步详细阐述,据信本领域的普通技术人员可以基于以上描述在其最大程度上利用本发明。因此以下具体实施例将被解释为仅是说明性的,并且无论如何并非以任何方式限制本披露的其余内容。本文引用的所有出版物均通过援引并入以用于本文提及的目的或主题。
[0234]
实例
[0235]
为了可以更充分地理解所述的本发明,阐述了以下实例。提供本技术中所述的实例以说明本文提供的方法和组合物,并且并非以任何方式解释为限制其范围。
[0236]
实例1:具有多个基因敲除的t细胞的产生。
[0237]
此实例描述了使用crispr/cas9基因编辑技术来产生同时缺乏两个或三个基因表达的人t细胞。具体地,将t细胞受体(tcr)基因(在tcrα常数(trac)区域中编辑的基因)、β2-微球蛋白(β2m)基因和分化簇70(cd70)基因通过crispr/cas9基因编辑进行编辑,以产生在两个或更多个所列基因中具有缺陷的t细胞。为了简明起见,使用以下缩写:
[0238]
2x ko:trac-/β2m-[0239]
3x ko(cd70):trac-/β2m-/cd70-[0240]
用cas9:grna rnp复合物对激活的原代人t细胞进行电穿孔。核转染混合物含有nucleofector
tm
溶液、5x106个细胞、1μm cas9和5μm grna(如hendel等人,nat biotechnol.[自然生物技术]2015;33(9):985-989,pmid:26121415中所述)。为了产生双重敲除t细胞(2x ko),用两种不同的rnp复合物对细胞进行电穿孔,每种复合物含有cas9蛋白和以下sgrna之一:处于以上指示浓度的trac(seq id no:6)和β2m(seq id no:10)。为了产生三重敲除t细胞(3x ko),用三种不同的rnp复合物对细胞进行电穿孔,每种rna复合物含有cas蛋白和以下sgrna之一:(a)trac(seq id no:6)、β2m(seq id no:10)和cd70(seq id no:2或66)。也可以使用grna的未修饰形式(或其他修饰的形式)(例如,seq id no:3、7、11和/或67)。还参见表6中的序列。
[0241]
表6.grna序列/靶序列。
[0242][0243]
电穿孔后约一(1)周,将细胞不处理或用佛波豆蔻醚乙酸盐(pma)/离子霉素处理过夜。第二天将细胞处理用于流式细胞术(参见例如,kalaitzidis d等人,j clin invest[临床研究杂志]2017;127(4):1405-1413),以评估在经编辑的细胞群体的细胞表面的trac、β2m和cd70表达水平。使用了以下一抗(表7):
[0244]
表7.抗体。
[0245][0246]
表8示出了非常高效的多基因编辑。对于三重敲除细胞,80%的活细胞缺乏tcr、β2m和cd70的表达(表8)。
[0247]
表8.在3ko细胞群体中缺乏表达的活细胞的%。
[0248] trac koβ2m kocd70 ko3ko3ko(cd70)99%79%99%80%
[0249]
为了评估t细胞中的三重基因编辑是否影响细胞扩增,在编辑后的两周时段内,计数了双重和三重基因编辑的t细胞(未编辑的t细胞用作对照)中的细胞数量。产生5x106个细胞,并针对t细胞的每种基因型进行铺板。
[0250]
在电穿孔后窗口测试中,细胞增殖(扩增)继续进行。在双重(β2m-/trac-)和三重β2m-/trac-/cd70-)敲除t细胞中观察到类似的细胞增殖,如通过活细胞数所指示的(数据未示出)。这些数据表明多基因编辑不影响t细胞健康,如通过t细胞增殖所测量的。
[0251]
实例2:具有多个敲除的抗cd70 car t细胞的产生。
[0252]
此实例描述了同种异体人t细胞的产生,这些同种异体人t细胞缺乏tcr基因、β2m基因和/或cd70基因的表达,并且表达靶向cd70的嵌合抗原受体(car)。这些细胞命名为tcr-/β2m-/cd70-/抗cd70 car
+
或3x ko(cd70)cd70 car
+
。
[0253]
将重组腺相关腺病毒载体血清型6(aav6)(moi 50,000)(其包含seq id no:43的核苷酸序列(包含seq id no:44中的供体模板,该供体模板编码包含seq id no:46的氨基酸序列的抗cd70 car))与cas9:sgrna rnp(1μm cas9,5μm grna)一起递送以激活同种异体人t细胞。使用以下sgrna:trac(seq id no:6)、β2m(seq id no:10)和cd70(seq id no:2或66)。也可以使用grna的未修饰形式(或其他修饰的形式)(例如,seq id no:3、7、11和/或67)。电穿孔后约一(1)周,将细胞进行处理用于流式细胞术,以评估经编辑的细胞群体的细胞表面的trac、β2m和cd70表达水平。使用了以下一抗(表9):
[0254]
表9.抗体。
[0255]
抗体克隆fluor目录#稀释度tcrbw242/412pe130-091-236(美天旎公司)1:100β2m2m2pe-cy7316318(百进公司)1:100cd70113-16fitc355105(百进公司)1:100
[0256]
t细胞比例测定。然后使用以下抗体通过流式细胞术评估经编辑的t细胞群体中cd4+和cd8+细胞的比例(表10):
[0257]
表10.抗体。
[0258]
抗体克隆fluor目录#稀释度cd4rpa-t4bv510300545(百进公司)1:100
cd8sk1bv605344741(百进公司)1:100
[0259]
在经编辑的抗cd70 car t细胞群体中实现了高效率的基因编辑和car表达。另外,编辑未不利地改变cd4/cd8 t细胞群体。图1示出了三重敲除car t细胞中的非常高效基因编辑和抗cd70 car表达。超过55%的活细胞缺乏tcr、β2m和cd70的表达,并且还表达抗cd70 car。图2显示trac-/β2m-/cd70-/抗cd70 car+细胞中cd4/cd8 t细胞亚群的正常比例保持不变,这表明如通过cd4/cd8 t细胞亚群的比例测量的,这些多基因编辑不影响t细胞生物学。
[0260]
实例3:cd70 ko对抗cd70 car t细胞的体外细胞增殖的影响。
[0261]
为了进一步评估破坏car t细胞中cd70基因的影响,如实例2所述产生抗cd70 car t细胞。具体地,使用两种不同的grna(t7(seq id no:2和t8(seq id no:66))产生3x ko(trac-/β2m-/cd70-)抗cd70 car t细胞。电穿孔后,通过在编辑后的两周时段内计数双重或三重基因编辑的t细胞来评估细胞扩增。产生5x106个细胞,并针对t细胞的每种基因型进行铺板。通过计数活细胞数来确定增殖。图3显示相对于双重敲除trac-/β2m-/抗cd70 car
+
t细胞,用t7或t8 grna产生的三重敲除trac-/β2m-/cd70-/抗cd70 car
+
t细胞表现出更大的细胞扩增。这些数据表明敲除cd70基因使抗cd70 car+t细胞具有细胞增殖优势。
[0262]
实例4:具有cd70敲除的抗cd70 car t细胞的细胞杀伤功能。
[0263]
使用细胞杀伤测定来评估trac-/β2m-/cd70-/抗cd70 car
+
t细胞和trac-/β2m-/抗cd70 car
+
t细胞杀伤cd70+粘附性肾细胞癌(rcc)衍生的细胞系(a498细胞)的能力。将粘附细胞以50,000个细胞/孔接种在96孔板中,并且在37℃下放置过夜。第二天,将经编辑的抗cd70 car t细胞以所指示的比率添加至含有靶细胞的孔中。在所指示的孵育期之后,通过抽吸从培养物中去除car t细胞,并且将100μl cell titer-glo(普洛麦格公司(promega))添加至板的每个孔中以评估剩余的活细胞数。然后使用读板仪对每孔发射的光量进行定量。在24小时共同孵育后,这些细胞表现出对rcc衍生的细胞的有效细胞杀伤(图4)。抗cd70 car t细胞在cd70被敲除时展示出更高的效力,这在低t细胞:a498比率(1:1和0.5:1)下清楚可见,其中trac-/β2m-/cd70-/抗cd70 car
+
t细胞的细胞溶解保持高于90%,而trac-/β2m-/抗cd70 car
+
t细胞的细胞溶解下降至低于90%。这表明敲除cd70基因使抗cd70 car+t细胞具有更高的细胞杀伤效力。
[0264]
实例5:cd70的敲除在连续再激发后维持抗cd70 car
+
t细胞杀伤。
[0265]
将上面产生的抗cd70 car
+
t细胞用cd70+肾癌细胞系a498连续再激发,并且评价其杀伤cd70+肾癌细胞系a498的能力。
[0266]
将a498细胞铺板在t25烧瓶中,并且以2:1的比率(t细胞比a498)与10x106个含有两个(trac-/β2m-)或三个(trac-/β2m-/cd70-))grna编辑的抗cd70 car+t细胞混合。具有三个编辑的抗cd70 car+t细胞也称为ctx130。
[0267]
每次激发之后两或三天,对细胞进行计数,洗涤,重悬于新鲜t细胞培养基中,并且第二天以每一个a498细胞两个抗cd70 car
+
t细胞的相同比率(2:1,car
+
t:靶标)再激发。将用cd70+a498细胞对抗cd70 car
+
t细胞的激发重复进行13次。每次暴露于a498细胞后三至四天(以及下一次再激发之前),取培养物等分试样并且分析car t细胞在2:1(car t细胞:靶细胞)的比率下杀伤a498靶细胞的能力。使用cell titer-glo(普洛麦格公司)测量细胞杀伤。在首次用a498激发之前,具有2x ko(trac-/β2m-)和3x ko(trac-/β2m-/cd70-)的抗
cd70 car+t细胞各自表现出接近100%的对a498细胞的靶细胞杀伤。然而,到激发九,2x ko(trac-/β2m-)抗cd70 car
+
t细胞诱导低于40%的a498细胞的靶细胞杀伤,而3x ko(trac-/β2m-/cd70-)抗cd70 car
+
t细胞表现出高于60%的靶细胞杀伤(图5)。即使在用a498细胞进行13次再激发后,针对3x ko(trac-/β2m-/cd70-)抗cd70 car
+
t细胞的靶细胞杀伤仍保持高于60%,这证明这些car+t细胞具有抗耗竭性。
[0268]
实例6:在cd70+细胞的存在下抗cd70 car+t细胞(ctx130)的细胞因子分泌的测量。
[0269]
此研究的目标是评估ctx130在表达cd70的细胞的存在下分泌效应细胞因子的能力。
[0270]
从atcc(htb-44、crl-1611和htb-22)获得靶癌细胞系(a498、achn和mcf7)。评价了cd70在靶细胞系上的表达。简言之,将ctx130或对照t细胞(未编辑的t细胞)与u型底96孔板中的靶细胞系以从0.125:1至4:1的t细胞与靶细胞的不同比率共培养。将细胞在总共200μl的靶细胞培养基中培养24小时,如每个实验中所述的。在不含有il-2和il-7添加的培养基中进行测定以评价在补充细胞因子不存在下的t细胞激活。
[0271]
使用如本文所述的基于luminex的milliplex测定评估ctx130或对照t细胞(不具有抗cd70 car表达的未编辑的t细胞)在与cd70阳性或cd70阴性靶细胞共培养后特异性分泌效应细胞因子干扰素-γ(infγ)和白介素-2(il-2)的能力。将a498和achn细胞系用作cd70
+
靶系,并且将mcf7细胞系用作cd70-靶系。因为该测定与细胞毒性测定结合进行,所以方案如下:将靶细胞接种(50,000个靶细胞/96孔板)过夜并且然后与ctx130或对照t细胞以不同比率(0.125:1、0.25:1、0.5:1、1:1、2:1和4:1t细胞比靶细胞)共培养。二十四小时后,将板离心,收集上清液并且将其储存在-80℃下,直到进一步处理。il-2和ifnγ定量如下:使用试剂盒(密理博公司(millipore),目录号hcytomag-60k)来分别使用磁性微球hcyifng-mag(密理博公司,目录号hcyifng-mag)和hil2-mag(密理博公司,目录号hil2-mag)定量ifn-γ和il-2分泌。遵循制造商的方案进行该测定。简言之,重构标准品和质量控制(qc)样品,并且制备从10,000pg/ml至3.2pg/ml的工作标准品的连续稀释液。将标准品、qc和细胞上清液添加至每个板中,并且使用测定培养基稀释上清液。将所有样品与hcyifng-mag和hil2-mag珠一起孵育2小时。孵育后,使用自动磁性板洗涤器洗涤板。向每个孔中添加人细胞因子/趋化因子检测抗体溶液,并且孵育1小时,之后与链霉亲和素-藻红蛋白一起孵育30分钟。随后洗涤板,用150μl鞘液重悬样品,并且在板振荡器上搅拌5分钟。使用带软件的100/200
tm
仪器读取样品,并且使用分析师软件完成数据采集和分析。使用5参数逻辑曲线拟合方法自动分析中值荧光强度(mfi)数据,以计算在未知样品中测量的细胞因子浓度。
[0272]
为了确定ctx130是否在cd70阳性和cd70阴性细胞的存在下分泌细胞因子,将开发批次01与a498、achn或mcf7细胞共培养24小时。ctx130细胞在与cd70+细胞(a498和achn)共培养后分泌ifnγ和il-2两者,但当与cd70阴性细胞(mcf7)共培养时并非如此(图6a-6c,表11-16)。未编辑的对照t细胞未显示出在测试的细胞系上的特异性效应细胞因子分泌。
[0273]
表11.在cd70+细胞系a498的存在下ctx130细胞的ifnγ分泌。
[0274][0275]
标有星号(*)的样品指示该值低于lod(其为6.54pg/ml)。
[0276]
表12.在cd70+细胞系a498的存在下ctx130细胞的il-2分泌。
[0277][0278][0279]
标有星号(*)的样品指示该值低于lod(其为6.15pg/ml)。
[0280]
表13.在cd70+细胞系achn的存在下ctx130细胞的ifnγ分泌。
[0281][0282]
标有星号(*)的样品指示该值低于lod(其为2.36pg/ml)。
[0283]
表14.在cd70+细胞系achn的存在下ctx130细胞的il-2分泌。
[0284][0285]
标有星号(*)的样品指示该值低于lod(其为4.48pg/ml)。
[0286]
表15.在cd70-细胞系mcf7的存在下ctx130细胞未分泌ifnγ。
[0287][0288]
标有星号(*)的样品指示该值低于lod(其为2.25pg/ml)。
[0289]
表16.在cd70-细胞系mcf7的存在下ctx130细胞未分泌il-2。
[0290][0291]
标有星号(*)的样品指示该值低于lod(其为2.74pg/ml)。
[0292]
这些结果证明ctx130细胞在表达cd70的肾细胞癌细胞的存在下通过分泌ifnγ和il-2表现出效应子功能,而在cd70阴性细胞系mcf7的存在下并非如此。
[0293]
实例7:抗cd70 car+t细胞(ctx130)对cd70+细胞的选择性杀伤。
[0294]
此研究的目标是评估ctx130体外选择性溶解表达cd70的细胞的能力。
[0295]
使用基于celltiter-glo发光细胞活力的细胞毒性测定评估ctx130或对照t细胞(不具有抗cd70 car表达的未编辑的t细胞)特异性杀伤cd70阳性或cd70阴性靶细胞的能力。将a498和achn细胞系用作cd70阳性靶系,并且将mcf7细胞系用作cd70阴性靶系(全部从
atcc获得)。在这些实验中使用了来自开发批次01的t细胞。
[0296]
将不透明壁96孔板(康宁公司(corning),马萨诸塞州图克斯伯里(tewksbury,ma))的每孔50,000个人靶细胞(cd70阳性a498和achn、cd70阴性mcf7)铺板过夜。第二天,将细胞与t细胞以不同比率(0.125:1、0.25:1、0.5:1、1:1、2:1和4:1t细胞比靶细胞)共培养24小时。将靶细胞与未编辑的t细胞(tcr+b2m+car-)或ctx130细胞一起孵育。在用pbs手动洗涤掉t细胞之后,使用celltiter-glo发光细胞活力测定(celltiter-2.0测定,普洛麦格公司g9242)定量剩余的活靶细胞。使用synergy h1读板仪(伯腾仪器公司(biotek instruments),福蒙特州威努斯基市(winooski,vt))测量荧光。在处理细胞用于celltiter-glo分析之前,收集上清液以用于定量共培养后的细胞因子分泌。
[0297]
然后使用利用相对光单位(rlu)的以下方程式计算细胞溶解百分比:
[0298]
细胞溶解%=((没有效应子的rlu靶细胞-具有效应子的rlu靶细胞))/(没有效应子的rlu靶细胞)x 100
[0299]
测试ctx130开发批次(批次01)针对cd70+细胞系a498和achn的细胞杀伤活性。ctx130批次显示出特异性针对表达高(a498;图7a)和低(achn;图7b)cd70的细胞的有效细胞杀伤活性,但在与cd70-mcf7细胞共培养时并非如此(图7c)。在car表达不存在下,对照未编辑的t细胞在杀伤cd70+细胞方面不太有效。还参见表17-19中的数据。
[0300]
表17.在ctx130细胞的存在下的死亡a498细胞百分比。
[0301][0302]
表18.在ctx130细胞的存在下的死亡achn细胞百分比。
[0303][0304]
表19.在ctx130细胞的存在下的死亡mcf7细胞百分比。
[0305][0306]
这些结果证明ctx130细胞能够以cd70特异性方式溶解体外癌细胞系。
[0307]
实例8:cd70 ko改善多种细胞类型中的细胞杀伤。
[0308]
(a)在各种癌细胞系中的cd70表达。
[0309]
在各种癌细胞系中测量了相对cd70表达,以进一步评价抗cd70 car
+
t细胞杀伤各种癌症类型的能力。使用alexa fluor 647抗人cd70抗体(百进公司目录号355115)通过facs分析测量cd70表达。图8a示出了与其他肾癌细胞系a498、786-o、cacki-1和caki-2相比,如通过facs测量的achn细胞中cd70的相对表达。另外,使用alexa fluor 647抗人cd70抗体(百进公司目录号355115;图8b)或fitc抗人cd70抗体(百进公司目录号355105;在图8c中)通过facs分析(表20,图8a-8c)评价非肾癌细胞系的cd70表达。snu-1(肠癌细胞)表现出与a498相似的高水平cd70表达(图8b)。skov-3(卵巢)、hut78(淋巴瘤)、nci-h1975(肺)和hs-766t(胰腺)细胞系表现出的cd70表达水平与achn相似或更高,但低于a498(表20,图8c)。
[0310]
表20.细胞系和相对cd70表达。
[0311]
细胞系癌症类型相对cd70表达a498肾癌高achn肾脏(衍生自转移)中-低sk-ov-3卵巢腺癌中nci-h1975肺腺癌(nsclc)中calu-1肺癌低du 145前列腺癌低snu-1胃癌高hs 766t胰腺癌中mjt细胞淋巴瘤高hut78t细胞淋巴瘤中hut102t细胞淋巴瘤中panc-1胰腺癌低u937aml无表达k562慢性髓细胞性白血病无表达(阴性对照)
[0312]
细胞杀伤测定。使用细胞杀伤测定,确定了多基因编辑的抗cd70 car+细胞杀伤各种实体瘤细胞的能力。为了定量细胞杀伤,将细胞洗涤,将培养基用200ml含有1:500稀释的5mg/ml dapi(分子探针公司(molecular probes))(以计算死亡/垂死细胞)的培养基替换。最后,将25ml countbright珠(生命科技公司(life technologies))添加至每个孔中。然后
car
+
t细胞的孔中消除了所有胃癌靶细胞(snu-1),这表明癌细胞在延长的共培养情况下被抗cd70 car
+
t细胞完全消除。
[0322]
实例9:抗cd70 cart细胞的功效:nog小鼠中皮下肾细胞癌肿瘤异种移植物模型中的治疗。
[0323]
使用小鼠中的皮下肾细胞癌肿瘤异种移植物模型,在体内评价了表达cd70 car的t细胞消除表达高水平cd70的肾癌细胞的能力。这些模型包括皮下a498-nog模型、皮下786-o-nsg模型、皮下caki-2-nsg模型和皮下caki-1-nsg模型。如本文所述产生ctx130细胞。
[0324]
对于每种皮下肾细胞癌肿瘤异种移植物模型,将所指示细胞类型的五百万个细胞皮下注射至nog(nod.cg-prkdc
scid
il2rg
tm1sug
/jictac)小鼠的右侧腹中。当平均肿瘤大小达到平均大小为大约150mm3时,将小鼠不治疗或静脉内注射8x106个car
+
ctx130(trac-/b2m-/cd70-/抗cd70 car+t细胞)细胞/小鼠。在皮下a498-nog模型中,向另外组的小鼠注射7.5x106个car+trac-b2m-抗cd70 car-t细胞/小鼠。
[0325]
ctx130细胞完全消除皮下a498-nog模型(图9a)和皮下caki-2-nsg模型(图9c)中的肿瘤生长。用trac-/b2m-/抗cd70 car+t细胞注射的小鼠中的肿瘤生长与未治疗的对照小鼠的肿瘤生长相似(图9a)。ctx130细胞显著降低皮下786-o-nsg模型(图9b)和皮下caki-1-nsg模型(图9d)中的肿瘤生长。
[0326]
合在一起,这些结果证明ctx130细胞在四种类型的皮下肾细胞癌肿瘤异种移植物模型中降低肿瘤生长。
[0327]
肿瘤再激发模型肾细胞癌肿瘤异种移植物模型
[0328]
还在再激发的情况下在皮下a498异种移植物模型中测试了ctx130的功效。简言之,在nod(nod.cg-prkdc
scid
il2rg
tm1sug
/jictac)小鼠的右侧腹中皮下注射五百万个a498细胞。使肿瘤生长到大约51mm3的平均大小,然后将荷瘤小鼠随机分成两组(n=5只/组)。将组1不治疗,而组2接受7x106个car+ctx130细胞并且组3接受8x106个car+trac-b2m-抗cd70 car t细胞。在第25天,开始肿瘤再激发,由此将5x106个a498细胞注射至治疗小鼠的左侧腹中且注射至新对照组(组4)中。
[0329]
如图10中所示,用ctx130细胞治疗的小鼠在通过将a498细胞注射至左侧腹中再激发后未表现出肿瘤生长,而用抗cd70 car t细胞治疗的小鼠表现出注射至左侧腹中的a498细胞的肿瘤生长。这些结果证明与其他抗cd70 car+t细胞(car+trac-b2m-抗cd70 car t细胞)相比,ctx130细胞保留较高的再暴露于肿瘤细胞之后的体内功效。
[0330]
ctx130再给药在肾细胞癌肿瘤异种移植物模型中的功效
[0331]
还在再给药的情况下在皮下a498异种移植物模型中测试了ctx130的功效。简言之,向nog(nod.cg-prkdc
scid
il2rg
tm1sug
/jictac)小鼠的右侧腹中皮下注射五百万个a498细胞。当平均肿瘤大小达到平均大小为大约453mm3时,将小鼠不治疗或静脉内注射(n=5)8.6x106个car+ctx130细胞/小鼠。在第17和36天将组2小鼠分别用第二和第三剂量的8.6x106个car+ctx130细胞/小鼠治疗。在第36天将组3小鼠用第二剂量的8.6x106个car+ctx130细胞/小鼠治疗。
[0332]
如图11中所示,与仅在第36天施用一次再给药的小鼠相比,在第1天用ctx 130细胞给药且然后在第17和36天再给药的小鼠表现出更少的肿瘤生长。这些结果证明ctx130细胞的再给药提供了对肿瘤生长的增强抑制。
[0333]
实例10:抗cd70 cart细胞的功效:nog小鼠中的cd70+实体瘤异种移植物模型中的治疗。
[0334]
使用鼠类皮下肿瘤异种移植物模型,在体内评价了表达抗cd70 car的t细胞消除表达cd70的肿瘤细胞的能力。
[0335]
如上使用crispr/cas9和aav6(参见例如,实例3),以使用靶向cd70的car构建体(seq id no:45;seq id no:46)产生缺乏tcr、β2m、cd70的表达但伴随trac基因座的表达的人t细胞。在此实例中,首先用3种不同的cas9对激活的t细胞进行电穿孔:含有靶向trac(seq id no:6)、β2m(seq id no:10)和cd70(seq id no:2)的sgrna的sgrna rnp复合物。使用aav6递送的dna模板(其包括供体模板(seq id no:43;seq id no:44)(编码包含seq id no:46的氨基酸序列的抗cd70 car))通过同源定向修复来修复trac基因座处的dna双链断裂,该模板含有侧翼于嵌合抗原受体盒(-/+基因表达的调控元件)的trac基因座的右和左同源臂。
[0336]
所得的修饰的t细胞是3x ko(trac-/β2m-/cd70-)抗cd70 car+t细胞。使用本文所述的方法,在nog小鼠中评价了抗cd70 car+t细胞改善由cd70+肿瘤细胞系引起的疾病的能力。
[0337]
卵巢肿瘤模型中的治疗
[0338]
使用小鼠中的皮下卵巢癌(skov-3)肿瘤异种移植物模型,在体内评价了表达抗cd70 car的t细胞消除表达中等水平cd70的卵巢腺癌细胞的能力。
[0339]
使用转化药物开发有限责任公司(translational drug development,llc)(亚利桑那州斯科茨代尔市(scottsdale,az))采用的方法,在nog小鼠中评价了抗cd70 car+t细胞改善由cd70+卵巢癌细胞系引起的疾病的能力。简言之,在开始研究之前5-7天,将十二(12)只5-8周龄雌性ciea nog(nod.cg-prkdc
scid
i12rg
tm1sug
/jictac)小鼠单独饲养在通风微隔离的笼子里,在无病原体的条件下维持。小鼠在右后侧腹中接受5x106个skov-3卵巢癌细胞/小鼠的皮下接种。当平均肿瘤大小达到25-75mm3(约50mm3的靶标)时,将小鼠进一步分为两个治疗组,如表21中所示。在第1天,根据表21,治疗组2接受200μl的单剂量静脉内抗cd70car+t细胞。
[0340]
表21.治疗组
[0341][0342]
从治疗开始日起每周2次测量肿瘤体积。到注射后第9天,相对于未治疗的动物中的肿瘤,用抗cd70 cart细胞治疗的肿瘤开始显示出肿瘤体积的减少。到注射后第17天,用抗cd70 car t细胞治疗的小鼠中的cd70+卵巢癌肿瘤完全消除。肿瘤生长的此完全消退在治疗的动物中得以维持到注射后第44天,随后用抗cd70 cart细胞治疗的5只小鼠中有4只保持无肿瘤直到观察结束(第69天)(图9a)。这些数据证明3x ko(trac-/β2m-/cd70-)抗cd70 car+细胞在体内用于治疗人卵巢肿瘤是高度有效的。
[0343]
非小细胞肺癌(nsclc)肿瘤模型中的治疗
[0344]
使用小鼠中的皮下肺癌(nci-h1975)肿瘤异种移植物模型,在体内评价了表达
cd70 car的t细胞消除表达中等水平cd70的肺腺癌细胞的能力。
[0345]
使用转化药物开发有限责任公司(亚利桑那州斯科茨代尔市)采用的方法,在nog小鼠中评价了这些抗cd70 car+t细胞改善由cd70+肺癌细胞系引起的疾病的能力。简言之,在开始研究之前5-7天,将12只5-8周龄雌性ciea nog(nod.cg-prkdc
scid
i12rg
tm1sug
/jictac)小鼠单独饲养在通风微隔离的笼子里,在无病原体的条件下维持。小鼠在右后侧腹中接受5x106个nci-h1975肺癌细胞/小鼠的皮下接种。当平均肿瘤大小达到25-75mm3(约50mm3的靶标)时,将小鼠进一步分为2个治疗组,如表22中所示。在第1天,根据表22,治疗组2接受200μl的单剂量静脉内抗cd70car+t细胞。
[0346]
表22.治疗组
[0347][0348]
从治疗开始日起每周2次测量肿瘤体积。到注射后第12天,相对于未治疗的动物中的肿瘤,用抗cd70 car t细胞治疗的肿瘤开始显示出肿瘤体积的减少。治疗的动物中肿瘤的此完全消退持续到注射后第33天。用抗cd70car t细胞的治疗导致对已建立的h1975肺癌异种移植物的有效活性到注射后40天(所有小鼠中的肿瘤再生长得以抑制长达40天,其中肿瘤大小《100mm3),随后肿瘤开始生长。(图9b)。这些数据证明3x ko(trac-/β2m-/cd70-)抗cd70 car+细胞在体内具有针对人cd70+肺癌肿瘤的有效活性。
[0349]
胰腺肿瘤模型中的治疗
[0350]
使用小鼠中的皮下胰腺(hs 766t)肿瘤异种移植物模型体内评价了表达cd70 car的t细胞消除表达中等水平cd70的胰腺癌细胞的能力。
[0351]
使用转化药物开发有限责任公司(亚利桑那州斯科茨代尔市)采用的方法,在nog小鼠中评价了这些抗cd70 car+t细胞改善由cd70+胰腺癌细胞系引起的疾病的能力。简言之,在开始研究之前5-7天,将12只5-8周龄雌性ciea nog(nod.cg-prkdc
scid
i12rg
tm1sug
/jictac)小鼠单独饲养在通风微隔离的笼子里,在无病原体的条件下维持。小鼠在右后侧腹中接受5x106个hs766t胰腺癌细胞的皮下接种。当平均肿瘤大小达到25-75mm3(约50mm3的靶标)时,将小鼠进一步分为2个治疗组,如表23中所示。在第1天,根据表23,治疗组2接受200μl的单剂量静脉内抗cd70 car+t细胞。
[0352]
表23.治疗组
[0353][0354]
从治疗开始日起每周2次测量肿瘤体积。到注射后第15天,用抗cd70car t细胞治疗的肿瘤开始在所有治疗小鼠中显示出肿瘤体积的减少。用抗cd70 car+t细胞的治疗有效减小了所有测试小鼠中cd70+胰腺癌肿瘤的大小(《37mm3),其中在研究期间(直到第67天)没有进一步增长的迹象(图9c)。这些数据证明3x ko(trac-/β2m-/cd70-)抗cd70 car+细胞在体内诱导人cd70+胰腺癌肿瘤的消退,对已建立的hs766t胰腺癌异种移植物具有有效活
性并且应答持久超出治疗开始后60天。
[0355]
胃肿瘤模型中的治疗
[0356]
使用小鼠中的皮下胃癌(snu-1)肿瘤异种移植物模型,在体内评价了表达抗cd70 car的t细胞消除表达中等水平cd70的卵巢腺癌细胞的能力。
[0357]
使用转化药物开发有限责任公司(亚利桑那州斯科茨代尔市)采用的方法,在nog小鼠中评价了这些抗cd70 car+t细胞改善由cd70+卵巢癌细胞系引起的疾病的能力。简言之,在开始研究之前5-7天,将十二(12)只5-8周龄雌性ciea nog(nod.cg-prkdc
scid
i12rg
tm1sug
/jictac)小鼠单独饲养在通风微隔离的笼子里,在无病原体的条件下维持。小鼠在右后侧腹中接受5x106个snu-1胃癌细胞/小鼠的皮下接种。当平均肿瘤大小达到25-75mm3(约50mm3的靶标)时,将小鼠进一步分为两个治疗组,如表24中所示。在第1天,根据表24,治疗组2接受200μl的单剂量静脉内抗cd70car+t细胞。
[0358]
表24.治疗组
[0359][0360]
从治疗开始日起每周2次测量肿瘤体积。到注射后第10天,用抗cd70cart细胞治疗的肿瘤开始显示出肿瘤体积的减少。到注射后第20天,用抗cd70 car t细胞治疗的小鼠中的cd70+胃癌肿瘤又经历肿瘤大小的显著下降。到注射后第60天,cd70+胃癌肿瘤显示出肿瘤生长的完全消退(图9d)。这些数据证明3x ko(trac-/β2m-/cd70-)抗cd70 car+细胞在体内用于治疗人胃肿瘤是高度有效的。
[0361]
实例11:同种异体crispr-cas9工程化t细胞(ctx130)在患有表达cd70的癌症的成人受试者中的安全性和功效的1期、开放标签、多中心、剂量递增和队列扩展研究。
[0362]
ctx130是一种cd70定向性t细胞免疫疗法,该免疫疗法包括使用crispr-cas9(成簇规律间隔短回文重复序列/crispr相关蛋白9)基因编辑组分(单指导rna[sgrna]和cas9核酸酶)离体基因修饰的同种异体t细胞。这些修饰包括靶向破坏t细胞受体α恒定(trac)、β2-微球蛋白(b2m)和cd70基因座,以及经由腺相关病毒(aav)表达盒将抗cd70嵌合抗原受体(car)转基因插入trac基因座中。抗cd70 car(seq id no:46)由衍生自先前表征的抗cd70杂交瘤if6的抗cd70单链可变片段(seq id no:48)、cd8跨膜结构域(seq id no:54)、4-1bb共刺激结构域(seq id no:57)和cd3ζ信号传导结构域(seq id no:61)组成。
[0363]
1.研究概述
[0364]
1.1研究群体
[0365]
剂量递增和队列扩展包括患有表达cd70的癌症,例如cd70+实体瘤的成人受试者,该癌症可以是晚期的(例如,不可切除的或转移性的)、复发性的或难治性的。
[0366]
剂量递增和队列扩展包括患有表达cd70的胰腺癌的成人受试者,该胰腺癌可以是晚期的(例如,不可切除的或转移性的)、复发性的或难治性的。
[0367]
剂量递增和队列扩展包括患有表达cd70的胃癌的成人受试者,该胃癌可以是晚期的(例如,不可切除的或转移性的)、复发性的或难治性的。
[0368]
剂量递增和队列扩展包括患有表达cd70的肺癌的成人受试者,该肺癌可以是晚期
的(例如,不可切除的或转移性的)、复发性的或难治性的。
[0369]
剂量递增和队列扩展包括患有表达cd70的卵巢癌的成人受试者,该卵巢癌可以是晚期的(例如,不可切除的或转移性的)、复发性的或难治性的。
[0370]
剂量递增和队列扩展包括患有表达cd70的前列腺癌的成人受试者。
[0371]
在一些情况下,受试者患有示例性cd70+实体瘤肾细胞癌(rcc),该肾细胞癌可以是晚期的(例如,不可切除的或转移性的)、复发性的或难治性的。
[0372]
1.2施用方式
[0373]
受试者在淋巴细胞清除(ld)化学疗法后接受ctx130的静脉内(iv)输注。
[0374]
1.3受试者参加的持续时间
[0375]
受试者参加此研究大约5年。完成此研究之后,所有受试者需要参加另外10年的单独长期随访研究,以评估安全性和存活期。
[0376]
2.研究目的
[0377]
1期剂量递增研究的目的是评价抗cd70同种异体crispr-cas9工程化t细胞(ctx130)在患有cd70+实体瘤,例如晚期(例如,不可切除的或转移性)、复发性或难治性cd70+实体瘤的受试者中的安全性和功效。
[0378]
car t细胞疗法是用于治疗人恶性肿瘤的过继性t细胞治疗剂(act)。尽管car t细胞疗法已在患有复发性/难治性非霍奇金淋巴瘤(nhl)的患者和患有急性成淋巴细胞性白血病(all)的儿科患者中取得巨大的临床成功(包括持久缓解),但其在实体瘤适应症中的研究性使用尚未显示出相关的临床应答。另外,当前批准的act是自体的并且需要患者特异性细胞收集和制造,这导致重新引入来自工程化t细胞的残留污染肿瘤细胞(ruella等人,(2018)nat med[自然医学],24,1499-1503)。此外,每种自体产品的异质性质使得在大多数研究的疾病适应症中证明car t细胞剂量、毒性和/或应答之间的相关性具有挑战性(mueller等人,(2017)blood[血液]130,2317-2325)。另外,用自体car t细胞疗法治疗的患有慢性淋巴细胞性白血病(cll)的患者中的低应答率和患有b细胞all的患者中的应答缺乏部分归因于耗竭的t细胞表型(fraietta等人,(2018)nat med[自然医学],24,563-571;riches等人,(2013)blood[血液]121,1612-21;mackall,(2019)cancer research[癌症研究],aacr年会,摘要pl01-05;long等人,(2015)nat med[自然医学],21,581-90;walker等人,(2017)mol ther[分子疗法],25,2189-2201;zheng等人,(2018)drug discov today[今日药物发现],23,1175-1182)。
[0379]
最后,收集、运送、制造和运送回至患者的治疗医师是耗时的,并且因此,一些患者在等待治疗时经历了疾病进展或死亡。同种异体的现成car t细胞产品可以提供诸如立即可获得性、没有制造失败以及来自健康供体的化学疗法幼稚t细胞的益处,因此相对于自体car t细胞疗法提供更一致的产品。
[0380]
通过crispr-cas9编辑,可以实现内源性t细胞受体(tcr)以及主要组织相容性复合物(mhc)i类蛋白的破坏。tcr敲除旨在显著降低或消除移植物抗宿主病(gvhd)的风险,而mhc敲除被设计用于增加car t细胞持久性。在患有cd70+实体瘤的受试者中的此首次人体试验评价了此crispr-cas9修饰的同种异体car t细胞方法的安全性和功效。
[0381]
ctx130(一种cd70定向性基因修饰同种异体t细胞免疫疗法)由健康供体的细胞制造;因此,所得的制造细胞旨在为每名受试者提供质量可靠的一致最终产品。此外,通过使
用aav和同源定向修复(hdr)在trac位点精确递送和插入car,ctx130的制造不存在与随机插入慢病毒和逆转录病毒载体相关的风险。
[0382]
应用于ctx130的4个编辑步骤以下述方式解决了安全性和功效:
[0383]
●
安全性:缺失trac基因座以破坏内源性tcr及其与宿主mhc系统的相互作用,从而抑制移植物抗宿主病(gvhd)。
[0384]
●
t细胞活性:插入靶向cd70的car构建体、缺失b2m基因座以及缺失cd70基因座。
[0385]
crispr-cas9允许通过同源重组将car构建体的引入与缺失的基因座相偶联。使用aav递送的dna供体模板和hdr在trac基因组基因座处递送和精确插入car与使用其他常见转导方法(诸如慢病毒和逆转录病毒转导)随机插入遗传物质形成对比。在trac基因座处插入car基因导致几乎所有表达car的细胞中的tcr消除。虽然crispr-cas9介导的内源性tcr破坏可以显著降低或消除gvhd的风险,但假设i类mhc蛋白的破坏增加car t细胞持久性。cd70基因座的缺失旨在增加ctx130的持久性和通过激活的car t细胞上的升高表达来减少潜在亲密。
[0386]
ctx130(一种cd70定向性基因修饰同种异体t细胞免疫疗法)由健康供体的细胞制造;因此,所得的制造细胞旨在为每名受试者提供质量可靠的一致最终产品。此外,通过使用aav和同源定向修复(hdr)在trac位点精确递送和插入car,ctx130的制造不存在与随机插入慢病毒和逆转录病毒载体相关的风险。复发有用car t细胞转导的恶性b细胞的患有all的受试者的最近报道病例进一步强调未将car插入与tcr破坏偶联的慢病毒方法的潜在风险(ruella等人,(2018)nat med[自然医学]24,1499-503)。单独的受试者制造失败、时序安排复杂性、与桥接化学疗法相关的毒性和白细胞单采术对受试者的风险不适用于同种异体car t细胞产品。立即施用ctx130的能力允许受试者以及时方式接受产品并且帮助受试者避免桥接化学疗法的需要。
[0387]
最终,cd70是cd27受体(其属于肿瘤坏死因子受体超级族)的膜结合配体。cd70在若干种血液学恶性肿瘤中表达。cd70还由非血液学恶性肿瘤(诸如肾细胞癌和胶质母细胞瘤)高度表达。
[0388]
3.研究目标
[0389]
主要目标,a部分(剂量递增):为了评估ctx130的递增剂量在患有cd70+实体瘤的受试者中的安全性,以确定推荐的b部分剂量(rpbd)。
[0390]
主要目标,b部分(队列扩展):为了评估ctx130在患有cd70+实体瘤的受试者中的功效,该功效如根据实体瘤应答评价标准(recist 1.1)通过客观应答率(orr)测量的。
[0391]
次要目标(a部分和b部分):为了评估ctx130随时间的活性,包括至应答时间(ttr)、应答持续时间(dor)、无进展存活期(pfs)、总存活期(os)、疾病控制率(dcr)、至进展时间(ttp);为了进一步表征的ctx130随时间的功效;为了进一步评估ctx130的安全性并且描述和评估特别关注的不良事件(aesi),包括细胞因子释放综合征(crs)、肿瘤溶解综合征和gvhd;以及为了表征血液中ctx130的药代动力学(pk)(扩增和持久性)。
[0392]
探索性目标(a部分和b部分):为了鉴定与疾病、临床应答、抗性、安全性或药效动力学(pd)活性相关的基因组、代谢和/或蛋白质组生物标记物;为了进一步描述ctx130的功效的动力学,并且为了描述ctx130对患者报告结局(pro)的影响。
[0393]
4.研究资格
[0394]
4.1纳入标准
[0395]
要被视为有资格参加此研究,受试者必须满足所有下列纳入标准:
[0396]
1.≥18岁且体重≥60kg。
[0397]
2.能够理解并遵守方案需要的研究程序,并自愿签署书面知情同意文件。
[0398]
3.诊断患有晚期、复发性或难治性cd70+实体瘤
[0399]
о肿瘤组织的可获得性。
[0400]
о如由站点放射科医生根据recistv1.1评估具有可测量疾病。如果在位于先前辐照区域中的靶病灶中展示出进展,则此类病灶被视为可测量的。
[0401]
о具有至少有一个适于活检的非靶病灶。
[0402]
4.如在筛选期期间评估的卡诺夫斯基性能状态(kps)≥80%。
[0403]
5.满足经受本文所述的ld化学疗法和car t细胞输注的方案指定标准。
[0404]
6.足够的器官功能:
[0405]
●
肾:肌酐清除率(crcl)≥50ml/min
[0406]
●
肝脏:
[0407]
о天冬氨酸转氨酶(ast)和丙氨酸转氨酶(alt)《3x正常上限(uln);
[0408]
о总胆红素《2xuln(对于吉尔伯特综合征(gilbert’s syndrome),总胆红素《3mg/dl);并且缀合胆红素正常,
[0409]
о白蛋白》90%的正常下限。
[0410]
●
心脏:超声心动图显示血流动力学稳定且左心室射血分数(lvef)≥45%。
[0411]
●
肺部:根据脉搏血氧饱和度仪,室内空气的氧饱和度水平》90%。
[0412]
●
血液学:在筛选之前,在没有先前血细胞输注的情况下血小板计数》100,000/mm3、绝对嗜中性粒细胞计数》1500/mm3且血红蛋白(hgb)》9g/dl
[0413]
●
凝血:活化部分凝血活酶时间(aptt)或ptt≤1.5xuln
[0414]
7.有生育能力的女性患者(月经初潮后有完整的子宫和至少1个卵巢,并且绝经后不到1年)必须同意从招募开始到最后一次ctx130输注之后的至少12个月使用高度有效避孕方法(如方案中指定的)。
[0415]
8.男性患者必须同意从招募开始到最后一次ctx130输注之后的至少12个月使用有效避孕方法(如方案中指定的)。
[0416]
4.2排除标准
[0417]
要有资格参加此研究,受试者不得满足下列任何排除标准:
[0418]
1.用任何抗cd70靶向剂的先前治疗。
[0419]
2.用任何car t细胞或任何其他修饰的t或自然杀伤(nk)细胞的先前治疗。
[0420]
3.对任何一种或多种ld化学疗法剂或ctx130产品的任何赋形剂的已知禁忌症。
[0421]
4.如通过阳性筛选mri或过去病史证明的具有其恶性肿瘤的中枢神经系统(cns)表现的受试者。
[0422]
5.临床相关cns病变诸如癫痫发作、中风、严重脑损伤、小脑疾病的病史或存在,使用先前疗法的后部可逆性脑病综合征(pres)的病史,或可以增加car t细胞相关毒性的另一病症。
[0423]
6.持续的、临床上显著的胸膜积液或腹水或任何心包输注或者在过去2个月中的
胸膜积液或腹水病史。
[0424]
7.在筛选之前6个月内的不稳定型心绞痛、临床上显著的心律失常或心肌梗塞。
[0425]
8.目前具有7.0%或48mmol/ml的血红蛋白a1c(hba1c)水平的糖尿病。
[0426]
9.不受控制的、危及生命的急性细菌、病毒或真菌感染。
[0427]
10.人免疫缺陷病毒1型或2型存在或活动性乙型肝炎病毒或丙型肝炎病毒感染呈阳性。允许有乙型肝炎或丙型肝炎感染的先前病史、已记录无法检测的病毒载量(通过定量聚合酶链反应或核酸测试)的受试者。
[0428]
11.先前或并发恶性肿瘤,用治愈性方法治疗、不需要身性疗法并且已缓解》12个月的那些或者具有发展为转移性疾病的低风险的任何其他局部恶性肿瘤除外。
[0429]
12.需要类固醇和/或任何其他免疫抑制疗法的原发性免疫缺陷障碍或活动性自身免疫性疾病。
[0430]
13.先前实体器官移植或骨髓移植。
[0431]
14.在招募之前14天内,抗肿瘤或研究性药剂(包括放射疗法)的使用。如果临床上指示并且经与医学监查员协商,则对于先前接受类固醇的受试者,允许使用生理剂量的类固醇。
[0432]
15.在招募之前28天内作为传统中药或处方草药疗法的一部分接受活疫苗或草药。
[0433]
16.诊断出可能严重妨碍受试者参加研究的能力的显著精神障碍。
[0434]
17.怀孕或哺乳的女性。
[0435]
5.研究设计
[0436]
5.1研究性计划
[0437]
这是一项评价ctx130在患有cd70+实体瘤的受试者中的安全性和功效的单臂、开放标签、多中心、1期研究。本研究分为2个部分:剂量递增(a部分),之后是队列扩展(b部分)。
[0438]
在a部分中,剂量递增在患有cd70+实体瘤(例如,不可切除的或转移性)的成人受试者中开始。受试者可以已进展至cpi和血管内皮生长因子(vegf)抑制剂两者。根据本文所述的标准进行剂量递增。
[0439]
在b部分中,开始扩展队列以进一步使用最佳西蒙(simon)2阶段设计来评估ctx130的安全性和功效。在第一阶段中,将受试者用针对b部分队列扩展推荐的剂量(等于或低于a部分中确定的mtd)的ctx130治疗。
[0440]
5.1.1研究设计
[0441]
本研究分为2个部分:剂量递增(a部分),之后是队列扩展(b部分)。本研究的两个部分包括3个主要阶段:筛选、治疗和随访。研究方案的示意性描绘示于图13中。
[0442]
3个主要阶段如下:
[0443]
阶段1-筛选以确定治疗资格(长达14天)。
[0444]
阶段2-ld化学疗法和ctx130输注。
[0445]
阶段2a-ld化学疗法:每日静脉内(iv)共同施用氟达拉滨30mg/m2和环磷酰胺500mg/m2,持续3天。两种药剂在同一天开始并且施用连续3天。在ctx130输注之前,ld化学疗法必须完成至少48小时(但不超过7天)。
[0446]
阶段2b-ctx130输注
[0447]
临床资格-在开始ld化学疗法和输注ctx130之前,必须重新确认受试者的临床资格。
[0448]
阶段3-随访(最后一次ctx130输注之后5年)。
[0449]
在ctx130输注后时段期间,监测受试者的急性毒性(第1-28天),包括crs、免疫效应细胞相关神经毒性综合征(icans)、gvhd和其他ae。本文描述了毒性管理指南(参见第8部分)。在a部分(剂量递增)期间,所有受试者在ctx130输注后的前7天内住院治疗,或者如果当地法规或站点实践需要,则更长时间。在a部分和b部分两者中,受试者必须在ctx130输注之后的28天内保持在研究站点附近(即,1小时的转运时间)。
[0450]
受试者参加此研究长达5年。完成此研究之后,受试者需要参加另外10年的单独长期随访研究,以评估长期安全性和存活期。
[0451]
5.2 ctx130剂量递增
[0452]
在此研究中可以从剂量水平1(dl1)开始评价基于car
+
t细胞数的ctx130的以下剂量(表25)。对于所有剂量水平可以施加1x105个tcr
+
细胞/kg的剂量限制。
[0453]
表25.ctx130的剂量递增。
[0454]
剂量水平总car
+
t细胞剂量-1(降级)1x10613x10721x10833x10849x108[0455]
car:嵌合抗原受体。
[0456]
使用标准3+3设计进行剂量递增,其中在每种剂量水平下招募3至6名受试者,这取决于如本文所定义的初始给药之后的剂量限制性毒性(dlt)的发生。dlt评价期从初始ctx130输注开始,并且持续28天。在剂量水平1(和剂量水平-1(如果需要))中,受试者将以交错方式治疗,使得受试者将仅在先前受试者已完成dlt评价期后接受ctx130(例如,交错28天)。在剂量水平1下出现需要将给药降低至剂量水平-1的dlt的情况下,也将所有受试者在剂量水平-1下的给药交错28天。如果在剂量水平1下未发生dlt,则剂量递增将进展至剂量水平2,并且每名受试者之间的给药将交错14天。如果在前2个剂量水平(剂量水平1和2)下未发生dlt,则在后续剂量水平(剂量水平3和4)下,每名受试者之间的给药将交错7天。
[0457]
根据以下规则进行剂量递增:
[0458]
о如果3名受试者中有0名经历dlt,则递增至下一剂量水平。
[0459]
о如果3名受试者中有1名经历dlt,则将当前剂量水平扩展至6名受试者。
[0460]
о如果6名受试者中有1名经历dlt,则递增至下一剂量水平。
[0461]
о如果6名受试者有≥2名经历dlt:
[0462]
■
如果在剂量水平-1中,则评价替代性给药方案或宣布无法确定用于b部分队列扩展的推荐剂量。
[0463]
■
如果在剂量水平1中,则降级至剂量水平-1。
[0464]
■
如果在剂量水平2或3中,则宣布先前剂量水平为mtd。
[0465]
о如果3名受试者有≥2名经历dlt:
[0466]
о如果在剂量水平-1中,则评价替代性给药方案或宣布无法确定用于b部分队列扩展的推荐剂量。
[0467]
о如果在剂量水平1中,则降低至剂量水平-1。
[0468]
о如果在剂量水平2或3中,则宣布先前剂量水平为mtd。
[0469]
о可以允许dl2与dl3之间的中间剂量,例如1.5x108个car
+
t细胞。
[0470]
о可以允许dl3与dl4之间的中间剂量,例如4.5x108个car
+
t细胞、6x108个car
+
t细胞或7.5x108个car
+
t细胞,这可以基于dl4安全性和功效数据的审查。
[0471]
о在此研究中剂量递增不超过表25中列出的最高剂量。
[0472]
5.2.1最大耐受剂量定义
[0473]
mtd是在少于33%的受试者中观察到dlt的最高剂量。在此研究中可以未确定mtd。可以在mtd不存在下进行移至b部分扩展队列的决定,前提是该剂量等于或低于研究的a部分中研究的最大剂量(或mad)。
[0474]
5.2.2 dlt定义
[0475]
毒性根据美国国家癌症研究所(nci)不良事件通用术语标准(ctcae)第5.0版进行分级和记录,除外的是crs(astct标准;美国移植与细胞疗法协会标准;lee标准)、神经毒性(icans标准;免疫效应细胞相关神经毒性综合征标准,ctcae 5.0版;lee标准)和gvhd(magic标准;西奈山急性gvhd国际联合会标准;harris等人,(2016)biol blood marrow transplant[血液和骨髓移植生物学]22,4-10)。与ctx130没有可信因果关系的ae不被视为dlt。
[0476]
dlt被定义为:
[0477]
a.》2级gvhd,如果它在7天内对类固醇治疗(例如,1mg/kg/天)没有应答的话(gvhd分级提供于表31中)。
[0478]
b.在ctx130输注之后不久在28天内发生的任何ctx130相关3至5级毒性,但具有下面列表的例外:
[0479]
以下项不被视为dlt:
[0480]
о通过适当的医学干预在72小时内改善至≤2级的根据crs分级系统的任何3级或4级crs
[0481]
о通过适当的医学干预在72小时内消退的3级或4级发热
[0482]
о持续《7天的3级疲劳
[0483]
о在14天内改善至≤2级的任何3级或4级异常肝功能测试
[0484]
о在7天内改善至≤2级的涉及除心脏之外的生命器官(例如,肺部、肾)的任何3级毒性
[0485]
о在72小时内改善至≤2级的任何3级心脏毒性
[0486]
о在72小时内消退至≤2级的任何3级神经毒性
[0487]
о由于疾病进展导致的死亡
[0488]
о非类固醇难治性并且在14天内消退至1级的gvhd
[0489]
5.3在a部分和b部分中用ctx130进行重复给药
[0490]
此研究将允许用ctx130细胞向受试者进行不超过2次再给药。要被考虑进行再给
药,受试者必须1)在初始或第二ctx130输注之后实现了部分应答(pr)或完全应答(cr)并且随后在最后一次剂量的2年内进展,即使没有满足正式recist进展标准,或2)在最近的ctx130输注之后的第3个月研究访视时实现pr(而非cr)或疾病稳定(sd)(再给药决定将基于当地ct扫描/评估)。
[0491]
受试者可以再给药的最早时间是在初始或第二ctx130输注之后2个月。
[0492]
要用ctx130进行再给药,受试者应满足以下标准:
[0493]
■
如果可获得适于活检的病灶,则确认肿瘤在复发时是cd70
+
的(基于当地或中心评估)
[0494]
■
在剂量递增(适用时)期间无先前dlt
[0495]
■
没有在ctx130输注后72小时未消退至≤2级的先前≥3级crs
[0496]
■
在ctx130输注后无先前》1级gvhd
[0497]
■
在ctx130输注后无先前≥2级icans
[0498]
■
满足如本文所述的初始研究纳入标准(#1、#2、#4-8)和排除标准(#2[用car t细胞的先前治疗除外]-17)(参见第4部分)。
[0499]
■
满足如此实例中所述的ld化学疗法和ctx130输注的标准。
[0500]
应与初始给药一致地跟踪再给药的受试者。必须重复所有筛选评估,包括脑mri。
[0501]
另外的再给药考虑包括以下:
[0502]
■
展示出疾病复发/进展的ct扫描将充当用于肿瘤应答评价的新基线。再给药必须在该扫描的28天内发生。
[0503]
■
如果受试者在第3个月访视时保持为pr并且再给药,则初始基线扫描将继续用于肿瘤应答评价。
[0504]
■
剂量递增队列中经受再给药的受试者将接受已被认为安全的最高ctx130剂量。
[0505]
■
扩展队列中的受试者将以推荐b部分剂量进行再给药。
[0506]
在每个给药事件之前,受试者可以接受另一剂量的ld化学疗法。
[0507]
6.研究程序
[0508]
本研究的剂量递增部分和扩展部分两者由3个不同阶段组成:(1)筛选和资格确认,(2)ld化学疗法和ctx130输注,和(3)随访。在筛选期期间,根据本文所述的资格标准评估受试者。在招募后,受试者接受ld化学疗法,之后是ctx130的输注。在完成治疗期后,评估受试者的肿瘤应答、疾病进展和存活期。在整个所有研究期中,定期监测受试者的安全性。
[0509]
表26和表27中提供了完整的评估时间表。缺失的评价应重新安排并尽可能接近原计划日期进行。根据医疗保健从业人员的意见由于重新安排与下一次的计划评价在时间上太近而使该重新安排变得在医学上是不必要的或不安全的情况例外。在这种情况下,应放弃缺失的评价。
[0510]
出于此方案的目的,没有第0天。所有访视日期和窗口均使用第1天作为ctx130输注日期来计算。
[0511]
[0512]
[0513]
[0514]
[0515]
[0516][0517]
6.1受试者筛选
[0518]
6.1.1卡诺夫斯基性能状态
[0519]
使用卡诺夫斯基量表在表26中概述的时间点评估性能状态以确定受试者的总体幸福感和执行日常生活活动的能力,评分范围为从0至100。较高的评分意指更佳的进行日常活动的能力。
[0520]
卡诺夫斯基性能状态量表示出于表28中,并且用于确定当前研究中的性能状态(p
é
us等人,(2013)bmc med inform decis mak.[bmc医学信息学与决策制定],13:72。
[0521]
表28.卡诺夫斯基性能状态量表。
[0522][0523]
6.1.2脑mri
[0524]
为了排除cns转移,脑mri将在筛选时(即,在ctx130输注之前28天内)进行。此mri的获取、处理和传递的要求将概述于成像手册中。
[0525]
6.1.3超声心动图
[0526]
在筛选时将由经培训的医务人员进行和读取经胸心脏超声心动图(用于评估左心室射血分数)以确认资格。如果在crs期间出现心脏症状,则应根据机构指南开始医学上适当的评估。
[0527]
6.1.4心电图
[0528]
十二(12)导联心电图(ecg)在筛选期间、在治疗第一天的每次ld化学疗法之前、在第1天的ctx130施用之前以及在第42天获得。从ecg确定qtc和qrs间隔。可以获得另外的ecg。
[0529]
6.1.5疾病和应答评估
[0530]
疾病评价是基于根据recist v1.1标准(eisenhauer等人,(2009)european journal of cancer[欧洲癌症杂志]45,228-247)的和本文所述(例如,第6.2部分)的评估。对于功效分析,使用recist v1.1应答标准对疾病结局进行分级。疾病和应答评价应根据表29和表30中的时间表进行,并且包括本文所述的评估。所有应答类别(包括进展)都需要在任何新疗法建立前的任何时间间隔至少1周进行的2个连续评估。
[0531]
6.1.6放射影像学疾病评估(ct或mri)
[0532]
只要有可能,应使用相同的ct要求和测试参数。在ct禁忌的情况下并且在与医学监查员讨论之后进行mri。
[0533]
将根据表26中的评估时间表、根据recist v1.1(例如,第6.2部分)和如临床上指示的,在筛选时(即,在ctx130输注之前28天内)、ctx130输注之后6周(在第42天)、以及在ctx130输注后第3(第84天)、6、9、12、15、18和24个月进行基线ct。在当地和在中心评估扫描以确定目标。
[0534]
ct扫描应在没有中间间隙(连续)的情况下以5mm切片获取。如果受试者具有ct iv对比的禁忌症,则可以获得胸部的非对比ct以及腹部和骨盆的对比增强磁共振成像(mri)。
mri应在没有间隙(连续)的情况下以5mm的切片厚度获取。应尽一切努力对于所有成像时间在相同扫描仪上使用相同获取方案对每名受试者进行成像。
[0535]
另外,如果受试者出于研究之外的原因接受氟脱氧葡萄糖(fdg)-正电子发射断层扫描(pet)/ct扫描,则可能的是,可以使用扫描的ct分量来评估疾病应答。
[0536]
只要有可能,用于放射影像学疾病评估的成像模式、机器和扫描参数在研究期间应保持一致。
[0537]
6.1.7肿瘤活检
[0538]
需要受试者在筛选时进行肿瘤活检,或者如果在招募之前3个月内和在最后一次全身性或靶向性疗法之后进行进展后活检,则可以提供归档组织。如果归档组织的体积或数量不足以满足中心实验室要求,则必须在筛选期间进行活检(参见此实例中的披露内容)。
[0539]
还将在第7天(+2天;或一旦临床上可行,立即)和第42天(
±
2天)进行肿瘤活检。如果在受试者处于研究中时发生复发,应尽一切努力获得复发肿瘤的活检并发送至中心实验室。
[0540]
活检应来自根据recist 1.1分析的可测量但非靶的病灶。当获取多个活检时,应努力从类似组织获得它们。肝转移瘤通常不太期望。由于干扰下游测定,骨活检和其他脱钙组织是不可接受的。分析此样品中ctx130以及肿瘤固有性和tme特异性生物标记物的存在,包括dna、rna、蛋白质和代谢物的分析。
[0541]
6.1.8患者报告结局
[0542]
根据表26和表27中的时间表执行四种患者报告结局(pro)调查:欧洲癌症研究和治疗组织(eortc)qlq-c30、euroqol-5维-5水平(eq-5d-5l)和fact-一般(fact-g)问卷。问卷应在进行临床评估之前完成(以受试者最熟悉的语言自行施用)。
[0543]
eortc qlq-c30是被设计用于测量癌症患者的生活质量的问卷。它由5个多项功能量表(身体、角色、社会、情感和认知功能)、3个症状量表(疲劳、恶心、疼痛)和另外的单一症状项(财务影响、食欲不振、腹泻、便秘、睡眠障碍和生活质量)构成。eortc qlq-c30是经验证的并且已经广泛用于癌症患者中(wisloff等人,(1996)br j haematol[英国血液学杂志]92,604-613;wisloff和hjorth,(1997)br j haematol[英国血液学杂志]97,29-37)。它按4分量表评分(1=一点也不,2=一点,3=相当多,4=非常多)。eortc qlq-c30工具还含有2个整体量表,这些整体量表使用了用锚评分的7分量表(1=非常差并且7=优异的)。
[0544]
eq-5d-5l是对健康状况的一般量度,并且含有评估包括以下的5个领域的问卷:运动性、自我护理、日常活动、疼痛/不适和焦虑/抑郁加上视觉模拟量表。
[0545]
fact-g问卷被设计用于评估经受癌症治疗的患者的健康相关生活质量。它分为身体、社交/家庭、情绪和功能领域(cella等人,(1993)j clin oncol[临床肿瘤学杂志]11:570-79)。
[0546]
6.1.9免疫效应细胞相关脑病(ice)评估
[0547]
神经认知评估使用ice评估进行。ice评估工具是cartox-10筛选工具的略微修改版本,该修改版本现在包括对感觉性失语症的测试(neelapu等人,(2018)nat rev clin oncol[自然评论:临床肿瘤学]15,47-62)。ice评估检查认知功能的各个领域:定位、命名、遵循命令、写作和注意力(表29a)。
[0548]
表29a.ice评估。
[0549][0550]
ice评分报告为所有评估的总分数(0-10)。
[0551]
ice评估在筛选时、在第1天施用ctx130之前以及在第2、3、5、8、42和56天进行。如果cns症状持续存在超过第42天,则应继续大约每2天进行一次ice评估,直到症状消退至1级或基线。为了最小化可变性,评估应尽可能由熟悉或受过ice评估工具管理培训的同一研究人员进行。
[0552]
6.1.10.实验室测试
[0553]
将根据如此研究中披露的评估时间表收集和分析实验室样品。利用满足适用当地要求(例如,临床实验室改善修正案)的当地实验室来分析以下表29b中列出的所有测试。
[0554]
表29b:当地实验室测试
[0555][0556]
alt:丙氨酸转氨酶;aptt:活化部分凝血活酶时间;ast:天冬氨酸转氨酶;bun:血尿素氮;cbc:全血计数;crp:c反应性蛋白;crs:细胞因子释放综合征;egfr:估算肾小球滤过率;hiv-1/-2:人免疫缺陷病毒1型或2型;hlh:噬血细胞性淋巴组织细胞增生症;nk:自然杀伤细胞;pt:凝血酶原时间;sgot:血清谷氨酸草酰乙酸转氨酶;sgpt:血清谷氨酸丙酮酸转氨酶;tbnk:t、b和nk细胞
[0557]1可以使用在招募的60天内获得的历史病毒血清学结果来确定资格。
[0558]2仅用于有生育潜力的女性。在筛选时、在ld化学疗法开始的72小时内以及在m1/第28天、m2/第56天和m3/第84天时需要妊娠测试。所有测试将是血清妊娠测试。
[0559]
6.2实体瘤应答评价标准1.1版(recist v1.1)
[0560]
以下内容改编自e.a.eisenhauer等人:new response evaluation criteria in solid tumors:revised recist guideline(version 1.1)[新的实体瘤应答评价:修订的recist指南(1.1版)].european journal of cancer[欧洲癌症杂志]45(2009)228-247。
[0561]
分类基线时的病灶
[0562]
可测量病灶
[0563]
可以在至少一个维度上准确测量的病灶。
[0564]
●
当通过ct或mri(切片厚度5-8mm)评估时,最长直径是切片厚度的两倍并且为至少10mm或更大的病灶。
[0565]
●
当通过胸部x射线评估时,最长直径为至少20mm的病灶。
[0566]
●
当通过卡尺评估时最大直径为10mm或更大的浅表病灶。
[0567]
●
当通过ct评估时,短轴为15mm或更大的恶性淋巴结。
[0568]
注意:对于恶性淋巴结,将最短轴用作直径,对于所有其他可测量病灶,将最长轴用作直径。
[0569]
不可测量疾病
[0570]
不可测量疾病包括太小而不被视为可测量的病灶(包括短轴在10与14.9mm之间的结)和真正不可测量的疾病,诸如胸膜或心包积液、腹水、炎症性乳腺疾病、柔脑膜疾病、皮肤或肺的淋巴管炎受累、无法用卡尺准确测量的临床病灶、通过体格检查鉴定的不可通过可再现成像技术测量的腹部块。
[0571]
●
骨疾病:除了可以通过ct或mri评价并且满足基线时可测量性的定义的软组织组分之外,骨疾病是不可测量的。
[0572]
●
先前局部治疗:除非完成治疗以来取得进展,否则先前辐照病灶(或进行其他局部治疗的病灶)是不可测量的。
[0573]
正常位点
[0574]
●
囊性病灶:单纯性囊肿不应被视为恶性病灶并且也不应将其记录为靶疾病或非靶疾病。如果被认为代表囊性转移瘤的囊性病灶满足以上具体定义,则这些囊性病灶可能是可测量的。如果也存在非囊性病灶,则这些优选为靶病灶。
[0575]
●
正常结:短轴《10mm的结被视为正常的,并且不应作为可测量或不可测量疾病进行记录或跟踪。
[0576]
记录肿瘤评估
[0577]
所有疾病位点必须在基线时进行评估。在研究开始之前,应尽可能接近地进行基线评估。为了进行足够的基线评估,必须在治疗之前28天内进行所有所需的扫描,并且必须适当记录所有疾病。如果基线评估不足,则随后状态通常应是不确定的。
[0578]
靶病灶
[0579]
代表所有受累器官的所有可测量病灶(最多达2个病灶/器官,总计5个病灶)在基线时应鉴定为靶病灶。应基于大小(最长病灶)和对于准确的重复测量的适用性选择靶病灶。记录每个病灶的最长直径,应记录短轴的病理学淋巴结的情况除外。在基线时所有靶病灶的直径(对于非结病灶为最长的,对于结病灶为短轴)的总和是与研究中进行的评估进行比较的基础。
[0580]
●
如果两个靶病灶融合在一起,则使用融合块的测量。如果较大靶病灶分裂,则使用各部分的总和。
[0581]
●
应继续记录对变小的靶病灶的测量。如果靶病灶太小而无法测量,则如果病灶被视为已经消失,应记录0mm;否则,应记录5mm的默认值。
[0582]
注意:当结病灶降低至《10mm(正常)时,仍应记录实际测量。
[0583]
非靶疾病
[0584]
所有不可测量疾病都是非靶标。所有未鉴定为靶病灶的可测量病灶也包括为非靶疾病。不需要测量而是需要评估的表达为不存在、不确定、存在/未增加、增加。一个器官中的多个非靶病灶可以记录为病例报告表上的单一项目(例如,
‘
多个增大骨盆淋巴结’或
‘
多个肝转移瘤’)。
[0585]
每次评价时的客观应答状态。
[0586]
必须使用与基线相同的技术(包括对比度和扫描时间安排的一致施用)评估疾病位点。如果需要进行改变,则该情况必须与放射科医生讨论以确定是否可以代替。如果没有,则随后客观状态是不确定的。
[0587]
靶疾病
[0588]
●
完全应答(cr):除了结疾病之外,所有靶病灶完全消失。所有靶结必须降低至正常大小(短轴《10mm)。所有靶病灶都必须评估。
[0589]
●
部分应答(pr):所有可测量靶病灶的直径的总和低于基线降低大于或等于30%。在靶结的总和中使用短直径,而在所有其他靶病灶的总和中使用最长直径。所有靶病灶都必须评估。
[0590]
●
稳定:不符合cr、pr或进展。所有靶病灶都必须评估。稳定只能在以下少见情况下遵循pr,即总和相比于最低点增加小于20%,但足以不再保持先前记录的30%降低。
[0591]
●
客观进展(pd):可测量靶病灶的直径的总和高于观察到的最小总和(如果在疗法期间未观察到总和的降低,则相比于基线)增加20%,并且最小绝对增加为5mm。
[0592]
●
不确定。尚未记录进展,并且
[0593]
о尚未评估一个或多个可测量靶病灶
[0594]
о或使用的评估方法与基线时使用的方法不一致
[0595]
о或无法准确测量一个或多个靶病灶(例如,看不清,除非由于太小而无法测量)
[0596]
о或一个或多个靶病灶被切除或辐照并且尚未出现或增加。
[0597]
非靶疾病
[0598]
●
cr:所有非靶病灶消失且肿瘤标记物水平正常化。所有淋巴结大小必须是
‘
正常’的(短轴《10mm)。
[0599]
●
非cr/非pd:任何非靶病灶持续存在和/或肿瘤标记物水平高于正常限值。
[0600]
●
pd:预先存在病灶明确进展。一般地说,总体肿瘤负荷必须足够增加以应受疗法中止。在靶疾病的sd或pr的存在下,由于非靶疾病的明确增加而导致的进展应很少见。
[0601]
●
不确定:尚未确定进展并且未评估一个或多个非靶位点,或者评估方法与基线时使用的方法不一致。
[0602]
新病灶
[0603]
任何新的明确恶性病灶的出现都表明pd。如果新病灶不明确(例如由于其大小较小),则继续的评估阐明病因。如果重复评估确认病灶,则应在初始评估日期记录进展。在先前未扫描的区域中鉴定出的病灶被视为新病灶。
[0604]
补充研究
[0605]
●
如果cr确定取决于大小减小但没有完全消失的残留病灶,则建议通过活检或细
针抽吸物对残留病灶进行研究。如果未鉴定出疾病,则客观状态是cr。
[0606]
●
如果进展确定取决于可能由于坏死而导致增加的病灶,则可以通过活检或细针抽吸物对病灶进行研究以阐明状态。
[0607]
主观进展
[0608]
在没有疾病进展的客观证据的情况下需要中止治疗的受试者不应在肿瘤评估crf上报告为pd。即使在中止治疗之后,应尽一切努力记录客观进展(参见表30)。
[0609]
表30.每次评价时的客观应答状态。
[0610][0611]
cr:完全应答;pd:疾病进展;pr:部分应答。
[0612]
对于仅患有非靶疾病的患者的招募,使用表31。
[0613]
表31.对于仅患有非靶疾病的患者每次评价下的客观应答状态。
[0614]
非靶疾病新病灶客观状态cr否cr非cr/非pd否非cr/非pd不确定否不确定明确的进展有或无pd任何有pd
[0615]
7.研究治疗
[0616]
7.1淋巴细胞清除化学疗法
[0617]
所有受试者在ctx130输注之前接受ld化学疗法。
[0618]
ld化学疗法由以下组成:
[0619]
.每日氟达拉滨30mg/m2 iv,共3个剂量,并且
[0620]
·
每日环磷酰胺500mg/m2 iv,共3个剂量。
[0621]
具有肾功能中度损害(肌酐清除率50 70ml/min/1.73m2)的成人受试者应接受减少至少20%的氟达拉滨剂量或根据当地处方信息接受。
[0622]
两种药剂在同一天开始并且施用连续3天。受试者应在研究招募的7天内开始ld化学疗法。在ctx130输注之前,ld化学疗法必须完成至少48小时(但不超过7天)。
[0623]
如果存在以下任何体征或症状,则将延迟ld化学疗法:
[0624]
·
临床状态显著恶化增加与ld化学疗法相关的ae的潜在风险。
[0625]
·
需要补充氧气以维持》91%的饱和度水平。
[0626]
·
新的不受控制的心律失常。
[0627]
·
需要血管升压药支持的低血压。
[0628]
·
活动性感染:对治疗无应答的细菌、真菌或病毒的阳性血培养物,或阴性培养物但强烈怀疑活动性感染。
[0629]
在没有先前血细胞输注的情况下血小板计数≤100,000/mm3、绝对嗜中性粒细胞计数≤1500/mm3且血红蛋白(hgb)≤9g/dl
[0630]
·
≥2级急性神经毒性。
[0631]
淋巴细胞清除的目的是允许输注后显著的car t细胞扩增。由不同剂量的氟达拉滨和环磷酰胺组成的ld化学疗法已成功用于若干自体car t细胞试验。使用ld化学疗法的基本原理是消除调控性t细胞和免疫系统中充当
‘
细胞因子沉没(cytokine sink)’的其他竞争性元件,增强诸如白介素7(il-7)和白介素15(il-15)的细胞因子的可获得性(dummer等人,(2002)j clin invest[临床研究杂志]110,185-192;gattinoni等人,(2005)j exp med[实验医学杂志]202,907-912)。另外,假设当原始t细胞总数降低至低于某个阈值时,幼稚t细胞开始增殖并分化为记忆样t细胞(dummer等人,(2002)j clin invest[临床研究杂志]110,185-192)。此方案中使用的提议ld化学疗法剂量与axicabtagene ciloleucel的登记临床试验中使用的剂量一致。
[0632]
7.2 ctx130的施用
[0633]
ctx130由用crispr-cas9修饰的同种异体t细胞组成,这些同种异体t细胞悬浮于冷冻保存溶液(cryostor cs5)中,并且提供于6-ml输注小瓶中。平剂量的ctx130(基于car
+
t细胞%)作为单一iv输注施用。总剂量可以包含在多个小瓶中。每个小瓶的输注应在解冻后的20分钟内进行。输注应优选地通过中心静脉导管进行。不得使用白细胞过滤器。
[0634]
在ctx130输注开始之前,站点配药室必须确保对于每名治疗的特定受试者可获得2个剂量的托珠单抗(tocilizumab)和紧急设备。在ctx130输注之前大约30至60分钟,应根据站点实践标准向受试者前驱用药口服对乙酰氨基酚(即,扑热息痛或根据站点处方集的其等效物)和iv或口服盐酸苯海拉明(或根据站点处方集的另一种h1-抗组胺药)。不应施用预防性全身性皮质类固醇,因为它们可能干扰ctx130的活性
[0635]
如果出现以下任何体征或症状,则可以延迟ctx130输注:
[0636]
·
新的活动性的不受控制的感染。
[0637]
·
与ld化学疗法开始之前相比的临床状态恶化使受试者处于增加的毒性风险中。
[0638]
·
≥2级急性神经毒性。
[0639]
在完成ld化学疗法后至少48小时(但不超过7天)施用ctx130。
[0640]
7.3 ctx130输注后监测
[0641]
在ctx130输注后,应每30分钟一次监测受试者的重要器官,持续输注之后的2小时或直到任何潜在临床症状的消退。
[0642]
a部分中的受试者在ctx130输注之后的最少7天内住院治疗。在a部分和b部分两者中,受试者必须在ctx130输注之后的最少28天内保持在研究站点附近(即,1小时的转运时间)。急性ctx130相关毒性的管理应仅发生在研究站点。
[0643]
根据评估时间表(表26和表27)监测受试者的细胞因子释放综合征(crs)、肿瘤溶解综合征(tls)、移植物抗宿主病(gvhd)和其他不良事件(ae)的体征。car t细胞相关毒性的管理指南描述于第8部分中。受试者应保持住院治疗,直到ctx130相关非血液学毒性(例如,发热、低血压、缺氧、持续的神经毒性)恢复至1级。如果由医疗管理者认为需要,受试者可以保持住院治疗更长时段。
[0644]
7.4先前和伴随药物
[0645]
7.4.1允许的药物和程序(伴随治疗)
[0646]
在整个研究中给出最佳医疗护理的必要支持措施,包括用于治疗感染的iv抗生素、促红细胞生成素类似物、血液组分等,但本文所述的禁止药物除外。
[0647]
所有并发疗法(包括处方和非处方药物)和医疗程序必须从签署知情同意日期至ctx130输注之后3个月进行记录。从ctx130输注后3个月开始,仅收集以下选择的伴随药物:疫苗接种、抗癌治疗(例如,化学疗法、放射、免疫疗法)、免疫抑制剂(包括类固醇)和任何研究性药剂。
[0648]
7.4.2禁止的/限制的药物和程序
[0649]
在研究的某一时段期间,禁止以下药物:
[0650]
●
在招募之前28天内和在ctx130输注之后3个月
[0651]-活疫苗
[0652]-作为传统中药或处方草药疗法的一部分的草药
[0653]
●
在整个研究中,直到开始新的抗癌疗法
[0654]-任何免疫抑制疗法,除非如本文所述建议治疗crs或免疫效应细胞相关神经毒性综合征(icans)或者如果先前与医学监查员进行了讨论并由其批准的话。
[0655]-在ctx130施用之后应避免药理学剂量的皮质类固醇疗法(》10mg/天的泼尼松或等效剂量的其他皮质类固醇)和其他免疫抑制药物,除非如本文所述医学上指示治疗新毒性或作为与ctx130相关的crs或神经毒性的管理的一部分。
[0656]-在疾病进展之前除ld化学疗法之外的任何抗癌疗法(例如,化学疗法、免疫疗法、靶向性疗法、放射或其他研究性药剂)。根据程度、剂量和一个或多个位点,允许用于症状管理的姑息性放射疗法,该程度、剂量和一个或多个位点应被定义并且报告至医学监查员以便确定。
[0657]
●
在ctx130输注之后的前一个月内禁止
[0658]-粒细胞-巨噬细胞集落刺激因子(gm-csf),这是由于恶化crs症状的可能性。在ctx130输注后,关于粒细胞集落刺激因子(g-csf)的施用应谨慎,并且在施用之前必须咨询医学监查员。
[0659]
●
在ctx130输注之后前28天(dlt评价期)内禁止
[0660]-受试者关于退热药(例如,对乙酰氨基酚、阿司匹林)的自我用药。
[0661]
8.毒性管理
[0662]
8.1一般指南
[0663]
在ld化学疗法之前,应根据免疫功能低下环境中ccrcc患者的机构护理标准开始感染预防(例如,抗病毒剂、抗菌剂、抗真菌剂)。
[0664]
受试者必须在ctx130输注之后密切监测至少28天。关于自体car t细胞疗法已报
道了显著毒性。
[0665]
基于自体cd70 car t细胞疗法的先前经验,提供以下一般建议:
[0666]
●
发热是细胞因子释放综合征(crs)最常见的早期表现;然而,受试者也可能在首次表现时经历虚弱、低血压或意识模糊。
[0667]
●
crs的诊断应基于临床症状而不是实验室值。
[0668]
●
在对crs特异性管理没有应答的受试者中,始终考虑败血症和耐药性感染。应持续评价受试者的耐药性或紧急细菌感染,以及真菌或病毒感染。
[0669]
●
crs、hlh和tls可能在car t细胞输注后同时发生。应持续监测受试者的所有病症的体征和症状,并进行适当管理。
[0670]
●
神经毒性可能发生在crs时、crs消退期间或crs消退后。神经毒性的分级和管理与crs分开进行。
[0671]
●
托珠单抗必须在从订购时间起的2小时内施用。
[0672]
除在自体car t细胞的情况下观察到的毒性之外,密切监测gvhd的体征,这是由于ctx130的同种异体性质。
[0673]
在整个研究过程中连续评估ctx130的安全性概况。
[0674]
8.2毒性特定指南
[0675]
8.2.1 ctx130输注相关反应
[0676]
在自体car t细胞试验中已报道了输注相关反应,包括在施用之后12小时内最常发生的短暂的发热、寒战和/或恶心。将ctx130用cryostor cs5(一种良好确立的含有5%二甲基亚砜(dmso)的冷冻保存培养基)配制。与dmso相关的组胺释放可能导致不良作用,诸如恶心、呕吐、腹泻、面红、发热、寒战、头痛、呼吸困难或皮疹。在大多数严重的情况下,它也可能引起支气管痉挛、过敏反应、血管舒张和低血压以及精神状态变化。
[0677]
如果发生输注反应,根据需要,可以在ctx130输注之后每6小时重复对乙酰氨基酚(扑热息痛)和盐酸苯海拉明(或另一种h1抗组胺药)。
[0678]
如果受试者继续有无法通过对乙酰氨基酚缓解的发热,则可以根据需要开具非类固醇抗炎药(nsaid)。除非在危及生命的紧急情况下,否则不应施用全身性类固醇,因为此干预可能对car t细胞产生有害影响。
[0679]
8.2.2感染预防和发热反应
[0680]
感染预防应根据免疫功能低下环境中ccrcc患者的机构护理标准进行管理。
[0681]
在出现发热反应的情况下,应开始对感染进行评价,并且根据医学指示并由治疗医师确定对受试者进行适当的抗生素、液体和其他支持性护理来管理。如果发热持续存在,应在受试者的整个医疗管理中考虑病毒和真菌感染。如果受试者在ctx130输注后出现败血症或全身性菌血症,应开始适当的培养和医疗管理。另外,在输注ctx130后28天内,在该输注后的任何发热情况下应考虑crs。
[0682]
对于在接受ctx130之后经历神经认知症状的受试者在鉴别诊断中必须考虑病毒性脑炎(例如,人疱疹病毒[hhv]-6脑炎)。任何3级或更高的神经认知毒性都需要腰椎穿刺(lp),并且对于1级和2级事件强烈建议。每当进行腰椎穿刺时,感染性疾病面板将从以下评估(至少)中审查数据:hsv1和2、肠病毒、人副肠孤病毒、vzv、cmv和hhv-6的定量测试。必须在症状发作的48小时内进行腰椎穿刺,并且必须在lp的4天内可获得感染性疾病面板的结
果,以适当地管理受试者。
[0683]
8.2.3肿瘤溶解综合征(tls)
[0684]
接受car t细胞疗法的受试者可能处于增加的tls风险中,该风险发生于以下情况时:肿瘤细胞自发地或响应于疗法将其内含物释放至血流中,从而导致高尿酸血症、高钾血症、高磷血症、低钙血症和血尿素氮升高的特征性发现。这些电解质和代谢紊乱可能进展为临床毒性作用,包括肾功能不全、心律失常、癫痫发作和由于多器官衰竭而导致的死亡(howard等人,2011)。在血液恶性肿瘤和实体瘤中已报道了tls。大多数实体瘤引起较低的tls风险。它在患有以下疾病的患者中最常观察到:血液恶性肿瘤、特别是具有高(》5%)的tls风险的白血病形式(诸如all、急性髓样白血病和cll),和非皮肤t细胞淋巴瘤、特别是成人t细胞白血病/淋巴瘤和dlbcl(coiffier等人,2008)。另外的风险因素包括高于uln的乳酸脱氢酶水平、高肿瘤负荷和具有高复制指数的肿瘤。肾功能受损的患者也处于升高的发展tls风险中。
[0685]
从ld化学疗法开始到ctx130输注后28天,应经由实验室评估和症状密切监测受试者的tls。有增加的tls风险的受试者应在筛选期间和开始ld化学疗法之前接受预防性别嘌呤醇(或非别嘌呤醇替代品,诸如非布索坦)和/或拉布立酶,并增加口服/iv补液。可以在ctx130输注后28天后,或一旦tls风险过去,停止预防。
[0686]
站点应根据其机构护理标准或根据已发布的指南监测和治疗tls(cairo和bishop,(2004)br j haematol[英国血液学杂志],127,3-11)。在临床上指示时应立即开始tls管理,包括施用拉布立酶。
[0687]
8.2.4细胞因子释放综合征(crs)
[0688]
crs是与免疫疗法(包括car t细胞)相关的毒性,该毒性由细胞因子、特别是il-6和il-1的释放引起(norelli等人,(2018)nat med[自然医学]24(6):739-748)。crs归因于响应于靶抗原的car接合的免疫系统过度激活,导致快速t细胞刺激和增殖所致的多细胞因子升高(frey等人,(2014)blood[血液]124,2296);maude等人,(2014)cancer j[癌症杂志]20,119-122)。在临床试验中已观察到crs,而与抗原靶向剂无关,这些抗原靶向剂包括cd19、bcma、cd123和间皮素定向性car t细胞以及抗ny-eso 1和mart 1靶向性tcr修饰的t细胞(frey等人,2014;hattori等人,2019;maude等人,2018;neelapu等人,2017;raje等人,2019;tanyi等人,2017)。crs是关于自体car t细胞疗法报道的主要毒性,也已经在同种异体car t细胞疗法的早期研究中观察到(benjamin等人,2018)。
[0689]
crs的临床表现可以是轻度的,并且限于体温升高,或者可能涉及一个或多个器官系统(例如,心脏、胃肠、呼吸道、皮肤、中枢神经)和多种症状(例如,发高烧、疲劳、厌食、恶心、呕吐、皮疹、低血压、缺氧、头痛、谵妄、混乱)。crs可以是危及生命的。在临床上,crs可能被误认为是全身性感染或在严重的情况下,脓毒性休克。通常,最早体征是体温升高,这应促使立即进行鉴别诊断检查,并及时开始适当的治疗。
[0690]
crs管理的目的是防止危及生命的状态和后遗症,同时保留ctx130抗癌作用的潜力。在血液学恶性肿瘤中,症状通常在自体car t细胞疗法之后1至14天出现。
[0691]
crs应基于临床表现而不是实验室测量值来鉴定和治疗。如果怀疑crs,应根据美国移植与细胞疗法协会(astct;先前称为美国血液和骨髓移植协会,asbmt)共识建议来应用分级(表32a;lee等人,2019);并且应根据表32b中的建议进行管理,这些建议改编自已发
布的指南(lee等人,2014;lee等人,2019)。因此,神经毒性的分级将与icans的astct标准对准。
[0692]
表32a:根据astct共识标准的crs分级(lee等人,2019)
[0693][0694]
astct:美国移植与细胞疗法协会;bipap:双水平气道正压;c:摄氏度;cpap:连续气道正压;crs:细胞因子释放综合征
[0695]
注意:与crs相关的器官毒性可以根据ctcae v5.0进行分级,但它们不影响crs分级。
[0696]1发热定义为体温≥38℃,但不可归因于任何其他原因。在患有crs然后接受退热药或抗细胞因子疗法诸如托珠单抗或类固醇的患者中,不再需要发热用于对随后的crs严重程度进行分级。在这种情况下,crs分级由低血压和/或缺氧驱动。
[0697]2对于高剂量血管升压药的信息,参见表28
[0698]3crs等级由更严重的事件确定:不可归因于任何其他原因的低血压或缺氧。例如,具有39.5℃体温、需要1种血管升压药的低血压和需要低流量鼻插管的缺氧的患者被分类为3级crs。
[0699]4低流量鼻插管定义为以≤6l/分钟递送的氧气。低流量还包括串气氧气递送,有时用于儿科。高流量鼻插管定义为以》6l/分钟递送的氧气
[0700]
表32b.细胞因子释放综合征分级和管理指南。
[0701]
[0702][0703]
crs:细胞因子释放综合征;iv:静脉内;n/a:不适用。
[0704]1参见lee等人,2019。
[0705]2参考托珠单抗处方信息
[0706]
表33.crs管理中的高剂量血管升压药。
[0707][0708]
*所有剂量都需要≥3小时。
[0709]
**vasst试验血管升压药当量方程式:去甲肾上腺素当量剂量=[去甲肾上腺素(μg/min)]+[多巴胺(μg/min)/2]+[肾上腺素(μg/min)]+[去氧肾上腺素(μg/min)/10]。
[0710]
在crs的整个过程中,应为受试者提供支持性护理,包括退热药、iv输液和氧气。应使用连续心电遥测仪和脉搏血氧饱和度仪监测经历≥2级crs的受试者。对于经历3级crs的受试者,考虑进行超声心动图以评估心脏功能。对于3级或4级crs,考虑重症监护支持疗法。可以考虑严重crs病例中潜在感染的可能性,因为表现(例如,发热、低血压、缺氧)是相似的。crs的消退定义为发热(体温≥38℃)、缺氧和低血压的消退(lee等人,(2018)biol blood marrow transplant[血液和骨髓移植生物学]25(4):625-638)。
[0711]
低血压和肾功能不全
[0712]
关于car t细胞疗法已报道了低血压和肾功能不全,并且应根据机构实践指南通过iv施用生理盐水推注对其进行治疗。适当时应考虑透析。
[0713]
8.2.5免疫效应细胞相关神经毒性综合征(icans)
[0714]
在用自体car t细胞疗法治疗的患有b细胞恶性肿瘤的受试者中已经记录神经毒性。因此,在当前试验中将监测受试者的与car t细胞疗法相关的神经毒性的体征和症状。
神经毒性可能在crs时、crs消退期间或crs消退后发生,并且其病理生理学尚不清楚。最近的astct(先前称为asbmt)共识进一步将与icans定义为特征在于在导致内源性或输注t细胞和/或其他免疫效应细胞的激活或接合的任何免疫疗法后涉及cns的病理过程的障碍(lee等人,2019)。神经毒性的病理生理学尚不清楚;然而,据推测,它可能是由于细胞因子释放、car t向csf中的运输以及血脑屏障的渗透性增加的组合(june等人,2018)。
[0715]
体征和症状可以是进展性的,并且可以包括但不限于失语症、意识水平改变、认知技能受损、运动无力、癫痫发作和脑水肿。icans分级(表34)是基于先前在自体car t细胞试验中使用的car t细胞疗法相关毒性(cartox)工作组标准开发的(neelapu等人,(2018)nat rev clin oncol[自然评论:临床肿瘤学]15,47-62)。icans并入了通过使用称为ice(免疫效应细胞相关脑病)评估工具的改良工具进行的意识水平、癫痫发作的存在/不存在、运动发现、脑水肿的存在/不存在的评估以及神经系统领域的总体评估(表29)。
[0716]
任何新发神经毒性的评价应包括如临床上指示的神经系统检查(包括ice评估工具,表29)、脑磁共振成像(mri)和csf检查。对于在神经毒性期间进行的腰椎穿刺,应将csf样品发送至中心实验室以用于细胞因子分析和ctx130的存在。将储存过量的样品(如果可获得)以用于探索性研究。只要有可能,应通过进行腰椎穿刺排除感染性病因(尤其是对于具有3或4级icans的受试者)。如果无法进行脑部mri,则所有受试者都应接受非对比计算机断层扫描(ct)以排除大脑内出血。如临床上指示的,也应考虑脑电图。在严重的情况下,可能需要气管插管以保护气道。
[0717]
尤其是在具有癫痫发作病史的受试者中,在ctx130输注后或神经症状消退后至少28天内可以考虑非镇静、抗癫痫发作预防(例如,左乙拉西坦)(除非抗癫痫药物导致有害症状)。应使用连续心电遥测仪和脉搏血氧饱和度仪监测经历≥2级icans的受试者。对于严重或危及生命的神经系统毒性,应提供重症监护支持疗法。应始终考虑神经科会诊。监测血小板和凝血障碍的体征,并且适当输注血液制品以减少大脑内出血的风险。表34提供了神经毒性分级,并且表35提供了管理指南。
[0718]
表34.icans分级。
[0719][0720]
ctcae:不良事件的通用术语标准;eeg:脑电图;icans:免疫效应细胞相关神经毒性综合征;ice:免疫效应细胞相关脑病(评估工具);icp:颅内压;n/a:不适用。
[0721]
注意:icans等级由不可归因于任何其他原因的最严重事件(ice评分、意识水平、癫痫发作、运动发现、升高的icp/脑水肿)确定。
[0722]1ice评分为0的受试者如果清醒时患有完全性失语症,则可以归类为3级icans,但如果无法唤醒,则ice评分为0的受试者可以归类为4级icans(关于ice评估工具,表24a)。
[0723]2意识水平低下不应归因于其他原因(例如,镇静药物)。
[0724]3与免疫效应疗法相关的震颤和肌阵挛应根据ctcae v5.0进行分级,但不影响icans分级。
[0725]
表35.icans管理指南。
[0726][0727]
crs:细胞因子释放综合征;icans:免疫效应细胞相关神经毒性综合征;iv:静脉内。
[0728]
头痛可能发生在发热环境下或化学疗法之后,是一种非特异性症状。单独的头痛不一定是icans的表现,并且应进行进一步的评价。icans的定义不包括因失调和肌肉损失导致的虚弱或平衡问题。类似地,由于这些受试者中的凝血障碍,可能有或没有相关水肿的颅内出血,并且也被排除在icans的定义之外。这些和其他神经毒性应根据ctcae v5.0捕获。
[0729]
8.2.6噬血细胞性淋巴组织细胞增生症(hlh)
[0730]
已报道了在用自体car t细胞进行治疗之后的hlh(barrett等人,(2014)curr opin pediatr[儿科最新观点],26,43-49;maude等人,(2015)blood[血液],125,4017-4023;porter等人,(2015)sci transl med[科学
·
转化医学],7,303ra139;teachey等人,(2013)blood[血液],121,5154-5157)。hlh是作为在输注car t细胞后炎症应答的结果的临床综合征,其中自激活的t细胞产生细胞因子导致过度巨噬细胞激活。hlh的体征和症状可以包括发热、细胞减少症、肝脾肿大、高胆红素血症引起的肝功能障碍、纤维蛋白原显著减少的凝血障碍、铁蛋白和c反应性蛋白(crp)显著升高。也已观察到神经系统学发现(jordan等人,(2011)blood[血液],118,4041-4052;la ros
é
e,(2015)hematology am soc hematol educ program[血液学:美国血液学会教育计划],190-196。
[0731]
crs和hlh可以具有相似的临床综合征,具有重叠的临床特征和病理生理学。hlh可能在crs或crs消退时出现。如果有无法解释的肝功能测试升高或细胞减少症(伴有或不伴有其他crs证据),则应考虑hlh。crp和铁蛋白的监测可以有助于诊断和定义临床进程。在可行的情况下,应遵循常规实践将过量的骨髓样品送至中心实验室。
[0732]
如果怀疑hlh:
[0733]
●
经常监测凝血参数,包括纤维蛋白原。这些测试可以比评估时间表中更频繁地进行,并且应基于实验室发现来驱动频率。
[0734]
●
纤维蛋白原应保持≥100mg/dl以减少出血的风险。
[0735]
●
凝血障碍应用血液制品校正。
[0736]
●
鉴于与crs重叠,根据3级crs进行管理,其中适当的监测强度根据表32b中的crs治疗指南。对于hlh的另外治疗遵循机构指南。
[0737]
8.2.7血细胞减少症
[0738]
在用自体car t细胞产品治疗的受试者中已报道了3级嗜中性粒细胞减少症和血小板减少症,有时持续car t细胞输注之后超过28天(kymriah us prescribing information[美国处方信息][uspi],2017;raje等人,(2019)n engl j med[新英格兰医学杂志]380,1726-37;yescarta uspi,2017)。因此,应监测接受ctx130的受试者的此类毒性,并且对这些受试者适当地支持。监测血小板和凝血障碍的体征,并且适当输注血液制品以减少出血的风险。针对患有延长的嗜中性粒细胞减少症的任何受试者应考虑抗微生物和抗真菌预防。
[0739]
由于cd70在激活的t和b淋巴细胞上的瞬时表达,可能发生机会性感染诸如病毒再激活,在临床症状产生时应考虑该机会性感染。
[0740]
在剂量递增期间,在ctx130输注后4级嗜中性粒细胞减少症的情况下,可以考虑g-csf。在队列扩展期间,可以根据医疗保健从业人员的判断谨慎施用g-csf。
[0741]
8.2.8移植物抗宿主病(gvhd)
[0742]
在同种异体hsct的环境中看到gvhd,并且是免疫活性供体t细胞(移植物)识别作为外源物的受体(宿主)的结果。随后的免疫应答激活供体t细胞以攻击受体以消除携带外源抗原的细胞。gvhd基于同种异体hsct的时间和临床表现分为急性、慢性和重叠综合征。急性gvhd的体征可以包括斑丘疹;由于小胆管损伤导致胆汁淤积导致的高胆红素血症伴黄疸;恶心、呕吐和厌食;以及水样或血性腹泻和痉挛性腹痛(zeiser和blazar,(2017)n engl j med[新英格兰医学杂志],377,2167-2179)。
[0743]
为了支持提议的临床研究,在以下述2个iv剂量治疗的免疫功能低下的小鼠中进行了一项符合非临床良好实验室实践(glp)的gvhd和耐受性研究:4x107个ctx130细胞/小鼠的高剂量(大约1.6x109个细胞/kg)和2x107个细胞/小鼠(大约0.8x109个细胞/kg)的低剂量。当针对体重归一化时,两个剂量水平均超过所提议的最高临床剂量超过10倍。用ctx130治疗的小鼠在12周研究过程期间未出现致命性gvhd。在验尸时,在一些动物中在肠系淋巴结和胸腺中观察到单核细胞浸润。在一些动物的肺中观察到极小至轻度血管周炎症。这些发现与轻度gvhd一致,但在这些小鼠中未表现临床症状。
[0744]
此外,由于car在trac基因座插入的特异性,t细胞极不可能同时是car+和tcr+。在制造过程中,通过抗tcr抗体柱上的免疫亲和色谱法去除剩余的tcr+细胞,以在最终产品中获得≤0.4%的tcr+细胞。对所有剂量水平施加的剂量限制为1x105个tcr+细胞/kg。此限制是基于已发表的关于在使用半相合供体的sct期间能够引起严重gvhd的同种异体细胞数量的报告(bertaina等人,(2014)blood[血液],124,822-826)。通过此特异性编辑、纯化和严格的产品放行标准,ctx130后gvhd的风险应是很低的,但真正的发病率未知。然而,鉴于car t细胞扩增是抗原驱动的,并且可能只发生在tcr-细胞中,tcr+细胞的数量将不太可能明显增加至高于输注的数量。
[0745]
gvhd的诊断和分级应基于已发布的标准(harris等人,(2016)biol blood marrow transplant[血液和骨髓移植生物学],22,4-10),如表36中所概述。
[0746]
表36.急性gvhd分级标准。
[0747][0748][0749]
bsa:体表面积;gi:胃肠;gvhd:移植物抗宿主病。
[0750]
总体gvhd等级可以基于最严重的靶器官受累情况确定。
[0751]
●
0级:没有任何器官的1-4期。
[0752]
●
1级:无肝脏、上gi或下gi受累的1-2期皮肤。
[0753]
●
2级:3期皮疹和/或1期肝脏和/或1期上gi和/或1期下gi。
[0754]
●
3级:2-3期肝脏和/或2-3期下gi,与0-3期皮肤和/或0-1期上gi。
[0755]
●
4级:4期皮肤、肝脏或下gi受累,具有0-1期上gi。
[0756]
应排除可能模仿gvhd的潜在混杂因素,诸如感染和对药物的反应。应在治疗开始前或治疗开始后不久进行皮肤和/或gi活检以进行确认。在肝脏受累的情况下,如果临床上可行,应尝试肝活检。
[0757]
表37中概述了管理急性gvhd的建议。为了在试验结束时实现受试者间的可比性,可以遵循这些建议,除非在特定的临床情况下遵循这些建议可能会使受试者处于危险之中。
[0758]
表37.急性gvhd管理
[0759][0760]
gi:胃肠;iv:静脉内。
[0761]
对于患有更严重gvhd的受试者,应尽早决定开始二线疗法。例如,可以在gvhd进展性表现3天后、持续性3级gvhd 1周后或持续性2级gvhd2周后适用二线疗法。在无法耐受高剂量糖皮质激素治疗的受试者中,可能更早适用二线全身性疗法(martin等人,(2012)biol blood marrow transplant[血液和骨髓移植生物学],18,1150-1163)。二级疗法的选择和何时开始可以基于临床判断和当地实践。
[0762]
难治性急性gvhd或慢性gvhd的管理可以根据机构指南进行。在使用免疫抑制剂(包括类固醇)治疗受试者时,应根据当地指南制定抗感染预防措施。
[0763]
8.2.9.中靶脱肿瘤毒性
[0764]
ctx130针对激活的t和b淋巴细胞、树突状细胞的活性
[0765]
激活的t和b淋巴细胞瞬时表达cd70,并且树突状细胞以及胸腺上皮细胞在一定程度上表达cd70。因此,这些细胞可能变为激活的ctx130的靶标。本文披露了感染和细胞减少症的管理。
[0766]
ctx130针对成骨细胞的活性
[0767]
在人原代成骨细胞的细胞培养中的非临床研究中检测到ctx130的活性。因此,将经由钙水平以及被视为骨形成评估中最有用的标记物的2种成骨细胞特异性标记物即i型前胶原氨基末端前肽(pinp)和骨特异性碱性磷酸酶(bsap)来监测骨周转(fink等人,2000)。用于评估血清中两种标记物的标准化测定是可获得的。这些肽标记物的浓度反映了成骨细胞的活性和新骨胶原蛋白的形成。
[0768]
将如本文披露的在筛选、基线、研究的第7、15、22和28天以及第3、6和12个月时通过中心实验室评估来测量pinp和bsap。由于昼夜节律对骨周转的强烈影响,将在指定的收集日的同一时间(
±
2小时)收集样品。
[0769]
ctx130针对肾小管样上皮细胞的活性
[0770]
在ctx130在原代人肾脏上皮中的非临床研究中检测到ctx130针对肾小管样上皮细胞的活性。因此,应通过以下方式监测受试者的急性小管损伤:监测在48小时时段内至少0.3mg/dl(26.5μmol/l)的血清肌酐增加和/或≥1.5倍的先前7天内的基线值。将如本文披露的在ctx130输注后的前7天内每日、在治疗的第8至15天之间每隔一天、以及然后每周两次直到第28天,评估血清肌酐。如果怀疑急性肾小管损伤,应进行另外的测试,包括尿沉渣分析和尿中钠的排泄分数,并且应启动肾病学家的会诊。
[0771]
8.2.10.不受控制的t细胞增殖
[0772]
在识别出靶肿瘤抗原时,已观察到关于car t细胞的体内激活和扩增(grupp等人nejm[新英格兰医学杂志]2013)。在外周血、骨髓、脑脊液、腹水和其他隔室中已检测到自体car t细胞(badbaran等人cancer[癌症]2020)。如果受试者出现不受控制的t细胞增殖的体征,则应将来自临床研究的样品提交至中心实验室进行单倍型分型,以确定t细胞的起源。
[0773]
9.安全性的评估
[0774]
9.1不良事件参数的定义
[0775]
9.1.1不良事件
[0776]
国际协调会议(ich)良好临床实践(gcp)指南e6(r2)将ae定义为:
[0777]“在施用药物产品的患者或临床研究受试者中的任何不利医学发生,但该不利医学发生不一定与此治疗有因果关系。因此,ae可以是与医药(研究性)产品的使用暂时相关的任何不利和意想不到的体征(例如,包括异常实验室发现)、症状或疾病,无论是否认为与医药(研究性)产品有关。”[0778]
定义ae的另外标准还包括受试者的预先存在病症的性质、严重程度、频率或持续时间的任何临床显著恶化。不良事件可以发生在治疗之前、期间或之后,并且可以是治疗突发性的(即,在ctx130输注后发生)或非治疗突发性的。非治疗突发性ae是在获得书面知情同意之后但在受试者已接受ctx130之前发生的任何新的体征或症状、疾病或其他不利医学事件。
[0779]
针对未相对于基线恶化的记录的预先存在病症的可选择或预先计划的治疗或医学/外科程序(在受试者被招募至研究中之前安排)不被视为ae(严重或非严重)。然而,在预先安排的选择性程序或定期安排的治疗期间发生的不利医学事件应记录为ae或sae。由于研究治疗输注或根据机构政策的预防措施而进行的或如此研究方案中定义的住院治疗不被视为ae。此外,如果受试者在ctx130输注后有计划的住院治疗,则不应将仅为了观察而进行的该住院治疗的延长作为sae,除非它与满足其他sae标准的医学意义事件相关。
[0780]
9.1.1.1异常实验室发现
[0781]
异常实验室发现被视为有临床意义,并且应报告为不良事件。只要有可能,应将这些报告为临床诊断而不是异常值本身。没有临床意义的异常实验室结果不需记录为ae。
[0782]
9.1.1.2疾病进展
[0783]
疾病进展是结局并且不应报告为ae。如果受试者需要住院治疗或使ae符合严重的
干预,则应将症状报告为sae(例如,由于局部进展导致的脾脏破裂)。
[0784]
9.1.2严重不良事件
[0785]
严重不良事件(sae)是任何不利医学发生,其在任何剂量下:
[0786]
●
导致死亡。
[0787]
●
是危及生命的。
[0788]
此定义意味着受试者在事件发生时有立即死于该事件的风险。它不包括如果以更严重形式发生可能引起了死亡的事件。
[0789]
●
需要入院的住院治疗或现有住院治疗的延长。
[0790]
一般来说,住院治疗表明受试者已经处于医院或紧急病房中(通常涉及至少一次过夜停留)以进行在门诊环境中将不适当的观察和/或治疗。
[0791]
●
导致持续性或显著的失能/无能。
[0792]
●
导致先天性异常/出生缺陷。
[0793]
●
其他重大/显著的医学事件
[0794]
在决定在其他情形下迅速报告是否适当时,应采用医学和科学判断,这些其他情形诸如可能没有立即危及生命或导致死亡或住院治疗但可能危害受试者,或可能需要干预以防止以上定义中列出的其他结局之一的重大医学事件。
[0795]
9.1.3特别关注的不良事件
[0796]
aesi(严重或非严重)是特定于产品或项目的科学和医学问题之一,对于其持续监测和快速沟通可能是适当的。
[0797]
基于自体car t细胞的被视为在相同药理类别中的报告临床经验,以下被鉴定为特别关注的不良事件(aesi):
[0798]
1.ctx130输注相关反应。
[0799]
2.≥3级感染和侵染
[0800]
3.肿瘤溶解综合征(tls)。
[0801]
4.细胞因子释放综合征(crs)。
[0802]
5.免疫效应细胞相关神经毒性综合征(icans)。
[0803]
6.噬血细胞性淋巴组织细胞增生症(hlh)。
[0804]
7.移植物抗宿主病(gvhd)。
[0805]
8.不受控制的t细胞增殖
[0806]
除上面列出的aesi之外,在ctx130输注之后任何时间,应报告研究人员确定可能与ctx130相关或与其相关的任何新的自身免疫性障碍。
[0807]
9.2不良事件的评估
[0808]
9.2.1因果性的评估
[0809]
应评估每种ae与ctx130、ld化学疗法以及任何方案授权的研究程序(全部单独评估)之间的关系。当进行它们的因果性评估时,应考虑以下:(1)事件的时间安排与治疗或程序的施用之间的时间关联,(2)可信的生物学机制,以及(3)事件的其他潜在原因(例如,伴随疗法、潜在疾病)。
[0810]
关系的评估是基于以下定义进行的:
[0811]
●
相关的:在研究治疗或程序与ae之间存在明显的因果关系。
[0812]
●
可能相关的:有一些证据表明研究治疗或程序与ae之间的因果关系,但也存在替代性潜在原因。
[0813]
●
不相关的:没有证据表明研究治疗或程序与ae之间的因果关系。
[0814]
如果确定ae/sae与ctx130之间的关系是“可能的”,则出于监管报告的目的,该事件被视为与ctx130相关。
[0815]
如果满足以下任何测试,则将事件视为与ctx130的使用“不相关”:
[0816]
●
ctx130的施用与事件的发作之间的不合理时间关系(例如,事件在ctx130的施用之前发生,或在其之后太长时间发生以致于ae不被视为产品相关的)。
[0817]
●
ip与事件之间的因果关系在生物学上是不可信的
[0818]
●
存在对该事件的明显更可能的替代性解释(例如,对伴随药物和/或典型疾病相关事件的典型不良反应)。
[0819]
单独的ae/sae报告如果未满足“不相关”标准,则被视为与ctx130的使用“相关”。如果评估sae与任何研究干预不相关,则必须在病例报告表(crf)中提供替代性病因。
[0820]
9.2.1.1与方案程序和/或其他病因的关系
[0821]
如果确定sae与用ctx130或ld化学疗法的治疗不相关,则可以提供对sae与方案程序之间关系的评估。sae报告表上的替代性病因应基于以下定义的标准提供:
[0822]
·
方案相关程序/干预:事件作为研究期间需要的程序或干预(例如,收集血液、对现有药物的洗除)的结果而发生,对于该事件,受试者的病历卡中不存在替代性病因。这适用于非治疗突发性sae(即,在施用ctx130之前发生的sae)以及治疗突发性sae。
[0823]
9.2.2严重程度的评估
[0824]
除了crs、ican和gvhd(它们分别根据表32、表34和表36中的标准进行分级)以外,根据nci ctcae 5.0的评分对严重程度进行分级。应使用如表38中所述的1至5级的严重程度类别,基于医学判断进行对ctcae等级或方案指定标准不可用的事件的严重程度的确定(并记录在crf中)。
[0825]
9.2.3不良事件结局
[0826]
ae或sae的结局如下分类和报告:
[0827]
●
致命的。
[0828]
●
未恢复/未消退。
[0829]
●
恢复/消退。
[0830]
●
恢复/消退,具有后遗症。
[0831]
●
恢复中/消退中。
[0832]
●
未知
[0833]
在记录和报告死亡和致命/5级事件时,需注意死亡是受试者结局,而致命的是事件结局并且应描述作为死亡原因的sae。跟踪由于ae而从研究中撤回的受试者,直到确定结局。
[0834]
表38:不良事件严重程度
[0835][0836]
adl:日常生活活动;ae:不良事件。
[0837]1工具性adl是指做饭、购买食品杂货或衣物、使用电话、理财等。
[0838]2自理性adl是指洗澡、穿脱衣、自己吃东西、使用盥洗室、服药等,但未卧床不起
[0839]
还参见表32a、32b、34和36,以及本文披露的针对例如crs、icans和gvhd的不良事件分级标准。
[0840]
10.停止规则和研究终止
[0841]
10.1试验的停止规则
[0842]
如果发生以下事件中的1种或多种,则可以暂停研究:
[0843]
●
不易管理、意料不到且与ld化学疗法不相关的可归因于ctx130的危及生命的(4级)毒性。
[0844]
●
在输注后的30天内与ctx130相关的死亡。
[0845]
●
在至少15名受试者已接受过ctx130之后,在》20%受试者中发生类固醇难治性的》2级gvhd。
[0846]
●
在已招募至少15名受试者之后,确定到在》35%受试者中发生的意料不到、临床上显著或不可接受的风险(例如,在7天内未消退至≤2级的3级神经毒性)。
[0847]
●
新的恶性肿瘤(不同于先前治疗的恶性肿瘤的再发/进展)。
[0848]
b部分(队列扩展)是使用最佳西蒙2阶段设计进行的单臂研究。在第一阶段中,22名受试者将用ctx130治疗。如果≥7名受试者在ctx130输注后,实现客观应答(cr或pr),则可以决定扩展招募以在第二阶段中包括另外的48名治疗受试者(总共70名)。如果在第一阶段之后作出结束试验的决定,则可以暂停招募,审查所有可用数据,并且根据需要通知卫生当局。
[0849]
如果招募是永久性暂停的,则已经招募在研究中的受试者可以不进行ld化学疗法和ctx130输注。已经接受过用ctx130治疗的受试者保留在研究中,并且根据研究方案继续跟踪或者需要转变至长期安全性随访研究。10.2单独受试者的停止规则
[0850]
单独受试者的停止规则如下:
[0851]
●
在继续研究相关治疗或随访期间将使受试者处于危险之中的任何医学病症。
[0852]
●
如果发现受试者尚未满足资格标准或者受试者在开始ld化学疗法之前具有严重方案偏离。
[0853]
10.3研究结束定义
[0854]
研究结束定义为最后一名受试者完成第60个月访视(最后一次方案定义评估),或被视为失访、撤回同意或死亡的时间。
[0855]
10.4研究终止
[0856]
可以由于安全性问题、无法满足预期招募目的和/或行政原因而在任何时间中止此研究。如果此研究提早终止,则需要已接受过ctx130的受试者在ctx130输注后参加长达15年的单独长期随访研究。
[0857]
11.统计方法
[0858]
11.1一般方法
[0859]
针对处置、人口统计学和基线特征、安全性和临床抗肿瘤活性汇总研究数据。
[0860]
分类数据按频率分布(受试者的数量和百分比)汇总,并且连续数据将按描述性统计学(平均值、标准偏差[sd]、中值、最小值和最大值)汇总。
[0861]
除非另有说明,否则将在剂量递增期期间治疗的受试者与在扩展期期间接受相同剂量的ctx130的受试者合并。所有汇总、列表、图和分析将按剂量水平进行。
[0862]
主要分析时间定义为b部分中的71名受试者完成了3个月的疾病应答评估,或者失访、从研究中撤回或死亡(以先发生者为准)的时间(在全分析集[fas]中定义)。将基于主要分析时间分析研究数据并且将其报告于主要临床研究报告(csr)中。将报告从主要分析时间到研究结束累积的另外数据。统计分析的完全细节将在统计分析计划(sap)中详细说明。
[0863]
11.2研究目标和假设
[0864]
a部分的主要目标是评估ctx130的递增剂量在患有不可切除的或转移性ccrcc的受试者中的安全性。
[0865]
b部分的主要目标是评估ctx130在患有不可切除的或转移性ccrcc的受试者中的功效,该功效如根据recist v1.1通过orr测量的。
[0866]
11.3研究终点
[0867]
11.3.1主要终点
[0868]
a部分(剂量递增):剂量限制性毒性(dlt)的发生率、和rpbd的定义。
[0869]
b部分(队列扩展):根据实体瘤应答评价标准(recist 1.1)定义为完全应答(cr)+部分应答(pr)的客观应答率(orr)。
[0870]
11.2.2a部分和b部分次要终点
[0871]
11.2.2.1根据recist 1.1应答标准的功效
[0872]
·
orr:如由研究人员评估的,根据recist v1.1已实现cr或pr的最佳总体应答的受试者比例。
[0873]
·
最佳总体应答:cr、pr、sd、疾病进展(pd)或不可评价的(ne)。
[0874]
·
至应答时间(ttr):ctx130输注日期至首次放射学记录的应答(pr/cr)之间的时间。
[0875]
·
应答持续时间(dor):pr/cr的首次客观应答与疾病进展或因任何原因死亡日期之间的时间。这将仅对于具有过pr/cr事件的受试者报告。
[0876]
·
无进展存活期(pfs):ctx130输注日期与疾病进展或因任何原因死亡日期之间的差。将对在数据截止日期没有进展且仍在研究中的受试者在其最后recist评估日期进行审查。
[0877]
·
总存活期(os):ctx130输注日期与因任何原因的死亡之间的时间。将对在数据截止日期活着的受试者在受试者已知活着的最后日期进行审查。
[0878]
11.2.2.2安全性
[0879]
ae的发生率和严重程度以及临床上显著的实验室异常根据ctcae 5.0版进行汇总和报告,除外的是crs(其根据lee标准(lee等人,(2014)blood[血液]124,188-195)进行分级)、神经毒性(其根据icans(lee等人,(2018)biol blood marrow transplant[血液和骨髓移植生物学]25(4):625-638)和ctcae v5.0进行分级)和gvhd(其根据magic标准(harris等人,(2016)biol blood marrow transplant[血液和骨髓移植生物学],22,4-10)进行分级)。
[0880]
11.2.2.3药代动力学
[0881]
使用测量car构建体拷贝/μg dna的pcr测定评估ctx130随时间在血液和其他组织中的水平。还可以进行使用流式细胞术确认细胞表面上car蛋白的存在的互补分析。
[0882]
此类分析可用于确认ctx130在血液中的存在,并且进一步表征其他细胞免疫表型。
[0883]
11.2.3a部分和b部分探索性终点
[0884]
●
组织中ctx130的水平。可以在根据方案特定采样收集的这些样品中的任一个中评价ctx130在肿瘤活检或csf中的扩增和持久性。
[0885]
●
抗ctx130抗体的发生率。
[0886]
●
淋巴细胞群体的免疫谱分析。
[0887]
●
在施用ctx130产品后的细胞因子谱。
[0888]
●
抗细胞因子疗法对治疗crs、ctx130增殖和临床应答的有效性的影响。
[0889]
●
后续(在ctx130后)抗癌疗法的发生率和类型。
[0890]
●
至cr时间:ctx130输注日期至记录的cr之间的时间。
[0891]
●
至疾病进展时间,定义为ctx130输注日期至疾病进展的第一证据之间的时间。
[0892]
●
无第一或第二后续疗法存活期:ctx130输注日期与第一后续疗法或由任何原因死亡日期之间的或pfs。
[0893]
●
pro相对于基线的变化,如通过eortc qlq-c30、eq-5d-5l、fksi-19和fact-g问卷测量的
[0894]
●
认知结局相对于基线的变化,如通过ice评估的
[0895]
●
其他基因组、蛋白质、代谢或药效动力学终点。
[0896]
11.3分析集
[0897]
将评价以下分析集并将其用于数据的呈现:
[0898]
a部分(剂量递增)
[0899]
●
dlt可评价集将包括接受ctx130且完成了初始输注后的dlt评价期或者在经历dlt之后更早中止的所有受试者。
[0900]
a部分+b部分
[0901]
●
安全性分析集(sas):被招募且接受至少1个剂量的研究治疗的所有受试者。将受试者根据接受的治疗进行分类,其中接受的治疗在其接受至少一次时定义为分配的剂量水平/时间表,或在从未接受分配的治疗时定义为接受的第一剂量水平/时间表。sas将是用于安全性数据的分析的主集。
[0902]
●
全分析集(fas):被招募且接受ctx130输注并且具有至少1次基线和1次基线后扫描评估的所有受试者。fas将是用于临床活性评估的主要分析集。
[0903]
11.4样本量和功效考虑
[0904]
a部分(剂量递增)样本量是大约6至18名可评价受试者,这取决于评价的剂量水平数和dlt的发生。
[0905]
b部分(队列扩展)将是使用最佳西蒙2阶段设计进行的单臂研究。在第一阶段中,至少23名受试者将被招募并且用ctx130治疗。如果≥5名受试者实现客观应答(cr或pr),则可以决定扩展研究以在第二阶段中包括另外的48名治疗受试者(总共71名);否则,将暂停招募。71名受试者的样本量将具有80%功效(α=0.05,双侧检验)来拒绝orr等于15%的历史应答率的零假设(barata等人,2018;nadal等人,2016;powles等人,2018),从而假定真orr是30%。
[0906]
11.5统计分析
[0907]
a部分
[0908]
将列出剂量限制性毒性,并且按监管活动医学词典(meddra)主要系统器官分类(soc)和/或优选术语(pt)、基于ctcae v5.0的最差等级、ae类型和剂量水平汇总其发生率。dlt可评价集将是用于评价a部分中的dlt的主要分析集。
[0909]
b部分
[0910]
对于在a部分和b部分两者中已接受过rpbd下的ctx130的受试者将评价orr的主要终点。fas将是用于功效的主要分析集。将汇总客观应答率,并且将计算95%置信区间(ci)。
[0911]
也将基于疾病评估的研究人员审查进行orr的敏感性分析。
[0912]
一般功效分析
[0913]
在适当的情况下,将使用kaplan-meier方法分析至事件时间终点。将计算基于kaplan-meier方法的中值和其他分位数(包括第25百分位和第75百分位)的估计值,并且将提供相关的95%ci。将基于kaplan-meier方法产生在特定时间点的存活率。要分析的至事件时间终点包括:
[0914]
●
应答持续时间:仅在应答者中,dor将被计算为首次发生应答日期至记录的疾病进展或死亡日期(以先发生者为准)。将对没有疾病进展或死亡的受试者在最后可评价应答评估日期进行审查。
[0915]
●
无进展存活期:定义为从研究治疗的最早日期至记录的客观肿瘤进展或死亡的持续时间。将对没有疾病进展或死亡的受试者在最后可评价应答评估日期进行审查。
[0916]
●
总存活期:定义为ctx130输注日期与因任何原因的死亡之间的时间。将对在数据截止日期活着的受试者在受试者已知活着的最后日期进行审查。
[0917]
一般安全性分析
[0918]
sas将用于安全性数据的所有列表和汇总。安全性数据将按剂量水平汇总。
[0919]
不良事件
[0920]
ae将根据ctcae v5.0进行分级,除外的是crs(astct标准)、神经毒性(icans和ctcae v5.0)和gvhd(magic标准)。治疗突发性不良事件(teae)的发生率将根据meddra按soc和/或pt、严重程度(基于ctcae v5.0)和与研究治疗的相关性汇总。将产生所有teae的汇总。
[0921]
将列出所有ae(无论开始和结束时间如何),并且在列表中将呈现指示teae与否的标志。
[0922]
实验室异常
[0923]
●
对于由ctcae v5.0涵盖的实验室测试,将相应地对实验室数据进行分级。对于由ctcae涵盖的实验室测试,将对于所有未分级为1或更高级的非缺失值分配0级。
[0924]
●
将分别针对血液学和化学实验室测试产生以下汇总:
[0925]-随着时间对临床实验室参数的实际值(和/或相对于基线的变化)或频率的描述性统计
[0926]-最差治疗中ctcae等级的表
[0927]-所有实验室数据的列表,其中值被标记以显示相应的ctcae等级和相对于实验室正常范围的分类
[0928]
除以上提及的表和列表之外,还可以在sap中详细说明关键安全性参数的图形展示,诸如实验室测试随时间的实际值或变化的散布图、或盒形图。
[0929]
11.5期中分析
[0930]
11.5.1功效期中分析
[0931]
进行一项无效性期中分析,并且由dsmb审查。期中分析不迟于22名受试者已进行治疗并具有3个月的可评价应答数据的时间进行。如果对ctx130的真应答率与护理标准没有差异,则在此分析处因无效性停止的可能性是70%。
[0932]
11.6.3生物标记物分析
[0933]
汇总了抗ctx130抗体的发生率、血液中ctx130 car+t细胞的水平和血清中细胞因子的水平。
[0934]
将收集肿瘤、血液、可能的骨髓和抽吸物(仅在患有治疗突发性hlh的受试者中)以及可能的csf样品(仅在患有治疗突发性神经毒性的受试者中),以鉴定可以指示ctx130的临床应答、抗性、安全性、疾病、药效动力学活性或作用机理的基因组学、代谢和/或蛋白质组学生物标记物。
[0935]
ctx130水平的分析(药代动力学分析)
[0936]
将在根据表26和表27中所述的时间表收集的血液样品上进行转导的cd70定向性car
+
t细胞的水平的分析。在经历crs的体征或症状的受试者中,应在计划收集之间每48小时抽取一次另外的血液样品。将使用测量car构建体拷贝的聚合酶链反应(pcr)测定描述ctx130在血液中的扩增和持久性时程。还可以进行使用更灵敏基因组技术或流式细胞术确认细胞表面上car蛋白的存在的互补分析。
[0937]
用于分析ctx130水平的样品应从在ctx130输注后进行的血液、csf(仅在患有治疗突发性神经毒性的受试者中)、骨髓(仅在患有治疗突发性hlh的受试者中)或肿瘤活检中发送至中心实验室。可以在根据方案指定采样收集的这些样品中的任一个中评价ctx130在血液、csf、骨髓或肿瘤组织中的扩增和持久性。
[0938]
细胞因子
[0939]
细胞因子(包括但不限于crp、il-1β、sil-1rα、il-2、sil-2rα、il-4、il-6、il-8、il-10、il-12p70、il-13、il-15、il-17a、干扰素γ、肿瘤坏死因子α和gm-csf)将在中心实验室中分析。如最近的综述(wang等人,2018)中汇总的,在多项先前car t细胞临床研究中进行的相关性分析已将这些细胞因子和其他细胞因子鉴定为严重crs的潜在预测标记物。将在如表26和表27中所述的指定时间收集用于细胞因子的血液。在经历crs的体征或症状的
受试者中,初始样品收集发生在症状开始时,并且应每12小时(
±
5小时)抽取一次另外的样品,直到消退。
[0940]
抗ctx130抗体
[0941]
car构建体由人源化scfv构成。在整个研究中收集血液以评估在此研究中提供的披露内容后的潜在免疫原性。
[0942]
探索性研究生物标记物
[0943]
可以进行探索性研究以鉴定可以指示或预测治疗的临床应答、抗性、安全性、疾病、药效动力学活性和/或作用机理的分子(基因组学、代谢和/或蛋白质组学)生物标记物和免疫表型。将根据表26和表27收集样品。对于有关用于支持探索性研究的血液、肿瘤、骨髓和csf样品的收集的说明,参考实验室手册。
[0944]
另外生物标记物的研究可以包括对血细胞和血液制品、肿瘤组织和其他受试者衍生的组织的评估。这些评估可以评价从这些组织衍生的dna、rna、蛋白质和其他生物分子。此类评价告知对与患者疾病相关的因子、对ctx130的应答以及ip的作用机理的理解。
[0945]
结果
[0946]
迄今为止,参与此研究的所有受试者都在14天内完成了阶段1(资格筛选)。在满足资格标准之后,三名受试者在完成阶段1的24小时内开始淋巴细胞清除疗法。所有有资格受试者完成了筛选期(阶段1)并且在不到8天内接受ld化学疗法,其中两名受试者完成筛选并在72小时内开始ld chemo剂量。接受ld化学疗法的所有受试者在完成ld化学疗法后的2-3天内已进展至接受dl1剂量的ctx130。
[0947]
迄今为止,此研究中的治疗受试者都没有表现出任何dlt。类似地,在使用ctx130治疗患有t或b细胞恶性肿瘤的受试者的平行研究中未观察到dtl。参见例如,2019年11月13日提交的美国专利申请号62/934,945和2020年6月4日提交的美国专利申请号63/034,510。此外,同种异体car-t细胞疗法在治疗的人受试者中表现出所希望的药代动力学特征,包括car-t细胞扩增和输注之后的持久性。早在dl1时已观察到显著的car t细胞分布、扩增和持久性。迄今为止,在一名评价的rcc受试者中已观察到外周血中ctx130相比于t0的多达87倍扩增,并且在输注后至少28天,可以在dl1受试者中检测到ctx130细胞的持久性。在相应的t或b细胞恶性肿瘤研究中观察到car t细胞分布、扩增和持久性的类似模式,其中观察到ctx130的20倍扩增,并且在输注后长达14天检测到ctx130细胞。
[0948]
此研究中的有资格受试者具有透明细胞rcc,一些伴有少数部分的肉样瘤分化。下面汇总了从前两名rcc受试者获得的结果。
[0949]
●
根据ctx130输注后42天时的ct扫描,接受dl1剂量的第一名受试者经历其肿瘤病灶的rcc稳定,而没有任何新的病灶或现有病灶进展。另外,在相同ct扫描中,溶解性骨转移显示出再钙化的明显迹象。受试者在12周时保持为疾病稳定。
[0950]
●
根据recist 1.1,接受dl1剂量的第二名受试者在42天时至少经历部分应答,其中一个胸膜下靶病灶和三个胸腔中的非靶病灶急剧减少。
[0951]
其他实施例
[0952]
在本说明书中披露的所有特征能以任意组合来组合。在本说明书中披露的每个特征可以由用于相同、等效或类似目的替代性特征替换。因此,除非另有明确规定,否则所披露的每个特征仅仅是等效或类似特征的通用系列的实例。
[0953]
通过以上的说明,本领域的技术人员可以很容易地确定本发明的基本特征并且在不偏离本发明的精神和范围的情况下,可以对本发明作不同变化和修改,以使其适应不同用途和条件。因此,其他实施例也在权利要求内。
[0954]
等效方案
[0955]
虽然本文已描述和说明了若干个本发明实施例,但本领域普通技术人员将容易地设想用于执行本文所述的功能和/或获得本文所述的结果和/或本文所述的一个或多个优点的多种其他装置和/或结构,并且此类变型和/或修改中的每一个被认为是在本文所述的本发明实施例的范围内。更一般地说,本领域的技术人员将容易地理解,本文所述的所有参数、尺寸、材料以及配置意在为示例性的,并且实际参数、尺寸、材料和/或配置将取决于发明传授内容所用于的一种或多种具体应用。本领域的技术人员仅仅使用常规实验将认识到或能够确定本文所述的具体本发明实施例的许多等效方案。因此,应当理解,前述实施例是仅借助于实例来呈现,并且在所附权利要求和其等效方案的范围内,可以按与具体描述和要求保护不同的方式实践本发明实施例。本披露的本发明实施例涉及本文所述的每个单独特征、系统、物品、材料、试剂盒和/或方法。另外,如果此类特征、系统、物品、材料、试剂盒和/或方法并不相互矛盾,两个或更多个此类特征、系统、物品、材料、试剂盒和/或方法的任意组合包括在本披露的发明范围内。
[0956]
如本文定义和使用的所有定义应当被理解成优先于所定义术语的字典定义、通过援引而并入的文件中的定义和/或普通含义。
[0957]
本文披露的所有参考文献、专利和专利申请都相对于每个被引用的主题通过援引而并入,这在一些情况下可以涵盖文件的全部内容。
[0958]
除非清楚地作相反指示,否则如本文在说明书中和在权利要求中使用的不定冠词“一个/种(a/an)”应理解为意指“至少一个(种)”。
[0959]
如本文在说明书中和在权利要求中使用的短语“和/或”应理解为意指如此联合的要素中的“任一者或两者”,即,要素在一些情况下联合存在且在其他情况下不联合存在。用“和/或”列出的多个要素应当以相同的方式来解释,即,如此联合的要素中的“一个(种)或多个(种)”。除了由“和/或”子句具体标识的要素,其他要素可以任选地存在,无论是与具体标识的那些要素相关还是不相关。因此,作为非限制性实例,当结合开放式语言诸如“包含”使用时,对“a和/或b”的提及可以在一个实施例中仅指a(任选地包括除了b的要素);在另一个实施例中,仅指b(任选地包括除了a的要素);在又另一个实施例中,指a和b(任选地包括其他要素);等等。
[0960]
如本文在说明书中和在权利要求中使用的,“或”应理解为具有与如以上定义的“和/或”相同的含义。例如,当分隔列表中的项目时,“或”或“和/或”应解释为包括性的,即,包括许多要素或要素列表中的至少一个(种),还包括其中的多于一个(种),并且任选地包括另外未列出的项目。仅清楚地作相反指示的术语,诸如
“……
中的仅一个(种)”或
“……
中的恰好一个(种)”,或者当用于权利要求中时,“由
……
组成”将是指恰好包括许多要素或要素列表中的恰好一个(种)要素。一般来说,如本文使用的术语“或”当前面加有排他性的术语,诸如“任何一个(种)”、
“……
中一个(种)”、
“……
中仅一个(种)”或
“……
中恰好一个(种)”时,应仅解释为指示排他性替代方案(即,“一个(种)或另一个(种)而不是两者”)。“主要由
……
组成”当用于权利要求中时,应具有如在专利法领域中所用的其普通含义。
[0961]
如本文在说明书中和在权利要求中所用,关于一个(种)或多个(种)要素的列表的短语“至少一个(种)”应理解为意指选自要素列表中的任何一个(种)或多个(种)要素的至少一个(种)要素,但不一定包括在要素列表内具体列出的每个(种)要素中的至少一个(种),并且不排除要素列表中的要素的任意组合。此定义还允许可以任选地存在除了短语“至少一个(种)”所提及的要素列表内具体标识的要素外的要素,无论与具体标识的那些要素相关还是无关。因此,作为非限制性实例,“a和b中的至少一个(种)”(或等效地,“a或b中的至少一个(种)”,或等效地“a和/或b中的至少一个(种)”)在一个实施例中可以是指至少一个(种)、任选地包括多于一个(种)a,而不存在b(并且任选地包括除了b的要素);在另一个实施例中,可以是指至少一个(种)、任选地包括多于一个(种)b,而不存在a(并且任选地包括除了a的要素);在又另一个实施例中,可以是指至少一个(种)、任选地包括多于一个(种)a,以及至少一个(种)、任选地包括多于一个(种)b(并且任选地包括其他要素);等等。
[0962]
术语“约”或“大约”意指由本领域普通技术人员确定的具体值处于可接受的误差范围内,这将部分取决于该值的测量或确定方式,即,测量系统的限制性。例如,根据本领域的实践,“约”可以意指在可接受的标准偏差内。替代性地,“约”可以意指给定值的至多
±
20%、优选地至多
±
10%、更优选地至多
±
5%、且更优选地至多
±
1%的范围。替代性地,特别是关于生物系统或过程,该术语可以意指在值的数量级以内、优选地在值的2倍以内。在本技术和权利要求书中描述了特定值的情况下,除非另有说明,否则术语“约”是隐含的并且在该上下文中意指在特定值的可接受误差范围内。
[0963]
还应当理解,除非清楚地作相反指示,否则在包括多于一个步骤或动作的本文所要求保护的任何方法中,方法的步骤或动作的顺序不一定限于方法的步骤或动作被列举的顺序。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1