药物用制剂原料十二烷基硫酸钠或包含其的制剂等的筛选、评价或制造方法与流程
1.本发明涉及:在含有十二烷基硫酸钠的药物制剂中,作为药物用制剂原料的十二烷基硫酸钠的筛选方法、以及包含该制剂原料的药物制剂的质量评价方法、和使用了所筛选的十二烷基硫酸钠的稳定性高的药物制剂的制造方法。另外,本发明还涉及:所筛选的药物用制剂原料、包含一定量的该所筛选的药物用制剂原料和/或其杂质的药物组合物或药物制剂。
背景技术:
2.式(i)所示的化合物(化合物名称:9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5h-苯并[b]咔唑-3-甲腈、通用名:阿来替尼)具有间变性淋巴瘤激酶(alk:anaplastic lymphoma kinase)抑制作用,盐酸阿来替尼被用作alk融合基因阳性的无法切除的进行/复发的非小细胞肺癌的治疗药(非专利文献1),。
[0003]
由于阿来替尼是难溶性的碱性药剂,因此在其制剂化中报道了:制成共存有助溶剂的组合物(专利文献1);或者通过形成包含式(i)所示的化合物或其盐的颗粒、并使该颗粒与崩解剂共存,制成溶出性良好的胶囊剂(专利文献2)。
[0004]
十二烷基硫酸钠被用作以阿来替尼制剂为代表的各种药物制剂的添加剂(非专利文献1)。已知含有十二烷基硫酸钠的制剂缺乏稳定性,而已劣化的含有十二烷基硫酸钠的制剂在制剂特性上发生变化,已知为了使含有十二烷基硫酸钠的制剂稳定化而掺混选自中性盐和碱性物质的至少1种(专利文献3)。
[0005]
然而,迄今为止,人们还不知道用作药物用制剂原料的十二烷基硫酸钠的微小的质量差异会影响制剂的劣化、以及检测十二烷基硫酸钠的微小的质量差异的方法。
[0006]
现有技术文献专利文献专利文献1:日本专利4918630号;专利文献2:日本专利5859712号;专利文献3:日本专利4902928号;非专利文献非专利文献1:alecensa (安圣莎) 150mg胶囊包装说明书2018年12月修订版。
技术实现要素:
[0007]
发明所要解决的课题希望提供检测用作药物制剂的制造原料的十二烷基硫酸钠的微小的质量差异、并判别作为药物的制剂原料所期望的质量的十二烷基硫酸钠的方法。
[0008]
用于解决课题的手段鉴于上述课题,本发明人反复进行了深入探讨,结果查明了:包含阿来替尼(alectinib)或其盐的制剂中所含的十二烷基硫酸钠的微小的质量差异会对制剂的稳定性或溶出性产生影响,且发现在加速条件下对十二烷基硫酸钠进行预处理的下述方法可解决上述课题,从而完成了本发明。
[0009]
即,本发明涉及以下的包含十二烷基硫酸钠的药物用制剂原料的筛选方法。
[0010]
《1》 筛选方法,其是包含十二烷基硫酸钠的药物用制剂原料的筛选方法,其特征在于:在加速条件下对上述制剂原料进行预处理后进行杂质的检测。
[0011]
《2》 《1》所述的筛选方法,其特征在于:上述加速条件为65~75℃的温度条件。
[0012]
《3》 《1》或《2》所述的筛选方法,其特征在于:上述加速条件为低于79%rh的湿度条件。
[0013]
《4》 《1》~《3》中任一项所述的筛选方法,其特征在于:上述加速条为约10%rh的湿度条件。
[0014]
《5》 《1》~《4》中任一项所述的筛选方法,其特征在于:上述加速条件为约70℃的温度条件,并且为约10%rh以下的湿度条件。
[0015]
《6》 《1》~《3》中任一项所述的筛选方法,其中,上述杂质为硫酸根离子、十二烷醇或十二烷基硫酸钠/十二烷醇复合物。
[0016]
《7》 《1》~《6》中任一项所述的筛选方法,其中,利用粉末x射线衍射、离子交换层析(色谱法)、气相层析或定量nmr检测上述杂质。
[0017]
《8》 《1》~《7》中任一项所述的筛选方法,其中,上述杂质为硫酸根离子,利用离子交换层析检测该杂质。
[0018]
《9》 《1》~《8》中任一项所述的筛选方法,其中,在上述加速条件下预处置2天以上。
[0019]
《10》 《1》~《8》中任一项所述的筛选方法,其中,在上述加速条件下预处置4天。
[0020]
《10a》 《1》~《10》中任一项所述的筛选方法,其中,上述杂质为硫酸根离子,筛选上述药物用制剂原料中的硫酸根离子的含量为1mg/l以下的药物用制剂原料。
[0021]
《10b》 《1》~《10a》中任一项所述的筛选方法,其中,上述杂质为硫酸根离子,筛选在将约100mg的上述药物用制剂原料溶于1l水而得的溶液中上述药物用制剂原料中的硫酸根离子的含量为1mg/l以下的药物用制剂原料。
[0022]
本发明的另一方案为药物制剂的质量评价方法,该质量评价方法是针对阿来替尼的药物制剂省略杂质的测定,该药物制剂包含利用加速条件检测杂质而筛选的药物用制剂原料即十二烷基硫酸钠。
[0023]
《2》 质量评价方法,其是含有包含式(i)所示的化合物或其盐和十二烷基硫酸钠的药物用制剂原料的药物制剂的质量评价方法,包括以下步骤:步骤a:选择药物制剂,该药物制剂使用了将上述药物用制剂原料在加速条件下预
处理后检测杂质而筛选的药物用制剂原料;以及步骤b:对步骤a中选择的药物制剂省略上述制剂中的杂质的测定,。
[0024]
《2a》 《2》所述的质量评价方法,其特征在于:上述加速条件为65~75℃的温度条件。
[0025]
《2b》 《2》或《2a》所述的质量评价方法,其特征在于:上述加速条件为低于79%rh的湿度条件。
[0026]
《2c》 《2》~《2b》中任一项所述的质量评价方法,其特征在于:上述加速条件为约10%rh的湿度条件。
[0027]
《2d》 《2》~《2c》中任一项所述的质量评价方法,其特征在于:上述加速条件为约70℃的温度条件,并且为约10%rh以下的湿度条件。
[0028]
《2e》 《2》~《2d》中任一项所述的质量评价方法,其中,上述杂质为硫酸根离子、十二烷醇或十二烷基硫酸钠/十二烷醇复合物。
[0029]
《2f》 《2》~《2e》中任一项所述的质量评价方法,其中,利用粉末x射线衍射、离子交换层析、气相层析或定量nmr检测上述杂质。
[0030]
《2g》 《2》~《2f》中任一项所述的质量评价方法,其中,上述杂质为硫酸根离子,利用离子交换层析检测该杂质。
[0031]
《2h》 《2》~《2g》中任一项所述的质量评价方法,其中,在上述加速条件下预处置2天以上。
[0032]
《2i》 《2》~《2h》中任一项所述的质量评价方法,其中,在上述加速条件下预处置4天。
[0033]
《2j》 《2》~《2i》中任一项所述的质量评价方法,其中,上述杂质为硫酸根离子,筛选上述药物用制剂原料中的硫酸根离子含量为1mg/l以下的药物用制剂原料。
[0034]
《2k》 《2》~《2j》中任一项所述的质量评价方法,其中,上述杂质为硫酸根离子,筛选在将约100mg的上述药物用制剂原料溶于1l水而得的溶液中上述药物用制剂原料中的硫酸根离子含量为1mg/l以下的药物用制剂原料。
[0035]
而且,本发明的又一方案为:根据作为药物用制剂原料的十二烷基硫酸钠的保存条件筛选该制剂原料的方法。
[0036]
《11》 筛选方法,其是包含十二烷基硫酸钠的药物用制剂原料的筛选方法,包括以下步骤:步骤a,筛选在规定的条件下保存的上述制剂原料的批次(lot)或包装单位;步骤b,对上述步骤a中筛选的药物用制剂原料省略杂质的检测。
[0037]
《12》 《11》所述的筛选方法,其中,上述条件为30℃~40℃、47天以下。
[0038]
《13》 《11》所述的筛选方法,其中,上述条件为30℃~40℃、47天以下,在超过40℃的情况下,超过40℃且为60℃以下的时间累积为48小时以内。
[0039]
《13a》 《11》~《13》中任一项所述的筛选方法,其中,上述条件为40℃。
[0040]
《13b》 《11》~《13a》中任一项所述的筛选方法,其中,上述条件为45天。
[0041]
《14》 《11》~《13b》中任一项所述的筛选方法,其中,上述条件为运输时的保存条件。
[0042]
另外,本发明的又一方案还涉及:通过在加速条件下对药物制剂进行预处理可评价药物制剂的质量的方法。
[0043]
《16》 包含十二烷基硫酸钠的药物制剂的质量评价方法,其特征在于:在加速条件下对包含十二烷基硫酸钠的药物制剂进行预处理后检测杂质。
[0044]
《17》 《16》所述的质量评价方法,其中,上述药物制剂含有式(i)所示的化合物或其盐,。
[0045]
《18》 《16》~《17》中任一项所述的质量评价方法,其特征在于:上述加速条件为55~65℃的温度条件。
[0046]
《19》 《16》~《18》中任一项所述的质量评价方法,其特征在于:上述加速条件为约60℃的温度条件。
[0047]
《20》 《16》~《19》中任一项所述的质量评价方法,其中,上述杂质为硫酸根离子、十二烷醇或十二烷基硫酸钠/十二烷醇复合物。
[0048]
《21》 《16》~《20》中任一项所述的质量评价方法,其中,利用粉末x射线衍射、离子交换层析、气相层析或定量nmr检测上述杂质。
[0049]
《22》 《16》~《21》中任一项所述的质量评价方法,其中,上述杂质为十二烷醇,利用气相层析检测该杂质。
[0050]
《23》 《16》~《22》中任一项所述的质量评价方法,其中,上述杂质为硫酸根离子,利用离子交换层析检测该杂质。
[0051]
《24》 《16》~《23》中任一项所述的质量评价方法,其中,上述预处理是在上述加速条件下进行2天以上。
[0052]
《25》 《16》~《24》中任一项所述的质量评价方法,其中,上述预处理是在上述加速条件下进行7天。
[0053]
《26》 《16》~《25》中任一项所述的质量评价方法,其中,筛选上述杂质以十二烷醇/十二烷基硫酸钠(mol/mol%)或硫酸根离子/十二烷基硫酸钠(mol/mol%)的形式在上述制剂中以2%以下存在的药物制剂。
[0054]
而且,本发明的又一方案为阿来替尼的药物制剂的制造方法,包括以下步骤:在加速条件下对作为药物用制剂原料的十二烷基硫酸钠进行预处理后进行筛选。
[0055]
《27》 制造方法,其是包含十二烷基硫酸钠的药物制剂的制造方法,包括以下步骤:步骤a,在加速条件下对作为药物用制剂原料的十二烷基硫酸钠进行预处理;步骤b,在上述步骤a的预处理后进行杂质的检测,筛选作为杂质的硫酸根离子的含量为1mg/l以下的药物用制剂原料;以及步骤c,使用上述步骤b中筛选的药物用制剂原料制造药物制剂。
[0056]
《28》 《27》所述的制造方法,其中,上述药物制剂含有式(i)所示的化合物或其盐,。
[0057]
《29》 制造方法,其是含有式(i)所示的化合物或其盐和十二烷基硫酸钠的药物制剂的制造方法,包括以下步骤:步骤a,使用包含十二烷基硫酸钠的药物用制剂原料制造上述药物制剂;步骤b,对上述步骤a中制造的药物制剂进行预处理;以及步骤c,在上述步骤b的预处理后进行杂质的检测,筛选作为杂质的十二烷醇/十二烷基硫酸钠(mol/mol%)或硫酸根离子/十二烷基硫酸钠(mol/mol%)为2%以下的药物制剂,。
[0058]
而且,本发明的又一方案为:以规定的比例包含杂质的药物用制剂原料或其药物制剂、含阿来替尼的组合物或其药物制剂,该杂质是在加速条件下对作为药物用制剂原料的十二烷基硫酸钠进行预处理后测定的。
[0059]
《30》 组合物,其是含有式(i)所示的化合物或其盐和十二烷基硫酸钠的药物组合物,其中,在加速条件下对包含上述组合物的药物制剂进行预处理后进行测定时,以对上述制剂的溶出性没有影响的比例包含上述组合物中的十二烷醇/十二烷基硫酸钠或硫酸根离子/十二烷基硫酸钠,
。
[0060]
《31》 《30》所述的组合物,其中,上述组合物中的十二烷醇/十二烷基硫酸钠(mol/mol%)或硫酸根离子/十二烷基硫酸钠(mol/mol%)利用粉末x射线衍射、离子交换层析、气相层析或定量nmr进行测定为2%以下。
[0061]
《32》 制剂,其是含有式(i)所示的化合物或其盐和十二烷基硫酸钠的药物制剂,以对溶出性没有影响的比例包含在加速条件下对上述制剂进行预处理后测定的上述制剂中的十二烷醇/十二烷基硫酸钠或硫酸根离子/十二烷基硫酸钠,。
[0062]
《33》 《32》所述的制剂,其中,上述制剂中的十二烷醇/十二烷基硫酸钠(mol/mol%)或硫酸根离子/十二烷基硫酸钠(mol/mol%)利用粉末x射线衍射、离子交换层析、气相层析或定量nmr进行测定为2%以下。
[0063]
《34》 制剂,其是含有十二烷基硫酸钠的药物制剂,其中,以对上述药物制剂的溶出性没有影响的比例包含在加速条件下对上述制剂进行预处理后测定的上述制剂中的十二烷醇/十二烷基硫酸钠或硫酸根离子/十二烷基硫酸钠。
[0064]
《35》 制剂原料,其是包含十二烷基硫酸钠的药物用制剂原料,其中,在加速条件下对上述制剂原料进行预处理后测定的上述原料中的硫酸根离子利用离子交换层析进行测定为1mg/l以下。
[0065]
本发明还包括以下的方案。
[0066]
(1) 筛选方法,其是包含十二烷基硫酸钠的药物用制剂原料的筛选方法,其特征在于:在加速条件下对上述制剂原料进行预处理后进行杂质的检测。
[0067]
(2) (1)所述的筛选方法,其特征在于:上述加速条件为65~75℃的温度条件。
[0068]
(3) (1)或(2)所述的筛选方法,其特征在于:上述加速条件为低于79%rh的湿度条件。
[0069]
(4) (1)~(3)中任一项所述的筛选方法,其特征在于:上述加速条件为约10%rh的湿度条件。
[0070]
(5) (1)~(4)中任一项所述的筛选方法,其特征在于:上述加速条件为约70℃的温度条件、并且为约10%rh以下的湿度条件。
[0071]
(6) (1)~(3)中任一项所述的筛选方法,其中,上述杂质为硫酸根离子、十二烷醇
或十二烷基硫酸钠/十二烷醇复合物。
[0072]
(7) (1)~(6)中任一项所述的筛选方法,其中,利用粉末x射线衍射、离子交换层析、气相层析或定量nmr检测上述杂质。
[0073]
(8) (1)~(7)中任一项所述的筛选方法,其中,上述杂质为硫酸根离子,利用离子交换层析检测该杂质。
[0074]
(9) (1)~(8)中任一项所述的筛选方法,其中,在上述加速条件下预处置2天以上。
[0075]
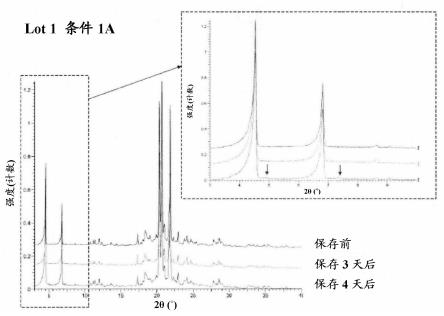
(10) (1)~(8)中任一项所述的筛选方法,其中,在上述加速条件下预处置4天。
[0076]
(11) 药物制剂的质量评价方法,其特征在于:将药物制剂在加速条件下预处理后检测杂质。
[0077]
(11a) (11)所述的质量评价方法,其中,上述药物制剂包含十二烷基硫酸钠。
[0078]
(12) (11)或(11a)所述的质量评价方法,其中,上述加速条件为约60℃的温度条件。
[0079]
(13) (11)、(11a)或(12)所述的质量评价方法,其中,上述药物制剂含有式(i)所示的化合物或其盐,。
[0080]
(14) 制造方法,其是包含十二烷基硫酸钠的药物制剂的制造方法,包括以下步骤:步骤a,在加速条件下对作为药物用制剂原料的十二烷基硫酸钠进行预处理;步骤b,在上述预处理后进行杂质的检测,筛选作为杂质的硫酸根离子的含量为1mg/l以下的上述制剂原料;以及步骤c,使用上述步骤b中筛选的上述制剂原料制造药物制剂。
[0081]
(15) (14)所述的制造方法,其中,上述药物制剂含有式(i)所示的化合物或其盐,。
[0082]
发明效果根据本发明的方法,可判别或筛选作为药物用制剂原料的十二烷基硫酸钠(sls)的质量,使用通过本发明的方法筛选的sls药物用制剂原料制造的药物组合物可提供具有优异的稳定性、且质量高的药物制剂。
[0083]
根据本发明的筛选方法,通过在规定的加速条件下对药物用制剂原料十二烷基硫酸钠进行预处理,可筛选药物用制剂原料,该制剂原料可制造稳定性优异的药物制剂。或者,在本发明的筛选方法中,可根据药物用制剂原料的保存状态省略杂质的检测。
[0084]
另外,根据本发明的质量评价方法,通过在规定的加速条件下对作为药物用制剂原料的十二烷基硫酸钠进行预处理并检测杂质量,可评价该药物制剂的质量。或者,根据本发明的质量评价方法,根据包含十二烷基硫酸钠的药物制剂是否是使用在规定的加速条件下进行预处理并根据杂质的量筛选的作为药物用制剂原料的十二烷基硫酸钠制造的,可评价是否为可省略药物制剂的杂质测定的质量。
[0085]
而且,根据本发明的制造方法,通过在规定的加速条件下对十二烷基硫酸钠的药物用制剂原料进行预处理,筛选杂质低的制剂原料,使用该所筛选的药物用制剂原料制造药物制剂,从而可制造包含十二烷基硫酸钠的稳定性优异的药物制剂。
[0086]
另外,根据本发明,可提供可用于制造稳定性优异的药物制剂的药物用制剂原料、或者含有对溶解性没有影响且为规定比例以下的杂质的含阿来替尼的组合物或药物制剂。
附图说明
[0087]
[图1a]是在温度条件1a下保存十二烷基硫酸钠的lot 1时的粉末x射线衍射的测定结果的图。
[0088]
[图1b]是在温度条件1a下保存十二烷基硫酸钠的lot 2时的粉末x射线衍射的测定结果的图。
[0089]
[图1c]是在温度条件1b下保存十二烷基硫酸钠的lot 1时的粉末x射线衍射的测定结果的图。
[0090]
[图1d]是在温度条件1b下保存十二烷基硫酸钠的lot 2时的粉末x射线衍射的测定结果的图。
[0091]
[图2a]是在湿度条件2a下保存十二烷基硫酸钠的lot 1时的粉末x射线衍射的测定结果的图。
[0092]
[图2b]是在湿度条件2a下保存十二烷基硫酸钠的lot 2时的粉末x射线衍射的测定结果的图。
[0093]
[图2c]是在湿度条件2b下保存十二烷基硫酸钠的lot 1时的粉末x射线衍射的测定结果的图。
[0094]
[图2d]是在湿度条件2b下保存十二烷基硫酸钠的lot 2时的粉末x射线衍射的测定结果的图。
[0095]
[图3]是十二烷基硫酸钠/十二烷醇复合物的粉末x射线衍射的测定结果的图。
[0096]
[图4]是十二烷基硫酸钠和十二烷基硫酸钠/十二烷醇复合物的扫描型电子显微镜照片。
[0097]
[图5]是十二烷基硫酸钠和十二烷基硫酸钠/十二烷醇复合物的质子核磁共振波谱的图。
[0098]
[图6a]是在温度70℃、相对湿度约10% (licl饱和水溶液)下保存十二烷基硫酸钠的lot 1时的粉末x射线衍射的测定结果的图。
[0099]
[图6b]是在温度70℃、相对湿度约10% (licl饱和盐水溶液)下保存十二烷基硫酸
钠的lot 2时的粉末x射线衍射的测定结果的图。
[0100]
[图7a]是在温度条件5a下保存制剂lot a时的粉末x射线衍射的测定结果的图。
[0101]
[图7b]是在温度条件5a下保存制剂lot b时的粉末x射线衍射的测定结果的图。
[0102]
[图7c]是在温度条件5b下保存制剂lot a时的粉末x射线衍射的测定结果的图。
[0103]
[图7d]是在温度条件5b下保存制剂lot b时的粉末x射线衍射的测定结果的图。
[0104]
[图7e]是在温度条件5c下保存制剂lot a时的粉末x射线衍射的测定结果的图。
[0105]
[图7f]是在温度条件5c下保存制剂lot b时的粉末x射线衍射的测定结果的图。
[0106]
[图8a]是在温度60℃下保存制剂lot c时的溶出试验曲线。
[0107]
[图8b]是在温度60℃下保存制剂lot d时的溶出试验曲线。
[0108]
[图9a]是在温度60℃下保存制剂lot c时的粉末x射线衍射的测定结果的图。
[0109]
[图9b]是在温度60℃下保存制剂lot d时的粉末x射线衍射的测定结果的图。
[0110]
[图10a]是在温度60℃下保存制剂lot e时的溶出试验曲线。
[0111]
[图10b]是在温度60℃下保存制剂lot f时的溶出试验曲线。
[0112]
[图10c]是在温度60℃下保存制剂lot g时的溶出试验曲线。
[0113]
[图10d]是在温度60℃下保存制剂lot h时的溶出试验曲线。
[0114]
[图10e]是在温度60℃下保存制剂lot i时的溶出试验曲线。
[0115]
[图10f]是在温度60℃下保存制剂lot j时的溶出试验曲线。
[0116]
[图10g]是在温度60℃下保存制剂lot k时的溶出试验曲线。
[0117]
[图11]是在温度60℃下保存制剂lot a和lot b时基于gc/ms的十二烷醇的测定结果的图。
具体实施方式
[0118]
以下,对本发明进行说明。
[0119]
在本发明中,“十二烷基硫酸钠”作为药物制剂的添加剂是已知的物质,特别是作为难溶性药物即阿来替尼的助溶剂而构成该药物制剂的药物组合物的物质。已知十二烷基硫酸钠中存在1水合物、1/2水合物、1/8水合物和非溶剂合物(文献名:journal of crystal growth 263 (2004) 480-490),通常在室温下保存,优选从制造起1年以内使用。所有形态均可用作本发明的药物用制剂原料。
[0120]“药物用制剂原料”是指包括阿来替尼等有效成分在内的用作药物制剂的添加剂的实质上纯粹的单一化合物(例如,十二烷基硫酸钠等)。药物用制剂原料是指用于该药物制剂的工业制造的、以千克级以上的量包含所期望的化合物的原料。“实质上纯粹”是指允许存在某种程度的杂质,但通常以可流通的程度包含所期望的化合物。在本发明中,药物用制剂原料可从制造商购入市售原料,也可以是由自己或委托其他公司制造的原料。另外,药物用制剂原料可使用刚刚购入或制造后的原料,或者可使用购入/制造后经过规定期间、例如1年以上的原料。
[0121]
需要说明的是,“包含十二烷基硫酸钠的药物用制剂原料”是指包含实质上纯粹的十二烷基硫酸钠的药物用制剂原料,可存在作为其杂质的微量的硫酸根离子、十二烷醇或十二烷基硫酸钠/十二烷醇复合物。
[0122]“筛选”是指选择纯度更高的药物用制剂原料或药物制剂,具体而言,是指通过测
定各制剂原料或药物制剂的批次或包装单位中的杂质含量,选择杂质更少的制剂原料或药物制剂的批次或包装单位。筛选药物用制剂原料是指,优选为选择纯度更高的药物用制剂原料,进一步优选为选择杂质含量适合日本药典(第十七修订版)记载的纯度试验的制剂原料的批次或包装单位。需要说明的是,批次是指基于相同的条件在规定的期间内制造的原料或产品的生产/发货的最小单位。包装单位是指将1个批次以上的药物用制剂原料或药物制剂以规定的重量或数量单位进行包装而成的单位。药物用制剂原料的筛选更优选为如下的方法:当药物用制剂原料为十二烷基硫酸钠、且杂质为硫酸根离子时,在利用离子交换层析进行测定时,选择在将样品溶于水而得的溶液中硫酸根离子的含量为5mg/l以下、优选为3mg/l以下、最优选为1mg/l以下的批次或包装单位。或者是如下的方法:选择在将样品溶于水而得的约100mg/l的溶液中硫酸根离子的含量为1mg/l以下的批次或包装单位。在筛选药物制剂的情况下,“筛选”是指如下的方法:当药物制剂的杂质为十二烷醇、硫酸根离子或十二烷基硫酸钠/十二烷醇复合物时,在利用粉末x射线衍射、离子交换层析、气相层析或定量nmr进行测定时,选择以十二烷醇/十二烷基硫酸钠(mol/mol%)或硫酸根离子/十二烷基硫酸钠(mol/mol%)计为5%以下、优选3%以下、最优选为2%以下的批次或包装单位。
[0123]
离子层析是一种主要测定离子种成分的液相层析,以洗脱液为流动相,可在以离子交换体等为固定相的填充柱内分离、定量样品溶液中的离子种成分。气相层析可通过固定相与物质的相互作用进行分离,根据到达检测器为止的时间进行定性,根据来自检测器的信号量进行定量。基于粉末x射线衍射的测定例如可按照日本药典(第十七修订版)中记载的“粉末x射线衍射测定法”等常规方法进行。
[0124]
定量nmr是利用在nmr波谱上观测到的单峰的面积与样品中所含的氢原子数成比例、而不依赖于物质的化学结构的原理进行定量的方法。因此,通过使用除分析对象成分以外的纯度已知的物质作为标准物质,可进行分析对象成分的绝对定量。优选为气相层析、或使用阴离子交换柱的离子层析,离子层析的优选的流动相、柱、检测器如下。
[0125]
流动相(洗脱液):5mm的na2co3溶液或20mm的naoh溶液;柱:在使用5mm的na2co3溶液的情况下,可使用metrosep a supp7-250/4.0 (metrohm制造),或者,在使用20mm的naoh溶液的情况下,可使用ion pac as11-hc 直径4mm、长度250mm (thermo scientific制造);检测器:电导率计。
[0126]
气相层析的优选的柱、测定条件如下。
[0127]
柱:hp-5ms ui、0.25mmid
×
30m、0.25μm (agilent制造);注入量:1.0μl;分流比:1:10;柱温:40℃ (1分钟)
→
(20℃/分钟)
→
180℃
→
(5℃/分钟)
→
190℃
→
(50℃/分钟)
→
300℃ (4分钟);喷射器温度:300℃;界面温度:30℃;载气:he;流速:1ml/分钟;离子电压:70ev;
离子化模式:esi-;测定模式:sim;监测离子(m/z):83.0。
[0128]“加速条件”是指比通常的保存状态更苛刻的条件,具体而言,温度或湿度等是比通常的保存状态更苛刻的条件。具体而言,关于药物用制剂原料的温度的加速条件是指50℃以上、优选约60℃以上、更优选约60℃~80℃、进一步优选约65℃~75℃、最优选约70℃的温度条件。在该加速条件下采用的湿度条件为80%rh以下、优选低于79%rh、或者更优选低于约10%rh的湿度条件。
[0129]
另外,如果药物用制剂原料是在一定的条件下保存,则可将产生的杂质的比例抑制在低水平,因此如果选择包含药物用制剂原料在该条件下保存后的该制剂原料的药物制剂,则可省略杂质的测定。
[0130]
关于药物制剂的温度的加速条件是指50℃以上、优选约50℃~70℃以上、更优选约55℃~65℃、最优选约60℃的温度条件。
[0131]
需要说明的是,“保存”是指药物用制剂原料从制造起到使用为止的期间在可管理温度或湿度的仓库、保存库、货物内等储存(保存)一定期间,也包括需要1天以上的运输。
[0132]
在本发明中,“规定的条件”是指保存期间的温度或天数,具体而言,关于温度和天数,优选为40℃以下、47天以下,更优选为30℃~40℃下、47天以下,最优选为30℃~40℃、45天以下。
[0133]
在关于温度的条件的情况下,“超过规定的条件”是指保存中在高于40℃的温度下保存。然而,即使是超过该温度条件的情况,只要在规定的范围以内,则对生成杂质的影响也少,因此可省略杂质的测定。具体而言,在超过40℃的情况下,如果超过40℃且为60℃以下的时间累积为48小时以内,则可省略杂质的测定。
[0134]
另外,在关于天数的条件的情况下,“超过规定的条件”是指在40℃以下的温度下保存47天、优选保存超过45天。然而,对于保存温度为室温~30℃、且保存1年以下的期间的情况也同样可省略杂质的测定。
[0135]
如此,即使在超过可省略杂质的测定的条件(追加条件)进行保存的情况下,也符合“超过规定的条件”。
[0136]
需要说明的是,在本技术说明书中“约”是指以允许
±
10%的意义使用。
[0137]“预处理”是指在用于制造药物制剂之前适用于药物用制剂原料的规定的处理。具体而言,规定的处理是指,将药物用制剂原料在上述加速条件下静置规定的期间。就药物用制剂原料而言,规定的期间是指1天以上、优选2天以上、更优选3天以上、进一步优选为4天。就药物制剂而言,规定的期间是指5天以上、优选7天以上、进一步优选7天以上且14天以内、最优选为7天以内。
[0138]“杂质”是指药物用制剂原料中的各批次或各包装单位中所含的除该原料以外的物质、例如用于制造药物用制剂原料的原料、其分解物、复合物等。或者,是指药物制剂中所含的药物用制剂原料的制造原料、分解物、复合物等。例如,在药物用制剂原料为十二烷基硫酸钠的情况下、或者为包含十二烷基硫酸钠的药物制剂的情况下,主要杂质是硫酸根离子、十二烷醇或十二烷基硫酸钠/十二烷醇复合物。作为药物用制剂原料的杂质的硫酸根离子可利用离子交换层析进行测定,在将样品溶于水而得的溶液中,可接受的硫酸根离子的
浓度为5mg/l以下、优选为3mg/l以下、最优选为1mg/l以下。作为药物用制剂的杂质的十二烷醇可与“筛选”中采用的方法同样地利用粉末x射线衍射、离子交换层析、气相层析或定量nmr进行测定,其浓度以十二烷醇/十二烷基硫酸钠(mol/mol%)或硫酸根离子/十二烷基硫酸钠(mol/mol%)计优选为2%以下。
[0139]“对溶出性没有影响的比例”是指将包含规定量的杂质的药物制剂的溶出性与不含杂质的药物制剂的溶出性作对比,其差为10%以内的情况下的杂质的比例。例如,对于包含各种含量的杂质的药物制剂,在试验液使用900ml包含7%聚氧乙烯(10)辛基苯基醚的第十六修订版日本药典溶出试验液第1液、基于第十六修订版日本药典溶出试验桨法的100转/分钟、37℃下的溶出试验中,将规定的时间点、优选75分钟的时间点的药物溶出率与不含杂质的药物制剂的药物溶出率作对比,由其差为10%以内的制剂中的杂质量求出该比例。具体而言,包含十二烷基硫酸钠的药物制剂的杂质以十二烷醇/十二烷基硫酸钠(mol/mol%)或硫酸根离子/十二烷基硫酸钠(mol/mol%)计优选为2%以下。
[0140]“检测”是指定性或定量地确认药物制剂或药物用制剂原料中的各批次或包装单位中所含的除原料以外的物质(杂质)。例如是指,当药物用制剂原料为十二烷基硫酸钠时、或者是包含十二烷基硫酸钠的药物制剂,通过与“筛选”中采用的方法同样地利用粉末x射线衍射、离子交换层析、气相层析或定量nmr等,定性或定量地确认作为杂质的硫酸根离子、十二烷醇或十二烷基硫酸钠/十二烷醇复合物的有无。
[0141]“药物制剂”是指将包含生理活性物质作为有效成分、而且还包含药学上可接受的添加剂的药物组合物制成适于服用的形态。在本发明中,优选口服给药制剂。“口服给药制剂”是指可口服进行给药的制剂,有效成分主要从肠道吸收。作为口服给药制剂,包括固体制剂以及液态制剂,本发明中优选固体制剂,具体而言,可列举:片剂、胶囊剂、散剂、口含片、咀嚼剂等固体制剂,其中优选片剂。在本发明的药物制剂中,可包含药物制剂中通常使用的赋形剂、润滑剂、包衣剂、粘合剂、崩解剂、稳定剂、矫味矫臭剂、稀释剂等作为添加剂。作为本发明中的药物制剂,优选含有式(i)所示的化合物或其盐、更优选含有盐酸阿来替尼的药物制剂,。
[0142]
在本发明中,用于质量评价的药物制剂可使用自己制造的药物制剂,也可使用市售的药物制剂。
[0143]“药物组合物”是指用于疾病的治疗/预防等的2种以上的物质的混合物,包含生理活性物质作为有效成分,还包含药学上可接受的添加剂。作为本发明中的生理活性物质,优选为式(i)所示的化合物或其盐,
。
[0144]
作为添加剂,优选包含十二烷基硫酸钠,还可包含乳糖水合物、羟丙基纤维素、羧甲纤维素钙和硬脂酸镁。
[0145]“质量评价方法”是指通过定性或定量地测定上述药物制剂中的杂质,对该药物制剂的质量进行评价的方法。杂质的定性或定量的测定可通过利用粉末x射线衍射、离子交换层析、气相层析或定量nmr等进行。优选质量评价方法是利用药物制剂中的杂质的含量来评价该药物制剂的质量。具体而言,利用“筛选”中采用的方法,将作为药物用制剂的杂质含量的十二烷醇/十二烷基硫酸钠(mol/mol%)或硫酸根离子/十二烷基硫酸钠(mol/mol%)为5%以下、优选3%以下、更优选2%以下的药物制剂评价为优选的质量的药物制剂。
[0146]“式(i)所示的化合物”是指式(i)所示的化合物、即9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5h-苯并[b]咔唑-3-甲腈,通用名为阿来替尼,。
[0147]
式(i)所示的化合物的“盐”优选药学上可接受的盐,作为“药学上可接受的盐”,例如包括:盐酸盐、氢溴酸盐、氢碘酸盐、磷酸盐、膦酸盐、硫酸盐、甲磺酸盐、对甲苯磺酸盐等磺酸盐;乙酸盐、枸橼酸盐、苹果酸盐、酒石酸盐、琥珀酸盐、水杨酸盐等羧酸盐;钠盐、钾盐等碱金属盐;镁盐、钙盐等碱土金属盐;铵盐(nh4x:x为1价酸根)、烷基铵盐、二烷基铵盐、三烷基铵盐、四烷基铵盐等的铵盐等。
[0148]
优选为盐酸盐,最优选为单盐酸盐。
[0149]
式(i)所示的化合物或其盐可通过已知的方法(例如,专利文献2中记载的方法)来制造。
[0150]
式(i)所示的化合物的单盐酸盐可以是无定形也可以是晶体,在晶体的情况下,优选在粉末x射线衍射图谱中在8.4
˚
、14.0
˚
、16.7
˚
、18.8
˚
、23.3
˚
附近的衍射角(2θ)具有峰的晶体(i型晶体)。另外,式(i)所示的化合物的单盐酸盐可以是水合物。式(i)所示的化合物的单盐酸盐的无定形体可利用wo2016/021707中记载的方法来制造,具有该峰的晶体可利用wo2015/163447中记载的方法来制造。
[0151]
相对于组合物整体,以游离体换算计含有20~70重量%、优选35~60重量%、进一步优选45~50重量%的式(i)所示的化合物或其盐。
[0152]
通过本发明的制造方法得到的制剂,其每单位制剂以游离体换算计含有150mg~
800mg、优选150mg~400mg、特别优选150mg~300mg的式(i)所示的化合物或其盐。具体而言,该制剂为150mg的胶囊制剂、150mg、300mg、600mg的片剂。
实施例
[0153]
实施例1:十二烷基硫酸钠的评价方法的预处理条件设定(温度)将由同一制造商获取的十二烷基硫酸钠的制造日期不同的批次(lot 1 (制造日期:2015.12.22)和lot 2 (制造日期:2017.3.10))适量装入玻璃小瓶中,在密闭系统中、在条件1a:温度60℃、条件1b:温度70℃下进行保存。对于保存前、保存3天、4天后的样品,按照下述所示的条件进行粉末x射线衍射(xrpd)测定。
[0154]
粉末x射线衍射的测定方法:测定装置:x’pert-pro mpd (panalytical制造);对阴极:cu;管电压:45kv;管电流:40ma;步宽:0.02;扫描轴:2θ;每个步骤的采样时间:43秒;扫描范围:3~40
˚
。
[0155]
lot 1、lot 2在条件1a和条件1b下保存时的粉末x射线衍射图谱见图1。在lot 2中,在条件1a、条件1b下直至保存4天后xrpd图谱也均无变化。
[0156]
另一方面,在lot 1中,在条件1a下保存4天后、在条件1b下保存3天以后,在4.9
˚
附近和7.4
˚
附近的衍射角(2θ)观测到新的峰。
[0157]
在条件1a和条件1b下,在lot 1和lot 2的xrpd中初次检测到新的峰的时间点如下所示。
[0158]
条件1alot 1:保存4天后;lot 2:保存4天后没有检测到新的峰;条件1blot 1:保存3天后;lot 2:保存4天后没有检测到新的峰。
[0159]
因此,判断为温度高的条件1b是可更早地评价十二烷基硫酸钠的lot 1和lot 2的条件,继续对实施例2的湿度进行了探讨。
[0160]
实施例2:十二烷基硫酸钠的评价方法的预处理条件设定(湿度)将实施例1中使用的十二烷基硫酸钠的不同批次(lot 1和lot 2)的约250mg装入玻璃小瓶中,在开放系统中、于条件2a:温度70℃、相对湿度约79% (nacl饱和盐水溶液)、条件2b:温度70℃、相对湿度约10% (licl饱和盐水溶液)下进行保存。对于在条件2a下保存前、保存1天、2天、3天后
*1
、在条件2b下保存前、保存1天、2天、3天、6天后的样品,按照实施例1所示的条件进行粉末x射线衍射测定。
[0161]
*1:由于在条件2a下保存2天、3天后的lot 1变成液态,所以没有实施粉末x射线衍
射的测定。
[0162]
lot 1、lot 2在条件2a和条件2b下保存时的粉末x射线衍射图谱见图2。在条件2b下直至保存6天后lot 2的xrpd图谱也没有变化,相对于此,在lot 1中3天以后在4.9
˚
附近和7.4
˚
附近的衍射角(2θ)观测到新的峰。另一方面,在条件2a下,lot 1在保存1天后观测到峰,lot 2在3天后观测到峰。
[0163]
显示在条件2a和条件2b下在lot 1和lot 2的xrpd中初次检测到新的峰的时间点。
[0164]
条件2alot 1:保存1天后;lot 2:保存3天后;条件2blot 1:保存3天后;lot 2:保存6天后没有检测到新的峰。
[0165]
由以上的结果判断为:相对湿度低的条件2b是更可识别十二烷基硫酸钠lot 1和lot 2的条件,用于筛选十二烷基硫酸钠样品。
[0166]
实施例3:十二烷基硫酸钠在保存期间的杂质鉴定在约2ml的十二烷醇中加入约85mg的十二烷基硫酸钠,边保持在30℃边搅拌约12小时。滤取析出的固体,得到了白色晶体。对于上述晶体(十二烷基硫酸钠/十二烷醇复合物),按照实施例1的条件进行粉末x射线衍射分析测定,测定结果见图3。在十二烷基硫酸钠/十二烷醇复合物中观测到的4.9
˚
附近和7.4
˚
附近的衍射角(2θ)的峰与实施例1、实施例2中保存十二烷基硫酸钠时观测到的未知物质的峰非常一致。
[0167]
另外,利用扫描型电子显微镜,在下述条件下对十二烷基硫酸钠和十二烷基硫酸钠/十二烷醇复合物进行观察。其结果见图4。十二烷基硫酸钠为薄板状的晶体,相对于此,十二烷基硫酸钠/十二烷醇复合物的形状不同。
[0168]
扫描型电子显微镜的测定条件:离子溅射装置:jfc-1500 (jeol制造);测定装置:sem ve-9800 (keyence制造);加速电压:2kv;物镜倍率:100倍。
[0169]
为了确认十二烷基硫酸钠/十二烷醇复合物中的十二烷基硫酸钠与十二烷醇的摩尔比,将约6mg十二烷基硫酸钠/十二烷醇复合物溶于1ml 99.8%的甲醇-d4中,按照以下所示的条件测定了质子核磁共振波谱(1h-nmr波谱)。
[0170]
测定装置:ecp500 (jeol制造);溶剂:甲醇-d4;x分辨率:0.22673 [hz];扫描次数:16;弛豫延迟:60秒。
[0171]
质子核磁共振波谱图见图5。定量的结果如下:十二烷基硫酸钠/十二烷醇复合物中的十二烷基硫酸钠与十二烷醇的摩尔比为1.18:1.00。
[0172]
由以上结果判明了:十二烷基硫酸钠在保存中分解,与作为分解物之一的十二烷
醇形成复合物。
[0173]
实施例4:加速条件下的保存期间的探讨(xrpd、离子层析)将约250mg十二烷基硫酸钠装入玻璃小瓶中,在开放系统中、于温度70℃、相对湿度约10% (licl饱和盐水溶液)下进行保存。对于保存前、保存1天、2天、3天、4天、7天、11天后的样品,按照实施例1所示的条件进行粉末x射线衍射测定。
[0174]
实施例1中使用的十二烷基硫酸钠的不同批次(lot 1、lot 2)的直至保存11天后的xrpd图谱见图6。lot 2直至保存11天都没有检测到十二烷基硫酸钠/十二烷醇复合物所具有的峰,相对于此,lot 1在保存3天后的样品中检测到表示十二烷基硫酸钠/十二烷醇复合物的峰。
[0175]
另外,对于保存4天后的lot 1和lot 2,利用以下所示的离子层析法定量了因十二烷基硫酸钠分解而产生的硫酸根离子。
[0176]
其结果,使用十二烷基硫酸钠lot 2调制的样品溶液中的硫酸根离子浓度为1mg/l以下,相对于此,使用十二烷基硫酸钠lot 1调制的样品溶液中的硫酸根离子浓度为24.1mg/l,判明了保存4天后的十二烷基硫酸钠lot 1正在进行分解。
[0177]
基于离子层析的硫酸根离子的测定方法:量取约5mg的十二烷基硫酸钠,加水至50ml。进行15分钟的超声波照射,用薄膜滤器(dismic-25hp ptfe 0.45μm hydrophilic、advantec公司制造)进行过滤。使滤液通过施行了洗涤的固相提取柱(dionex onguard ii rp、thermofisher scientific制造),将洗脱液作为样品溶液。另外使用离子层析用硫酸根离子标准液(1g/l、和光纯药工业制造)调制硫酸根离子浓度为1mg/l、2mg/l、3mg/l、4mg/l、5mg/l的溶液,作为标准溶液。离子层析使用compact ic flex (metrohm制造),按照以下的分析条件进行了试验。
[0178]
柱:metrosep a supp 7-250/4.0 (metrohm制造);保护柱:metrosep a supp 4/5 s-guard/4.0 (metrohm制造);抑制器:msm、mcs (metrohm制造);洗脱液:5mm的na2co3溶液;洗涤液:纯净水;流速:0.8ml/分钟;样品温度:20℃;柱温:45℃;注入量:10ml;测定时间:24分钟。
[0179]
样品溶液中的硫酸根离子浓度根据使用标准溶液制作的标准曲线进行计算。
[0180]
实施例5:用于药物制剂的质量评价的预处理方法的探讨(温度)由实施例3判明了:十二烷基硫酸钠根据批次而存在杂质。因此,按照日本专利5859712的实施例1,使用十二烷基硫酸钠lot 1制造制剂lot a的alecensa胶囊(150mg)制剂、以及使用同一制造商的制造日期不同的十二烷基硫酸钠lot 3 (制造日期:2015.10.02)制造制剂lot b的alecensa胶囊(150mg)制剂,在不同的保存条件下探讨了作为杂质的复合物的存在。
[0181]
将制剂lot a和lot b装入玻璃小瓶中,在密闭系统中、于温度条件5a:60℃、条件
5b:70℃、条件5c:80℃下进行保存。对于在条件5a下保存4天、7天、10天、14天后、在条件5b下保存2天、3天后、在条件5c下保存1天后的样品,按照实施例1所示的条件进行粉末x射线衍射测定。
[0182]
lot a和lot b在条件5a、5b、5c下保存时的粉末x射线衍射图谱见图7。在条件5a下,在lot b中在直至保存10天后的样品中没有检测到十二烷基硫酸钠/十二烷醇复合物所具有的峰,相对于此,在lot a中在保存7天后的样品中检测到了该峰。
[0183]
显示在各温度条件下在lot a和lot b的xrpd图谱中初次检测到十二烷基硫酸钠/十二烷醇复合物所具有的峰的时间点。
[0184]
条件5alot a:保存7天后;lot b:保存14天后;条件5blot a:保存2天后lot b:保存2天后;条件5clot a:保存1天后;lot b:保存1天后。
[0185]
因此,判断为条件5a、60℃是可评价制剂lot a和lot b的稳定性的条件,用于制剂的质量评价。
[0186]
实施例6:十二烷基硫酸钠的杂质对制剂的影响为了探讨十二烷基硫酸钠的杂质对制剂的影响,与实施例5同样使用实施例1中使用的十二烷基硫酸钠lot 1制造制剂lot c的alecensa胶囊(150mg)制剂,使用同一制造商的制造日期不同的十二烷基硫酸钠lot 4 (制造日期:2016.06.28)制造制剂lot d的alecensa胶囊(150mg)制剂,探讨了各自的溶出率。
[0187]
将制剂lot c和制剂lot d装入玻璃小瓶中,在密闭系统中、于温度60℃下继续保存。对于保存前和保存7天后的样品,按照下述条件实施了溶出试验,结果如下:lot d的溶出曲线与保存前同等,相对于此,lot c的溶出率较保存前显著降低(图8)。
[0188]
溶出试验的实施方法:试验液使用900ml包含7%聚氧乙烯(10)辛基苯基醚的日本药典溶出试验第1液,按照日本药典溶出试验桨法,在37℃下以100转/分钟进行了试验。
[0189]
另外,对于保存前和保存5天、6天、7天、8天、9天、12天、14天后的样品,按照实施例1所示的条件进行粉末x射线衍射测定。其结果,在lot d中直至保存14天后都没有检测到十二烷基硫酸钠/十二烷醇复合物所具有的峰,相对于此,在lot c中保存7天后检测到了该峰(图9)。
[0190]
对于保存7天后的样品,进一步按照以下所示的方法实施了基于gc/ms的十二烷醇的定量。
[0191]
基于gc/ms的十二烷醇的测定方法:取出各制剂的3个胶囊量的胶囊内容物进行混合。量取50mg胶囊内容物,加入己烷至25ml。进行30分钟的超声波照射,将溶液转移到离心管中进行离心分离,将上清作为样品
溶液。另外使用1-十二烷醇(和光纯药工业制造)调制十二烷醇浓度为1g/l、5g/l、10g/l、50g/l、100g/l的溶液,作为标准溶液。gc/ms使用7850a (agilent制造),按照以下的分析条件进行了试验。
[0192]
柱:hp-5ms ui、0.25mmid
×
30m、0.25μm (agilent制造);注入量:1.0
µ
l;分流比:1:10;柱温:40℃ (1分钟)-》(20℃/分钟)-》180℃-》(5℃/分钟)-》190℃-》(50℃/分钟)-》300℃ (4分钟);喷射器温度:300℃;界面温度:30℃;载气:he;流速:1ml/分钟;离子电压:70ev;离子化模式:esi-;测定模式:sim;监测离子(m/z):83.0。
[0193]
其结果,lot d中的十二烷醇浓度为定量限以下,相对于此,lot c中的十二烷醇/十二烷基硫酸钠(mol/mol%)为6.2%。
[0194]
由以上判明了:使用十二烷基硫酸钠lot 4制造的制剂lot d在60℃、7天的保存期间十二烷基硫酸钠没有分解,溶出性也没有变化,相对于此,使用十二烷基硫酸钠lot 1制造的制剂lot c通过60℃、7天的保存,确认到十二烷基硫酸钠的分解,制剂的溶出性也下降。因此,发现了:通过筛选适当质量的十二烷基硫酸钠并制造制剂,可制造更高质量的制剂。即,可知为了去除lot 1这样的容易分解的十二烷基硫酸钠批次、并筛选lot 2这样的不易分解的十二烷基硫酸钠,在温度70℃、相对湿度约10%的加速条件下保存4天后测定通过离子层析检测到的硫酸根离子浓度的方法,对筛选用于制造稳定性更优异的制剂的药物用制剂原料有效。而且,可筛选通过该方法测定的硫酸根离子浓度为1mg/l以下的十二烷基硫酸钠作为可制造稳定性优异的药物制剂的药物用制剂原料。
[0195]
实施例7:十二烷基硫酸钠的保存条件设定(温度)十二烷基硫酸钠通常是在室温下保存,但设想在运输中等可具有高于室温的温度条件的情况,而设定了保存条件(温度)。使用十二烷基硫酸钠lot 5 (制造日期:2016年10月13日),一次包装为塑料袋,二次包装为铝袋,按照表1所示的温度条件和期间进行保存。之后,将约250mg装入玻璃小瓶中,在开放系统中、于温度70℃、相对湿度约10% (licl饱和盐水溶液)下保存4天,对于保存后的样品,按照实施例4所示的离子层析法定量了因十二烷基硫酸钠分解而产生的硫酸根离子。
[0196]
[表1]
其结果,在上述的所有条件下通过离子层析检测到的硫酸根离子浓度均为1mg/l以下。因此,以最苛刻的条件6 (40℃下、45天和60℃下、48小时)作为保存条件的上限,对于未超过该上限而进行保存的十二烷基硫酸钠的批次,判断为其可用于制造稳定性更优异的制剂。
[0197]
实施例8:十二烷基硫酸钠的杂质与制剂质量(溶出性)的关系性使用多批制剂,研究了作为十二烷基硫酸钠的杂质的十二烷醇在制剂中被检出的量与制剂的溶出性的关系性。将制剂批次lot e (制造日期:2016.08.24)、lot f (制造日期:2016.08.29)、lot g (制造日期:2016.08.24)、lot h (制造日期:2016.10.19)、lot i (制造日期:2016.03.29)、lot j (制造日期:2016.03.24)、lot k (制造日期:2015.07.07)的各制剂装入玻璃小瓶中,在密闭系统中、于温度60℃下进行保存,对保存前和保存7天后的样品实施了溶出试验,对保存7天后的样品实施了基于gc/ms的十二烷醇的定量。溶出试验和基于gc/ms的十二烷醇的定量按照实施例6所示的方法进行实施。
[0198]
溶出试验的结果,lot h、lot i、lot j、lot k的溶出曲线与保存前同等,相对于此,lot e、lot f、lot g的溶出率较保存前显著降低(图10a~g)。另外,保存后的样品的十二烷醇定量的结果,lot h、lot i、 lot j、 lot k中的十二烷醇/十二烷基硫酸钠(mol/mol%)为2%以下,相对于此,lot e、 lot f、lot g的十二烷醇/十二烷基硫酸钠(mol/mol%)均为超过2%的值(表2)。
[0199]
[表2]
制剂lot在60℃下保存7天后制剂中的十二烷醇/十二烷基硫酸钠(mol/mol%)lote5.0%lotf3.0%lotg2.3%
loth0.4%loti0.8%lotj0.5%lotk定量限以下
根据十二烷基硫酸钠的分解机制,认为通过分解而产生的十二烷醇/十二烷基硫酸钠(mol/mol%)与硫酸根离子/十二烷基硫酸钠(mol/mol%)相等。因此,由以上的结果判明了:对于在密闭系统中、于温度60℃下保存7天后的制剂,在检测到十二烷醇/十二烷基硫酸钠(mol/mol%)、或者硫酸根离子/十二烷基硫酸钠(mol/mol%)为超过2%的值的情况下,导致制剂的溶出性降低,会对制剂质量产生影响。
[0200]
实施例9:制剂中的十二烷基硫酸钠的分解的动力学特性的确认在实施例6中确认到:制剂中十二烷基硫酸钠的分解速度根据制剂批次而不同,确认了其分解的动力学特性。使用制剂lot a和lot b,在密闭系统中、于温度60℃下进行保存,按照实施例6所示的基于gc/ms的十二烷醇的测定方法,对于lot a对其保存前、保存4天、7天、8天、9天、12天、14天后的样品实施了十二烷醇的定量,对于lot b对其保存4天、7天、8天、9天、12天后的样品实施了十二烷醇的定量。
[0201]
其结果见图11。确认到:制剂lot a和lot b的直到检测到十二烷醇的时间不同,另外,十二烷醇生成后量加速增加。
[0202]
认为这些反映了:由制剂中的十二烷基硫酸钠的分解而产生硫酸,该硫酸成为催化剂而促进分解,其结果,十二烷基硫酸钠加速分解。
[0203]
产业实用性本发明用于筛选用于制造药物的药物用制剂原料十二烷基硫酸钠,或者用于包含十二烷基硫酸钠的组合物或药物的筛选、质量评价、制造等。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1