OGR1的用途的制作方法
本发明涉及医药技术领域,尤其涉及ogr1的用途。
背景技术:
传统的肿瘤治疗手段包括手术、放疗和化疗,在提高患者生存率和生存期限方面取得了重大进展。随着肿瘤分子生物学和免疫学的发展,肿瘤分子靶向治疗和免疫治疗逐渐成为肿瘤治疗的热点。其中肿瘤免疫治疗又称肿瘤生物治疗,是运用生物技术和生物制剂对从病人体内采集的免疫细胞进行体外培养和扩增后回输到病人体内,以激发和增强机体自身免疫功能,从肿瘤的源头加以控制,识别、杀伤肿瘤细胞,并对其进行毁灭性打击,从而成功预防肿瘤的复发和转移,达到治疗肿瘤目的的方法和技术。例如,靶向于b细胞淋巴瘤表面标志cd19的car-t细胞对血液系统b细胞淋巴瘤有很好的治疗效果,并于2017年通过美国fda审批。研究表明,pd1/pd-l1抑制剂显著抑制黑色素转移瘤的发生发展等。虽然这些基于t细胞的抗肿瘤免疫治疗方法取得了可喜进展,但仍有很多局限性,如:car-t细胞治疗对实体瘤疗效甚微,pd1/pd-l1广谱性差等。造成这些的很大部分原因在于肿瘤酸性微环境中抑制信号的结果,酸性的微环境会抑制t细胞的增殖和激活,表现为高亲和力的il-2受体cd25表达受损,影响细胞因子分泌和细胞周期的进展,从而减弱杀伤肿瘤作用。
ogr1(ovariancancergprotein-coupledreceptor1)作为质子感知g蛋白偶联受体(gpcr,gproteincoupledreceptor)家族的成员之一,可将细胞外酸转化为细胞内信号,并在ph值6.8处被完全激活。t细胞上高表达ogr1,但其在肿瘤微环境中对t细胞功能的影响仍属空白。因此,研究ogr1对t细胞抗肿瘤免疫的潜在作用,筛选有效的小分子抑制剂,将具有向临床治疗转化的积极意义。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供ogr1的用途,研究表明,ogr1功能缺失会促进cd4+、cd8+t细胞在肿瘤灶中的浸润,增强其增殖和迁移能力,调节肿瘤杀伤因子的分泌,具有提高抗肿瘤效果的作用。
根据本发明的一个方面,本发明提供了ogr1的用途,所述用途包括以下任一项:
1)在制备增强t细胞肿瘤杀伤能力的药物中的应用;
2)在制备增强t细胞抗肿瘤细胞因子分泌水平的药物中的应用;
3)在制备增强t细胞增殖能力的药物中的应用;
4)在制备增强t细胞迁移能力的药物中的应用;
5)在制备t细胞中的应用,所述t细胞具有以下性质:肿瘤杀伤能力强、抗肿瘤细胞因子分泌能力强、增殖能力强、迁移能力强;
6)在制备治疗肿瘤的药物中的应用。
进一步,所述细胞因子包括inf-γ、tnf、gramb。
进一步,所述t细胞为cd4+t细胞或cd8+t细胞。
根据本发明的另一个方面,本发明提供了一种药物,所述药物包括抑制ogr1的物质。
进一步,抑制ogr1的物质包括抑制ogr1表达或活性的物质。
更进一步,所述物质包括cre/loxp系统、flp/frt系统、dre/rox系统、锌指核酸内切酶技术、转录激活因子样效应核酸酶技术、crispr/cas9基因编辑系统、ngago-gdna基因编辑技术或rna干扰技术中使用的试剂。
根据本发明的又一个方面,本发明提供了一种t细胞,所述t细胞中ogr1表达或活性被抑制。
进一步,所述t细胞经过了肿瘤微环境的刺激。
根据本发明的又一个方面,本发明提供了一种体外制备t细胞的方法,所述方法包括:抑制t细胞中ogr1表达或活性;提取t细胞。
进一步,所述方法包括:利用cre/loxp系统、flp/frt系统、dre/rox系统、锌指核酸内切酶技术、转录激活因子样效应核酸酶技术、crispr/cas9基因编辑系统、ngago-gdna基因编辑技术或rna干扰技术抑制t细胞中ogr1表达或活性。
在本发明具体实施例中,抑制t细胞中ogr1表达或活性使用的cre/loxp系统。需要说明的是,本申请虽然仅仅记载了使用cre/loxp系统抑制t细胞中ogr1表达或活性,但并不代表其他抑制t细胞中ogr1表达或活性的方法不能用于本发明,本发明只是以cre/loxp系统作为抑制ogr1表达或活性的一种方法的例子来说明抑制ogr1表达或活性这一过程可以如何实现。
更具体地,所述方法包括:
1)抑制受试者的t细胞中ogr1表达或活性;
2)肿瘤微环境刺激;
3)提取t细胞。
优选地,受试者不患有肿瘤;优选地,所述受试者包括除人以外的哺乳动物。
进一步,肿瘤微环境刺激7天。
进一步,肿瘤微环境可通过植入肿瘤细胞创造,植入肿瘤细胞的方式包括皮下植入、原位移植、尾静脉注射。
进一步,提取t细胞的方式可以从血液中提取也可以从脾脏中提取,优选地,从血液中提取。
作为可替代的技术方案,所述方法包括:
1)抑制患有肿瘤的受试者的t细胞中ogr1表达或活性;
2)提取t细胞。
优选地,受试者包括哺乳动物。
举例来说,哺乳动物可以是以下任何物种:家养宠物,如小鼠、大鼠、沙鼠、兔子、天竺鼠、仓鼠、猫或狗;或家畜,如山羊、绵羊、猪、牛或马。在本发明的另外一个优选实施例中,受试者可以是灵长类动物,如猴、长臂猿、大猩猩、猩猩(orang-utang)、黑猩猩或倭黑猩猩(bonobo)。在本发明的一个优选实施例中,受试者是人类。
进一步,提取t细胞的方式可以从血液中提取也可以从脾脏中提取,优选地,从血液中提取。
进一步,本发明的制备的t细胞是cd4+t细胞或cd8+t细胞。
根据本发明的又一个方面,本发明提供了根据前面所述的方法制备而成的t细胞。
根据本发明的又一个方面,本发明提供了前面所述的t细胞在制备治疗肿瘤的药物中的应用。
本发明所述的肿瘤包括先不限于黑色素瘤、膀胱癌、血癌、骨癌、脑癌、乳腺癌、中枢神经系统癌症、宫颈癌、结肠癌、子宫内膜癌、食管癌、胆囊癌、胃肠道癌、外生殖器癌、泌尿生殖道癌、头癌、肾癌、喉癌、肝癌、肺癌、肌肉组织癌症、颈癌、口腔或鼻黏膜癌、卵巢癌、胰腺癌、前列腺癌、皮肤癌、脾癌、小肠癌、大肠癌、胃癌、睾丸癌、甲状腺癌。
在本发明的具体实施方案中,本发明的肿瘤是黑色素瘤。
本发明的药物还包括药学上可接受的载体。
药学上可接受的载体可以是任何常规使用的那些且仅由化学-物理的考虑(例如溶解度和与活性试剂的反应性的缺失)和给药方式限制。在此描述的所述药学上可接受的载体,例如,载体,佐剂,赋形剂和稀释剂对那些本领域技术人员公知的并且公众容易获得。优选所述药学上可接受的载体为对活性试剂为化学惰性的载体和在使用条件下无有害副作用或毒性的载体。
载体的选择将部分由具体的本发明的药物以及由用于施用本发明的药物的具体方法决定。因此,存在多种合适的本发明的药物的制剂。合适的制剂可以包括用于肠胃外、皮下、静脉内、肌肉内、动脉内、鞘内、瘤内或腹膜内施用的那些制剂中的任何制剂。可以使用多于一种途径来施用本发明的药物,并且在某些情况下,特定途径可以比另一途径提供更直接以及更有效的应答。
优选地,通过注射,例如静脉内施用本发明的药物。用于注射的药学可接受的载体可以包括任何等张载体,如例如生理盐水(含约0.90%w/vnacl的水,含约300mosm/lnacl的水,或者每升水约9.0gnacl)、normosolr电解质溶液(abbott,chicago,il)、plasma-lytea(baxter,deerfield,il)、含约5%葡萄糖的水或者乳酸林格氏液。在实施方案中,用人血清白蛋白补充药学可接受的载体。
本发明的药物还可包括与本发明的t细胞联合施用的其它药学活性剂或药物,其它药学活性剂或药物包括但不限于沙利度胺、顺铂(顺-ddp)、奥沙利铀、卡铂、蒽二酮类、米托蒽醌;羟基脲、甲基肼衍生物、甲基苄肼(n-甲基肼,mih)、肾上腺皮质抑制剂、米托坦(〇,p’-ddd)、氨鲁米特、rxr激动剂、贝沙罗汀、酪氨酸激酶抑制剂、舒尼替尼、伊马替尼、氮芥、环磷酰胺、异环磷酰胺、美法仑(l-溶肉瘤素)、苯丁酸氮芥、乙撑亚胺类、甲基三聚氰胺类、六甲三聚氰胺、噻替昵、白消安、卡莫司汀(bcnu)、司莫司汀(甲基-ccnu)、洛莫司汀(ccnu)、链脲霉素(链脲佐菌素)、dna合成拮抗剂、磷酸雌莫司汀、三嗪、氮烯唑胺(dtic,二甲基-三氮烯咪唑氨甲酰)、替莫唑胺、叶酸类似物、甲氨喋呤(氨甲喋呤)、嘧啶类似物、氟尿嘧啶(5-氟尿嘧啶、5-fu、5fu)、氟尿苷(氟尿嘧啶脱氧核苷,fudr)、阿糖胞苷(胞嘧啶阿拉伯糖苷)、吉西他滨、嘌呤类似物、巯基嘌呤(6-巯基嘌呤,6-mp)、硫鸟嘌呤(6-硫鸟嘌呤,tg)、喷司他丁(2’-脱氧助间霉素、脱氧助间霉素)、克拉屈滨和氟达拉滨、拓扑异构酶抑制剂、安丫啶、长春花生物碱、长春花碱(vlb)、长春新碱、紫杉烷类、紫杉醇、蛋白结合的紫杉醇(abraxane)、多西紫杉醇(泰素帝);表鬼臼毒素类、依托泊苷、替尼泊苷、喜树碱类、托泊替康、伊立替康、更生霉素(放线菌素d)、道诺霉素(柔红霉素、红比霉素)、阿霉素、博来霉素、丝裂霉素(丝裂霉素c)、去甲氧基柔红霉素、表柔比星、布舍瑞林、肾上腺皮质类固醇、泼尼松、黄体酮类、己酸羟基孕酮、醋酸甲羟孕酮、醋酸甲地孕酮、己烯雌酚、炔雌醇、他莫昔芬、阿那曲唑、丙酸睾酮、氟甲睾酮、氟他胺、比卡鲁胺、硼替佐米、亮丙瑞林。
当将本发明的t细胞药物与一种或多种另外的治疗剂一起施用时,一种或多种另外的治疗剂可以共施用至哺乳动物。“共施用”意为在时间上足够接近地施用一种或多种另外的治疗剂和本发明的t细胞药物,以使本发明的t细胞药物可以增强一种或多种另外的治疗剂的作用,反之亦然。就这点而言,可以首先施用本发明的t细胞,之后施用一种或多种另外的治疗剂,反之亦然。可选地,可以同时施用本发明的t细胞药物和一种或多种另外的治疗剂。
本文的术语“治疗”是指递送有效量的该制剂以达成预防任何症状或疾病病况产生的目的或达成预防或延迟进展、减轻、改善或消除已产生的此类症状或疾病病况的目的。因此,术语“治疗”旨在包括治疗如下个体的程度最小或不可检测的疾病,该个体(i)在第一治疗之后有部分反应或完全反应,(ii)有所缓解,(iii)罹患可检测的疾病,或(iv)患有恶性疾病前兆。
本发明的优点和有益效果:
本发明结合体内和体外多层次实验发现,ogr1功能抑制能显著增强cd4+t、cd8+t细胞在实体肿瘤中的浸润,提高其增殖、迁移和抗肿瘤细胞因子的分泌。其可作为t细胞抗肿瘤免疫潜在的治疗靶位点。
附图说明
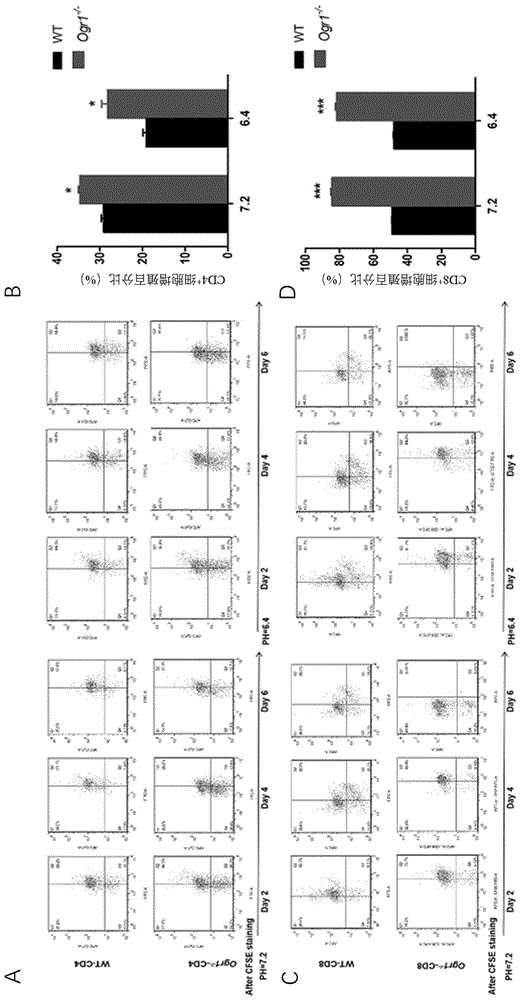
图1显示在不同酸度环境下ogr1敲除对cd4+t、cd8+t细胞的增殖能力影响的结果图,其中a:cd4+t细胞流式细胞图;b:cd4+t细胞在第6天的统计图;c:cd8+t细胞流式细胞图;d:cd8+t细胞在第6天的统计图;
图2显示在不同酸度环境下ogr1敲除对cd4+t、cd8+t细胞的迁移能力影响的结果图,其中a:cd4+t细胞;b:cd8+t细胞;
图3显示在不同酸度环境下ogr1敲除对cd4+t、cd8+t细胞的肿瘤杀伤能力影响的结果图,其中a:细胞实物图;b:与cd4+t细胞共培养的统计图;c:与cd8+t细胞共培养的统计图;
图4显示在不同酸度环境下ogr1敲除对cd4+t、cd8+t细胞细胞因子分泌能力影响的结果图,其中a:cd4+t/inf-γ;b:cd4+t/tnf;c:cd4+t/gramb;d:cd8+t/inf-γ;e:cd8+t/tnf;f:cd8+t/gramb;
图5显示ogr1敲除对效应t细胞基因表达影响的结果图;
图6显示ogr1缺失对过继回输t细胞的抗肿瘤效果影响的结果图,其中,a:实验方案图;b:肿瘤体积随时间变化的曲线图;c:荷瘤后第21天肿瘤体积统计图;d:荷瘤后第21天肿瘤重量统计图;f:肿瘤实物图;
图7显示cd4+t、cd8+t细胞特异性敲除ogr1后对其抗肿瘤能力影响的结果图,其中,a:实验方案图;b:ogr1表达量统计图;c:肿瘤体积随时间变化曲线图;d:荷瘤后第17天肿瘤重量统计图;f:肿瘤实物图。
具体实施方式
本发明提供了ogr1的用途,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本发明采用的试材皆为普通市售品,皆可于市场购得。本发明未详细披露的实验方案均为本领域常规的实验步骤。
下面结合实施例,进一步阐述本发明:
实施例1体外探究ogr1敲除对cd4+t、cd8+t细胞功能的影响
分别将cd4-cre、cd8-cre小鼠与ogr1flox/flox小鼠杂交,构建cd4+t、cd8+t细胞中特异性敲除ogr1的小鼠(ogr1flox/floxcd4cre+/-,ogr1flox/floxcd8cre+/-)。取小鼠中的cd4+t、cd8+t细胞利用qpcr方法检测ogr1基因的相对表达量,图7b的结果显示ogr1基因敲除成功。以野生型小鼠作为对照,体外探究ogr1敲除对cd4+t、cd8+t细胞功能的影响。具体如下:
1、在皮下荷b16黑色素瘤刺激后7天,提取野生型小鼠和ogr1敲除小鼠脾中cd4+t、cd8+t细胞,分别在ph7.2和ph6.4的环境中进行体外培养,检测t细胞的增殖能力(csfe染色流式细胞术检测)。结果如图1,表明ogr1敲除增强了cd4+t、cd8+t细胞的增殖能力。
2、在皮下荷b16黑色素瘤刺激后7天,提取野生型小鼠和ogr1敲除小鼠脾中cd4+t、cd8+t细胞,分别在ph7.2和ph6.4的环境中进行体外培养,检测t细胞的细胞迁移能力(transwell),结果如图2,结果表明ogr1敲除增强了cd4+t,cd8+t细胞的迁移能力。
3、在皮下荷b16黑色素瘤刺激后7天,提取野生型小鼠和ogr1敲除小鼠脾中cd4+t、cd8+t细胞后与b16黑色素瘤细胞行体外共培养,检测t细胞对肿瘤细胞的杀伤能力(cck8检测法),结果如图3,表明ogr1敲除增强了cd4+t、cd8+t细胞的肿瘤杀伤能力。
4、在皮下荷b16黑色素瘤刺激后7天,提取野生型小鼠和ogr1敲除小鼠脾中cd4+t、cd8+t细胞后与b16黑色素瘤细胞行体外共培养,取上清检测细胞因子分泌的情况。结果如图4和图5,表明ogr1敲除提高了cd4+t、cd8+t细胞分泌gramb、inf-γ、tnf的能力。
实施例2ogr1缺失对过继回输t细胞抗肿瘤效果的影响
分别将cd4-cre、cd8-cre小鼠与ogr1flox/flox小鼠杂交,构建cd4+t、cd8+t细胞中特异性敲除ogr1的小鼠(ogr1flox/floxcd4cre+/-,ogr1flox/floxcd8cre+/-)。取小鼠中的cd4+t、cd8+t细胞利用qpcr方法检测ogr1基因的相对表达量,图7b的结果显示ogr1基因敲除成功。
以免疫系统健全的c57小鼠造模,造模细胞为b16黑色素瘤,造模位置为皮下注射实体瘤模型及尾静脉注射肺转移瘤模型。所得荷瘤小鼠分成五组,每组4只,正常饮食,各组给药情况为:
对照组:不给予药物;
过继回输ogr1flox/flox小鼠的cd4+t细胞,记为ogr1-/-cd4+;
过继回输ogr1flox/flox小鼠的cd8+t细胞,记为ogr1-/-cd8+;
过继回输野生c57小鼠的cd4+t细胞,记为wtcd4+tcell(或wtcd4);
过继回输野生c57小鼠的cd8+t细胞,记为wtcd8+tcell(或wtcd8);
观察小鼠皮下荷瘤观察肿瘤生长情况,结果如图6,表明ogr1缺失会增强过继回输t细胞的抗肿瘤效果。
实施例3动物模型研究cd4+t、cd8+t细胞特异性敲除ogr1后的抗肿瘤效果
分别将cd4-cre、cd8-cre小鼠与ogr1flox/flox小鼠杂交,构建cd4+t、cd8+t细胞中特异性敲除ogr1的小鼠(ogr1flox/floxcd4cre+/-,ogr1flox/floxcd8cre+/-),实验方案见图7a。取小鼠中的cd4+t、cd8+t细胞利用qpcr方法检测ogr1基因的相对表达量,图7b的结果显示ogr1基因敲除成功。
以免疫系统健全的c57小鼠作为对照,在皮下植入b16黑色素瘤,构建野生型荷瘤小鼠模型,记为wt,
在cd8+t细胞被敲除ogr1的小鼠皮下植b16黑色素瘤,构建荷瘤小鼠模型,记为ogr1flox/floxcd8cre+/-;
在cd4+t细胞被敲除ogr1的小鼠皮下植入b16黑色素瘤,构建荷瘤小鼠模型,记为ogr1flox/floxcd4cre+/-。
观察各组小鼠肿瘤生长情况,荷瘤造模17天后小鼠处死,瘤体称重。结果如图7c、d、f所示,相比未敲除的小鼠,cd4+t、cd8+t细胞中特异性敲除ogr1的小鼠肿瘤体积和肿瘤重量均显著减少,表明cd4+t、cd8+t细胞特异性敲除ogr1后抗肿瘤能力增强。
需要说明的是,虽然本申请使用的是从脾脏中获取cd4+t、cd8+t细胞进行的实验,但是本领域技术人员熟知,血液中的cd4+t、cd8+t细胞均来源于脾脏,故血液来源的cd4+t、cd8+t与脾脏来源的cd4+t、cd8+t细胞性质相同,能获得同样的实验结果此处不再赘述。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!