Rucaparib的高剂量强度片剂的制作方法
相关申请本申请是2015年8月17日提交的、发明名称为“rucaparib的高剂量强度片剂”的中国专利申请201580042815.9的分案申请。本申请要求于2014年8月22日提交的美国临时申请系列号62/040,849和于2015年1月9日提交的美国临时申请系列号62/101,739的优先权,将其二者以其整体援引加入本文。本公开一般性地涉及rucaparib的片剂,并且更具体地涉及rucaparib的高剂量强度片剂。
背景技术:
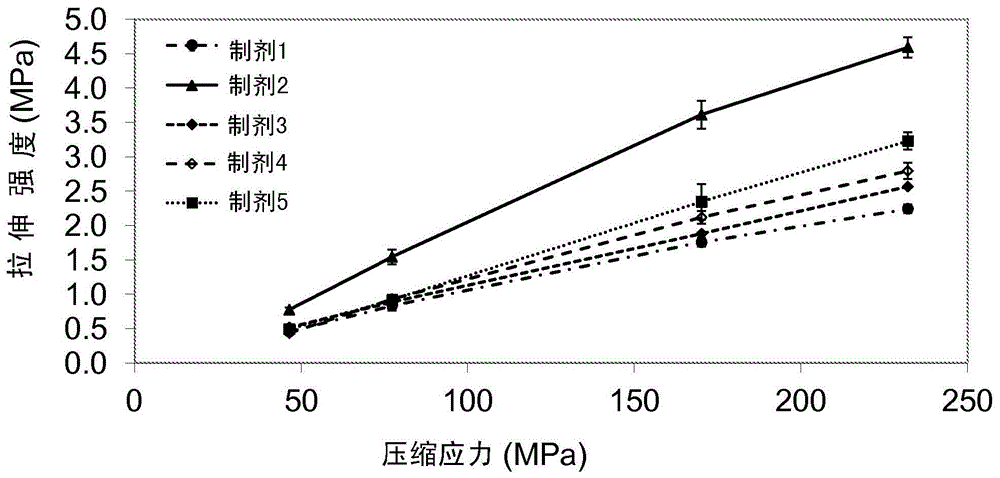
:化合物8-氟-2-{4-[(甲基氨基)甲基]苯基}-1,3,4,5-四氢-6h-氮杂并[5,4,3-cd]吲哚-6-酮(“rucaparib”)是聚(adp-核糖)聚合酶(parp)的小分子抑制剂。rucaparib及其制备方法在例如第6,495,541号和第7,323,562号美国专利中记载。第6,495,541号美国专利记载了一般的rucaparib的盐和一般的固体剂型(第9栏,第7-61行),其宽剂量范围以mg/kg体重的形式表示(第26栏,第7-20行)。剂量负荷(即制剂的药物含量百分比)的问题没有被解决。在第7,351,701号、第7,351,530号和第7,268,126号美国专利以及第2004-0248879号美国专利申请公布中公开了rucaparib的某些盐和多晶型物。第7,351,701号和第7,351,530号美国专利记载了rucaparib的磷酸盐的用途。它们一般性地提到所有剂型,包括片剂(‘701专利,第6栏,第48-57行;‘530专利,第6栏,第30-38行),但唯一的实施例是未指定含量的液体制剂。另外,剂量负荷的问题没有被解决,实际上它阐述“仅需要非常低的剂量...”(‘701专利,第6栏,第21-24行;’530专利,第6栏,第3-6行)。公布的申请2004-0248879记载了rucaparib的磷酸盐和葡糖醛酸盐,并一般地记载了其固体剂型(第0035-0036段),以mg/kg体重的形式记载剂量(第0036段)。没有举例说明或记载具体制剂,并且没有解决剂量负荷的问题。第8,754,072号美国专利(“‘072专利”)公开了rucaparib马来酸盐和rucaparib樟脑磺酸盐(camsylate)的固体剂型。‘072专利阐述在适合用于与活性成分一起使用的药学上可接受的反荷离子中,发现与其它盐形式相比,rucaparib的马来酸盐和樟脑磺酸盐为较不吸湿性的(第11栏,第45-49行),“使得它们在固体剂型的制备中是特别合适的”(第11栏,第49-50行)。另外,发现rucaparib的马来酸盐和樟脑磺酸盐比其它盐形式更容易制备和分离(第11栏,第51-53行)。所述‘072专利非常宽泛地阐述所述组合物“通常会含有约0.001重量%至约99重量%的任意含量的活性成分”,优选范围是约0.01%至约5%和约0.01%至2%(第36栏,第41-47行)。还公开了含有10%-25%活性成分的实施方案(第3栏,第65行-第4栏,第9行;第5栏,第60行-第6栏,第4行)。制剂的唯一实施例(实施例13)涉及包含17.18%的所述樟脑磺酸盐的制剂。因而,‘072专利并没有具体地解决高剂量rucaparib制剂的问题,并且实际上,如上文讨论的现有技术一样,教导了较低的剂量负荷(即25%以下)是优选的。口服rucaparib樟脑磺酸盐的临床开发从较低强度(40mg和60mg)的片剂开始。随着个体剂量要求增加,采用32%药物负荷和干法制粒制备方法,开发了120mg的较高剂量强度。需要对较低强度进行制剂修改以制备120mg片剂,这表明显著高于32%的药物负荷难以用干法制粒方法实现。rucaparib的临床研究表明对活性成分的高单位剂量(200mg-800mg)的需求。为了便于口服给药,片重通常不应超过800mg。由于每个剂量所需的片剂的数目可导致顺应性问题,找到导致每个剂量需要更少的片剂,从而有改善的患者顺应性的期望的可商业上制备的制剂会是期望的。因而,需要开发含有rucaparib盐的片剂剂型,其1)具有合适的大小以允许患者容易吞服所述片剂,2)具有rucaparib的高负荷,以使每个剂量所需的片剂数目最小化,3)就rucaparib从片剂的释放而言具有合适性质,和4)具有导致期望效果的药物性能。在一些实施方案中,所述剂型可为胶囊剂。低药物负荷制剂的总体物理性质和可制造性主要由制剂的无活性成分或赋形剂决定。然而,在高药物负荷下,活性药物成分(“api”)的物理性质对制剂的可制造性的贡献变为主要的。并非所有api都具有对于为了使用干法制粒方法得到高负荷片剂所需的可压性而言必须的性质。大多数小分子api可以低剂量形式配制,因为在制剂中利用的赋形剂的物理性质主导了固体组合物的性质,而不是由api本身的物理性质主导。随着药物负荷增加,药物物质的物理化学特性在片剂制备过程中变得越来越主导。通常在单个制剂中包含具有脆性特性的填充剂赋形剂和具有可延展/可塑特性的填充剂赋形剂。在给定制剂中脆性和可塑性类型材料的组合对于该制剂的“可制造性”而言是重要的。然而,由于api可具有宽范围的物理性质并且不是基于这些物理性质选择的,因此不会预期特定api会具有对于可制造性和稳定性而言有利地贡献于总体制剂的物理性质。实际上,就是api的物理性质实际上给制备可行制剂造成最大障碍并非不常见。因此发现api可在超过45%的药物负荷的干法制粒制备方法中配制是令人惊奇且预料不到的。实际上,以前的经验教导,可能不可以显著超过32%的剂量负荷制备rucaparib的制剂。可以使用如下文所述的干法制粒方法以超过45%的药物负荷制备rucaparib樟脑磺酸盐片剂是惊人惊奇的发现,其可归因于rucaparib的樟脑磺酸盐的独特物理化学特性。在本发明中,由于rucaparib樟脑磺酸盐的独特和出乎预料的物理化学特性,不需要脆性填充剂赋形剂。如吸湿性和易于制备性,形成活性成分的高剂量形式的能力也可取决于药物的具体盐形式。但是,在低剂量负荷下的吸湿性和易于制备性不预示对于高剂量制剂的适合性。这在下文由本文中呈现的数据证实,所述数据表明rucaparib的马来酸盐(在低剂量制剂中表现出有利的吸湿性和制备性质)不可在干法制粒制备方法中配制为高剂量形式。在本案中,发明人令人惊讶地发现,基于众多物理化学性质(诸如吸湿性、脆性性能和结晶性质)适合用于干法制粒制备的盐形式中仅一种也具有对于高剂量制剂适合的物理性质-即樟脑磺酸盐。技术实现要素:本发明涉及rucaparib的高剂量强度片剂。在一些实施方案中,所述片剂包含45-90%w/w的rucaparib樟脑磺酸盐。在一些实施方案中,所述干法制粒片剂包含45-90%w/w的rucaparib樟脑磺酸盐。一个这样的实施方案是包含至少200mgrucaparib的片剂。另一实施方案是包含至少300mgrucaparib的片剂。在一些实施方案中,治疗由聚(adp-核糖)聚合酶活性介导的哺乳动物疾病病况的方法包括向需要其的哺乳动物给药治疗有效量的rucaparib的高剂量强度片剂。在一些实施方案中,治疗哺乳动物中的癌症的方法包括向所述哺乳动物给药治疗有效量的rucaparib的高剂量强度片剂。附图简述图1显示从在给定的压缩应力下可达到的拉伸强度来看,表1中制剂1-5的关系。图2显示表1中制剂1-5在给定固相分数下的拉伸强度。图3显示表1中制剂1-5在给定压缩应力下的拉伸强度。图4显示表1中片剂制剂3-5的溶出结果。图5显示300mg最终片剂掺合物和供料架样品的粒度分布。图6a-c显示压缩特性相对于硬脂酸镁水平评价。图7显示rucaparib樟脑磺酸盐和马来酸盐60%和75%负荷的制剂的可压片性。图8显示颗粒内rucaparib樟脑磺酸盐制剂的可压片性。图9显示颗粒内rucaparib樟脑磺酸盐制剂的紧实性。图10显示颗粒内rucaparib樟脑磺酸盐制剂的可压性。图11显示颗粒内rucaparib马来酸盐制剂的可压片性。图12显示颗粒内rucaparib马来酸盐制剂的紧实性。图13显示颗粒内rucaparib马来酸盐制剂的可压性。具体实施方式尽管上文已经总结了某些实施方案的多个方面和特征,以下详细描述更详细地说明数个示例性实施方案以使本领域技术人员能够实施这样的实施方案。所描述的实施例为了说明目的而提供,并且不意图限制本发明的范围。在以下描述中,为了解释的目的,阐述众多具体细节以提供所描述的实施方案的彻底理解。然而,本领域技术人员会明白,在没有这些具体细节中的一些的情况下可以实施本发明的其它实施方案。除非另有说明,在本文中用于表达量、尺寸以及如此使用的所有数字应当理解为在所有情况下被术语“约”修饰。在本申请中,使用单数的包括复数,除非另外特别说明,并且使用的术语“和”和“或”意指“和/或”,除非另外指出。此外,使用的术语“包含/包括(including)”以及其它形式诸如“包含/包括(includes)”和“包含/包括(included)”应认为是非封闭式的。与rucaparib的其它盐相比,rucaparib樟脑磺酸盐具有低吸湿性,同时保留了期望的物理化学特性,例如,多晶型控制和水溶性。请求保护的盐的低吸湿性是商业上重要的性质,因为它非常便于用于口服给药的rucaparib的固体剂型的生产,所述口服给药对于接受rucaparib治疗的患者而言是非常期望的。令人惊奇地发现,除了它的低吸湿性以外,rucaparib樟脑磺酸盐是就可压性而言具有有益性质的盐,并且可以45%w/w或更高的负荷制备其片剂。这意味着本发明提供可具有如此高含量的rucaparib,使得可以在1个、2个或3个片剂中提供所需的每日剂量的片剂。在一些实施方案中,所述片剂包含45-90%w/w的rucaparib樟脑磺酸盐,例如,50-90%w/w、55-90%w/w、60-90%w/w、65-85%w/w或70-80%w/w的rucaparib樟脑磺酸盐。在一些实施方案中,所述片剂包含至少300mgrucaparib,例如,至少350mg、至少400mg、至少450mg、至少500mg或至少550mgrucaparib。在一些实施方案中,所述片剂包含至少200mgrucaparib,例如,至少250mg、至少300mg或至少350mgrucaparib。为了得到期望的药物性能,片剂必须在合适的时间范围中释放rucaparib樟脑磺酸盐。在一些实施方案中,当根据uspiipaddles在0.01nhcl中和在75rpm下测试时,所述片剂在30min内释放至少95%w/w的所述片剂中包含的rucaparib樟脑磺酸盐。在另一个实施方案中,当根据uspiipaddles在0.01nhcl中和在75rpm下测试时,所述片剂在15min内释放至少95%w/w的所述片剂中包含的rucaparib樟脑磺酸盐。在另一个实施方案中,当根据uspiipaddles在0.01nhcl中和在75rpm下测试时,所述片剂在10min内释放至少95%w/w的所述片剂中包含的rucaparib樟脑磺酸盐。所述片剂可以包含一种或多种药学上可接受的赋形剂、载体或稀释剂/填充剂。可使用表面活性剂、稀释剂、甜味剂、崩解剂、粘合剂、润滑剂、助流剂、着色剂、调味剂、稳定剂、其混合物等。填充剂包括可延展性填充剂和脆性填充剂,并且包括但不限于甘露醇、山梨糖醇、木糖醇、微晶纤维素、硅化微晶纤维素、羟丙基甲基纤维素、羟丙基纤维素、短梗霉聚糖和快速溶解的碳水化合物诸如pharmabursttm、其混合物等。可延展性填充剂在临界应力后产生并开始可塑地变形。可延展性填充剂经常产生低孔隙率的片剂,因为高度的塑性变形使得颗粒能移动得彼此非常靠近。脆性填充剂在特定应力值下破碎成较小的单元。脆性填充剂的破碎导致较小颗粒的增加。经历广泛破碎的脆性填充剂通常产生相对较高孔隙率的片剂,因为产生的大量结合点阻止进一步体积减小。由于rucaparib樟脑磺酸盐是相当脆性的,在一些实施方案中,使用可延展性赋形剂(例如微晶纤维素)作为主要填充剂而无脆性填充剂。助流剂是但不限于二氧化硅、胶体二氧化硅、硅酸钙、硅酸镁、三硅酸镁、滑石粉、淀粉、其混合物等。润滑剂是但不限于硬脂酸钙、单硬脂酸甘油酯、山嵛酸甘油酯、棕榈硬脂酸甘油酯、六方氮化硼、氢化植物油、轻矿物油、硬脂酸镁、矿物油、聚乙二醇、泊洛沙姆、苯甲酸钠、月桂基硫酸钠、硬脂酰富马酸钠、硬脂酸、滑石粉、硬脂酸锌、其混合物等。崩解剂是但不限于淀粉羟乙酸钠、羧甲基纤维素钠、羧甲基纤维素钙、交联羧甲纤维素钠、交聚维酮、壳聚糖、琼脂、海藻酸、藻酸钙、甲基纤维素、微晶纤维素、粉状纤维素、低级烷基取代的羟丙基纤维素、羟丙基淀粉、低取代的羟丙基纤维素、波拉克林钾、淀粉、预胶化淀粉、海藻酸钠、硅酸镁铝、波拉克林钾、聚维酮、淀粉羟乙酸钠、其混合物等。在一些实施方案中,所述片剂包含5-50%w/w填充剂,例如,5-45%w/w、5-40%w/w、5-35%w/w、5-30%w/w、10-25%w/w或15-20%w/w填充剂。在一些实施方案中,所述填充剂基本上由可延展性填充剂组成。在一些实施方案中,所述片剂包含1-20%崩解剂,例如,1-15%w/w、1-10%w/w、2-9%w/w、3-8%w/w、4-7%w/w或5-7%w/w崩解剂。在一些实施方案中,所述片剂包含0.20-2.5%w/w润滑剂,例如,0.2-2.0%w/w、0.2-1.8%w/w、0.2-1.5%w/w或0.25-1.5%w/w润滑剂。在一些实施方案中,所述片剂包含0-1%w/w助流剂,例如,0.25-0.75%w/w或0.25-0.50%w/w助流剂。干法制粒是公知的药物制备方法。一般而言,将api与赋形剂和润滑剂合并,然后压紧以形成团块。通常然后将该团块捣碎或研磨,然后过筛以得到期望大小的颗粒。然后将颗粒状产物压缩为片剂,装入胶囊中或以常规方式形成单位剂型。在一些实施方案中,通过该方法制备高剂量rucaparib片剂。在其它实施方案中,将包含高剂量rucaparib的颗粒状产物装入胶囊中或形成为单位剂型。压紧为团块通过常规设备实现。通常,使掺合的api和赋形剂穿过辊压机或chilsonator设备进行压紧。但是,对于其它压紧方式(例如压紧为小块(或“猛击”)),任选地使用api/赋形剂掺合物。再将其捣碎或研磨,然后任选地过筛以生成期望大小的颗粒。包含rucaparib樟脑磺酸盐的干法制粒组合物被定义为干法制粒方法的产物。干法制粒组合物包括干法制粒的直接产物,即干燥颗粒本身,以及从这样的颗粒制备的产物,包括片剂、胶囊剂、栓剂和其它药物剂型。所述片剂可通过包括下述步骤的干法制粒来制备:i)制备包含rucaparib樟脑磺酸盐的混合物,ii)通过辊压机压紧在步骤(i)中获得的混合物以形成压紧物(comprimate),iii)将在步骤(ii)中得到的压紧物转化为颗粒,iv)任选地将在步骤(iii)中得到的颗粒与药物赋形剂混合,以及v)将在步骤(iii)中得到的颗粒或在步骤(iv)中得到的混合物进行压缩以得到片剂。实施例实施例1:颗粒内(intragranular)制剂的评价颗粒内意指这些成分存在于干燥颗粒结构内。颗粒外(extragranular)意指所述物质位于颗粒结构外部。表1总结了已评价的颗粒内制剂。制剂1和2被认为是最好和最坏情况方案,其中制剂1是纯的100%rucaparib樟脑磺酸盐api,并且制剂2用于制备120mga制剂。制剂3和4被设计成观察不同水平的可延展性填充剂和脆性填充剂,并且制剂5是增加的片剂大小以评价负荷影响。制剂3-5都加入了胶态二氧化硅(cab-o-sil)以辅助颗粒内掺合物的流动性。表1.颗粒内制剂图1显示从对于给定压缩应力可实现的拉伸强度看各制剂的关系。在旋转式压片机上被认为在正常范围内的最大可接受力是大约250mpa。片剂的常见目标拉伸强度是2mpa;这样的片剂通常具有低脆碎度,并且对于下游处理和薄膜包衣而言是合适的。因而,如果给定的制剂可以在小于250mpa的压缩应力下压缩至2mpa的拉伸强度,认为它具有可接受的可压性。制剂3-5具有可接受的可压性,并且与单独的api相比是改善的。尽管可以制备具有可接受的可压性的制剂,但优选维持较低的压缩力,同时仍然能够达到目标拉伸强度,因为这会对api、原料和环境变化提供更多的耐用性并且对压片设备和模具提供更少的磨损。制剂3-5实现了这种平衡。图2和3提供与rucaparib樟脑磺酸盐的制剂的固相分数有关的信息。确保片剂具有有效的孔隙率,使得流体具有有效地移入片剂中并激活崩解的机会是重要的。所有测试的制剂具有对于所述目标拉伸强度而言可接受的固相分数,并且在包含api和赋形剂的片剂的范围内。实施例2:高剂量制剂的崩解和溶出制备来自制剂3-5的小规模批次的片剂,并针对崩解和溶出进行测试。使用小规模基于猛击的干法制粒和片剂压缩技术制备片剂。将小块在大约0.3mpa的相对低的拉伸强度下压紧以使对最终片剂可压性的潜在影响最小化,使用研钵/研棒和20目筛技术研磨,并与0.5%cab-o-sil和0.25%硬脂酸镁(作为颗粒外赋形剂加入)进行最终掺合。表2为制备成片剂的制剂以及相应的拉伸强度和硬度的总结。表2.对于相关的拉伸强度和硬度评价的制剂表3显示来自用0.01nhcl(ph=2.0)作为崩解介质的usp崩解设备的崩解结果。图4显示在uspii型溶解设备中实施的片剂制剂3-5的溶出结果图。溶出条件是:0.01nhcl(ph=2.0),uspiipaddles,75rpm,japanesesinkers。制剂3-5快速地和完全地崩解和溶解。表4显示在15min、30min和60min的溶出结果表。表3.制剂3-5的崩解结果(用0.01nhcl(ph=2.0)介质的usp崩解设备)制剂3制剂4制剂5崩解时间(秒)151415拉伸强度(mpa)2.062.052.00表4.制剂3-5的溶解百分比实施例3:最终片剂掺合物和供料架样品的粒度分布图5显示制剂4和供料架样品(在运行结束时)的300mg最终片剂掺合物的粒度分布。粒度分布对于材料处理和流动而言是期望的。压片机的供料架在加工过程中没有显著地改变最终掺合物的粒度。实施例4:润滑剂水平对可压性的效果图6a-c显示颗粒内硬脂酸镁水平评价。用不同水平的硬脂酸镁制备的颗粒内掺合物的所有压缩特性具有可接受的性能。具有实线的框代表用于碾压的目标拉伸强度的典型范围以及相关的压缩应力和固相分数。具有虚线的框代表用于压片的目标拉伸强度的典型范围以及相关的压缩应力和固相分数。含有不同水平的硬脂酸镁的所有颗粒内掺合物在小于150mpa压缩应力下具有可接受的可实现的拉伸强度值。实施例5:片剂a方法使用表6-8中的条件根据表5中的配方制备10-kg批次。使用在表6中列出的参数通过在gerteisminipactor上碾压来压紧掺合物。然后,使用在表7中列出的参数将压紧的掺合物制粒。然后,将粒化的掺合物使用在表8中列出的参数在压片机上压片至约700mg的目标重量。表5.片剂a的组成表6滚筒设计光滑/光滑具有侧缘是目标固相分数0.70-0.75拉伸强度(mpa)0.2-0.4压缩力(kn/cm)6滚筒速度(rpm)2压紧/进料比率(%)160-200间隙宽度(mm)2表7表8模具0.3183x0.6367m.o.片重700mg目标硬度23kp拉伸强度(mpa)~2.05压缩力(kn)22进料机速度(rpm)15-20转动架速度(rpm)20实施例6:评价rucaparib樟脑磺酸盐和rucaparib马来酸盐的片剂可压性性质对低剂量rucaparib片剂的研究已经表明,rucaparib樟脑磺酸盐和rucaparib马来酸盐具有众多在固体剂型中可能有用的物理化学性质。然而,之前的工作表明,高于32%api的剂量负荷难以达到或不能达到。本实施例为就用于制备高api-负荷片剂的干法制粒方法而言对rucaparib樟脑磺酸盐和rucaparib马来酸盐的可压性性质的评价。目的是鉴别具有适合用于干法制粒压片的高剂量形式的性质的rucaparib的盐形式。最相关的和被广泛地接受的评估不同制剂(和不同api盐)的压缩评价的方法是,使用压片模拟器测量压缩应力、固相分数和拉伸强度的相互关系。这些参数在被称作可压性、可压片性和紧实性特性(即,ctc特性)的一组关系中彼此相关(tye,sun,amidon,j.pharm.sci,94:465-472,(2005))。关注焦点在于颗粒内掺合物而不是最终掺合物,因为几乎所有的先导制剂都是通过干法制粒处理;仅小部分是颗粒外的。另外,小规模的颗粒外润滑步骤不能代表下游中试(pilot)或商业加工并且具有掩蔽固有可压性性质的风险。对于所提供的各盐形式批次,以在最终片剂制剂的100%、90%、75%和60%下(这与100%、90.68%、75.57%和60.45%的颗粒内组分关联)评价制剂。表10总结了所评价的制剂。在api的不同负荷下评价了rucaparib的两种盐形式,其包括各自的一种制剂,由此测试纯api。如下测定各api和制剂的ctc特性:一式三份地在5mm/秒的速度下使用线性锯齿应变(strain)特性压缩(texturetechnologiesmodelta.xtplustextureanalyzer)1/4″圆平面100mg压紧物至4个预先程序化的峰力(涵盖碾压和压片压缩应力范围(例如,直至~240mpa))。然后针对物理尺寸、重量和硬度评价压紧物。从这些数据和测量的真密度(micromeriticsaccypyc1340heliumpynchnometer),计算压缩应力、拉伸强度和固相分数值,并生成各个ctc特性。被认为在商业旋转式压片机的正常范围内的最大可接受压缩应力是大约250mpa。类似地,片剂的典型目标拉伸强度是2mpa;这样的片剂通常具有低脆碎度,并且对于下游处理和薄膜包衣而言是合适的。因而,如果给定的制剂可在小于250mpa的压缩应力下压缩至2mpa的拉伸强度,认为它具有可接受的可压性。盐可压性的最直接对比是在没有赋形剂下的纯api。然而,不能形成纯的马来酸盐压紧物。在非常高的力(以及甚至在降低的(90%)负荷)下生成压紧物的尝试所得到的呈薄片状分离地、帽状的压紧物,因此不能评估拉伸强度或其它压紧参数。该结果第一次表明马来酸盐api不能修改以压缩为较高负荷片剂制剂。令人惊奇地,樟脑磺酸盐api形成良好的压紧物,其对于所有评价的制剂(包括纯api)而言表现出良好的压片性质。可压片性是ctc特性中说明在旋转式压片机上形成片剂的能力的最直接关联。图7和表9显示了计划的300mg(非基于盐)片剂强度(60%和75%api负荷)的两种最相关的制剂的可压片性(压缩应力相对于拉伸强度)对比。表9.数据表与马来酸盐相比,樟脑磺酸盐制剂在低得多的压缩力下显示出更好的拉伸强度值(适合于片剂压缩)。实际上,马来酸盐制剂即使在250mpa也没有达到2mpa的目标拉伸强度;此外,在>200mpa的曲线渐近出现平台表明可能根本不能实现可接受的拉伸强度片剂,即使在压缩力极值下。换而言之,马来酸盐的可压片性比樟脑磺酸盐低大约2-2.5倍,并落在压片的可接受阈值以下。因而,当与樟脑磺酸盐相比,对于干法制粒压片需要显著更低负荷的马来酸盐制剂。由于所有60-100%负荷的樟脑磺酸盐制剂都在适度的压缩应力下表现出至少2.0mpa的可达到的拉伸强度(参见图8),可以得出以下一般结论:从可压片性角度看都是可接受的。相反,60-100%马来酸盐制剂都没有达到2.0mpa的拉伸强度(图7和11)。在图8-10中显示的数据是用樟脑磺酸盐分析的4种制剂的ctc特性。类似地,在图11-13中显示的数据是能够用于马来酸盐分析的3种制剂的ctc特性。纯的马来酸盐不可修改用于分析,因为在90%和100%api制剂下不能形成完整的压紧物。生成的ctc特性表明,所评价的樟脑磺酸盐远远更可修改用于干法制粒和片剂压缩方法。另外,马来酸盐可压性次于樟脑磺酸盐,使得需要将马来酸盐药物负荷从>70%的目标降低至估计的<50%以得到对于下游包衣、包装和/或运输过程具有足够强度的片剂。最后,值得注意的是,在60-100%下的樟脑磺酸盐api负荷的ctc特性对于api负荷不是高度敏感的。因而,对于非常高的负荷(高剂量:片剂大小比)片剂而言,可压性不会是限制性的。相反,上限可能是其它质量或加工属性(诸如崩解、溶出、粉末流动或粘冲),这使得大于300mg的rucaparib樟脑磺酸盐的片剂强度成为可能。表10.针对rucaparib盐形式评价的初始颗粒内制剂当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1