一种天然产物在制备治疗肥胖及相关代谢性疾病药物中的应用
技术领域:
:本发明属于生物医药领域,具体涉及一种天然产物在制备治疗肥胖及相关代谢性疾病药物中的应用。
背景技术:
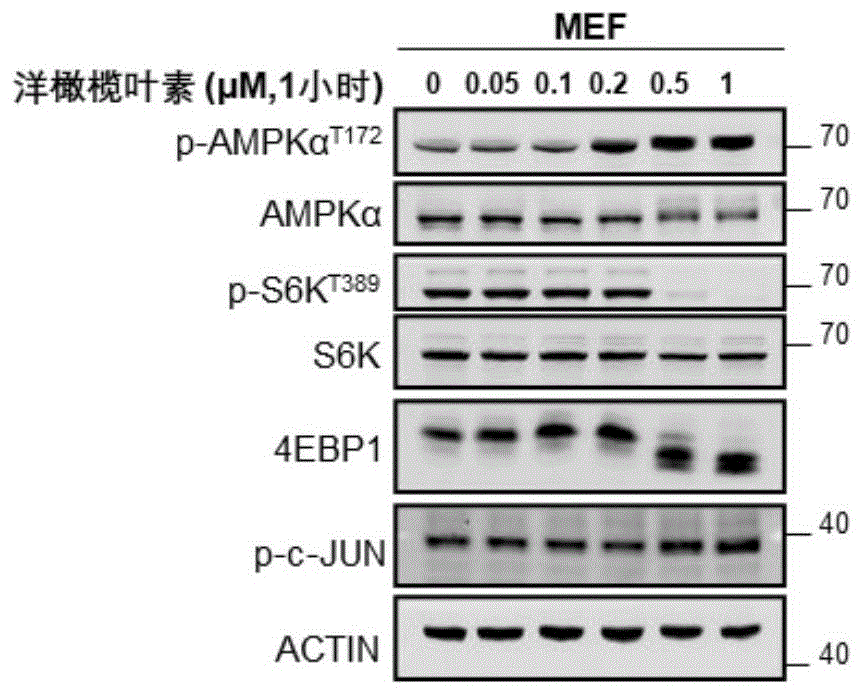
::肥胖是在西方国家和发展中国家中都普遍存在的一个主要健康问题,其流行率持续上升,英国有大约20%,美国有30%左右的肥胖症患者。为生物合成反应提供能量是生命的基本需求,但是营养过剩则会导致脂肪积累,最后引起肥胖。在现代社会,不太可能出现一段时间的饥饿来耗尽脂肪储备,而廉价又丰富的食物供应链则会导致肥胖的流行率持续走高。肥胖会引起多种代谢异常,如胰岛素抵抗,血脂异常和高血压。肥胖还会导致很多慢性疾病的发生,如二型糖尿病,心血管疾病和癌症。传统的肥胖治疗方式是生活方式的管理,包括饮食干预、运动和行为治疗。而药物疗法或者外科手术干预可能具有更广阔的发展前景。尽管目前关于抗肥胖药物的研究很多,但药物的有效性和安全性仍是一个很大的问题。这可能的原因之一是我们对肥胖的发病机制的理解还不够完全。目前被美国食品药品管理局通过的药物仅有5种,而且在患者身上长期使用会出现一定程度的副作用。因为这些药物在临床上长期应用的局限性,预防和治疗肥胖的新药开发需求与日俱增。ampk是肥胖及相关并发症的一个极具吸引力的靶点蛋白。当细胞中能量状态下降时,ampk能够被激活,触发生成atp的分解代谢,同时抑制合成代谢,以恢复细胞的能量稳态。ampk通过磷酸化tbc1d1(tbcdomainfamily,member1)和txnip(thioredoxin-interactingprotein)促进葡萄糖摄取。tbc1d1和txnip分别可以调控葡萄糖转运蛋白glut4和glut1的转位至细胞表面的水平。在一些组织类型中,ampk还能够通过磷酸化pfkfb3来快速上调糖酵解。ampk通过直接磷酸化acc1(acetyl-coacarboxylase1)和acc2,来调控细胞的脂质代谢。acc2可以在线粒体外膜催化丙二酰辅酶a的生成,缓解对肉碱棕榈基转移酶1(carnitinepalmitoyltransferase1,cpt1)的抑制,从而抑制脂肪酸合成,同时促进脂肪酸氧化。ampk抑制蛋白合成的能力很大程度上是依赖对mtorc1(mechanistictargetofrapamycincomplex1)的抑制。mtor是营养和生长因子信号的整合中心,激活包括蛋白质合成在内的很多生物合成途径,促进细胞生长。在很多情况下,ampk和mtorc1拮抗调节细胞代谢。ampk通过磷酸化并激活tsc2(tuberoussclerosiscomplex2)和抑制raptor(regulatory-associatedproteinofmtor)这两种机制来抑制mtorc1的活性。tsc2是mtorc1的负调控因子,而raptor是mtorc1复合物中的一个组成亚基。活性天然产物一直是治疗各种疾病的主要药物来源。洋橄榄叶素(elaiophylin,又称azalomycinb),其结构式如式1所示,它是一种最初从黑孢链霉菌中分离出来的大环内酯类抗生素,拥有一个双糖苷键修饰的16元环大环内酯对称结构,两个2-脱氧岩藻糖基。以往的研究表明,洋橄榄叶素及其类似物具有抗菌、抗蠕虫、抗肿瘤、抗病毒和免疫抑制的作用。在抗肿瘤方面,洋橄榄叶素可以抑制细胞自噬,作为单一药物在卵巢癌原位转移模型中具有显著的抗肿瘤作用。另外,洋橄榄叶素还可以通过抑制肿瘤细胞内的hif1α累积,来抑制血管内皮生长因子诱导的血管新生。技术实现要素::本发明的第一个目的是提供天然产物-洋橄榄叶素在制备治疗肥胖或相关代谢性疾病药物中的应用。本发明通过实验表明,肥胖小鼠在腹腔注射洋橄榄叶素后,表现出明显的体重降低及脂肪组织含量的降低。另外,小鼠的糖代谢水平有明显的改善,氧气消耗以及能量消耗增强,小鼠在寒冷环境中保持自身体温的能力增加。此外,在体外的小鼠原代肝细胞中用洋橄榄叶素处理,可以快速地激活ampk,并且促进葡萄糖消耗与脂肪酸氧化。这说明洋橄榄叶素可以通过激活ampk来改善机体肥胖及代谢异常,可用于开发及制备新的抗机体肥胖及代谢异常的小分子制剂。因此,本发明提供了洋橄榄叶素在制备治疗肥胖或相关代谢性疾病药物中的应用。所述的相关代谢性疾病指的是糖代谢或能量代谢失衡等代谢性疾病,包括由肥胖诱发的机体高血糖、葡萄糖耐受、胰岛素耐受或能量代谢失调等代谢性疾病。本发明还提供了洋橄榄叶素在制备在寒冷环境下维持体温的药物中的应用。本发明的第二个目的是提供链霉菌(streptomycessp.)scsio1934在生产洋橄榄叶素中的应用。本发明的第三个目的是提供一种制备洋橄榄叶素的方法,其是从链霉菌(streptomycessp.)scsio1934的发酵培养物中制备分离得到的。优选,所述的链霉菌(streptomycessp.)scsio1934的发酵培养物是以e2培养基为发酵培养基进行发酵而制得,所述的e2培养基,每升含有葡萄糖10g、黄豆粉15g、氯化钠2g、caco31g、余量为水。优选,具体方法为:制备链霉菌(streptomycessp.)scsio1934的发酵培养物,将发酵培养物中的上清液、菌丝体分离,菌丝体用丙酮-水溶液浸提,浸提液经减压回收丙酮后剩余的水液放冷静置,水液中析出淡黄色固体,析出物过滤干燥后上正相硅胶柱层析,以氯仿:丙酮作为洗脱剂从体积比1:0至0:1梯度洗脱,洗脱物经薄层层析,展开剂氯仿:丙酮=1:4v/v,收集比移值为rf=0.8的馏分段,蒸干,再经高效液相纯化得到洋橄榄叶素。所述的经高效液相纯化是将蒸干的馏分经高压反相c-18硅胶柱层析,以体积分数66%乙腈:水作为洗脱剂进行等度洗脱,色谱柱为welchxb-c18column21.2x250mm,流速为10ml·min-1,收集保留时间为tr=25.27min的亚馏分,即为洋橄榄叶素。本发明的有益效果是:洋橄榄叶素可以通过激活ampk来促进葡萄糖消耗和脂肪酸氧化从而改善脂质累积以及糖代谢、能量代谢失衡,具有良好的临床治疗潜能,为肥胖症及其相关糖代谢、能量代谢失衡的治疗提供了一种新途径。同时本发明提供了一种可以生产洋橄榄叶素的南海来源链霉菌streptomycessp.scsio1934,以及快速分离制备洋橄榄叶素的技术方法。本发明的链霉菌(streptomycessp.)scsio1934,于2010年11月25日保藏于中国典型培养物保藏中心(cctcc),地址:中国武汉市武汉大学,其保藏编号为cctccno:m2010317。该菌株公开于专利号:zl201010603179.1,发明名称为:一种链霉菌及利用该菌制备多种抗生素的工艺的发明专利中。附图说明:通过结合附图来详细说明本发明的实施方案,其中:图1-4示出了洋橄榄叶素的浓度在mef,小鼠原代肝细胞,分化成熟的脂肪细胞以及分化成熟的肌细胞中对ampk激活的影响。其中,图1示出了用洋橄榄叶素处理mef细胞1个小时时,最低0.2μm可以激活ampk。图2示出了用洋橄榄叶素处理小鼠原代肝细胞1个小时时,最低0.2μm可以激活ampk。图3示出了用洋橄榄叶素处理分化成熟的脂肪细胞1个小时时,最低0.1μm可以激活ampk,并且油红染色证明了脂肪细胞是分化成功的。图4示出了用洋橄榄叶素处理分化成熟的肌细胞1个小时时,最低0.2μm可以激活ampk。图5-8示出了洋橄榄叶素在不同细胞中处理不同的时间对ampk激活的影响。其中,图5示出了用1μm洋橄榄叶素处理mef细胞,最快2分钟就可以激活ampk。图6示出了用1μm洋橄榄叶素处理小鼠原代肝细胞,最快5分钟就可以激活ampk。图7示出了用1μm洋橄榄叶素处理分化成熟的脂肪细胞,最快2分钟就可以激活ampk。图8示出了用1μm洋橄榄叶素处理分化成熟的肌细胞,最快5分钟就可以激活ampk。图9示出了用洋橄榄叶素腹腔注射野生型的c57bl/6j小鼠,对小鼠血糖的影响,*p<0.05,**p<0.01,***p<0.001。图10-11示出了洋橄榄叶素可以特异性地激活小鼠肝脏及脂肪组织中的ampk。其中,图10示出了洋橄榄叶素可以激活小鼠肝脏及附睾白色脂肪组织中的ampk,而不能激活肌肉组织中的ampk。图11示出了洋橄榄叶素可以激活小鼠棕色脂肪组织,腹股沟白色脂肪组织以及附睾白色脂肪组织中的ampk。图12示出了洋橄榄叶素腹腔注射肥胖小鼠后体重的变化,*p<0.05,**p<0.01,***p<0.001。图13-14示出了洋橄榄叶素腹腔注射肥胖小鼠后,对于脂肪含量以及脂肪细胞大小的影响。其中,图13示出了洋橄榄叶素腹腔注射肥胖小鼠后,对于脂肪,肌肉以及液体含量的影响。图14示出了洋橄榄叶素腹腔注射肥胖小鼠后的肝脏以及脂肪组织he染色的结果,*p<0.05,**p<0.01,***p<0.001。图15示出了腹腔注射洋橄榄叶素可增强肥胖小鼠的氧耗,*p<0.05,**p<0.01,***p<0.001。图16示出了腹腔注射洋橄榄叶素后,对肥胖小鼠进行冷暴露处理,可增强小鼠的产热能力,*p<0.05,**p<0.01,***p<0.001。图17-18示出了洋橄榄叶素对肥胖小鼠糖代谢的影响。图17示出了腹腔注射洋橄榄叶素对小鼠空腹血糖及随机血糖的影响,图18示出了腹腔注射洋橄榄叶素对小鼠糖耐量及胰岛素耐量的影响。*p<0.05,**p<0.01,***p<0.001。图19-21示出了生产洋橄榄叶素的菌株和洋橄榄叶素的核磁共振氢谱以及低分辨质谱图。图19示出了南海来源链霉菌streptomycessp.scsio1934的菌株形态,图20示出了洋橄榄叶素的核磁共振氢谱图。图21示出了洋橄榄叶素的低分辨质谱图。具体实施方式:以下实施例是对本发明的进一步说明,而不是对本发明的限制。实施例1、洋橄榄叶素在不同细胞系中能够激活ampk并且抑制mtoc11.1材料1.1.1mef细胞系1.1.2dmem培养基,dmem/f12培养基(gibco)1.1.3胎牛血清(gibco)1.1.4生物素(sigma)1.1.5青霉素和链霉素1.1.6洋橄榄叶素(中国科学院南海海洋研究所)1.1.7罗格列酮1.1.8pvdf膜1.1.9化学发光液1.1.10滤纸(whatman)1.1.11雄性c57bl/6j小鼠(4-6week)1.2设备1.2.1倒置显微镜:ckx41型,奥林巴斯1.2.2微量量程移液器:1ml,100ul,10ul,1.5ul,德国eppendorf公司1.2.3移液枪枪头和1.5mlep管:axygen公司1.2.4co2培养箱:formasteri-cycle,thermoscientific1.2.5超净工作台:airtech,苏州安泰1.2.6细胞培养皿:多种规格,corning,thermoscientific1.2.7真空泵:循环水式多用真空泵shb-ⅲa1.2.8高速离心机:centrifuge5424,eppendorf1.2.94℃冰箱:bio-medical,haier1.2.10-20℃低温冰箱:biomedicalfreezer,santo1.2.11-80℃超低温冰箱:mdf-u74v,松下1.2.12分析天平,电子天平和ph计:mettlertoledo1.2.13水平摇床:zd-9556,太仓科教仪器厂1.2.14垂直摇床:zd-9550,太仓科教仪器厂1.2.15液氮罐:mvecryosystem6200,mvecryosystem1.2.16制冰机:sim-f140ay65-pc,松下1.2.17多功能激光扫描成像系统:typhoonfla9500,gehealthcare1.2.18纯水仪:milliporeprogardts2,milli-q1.2.19一次性乳胶手套:光明绿色芦荟款1.3溶液1.3.15×tbs缓冲液:0.5mtris-hcl,ph7.5,4.5%nacl。1.3.2tbst缓冲液:1×tbs,0.1%tween-201.3.35×sds上样缓冲液:0.25mtris-hcl(ph6.8),50%甘油,10%sds,20%β-巯基乙醇(β-me),0.0013%溴酚蓝。1.3.410%过硫酸铵(aps):5g过硫酸按溶解于50ml水中,分装后,-20℃保存。1.3.5sds-page胶:两块胶用量10%分离胶12%分离胶5%浓缩胶水4ml3.3ml2.7ml30%丙烯酰胺3.3ml4ml0.67ml1.5mtris/10%sds(ph8.8)2.5ml2.5ml-1mtris/10%sds(ph6.8)--0.5ml10%过硫酸铵100μl100μl40μltemed4μl4μl4μl1.3.6pbs:9.1mmna2hpo4,1.7mmnah2po4,,0.15mnacl,高温蒸汽灭菌。1.3.7胰酶:粉末购于gibco,0.05%胰酶,0.02%edta,溶于pbs中,过滤除菌。1.3.8罗格列酮(1mm):称取5mg溶于13.9888mldmso,分装后储存于-20℃。1.3.9胰岛素(1mg/ml):称取100mg人胰岛素溶解于100ml去离子水中(用浓盐酸促进溶解),过滤除菌,分装后储存于-20℃。1.3.103-异丁基-1-甲基黄嘌呤(50mm):称取1.15g粉末溶于100ml氢氧化钾(200mm),过滤除菌,分装后储存于-20℃。1.3.11地塞米松(1mm):称取19.5mg溶解于50ml去离子水中,过滤除菌,分装后储存于-20℃。1.3.12生物素:称取80mg生物素以及40mg泛酸钙,溶解于100ml去离子水中,50℃水浴30分钟促进溶解,过滤除菌,分装后储存于-20℃。1.4方法1.4.1sds-page电泳根据目的蛋白的大小,配制对应浓度的sds-page胶,将蛋白样品和marker缓慢加入到上样孔中,按照80v/20分钟,135v/60分钟的程序电泳,可根据不同蛋白大小做出相应调整。采用湿转法转膜,跑胶结合后,拆下胶板,冲洗干净。在槽子中提前倒入预冷的转膜缓冲液,将海绵,滤纸,硝酸纤维素膜和蛋白胶浸泡一下。再在夹子中依次放入海绵,滤纸,蛋白胶,硝酸纤维素膜,滤纸和海绵,应当注意不要引入气泡,再夹紧夹子。按照正负极顺序放入转膜槽中,恒流300ma转1个小时。转膜结束后,取出硝酸纤维素膜,对照marker,剪下需要的部分,放入盒子中。用含5%脱脂奶粉的tbst缓冲液将其覆盖,在垂直摇床上室温封闭1个小时。封闭结束后,弃封闭液,用tbst缓冲液在水平摇床上清洗3次,每次10分钟。按照一定比例将一抗配制在一抗稀释液中,将膜覆盖,置于垂直摇床上,4℃孵育过夜。第二天,回收一抗后在用tbst缓冲液清洗3次,步骤同前。将二抗配制于含5%脱脂奶粉的tbst缓冲液中,将膜覆盖,置于垂直摇床上,室温孵育1个小时。然后回收二抗,再次用tbst缓冲液洗3次。按照40:1的比例将ecl-plus显色试剂盒中的溶液a和溶液b混匀,避光放置。将洗好的膜沥干,在膜上的目的条带区域滴加混好的显色液,避光显色2分钟左右,可以根据信号强弱来调整显色时间。显色完成后加入双蒸水终止,用镊子将膜置于typhoon中扫膜。抗体信息见下表:1.4.2c2c12细胞的诱导分化复苏传代代数比较少的c2c12细胞,用含10%fbs的dmem培养基培养。当细胞状态良好时,将细胞传到6孔板中,确保第二天的细胞密度大概在70-80%。隔天,吸走旧培养基,换成含2%马血清的dmem培养基继续培养。每隔2天换一次液,大约培养4-6天可以渐渐看到肌管形成,最后分化为成熟的肌细胞。1.4.3svf细胞的分离1)配置0.075%的胶原酶,称取0.01125g的胶原酶ⅷ,拿到超净工作台中加pbs,过滤至新的15ml管中备用;2)小鼠处死后,取其腹股沟白色脂肪组织,注意不要沾到毛,放入盛有pbs的皿中。将皿拿到超净工作台里,取出组织,置于1ml胶原酶中,剪碎,剪得越碎越好,再补加4ml胶原酶。用封口膜封口后置于37℃培养箱中,消化40分钟,每10分钟上下颠倒一下;3)将消化好的细胞用100μm的滤网过滤,再加入5mldmem/f12培养基终止消化。置于离心机中700g离心5分钟;4)小心吸走浮在上面的成熟脂肪细胞以及上清,加入5ml红细胞裂解液,吹打混匀,室温静置3分钟;5)再加入5mldmem/f12培养基,用100μm的滤网过滤,700g离心5分钟;6)吸走上清,加入1ml培养基重悬,置于事先加入2ml培养基的60mm皿中,放入细胞培养箱培养;7)第二天,用培养基清洗几次后,继续培养。1.4.4svf细胞的诱导分化1)待svf细胞增殖到大约70%的密度时,可以将其传代到后续实验需要的皿中;2)当细胞增殖到完全长满时,为-2天,换液继续培养;3)两天后为d0天,在培养基中加入10μg/ml胰岛素,1μm地塞米松,0.5mmibmx和1μm罗格列酮诱导分化;4)d2天时,在培养基中加入10μg/ml胰岛素和1μm罗格列酮继续诱导;5)d4天时,撤诱导剂,换液继续培养;6)培养到6-8天时,可以看到细胞形态由长梭形变圆,且有很多脂滴出现,说明细胞已经分化为成熟的脂肪细胞。1.4.5油红染色1)事先配制油红染色工作液。将油红染色储存液与双蒸水按3:2的比例混匀,放置10分钟,然后用滤纸过滤后备用;2)吸走细胞培养液中的培养基,用预冷的pbs洗两次,加入4%的pfa,置于垂直摇床上室温固定15分钟;3)吸走pfa,用双蒸水洗两次,加入60%的异丙醇,孵育5分钟;4)吸走异丙醇,加入油红染色工作液,孵育10-20分钟;5)吸走染色液,用双蒸水洗2-5次,直到没有多余的染料;6)加苏木素染核1分钟,再用双蒸水洗2-5次;7)用双蒸水覆盖细胞,在显微镜下可以观察到红色的脂滴和蓝色的核,拍照。1.4.6原代肝细胞的分离用异氟烷麻醉小鼠,采用两步灌流法,第一步灌hbss,第二步灌消化液。消化完成后,剪下肝脏,置于含pbs的100mm皿中,然后转移至超净工作台中。将肝脏撕开,轻轻晃动以分散细胞,并吹打成单个的细胞,用70μm的滤膜过滤细胞悬液。置于离心机中,50g离心3分钟。弃上清,加入25ml含有10%fbs的dmem培养基,重悬计数铺板。4-6小时后待细胞贴壁,换成2%fbs的dmem培养基,防止细胞分化。过夜后可进行后续实验操作。1.4.7洋橄榄叶素处理将细胞铺到6孔板中,第二天待细胞贴壁后,提前一个小时换成新鲜的培养基。随后在培养基中加入洋橄榄叶素,终浓度分别为0.05,0.1,0.2,0.5,1μm,每个处理3个重复,一个小时后收细胞进行后续的westernblot检测。1.5结果用不同浓度的洋橄榄叶素分别处理mef,小鼠原代肝细胞,分化成熟的脂肪细胞以及分化成熟的肌细胞1个小时,发现最低用到1μm就能够激活ampk(如图1-4所示)。用洋橄榄叶素处理不同时间的结果见图5-8。实施例2、腹腔注射洋橄榄叶素降低小鼠的血糖含量2.1材料2.1.1雄性c57bl/6j小鼠(4-6周,上海斯莱克实验动物有限公司)2.1.2玉米油(mce)2.1.3洋橄榄叶素(中国科学院南海海洋研究所)2.2设备2.2.1血糖仪及试纸(罗氏)2.3方法2.3.1小鼠的饲养、给药及血糖含量检测c57bl/6小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。将6周左右的成年雄性c57bl/6j小鼠随机分为3组(5只/组),分别为空白对照组(dmso)、洋橄榄叶素处理组(5mg/kg及10mg/kg),药物用玉米油溶解,以腹腔给药的方式对小鼠进行处理。每隔一段时间,取鼠尾血检测血糖浓度。2.3.2数据分析数据差异性由studentttest方法分析,p<0.05时,认为有统计学差异。2.4结果实验结果显示,洋橄榄叶素注射4个小时后,小鼠血糖浓度显著降低;6个小时后,血糖浓度可以进一步降低;而20个小时后,血糖浓度会有所回升,但仍然显著低于对照组(如图9所示)。实施例3、洋橄榄叶素特异性激活小鼠肝脏及脂肪组织中的ampk3.1材料3.1.1雄性c57bl/6j小鼠(4-6周,上海斯莱克实验动物有限公司)3.1.2玉米油(mce)3.1.3洋橄榄叶素(中国科学院南海海洋研究所)3.1.4ripa裂解液(碧云天)3.2设备3.2.1组织研磨仪3.2.2低温高速离心机:eppendorf3.3方法3.3.1小鼠的饲养、给药及血糖含量检测c57bl/6小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。将6周左右的成年雄性c57bl/6j小鼠随机分为3组(5只/组),分别为空白对照组(dmso、洋橄榄叶素处理组(5mg/kg及10mg/kg),药物用玉米油溶解,以腹腔给药的方式对小鼠进行处理。16天后处死小鼠,取肝脏,脂肪及肌肉组织,加入裂解液研磨后,再加入上样缓冲液加热变性后,跑sds-page胶。3.4结果与对照组相比,洋橄榄叶素可以特异性地激活小鼠肝脏,棕色脂肪,附睾白色脂肪以及腹股沟白色脂肪组织中的ampk(如图10-11所示)。实施例4、洋橄榄叶素可抑制肥胖小鼠体重增加4.1材料4.1.1雄性ob/ob小鼠(4-6week,上海斯莱克实验动物有限公司)4.1.2洋橄榄叶素(中国科学院南海海洋研究所)4.1.3天平(sartorius公司,germany)4.2方法4.2.1小鼠的饲养和给药ob/ob小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。将6-8周的成年雄性ob/ob小鼠随机分为3组(6-7只/组),分别为空白对照组(dmso)、洋橄榄叶素处理组(5mg/kg以及10mg/kg),药物用玉米油溶解。以腹腔给药的方式对小鼠进行处理,每3天注射一次,给药持续16天,每天记录一次小鼠的体重变化情况。4.2.2数据分析数据差异性由studentttest方法分析,p<0.05时,认为有统计学差异。4.3结果腹腔注射洋橄榄叶素的小鼠体重明显低于对照组小鼠,两组之间的体重差异具有统计学差异,且体重差异与药物剂量成正相关(如图12所示)。由此可知,腹腔注射洋橄榄叶素显著抑制了肥胖小鼠的体重增长。实施例5、腹腔注射洋橄榄叶素可减少肥胖小鼠的脂肪组织含量5.1材料5.1.1雄性ob/ob小鼠(4-6week,上海斯莱克实验动物有限公司)5.1.2洋橄榄叶素(中国科学院南海海洋研究所)5.1.3多聚甲醛(4%,sigma)5.1.4nmr(bruker公司,germany)5.2方法5.2.1小鼠的饲养、给药及脂肪组织含量检测ob/ob小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。将6-8周的成年雄性ob/ob小鼠随机分为3组(5只/组),分别为空白对照组(dmso)、洋橄榄叶素处理组(5mg/kg及10mg/kg),药物用玉米油溶解。以腹腔给药的方式对小鼠进行处理,每3天注射一次,给药持续16天。给药16天后,对各处理组小鼠进行核磁共振检测。断颈处死小鼠,解剖取出小鼠的肝脏,腹股沟部脂肪(皮下脂肪),附睾部脂肪(内脏脂肪)和肩胛间区的棕色脂肪(bat)。并分别取一部分组织加4%多聚甲醛固定后进行苏木素-伊红染色。5.2.2数据分析数据差异性由studentttest方法分析,p<0.05时,认为有统计学差异。5.3结果核磁共振结果可见洋橄榄叶素处理组小鼠的机体脂肪含量明显低于对照组,肌肉组织以及液体含量没有显著变化(如图13所示)。并且苏木素-伊红染色结果显示,在肝脏组织中,洋橄榄叶素处理可以使脂滴和脂质积累显著降低,而在脂肪组织中,洋橄榄叶素处理可以明显缩小脂肪细胞的大小(如图14所示)。由此可见,腹腔注射洋橄榄叶素可有效抑制肥胖小鼠脂肪堆积。实施例6、腹腔注射洋橄榄叶素可增强肥胖小鼠的氧消耗6.1材料及仪器6.1.1雄性ob/ob小鼠(4-6week,上海斯莱克实验动物有限公司)6.1.2洋橄榄叶素(中国科学院南海海洋研究所)6.1.3小动物代谢监测系统:(columbus公司,usa)6.2方法6.2.1小鼠的饲养及给药处理ob/ob小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。将6-8周的成年雄性ob/ob小鼠随机分为2组(5只/组),分别为空白对照组(dmso)、洋橄榄叶素处理组(5mg/kg),药物用玉米油溶解。以腹腔给药的方式对小鼠进行处理,每3天注射一次,给药持续16天。6.2.2小鼠的能量代谢情况监测使用小动物新陈代谢监测系统(代谢笼)对不同处理组的小鼠进行能量代谢分析及昼夜活动监测,监测时间共为72小时。6.2.3数据分析使用studentttest方法分析数据差异,p<0.05时,认为有统计学意义。6.3结果在肥胖小鼠模型中,相比于空白对照小鼠,洋橄榄叶素处理组小鼠在白循环中的氧耗量均显著增加(如图15所示)。实施例7、腹腔注射洋橄榄叶素可增强肥胖小鼠的冷耐受7.1材料及仪器7.1.1雄性ob/ob小鼠(4-6week,上海斯莱克实验动物有限公司)7.1.2洋橄榄叶素(中国科学院南海海洋研究所)7.1.3小鼠直肠温度检测仪(physitemp,usa)7.2方法7.2.1小鼠的饲养及给药处理ob/ob小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。将6-8周的成年雄性ob/ob小鼠随机分为2组(5只/组),分别为空白对照组(dmso)、洋橄榄叶素处理组(5mg/kg),药物用玉米油溶解。以腹腔给药的方式对小鼠进行处理,每3天注射一次,给药持续16天。7.2.2小鼠在冷暴露情况下的直肠温度监测对不同处理组的小鼠进行4℃冷暴露处理,共处理6小时,每两小时监测小鼠直肠温度。7.2.3数据分析使用studentttest方法分析数据差异,p<0.05时,认为有统计学意义。7.3结果如图16所示,在肥胖小鼠模型中,对不同处理组小鼠进行冷暴露处理,虽然两组小鼠的体温都随时间延长而逐渐降低,但在冷暴露4小时及6小时时,洋橄榄叶素处理组小鼠的体温显著高于对照组,说明洋橄榄叶素处理组小鼠在受到低温刺激时,保存自身体温的能力高于对照组,冷耐受能力增加,提示机体产热性脂肪组织的功能增强,机体产热增多。实施例8、腹腔注射洋橄榄叶素可缓解肥胖小鼠血糖异常8.1材料8.1.1雄性ob/ob小鼠(4-6week,上海斯莱克实验动物有限公司)8.1.2洋橄榄叶素(中国科学院南海海洋研究所)8.1.3血糖仪及试纸(罗氏)8.2方法8.2.1小鼠的饲养、给药及血糖测量ob/ob小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。将6-8周的成年雄性ob/ob小鼠随机分为3组(5只/组),分别为空白对照组(dmso)、洋橄榄叶素处理组(5mg/kg及10mg/kg),药物用玉米油溶解。以腹腔给药的方式对小鼠进行处理,每3天注射一次,给药持续16天。给药16天后,按不同的条件,取鼠尾血测量血糖浓度。8.2.2数据分析使用studentttest方法分析数据差异,p<0.05时,认为有统计学意义。8.3结果实验结果显示,与对照组小鼠相比,洋橄榄叶素处理组小鼠的随机血糖及空腹血糖的水平都有显著性的降低(如图17所示)。实施例9、腹腔注射洋橄榄叶素可显著改善肥胖小鼠的葡萄糖耐量及胰岛素耐量的降低9.1材料9.1.1雄性ob/ob小鼠(4-6week,上海斯莱克实验动物有限公司)9.1.2洋橄榄叶素(中国科学院南海海洋研究所)9.1.3血糖仪及试纸(罗氏)9.2方法9.2.1小鼠的饲养及给药ob/ob小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。将6-8周的成年雄性ob/ob小鼠随机分为3组(5只/组),分别为空白对照组(dmso)、洋橄榄叶素处理组(5mg/kg及10mg/kg),药物用玉米油溶解。以腹腔给药的方式对小鼠进行处理,每3天注射一次,给药持续两周。9.2.2葡萄糖耐受实验(gtt)及胰岛素耐受实验(itt)给药两周后,对上述三组小鼠进行gtt以及itt实验。葡萄糖耐受实验(gtt):腹腔注射1mg/kg体重的葡萄糖注射液,并分别在注射后0分钟、30分钟、60分钟、90分钟、120分钟时,检测小鼠的尾静脉血糖高低以评估不同处理组小鼠的葡萄糖耐受情况。胰岛素耐受实验(itt):腹腔注射1u/kg体重的胰岛素,并在注射后0分钟、30分钟、60分钟、90分钟、120分钟时,检测小鼠的尾静脉血糖高低以评估不同处理组小鼠的胰岛素耐受情况。9.2.3数据分析使用studentttest方法分析数据差异,p<0.05时,认为有统计学意义。9.3结果如图18所示,在肥胖小鼠模型中,腹腔注射洋橄榄叶素可显著改善小鼠的葡萄糖耐受及胰岛素耐受异常情况。实施例10、南海来源链霉菌streptomycessp.scsio1934的发酵培养及洋橄榄叶素的分离鉴定10.1材料10.1.1南海海底沉积物样品10.1.2培养基一号培养基:按质量分数计,葡萄糖2%,氯化钠0.2%,酵母粉0.4%,k2hpo40.05%,牛肉膏0.1%,蛋白胨2%,黄豆粉0.5%,caco30.2%,可溶性淀粉1%,余量为水,ph7.0。am6培养基:按质量分数计,可溶性淀粉2%,葡萄糖1%,蛋白胨0.5%,酵母膏0.5%,caco30.5%,海盐3%,余量为水,ph7.0。e1培养基:按质量分数计,葡萄糖1%,黄豆粉1.5%,海盐3%,caco30.1%,余量为水,ph7.0。e2培养基:按质量分数计,葡萄糖1%,黄豆粉1.5%,氯化钠0.2%,caco30.1%,余量为水,ph7.0。制备方法都为将各组分按其含量混合均匀,调ph值,灭菌备用。10.1.3设备超净工作台,高压蒸汽灭菌锅,恒温振荡摇床,旋转蒸发仪,高效液相色谱仪,核磁共振波谱仪,质谱仪10.1.4方法与结果本发明中的洋橄榄叶素可以购买,也可以按照以下方法制备。10.1.4.1菌株scsio1934的分离鉴定本发明提供一株具有生产洋橄榄叶素能力的链霉菌,其编号为streptomycessp.scsio1934。菌株scsio1934分离自南海海底沉积物样品(2008年9月采自南海北部,e111°26.118′,n18°34.363′,采样深度200m),保存在中国科学院南海海洋研究所海洋微生物研究中心海洋微生物资源库。streptomycessp.scsio1934也于2010年11月25日保藏于中国典型培养物保藏中心(cctcc),地址:中国武汉市武汉大学,其保藏编号为cctccno:m2010317。该菌株公开于专利号:zl201010603179.1,发明名称为:一种链霉菌及利用该菌制备多种抗生素的工艺的发明专利中。将2克海洋底泥样品置于超净工作台中风干,分作两份分别采用印迹法和加水稀释法涂布于isp2平板,28℃条件下培养,定期进行形态观察,挑取单菌落连续进行分离纯化,获得了纯化的菌株scsio1934(图19)。提取菌株scsio1934的基因组dna,通过聚合酶链反应(pcr)扩增获得16srrna序列,经序列比对并建立系统发育树。该菌的16srrna序列提交到genbank,获得序列号hq403650。通过ncbiblast搜索,并与基因库中的已知菌株的16srrna进行比对,结果显示:该菌与streptomycessp.m4032,streptomycessp.m4033和streptomycesmalaysiensis的相似度达到100%,说明菌株scsio1934为链霉菌属,命名为streptomycessp.scsio1934。10.1.4.2洋橄榄叶素的快速分离制备技术本发明提供洋橄榄叶素的快速分离制备技术,所述的洋橄榄叶素是从streptomycessp.scsio1934的发酵培养物中制备分离得到的。将菌株scsio1934分别接种到50毫升一号培养基、am6培养基、e1和e2液体培养基中,置于恒温振荡摇床上以200转/分钟的转速于28℃条件下进行培养。分别于第5天、第6天、第7天在超净工作台中对上述四种培养基中的发酵产物取样5毫升,加等量丁酮萃取后,取有机相蒸干后加200微升乙腈溶解,高速离心后做高效液相色谱分析。以洋橄榄叶素的产量多寡为指标作发酵条件筛选,结果发现scsio1934在e2液体培养基中所产的洋橄榄叶素最多,因此e2培养基是上述四种培养基中的最优培养基。将链霉菌streptomycessp.scsio1934经isp2平板活化后接种到14升e2液体培养基(每升培养基中含有葡萄糖10g,黄豆粉15g,氯化钠2g,caco31g,余量为水,ph7.0,115℃灭菌30分钟)中,置于恒温振荡摇床上以200转/分钟的转速于28℃条件下进行培养。培养1周后将发酵培养物中的上清液、菌丝体以4000转/分钟的转速离心分离。菌丝体用体积分数80%丙酮-水浸提,浸提液经减压回收丙酮后剩余的水液放冷静置2小时,水液中析出大量淡黄色固体,析出物过滤干燥后以氯仿溶解上正相硅胶柱层析,以氯仿:丙酮作为洗脱剂从体积比1:0至0:1梯度洗脱,以elaiophylin标准品为对照经薄层层析(氯仿:丙酮=1:4)检测合并含有elaiophylin的馏分段(比移值为rf=0.8),蒸干。以二甲基亚砜(dmso)溶解以上产物,经高压反相c-18硅胶柱层析,以乙腈:水(体积分数66%)作为洗脱剂进行等度洗脱,紫外检测器上设置254纳米作为检测波长,色谱柱为welchxb-c18column(21.2x250mm),流速为10ml·min-1,收集保留时间为tr=25.27min的亚馏分得到1.4克化合物1。化合物1的纯度经hplc分析检测后约为97.5%,进一步做核磁共振氢谱和低分辨率质谱分析(图20,图21),确定其为洋橄榄叶素,化学结构式见式1。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1