含有抗EGFR抗体或其片段的联合用药物的制作方法
含有抗egfr抗体或其片段的联合用药物
技术领域
1.本发明涉及生物制药领域,更具体地,涉及抗egfr抗体或其片段治疗癌症的用途,尤其是该抗体或片段在联合用药物中的用途。
背景技术:
2.癌症是指具有细胞分化和增殖异常、生长失去控制、浸润性和转移性等生物学特征的一大类疾病,不受管制的细胞分裂可能导致恶性肿瘤或侵入邻近组织的细胞的形成,并可能通过淋巴系统或血流转移到身体的远端部位,其发生是一个多因子、多步骤的复杂过程,分为致癌、促癌、演进三个过程,与吸烟、感染、职业暴露、环境污染、不合理膳食、遗传因素密切相关。癌症包括多种类型,癌症总体分为原发性和继发性两大类,按照发生的器官部位分为:肺癌、胃癌、乳腺癌、鼻咽癌、肝癌、肠癌、前列腺癌等多种。癌症按照发生的组织系统分为:消化系统癌症、呼吸系统癌症、泌尿生殖系统癌症、血液系统癌症等。按照身体部位分为:头颈部癌症、胸部、腹部、盆腔癌症等。按照细胞来源不同分为:腺癌、鳞状细胞癌、未分化癌三大类,每种癌症的发病概率及严重程度不同。
3.肺癌是我国和世界范围内发病率和死亡率最高的恶性肿瘤,临床症状多隐匿,以咳嗽、咳痰、咯血和消瘦为主要表现,x线影像学主要表现为肺部结节、肿块影等,确诊时多数患者已分期较晚,5年生存率较低,疾病负担重,严重威胁国人健康。肺癌的病因与发病机制迄今尚未明确,大约85~90%的肺癌是由主动或被动吸烟所致,同时有证据表明与职业致癌因子(石棉、砷、铬镍、多环芳香烃类等)、空气污染、电离辐射、饮食与体力活动、遗传和基因改变有关。肺癌按照组织学特点可以分为非小细胞肺癌(nsclc)和小细胞肺癌(sclc)。其中nsclc约占肺癌总数的85%,目前多种基因突变与表达异常等分子机制被证实与nsclc发病相关,其中表皮生长因子受体(egfr)是肺癌主要的驱动基因之一。egfr的胞内区域酪氨酸磷酸化后进而活化第二信使转导,通过mapk途径诱导细胞外信号的活化(激酶erk1和erk2);通过pi3k途径活化akt;通过jak2活化信号转导子和stat3、stat5的转录活化子。
4.随着肺癌系列致癌驱动基因的相继确定,靶向治疗药物大大改善和延长携带相应驱动基因的nsclc患者的预后和生存。肺癌的分型也由过去单纯的病理组织学分类,进一步细分为基于驱动基因的分子亚型。亚裔人群和我国的nsclc患者egfr基因突变阳性率为40~50%。亚裔人和西方人之间的egfr突变比例不同。egfr突变主要包括4种类型:外显子19缺失突变、外显子21点突变、外显子18点突变和外显子20插入突变。最常见的egfr突变为外显子19缺失突变19del和外显子21点突变21l858r,均为egfr tki的敏感性突变,18外显子g719x、20外显子s768i和21外显子l861q突变亦均为敏感性突变。egfr罕见突变约占所有egfr突变的15%~20%,其中50%以上的罕见突变位于egfr 20号外显子,又以20号外显子插入突变(egfr exon20 ins)最为常见。
5.egfr突变肺癌患者中,egfr exon20 ins是egfr罕见突变中最常见的一种突变类型,约占egfr罕见突变的30%,研究报道西方人群中egfr exon20 ins占所有egfr突变的4.8%~12%,已知的egfr exon20 ins有30多种类型。中国人群egfr exon20 ins占egfr突
变比例为3%~4%,研究表明,中国nsclc患者中egfr exon20 ins的遗传特征与白种人患者中报道的遗传特征相当,发病率约占总nsclc的2~3%,包括大多数独特的突变和最普遍的共突变。
6.晚期egfr敏感突变阳性nsclc精准靶向治疗的疗效与分子分型关系已经在临床实践中得到充分证实。egfr小分子酪氨酸激酶抑制剂(egfr
‑
tkis)目前已成为egfr敏感突变型非小细胞肺癌的一线标准治疗。其中,阿法替尼(afatinib)是第二代egfr
‑
tkis,已在国内获批nsclc一线egfr敏感突变适应症。奥希替尼(osimertinib)是第三代egfr
‑
tkis,也是众多国际指南egfr敏感突变一线治疗的首选推荐用药。该药目前已在国内获批nsclc一线egfr敏感突变及后线t790m阳性的两个适应证。
7.然而,egfr exon20 ins nsclc患者对一代和二代egfr
‑
tki治疗的不敏感已被多项临床研究证实。根据对lux
‑
lung 2、lux
‑
lung 3和lux
‑
lung 6的上市后联合分析显示,egfr exon20 ins患者接受阿法替尼治疗的获益较其他突变患者最少,23例egfr exon20ins患者接受阿法替尼一线治疗的orr为8.7%,中位pfs为2.7个月,中位os为9.2个月,在所有egfr突变患者中最短,提示阿法替尼单药对egfr exon20ins nsclc的疗效有限。研究表明,当接受第一、二代egfr
‑
tkis治疗时,egfr exon20 ins nsclc患者的orr为0%~11%,mpfs为2~3个月,os与野生型egfr患者相似。美国国立综合癌症网络(nccn)nsclc指南也指出:大多数的egfr exon20 ins预示着临床上对tki耐药。
8.2018年欧洲肿瘤内科学会年会(esmo)发布了美国的一项奥希替尼治疗晚期egfr exon20 ins nsclc患者的ⅱ期临床试验初步数据(nct 03191149),之前全身治疗线数的中位数为1(范围0~3),在所有接受奥希替尼治疗的17例患者中,仅观察到1例部分缓解,orr为6%,mpfs为3.7个月,五个月的疾病控制率(disease control rate,dcr)为35%(6例/17例),结论为奥希替尼对egfr exon20 ins nsclc患者的抗肿瘤活性有限。2019年esmo发布了另一项韩国的评估奥希替尼在标准化疗失败后的晚期egfr exon20 ins nsclc患者中的疗效的ⅱ期临床试验初步数据(nct03414814),在2018年1月至2019年2月期间,有15名患者在第一阶段接受了奥希替尼作为二线治疗(20%,n=3)和三线以上(含三线)治疗(n=12),其中orr为0%,大部分疾病稳定(稳定疾病,占46.7%,n=7),mpfs为3.5个月(95%ci 1.6
‑
nr),mos未达到(1年os率56.3%),6个月时的dcr为31.1%。最常见的不良事件(所有等级)是恶心(20%,n=3),呕吐(20%,n=3),贫血(13.3%,n=2)和发烧(13.3%,n=2),结论为奥希替尼具有良好的耐受性,但在标准化疗失败后的egfr exon20 ins nsclc患者中疗效有限。
9.目前,egfr单抗单药未获批或未有指南推荐用于nsclc(包括egfr exon20 ins nsclc),egfr单抗单药疗效欠佳,培美曲塞中位os 10.3m[95%ci:7.5,16.8];西妥昔单抗(cetuximab)单药中位os 3.5m[95%ci:2.8,11.7],p=0.046(bmc cancer.2014jan 4;14:5)。而egfr单抗联合化疗用于nsclc的疗效也欠佳,耐昔妥珠单抗(necitumumab)联合吉西他滨及顺铂方案虽获批肺癌适应症,但因疗效、毒性及成本问题,nccn指南删除了该疗法的推荐(lancet oncology,2015,16(7):763
‑
774);2015年《nccn指南》删除了西妥昔单抗的相关推荐(西妥昔单抗/顺铂/长春瑞滨的一线疗法(2b类),认为西妥昔单抗/顺铂/长春瑞滨方案的获益非常轻微,是一个难以给药的方案,且与其他方案相比耐受性更差(lancet 2009;373:1525
‑
1531);随机对照试验披露帕尼单抗(panitumumab)联合标准治疗(培美曲
塞+铂类)用于nsclc无获益,并且数据更支持标准治疗(clinical lung cancer,2015,16(6):447
‑
456)。
[0010]
目前阿法替尼或奥希替尼单药在egfr exon20 ins nsclc的疗效有限,该患者人群目前的一线标准治疗为化疗,而全身化疗orr仅20%
‑
40%(j clin oncol 2003;21(16):3016
‑
3024;j clin oncol 2008;26:3543
‑
3551;cancer 2003;98:542
‑
553;ann oncol 2007;18:317
‑
323),疗效欠佳,且目前egfr exon20 ins nsclc尚未有靶向药物批准上市,国内外临床指南中亦无推荐治疗方案,部分药物尚处于临床试验阶段,egfr exon20 ins nsclc治疗存在未满足的临床需求。因此非常有必要研究出更有效的靶向egfr exon20 ins nsclc的药物以精准治疗这些患者。更特别的,如果能够研发出抗egfr抗体与其他肺癌特别是非小细胞肺癌疗法相结合以获得更好的治疗egfr exon20 ins nsclc的效果,如加强肿瘤缓解、减少复发可能性或频率、延长存活时间、降低毒副作用等,将使这些患者获益。
[0011]
cn103772504a(其内容全文引用到本技术中)公开了一系列的抗egfr抗体或其抗原结合部分,其重链cdr1的序列选自seq id no:1和seq id no:39所示序列或其衍生序列,cdr2的序列为seq id no:4所示序列或其衍生序列,cdr3的序列选自seq id no:2、seq id no:3和seq id no:40所示序列或其衍生序列;轻链cdr1的序列为seq id no:11所示序列或其衍生序列,cdr2序列为seq id no:12所示序列或其衍生序列,cdr3序列选自seq id no:9、seq id no:10或seq id no:41所示序列或其衍生序列。
技术实现要素:
[0012]
本发明提供了预防或治疗癌症的联合用药物,包括抗egfr抗体或其片段和egfr小分子酪氨酸激酶抑制剂尤其是阿法替尼(包括阿法替尼盐)/奥希替尼(包括奥希替尼盐),以及该联合用药物在制备治疗癌症药物中的用途。特别是,发现当抗egfr抗体或其片段与egfr小分子酪氨酸激酶抑制剂尤其是阿法替尼(包括阿法替尼盐)/奥希替尼(包括奥希替尼盐)联合施用治疗肺癌尤其是egfr exon20 ins nsclc时具有有利的协同作用。
[0013]
具体地,本发明提供了预防或治疗肺癌的联合用药物,包括同时或分别给药的抗egfr抗体或其片段和egfr小分子酪氨酸激酶抑制剂。
[0014]
优选地,所述癌症选自肺癌、胃癌、肝癌、乳腺癌、食管癌、肾癌、膀胱癌、宫颈癌、结直肠癌、淋巴癌,优选肺癌;所述肺癌选自小细胞癌、非小细胞肺癌,优选非小细胞癌,进一步优选为egfr exon20 ins非小细胞肺癌。
[0015]
本发明中所述抗egfr抗体或其片段优选具有西妥昔单抗(cetuximab)、尼妥珠单抗(nimotuzumab)、帕尼单抗(panitumumab)、耐昔妥珠单抗(necitumumab)的重链和轻链的6个cdr序列,更优选地,本发明中所述抗egfr抗体或其片段的包括seq id no:1或seq id no:2所示的重链cdr1序列、seq id no:3所示的重链cdr2序列和seq id no:4、seq id no:5或seq id no:6所示的重链cdr3序列,和/或seq id no:7所示的轻链cdr1序列、seq id no:8所示的轻链cdr2序列和seq id no:9、seq id no:10和seq id no:11所示的轻链cdr3序列。进一步地,所述抗egfr抗体或其片段优选包含seq id no:1所示的重链cdr1序列、seq id no:3所示的重链cdr2序列和seq id no:4所示的重链cdr3序列,和/或seq id no:7所示的轻链cdr1序列、seq id no:8所示的轻链cdr2序列和seq id no:9所示的轻链cdr3序列。优选地,所述抗egfr抗体或其片段包括seq id no:12所示的重链可变区和/或seq id no:
13所示的轻链可变区。所述抗egfr抗体片段可以为单链抗体(scfv)、嵌合抗体、双抗体、scfv
‑
fc二价分子、dab、fab片段、fab’片段、fv或f(ab’)2片段。优选地,所述抗egfr抗体或其片段为全长抗egfr抗体。进一步地,所述抗egfr抗体具有人igg1重链恒定区和/或人κ轻链恒定区。优选地,所述抗egfr抗体为人源化抗体。
[0016]
本发明中所述egfr小分子酪氨酸激酶抑制剂优选为阿法替尼(包括阿法替尼盐)或奥希替尼(包括奥希替尼盐)。
[0017]
本发明还提供了所述联合用药物用于制备治疗癌症药物中的应用。
[0018]
本发明还提供了抗egfr抗体或其片段在制备与egfr小分子酪氨酸激酶抑制剂联合治疗癌症的药物中的用途。
[0019]
优选地,上述癌症选自肺癌、胃癌、肝癌、乳腺癌、食管癌、肾癌、膀胱癌、宫颈癌、结直肠癌、淋巴癌,优选肺癌;所述肺癌选自小细胞癌、非小细胞肺癌,优选非小细胞癌,进一步优选为egfr exon20 ins非小细胞肺癌。
[0020]
本发明中,所述联合用药物用于制备二线及以上治疗携带egfr exon20 ins非小细胞肺癌,更优选地,所述联合用药物用于制备二线及以上治疗既往至少接受过一次全身化疗的携带egfr exon20 ins非小细胞肺癌。
[0021]
本发明中,所述联合用药物或用途中抗egfr抗体配制成在所述egfr小分子酪氨酸激酶抑制剂之前、同时或之后施用。
[0022]
本发明中,施用对象为人时,所述抗egfr抗体的施用剂量为4mg/kg
‑
10mg/kg,优选为4mg/kg、4.8mg/kg、6mg/kg、8mg/kg和10mg/kg,更优选为6mg/kg;施用频次为1
‑
4周一次,优选为1周一次、2周一次、3周1次或4周一次,更优选为2周一次。
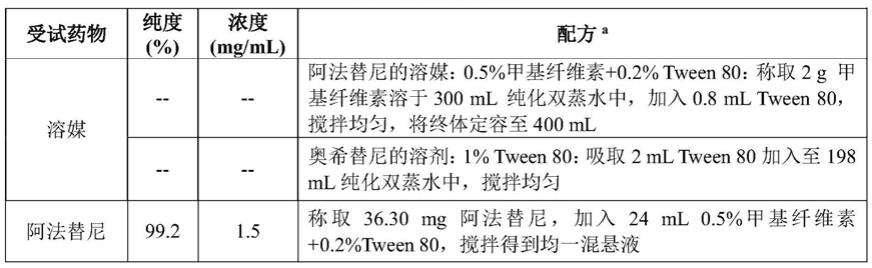
[0023]
本发明中,所述egfr小分子酪氨酸激酶抑制剂为阿法替尼或其盐时,优选施用剂量为20mg/天
‑
50mg/天,优选为20mg/天、30mg/天、40mg/天、50mg/天,更优选为30mg/天。
[0024]
本发明中,所述egfr小分子酪氨酸激酶抑制剂为奥希替尼或其盐时,优选施用剂量为40
‑
160mg/天,优选为40mg/天、80mg/天、120mg/天、160mg/天,更优选为160mg/天。
[0025]
本发明中,优选先输注抗egfr抗体,12小时内给予egfr小分子酪氨酸激酶抑制剂,之后每天给药egfr小分子酪氨酸激酶抑制剂,间隔1
‑
4周(优选1周、2周、3周或4周)后再给药抗egfr抗体,12小时内给予egfr小分子酪氨酸激酶抑制剂,之后每天给药egfr小分子酪氨酸激酶抑制剂,更优选2周为周期循环该施用方案。按照上述给药方案进行循环,直至疾病进展、不能耐受毒性或评价认为患者不能从治疗中获益为止,以先出现者为准。
[0026]
本发明通过体外研究证实,抗egfr抗体与阿法替尼(包括阿法替尼盐)或奥希替尼(包括奥希替尼盐)联合用药后,分别提升阿法替尼(包括阿法替尼盐)或奥希替尼(包括奥希替尼盐)的ba/f3 egfr exon 20ins asv细胞增殖抑制活性。
[0027]
应该理解,本发明描述的具体实例和方案仅仅是为了例证目的作为示例给出,不视为对本发明的限制,包括在本技术的精神和范围内的各种进一步修改或变化均视为涵盖在本发明的公开范围内。
[0028]
本发明中,具有如seq id no:14所示的重链氨基酸序列和如seq id no:15所示的轻链氨基酸序列的抗egfr抗体命名为jmt101。
附图说明
[0029]
图1
‑
图2:受试药物对ba/f3 egfr
‑
exon20 v769_d770insasv细胞增殖抑制作用。
[0030]
图3:肿瘤生长曲线,其中,数据点代表组内平均肿瘤体积,误差线代表标准平均误差(sem)。
[0031]
图4:在给药第14天的肿瘤体积柱状图,其中数据点代表组内平均肿瘤体积,误差线代表标准平均误差(sem),**p<0.01,***p<0.001。
[0032]
图5:在给药第14天后的终点肿瘤重量柱状图,其中数据点代表组内平均肿瘤重量误差线代表标准平均误差(sem),**p<0.01,***p<0.001。
实施例
[0033]
实施例1细胞增殖实验研究
[0034]
检测药物对ba/f3 egfr
‑
exon20 v769_d770insasv细胞增殖的影响。
[0035]
1、实验材料
[0036]
1.1药物
[0037]
阿法替尼(afatinib)、奥希替尼(osimertinib)、jmt101注射液(201906071)。
[0038]
1.2细胞
[0039]
ba/f3 egfr
‑
exon20 v769_d770ins asv细胞。
[0040]
2、实验步骤
[0041]
2.1药物配制
[0042]
化合物afatinib、osimertinib室温预热,用dmso完全溶解至10mm,然后稀释0.5mm工作液;jmt101用rpmi 1640完全培养基稀释成100μg/ml的工作液。
[0043]
2.2细胞种板及化合物处理
[0044]
1)开启生物安全柜紫外灯,倒计时30min。37度水浴锅中,预热rpmi 1640完全培养基(rpmi 1640+10%fbs)。
[0045]
2)紫外照射完毕,开启生物安全柜。将预热rpmi 1640完全培养基和384孔板用酒精擦拭并放入生物安全柜中,将3种细胞t75培养瓶从培养箱中取出并放入生物安全柜中。
[0046]
3)用移液器将3种细胞悬浮液均转移至50ml离心管中,共50ml,拧紧瓶盖,离心(800rpm,5min)。
[0047]
4)离心去上清,加入50ml完全培养基重悬,取出1ml细胞悬液,用细胞活力计数仪进行计数。
[0048]
5)每孔加45μl上述细胞悬浮液种板,每孔3000个细胞。
[0049]
6)384孔板第2列和第23列加入50μl rpmi 1640+10%fbs培养基,周围加50μlpbs.
[0050]
7)放入培养箱(37℃,5%co2)孵育4小时。
[0051]
8)转移5μl 100μg/ml的jmt101溶液到细胞板h3
‑
h11,i3
‑
i11,j3
‑
j11和k3
‑
k11。
[0052]
9)对100μg/ml的jmt101溶液在384孔板进行3倍稀释,稀释完之后,从稀释板b1
‑
b9转移5μl jmt101溶液到细胞板l3
‑
l11和m3
‑
m11。
[0053]
10)转移5μl完全培养基到细胞板12
‑
22列。
[0054]
11)其他化合物afatinib、osimertinib用tecan hp d300e添加。
[0055]
12)细胞板每孔中dmso含量为体积比0.2%。
[0056]
13)800rpm离心30秒,放入培养箱(37℃,5%co2)培养72小时。
[0057]
14)药物孵育72小时后读板,获取数据。
[0058]
将cell
‑
titer glo reagent和细胞板取出放置室温平衡30min,用分液器multi
‑
drop分液每孔25μl cell
‑
titer glo reagent至384孔板细胞中,中速震荡2min,1000rpm离心1min,10min稳定发光信号;envision读板,luminescence。
[0059]
3、数据分析及结果
[0060]
ic
50
结果由idbs公司的xlfit5进行分析。
[0061]
表1ba/f3 egfr
‑
exon20 v769_d770insasv细胞株中的ic
50
值
[0062]
药物ab ic
50
μmre ic
50
μmafatinib0.0380.039afatinib+jmt101(10μg/ml)0.00520.0078osimertinib0.0720.073osimertinib+jmt101(10μg/ml)0.0160.028jmt101 10μg/ml>10>10
[0063]
注:ab ic
50
即绝对ic
50
,为抑制率50%时的化合物浓度,re ic
50
即相对ic
50
,是抑制率最高值和最低值一半时对应的药物浓度。
[0064]
结果表明,ba/f3 egfr
‑
exon20 v769_d770insasv细胞中,afatinib或osimertinib联合jmt101单抗时的ic
50
明显低于afatinib或osimertinib单独用药时的ic
50
,如图1和图2所示。
[0065]
在ba/f3 egfr
‑
exon20 v769_d770insasv细胞株的细胞增殖实验中,jmt101与阿法替尼或奥希替尼联用,有明显的协同作用。
[0066]
实施例2体内药效评估
[0067]
评价jmt101单药或联合阿法替尼或奥希替尼在baf3 egfr exon20v769_d770insasv肿瘤皮下移植雌性balb/c nude小鼠模型中的体内药效。
[0068]
egfr exon20 v769_d770insasv是指egfr上外显子20(exon 20)的第769位氨基酸v(val,缬氨酸)和第770位氨基酸d(asp,天冬氨酸)之间插入三个氨基酸asv。
[0069]
1、实验材料
[0070]
1.1实验动物
[0071]
雌性、6~8周龄、balb/c nude小鼠,购自上海灵畅生物科技有限公司。
[0072]
1.2药品和阳性对照品信息
[0073]
阿法替尼,生产厂家为上海升德医药科技有限公司,批号:send20190925
[0074]
奥希替尼,生产厂家为上海毕得医药科技有限公司,批号:bmw262
[0075]
jmt101,提供单位为上海津曼特生物科技有限公司,批号:201906071
[0076]
规格:100mg/10.0ml/瓶。
[0077]
2、实验方法和步骤
[0078]
2.1细胞培养
[0079]
baf3 egfr exon20 v769_d770insasv细胞悬浮培养,培养条件为rpmi1640培养基中加10%胎牛血清和1%双抗,37℃,5%co2培养。一周常规传代2次。当细胞维持在指数增长期且细胞活力大于95%时,收取细胞,计数,接种。
[0080]
2.2肿瘤细胞接种
[0081]
在每只小鼠的右侧颈背部接种加了50%matrigel的5
×
105个baf3 egfr exon20 v769_d770insasv细胞。接种同时将实验动物进行5位数字的耳标号标记,作为后续实验的确认标志。肿瘤平均体积达到101mm3时开始分组给药。
[0082]
2.3药物的配制
[0083]
表2药物配制方法
[0084][0085][0086]
注:阿法替尼、奥希替尼每周配制两次,jmt101注射液现配现用,所有药物于4℃保存。
[0087]
2.4实验动物日常观察
[0088]
本实验方案的拟定及任何修改均通过了上海药明康德新药开发有限公司实验动物管理与使用委员会(iacuc)的评估核准。实验动物的使用及福利遵照国际实验动物评估和认可委员会(aaalac)的规定执行。每天监测动物的健康状况及死亡情况,例行检查包括观察肿瘤生长和药物治疗对动物日常行为表现的影响如行为活动,摄食摄水量(仅目测),外观体征或其它不正常情况。
[0089]
2.5肿瘤测量和实验指标
[0090]
实验指标是考察肿瘤生长是否被抑制、延缓或治愈。每周两次用游标卡尺测量肿瘤直径。肿瘤体积的计算公式为:v=0.5a
×
b2,a和b分别表示肿瘤的长径和短径。
[0091]
化合物的抑瘤疗效用tgi(%)或相对肿瘤增殖率t/c(%)评价。tgi(%),反映肿瘤生长抑制率。tgi(%)的计算:tgi(%)=[(1
‑
(某处理组给药结束时平均瘤体积-该处理组开始给药时平均瘤体积))/(溶剂对照组治疗结束时平均瘤体积-溶剂对照组开始治疗时平均瘤体积)]
×
100。
[0092]
相对肿瘤增殖率t/c(%):计算公式如下:t/c(%)=t
rtv
/c
rtv
×
100(t
rtv
:治疗组rtv;c
rtv
:阴性对照组rtv)。根据肿瘤测量的结果计算出相对肿瘤体积(relative tumor volume,rtv),计算公式为rtv(%)=v
t
/v0×
100,其中v0是分组给药时(即d0)测量所得平均肿瘤体积,v
t
为某一次测量时的平均肿瘤体积,t
rtv
与c
rtv
取同一天数据。
[0093]
在实验结束后安乐死动物并剥取肿瘤后测量肿瘤重量,计算t/c
weight
百分比,t
weight
和c
weight
分别表示给药组和溶剂对照组的肿瘤重量,计算公式为:t/c
weight
(%)=
tw
treatment
/tw
vehicle
×
100。
[0094]
2.6肿瘤称重和拍照
[0095]
在给药后第14天,对所有小鼠进行安乐死。所有肿瘤称重和拍照。
[0096]
2.7统计分析
[0097]
基于实验结束时获得的数据进行统计学分析评估组间差异。t检验用于两组间比较。使用graphpad prism软件进行所有数据分析,p<0.05认为有显著性差异。
[0098]
3、实验设计
[0099]
表3药物的体内药效实验方案
[0100][0101]
注:n:每组小鼠数目
[0102]
a.给药体积:根据小鼠体重10μl/g
[0103]
b.如果体重下降超过15%,暂时停药,待小鼠体重恢复到下降<10%时,再继续给药
[0104]
c.vehicle:溶剂对照。
[0105]
d.iv:静脉注射,po:口服给药,qd:一天一次,biw:一周两次
[0106]
4、实验结果
[0107]
4.1肿瘤体积
[0108]
baf3 egfr exon20 v769_d770insasv肿瘤皮下移植雌性balb/c nude小鼠模型的平均肿瘤体积随时间的变化如表4所示。
[0109]
表4各组不同时间点的肿瘤体积
[0110][0111]
注:a.平均值
±
标准误差
[0112]
4.2肿瘤生长曲线及终点肿瘤重量
[0113]
肿瘤生长曲线以及肿瘤体积和肿瘤重量如图3、图4和图5所示。
[0114]
4.3抗肿瘤药效评价指标
[0115]
基于给药后第14天肿瘤体积计算得出受试药物对baf3 egfr exon20 v769_d770insasv肿瘤皮下移植雌性balb/c nude小鼠模型的生长抑制率(表5)。第14天所有组的肿瘤重量如表6所示。
[0116]
表5受试药物对baf3 egfr exon20 v769_d770insasv肿瘤皮下移植雌性balb/c nude小鼠模型的抑瘤药效评价(基于给药后第14天的肿瘤体积计算得出)
[0117][0118]
a.平均值
±
标准误差。
[0119]
b.根据公式t/c(%)=t
rtv
/c
rtv
×
100和tgi(%)=[1
‑
(t
i
‑
t0)/(c
i
‑
c0)]
×
100计算。
[0120]
c.各给药组与vehicle组p值采用one
–
tailed t test分析;
[0121]
d.jmt101与afatinib的联用组与afatinib单用组p值采用one
–
tailed t test分
析分析;
[0122]
e.jmt101与osimertinib的联用组与osimertinib单用组p值采用one
–
tailed t test分析分析。
[0123]
表6实验结束时(第14天)的肿瘤重量及统计学分析
[0124][0125][0126]
a.平均值
±
标准误差。
[0127]
b.根据公式t/c
weight
(%)=tw treatment
/tw
vehicle
×
100计算。
[0128]
c.各给药组与vehicle组p值采用one
–
tailed t test分析;
[0129]
d.jmt101与afatinib的联用组与afatinib单用组p值采用one
–
tailed t test分析;
[0130]
e.jmt101与osimertinib的联用组与osimertinib单用组p值采用one
–
tailed t test分析。
[0131]
5、实验结果及讨论
[0132]
在本实验中,我们评价了受试药物在baf3 egfr exon20 v769_d770insasv肿瘤皮下移植雌性balb/c nude小鼠模型中的体内药效。各实验组在不同时间点测量的肿瘤体积如图4和表4~5所示。肿瘤重量统计结果如表6以及图5所示。
[0133]
在给药14天后,溶剂对照组小鼠的瘤体积达到1595mm3。和溶剂对照组相比,afatinib在15mg/kg(tv=1129mm3,tgi=31.2%,t/c=68.6%,p<0.01),osimertinib在25mg/kg(tv=993mm3,tgi=40.3%,t/c=60.3%,p<0.001)的剂量下均一定程度抑制肿瘤生长,且具有统计学差异。jmt101在50mg/kg(tv=702mm3,tgi=59.8%,t/c=42.3%,p<0.001)的剂量下对baf3 egfr exon20v769_d770insasv肿瘤的生长有较显著的抑制作用。
[0134]
afatinib与jmt101的联合用药(tv=271mm3,tgi=88.6%,t/c=16.5%,p<0.001)对baf3 egfr exon20 v769_d770insasv肿瘤的生长具有显著的抑制作用,与afatinib单药治疗组相比具有统计学差异(p<0.001)。osimertinib与jmt101的联合用药(tv=57mm3,tgi=103.0%,t/c=3.5%,p<0.001)对baf3 egfr exon20 v769_d770insasv肿瘤的生长具有显著的抑制作用,与osimertinib单药治疗组相比具有统计学差异(p<
q2w,联合药物剂量不变)的探索。
[0154]
剂量限制毒性(dlt)剂量水平的前一个剂量水平定义为最大耐受剂量(mtd),在mtd剂量组至少入组6例受试者并进行评估。
[0155]
第二阶段剂量扩增研究:
[0156]
根据第一阶段获得的安全性、耐受性及有效性等数据对目标剂量队列进行剂量扩增研究。选取第一阶段安全性和耐受性良好的所有队列(如果大于4个队列,则最多只选择4个队列),继续纳入一定数量的受试者(加上剂量递增阶段受试者,不超过12例),进一步探索安全性、耐受性、药代动力学特征及抗肿瘤活性。无临床症状的中枢神经系统转移或脑膜转移受试者由研究者决定入组a或者b组,其余受试者在各队列之间按一定顺序采取依次入组的形式。
[0157]
以上所有受试者,治疗期间每4周(28天)作为一个治疗周期,治疗持续进行,直至出现下列情况之一:疾病进展、不能耐受毒性、受试者要求退出或研究者认为受试者不能再从治疗中获益,以先出现者为准。
[0158]
治疗期间需按方案要求进行安全性检查,于第1周期末以及之后每两周期(第3周期、第5周期......)进行一次肿瘤疗效评估(如肿瘤相关症状加重,研究者认为有必要,可缩短肿瘤评估的时间)。在受试者结束末次试验药物给药后,应对其每8周的生存情况、研究结束访视时仍存在的不良事件进行随访。
[0159]
dlt定义为:研究开始给药第1周期内(第1~28天)发生的、判定与研究药物有合理相关性(相关、很可能相关及可能相关)的以下一种或多种毒性反应:
[0160]
(1)非血液学毒性:
[0161]
4级皮疹或引起停药4周的3级皮疹,或伴严重感染的3级皮疹。
[0162]
4级腹泻或停药2周仍未缓解的3级腹泻,或经过适当支持治疗后再次出现的3级腹泻。
[0163]
除皮疹、腹泻外任何3级或以上的非血液毒性(恶心/呕吐、便秘和电解质紊乱须经过适当的支持治疗后仍然≥3级才认为是dlt)。
[0164]
发生间质性肺炎或肺纤维化。
[0165]
(2)血液学毒性:
[0166]
4级中性粒细胞减少,持续超过5天。
[0167]
发热性中性粒细胞减少(anc<1.0
×
10^9/l,一次体温达到38.3℃(腋温)或体温持续≥38℃(腋温)超过一小时)。
[0168]
3级中性粒细胞减少伴有证据的感染。
[0169]
3级血小板减少伴有临床意义的出血。
[0170]
4级血小板减少。
[0171]
4级贫血(危及生命)。
[0172]
(3)其他经研究者判断应永久停用研究药物的毒性反应。
[0173]
所有不良事件将根据《美国国家癌症研究所
‑
不良事件通用术语标准》(nci
‑
ctcae)5.0版进行分级。
[0174]
试验人群:
[0175]
入选标准:
[0176]
1.年龄18~75(含)周岁,性别不限。
[0177]
2.必须有经组织学或细胞学确诊的ⅲb或iv期nsclc,不适合进行根治性手术或放疗,且证实具有egfr 20号外显子插入突变(包括重复突变),初治或一线治疗失败后的患者。
[0178]
*nsclc分期参考《国际肺癌tnm分期标准第7版修订稿》。
[0179]
3.基线至少存在一个符合recist 1.1标准定义的可测量的病灶。
[0180]
4.ecog体能状态评分:0或1分。
[0181]
5.预计生存时间≥3个月。
[0182]
6.主要器官和骨髓功能在治疗前7天内,符合表7所列指标标准(在研究药物给药前7天内未接受过输血、epo、g
‑
csf、gm
‑
csf或其他医学支持治疗):
[0183]
表7器官和骨髓功能在治疗前7天内的指标标准
[0184][0185]
7.有生育能力的女性在试验筛选前7天内的血妊娠试验为阴性;任何有生育能力的男性和女性患者必须同意在整个试验期间以及试验结束后半年内使用有效的避孕方法。根据研究者的判断,患者有生育能力是指:他/她生物学上有能力有孩子以及有正常的性生活。没有生育能力的女性患者(即,满足至少1条以下标准):
[0186]
已行子宫切除术或双侧卵巢切除术,或
[0187]
经医学确认卵巢衰竭,或医学确认为绝经后(无病理性或生理性原因的情况下,至少连续12个月停经)。
[0188]
8.受试者须在试验前对本研究知情同意,并自愿签署书面的知情同意书。
[0189]
排除标准:
[0190]
1.既往接受过egfr单克隆抗体靶向治疗。
[0191]
2.在首次使用研究药物前4周内接受过化疗、生物治疗、靶向治疗、免疫治疗等抗肿瘤治疗,其中:口服小分子靶向药物为首次使用研究药物前2周或已知的药物的5个半衰期内(以时间长者为准);放疗为首次使用研究药物前2周内。
[0192]
3.在首次使用研究药物前4周内接受过其它临床研究药物治疗。
[0193]
4.在首次使用研究药物前4周内接受过主要脏器外科手术(不包括穿刺活检)或出现过显著外伤。
[0194]
5.已知对研究方案药物或其辅料的任何成分的超敏反应或不可耐受的情况。
[0195]
6.在首次使用研究药物前14天内使用过cyp3a4的强效或中度诱导剂、p
‑
gp的强诱导剂和抑制剂者。
[0196]
7.既往抗肿瘤治疗的不良反应尚未恢复到ctcae 5.0等级评价≤1级(脱发等研究者判断无安全风险的毒性除外)。
[0197]
8.具有临床症状的中枢神经系统转移或脑膜转移。
[0198]
9.有自身免疫性疾病史、免疫缺陷病史,包括hiv检测阳性,或患有其他获得性、先天性免疫缺陷疾病,或有器官移植史。
[0199]
10.活动性乙型肝炎(乙型肝炎病毒滴度>1000拷贝/ml或200iu/ml);丙型肝炎病毒、梅毒感染。
[0200]
11.有严重的心血管疾病史,包括但不限于:
[0201]
·
有完全性左束支传导阻滞或ⅲ度房室传导阻滞;
[0202]
·
有心肌梗塞、血管成形术、冠状动脉架桥病史;
[0203]
·
基线期心电图qt/qtc间期延长者(qtcf男性>450ms,女性>480ms);
[0204]
·
严重心律失常,且经研究者判断对本试验有影响的;
[0205]
·
基线超声心动图(echo)或多门控采集(muga)技术显示左室射血分数(lvef)≤50%;
[0206]
·
心力衰竭,纽约心脏病学会(nyha)分级为ii级及以上;
[0207]
·
控制不良的高血压(尽管使用了最优治疗,但bp大于等于150/95mmhg);
[0208]
·
既往或当前患有心肌病,且经研究者判断对本试验有影响的。
[0209]
12.无法口服吞咽药物,或存在经研究者判断严重影响胃肠道吸收的状况。
[0210]
13.首次使用研究药物前5年内已诊断为其他恶性肿瘤;经有效治疗的皮肤基底细胞癌、皮肤鳞状细胞癌和/或经有效切除的原位宫颈癌和/或乳腺癌除外。
[0211]
14.有间质性肺病的既往病史,药物引起的间质性肺病,需要类固醇治疗的放射性肺炎,或临床活动性间质性肺病的任何证据。
[0212]
15.有其它严重的系统性疾病史,经研究者判断不适合参加临床试验的患者。
[0213]
16.已知有酒精或药物依赖。
[0214]
17.既往有明确的神经或精神障碍史,包括癫痫或痴呆。
[0215]
18.妊娠期或哺乳期女性。
[0216]
19.研究者认为受试者存在其他原因而不适合参加本临床研究。
[0217]
试验持续时间:
[0218]
本研究包括两阶段,各阶段研究流程主要包括筛选、治疗、安全性随访和生存随访。第一阶段剂量递增研究中,每例受试者将参与大约6个月的研究治疗,最后一次研究方案规定的治疗结束30天(
±
3天)后,受试者将接受安全性随访访视。在此之后为研究的生存随访部分。由于本研究无法明确预估各研究阶段需纳入的受试者的具体例数。此外,各例受试者的研究持续时间也可能有所不同,取决于是否需要接受后续治疗和无进展生存时间。因此整个研究持续时间仅为初步预估,对于从第一剂试验药物给药至生存随访阶段完成整
个研究的受试者,整个研究的持续时间将大约3.5年。
[0219]
主要终点:
[0220]
不良事件、体格检查、生命体征、实验室检查(包括血常规、血生化、尿常规、凝血功能等)、心电图。
[0221]
次要终点:
[0222]
1、疗效指标:客观缓解率(orr,分别由irc及研究者根据recist 1.1标准评估)、缓解持续时间(dor)、疾病控制率(dcr)、无进展生存期(pfs)、总生存期(os);
[0223]
2、药代动力学指标:包括但不限于auc0‑
t
、auc0‑
inf
、c
max
、t
max
、t
1/2
和cl等;
[0224]
3、抗药抗体和中和抗体发生情况;
[0225]
4、对肿瘤相关的生物标志物进行探索,分析生物标志物与临床结果之间可能的相关性。
[0226]
样本量:
[0227]
共预计入组最少12例,最多不超过48例受试者,更改方案后最多不超过200例受试者。
[0228]
统计分析:
[0229]
分析人群
[0230]
全分析集(full analysis set,fas):所有成功入组,且至少使用一次研究药物的病例集合。
[0231]
符合方案集(per
‑
protocol set,pps):指符合纳入标准、不符合排除标准、完成治疗方案的病例集合,即对符合试验方案、依从性好、完成方案规定的治疗,并且过程中无重大方案偏离的所有受试者的集合进行分析。
[0232]
安全性分析集(safety set,ss):包含所有入组病例至少使用过1次试验用药,且并有用药后安全性记录的全部受试者,均属于安全性分析集。
[0233]
dlt分析集(dlt set):dlt分析集包含所有dlt评估期(1~28d)的受试者,完成dlt评估或者在dlt评估期因不良事件提前退出试验的受试者(由于非研究药物剂量耐受性原因导致dlt不可评估的受试者将不计入dlt统计样本)。该分析集将用于dlt事件的分析和汇总。
[0234]
pk浓度集:至少接受1次研究药物治疗,试验期间至少有1个研究药物血药浓度的受试者。
[0235]
pk参数分析集:至少接受1次研究药物治疗,并能计算出至少一个研究药物的有效pk参数的受试者。
[0236]
免疫原性分析人集:至少接受1次研究药物治疗,且至少有1个抗药抗体样本的受试者。
[0237]
生物标志物分析集:至少接受1次研究药物治疗,且至少有1个生物标志物血样采集的受试者。
[0238]
统计分析方法
[0239]
一般统计原则
[0240]
分类变量的统计描述用例数和百分比(%)表达;连续型变量的统计描述用例数、缺失数、均数、标准差、中位数、下四分位数、上四分位数、最小值、最大值。除特别说明,假设
检验将使用双侧检验,以0.05为检验水准,参数的置信区间估计采用95%置信区间。
[0241]
安全性分析
[0242]
·
不良事件和不良反应:
[0243]
用药期间不良事件和不良反应分析,汇总各组别受试者发生不良事件、不良反应、因不良事件而终止试验、因不良事件而死亡、严重不良事件、dlt事件的例数、例次和百分比;必要时进行发生率的组间比较。
[0244]
根据meddra字典对不良事件和不良反应进行系统器官分类(system organ class,soc)和首选术语(preferred term,pt)编码,并根据soc/pt分类统计不良事件和不良反应的例数、例次和百分比:
[0245]
按soc/pt和严重程度分类统计不良事件和不良反应发生例数、例次和百分比。一个受试者的一类不良事件仅在同一术语(soc或pt)内最高严重程度项下计数1次。
[0246]
对所有不良事件(包括非用药期间的不良事件)、不良反应、严重不良事件、因不良事件而终止研究、因不良事件而死亡、特殊关注不良事件、dlt事件分别进行列表。
[0247]
·
实验室检查:
[0248]
各实验室检查项目的统计时间点包括基线、基线后各访视时间点和末次访视时间点,按剂量组和总计分别统计各时间点测量值、基线后测量结果的最小值、最大值和末次访视观测值,及其相对基线的变化值。
[0249]
通过用药前后临床判定交叉表比较用药前后各指标的正常异常变化情况。
[0250]
按组别列出各实验室检查指标的详细列表。
[0251]
·
生命体征:
[0252]
生命体征检查项目的统计时间点包括基线、基线后各访视时间点和提前退出访视时间点,按组别和总计统计基线、基线后访视时间点、研究结束时的描述性统计结果,并通过用药前后临床判定交叉表比较用药前后各指标的正常异常变化情况(如适用)。
[0253]
·
体格检查和心电图:
[0254]
体格检查项目:一般情况、皮肤粘膜、淋巴结、头颈部、胸部、腹部、脊柱、肌肉骨骼、神经系统及其他部位。通过用药前后临床判定交叉表比较各剂量组用药前后的正常异常变化情况。
[0255]
心电图检查项目包括:心率,pr,qrs,qtc。按剂量组和总计统计基线、基线后各访视时间点,基线后测量结果的最小值,最大值和末次访视观测值及其较基线变化值进行统计分析。通过用药前后临床判定交叉表比较各剂量组用药前后的正常异常变化情况。
[0256]
按组别列出体格检查和心电图检查的详细列表。
[0257]
有效性分析:
[0258]
将根据recist v1.1标准和相关评价结果判断客观缓解率[orr:完全缓解(cr)+部分缓解(pr),由irc评估]、疾病控制率(dcr)(cr+pr+sd)、无进展生存(pfs)、总生存期(os)。
[0259]
计算orr和dcr在各剂量组与所有受试者中的例数、百分比及95%置信区间。
[0260]
采用kaplan
‑
meier法估算所有受试者和各剂量组的中位pfs、中位os及其95%置信区间,绘制生存曲线图。
[0261]
药代动力学分析:
[0262]
(1)第一阶段剂量递增研究
[0263]
用非房室模型分析pk参数分析集数据,计算各受试者的药代参数,包括:首次给药后的c
max
,auc0‑
t
,auc0‑
inf
,t
max
,v
z
,t
1/2
,cl,%auc
ext
,多次给药后c
max,ss
,c
min,ss
,auc0‑
τ
,auc0‑
inf
,t
max,ss
,v
ss
,t
1/2
,cl,c
av,ss
,df,range,%auc
ext
,蓄积指数r
1ac
=c
max,ss
/c
max
,蓄积指数r
2ac
=auc0‑
τ
/auc0‑
t
。同时计算各参数的均数和标准差。
[0264]
(2)第二阶段剂量扩增研究
[0265]
扩增阶段进行稀疏采血,与其它jmt101浓度数据合并进行群体药代动力学分析。
[0266]
免疫原性分析:
[0267]
汇总和分列每个剂量组ada、nabs阳性的例数和发生率。
[0268]
生物标志物分析:
[0269]
药效学生物标志物:根据血浆中游离dna含量高低,确定cut
‑
off值并根据该值确定低和高表达组,采用kaplan
‑
meier法估算所有受试者和各剂量组的中位pfs、中位os及其95%置信区间,绘制生存曲线图。
[0270]
试验实施状态:
[0271]
截止2021
‑2‑
22,本研究已入组48例非小细胞肺癌患者,其中a1队列10例、a2队列4例、b1队列9例、b2队列25例,其中b1和b2队列各脱落1例,未获取给药后首次疗效评价即脱落。
[0272]
研究初步疗效结果:
[0273]
1、分析数据集
[0274]
全分析集(full analysis set,fas):所有成功入组,且至少使用一次研究药物的病例集合。fas主要用于基线及疗效分析。截止2021
‑2‑
22,本试验中,4个队列共有48例纳入fas,分别为a1队列(jmt101联合阿法替尼30mg)10例,a2队列(jmt101联合阿法替尼40mg)4例,b1队列(jmt101联合奥希替尼80mg)9例,b2队列(jmt101联合奥希替尼160mg)25例。
[0275]
符合方案集(per
‑
protocol set,pps):指符合纳入标准、不符合排除标准、完成治疗方案的受试者集合,即对符合试验方案、依从性好、完成方案规定的治疗,并且过程中无重大方案偏离的所有受试者的集合进行分析。本试验尚在进行中,尚未最终讨论哪些受试者不能纳入pps集,故本次疗效数据分析不涉及pps。
[0276]
2、重要人口统计学及基线特征
[0277]
在fas集48例受试者中,男性共16例占33.3%,女性共32例占66.7%;年龄最小26岁,最大74岁,中位年龄为59岁;组织病理类型均为腺癌,入组时临床分期均为iv期,各队列中合并脑转移者均约占一半。初治13例,既往经过一线及以上治疗者共35例。既往至少接受过一次全身化疗者共32例,其中b1队列6例,b2队列14例。
[0278]
b2队列25例受试者中,15例(60%)为女性,10例(40%)为男性;年龄最小36岁,最大74岁,中位年龄60岁;均为iv期腺癌;40%(10例)为初治病例,60%(15例)病例既往接受过一线及以上治疗,56%(14例)病例既往至少接受过一次全身化疗;56%(14例)病例合并有脑转移。
[0279]
3、疗效分析
[0280]
本次疗效分析在fas集进行,48例受试者中基线后至少有一次疗效评价者共46例,其余2例受试者无疗效评价数据,分别为b1和b2队列各脱落1例,均为未获取给药后首次疗效评价即脱落。因irc评价数据相对比较滞后,本次疗效分析均为研究者评价数据。以下本
研究疗效数据已进行初步数据清理。
[0281]
3.1客观缓解率(orr)及疾病控制率(dcr)
[0282]
在fas集,a1队列:部分缓解(pr)3例,疾病稳定(sd)6例,疾病进展(pd)1例,客观缓解率(orr)为30.0%(3/10),疾病控制率(dcr)为90%(9/10);a2队列:部分缓解(pr)0例,疾病稳定(sd)3例,疾病进展(pd)0例,未评估(ne)1例(截止时间未到首次疗效评估时间),客观缓解率(orr)为0,疾病控制率(dcr)为75%(3/4);b1队列:部分缓解(pr)3例,疾病稳定(sd)5例,疾病进展(pd)0例,未评估(ne)1例(脱落),客观缓解率(orr)为33.3%(3/9),疾病控制率(dcr)为88.9%(8/9);b2队列:部分缓解(pr)11例,疾病稳定(sd)12例,疾病进展(pd)1例(新增骨转移病灶,靶病灶疗效评估为pr),未评估(ne)1例(脱落),客观缓解率(orr)为44.0%(11/25),疾病控制率(dcr)为92.0%(23/25)。
[0283]
表8客观缓解率/疾病控制率(研究者评价)
[0284]
数据集:fas
[0285][0286]
注:orr=客观缓解率,dcr=疾病控制率,cr=完全缓解,pr=部分缓解,sd=疾病稳定,pd=疾病进展,ne=未评估,bor=最佳时间点应答,因多例受试者尚未进行第二次肿瘤疗效评价,故上表统计为未经确认的cr和pr。a1队列3例pr中1例已经确认,1例未经确认即pd,1例尚未行疗效确认评价;b1队列3例pr中,2例已经确认,1例尚未行疗效确认评价;b2队列11例pr中,9例已经确认,2例尚未行疗效确认评价。
[0287]
注:orr=cr+pr
[0288]
注:dcr=cr+pr+sd
[0289]
注:ci表示置信区间,95%ci采用clopper
‑
pearson法
[0290]
注:疗效由研究者根据recist v1.1评估
[0291]
3.2无进展生存期(pfs)
[0292]
本研究尚在进行中,从首例受试者入组给药至数据截止时间不足8个月,至数据截止时间48例受试者中仍有34例(占70.8%)持续给药中。故本次疗效分析pfs数据尚未成熟,仅作为初步补充参考。
[0293]
在fas集,a1队列中位pfs为4.6个月(95%ci:1.02~nr),a2队列中位pfs尚未达到(95%ci:2.73~nr),b1队列中位pfs为4.6个月(95%ci:2.73~nr),b2队列中位pfs尚未达到(95%ci:2.50~nr)。
[0294]
表9 pfs分析(研究者评价)数据集:fas
[0295]
项目a1(n=10)a2(n=4)a组(n=14)b1(n=9)b2(n=25)b组(n=34)
无进展生存期(月)
ꢀꢀꢀꢀꢀꢀ
n1041492534事件数n(%)4(40.0)1(25.0)5(35.7)3(33.3)3(12.0)6(17.6)删失数n(%)6(60.0)3(75.0)9(64.3)6(66.7)22(88.0)28(82.4)
ꢀꢀꢀꢀꢀꢀꢀ
kaplan
‑
meier估计
ꢀꢀꢀꢀꢀꢀ
50%(95%ci)4.6(1.02~.).(2.73~.)4.6(2.73~.)2.8(2.79~.).(2.50~.)2.9(2.76~.)
[0296]
注:无进展生存期(pfs)定义为开始使用研究药物至首次记录疾病进展(pd)或任何原因引起死亡的时间。pfs(月)=(pfs事件或删失日期
‑
首次用药日期+1)/30.4375
[0297]
3.3亚组分析
[0298]
将orr、dcr及pfs依据各队列或各组受试者抗肿瘤治疗线数及是否合并脑转移进行亚组分析。拟开发的目标适应症为既往至少接受过一次全身化疗的携带egfr 20号外显子插入突变的局部晚期或转移性nsclc。关键试验拟采用的治疗方案为b2队列治疗方案:jmt101 6mg/kg q2w,联合奥希替尼160mg qd。
[0299]
3.3.1一线治疗有效性数据
[0300]
根据orr、dcr及pfs亚组分析的结果,在本研究联合治疗作为一线治疗(即入组时为初治患者)受试者中,各组的疗效情况为:a组共1例,疗效为部分缓解(pr),客观缓解率(orr)和疾病控制率(dcr)均为100.0%(1/1),pfs未达到;b组共12例,部分缓解(pr)5例,疾病稳定(sd)6例,疾病进展(pd)1例(新增骨转移病灶,靶病灶疗效评价为pr),客观缓解率(orr)为41.7%(5/12),疾病控制率(dcr)为91.2%(11/12),pfs尚未达到。fas集一共48例受试者中,一线治疗共13例,部分缓解(pr)6例,疾病稳定(sd)6例,疾病进展(pd)1例(新增骨转移病灶,靶病灶疗效评价为pr),客观缓解率(orr)为46.2%(6/13),疾病控制率(dcr)为92.3%(12/13),pfs尚未达到。
[0301]
上述一线治疗疗效数据表明,本研究联合治疗在初治患者中疗效亦明显,与一线标准治疗含铂双药化疗疗效相当,且整体orr数值上较含铂双药化疗有升高趋势。
[0302]
3.3.2目标适应症(既往至少接受过一次全身化疗)有效性数据
[0303]
根据orr及dcr亚组分析的结果,在目标适应症既往至少接受过一次全身化疗的携带egfr 20号外显子插入突变的局部晚期或转移性nsclc,各队列的疗效情况为:a1队列共9例:部分缓解(pr)2例,疾病稳定(sd)6例,疾病进展(pd)1例,客观缓解率(orr)为22.2%(2/9),疾病控制率(dcr)为88.9%(8/9);a2队列共3例:部分缓解(pr)0例,疾病稳定(sd)2例,疾病进展(pd)0例,未评估(ne)1例(截止时间未到首次疗效评估时间),客观缓解率(orr)为0,疾病控制率(dcr)为66.7%(2/3);b1队列共6例:部分缓解(pr)0例,疾病稳定(sd)5例,疾病进展(pd)0例,未评估(ne)1例(脱落),客观缓解率(orr)为0(0/6),疾病控制率(dcr)为83.3%(5/6);b2队列共14例:部分缓解(pr)7例,疾病稳定(sd)6例,疾病进展(pd)0例,未评估(ne)1例(脱落),客观缓解率(orr)为50.0%(7/14),疾病控制率(dcr)为92.9%(13/14)。在既往至少接受过一次全身化疗的受试者中,b2队列客观缓解率数值上明显高于其他队列,疾病控制率数值上也高于其他队列。
[0304]
根据pfs亚组分析结果,在目标适应症既往至少接受过一次全身化疗受试者中,a组(联合阿法替尼治疗组)共12例,中位pfs为4.6个月(95%ci:2.73~nr)。b组(联合奥希替尼治疗组)共20例,中位pfs为2.9个月(95%ci:2.76~nr)。其中b1队列共6例,中位pfs为
2.8个月(95%ci:2.79~nr),b2队列共14例,中位pfs尚未达到(95%ci:2.76~nr)。
[0305]
目标适应症在关键试验拟采用治疗方案及剂量下疗效显著
[0306]
根据亚组分析的结果,在目标适应症既往至少接受过一次全身化疗的携带egfr 20号外显子插入突变的局部晚期或转移性nsclc,关键试验拟采用的治疗方案及剂量下(即b2队列)的疗效情况为:共14例受试者,部分缓解(pr)7例,其中5例为经确认的pr,其余2例pr受试者尚未进行疗效确认评价,疾病稳定(sd)6例,疾病进展(pd)0例,未评估(ne)1例(首次疗效评价前脱落),客观缓解率(orr)为50.0%(7/14,95%ci:0.230
‑
0.770),疾病控制率(dcr)为92.9%(13/14,95%ci:0.661
‑
0.998),中位pfs尚未达到(95%ci:2.76~nr)。b2队列在至少有一次疗效评价的13例受试者中,客观缓解率(orr)为53.8%(7/13,95%ci:0.251
‑
0.808)。与目标适应症人群目前参照的标准治疗多西他赛单药疗效(journal of clinical oncology,2000,18(12):2354
‑
2362;journal of clinical oncology,2004,22(9):1589
‑
1597)(orr不到10%,pfs不到3个月,此为多西他赛在nsclc人群中的疗效数据,未检索到多西他赛单药化疗在egfr exon20ins nsclc中的前瞻性或回顾性临床研究数据)相比,jmt101与奥希替尼160mg的联合治疗方案疗效数据具有显著优势。与文献报道的奥希替尼160mg单药治疗既往经过一线治疗的egfr exon20ins nsclc临床研究的orr 25%(4/12)(journal of clinical oncology,2020,38(15_suppl):9513
‑
9513)、奥希替尼160mg单药治疗egfr exon20ins nsclc真实世界研究的orr 0%(0/9)(lung cancer.2021feb;152:39
‑
48.)相比,jmt101与奥希替尼160mg的联合治疗方案增效显著。
[0307]
表10 orr/dcr亚组分析
‑
(研究者评价)
[0308]
数据集:fas
[0309]
[0310][0311]
注:orr=客观缓解率,dcr=疾病控制率
[0312]
注:orr=cr+pr,此处cr或pr为未经确认的cr或pr
[0313]
注:dcr=cr+pr+sd
[0314]
注:ci表示置信区间,95%ci采用clopper
‑
pearson法
[0315]
注:疗效由irc根据recist v1.1评估。
[0316]
表11 pfs分析亚组分析(研究者评价)_a组
[0317]
数据集:fas
[0318][0319]
表12 pfs分析亚组分析(研究者评价)_b组
[0320]
数据集:fas
[0321]
[0322][0323]
表13 pfs分析亚组分析(研究者评价)_b1队列
[0324]
数据集:fas
[0325][0326]
表14 pfs分析亚组分析(研究者评价)_b2队列
[0327]
数据集:fas
[0328][0329]
3.4、疗效结论
[0330]
本研究初步疗效数据显示,在fas集,客观缓解率b组(联合奥希替尼队列)数值上明显高于a组(联合阿法替尼队列),其中以b2队列数值最高,orr为44.0%。疾病控制率b组数值上高于a组,其中以b2队列数据最高,dcr为92.0%。a1队列和b1中位pfs均为4.6个月,a2队列和b2队列中位pfs均尚未达到。亚组分析提示,一线治疗疗效数据表明,本研究联合治疗在初治患者中疗效亦明显,与一线标准治疗含铂双药化疗疗效相当,且整体orr数值上较含铂双药化疗有升高趋势。
[0331]
在目标人群既往至少接受过一次全身化疗受试者中,关键研究拟采用的联合治疗
方案及剂量即b2队列客观缓解率数值上明显高于其他队列,疾病控制率数值上也高于其他队列:客观缓解率(orr)为50.0%,疾病控制率(dcr)为92.9%;b2队列在至少有一次疗效评价的13例受试者中,客观缓解率(orr)为53.8%(7/13,95%ci:0.251
‑
0.808)。中位pfs尚未达到。本研究初步疗效数据表明,jmt101在6mg/kg q2w静脉滴注给药方式下联合奥希替尼160mg qd口服给药,治疗既往至少接受过一次全身化疗的携带egfr 20号外显子插入突变的局部晚期或转移性nsclc疗效显著,具备显著优于现有治疗的潜力。
[0332]
重要术语:
[0333]
靶病灶的疗效评价:
[0334]
完全缓解(cr):所有靶病灶消失,任何病理性淋巴结(无论是否为靶病灶)的短轴值必须<10mm。
[0335]
部分缓解(pr):以基线状态总直径为参照,所有靶病灶直径的总和至少减小30%。
[0336]
疾病进展(pd):以研究过程中最小病灶总直径为参照(包括基线的病灶直径总和,假如其为最小值),所有靶病灶直径总和至少增加20%。另外,除了直径总和相对增加20%,其总和的绝对值还必须增加至少5mm(注:出现一个或更多的新病灶也可认为是病情进展)。
[0337]
疾病稳定(sd):以研究过程中最小病灶直径总和为参照,病灶缩小既不符合pr,病灶增加也不符合pd。
[0338]
客观缓解率(orr):定义为开始使用研究药物至退出研究期间,由独立评审委员会(irc)根据实体瘤的疗效评价标准(recist v1.1)评价,最佳时间点应答为完全缓解(cr)或部分缓解(pr)(即cr+pr)所占的比例。
[0339]
疾病控制率(dcr):定义为开始使用研究药物至退出研究期间,根据recist 1.1标准评价,最佳时间点应答为cr、pr、疾病稳定(sd)(即cr+pr+sd)所占的比例。
[0340]
无进展生存期(pfs):定义为开始使用研究药物至首次记录疾病进展(pd)或死亡日期之间的时间,取决于哪一个首先发生。
[0341]
总生存期(os):定义为开始使用研究药物至任何原因导致的死亡日期之间的时间。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1