甲磺酸去铁胺在制备抗肿瘤药物中的应用
1.本发明属于抗肿瘤药物技术领域,具体涉及甲磺酸去铁胺在制备抗肿瘤药物中的应用。
背景技术:
2.肝细胞癌(hcc)占原发性肝癌的90%以上,是最常见的消化道恶性肿瘤。who国际癌症中心统计显示,全世界每年新增超过70万hcc病例,是全球癌症死亡的第二大原因,而我国是hcc的重灾区,发病人数和死亡人数均超过全球的50%。hcc为富血供、多中心发生,具有侵袭性,易发生肝内扩散和肝外转移,预后较差,一旦发现就已经是中晚期,可手术率只有15%,总体生存率仅12.1%。肝癌传统治疗方法主要有肝切除、肝移植、肝动脉化疗栓塞、局部消融治疗等,然而,总的5年生存率仍然小于20%。因此,进一步了解肿瘤发生的分子机制对于制定治疗策略或针对hcc的新靶点至关重要。
3.甲磺酸去铁胺(deferoxamine mesylate,简称dfo)是一种链球菌发酵液中提纯的有机分子,其可以与游离或者蛋白结合的fe
3+
相结合而形成的稳定的、无毒的、可溶于水中的铁铵,最终通过尿液排出体外。dfo在在临床上用于治疗遗传性血色素沉着症、弗里德赖希共济失调症、地中海贫血等疾病,并取得了一定的疗效。目前,关于甲磺酸去铁胺在肝细胞癌治疗方面的研究还没有报道。
技术实现要素:
4.本发明的目的在于提供甲磺酸去铁胺在制备抗肿瘤药物中的用途。
5.为了实现上述目的,本发明采用以下技术方案:
6.甲磺酸去铁胺在制备抗肿瘤药物中的应用,所述肿瘤为肝癌。
7.具体的,所述药物为抑制肝癌细胞增殖的药物。
8.具体的,所述药物通过诱导线粒体功能障碍抑制肝癌细胞增殖。进一步的,所述药物通过降低肝癌细胞铁含量,影响线粒体呼吸链电子传递,破坏线粒体结构和细胞能量代谢导致线粒体功能障碍。
9.具体的,所述药物为阻滞肿瘤细胞周期进展的药物,所述肿瘤为肝癌。
10.具体的,所述药物为抑制肿瘤生长的药物,所述肿瘤为肝癌。
11.优选的,所述药物的给药途径为腹腔注射。
12.本发明取得的有益效果:
13.本发明提供了甲磺酸去铁胺在制备抗肿瘤药物中的用途。本发明通过体外实验证明,甲磺酸去铁胺(dfo)在体外能够抑制肝癌细胞的增殖;通过小鼠荷瘤试验证明,100mg/kg dfo对小鼠是一个安全剂量,可以减少小鼠铁负荷,不会影响小鼠体重、肝肾指数、组织结构合生化指标,同时可抑制异种移植瘤的生长。体内、外试验结果一致表明,dfo能够降低肝癌细胞的铁负荷,抑制肝癌细胞的增殖,具有抗肿瘤作用。本发明进一步对dfo的抗肿瘤作用机制进行了探究,发现dfo降低细胞铁含量,通过破坏线粒体结构和线粒体呼吸电子传
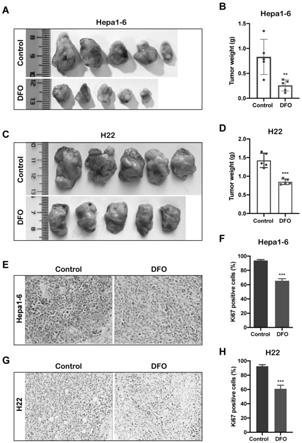
递链而导致线粒体功能障碍,从而影响细胞能量代谢,抑制肝癌细胞增殖;同时,dfo能够阻滞肿瘤细胞周期进展,从而抑制hcc增殖和肿瘤生长。本发明为甲磺酸去铁胺提供了新的医药用途。
附图说明
14.图1为本发明去铁胺药物dfo在体外抑制肝癌细胞增殖的示意图;
15.图中,a
‑
c为cck
‑
8法检测不同浓度dfo(0、25、50、100umol/l)处理肝癌细胞hepg2、huh7和hepa1
‑
6的结果;d
‑
f为实时无标记细胞分析仪记录25umol/l的dfo作用于肝癌细胞(hepg2、huh7、hepa1
‑
6)的结果;g
‑
h为25umol/l的dfo处理肝癌细胞(hepg2、huh7、hepa1
‑
6)平板克隆结果。
16.图2为本发明提供的腹腔注射药物dfo对小鼠安全剂量评价的示意图;
17.图中,a为不同浓度dfo(0、50、100、200、400mg/kg)腹腔注射后的小鼠体重变化的结果;b为上述浓度dfo腹腔注射后的小鼠肝脏指数分析的结果;c为上述浓度dfo处理的小鼠肝细胞中谷丙转氨酶(alt)水平分析的结果;d为上述浓度dfo处理的小鼠肝细胞中谷草转氨酶(ast)水平分析的结果;e为上述浓度dfo处理的小鼠肝脏组织he染色的结果。f为上述浓度dfo处理的小鼠肾脏指数分析的结果;g为上述浓度dfo处理后小鼠血尿素氮(bun)水平分析的结果;h为上述浓度dfo处理的小鼠血肌酐(scr)水平分析的结果;i为上述浓度dfo处理的小鼠肾脏组织he染色的结果。
18.图3为本发明提供的腹腔注射药物dfo在体内抑制肝癌小鼠皮下瘤的生长
19.图中,a、c分别为皮下注射肝癌细胞hepa1
‑
6、h22皮下瘤模型dfo组和对照组小鼠剥除的瘤体;b、d分别为肝癌细胞hepa1
‑
6、h22皮下瘤模型dfo组和对照组瘤体重量的对比;e、g分别为肝癌细胞hepa1
‑
6、h22皮下瘤模型dfo组和对照组针对ki
‑
67的抗体对肿瘤组织切片进行ihc染色;f、h分别为肝癌细胞hepa1
‑
6、h22皮下瘤模型dfo组和对照组中具有ki
‑
67表达阳性的细胞数。
20.图4为本发明提供的腹腔注射药物dfo降低肝癌细胞和小鼠肝、脾、皮下瘤组织组织的铁负荷;
21.图中,a
‑
d在荧光显微镜下观察正常肝癌细胞和dfo处理48h后的肝癌细胞hepg2、huh7、hepa1
‑
6的lip荧光强度对比的结果;e为普鲁士蓝染色镜下观察到肝脏中的铁沉积;f为普鲁士蓝染色镜下观察到脾脏中的铁沉积;g为普鲁士蓝染色镜下观察到h22肿瘤组织中的铁沉积;h为普鲁士蓝染色镜下观察到hepa1
‑
6肿瘤组织中的铁沉积。(20倍,40倍)
22.图5为本发明本发明提供的去铁胺药物dfo诱导肝癌细胞g0/g1期阻滞;
23.图中,a
‑
b为为25umol/l的dfo处理hepg2 48小时后通过流式细胞法评估细胞周期进展;c
‑
d为25umol/l的dfo处理huh7 48小时后通过流式细胞法评估细胞周期进展;e
‑
f为25umol/l的dfo处理hepa1
‑
6 48小时后通过流式细胞法评估细胞周期进展。
24.图6为本发明提供的去铁胺药物dfo影响代谢途径;
25.图中,a为用25umol/l dfo处理hepg2 48h,提取rna送检rna
‑
seq,计算差异基因;b为通过kegg富集分析途径的变化。
26.图7为本发明提供去铁胺药物dfo对肝癌细胞相关蛋白表达影响;
27.图中,a为蛋白免疫印迹(wb)分析hepg2和huh7在使用25umol/l dfo或不使用dfo
处理48h后的蛋白表达情况;b、c为用image j软件计算蛋白的相对水平。
28.图8为本发明提供去铁胺药物dfo导致hcc细胞线粒体功能障碍。
29.图中,a为线粒体功能调节过程中的电子转移链示意图;b为hepg2细胞经25umol/l dfo处理48h后用线粒体呼吸链复合物i
‑ⅳ
活性测定试剂盒测定线粒体呼吸链复合物i
‑ⅳ
的活性;c为huh7细胞经25umol/l dfo处理48h后用线粒体呼吸链复合物i
‑ⅳ
活性测定试剂盒测定线粒体呼吸链复合物i
‑ⅳ
的活性;d为hepg2在25umol/l浓度下用dfo处理48h后电镜下线粒体的图像,箭头表示膜变化的主要方向;e为huh7在25umol/l浓度下用dfo处理48h后电镜下线粒体的图像,箭头表示膜变化的主要方向;f为hepg2经25umol/l dfo处理或不处理48h后荧光显微镜下图像,荧光图像显示jc
‑
1的单体荧光(绿色)和聚集荧光(红色);g为huh7经25umol/l dfo处理或不处理48h后荧光显微镜下图像,荧光图像显示jc
‑
1的单体荧光(绿色)和聚集荧光(红色)。
具体实施方式
30.下面结合具体实施方式对本发明作进一步描述,但本发明的保护范围并不仅限于此;以下实施例中所涉及的仪器设备如无特别说明,均为常规仪器设备;所涉及的试剂如无特别说明,均为市售常规试剂;所涉及的试验方法,如无特别说明,均为常规方法。
31.实施例中的人肝癌细胞株(hepg2、huh7)购自于中国科学院细胞库。小鼠肝癌细胞株(hepa1
‑
6和h22)从中国细胞培养中心采集。这些细胞在补充10%胎牛血清的dmem(hyclone,logancity,usa)中维持(fbs,gbico,美国格兰岛),100u/ml青霉素和0.1mg/ml链霉素。细胞在37℃5%co2加湿的大气中孵育。
32.实施例1 cck
‑
8法检测dfo对肝癌细胞增殖的影响
33.用不同浓度的dfo(0、25、50、100mol/l)处理hepg2、huh7和hepa1
‑
6细胞。细胞以每孔3
×
103个细胞的密度接种于96孔板。部分细胞用不同浓度的dfo(25,50,100mol/l,dfo购自诺华制药有限公司)孵育,其他细胞作为对照组。培养12h后,在指定的时间点(24、48、72和96h)分别向每孔中加入cck
‑
8(日本熊本岛dojindo)细胞10mol/l。细胞孵育2小时后,用酶标仪在450nm处测定光密度值。
34.结果如图1a
‑
c所示,25、50、100mol/l dfo组的细胞增殖与对照组相比差异有统计学意义。因此,我们选择剂量为25mol/l的dfo进行48h的进一步实验。
35.实施例2 rtca实时细胞分析系统动态监测dfo对肝癌细胞增殖的影响
36.采用rtca实时无标记细胞功能分析仪(ixl8,美国acea公司)测量hcc细胞生长速率。将rtca实时无标记细胞功能分析仪置于37℃、5%co2的加湿培养箱中,在8孔电子板中加入100ul/孔含有10%fbs的培养基,并立即记录背景读数。然后将48000个肝癌细胞分别加入300个大鼠肝细胞悬液中。孵育24小时后,将dfo添加到培养基中(dfo终浓度为25mol/l),连续监测96小时,每隔1小时记录细胞生长速率。
37.结果显示,25mol/l的dfo处理显著抑制hepg2、huh7和hepa1
‑
6细胞的增殖(图1d
‑
f)。
38.实施例3 克隆形成试验
39.分别将hepg2、huh7和hepa1
‑
6细胞接种于6孔板(500个/孔),实验组用25mol/l的dfo处理。细胞在37℃孵育10天。第10天pbs洗涤细胞3次。4%多聚甲醛固定30min,0.5%结
晶紫室温染色30min,观察并计数细胞菌落。
40.菌落形成实验结果表明,与对照组相比,25mol/l dfo处理后的细胞增殖能力明显下降。与对照组相比,dfo处理后hepg2、huh7和hepa1
‑
6细胞的集落形成率分别下降了52.74%、52.13%和89.07%(p<0.05;图1g、h)。
41.由实施例1
‑
3的试验结果可知,dfo在体外能够抑制肝癌细胞的增殖。
42.实施例4 动物实验
43.1.dfo对小鼠最大耐受剂量确定
44.将昆明雄性小鼠(vital river实验动物科技有限公司)随机分为5组(n=5)。对照组给予0.9%生理盐水腹腔注射。dfo组小鼠腹腔注射dfo 50、100、200、400mg/kg/d,连续14天。每隔一天评估一次体重。动物实验结束时,收集肝脏和肾脏,用4%的组织固定液固定,进行组织学分析。
45.从血液中提取血清,并将其储存在
‑
80℃,用于进一步的生化参数估计。所有动物实验均按照新乡医学院动物护理委员会批准的方案进行指导执行,依照英国动物(科学程序)法案1986和相关的指导方针。
46.结果如图2a所示,dfo 50、100、200mg/kg/d处理组与对照组的体重差异无统计学意义(p>0.05)。dfo剂量为400mg/kg/d时,小鼠体重显著下降(p<0.01)。结果表明,400mg/kg dfo对小鼠可能有毒性作用。采用血液生化指标和组织病理学检查监测肝肾功能,结果如图2b
‑
d所示,dfo(200mg/kg和400mg/kg)组小鼠肝脏指数、血清alt和ast均较溶血剂组显著升高(p<0.05)。he染色显示,400mg/kg dfo处理组肝细胞肿胀(图2e)。而dfo组的血液生化指标、肾指数及he染色未见明显的肾损伤(图2f
‑
i)。根据上述实验结果,在接下来的动物给药中使用100mg/kg dfo。
47.2.小鼠荷瘤试验
48.为了确定dfo是否在体内抑制肿瘤的发展,建立了皮下肝肿瘤小鼠模型。昆明小鼠随机分为2组,对照组和dfo组。然后皮下注射2
×
106hepa1
‑
6细胞或h22细胞。接种肿瘤6天后,dfo组腹腔注射100mg/kg/d dfo,连续注射14天,对照组腹腔注射等量ns。每隔一天监测小鼠体重和肿瘤大小。实验结束时,记录体重和瘤重。收集肝脏、脾脏及肿瘤组织进行普鲁士蓝染色,并收集肿瘤组织作进一步实验。
49.2.1组织学及免疫组化分析:分离肝、肾、肿瘤,石蜡包埋。苏木精
‑
伊红染色切片后观察肝、肾的病理变化。在免疫组织化学分析(ihc)中,肿瘤标本按照先前研究的(ren f,wu k,yang y,et al.dandelion polysaccharide exerts anti
‑
angiogenesis effect on hepatocellular carcinoma by regulating vegf/hif
‑
1αexpression[j].frontiers in pharmacology,2020,11:460.)进行评估。图片由尼康光学显微镜(尼康公司,东京,日本)采集。
[0050]
2.2普鲁士蓝染色:取小鼠肝脏、脾脏和肿瘤,制作冷冻切片。普鲁士蓝染色,冷冻切片用等体积的20%盐酸和10%三水合亚铁氰化钾孵育,perls stain溶液(solarbio science&technology co.,ltd,beijing,china)室温孵育30分钟。样品脱水后用光学显微镜(尼康公司,东京,日本)观察。
[0051]
免疫组化分析结果如图3a
‑
d所示,在hepa1
‑
6和h22荷瘤小鼠中,dfo处理的肿瘤体积和重量均较盐水处理对照组明显降低。与盐水处理对照组相比,dfo处理组hepa1
‑
6和h22
荷瘤小鼠的平均肿瘤重量分别降低68.88%和40.08%(p<0.01)。ki
‑
67是细胞增殖的分子标记。免疫组化染色证实,dfo处理的肿瘤中ki
‑
67的表达明显低于盐水处理的对照组(图3e
‑
h)。
[0052]
组织中的铁沉积是含铁血黄素,由聚集的铁蛋白分子形成。用普鲁士蓝染色法检测组织中的铁沉积含铁血黄素呈蓝色颗粒。普鲁士蓝染色结果如图4e
–
h所示,与对照组相比,dfo降低了肝脏、脾脏和肿瘤组织中蓝色含铁血黄素的沉积。
[0053]
由实施例4的试验结果可知,100mg/kg dfo对小鼠是一个安全剂量,可以减少小鼠铁负荷,不会影响小鼠体重、肝肾指数、组织结构合生化指标,同时可抑制异种移植瘤的生长。
[0054]
实施例5 细胞内不稳定铁池(lip)的测量
[0055]
为了确定dfo是否减少了肝癌患者的lip,用25mol/l dfo或不加25mol/l dfo分别预处理hepg2、huh7和hepa1
‑
6细胞48h,然后用荧光铁敏感探针calcein
‑
am检测肝癌细胞的lip。简单地,用0.15mol/l calcein
‑
am 37℃孵育20min,pbs洗涤2次。然后用荧光显微镜(激发,490nm;发射,515nm),使用image j软件测定荧光密度。
[0056]
结果如图4a
‑
d所示,25mol/l dfo处理后的细胞中,calcein
‑
am荧光明显失活,提示各组细胞游离铁含量下降。
[0057]
由实施例4
‑
5的试验结果可知,体外试验结果与动物体内试验结果一致,dfo能够降低肝癌细胞的铁含量。
[0058]
实施例6 dfo对肝癌细胞增殖的影响
[0059]
众所周知,细胞凋亡与细胞活力密切相关。dfo(25mol/l)分别处理hepg2、huh7和hepa1
‑
6细胞后,用胰蛋白酶收集细胞,pbs洗涤2次。用于细胞周期检测时,先用75%冷乙醇4℃固定12h,用100mg/ml pi溶液(中国博时生物科技有限公司)避光染色30min;用于细胞凋亡检测时,收集细胞,按照说明书中所述,用annexin v
‑
fitc和pi溶液孵育15min。使用facs calibur(bd biosciences,san jose,ca)分析细胞周期和细胞凋亡。
[0060]
细胞周期分析结果如图5a
‑
f所示,dfo诱导hepg2、huh7和hepa1
‑
6细胞周期的g0/g1期阻滞。dfo使hepg2细胞的g0/g1期细胞数量从56.84%增加到69.96%,使huh7细胞从56.58%增加到70.96%,使hepa1
‑
6细胞从43.36%增加到75.55%(p<0.01)。
[0061]
实施例7 rna测序分析
[0062]
dfo通过降低铁负荷抑制hcc增殖和肿瘤生长,但其潜在机制尚不十分清楚。因此,利用rna
‑
seq来确定dfo处理的潜在机制。
[0063]
采用bgiseq
‑
500测序系统(北京基因组学研究所,中国广东)对对照和dfo处理(25mol/l,48h)hepg2(每个有3个生物学重复)进行rna测序。使用rsem工具对基因表达进行量化和归一化。采用noiseq法对对照组和dfo处理的hepg2细胞之间的差异表达基因进行了筛选。对degs进行kegg通路富集分析。
[0064]
结果如图6a所示,kegg富集分析发现,dfo处理后,327个基因转录下调,556个基因转录上调。此外,代谢途径是dfo影响的主要途径(图6b)。
[0065]
实施例8 免疫印迹(wb)分析凋亡通路蛋白的表达情况
[0066]
分别用dfo或不加dfo处理hepg2和huh7细胞48h,然后用免疫印迹(ib)分析凋亡通路蛋白的表达情况。用ripa裂解缓冲液提取细胞和组织裂解液,bca蛋白检测试剂盒
(beyotime)检测蛋白浓度。制备蛋白裂解液,置于sds
‑
page上,转移到pvdf膜上,用2.5%的脱脂牛奶在室温下印迹1小时。本实施例使用的一抗为:tubulin,(santa cruz biotechnology,santa cruz,usa);bcl
‑
2、bax、cleaved
‑
caspase
‑
3和细胞色素c分别来自abways technology(上海)和ki67(cell signaling technology,美国beverly)。主要抗体在4℃孵化12h,二抗(山羊anti
‑
rabbit/鼠标免疫球蛋白)孵化在37℃ 1h然后用增强化学发光(ecl)处理细胞膜,并使用强发光仪捕获图像。
[0067]
结果如图7a
‑
c所示,dfo降低了抗凋亡蛋白bcl2的表达。相反,许多凋亡蛋白,包括bax,cleaved
‑
caspase3和细胞色素c(cytochrome c,cytc)在dfo处理后表达上调。
[0068]
由实施例6
‑
8的试验结果可知,dfo在机制上通过细胞周期阻滞和细胞凋亡抑制hcc增殖和肿瘤生长。
[0069]
实施例9 透射电子显微镜分析(tem)
[0070]
收集细胞,2%戊二醛固定2小时,pbs洗涤,乙醇梯度脱水后,包埋于环氧树脂中。超薄切片用醋酸铀酰和柠檬酸铅染色。切片用透射电子显微镜(jeol,eching,germany)成像。
[0071]
结果如图8d
‑
e所示,dfo预处理48小时后的肝癌细胞出现线粒体损伤的现象:线粒体数量减少,线粒体外膜破裂,出现明显的肿胀,并伴有线粒体嵴扭曲,而对照组的线粒体变化不大。
[0072]
实施例10 线粒体膜电位(δψm)测定和呼吸链(mrc)活性测定
[0073]
肝癌细胞接种于6孔板。25mol/l dfo处理48h后,用jc
‑
1(beyotime)染色,37℃孵育20min,pbs洗涤2次。荧光显微镜捕捉荧光图像。
[0074]
mrc复合物i
‑
iv活性检测采用比色法,使用mrc复合物i
‑
iv活性检测试剂盒(solarbio life sciences,北京,中国)。将hepg2、huh7细胞接种在6孔板中,用或不加25mol/l dfo处理48小时,然后根据制造商的说明进行所有的检测。每个处理进行三个独立重复。
[0075]
线粒体呼吸电子传递链(etc)在线粒体功能中起重要作用。它由四个氧化还原酶复合物(复合物i、ii、iii和iv)和两个移动电子转运体(包括cytc)组成,利用电子流动调节atp的产生(图8a)。本发明通过评估mrc复合物i、ii、iii和iv在hepg2和huh7细胞中的活性来评估线粒体功能。
[0076]
结果数据(图8b和图8c)表明,25umol/l dfo处理48h后复合物i、ii和iv活性明显降低降低(p<0.001)。另外,如图8f和图8g所示,对照组中jc
‑
1主要是以红色荧光聚集在线粒体中,这意味着线粒体膜电位升高,dfo处理后的肝癌细胞,jc
‑
1通过绿色发射荧光作为单体在细胞质中积累,导致红色荧光的损失,即线粒体膜电位下降。在线粒体膜电位较高时,jc
‑
1聚集在线粒体的基质(matrix)中,形成聚合物(j—aggregates),可以产生红色荧光;在线粒体膜电位较低时,jc
‑
1不能聚集在线粒体的基质中,以单体形式存在,可以产生绿色荧光。dfo处理48h后的肝癌细胞相对于对照组,红光明显减弱,绿光较强(图8f
‑
g),提示dfo可以降低肝癌细胞的线粒体膜电位。
[0077]
由实施例9
‑
10的试验结果可知,dfo通过破坏线粒体结构和线粒体呼吸电子传递链而导致线粒体功能障碍,从而影响细胞能量代谢,抑制肝癌细胞增殖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1