截短侧耳素类化合物在治疗万古霉素耐药屎肠球菌感染性疾病中的应用
1.本发明属于医药化学领域,具体涉及截短侧耳素类化合物在治疗万古霉素耐药屎肠球菌感染性疾病中的应用。
背景技术:
2.抗菌药物在治疗和控制微生物感染疾病方面发挥着至关重要的作用,保障了人类和动物的健康。但是,抗菌药物的大规模和不规范使用导致的细菌耐药性问题日益严重,致使多种抗菌药物对细菌感染的疗效降低或无效。为保障人类健康和畜牧业的持续发展,开发有效的治疗方案提高现有抗菌药物的使用效率势在必行。屎肠球菌(enterococcus faecium)是一种广泛存在于人体及动物体内的重要条件致病菌,被认为是危险性较低的病原菌,但万古霉素耐药屎肠球菌(vancomycin
‑
resistant enterococcus faecium,vre
fm
)出现后,由vre
fm
引发的感染率和持续定殖率明显提高,为临床治疗带来严重威胁(sci rep,2018,8,5098
‑
5109),2016年被世界卫生组织列为12种“急需新抗生素治疗的细菌”之一。vre
fm
可引起的感染主要为腹腔感染和肺部感染,其次为泌尿道感染、皮肤感染和血液感染,严重时可导致脓毒血症,且vre
fm
极易引起院内感染并且容易感染各种癌症、泌尿系统疾病和脑梗死等重症患者,这也是vre
fm
感染死亡率高的原因之一(nat rev microbiol,2012,10,266
‑
278)。此外,vre
fm
可在健康的人和动物胃肠道中存在,并在合适的条件下进行定殖和传播,引起全身感染,尤其是在经过抗生素治疗并且免疫力低下的重症患者体内,定殖在胃肠道的vre
fm
扩散到其他组织,如肝脏、脾脏、肠系膜淋巴结和血液等,造成严重的感染性疾病。
3.vre
fm
因持续定殖和传播已成为最具挑战性的病原体之一,在美国每年导致至少5400人死亡和超过5亿美元的额外医疗费用,德国37%的院内感染都是vre
fm
引起,在中国vre感染的病原体中74%是屎肠球菌(drug resist update,2020,53,100732)。又因为屎肠球菌基因组的可塑性极高,其天然耐药和通过质粒和转座子获得的耐药使得临床治疗难上加难(antimicrob agents chemother,2012,56,1650
‑
1654)。vre
fm
耐药形势日益严重,耐药机制复杂,新的抗菌药物的研发速度缓慢,因此,探究新的治疗策略是至关重要的。
4.截短侧耳素类化合物是从真菌pleurotus multilus中分离的一种具有抗菌活性的双萜类化合物,此类化合物及其衍生物作用于细菌核糖体50s亚基23rrna的肽基转移酶(peptidyl transferase,ptc),从而抑制细菌蛋白质的合成,起到抑制细菌生长的作用(cold spring harb perspect med,2017,7,a027110)。截短侧耳素类化合物本是动物专用的抗生素,随着耐药性逐渐严重,截短侧耳素类药物逐渐被关注,2007年第一个人用截短侧耳素瑞他妙林获批应用于临床,但仅作为局部用药,用于治疗金黄色葡萄球菌和化脓链球菌感染的皮肤疾病;2019年最新截短侧耳素类药物lefamulin获批作为全身用药的化合物,用来治疗社区获得性细菌性肺炎(jama,2019,322,1661
‑
1671)。研究表明,截短侧耳素类化合物对金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌、肺炎链球菌和结核分支杆菌等多种
病原菌及耐药病原菌有良好治疗效果,且因为其抗菌靶点在肽基转移酶,与市场上抗菌药物的靶点不同,降低了交叉耐药的风险。综上,扩大截短侧耳素类化合物的抗菌谱,拓宽其适应症,控制耐药菌发展,有较高的开发和研究价值。
技术实现要素:
5.本发明的目的是提供截短侧耳素类化合物的药物新用途。
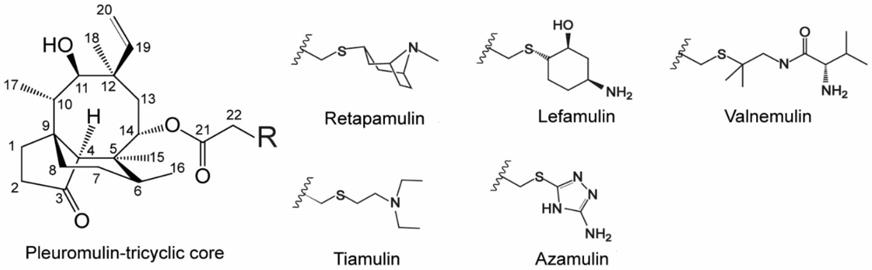
6.进一步的,本发明所述的截短侧耳素类化合物具体选自下述化合物中的至少一种:
[0007][0008]
第一方面,本发明要求保护a1)截短侧耳素类化合物,或a2)截短侧耳素类化合物药学上可接受的盐,或a3)以截短侧耳素类化合物或其药学上可接受的盐为活性成分的物质在如下任一中的应用:
[0009]
(a1)制备用于抑制万古霉素耐药屎肠球菌活性的产品;
[0010]
(a2)抑制万古霉素耐药屎肠球菌活性。
[0011]
第二方面,本发明要求保护a1)截短侧耳素类化合物,或a2)截短侧耳素类化合物药学上可接受的盐,或a3)以截短侧耳素类化合物或其药学上可接受的盐为活性成分的物质在如下任一中的应用:
[0012]
(b1)制备用于抗万古霉素耐药屎肠球菌感染的产品;
[0013]
(b2)抗万古霉素耐药屎肠球菌感染。
[0014]
第三方面,本发明要求保护a1)截短侧耳素类化合物,或a2)截短侧耳素类化合物药学上可接受的盐,或a3)以截短侧耳素类化合物或其药学上可接受的盐为活性成分的物质在如下任一中的应用:
[0015]
(c1)制备用于预防和/治疗万古霉素耐药屎肠球菌感染介导的感染性疾病的产品;
[0016]
(c2)预防和/治疗万古霉素耐药屎肠球菌感染介导的感染性疾病。
[0017]
第四方面,本发明要求保护a1)截短侧耳素类化合物,或a2)截短侧耳素类化合物药学上可接受的盐,或a3)以截短侧耳素类化合物或其药学上可接受的盐为活性成分的物质在如下任一中的应用:
[0018]
(d1)制备万古霉素耐药屎肠球菌的抑菌剂;
[0019]
(d2)作为万古霉素耐药屎肠球菌的抑菌剂。
[0020]
第五方面,本发明要求保护一种产品。
[0021]
本发明所要求保护的产品,其活性成分包括截短侧耳素类化合物或其药学上可接
受的盐;所述产品具有如下任一用途:
[0022]
(a1)抑制万古霉素耐药屎肠球菌活性;
[0023]
(a2)抗万古霉素耐药屎肠球菌感染;
[0024]
(a3)预防和/治疗万古霉素耐药屎肠球菌感染介导的感染性疾病。
[0025]
本发明中所述万古霉素耐药屎肠球菌介导的感染性疾病,包括心内膜炎,泌尿道感染,皮肤感染,脓毒血症等。
[0026]
第六方面,本发明要求保护一种万古霉素耐药屎肠球菌抑菌剂。
[0027]
本发明所要求保护的万古霉素耐药屎肠球菌抑菌剂,其活性成分包括截短侧耳素类化合物或其药学上可接受的盐。
[0028]
在上述各方面中,所述万古霉素耐药屎肠球菌可为万古霉素耐药屎肠球菌标准株或万古霉素耐药屎肠球菌临床分离株或万古霉素耐药屎肠球菌感染的患者携带的万古霉素耐药屎肠球菌。
[0029]
在本发明的一个具体实施方式中,所述万古霉素耐药屎肠球菌为万古霉素耐药屎肠球菌临床分离株。
[0030]
在上述各方面中,所述产品均可为药品。
[0031]
第七方面,本发明要求保护一种抑制万古霉素耐药屎肠球菌活性的方法。
[0032]
本发明所要求保护的抑制万古霉素耐药屎肠球菌活性的方法,是使用截短侧耳素类化合物或其药学上可接受的盐或以截短侧耳素类化合物或其药学上可接受的盐为活性成分的物质抑制万古霉素耐药屎肠球菌活性。
[0033]
在所述方法中,所述截短侧耳素类化合物或其药学上可接受的盐或以截短侧耳素类化合物或其药学上可接受的盐为活性成分的物质的用量不小于其对待抑制的所述万古霉素耐药屎肠球菌的最小抑菌浓度(mic)。
[0034]
所述方法为非疾病诊断治疗方法。如作为阳性对照用于开发万古霉素耐药屎肠球菌的敏感药物。
[0035]
实验证明,截短侧耳素类化合物对临床来源的102株vre
fm
都具有显著的抑菌作用,对最小抑菌浓度为0.03μg/ml;本发明的截短侧耳素类化合物可有效减少vrefm在小鼠肠道内的定殖,减弱vre
fm
定殖后传播到全身各脏器引起全身感染的风险。
附图说明
[0036]
图1为截短侧耳素类化合物消除vre
fm
在小鼠肠道内定殖实验;其中pbs为pbs处理组,lefamulin为5mg/kg lefamulin处理组,利奈唑胺为5mg/kg利奈唑胺处理组;
[0037]
图2为截短侧耳素类化合物减少vre
fm
在小鼠粪便内的含量实验;其中pbs为pbs处理组,lefamulin为5mg/kg lefamulin处理组,利奈唑胺为5mg/kg利奈唑胺处理组;
[0038]
图3为截短侧耳素类化合物恢复小鼠肠道内微生物多样性实验;其中pbs为pbs处理组,lefamulin为5mg/kg lefamulin处理组。
具体实施方式
[0039]
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的实验材料,如无特殊说明,均为自
常规生化试剂商店购买得到的。以下实施例中的定量实验,均设置三次重复实验,结果取平均值。
[0040]
icr雌性小鼠为北京维通利华实验动物技术有限公司产品。
[0041]
实施例1、截短侧耳素类化合物的抑菌活性测定
[0042]
采用微量肉汤稀释法(clinical and laboratory standards institute,clsi,2019)检测截短侧耳素类化合物对待测菌株的最小抑菌浓度(mic)。
[0043]
检测最小抑菌浓度的步骤如下:
[0044]
1、用bhi液体培养基(每升所含成分:牛肉粉1.5g,可溶性淀粉1.5g,酸水解酪蛋白17.5g)悬浮待测菌株(见表1),得到菌浓度为1
×
106cfu/ml的菌悬液。
[0045]
2、取截短侧耳素类化合物,用水溶解并用bhi肉汤培养基稀释,得到浓度为128μg/ml的来法莫林(lefamulin)、瑞他妙林(retapamulin)、沃尼妙林(valnemulin)、泰妙菌素(tiamulin)、阿扎莫林(azamulin)溶液。
[0046]
3、取96孔板,加入bhi肉汤培养基(每孔100μl),第一列每孔加入步骤2制备的截短侧耳素类化合物溶液(每孔100μl),倍比稀释至第十孔,第十孔弃掉100μl液体,之后每孔加入100μl步骤1制备的待测菌悬液,最终在孔中的浓度为0.03、0.0625、0.25、0.5、1.0、2.0、4.0、8.0或16.0μg/ml,37℃静置培养16
‑
20h,观察孔内抑制细菌生长的最低浓度即为mic。在96孔板中设置阴性对照孔,每个阴性对照孔加入100μl bhi肉汤培养基。
[0047]
实验结果见表2。结果表明,截短侧耳素类化合物对90%临床分离的vre
fm
最小抑菌浓度为0.03μg/ml(89/101),对vre
fm
的mic
50
为0.03μg/ml,对vre
fm
具有较强的抑菌活性。
[0048]
表1
[0049]
[0050]
[0051][0052]
注:a、表格中的屎肠球菌均为临床分离的万古霉素耐药菌株,多携带vana耐药基因簇。
[0053]
b、耐万古霉素屎肠球菌分离过程:分别采集北京、浙江等省份的医院内的肛拭子和血液样品,将其浸渍与脑心浸萃(bhi)液态培养基中5分钟,并将其过滤,将滤液保存于eswab管中备用。用接种环蘸取不同样品涂布于含30μg/ml万古霉素的七叶苷肠球选择培养基,静置37℃培养18个小时,挑取褐色菌落至2ml bhi无菌离心管中,置于置于
‑
80℃冰箱中保存备用。采用常规pcr扩增16srrna和测序的方法进一步确证菌属;同时,扩增mcr基因检测。16s rrna上游引物为序列为16srrna
‑
f:5
′‑
agagtttgatcctggctcag
‑3′
,下游引物序列
为16sr rna
‑
r:5
′‑
tacggctaccttgttacgactt
‑3′
,反应运行参数为:(94℃,10min)+[(94℃,30s)+(55℃,40s)+(72℃,2min)]
×
30cycles+(72℃,10min)。
[0054]
表2
[0055]
[0056]
[0057]
[0058]
[0059]
[0060][0061]
实施例2、截短侧耳素类化合物对清除vre
fm
在小鼠肠道内的定殖
[0062]
pbs缓冲液为ph为7.4,0.01m的pbs缓冲液。
[0063]
vre
fm
悬浮液:用pbs重悬vre
fm
,达到浓度为1.0
×
109cfus/ml。
[0064]
分组:pbs组;来法莫林(lefamulin)(5mg/kg)处理组;利奈唑胺(5mg/kg)处理组。
[0065]
1、实验操作具体步骤
[0066]
(1)0.5g/l氨苄西林饮水处理五天之后;停药一天;取粪便,进行称重及vre
fm
计数(cfu/g);
[0067]
(2)1
×
109cfus vre
fm
灌胃一次,每只小鼠灌胃200ul菌液;24h后(即给药治疗前前),取粪便,称重及测vre
fm
数目(cfu/g)。每组取3只,取粪便和肠段送公司测菌群丰富度;
[0068]
(3)vre
fm
灌胃24h后,进行灌胃给药治疗(200ul),6组小鼠分别给予pbs,lefamulin(5mg/kg),利奈唑胺(5mg/kg)。
[0069]
(4)每天固定时间,取粪便,称重及测vre
fm
数目,共检测7天。给药治疗后第1天和第7天取回肠、盲肠及结肠内容物计数,且取部分各肠段分别用4%多聚甲醛固定及
‑
80℃冻存。
[0070]
(5)将治疗前采集的粪便、治疗后1,3,7天的粪便和给药治疗后1天和7天肠段送赛诺百合公司,进行16s宏基因组测序,测肠道菌群相对丰度以及肠道菌群多样性。
[0071]
2、试验动物准备
[0072]
实验动物:6周龄icr小鼠。本实验均用无菌水,正常鼠粮。试验共分为3组,每组8只小鼠,正式实验需要24只小鼠。
[0073]
3、实验的结果统计
[0074]
治疗前采集的粪便、治疗后1,3,7天的粪便和给药治疗后1天和7天肠段送赛诺百合公司,进行16s宏基因组测序。
[0075]
实验结果见图1、图2和图3。由于lefamulin或利奈唑胺口服给药导致肠道内定殖的vre
fm
浓度降低,从而降低vre
fm
造成全身感染的风险,且lefamulin有利于恢复小鼠被破坏的肠道菌群稳态及微生物多样性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1