一种雷公藤红素/甘草次酸-羧甲基壳聚糖-酮缩硫醇-大黄酸胶束
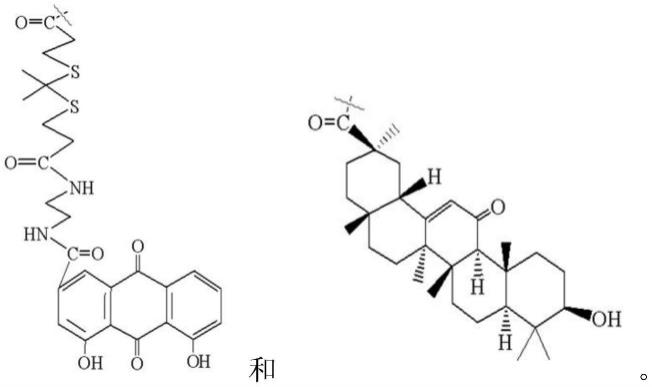
1.本发明属于医药技术领域,具体涉及一种雷公藤红素/甘草次酸-羧甲基壳聚糖-酮缩硫醇-大黄酸胶束。
背景技术:
2.根据国际卫生组织2020年全球癌症数据显示,肝癌在人类所有癌症中占有相当大的比例。在过去几年里,肝癌的发病率和死亡率呈上升趋势,而且这种趋势可能在未来几年一直持续。中国是人口大国,肝癌死亡率是增长最快的癌症之一,显著高于其他国家,并且复发率高、预后差。由此可见,肝癌已经严重影响人类生命及健康,对社会构成了实质性的健康和经济负担。肝癌发病原因复杂多样,基因和环境因素都会导致肝癌的发生,因此,肝癌的治疗也成为亟待解决的难题之一。
3.雷公藤红素(cela)是从卫矛科藤本植物雷公藤(trepterygium)根部提取得到的有效成分之一,形态为红色针状晶体,易溶于有机溶剂。问世至今已经发现其具有多种药理作用,作为一种天然的蛋白酶体抑制剂,大量药理实验发现cela具有显著的抗癌作用,对多种癌细胞均有抑制增殖的作用,可以通过调节多种信号途径和致癌分子靶点等机制发挥抑制肿瘤生长的作用,以上都表明cela有望成为治疗癌症的一种非常有前景的药物。
4.在寻求新的安全有效的肝癌化疗药物的过程中,cela成为研究重点之一。随着对cela进一步研究发现,cela能在细胞学水平调控凋亡相关因子诱导细胞凋亡,阻滞hepg2的生长。另有研究表明cela能够明显的增加肝癌细胞中跨膜糖蛋白fas、fasl的表达,显著增加胞浆中细胞色素c(cyt c)的含量,同时活化的caspase3、caspase8、caspase9等蛋白的表达也显著增多,证明可以同时激活细胞内源性和外源性两种调亡途径,诱导肝癌bel-7402细胞的调亡。动物实验研究表明cela能够明显降低肝细胞癌(hepatocellular carcinoma,hcc)中谷草转氨酶(aspartate,ast)、谷丙转氨酶(alanine aminotransferase,alt)、碱性磷酸酶(alkaline phosphatase,alp)的活性,降低血清中甲胎蛋白(alpha-fetal protein,afp)水平,使得hcc大鼠肝癌细胞数和肿瘤体积减小,提高大鼠肝组织肿瘤抑制基因p53和bax蛋白的表达,表现出明显抗大鼠hcc作用。以上结果表明cela对肝细胞癌具有一定的治疗效果,可对其开展进一步抗肝癌研究。
5.但是雷公藤红素的低水溶性、生物利用度差、毒副作用较大等缺陷,限制了它的研究开发和临床应用。
6.中国发明专利申请“cn108888774b一种雷公藤红素-树状大分子缀合物及其制备方法与应用”公开了一种新的雷公藤红素剂型,其由pamam纳米载体、聚乙二醇、表面靶向配体制成树枝状有机高分子,再利用该高分子对雷公藤红素进行负载。该专利申请提供的雷公藤红素剂型在治疗结肠癌、肝癌、乳腺癌等epcam表面膜蛋白丰富的癌症中具有靶向作用,能够提高药物的选择性和特异性,降低雷公藤红素的毒性。然而,pamam属于聚酰胺-胺树形高分子,其缺点是容易与带负电的非特性细胞和蛋白结合。且该专利申请中的制剂是
针对epcam表面膜蛋白产生靶向作用,其选择性和特异性针对的是多种癌细胞。此外,该制剂对肝癌细胞靶向效果并不理想。总之,上述专利申请中的制剂针对肝癌的靶向选择性和特异性仍然不足。因而,针对肝癌有必要进一步开发雷公藤红素的制剂,为肝癌的临床治疗提供更多的选择。
技术实现要素:
7.针对现有技术的缺陷,本发明提供一种雷公藤红素/甘草次酸-羧甲基壳聚糖-酮缩硫醇-大黄酸胶束,目的在于提供一种负载雷公藤红素的胶束制剂,该胶束对肝脏组织和肿瘤组织具有很好的靶向性,特别适用于作为预防或治疗肝癌的药物,为临床提供了一种新的选择。
8.一种雷公藤红素/甘草次酸-羧甲基壳聚糖-酮缩硫醇-大黄酸胶束,它是将雷公藤红素负载在胶束中得到的;所述胶束是由改性羧甲基壳聚糖构成;所述改性羧甲基壳聚糖是被如下两种取代基取代的羧甲基壳聚糖:
[0009][0010]
优选的,所述改性羧甲基壳聚糖的结构中,取代基的摩尔取
代度为5.43-9.05%,取代基的摩尔取代度为1.79-2.93%。
[0011]
优选的,所述改性羧甲基壳聚糖是在酮缩硫醇的一端连接大黄酸,并将甘草次酸和所述酮缩硫醇分别接枝到羧甲基壳聚糖上而得到。
[0012]
优选的,所述胶束制备原料的投料比为:雷公藤红素与所述改性羧甲基壳聚糖重量比1:0.8~1:1.6;优选为1:1.4;
[0013]
和/或,大黄酸与酮缩硫醇摩尔比1:1~1:2;
[0014]
和/或,羧甲基壳聚糖与甘草次酸摩尔比1:1~1:2;
[0015]
和/或,羧甲基壳聚糖与酮缩硫醇摩尔比1:1.2~1:2.4;
[0016]
和/或,大黄酸、酮缩硫醇、羧甲基壳聚糖和甘草次酸摩尔比1.2:1.8:1:1.5。
[0017]
优选的,所述大黄酸通过多氨基化合物连接至酮缩硫醇一端的羧基上,所述多氨基化合物优选自乙二胺、1,3丙二胺或1,4丁二胺中的其中一种;和/或,所述羧甲基壳聚糖选自o-羧甲基壳聚糖;和/或,所述羧甲基壳聚糖的分子量为1万~10万;和/或,所述胶束粒径为140~190nm。
[0018]
本发明还提供上述胶束的制备方法,包括如下步骤:
[0019]
(a)将雷公藤红素与所述改性羧甲基壳聚糖混合;
[0020]
(b)将步骤(a)得到的混合物用水透析,得到水溶液;
[0021]
(c)分离步骤(b)得到的水溶液中的上清液,冷冻干燥,既得。
[0022]
优选的,步骤(a)中,将雷公藤红素加入所述改性羧甲基壳聚糖的溶液中,所述溶液的溶剂为dmso,和/或,所述改性羧甲基壳聚糖的浓度为4~8mg/ml;
[0023]
和/或,步骤(c)中,冷冻干燥过程中加入葡萄糖作为冻干保护剂。
[0024]
本发明还提供上述胶束在制备预防和/或治疗肝癌的药物中的用途。
[0025]
本发明还提供一种药物,它是由上述胶束加入药学上可接受的辅料制成的。优选的,所述药物是将所述胶束配制在氯化钠注射液中制成的。
[0026]
本发明提供的gctr偶联物的胶束对活性氧敏感,其制成的药物cela/gctr胶束表现出对肝组织和肿瘤组织的靶向性,且在体内具有缓释cela药物的作用。该特性使得gctr偶联物及cela/gctr胶束在肝癌药物的制备中具有很高的应用潜力。这为肝癌的临床治疗提供了一种新的选择。
[0027]
相比于现有的靶向制剂,本发明的制剂具有针对肝癌细胞表面的甘草次酸受体的主动靶向,同时也由于其粒径小而具有被动靶向的效果,这使得本发明的制剂靶向的效果更好。
[0028]
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
[0029]
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
[0030]
图1为实施例1的合成过程的示意图;
[0031]
图2为实施例1的gctr偶联物形成胶束的粒径分布图;
[0032]
图3为实施例1的甘草次酸(a)、大黄酸(b)、酮缩硫醇(c)、羧甲基壳聚糖(d)和gctr偶联物(e)的ft-ir图谱(左)和1h-nmr图谱(右);
[0033]
图4为实施例2的cela/gctr胶束的粒径分布图;
[0034]
图5为实验例2中gctr偶联物(a)胶束和h2o2处理6h的gctr偶联物(b)胶束的tem图像;
[0035]
图6为实验例3中gctr偶联物胶束在水溶液中的粒径变化图(n=3);
[0036]
图7为实验例5中cela/gctr胶束体外释放曲线(n=3);
[0037]
图8为实验例6中gctr偶联物与cela/gctr胶束对hepg2、bel-7402、l-02细胞的细胞毒性(n=6);
[0038]
图9为实验例6中hepg2、l-02细胞摄取的clsm图;
[0039]
图10为实验例6中hepg2细胞摄取的流式细胞术和荧光强度分布图(n=3),其中,a:control组;b:p4组;c:ga预处理1h后的(p4+cela)/gctr胶束组;d:(p4+cela)/cr胶束组;e:(p4+cela)/gctr胶束组;
[0040]
图11为实验例6中流式细胞术检测cela/gctr胶束对hepg2细胞周期的影响;
[0041]
图12为实验例7中小鼠尾静脉注射cela各制剂后的血药浓度-时间曲线;
[0042]
图13为实验例7中荷瘤小鼠不同时间点不同cela制剂在各组织中的分布图;
[0043]
图14为实验例7中小鼠活体荧光成像结果;
[0044]
图15为实验例7中小鼠活体成像不同时间点全身荧光强度结果;
[0045]
图16为实验例7中小鼠活体成像不同时间点肿瘤荧光强度结果;
[0046]
图17为实验例7中小鼠第24h组织荧光成像(组织荧光图从上到下依次为:心、肝、脾、肺、肾、肿瘤);
[0047]
图18为实验例7中小鼠第24h组织荧光强度结果。
具体实施方式
[0048]
以下实施例和实验例中,所用的试剂和材料均为市售,具体如下:
[0049]
甘草次酸(ga),医药级(98%),上海源叶生物科技有限公司;
[0050]
o-羧甲基壳聚糖(cmcs),分子量1万,青岛弘海生物技术有限公司;
[0051]
酮缩硫醇(tk),医药级(98%),西安瑞禧生物科技有限公司;
[0052]
大黄酸(r),医药级(98%),陕西澳源生物技术有限公司;
[0053]
盐酸乙二胺,分析级(99%),麦克林生化科技有限公司;
[0054]
n-羟基琥珀酰亚胺(nhs),分析级(98%),上海阿拉丁生化科技股份有限公司;
[0055]
1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐(edc
·
hcl),分析级(98%),上海阿
拉丁生化科技股份有限公司;
[0056]
无水乙二胺,分析级,福州宏新玻璃仪器有限公司;
[0057]
芘,分析级(99%),上海阿拉丁生化科技股份有限公司;
[0058]
透析袋,mwco3500,biosharp;
[0059]
雷公藤红素(cela),医药级(98%),南京卡塞斯医药科技有限公司;
[0060]
dmso、乙醇、甲醇,分析纯,国药集团化学试剂有限公司;
[0061]
n,n-二甲基甲酰胺,分析纯,国药集团化学试剂有限公司;
[0062]
葡萄糖,分析纯,国药集团化学试剂有限公司;
[0063]
甘露醇,分析纯,国药集团化学试剂有限公司;
[0064]
0.9%氯化钠注射液,190407a44,福州海王福药制药有限公司;
[0065]
5%葡萄糖注射液,分析纯,福州海王福药制药有限公司;
[0066]
透析袋,mwco3500,biosharp;
[0067]
p2和p4荧光探针,按照文献nanomedicine:nanotechnology,biology,and medicine,2015(11):1939
–
1948的方法合成。
[0068]
以下实施例和实验例中,还采用如下缩写:
[0069]
大黄酸-n-羟基琥珀酰亚胺加合物:r-nhs;大黄酸-乙二胺加合物:r-eda;酮缩硫醇-大黄酸偶联物:ter;羧甲基壳聚糖-酮缩硫醇-大黄酸偶联物:ctr;甘草次酸-羧甲基壳聚糖-酮缩硫醇-大黄酸偶联物:gctr偶联物;雷公藤红素/甘草次酸-羧甲基壳聚糖-酮缩硫醇-大黄酸偶联物胶束:cela/gctr胶束;羧甲基壳聚糖-大黄酸偶联物:cr偶联物;雷公藤红素/羧甲基壳聚糖-大黄酸偶联物:cela/cr胶束;活性氧:ros。
[0070]
实施例1gctr偶联物(即改性羧甲基壳聚糖)的合成
[0071]
gctr偶联物的合成如图1所示,拟用四步合成:
[0072]
第一步:0.1mmol r用1%naco3加热溶解,搅拌下加入0.12mmol edc
·
hcl,室温反应20min后,再加入与0.12mmol nhs室温反应10min,得r-nhs。加入0.15mmol eda用水溶解,将r-nhs滴加入eda水溶液,反应6h,得r-eda。
[0073]
第二步:0.15mmol tk用dmf溶解,加入0.18mmol edc
·
hcl室温反应20min后,再加入0.18mmol nhs室温反应10min,加入至r-eda溶液中,室温反应,得ter。
[0074]
第三步:0.083mmol cmcs用水溶解。取ter溶液离心取上清液,加入0.12mmol edc
·
hcl室温反应20min后,再加入0.12mmol nhs室温反应10min,然后加入至cmcs水溶液中,反应24h,得ctr。
[0075]
第四步:0.12mmol ga用dmf溶解,0.14mmol edc
·
hcl室温反应20min,0.14mmol nhs室温反应10min,加入至ctr溶液中,室温反应24h,反应液于透析袋(mwco 3500)中,用蒸馏水透析72h,探头超声20min,冷冻干燥,即得产物gctr偶联物。
[0076]
该合成工艺下合成的gctr偶联物结构中,r的摩尔取代度为(7.24
±
1.81)%,ga的摩尔取代度为(2.36
±
0.57)%,其在水中自组装形成的胶束粒径较小,为(220.17
±
5.50)nm(图2),分布均匀,电位为(-12.03
±
0.82)mv。
[0077]
对各原料及得到的gctr偶联物进行ft-ir表征和1h-nmr表征,结果如图3,从图中的红外谱峰和质子峰的变化可知,gctr偶联物成功合成。
[0078]
实施例2 cela/gctr胶束的制备
[0079]
本实施例中gctr偶联物采用实施例1的方法制备。
[0080]
cela/gctr胶束通过如下方法制备:称取12mg gctr偶联物,加入蒸馏水2.4ml,搅拌溶解,冰水浴探头超声10min分散均匀后,剧烈搅拌下,逐滴滴加20mg/ml cela dmso溶液,继续高速搅拌20min,冰水浴探头超声20min,蒸馏水透析12h除去有机溶剂,结束透析后冰水浴探头超声20min,3500r/min离心10min,上清液用0.8μm滤膜滤过,即得cela/gctr胶束溶液。
[0081]
按最佳载药工艺重复三批,结果见表1和图4,本实施例制备的cela/gctr胶束粒径小、粒径分布(pdi)范围小、载药量(dl)大、包封率(ee)高,且重复性高,表明该载药工艺可靠且稳定。
[0082]
表1最佳载药工艺验证结果(n=3)
[0083][0084]
为了进一步说明本发明的有益效果,进行如下实验,未说明的情况下所用的gctr偶联物为实施例1的gctr偶联物,所用的cela/gctr胶束为实施例2的cela/gctr胶束。
[0085]
实验例1 gctr偶联物的合成条件筛选
[0086]
在实施例1的方法的基础上,以粒径大小及分布(pdi)、zeta电位、r与ga的取代度(dsr、ds
ga
)作为gctr偶联物合成工艺考察的指标,不同投料比合成的gctr偶联物的检测结果见表2。
[0087]
当固定cmcs与ga投料,r:tk投料量变化(1:1~1:2)时,随tk投料的增加,r和ga的摩尔取代度皆降低,当r:tk=1:1时,gtcr偶联物胶束r与ga取代度最大,粒径较小,为(237.67
±
21.51)nm,分布较均匀。
[0088]
当固定r与tk投料量,而cmcs与ga投料量发生变化(1:1~1:2)时,gctr偶联物的r、ga的摩尔取代度变化较大,电位随ga投料的增加而增大。当cmcs:ga=1:1.5时,r、ga摩尔取代度最大,粒径及分布影响不明显。
[0089]
反应时间考察结果显示,随反应时间的延长(6h~24h),gctr偶联物上的r和ga的摩尔取代度增加,粒径变小,粒径分布更加均匀,推测增加反应时间有利于产物的合成,但如果时间过长会降低合成效率。因此,选择24h为反应时间。
[0090]
综合考虑r、ga的取代度、粒径、pdi、电位等因素,最终确定r:tk:cmcs:ga(1.2:1.8:1:1.5)为最佳合成投料比,r与tk反应24h。
[0091]
表2不同合成工艺产物的考察指标结果
[0092][0093]
实验例2 gctr偶联物的ros敏感特性
[0094]
将实施例1得到的gctr偶联物用直接分散溶解法制成gctr偶联物胶束,对其形态进行tem表征,如图5a所示。可以看出,gctr偶联物胶束均为球状结构,粒径分布较均匀,分布在220nm左右。取gctr偶联物胶束溶液用含10mmol/l的h2o2溶液稀释成1mg/ml的溶液,置于37℃摇床中,处理6h后,观察tem图,如图5b所示,经h2o2处理后gctr偶联物胶束粒径变大,表明gctr偶联物中tk键可能已经断裂,导致胶束结构改变,体积变大,说明gctr偶联物胶束具有ros敏感的特性。
[0095]
不同时间点取出测定gctr偶联物胶束得粒径大小,结果如表3所示,gctr偶联物胶束粒径随着与h2o2接触时间延长,粒径急剧变大,分散度也增大。进一步证明,gctr偶联物胶束可以在低浓度的h2o2溶液中解聚,具有ros敏感性。
[0096]
表3 10mmol/lh2o2溶液中gctr偶联物胶束的粒径分布特点溶液中gctr偶联物胶束的粒径分布特点
[0097]
[0098]
实验例3 gctr偶联物胶束的稳定性
[0099]
实施例1的gctr偶联物胶束稳定性考察结果如图6所示,一周之内,可观察到gctr聚合物胶束在室内自然光照与避光条件下粒径基本无变化,也未发生絮凝、沉淀等现象,稳定性较好。说明gctr偶联物胶束在水中在室温下放置一周稳定性良好。
[0100]
实验例4 cela/gctr胶束的制备条件筛选
[0101]
以载药量、包封率、粒径和分布指数为指标考察cela溶剂、药载比和载体浓度各因素对gctr偶联物胶束包载cela的影响。
[0102]
1、cela溶剂筛选
[0103]
采用甲醇、乙醇、dmf、dmso作为cela的溶剂,考察溶剂对gctr偶联物载药能力的影响,实验结果如表4所示。由表可见,与甲醇、乙醇、dmf相比,dmso更有利于cela的载入。当使用dmso作为cela溶剂时,所制备的cela/gctr胶束粒径为(182.83
±
4.37)nm、pdi为0.017
±
0.010、载药量为(38.73
±
4.64)%、包封率为(77.72
±
9.15)%。综上表明,cela/gctr胶束粒径小、分布均匀、载药量大、包封率高,因此,本研究选用dmso作为cela溶解的溶剂。
[0104]
表4不同cela溶剂对gctr偶联物载药能力的影响
[0105][0106]
2、药物与载体投料比
[0107]
药物与载体投料比(药载比)对gctr偶联物包载cela的影响,结果如表5所示。载药量随着药载比的增加而增大,包封率也随着增高。当药载比增加至1:1.6时包封率显著下降,说明gctr偶联物包载cela已达饱和。且在药载比为1:1.4时,粒径较其他比例较小,故选用1:1.4作为cela和gctr偶联物的最佳投料比。
[0108]
表5不同药物量与载体投料比对gctr偶联物载药能力的影响
[0109][0110]
3、载体浓度
[0111]
载体浓度对gctr偶联物包载cela的影响,结果如表6所示。结果显示当载体浓度在4~8mg/ml,随着载体浓度的增加,增大了cela与偶联物胶束的接触机会,因此载药量增加。载体在5mg/ml时,载药量、包封率比6~8mg/ml时大,且粒径较小。因此,确定最佳载体浓度为5mg/ml。
[0112]
表6不同载体浓度对gctr偶联物载药能力的影响
[0113][0114]
4、冻干保护剂的筛选
[0115]
为防止药物在冻干过程中出现结构疏松、外观差、随水分飞散等不良情况的出现,一般可以加入冻干保护剂来改善冻干制剂的产物形态和溶解性。本实验以冻干制剂的外观、再分散性、粒径、电位、载药量以及包封率作为评价指标,考察了0.2%甘露醇和葡萄糖这两种冻干保护剂对cela/gctr胶束冻干的影响。
[0116]
评价指标如下:
[0117]
表7外观及复溶性评价指标
[0118][0119]
结果表明,没有加冻干保护剂的cela/gctr胶束冻干制剂为橘红色絮状物,表面粗糙,质地疏松,且在冻干过程中会观察到有部分药物随水分飞散。加入冻干保护剂后,cela/gctr胶束冻干制剂的外观、复溶性、粒径、载药量和包封率均有所改善。两种冻干保护剂中,葡萄糖效果更好,其外观平整呈饼状,复溶性稳定,粒径为(135.40
±
35.4)nm,载药量和包封率分别为(36.71
±
6.71)%、(79.77
±
9.77)%,与未冻干的制剂相比无明显差异。与未加冻干保护剂的冻干制剂相比,粒径减小,包封率、载药量均增大。综上结果,选用0.2%葡萄糖作为cela/gctr胶束冻干制剂的保护剂。
[0120]
表8 cela/gctr胶束冻干制剂处方筛选
[0121][0122]
实验例5 cela/gctr胶束体外释放
[0123]
采用透析法来研究cela从gctr偶联物体外释放的行为,模拟体内环境,分别用ph 5.0的磷酸盐缓冲溶液、ph 5.0+10mmol/l h2o2的磷酸盐缓冲溶液模拟肿瘤组织环境及ph 7.4的磷酸盐缓冲溶液模拟血液中性环境,考察cela/gctr胶束的体外释放动力学行为。
[0124]
一、实验方法
[0125]
1、cela/gctr胶束在释放介质中的稳定性
[0126]
以粒径为考察指标,考察cela/gctr胶束在不同ph磷酸盐缓冲液中的稳定性。称取适量cela/gctr胶束,用不同ph磷酸盐缓冲液溶解,探超10min至分散均匀,放置于37℃水浴摇床中,100r/min于0、6、12、24、48、72h后测定cela/gctr胶束的粒径,考察其稳定性。
[0127]
2、cela/gctr胶束体外释放实验
[0128]
精密称定cela/gctr胶束,加0.9%氯化钠注射液溶解,加释放介质稀释至含cela浓度为250μg/ml,探头超声10min,取1ml cela/gctr胶束溶液至于3500da透析袋内,放于盛有100ml溶出介质的烧杯内,平行3份,在100r/min振速和37℃介质温度下进行cela/gctr胶束体外释放度实验。按设定时间间隔0.25、0.5、1、2、4、6、8、12、24、36、48、60、72h,取透析袋外的释放液4ml于加入10μl内标emodin(300μg/ml)挥干的10ml离心管中,同时添加相同体积的空白释放介质。样品加入3ml二氯甲烷萃取,涡旋5min,收集下层液至5ml离心管中,减
压挥干,用200μl甲醇复溶,涡旋3min,14000r/min离心20min,取适量上清液通过高效液相色谱测定cela含量,计算累积释放量并绘制释放曲线,累积释放率(q
t
)的计算公式如下:
[0129][0130]
其中,cn为第n次取样时释放液中cela的浓度,v为总释放介质体积,v0为取样体积,m为用于释放的cela总量。
[0131]
二、实验结果
[0132]
1、cela/gctr胶束在体外释放介质中的稳定性
[0133]
cela/gctr胶束在不同释放介质中的稳定性如表9所示,cela/gctr胶束在nacl、ph 7.4的缓冲介质中,72h粒径无明显变化。在ph 5.0缓冲介质中,6h开始变大,12h时粒径超过200nm,72h时达259nm;ph 5.0+10mmol/l h2o2缓冲介质中3h粒径已经达到了200nm多,随着时间延长,粒径越来越大,12h时已经几乎没有胶束存在,这与gctr偶联物ros敏感性测定结果相似,表明cela/gctr胶束在ph 5.0+10mmol/l h2o2缓冲介质中药物释放会更快。上述介质中均未出可见的沉淀或絮凝,稳定性良好。
[0134]
表9 cela/gctr胶束在体外释放介质中的粒径变化
[0135][0136][0137]
2、体外释放研究
[0138]
通过透析法研究了cela从cela/gctr胶束中的体外释放行为。本实验用三种不同条件的磷酸盐缓冲盐(ph 7.4、ph 5.0、ph 5.0+10mmol/l h2o2)作为释放介质,分别模拟血液中性环境、肿瘤组织酸性环境、肿瘤组织高ros内环境,考察不同时间点cela从cela/gctr胶束中释放的程度。
[0139]
由释放结果图7可见,在ph 7.4条件下cela溶液12h的累积释放率达70%以上,24h几乎完全释放。而cela/gctr胶束12h的累积释放率在29%左右,24h的累积释放率在37%左
右,72h仍然维持平稳释放。在释放过程中没有突释现象,表明cela被完全包载在偶联物胶束的疏水内核里,cela/gctr胶束在血液中性环境中具有缓释作用。在ph 5.0条件下,cela/gctr胶束12h的累积释放率在37%左右,cela/gctr胶束12h的累积释放率在50%左右,前2h释放速度较快,2h后缓慢释放,与ph 7.4条件下cela/gctr胶束的释放量比较,药物释放量随ph的降低而增多,呈现出一定的ph敏感性。当有10mmol/l h2o2存在时,cela/gctr胶束在12h的累积释放率为58%左右,在24h的累积释放率为81%左右。由此可见,加入10mmol/l h2o2后,其释放速率更快,释放量更多,表明cela/gctr胶束具有ros敏感性。
[0140]
实验结果表明,cela/gctr胶束在血液ph环境下具有缓释作用,且对具有肿瘤微环境特点的弱酸性环境和高ros环境敏感,能够提高药物释放速率。
[0141]
实验例6 cela/gctr胶束的细胞生物学效应
[0142]
一、实验方法
[0143]
1、cr偶联物、gctr偶联物的合成
[0144]
cr偶联物合成:
[0145]
(1)称取羧甲基壳聚糖于反应瓶中,加入10ml蒸馏水溶胀30min;取大黄酸粉末于广口瓶中,加入10ml 1%nahco3溶液,加热使大黄酸完全溶解,冷却至室温,加入edc
·
hcl,活化20min,再加入nhs;然后边搅拌边将混合液加入羧甲基壳聚糖溶液中,避光搅拌反应24h;其中,各物质的摩尔比为羧甲基壳聚糖:大黄酸:edc
·
hcl:nhs=1:1:3:1;(2)用95%乙醇沉淀反应液,静置后抽滤,并用95%乙醇洗涤沉淀物至洗涤液无色;将抽干后的沉淀物溶解于水中,冰水浴条件下探头超声20min后,3000rpm离心10min,取上清液过0.8μm滤膜,取滤液置于透析袋中透析72h;(3)透析结束后,将所述滤液再置于冰水浴中探头超声20min后,3000rpm离心10min,取上清液过0.8μm滤膜,滤液冷冻干燥,即得羧甲基壳聚糖-大黄酸偶联物。
[0146]
gctr偶联物合成:
[0147]
(1)0.1mmol r用1%naco3加热溶解,搅拌下加入0.12mmol edc
·
hcl,室温反应20min后,再加入与0.12mmol nhs室温反应10min,得r-nhs。加入0.15mmol eda用水溶解,将r-nhs滴加入eda水溶液,反应6h,得r-eda。
[0148]
(2)0.15mmol tk用dmf溶解,加入0.18mmol edc
·
hcl室温反应20min后,再加入0.18mmol nhs室温反应10min,加入至r-eda溶液中,室温反应,得ter。
[0149]
(3)0.083mmol cmcs用水溶解。取ter溶液离心取上清液,加入0.12mmol edc
·
hcl室温反应20min后,再加入0.12mmol nhs室温反应10min,然后加入至cmcs水溶液中,反应24h,得ctr。
[0150]
(4)0.12mmol ga用dmf溶解,0.14mmol edc
·
hcl室温反应20min,0.14mmol nhs室温反应10min,加入至ctr溶液中,室温反应24h,反应液于透析袋(mwco 3500)中,用蒸馏水透析72h,探头超声20min,冷冻干燥,即得产物gctr偶联物。
[0151]
2、细胞培养
[0152]
细胞完全培养基的配制:hepg2细胞的培养基为dmem培养液中加入10%fbs、1%penicilin streptomycin solution混匀即可;bel-7402细胞的培养基为rpim1640培养液中加入10%fbs、1%penicilin streptomycin solution混匀即可;l-02细胞的培养基为rpim1640培养液中加入20%fbs、1%penicilin streptomycin solution混匀即可。
[0153]
细胞复苏:从液氮取出细胞,立即放入37℃恒温水浴中,迅速摇晃至冻存液完全溶解,转移至离心管中,加入约5倍体积的培养液,反复、轻轻吹打混匀,离心4min(1000r/min),弃上清,向离心管中加入适量培养液,反复、轻轻吹打混匀,转移至培养瓶内,置于37℃,5%co2培养箱中,隔天换液。
[0154]
细胞传代:当细胞贴壁达到约为80%时进行传代培养,弃掉旧培养基,pbs洗2遍,加入1ml胰蛋白酶溶液进行消化,于培养箱中放置2min;在显微镜下进行观察,若细胞间隙变大,细胞变圆,立即加入含血清的培养基3ml,用枪轻轻吹打瓶壁,使细胞落在瓶中的培养液中;将混悬液转移至15ml离心管中,1000r/min离心4mim,去上清;向离心管中的细胞沉淀加入适量完全培养基重悬细胞,以1:1.2~1:4比例进行传代,继续培养。
[0155]
3、细胞毒性考察
[0156]
采用噻唑蓝比色法(mtt assay)测定载药胶束的细胞毒性,考察cr偶联物、gctr偶联物、cela/cr胶束、cela/gctr胶束和游离cela及其溶媒cremophor el:etoh(50%:50%,v/v)对hepg2、bel-7402、l-02细胞的毒性。
[0157]
取处于对数生长期的hepg2、bel-7402、l-02细胞接种于96孔板中,每孔5
×
104个细胞,边缘孔用空白pbs填充,培养箱中孵育24h使其贴壁,吸弃培养基。将不同浓度的cr偶联物、gctr偶联物、cela/cr胶束、cela/gctr胶束、游离cela、cremophor el:etoh(50%:50%,v/v)受试液150μl加入96孔板中,每个浓度平行6个孔。放于培养箱中孵育,实验设不含细胞的空白对照孔和含细胞不给药物的正常孔。分别于加药后24、48、72h,将培养板取出,每孔加入100μl浓度为1μg/ml mtt溶液,放回培养箱中孵育4h。将培养板取出,小心吸弃上清液。每孔加入150μl dmso溶解蓝紫色结晶物。用酶标仪在570nm处测定吸光度值(od值)。按照如下公式计算细胞存活率,并利用graphpad软件进行计算ic
50
值。
[0158][0159]
4、细胞摄取
[0160]
4.1载p4的胶束制备
[0161]
由于cela本身不具有荧光,所以为了比较肿瘤细胞对cela/cr胶束和cela/gctr胶束的摄取能力,以疏水性有机染料p4(环境响应型荧光探针)作为荧光指示剂,制备共载p4和cela的(p4+cela)/cr胶束和(p4+cela)/gctr胶束,负载方法与载cela方法类同。具体为:称取cr偶联物或gctr偶联物12mg,加入2.4ml蒸馏水,探头超声使其充分溶解,形成cr胶束或gctr胶束溶液。称取少量cela,溶解于含有90μg p4的dmso溶液中,混匀,高速搅拌下,逐滴滴加到cr胶束或gctr胶束溶液中,继续高速搅拌20min,冰水浴探头超声20min,透析24h,探头超声20min,3500r/min离心10min,取上清液,即得(p4+cela)/cr胶束和(p4+cela)/gctr胶束。
[0162]
4.2激光共聚焦显微镜定性考察
[0163]
借助共聚焦显微镜考察hepg2细胞对游离p4以及载p4的两种胶束(p4+cela)/cr胶束和(p4+cela)/gctr胶束(p4浓度为0.5μg/ml)的摄取情况。取对数生长期的hepg-2、l-02细胞,以2
×
105个/ml的密度接种于激光共聚焦培养皿中,培养贴壁后弃去培养液,加入37℃预热的pbs轻轻洗2次,加入各组受试液各1ml(当考察ga影响时,提前1h加入ga 5μg/ml溶液2ml,使其饱和hepg-2细胞上的ga受体后,再加入载药胶束),孵育4h后,弃去药物溶液,加
入4℃的冰冷hbss终止摄取,清洗细胞3次。弃去hbss,用4%多聚甲醛固定20min,hbss清洗2~3遍。各孔加入含hoechst33258 pbs溶液(10μg/ml)1ml,细胞核染色15min,冷的hbss清洗3次后加入200μl pbs,激光共聚焦显微镜下观察并拍照。
[0164]
4.3流式细胞仪定量考察
[0165]
取处于指数生长期的hepg2细胞以4
×
105个/ml的密度接种于六孔板中,培养24h后,吸弃培养基,加入含有相同浓度的p4及制备的(p4+cela)/cr胶束和(p4+cela)/gctr胶束溶液各1.5ml,继续培养4h后吸弃药液,加入4℃的冰冷hbss终止摄取,洗2遍,往六孔板里加入消化液,收集细胞,2000r/min离心3min,弃去培养液,再加入pbs重复2次。目的是除去可能未被细胞吞噬的荧光物质,并除去消化液。洗净后加入1ml pbs,吹打分散均匀制成悬浮液。400目筛网过滤,激发波长480nm,发射波长575nm,进样,流式细胞术检测,软件分析结果。
[0166]
4.4细胞周期实验
[0167]
取对数生长期的hepg2细胞以2
×
105个细胞的密度接种于6孔板中,培养箱培养过夜,吸弃培养基,用pbs洗两遍。分别设置control组、游离cela组和cela/gctr胶束组,每组设3个复孔,培养箱培养24h后,采用细胞周期检测试剂盒进行样品处理,用流式细胞仪进行检测。
[0168]
二、实验结果
[0169]
1、细胞毒性实验结果
[0170]
选用hepg2、bel-7402、l-02细胞作为细胞模型,采用mtt法考察了cr偶联物、gctr偶联物、cela/cr胶束、cela/gctr胶束和游离cela及其溶媒cremophor el:etoh(50%:50%,v/v)对分别对hepg-2、bel-7402、l-02细胞增殖的影响,以评价载体材料、载药胶束的细胞毒性。将一系列不同浓度的受试药液与细胞共同孵育24h、48h、72h,检测其细胞存活率。
[0171]
在对l-02的mtt实验结果图8中可以看出,不同浓度的cr偶联物、gctr偶联物对l-02细胞存活率均无显著影响,作用72h后,均未出现明显毒性作用,表明载体材料对细胞不会造成损害,生物相容性良好。在0.01~1μg/ml浓度下,cela/cr胶束、溶媒组etoh+el、cela/gctr胶束对l-02细胞均没有产生毒性,而游离cela在该浓度范围下,48h开始表现出一定的抑制作用。在2.5μg/ml和5μg/ml两个浓度下游离cela、cela/cr胶束、cela/gctr胶束均表现出l-02细胞抑制作用,并且随时间的延长,抑制作用逐渐增强。综上结果表明,gctr偶联物载体对l-02细胞在实验浓度范围内无细胞毒性,0.01~1μg/ml浓度范围内cela/gctr胶束对l-02细胞无明显抑制增殖的作用,gctr偶联物和cela/gctr胶束具有良好安全性。
[0172]
从hepg2细胞的mtt实验结果可以看出,实验浓度范围内,不同浓度的etoh+el、cr偶联物、gctr偶联物对hepg2细胞存活率均无显著影响。游离cela、cela/cr胶束、cela/gctr胶束对hepg2细胞均有一定增殖抑制作用,表现为时间与剂量依赖型,随时间、浓度的增加,其抑制作用越强。在cela浓度较低时,游离cela、cela/cr胶束、cela/gctr胶束对hepg2细胞无明显抑制作用,当cela浓度达到0.5μg/ml时,游离cela、cela/cr胶束、cela/gctr胶束对hepg2细胞的生长抑制作用呈现出差异性。其增殖抑制作用,cela/gctr胶束明显大于游离cela,与cela/cr胶束比,其增殖抑制效果也更好。在72h时,浓度为0.5μg/ml时,cela/gctr
胶束细胞存活率为(41.58
±
6.14)%,cela/cr胶束细胞存活率为(71.73
±
2.83)%,游离cela细胞存活率为(87.06
±
5.78)%。与游离cela、cela/cr胶束比较,cela/gctr胶束细胞存活率分别下降了的2.1、1.7倍左右。随着时间的延长、浓度的增加,cela/gctr胶束抑制hepg2细胞增殖的效果越明显,表现出较强的细胞毒性。
[0173]
从bel-7402细胞mtt结果可以看出,不同浓度的etoh+el、cr偶联物、gctr偶联物对bel-7402细胞存活率均无显著影响。当cela浓度达到0.25μg/ml时,游离cela、cela/cr胶束、cela/gctr胶束表现出抑制bel-7402细胞增殖作用,抑制效果强于同给药浓度时对hepg2细胞的增殖抑制效果,其中以cela/gctr胶束抑制作用最强。cela浓度为0.5μg/ml时,24h,游离cela细胞存活率约为cela/cr胶束的1.5倍,约是cela/gctr胶束的1.6倍,表明cela包载进胶束后,抑制细胞增殖的能力增强。
[0174]
由表10可知,游离cela与cela/cr胶束、cela/gctr胶束组ic
50
值比较结果显示,各组ic
50
具有较大差异,证明cela/cr胶束、cela/gctr胶束组对肝癌细胞具有良好的杀伤作用。相同cela浓度下,cela/gctr胶束对肝癌细胞增殖抑制作用强于对正常肝细胞的增殖抑制作用,说明cela/gctr胶束具有一定的肝癌细胞选择性。与cela/cr胶束比,cela/gctr胶束对hepg2细胞和bel-7402细胞这两种肝癌细胞的抑制增殖作用更强,并且随时间推移其杀伤作用越来越强。
[0175]
表10 cela及其不同胶束对不同细胞毒性作用ic
50
值(μg/ml)(n=6)
[0176][0177]
2、细胞摄取实验结果
[0178]
本实验采用p4作为荧光探针进行细胞摄取实验。p4是一种环境响应型氮杂bodipy染料,在疏水性环境中呈现红色荧光,但在水中会因为分子聚集而荧光淬灭。激光共聚焦定性研究结果如图10所示,其中红色为p4的荧光,蓝色为hoechst 33342的荧光。在hepg2细胞中,游离p4溶液孵育4h后在细胞中并无明显红色荧光,而(p4+cela)/cr胶束、(p4+cela)/gctr胶束孵育后的hepg2细胞内出现了红色荧光,表明胶束以完整的胶束形态包裹cela和p4进入细胞内。而在l-02细胞内所有组别都未出现明显红色荧光,表明正常肝细胞对胶束的摄取较少,因而载药胶束将对肝脏产生较小的毒副作用。
[0179]
为了研究ga修饰后的胶束摄取,提前1h加入ga溶液,使其饱和hepg2细胞上的ga受体后,再加入(p4+cela)/gctr胶束,以及设置无ga修饰的(p4+cela)/cr胶束,考察hepg2细胞对胶束的摄取情况。图11可看出,经ga预处理的(p4+cela)/gctr胶束红色荧光最弱,平均荧光强度为225.62
±
13.45,表明ga预处理后,肿瘤细胞对(p4+cela)/gctr胶束的摄取率较低。在相同时间内,ga修饰的(p4+cela)/gctr胶束较无ga修饰的(p4+cela)/cr胶束有更明
显的细胞摄取,两者的平均荧光强度分别为606.79
±
49.94、293.37
±
13.94。
[0180]
结合上述结果,表明ga介导的主动靶向有利于纳米胶束被肝肿瘤细胞所摄取。
[0181]
3、细胞周期实验结果
[0182]
将hepg2细胞分别用cela、cela/gctr胶束溶液孵育24h后,采用流式细胞仪检测细胞周期不同阶段的细胞群体,细胞周期分布通过用pi染色dna来确定。图11、表11结果显示,control组细胞大部分处于g0/g1期,当给予两组药物制剂后均使g0/g1期细胞比例增加,s期细胞比例降低。相比于cela单独处理组,cela/gctr胶束处理组还能使一些细胞阻滞于g2/m期。由此可见,cela/gctr胶束能阻滞细胞周期从而抑制肿瘤细胞有丝分裂,促进细胞凋亡。
[0183]
表11 cela和cela/gctr胶束对hepg2细胞周期的影响(n=3)
[0184][0185]
本实验例的结果表明,gctr偶联物是一种安全的药物载体。在合适浓度范围内cela/gctr胶束对正常肝细胞l-02无明显毒性,对肝癌细胞hepg2、bel-7402细胞均表现出明显的抑制增殖作用。经ga修饰的cela/gctr胶束对肝肿瘤细胞具有识别作用,增加了肝肿瘤细胞的摄取率,进而增强了对于肝肿瘤细胞的杀伤效率,证明了cela/gctr胶束具有体外靶向抑瘤效应。
[0186]
实验例7 cela/gctr胶束的体内药动学与组织分布研究
[0187]
一、实验方法
[0188]
1、血浆样品的制备
[0189]
小鼠眼球取血,置于含有肝素钠的1.5ml离心管中,4000r/min离心5min,取血浆备用。精密吸取小鼠空白血浆200μl,加入内标物质(tanshinoneⅱa 5μg/ml)10μl,涡旋混匀后加入3ml乙酸乙酯萃取,涡旋振荡3min,置于高速离心机中3500r/min离心10min,取上清液至5ml离心管中,挥干,100μl甲醇涡旋振荡5min复溶,14000r/min离心10min,取上清液70μl做uplc-ms分析。
[0190]
2、活体成像实验
[0191]
2.1共载p2和cela胶束的制备
[0192]
称取gctr偶联物12mg于西林瓶中,加入2.4ml水溶解。取2mg p2于250ml容量瓶中,用甲醇溶解定容,配制成8μg/ml的母液备用。精密量取p2母液11.25ml于离心管中挥干甲醇,加入450μl含有少量cela的dmso溶液复溶,室温下逐滴加入至高速搅拌的gctr偶联物水溶液中,继续搅拌20min,冰水浴探头超声20min,将溶液转移至透析袋中,透析12h,冷冻干燥即得共载p2和cela的(p2+cela)/gctr胶束。(p2+cela)/cr胶束制备方法同上。
[0193]
2.2实验方法
[0194]
为了考察gctr胶束在体内分布情况,我们用共载p2和cela的gctr胶束,考察其体
内分布。将肿瘤体积大于100mm3的小鼠随机分成4组,每组3只,分别经尾静脉注射p2的生理盐水溶液、(p2+cela)/cr胶束以及(p2+cela)/gctr胶束,注射后于0h、0.5h、l h,2h,4h,6h,12h和24h时间点于活体成像仪下观察小鼠体内荧光物质分布情况,并拍照记录。
[0195]
二、实验结果
[0196]
1、血药浓度时间曲线
[0197]
图12为小鼠尾静脉注射cela、cela/cr胶束和cela/gctr胶束后,测定不同时间点小鼠血液中cela的浓度,以取样时间点为横坐标,血药浓度为纵坐标,绘制血药浓度-时间曲线。结果表明,给药后血浆中cela血药浓度逐渐下降,cela/cr胶束和cela/gctr胶束的cela血药浓度变化缓慢,从2h后逐渐保持平稳趋势释放。游离cela在血中清除速度较快,在2h内呈现快速下降的趋势,在24h时血浆中几乎检测不到,而cela/cr胶束和cela/gctr胶束组前1h释放速率较快,1h后开始缓慢释放,24h仍然维持稳定的血药浓度,表明cela被包载进胶束后,改变了药物存在的形态,可以使cela长时间存在于体内并保持缓慢释放,显著提高cela在血液中的滞留时间。
[0198]
2、cela/gctr胶束的活体成像研究
[0199]
小鼠尾静脉注射p2、(p2+cela)/cr胶束和(p2+cela)/gctr胶束的生理盐水溶液后,小鼠活体及给药第24h组织荧光成像结果见图14~18。由图15可以看出,小鼠尾静脉注射(p2+cela)/gctr胶束后,从0.5h开始逐渐在肝脏累积,并在1h荧光信号达到最强然后逐渐减弱,到24h仍然存在荧光信号。(p2+cela)/cr胶束荧光信号也是从0.5h开始在肝脏累积,2h达到最大。从图16可以看出,小鼠全身荧光强度在1h和2h时,(p2+cela)/gctr胶束组均大于(p2+cela)/cr胶束组,表明p2+cela/cr胶束和(p2+cela)/gctr胶束均表现出肝靶向性,且(p2+cela)/gctr胶束肝靶向性更强,可能是由于gctr偶联物中ga与肝细胞表面受体结合,使得(p2+cela)/gctr胶束与肝脏组织的亲和力增大,更多的在肝部位浓集。从图17可以看出,随着时间的延长,荧光信号逐渐在肿瘤部位累积,(p2+cela)/cr胶束组在12h荧光强度达到最大,(p2+cela)/gctr胶束在第8h荧光强度最强,且荧光强度明显高于(p2+cela)/cr胶束。该结果表明,(p2+cela)/gctr胶束对肿瘤细胞具有靶向作用,且靶向效果比(p2+cela)/cr胶束更好。
[0200]
给药24h后将小鼠脱颈椎处死,解剖取出各脏器组织和肿瘤组织,活体荧光分析。组织荧光成像结果可以发现,在第24h时,肝组织中还存在少量荧光信号,肿瘤组织中荧光信号相对较强。从荧光强度图中也能看出同样的结果,肝脏组织中剩余荧光强度也略高于(p2+cela)/cr胶束组,分析原因可能是载体gctr偶联物中ga可与肝脏中ga受体结合,所以荧光较强。肿瘤组织中(p2+cela)/gctr胶束剩余荧光强度更高可能是由于cela/gctr胶束粒径较小,水溶性更好,与肿瘤组织接触更多,因此剩余荧光更强。
[0201]
本实验例的实验表明,cela/gctr胶束在体内具有长循环作用,能够显著提高cela在血液中的滞留时间,提高了cela生物利用度。此外,cela/gctr胶束在体内可以到达肝脏和肿瘤部位,能够停留24h以上,表现出对肝组织和肿瘤组织的靶向性。
[0202]
通过上述实施例和实验例可以看出,本发明提供的gctr偶联物的胶束对活性氧敏感,其制成的药物cela/gctr胶束表现出对肝组织和肿瘤组织的靶向性,且在体内具有缓释cela药物的作用。该特性使得gctr偶联物及cela/gctr胶束在肝癌药物的制备中具有很高的应用潜力。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1