一种针对药物警戒E2BR3标准报告的自动生成与解析验证方法、系统及存储介质与流程
一种针对药物警戒e2b r3标准报告的自动生成与解析验证方法、系统及存储介质
技术领域
1.本发明涉及一种数据管理技术领域,具体涉及一种针对药物警戒e2b r3标准报告的自动生成与解析验证方法、系统及存储介质。
背景技术:
2.e2b(r3)是关于icsr(个例安全报告)的电子数据标准,是监管部门、药品上市许可持有人等机构之间信息系统公认的“通用言语”,e2b(r3)实施应用核心目的是便于icsr在不同机构之间共享和交换。r3报告主要应用在临床试验药物警戒系统中,规范个例安全报告统一递交的格式。对于非it人员研究来讲,要看懂此xml文档并进行编辑得到正确的结果,基本上是非常困难的事情。再者,药物警戒涉及器械类,疫苗类,化妆品类多种行业,每个行业对应数据字段也有区别。同时,各国家也会增加自己国家特有的区域性字段。
3.因此,需要一种灵活的数据结构设计方式,可以适应不断发展的业务需求,方便集成至各类临床试验系统中使用。
技术实现要素:
4.针对现有技术存在的问题,本发明提供一种针对药物警戒e2b r3标准报告的自动生成与解析验证方法,所述e2b r3标准报告具有各类数据元素,包括如下步骤:
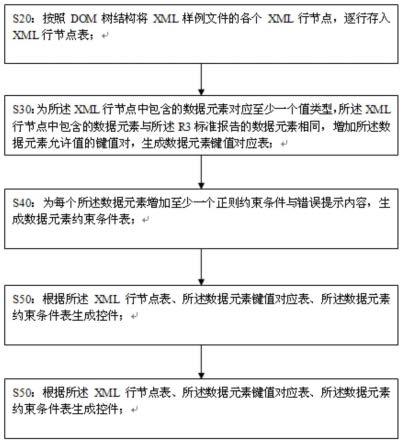
5.s20:按照dom树结构将xml样例文件的各个xml行节点,逐行存入xml行节点表;优选的,包括行的注释信息;
6.s30:为所述xml行节点中包含的数据元素对应至少一个值类型,所述xml行节点中包含的数据元素与所述r3标准报告的数据元素相同,增加所述数据元素允许值的键值对,生成数据元素键值对应表;
7.s40:为每个所述数据元素增加至少一个正则约束条件与错误提示内容,生成数据元素约束条件表;
8.s50:根据所述xml行节点表、所述数据元素键值对应表、所述数据元素约束条件表生成控件;
9.s60:选择需要组合的所述控件,生成模板表。
10.在一些实施方式中,还包括步骤:
11.s70:录入数据,根据验证规则进行提示;
12.s80:提交数据,生成r3 xml文件;
13.s90:根据xml schema文档对所述r3 xml文件进行内容校验;
14.s100:校验通过,生成可导出的所述e2b r3 xml标准报告。
15.在一些实施方式中,在所述步骤s20前还包括步骤s10:将所述e2b r3标准报告的数据元素生成数据元素注释表,所述数据元素注释表的字段至少包括数据元素变量id值、数据元素标识和数据元素控件类型。
16.在一些实施方式中,所述步骤s20具体包括:获取xml样例文件的dom树结构的各个行节点,按照所述xml样例文件的dom树结构,将所述各个行节点中的上级节点的xml标签进行独立保存,记录同级节点的xml标签排序顺序值,得到xml行节点表。
17.在一些实施方式中,所述步骤s20具体还包括:将所述xml样例文件逐行拆解,获取所述行节点的属性值,判断所述属性值是否等于所述数据元素注释表中的数据元素标识字段值,如果相等,则分别单独保存数据元素变量id值字段,并将与具有所述属性值的节点对应的xml数据保存至数据库,所述xml数据包括节点xml数据、顺序行号、同组编号、数据元素变量id值,所述xml数据形成xml行节点表。
18.在一些实施方式中,所述步骤s30具体包括:根据所述数据元素控件类型对所述数据元素进行定义,以此为所述xml行节点中包含的数据元素对应至少一个值类型。
19.在一些实施方式中,所述数据元素约束条件表的字段包括所述数据元素变量id值、是否存在关联、关联数据元素id值、关联数据元素的值和数据元素正则表达式;所述正则约束条件按预设要求逐个对数据元素进行独立设定。优选的,所述预设要求为e2b r3官方指南文件中的规则要求。
20.在一些实施方式中,所述步骤s80具体为:提交数据后,按照所述xml行节点表对每个所述节点进行数据赋值,并根据父级以及同级顺序进行组装xml文件,生成r3 xml文件。
21.本发明的另一目的是提供一种针对药物警戒e2b r3标准报告的自动生成与解析验证系统,所述系统包括存储器、处理器及存储在所述存储器上并可在所述处理器上运行的针对药物警戒e2b r3标准报告的自动生成与解析验证程序,所述针对药物警戒e2b r3标准报告的自动生成与解析验证程序配置为实现如权利要求1至8中任一项所述的针对药物警戒e2br3标准报告的自动生成与解析验证方法的步骤。
22.本发明的另一目的是提供一种存储介质,所述存储介质上存储有针对药物警戒e2b r3标准报告的自动生成与解析验证程序,所述针对药物警戒e2b r3标准报告的自动生成与解析验证程序配置为实现如权利要求1至8中任一项所述的针对药物警戒e2b r3标准报告的自动生成与解析验证方法的步骤。
23.本发明所提供的一种针对药物警戒e2b r3标准报告的自动生成与解析验证方法实现了对药物警戒相关的e2b r3标准xml文档进行分解、生成和验证一体化操作,可以方便的集成至相关系统中适用。本发明所提供的一种针对药物警戒e2b r3标准报告的自动生成与解析验证系统采用本发明的方法,可以减少相关人员的学习成本,只需要根据简单学习下操作规则,即可根据录入规则以及标签提示进行数据的录入。同时,将各项数据进行解耦合后,当标签进行增加、减少、变化的时候,只需要对相应的表数据进行修正即可,前后台代码根本无需更改。由于此数据一次录入后,即可用在任何其他的系统中,也可以提供一种微服务,供各类相关系统使用。
附图说明
24.为了更清楚地说明本技术实施例的技术方案,下面将对本技术实施例中所需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下还可以根据这些附图获得其他的附图。
25.图1是本发明的针对药物警戒e2b r3标准报告的自动生成与解析验证方法步骤示意图;
26.图2是e2b r3指南原始pdf文档的部分截图;
27.图3是本发明一实施例中录入excel表导入数据元素注释表后的数据信息示意图;
28.图4是本发明一实施例的c.1.9.1.r.1数据元素xml行节点样例文档示意图;
29.图5是本发明一实施例的xml行节点表示意图;
30.图6是e2b r3指南原始pdf文档中关于数据元素(c.2.r.4资格)部分的截图;
31.图7是本发明一实施例的数据元素键值对应表示意图;
32.图8是本发明一实施例的数据元素约束条件表示意图;
33.图9是本发明一实施例的模板数据表示意图;
34.图10是本发明一实施例的前台页面示意图。
具体实施方式
35.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
36.针对现有技术存在的问题,本发明提供了一种针对药物警戒e2b r3标准报告的自动生成与解析验证方法,该e2b r3标准报告具有各类数据元素标签,该方法包括如下步骤:
37.s10:将e2b r3标准报告所涉及的数据元素内容生成数据元素注释表,数据元素注释表的字段至少包括数据元素变量id值、数据元素标识和数据元素控件类型。
38.请参考图1~图2,根据当前的e2b r3指南pdf文件,整理所有相关数据元素至excel文档中,导入至[数据元素注释表_001]。e2b r3指南pdf文件是官方发布的,英文版由ich发布,中文版由cde发布。按照pdf文件对各个数据元素知识点的定义,可以人工手动的把各类数据元素的文本信息录入至excel表格中。excel表格的相关字段和字段值与[数据元素注释表_001]的字段和字段值一致。这些字段和字段值都是文本信息内容,相关字段和字段值全部为pdf的原始数据信息,并不参与主要业务逻辑的运算。主要是作为后续逻辑的备档查看与快速检索,方便开发人员或用户快速查看各标签的含义。字段包括但不限于:[数据元素变量id值]、[数据元素标识]、[数据元素中文名称]、[数据元素英文名称]、[数据元素介绍]、[数据元素约束条件说明]。其中,[数据元素变量id值]字段为全局系统唯一,标识为主键。为保证具有语义性,与官方定义的数据元素标识名称一致。
[0039]
s20:按照dom树结构将xml样例文件的各个xml行节点,逐行存入xml行节点表。优选的,包括行的注释信息。
[0040]
具体来讲,是将r3 xml样例文件,按照dom树结构,将各行节点node存入一[xml行节点表_002]。根据ich官方发布的r3 xml样例文件,按照xml文件的dom树结构,可以手工把各行节点片段抽离,并把各自的上级节点的数据元素进行独立保存,同级数据元素记录排序顺序值,记录该数据元素以什么控件展示,即xml数据元素的控件类型。通过此方法,将上千行的xml文件,分成了若干个片段,并且树结构也得以保存,以实现后续xml树的还原操作。
[0041]
根据xml文档的特性,各个node树之间都带有相关层级性,为了保持层级性,需要
将node树结构也保存完整。请参考图3~图4,利用自写代码程序,逐行的将样例xml文件拆解,取得xml相关属性值,并与[数据元素注释表_001]中[数据元素标识]字段进行比对,凡是相等的,都单独保存[数据元素变量id值]字段,将并将与具有该属性值的节点对应的xml数据保存至数据库中。如图3所示,xml数据包括节点xml数据、顺序行号、同组编号、数据元素变量id值,利用上述的xml数据形成xml行节点表。上述的[是否可重复]表示该节点字段是否具有重复属性;[顺序行号]表示各行节点的所在位置,在后续功能页面利用行号进行组合;[同组编号]表示多个行节点源数据为闭合组合,再利用是否可重复字段,可还原重复的开始和结束。
[0042]
s30:为xml行节点中包含的数据元素对应至少一个值类型,增加各个数据元素允许值的键值对,生成数据元素键值对应表。
[0043]
应当说明的是,为了保持一致性,xml行节点的数据元素与r3标准报告的数据元素相同,所述的相同是指数据元素的字段相同,不是数据元素数量相同。为一个数据元素对应多个值类型,例如:下拉框,单选,多选框,增加允许值的键值对,该系列操作可以形成一[数据元素键值对应表_003];举例来讲,某些数据元素是有多个选项值的,例如(由报告者强调的术语)此数据元素对应:1=是,由报告者突出显示,非严重;2=否,报告者未突出显示,非严重;3=是,由报告者突出显示,严重;4=否,报告者未突出显示,严重这四个值,中英文也需要同时保存。类型基本也就是常见的下拉框、单选、多选。
[0044]
参考图5~图6,根据[数据元素注释表_001]中[数据元素控件类型]字段对每个数据元素类型进行定义。例如select表示下拉框,radio表示单选框,checkbox表示多选框,date表示日期选择框。当是下拉框时,此数据元素允许的值是动态的,根据r3官方手册进行添加记录。例如:c.2.r.4允许值如图4所示,则在[数据元素键值对应表_003]表中添加对应的信息。根据图中e3b r3文档,将允许值添加至数据库中,方便建立索引实现报告的快速统计等效果。
[0045]
s40:为每个数据元素增加至少一个正则约束条件与错误提示内容,生成数据元素约束条件表;
[0046]
根据指南文件,将每个数据元素相关的验证规则,通过正则表达式的方式,记录在数据表中,每个数据元素有多个验证规则,并且也记录错误的提示内容,以此获得较好的人性化体验,通过为每个数据元素增加多个正则约束条件与错误提示内容,存入一[数据元素约束条件表_004]。
[0047]
根据文档中的说明,对各个数据元素的验证条件进行编写保存。例如图5所示,一致性:可选,但是如果c.2.r.5=1,则为必填;数据类型:1n;允许值:1,2,3,4,5,unk。录入数据库后如图7所示,数据元素存在多种的验证条件,都是通过正则表达式进行表示的。require表示当关联控件c_2_r_5=1时,此控件为必填项。必填项的值只允许第2行中的正则允许值。这样方便前端开发与后端开发拥有统一的验证规则,降低开发人员的学习成本与理解不一致性带来的系统bug。
[0048]
需要说明的是,本发明中由于涉及多个数据元素,应当理解的是,为了避免混淆,相同字段的数据元素无论在前述的何种表或者前述的何种文件亦或是数据中都表示同一种含义,例如[数据元素变量id]值这一字段,其在[数据元素注释表]中的含义与在xml样例文件中的含义相同,进一步示例,如[数据元素注释表]中的[数据元素变量id值]的字段值
为c.1.9.1.r.1,[数据元素约束条件表]中的数据元素变量id值的字段值也为c.1.9.1.r.1,则表示为同一个元素。
[0049]
s50:根据xml行节点表、数据元素键值对应表、数据元素约束条件表生成控件;
[0050]
s60:选择需要组合的所述控件,生成模板表。
[0051]
准备模板表,选择此表单需要组合的控件群组,可以形成一[模板表_005]。开发人员可依照此数据结构,在软件/web前端,建立数据元素选择功能,将某一规定报告(例如个例安全报告,cioms报告)所需要的所有控件都勾选,存入[模板表_005],以此将控件信息都记录至此模板中,并辅以命名,方便下一步进行调用。
[0052]
如图8所示,此表承载各类报告的控件组合,是前端开发人员对报告页面显示哪些控件,如何显示,显示的顺序是多少都进行了布局定义。后端开发工程师读取数据后,即可根据其他表一起向前端返回各类表的json组合字段。
[0053]
为了方便解析和验证,在一些实施例中,本发明的方法还包括步骤:
[0054]
s70:录入数据,根据验证规则进行提示。
[0055]
用户在页面前台录入数据,根据验证规则进行人性化提示;该数据是需要提交的个例安全报告数据。根据前述得到的[模板表_005],前端开发工程师根据后端开发工程师接口api,返回模板json数据结构。信息录入人员需要录入哪种报告格式,就选择哪种模板,程序自动根据模板的json数据结构,在页面进行组装布局呈现。录入人员在数据录入页面进行录入,录入数据会根据[数据元素约束条件表_004]的验证规则,时时对数据进行正确性验证,辅助录入人员的工作,减少大量的学习成本。如图9所示,前端开发工程师根据后端开发工程师接口返回的json数据,即可在前端页面进行布局以及增加验证条件。
[0056]
s80:提交数据,生成r3 xml文件。
[0057]
用户提交,系统根据已填数据生成r3 xml文件;是已经录入的数据,通过正则规则验证后,将会按照[xml行节点表_002]对每个node节点进行数据赋值,并根据父级以及同级顺序进行组装xml文件,达到快速生成的目的。填写完毕后,前端开发工程师与后端开发工程师,根据[数据元素约束条件表_004]中预设的正则条件,对各项数据进行验证,保证数据录入的正确性。
[0058]
s90:根据xml schema文档对所述r3 xml文件进行内容校验。
[0059]
根据xml schema文档进行内容校验;是针对已经生成的r3 xml文件进行格式的验证,验证xml格式与数据是否已经全部正确。如果验证不正确,则提示在第几行有什么样的错误,相关人员辅以修正,直到验证正确。利用官方提供的schema文档,对xml文档的格式再次进行验证,可以保证文档格式的正确性。
[0060]
s100:校验通过,生成可导出的所述e2b r3 xml标准报告。
[0061]
导出的标准e2b r3 xml文档,可发送至任何公司使用,经过验证后的数据文档,通过导出的方式,可以下载标准格式的e2b r3 xml文档。此份文档就是针对药物警戒体系,全世界通用的标准文档。即,验证完成后,就可以按照要求进行导出xml文档,此文档就可以上报至国家cde平台,adr平台,也可以发送至其他公司进行系统导入使用。
[0062]
本发明还提供一种针对药物警戒e2b r3标准报告的自动生成与解析验证系统,该系统包括存储器、处理器及存储在存储器上并可在处理器上运行的针对药物警戒e2b r3标准报告的自动生成与解析验证程序,针对药物警戒e2b r3标准报告的自动生成与解析验证
程序配置为实现前述的针对药物警戒e2b r3标准报告的自动生成与解析验证方法的步骤。
[0063]
本发明还提供一种存储介质,该存储介质中存储有计算机程序,其中,该计算机程序即针对药物警戒e2b r3标准报告的自动生成与解析验证程序,其被设置为运行时执行前述的针对药物警戒e2b r3标准报告的自动生成与解析验证方法的步骤。存储介质可以包括如软盘、光盘、dvd、硬盘、闪存、u盘、cf卡、sd卡、mmc卡、sm卡、记忆棒(memory stick)、xd卡等。
[0064]
作为计算机软件产品,上述的针对药物警戒e2b r3标准报告的自动生成与解析验证程序被存储在存储介质中,包括若干指令用以使得一台或多台计算机设备(可以是个人计算机设备、服务器或其他网络设备等)用以执行本发明方法的全部或部分步骤。
[0065]
以上所述本发明的具体实施方式,并不构成对本发明保护范围的限定。任何根据本发明的技术构思所做出的各种其他相应的改变与变形,均应包含在本发明权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1