一种注射用更昔洛韦钠冻干粉的制备方法与流程
1.本发明涉及医药领域,特别涉及一种注射用更昔洛韦钠冻干粉的制备方法。
背景技术:
2.更昔洛韦钠,别称为9
‑
(1,3
‑
二羟基
‑2‑
丙氧甲基)
‑
鸟嘌呤钠,分子式为c9h
12
n5nao4,由更昔洛韦制备而成。相比更昔洛韦,更昔洛韦钠具有较好的水溶性。目前,有关更昔洛韦钠的研究主要集中于更昔洛韦钠的结晶。
[0003][0004]
cn01133524.6公开了更昔洛韦钠水合物及制备方法和应用,认为该法制备的样品吸潮率和杂质远低于按冷冻干燥法制备的样品,为解决更昔洛韦钠冷冻干燥问题,本技术重点研究更昔洛韦钠冻干粉,以提供一种低吸潮率和高纯度的注射用更昔洛韦钠冻干粉。而且并未见有关更昔洛韦或更昔洛韦钠冻干粉的吸潮性和纯度研究。
技术实现要素:
[0005]
鉴以此,本发明的目的在于提出一种注射用更昔洛韦钠冻干粉的制备方法。本发明的技术方案是这样实现的:
[0006]
一种注射用更昔洛韦钠冻干粉的制备方法,依次包括以下步骤:
[0007]
(1)将甘露醇加入注射用水中,制得甘露醇溶液;
[0008]
(2)将步骤(1)的甘露醇溶液中加入活性炭,搅拌静置,然后粗滤脱炭;将粗滤脱炭后的甘露醇溶液过0.22μm无菌混合纤维素薄膜,制得纯化后的甘露醇溶液;
[0009]
(3)将更昔洛韦钠加入到纯化后的甘露醇溶液中,再过0.22μm无菌混合纤维素薄膜制得更昔洛韦钠溶液;将所述更昔洛韦钠溶液温度控制在50
‑
60℃之间,并用co2调节ph值在8
‑
10之间;
[0010]
(4)将所述更昔洛韦钠溶液装于瓶中,半压塞后进行冻干;通过半压塞防止药物流失和异物进入,同时半压塞给水的升华提供了通道,降低了更昔洛韦钠溶液的冻干条件,提高了冻干效率。
[0011]
(5)冻干结束后进行压塞、复压,制得注射用更昔洛韦钠冻干粉。
[0012]
进一步的技术方案是,所述甘露醇溶液的质量浓度为2
‑
5%。
[0013]
进一步的技术方案是,步骤(2)中所述活性炭在甘露醇溶液中的质量浓度为0.05
‑
0.1%。
[0014]
进一步的技术方案是,所述更昔洛韦钠与甘露醇溶液的重量比为0.010
‑
0.020:1。
[0015]
进一步的技术方案是,所述步骤(2)中的搅拌静置是搅拌20
‑
30min,然后静置15
‑
20min。
[0016]
进一步的技术方案是,所述步骤(4)中的冻干依次包括步骤:预冻、一次干燥和二次干燥,
[0017]
所述预冻是在60min内将温度降至
‑
45℃至
‑
35℃之间,并在
‑
45℃至
‑
35℃之间预冻3
‑
5小时。
[0018]
更进一步的技术方案是,所述一次干燥是在真空度10
‑
15pa的条件下,在7
‑
9h之内将温度提高至
‑
5至5℃之间,并在
‑
5至5℃下保温5
‑
8h。
[0019]
更进一步的技术方案是,所述二次干燥是在真空度0
‑
10pa和3
‑
4h之内将温度提高至25
‑
45℃,并在25
‑
45℃保温6
‑
9h。
[0020]
与现有技术相比,本发明的有益效果为:
[0021]
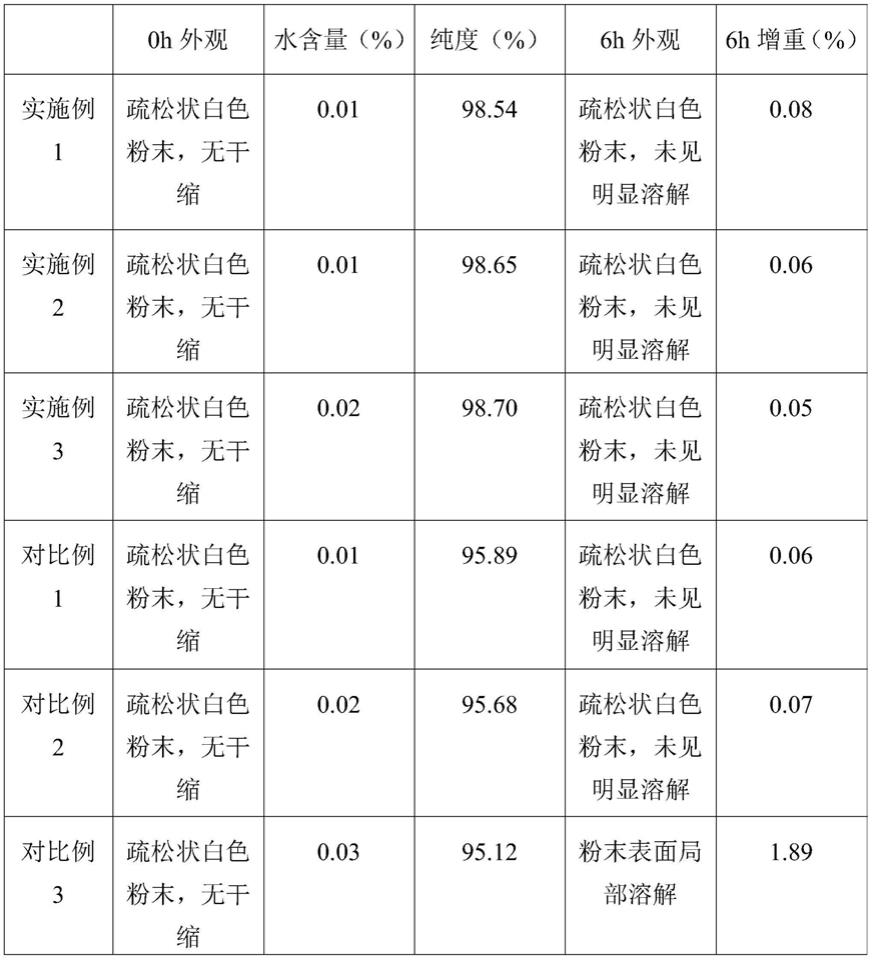
(1)本发明所述的注射用更昔洛韦钠冻干粉制备方法,以甘露醇作为保护剂载体,可形成疏松结实的均匀骨架,改善外观,且吸湿性低,纯度在98.54
‑
98.70%之间,6h后外观未见明显变化,且6h增重仅0.05
‑
0.08%,;而以无机盐氯化钠、山梨醇等保护剂的注射用更昔洛韦钠冻干粉,纯度在95.12
‑
95.26%之间,且由于具有吸湿性,6h后粉末表面有局部溶解,6h增重1.76
‑
1.89%;因此,甘露醇作为更昔洛韦钠冻干粉的保护剂更适宜更昔洛韦那冻干粉的储存,更能保证更昔洛韦钠冻干粉的纯度。
[0022]
(2)本发明所述的注射用更昔洛韦钠冻干粉制备方法中甘露醇溶液经过两次过滤,加入更昔洛韦钠后再次过滤,过滤掉了甘露醇和更昔洛韦钠携带的杂质,保证了注射用更昔洛韦钠冻干粉的纯度,另外通过co2调节ph值,也减少了其他成分及杂质的引入,进一步提高了注射用更昔洛韦钠冻干粉的纯度。
具体实施方式
[0023]
为对本发明中的技术方案进行清楚、完整地描述,显然,发明人结合实施例进行说明,但以下实施例所描述的仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0024]
实施例1
[0025]
一种注射用更昔洛韦钠冻干粉的制备方法,依次包括以下步骤:
[0026]
(1)将甘露醇加入注射用水中,制得甘露醇溶液。所述甘露醇溶液的质量浓度为5%。
[0027]
(2)将步骤(1)的甘露醇溶液中加入活性炭,搅拌20min,静置15min,然后粗滤脱炭;将粗滤脱炭后的甘露醇溶液过0.22μm无菌混合纤维素薄膜,制得纯化后的甘露醇溶液。所述活性炭在甘露醇溶液中的质量浓度为0.05%。所述更昔洛韦钠与甘露醇溶液的重量比为0.010:1。
[0028]
(3)将更昔洛韦钠加入到纯化后的甘露醇溶液中,再过0.22μm无菌混合纤维素薄膜制得更昔洛韦钠溶液;将所述更昔洛韦钠溶液温度控制在50℃之间,并用co2调节ph值在
8之间。
[0029]
(4)将所述更昔洛韦钠溶液装于瓶中,半压塞后进行冻干。所述冻干依次包括步骤:预冻、一次干燥和二次干燥;所述预冻是在60min内将温度降至
‑
45℃,并在
‑
45℃预冻3小时;所述一次干燥是在真空度10pa的条件下,在7h之内将温度提高至
‑
5℃之间,并在
‑
5℃下保温5h;所述二次干燥是在真空度0pa和3h之内将温度提高至25℃,并在25℃保温6h。
[0030]
(5)冻干结束后进行压塞、复压,制得注射用更昔洛韦钠冻干粉。
[0031]
实施例2
[0032]
一种注射用更昔洛韦钠冻干粉的制备方法,依次包括以下步骤:
[0033]
(1)将甘露醇加入注射用水中,制得甘露醇溶液。所述甘露醇溶液的质量浓度为2%。
[0034]
(2)将步骤(1)的甘露醇溶液中加入活性炭,搅拌30min,静置20min,然后粗滤脱炭;将粗滤脱炭后的甘露醇溶液过0.22μm无菌混合纤维素薄膜,制得纯化后的甘露醇溶液。所述活性炭在甘露醇溶液中的质量浓度为0.1%。所述更昔洛韦钠与甘露醇溶液的重量比为0.020:1。
[0035]
(3)将更昔洛韦钠加入到纯化后的甘露醇溶液中,再过0.22μm无菌混合纤维素薄膜制得更昔洛韦钠溶液;将所述更昔洛韦钠溶液温度控制在60℃之间,并用co2调节ph值在10之间。
[0036]
(4)将所述更昔洛韦钠溶液装于瓶中,半压塞后进行冻干。所述冻干依次包括步骤:预冻、一次干燥和二次干燥;所述预冻是在60min内将温度降至
‑
35℃之间,并在
‑
35℃之间预冻5小时;所述一次干燥是在真空度15pa的条件下,在9h之内将温度提高至5℃之间,并在5℃下保温8h;所述二次干燥是在真空度10pa和4h之内将温度提高至45℃,并在45℃保温9h。
[0037]
(5)冻干结束后进行压塞、复压,制得注射用更昔洛韦钠冻干粉。
[0038]
实施例3
[0039]
一种注射用更昔洛韦钠冻干粉的制备方法,依次包括以下步骤:
[0040]
(1)将甘露醇加入注射用水中,制得甘露醇溶液。所述甘露醇溶液的质量浓度为4%。
[0041]
(2)将步骤(1)的甘露醇溶液中加入活性炭,搅拌25min,静置18min,然后粗滤脱炭;将粗滤脱炭后的甘露醇溶液过0.22μm无菌混合纤维素薄膜,制得纯化后的甘露醇溶液。所述活性炭在甘露醇溶液中的质量浓度为0.07%。所述更昔洛韦钠与甘露醇溶液的重量比为0.015:1。
[0042]
(3)将更昔洛韦钠加入到纯化后的甘露醇溶液中,再过0.22μm无菌混合纤维素薄膜制得更昔洛韦钠溶液;将所述更昔洛韦钠溶液温度控制在55℃之间,并用co2调节ph值在9之间。
[0043]
(4)将所述更昔洛韦钠溶液装于瓶中,半压塞后进行冻干。所述冻干依次包括步骤:预冻、一次干燥和二次干燥;所述预冻是在60min内将温度降至
‑
40℃,并在
‑
40℃之间预冻4小时;所述一次干燥是在真空度10pa的条件下,在8h之内将温度提高至0℃之间,并在0℃下保温6h;所述二次干燥是在真空度5pa和3.5h之内将温度提高至35℃,并在35℃保温8h。
[0044]
(5)冻干结束后进行压塞、复压,制得注射用更昔洛韦钠冻干粉。
[0045]
对比例1
[0046]
无步骤(2),其他步骤与实施例1相同。具体为:一种注射用更昔洛韦钠冻干粉的制备方法,依次包括以下步骤:
[0047]
(1)将甘露醇加入注射用水中,制得甘露醇溶液。所述甘露醇溶液的质量浓度为5%。
[0048]
(2)将更昔洛韦钠加入到纯化后的甘露醇溶液中,再过0.22μm无菌混合纤维素薄膜制得更昔洛韦钠溶液;将所述更昔洛韦钠溶液温度控制在50℃之间,并用co2调节ph值在8之间。
[0049]
(3)将所述更昔洛韦钠溶液装于瓶中,半压塞后进行冻干。所述冻干依次包括步骤:预冻、一次干燥和二次干燥;所述预冻是在60min内将温度降至
‑
45℃,并在
‑
45℃预冻3小时;所述一次干燥是在真空度10pa的条件下,在7h之内将温度提高至
‑
5℃之间,并在
‑
5℃下保温5h;所述二次干燥是在真空度0pa和3h之内将温度提高至25℃,并在25℃保温6h。
[0050]
(4)冻干结束后进行压塞、复压,制得注射用更昔洛韦钠冻干粉。
[0051]
对比例2
[0052]
步骤(3)中没有过0.22μm无菌混合纤维素薄膜,其他步骤与实施例1相同。具体为:一种注射用更昔洛韦钠冻干粉的制备方法,依次包括以下步骤:
[0053]
(1)将甘露醇加入注射用水中,制得甘露醇溶液。所述甘露醇溶液的质量浓度为5%。
[0054]
(2)将步骤(1)的甘露醇溶液中加入活性炭,搅拌20min,静置15min,然后粗滤脱炭;将粗滤脱炭后的甘露醇溶液过0.22μm无菌混合纤维素薄膜,制得纯化后的甘露醇溶液。所述活性炭在甘露醇溶液中的质量浓度为0.05%。所述更昔洛韦钠与甘露醇溶液的重量比为0.010:1。
[0055]
(3)将更昔洛韦钠加入到纯化后的甘露醇溶液中,制得更昔洛韦钠溶液;将所述更昔洛韦钠溶液温度控制在50℃之间,并用co2调节ph值在8之间。
[0056]
(4)将所述更昔洛韦钠溶液装于瓶中,半压塞后进行冻干。所述冻干依次包括步骤:预冻、一次干燥和二次干燥;所述预冻是在60min内将温度降至
‑
45℃,并在
‑
45℃预冻3小时;所述一次干燥是在真空度10pa的条件下,在7h之内将温度提高至
‑
5℃之间,并在
‑
5℃下保温5h;所述二次干燥是在真空度0pa和3h之内将温度提高至25℃,并在25℃保温6h。
[0057]
(5)冻干结束后进行压塞、复压,制得注射用更昔洛韦钠冻干粉。
[0058]
对比例3
[0059]
将甘露醇替换为氯化钠,其他步骤与实施例1相同。
[0060]
对比例4
[0061]
将甘露醇替换为山梨醇,其他步骤与实施例1相同。
[0062]
由表1可知,实施例1
‑
3中注射用更昔洛韦钠冻干粉外观疏松状白色粉末,无干缩,通过hplc检测水含量在0.01
‑
0.02%之间;而对比例3
‑
4水含量达到0.03%。
[0063]
分别取实施例1
‑
3和对比例1
‑
4的样品在20
‑
30℃的温度、相对湿度在70
‑
80%条件下放置6h,结果显示:实施例1
‑
3及对比例1
‑
2中的注射用更昔洛韦钠冻干粉外观未见明显变化看,且6h增重0.05
‑
0.08%;而对比例3
‑
4中的注射用更昔洛韦钠冻干粉外观是粉末表
面局部溶解,6h增重1.76
‑
1.89%;可见氯化钠和山梨醇作为更昔洛韦钠冻干的保护剂相比甘露醇吸湿性更大,因此甘露醇作为保护剂更适宜更昔洛韦钠冻干粉的储存。
[0064]
表1
[0065][0066][0067]
通过hplc检测实施例1
‑
3及对比例1
‑
4中更昔洛韦钠冻干粉的纯度,发现是实施例1
‑
3中更昔洛韦钠冻干粉的纯度在98.54
‑
98.70%之间,而对比例1
‑
2的更昔洛韦钠冻干粉的纯度在95.68
‑
95.89%之间,原因主要是对比例1没有进行甘露醇溶液的过滤,对比例2在更昔洛韦钠加入甘露醇溶液后没有进行滤膜过滤,导致更昔洛韦钠冻干粉中含有甘露醇或更昔洛韦钠携带的杂质所致。而对比例3
‑
4中更昔洛韦钠冻干粉的纯度在95.12
‑
95.26%之
间,主要原因是更昔洛韦钠结晶水所致,因此针对对比例3
‑
4可能还需要更加严苛的冻干条件,才能提高更昔洛韦钠冻干粉的纯度。
[0068]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1