非洲猪瘟病毒亚单位疫苗组合物、非洲猪瘟病毒蛋白抗原的组合及其应用的制作方法
1.本发明属于兽用生物制品技术领域,具体涉及非洲猪瘟病毒亚单 位疫苗组合物、非洲猪瘟病毒蛋白抗原的组合、制备方法及其应用。
背景技术:
2.非洲猪瘟(african swine fever,asf)是由非洲猪瘟病毒(asfv) 引起的一种急性、烈性、高度接触性的传染病,其发病率高,死亡率 更可高达100%,我国将其列为一类动物疫病。该病最早在1921年于 非洲的肯尼亚确认发生,2007年以来,非洲猪瘟在全球多个国家发生、 扩散、流行,2018年传入我国。该病被发现至今近百年,但目前全球 尚无获批疫苗和特效药。
3.非洲猪瘟疫苗研发的难点在于病毒基因组大,蛋白多,结构复杂, 且大部分基因功能未知,病毒与宿主细胞相互作用的机制不明确,难 以大规模培养,传代易变异,病毒免疫逃逸机制不清,因此常规灭活疫 苗及减毒活疫苗迄今尚无实质性进展,且减毒活疫苗使用不当存在毒 力返强及散毒的生物安全风险。
4.因此,临床上亟需非洲猪瘟疫苗,要求其具有良好的免疫效果, 能有效保护猪,同时没有生物安全的风险。
技术实现要素:
5.为此,本发明通过现代生物学方法,将病原的基因和蛋白进行分 析,并对其免疫保护能力进行检验,进行亚单位疫苗的开发,有效解 决目前各类疫苗免疫效果不理想的问题。
6.本发明提供一种非洲猪瘟病毒亚单位疫苗组合物,所述非洲猪瘟 病毒亚单位疫苗组合物的蛋白抗原由多组分蛋白抗原组成,能为猪提 供良好的免疫效力。
7.本发明还提供所述非洲猪瘟病毒亚单位疫苗组合物的应用,所述 应用是指在制备预防非洲猪瘟病毒感染的药物中的应用。
8.本发明提供非洲猪瘟病毒蛋白抗原的组合,其中,所述非洲猪瘟 病毒蛋白抗原由多组分蛋白抗原组成。所述非洲猪瘟病毒蛋白抗原的 组合共同施用,协同增效,免疫效果良好,有效解决了现有技术中各 类疫苗免疫效果不理想的问题。
9.本发明还提供所述的非洲猪瘟病毒蛋白抗原的组合的应用,其 中,所述应用是指在制备预防非洲猪瘟病毒感染的药物中的应用。
10.本发明的非洲猪瘟病毒亚单位疫苗和蛋白抗原的组合采用多组 分非洲猪瘟病毒蛋白抗原,免疫效果好,有效解决了目前非洲猪瘟病 毒疫苗面临的免疫原性差的问题;所述疫苗组合物可通过基因工程手 段进行大量的表达,不仅耗时短,还可便于大规模生产,无生物安全 风险。
具体实施方式
11.以下,对本发明的实施方式进行说明。
12.定义
13.术语“非洲猪瘟病毒”是指非洲猪瘟病毒(asfv,african swinefever virus)是非洲猪瘟病毒科(asfarviridae)下仅有的种,具有传 染性和极高的致病性,asfv形态为正二十面体,直径约200纳米, 由多层物质构成:中央为内含拟核的蛋白质核壳,由内向外分别还有 一层脂质包膜和蛋白质衣壳。衣壳由8280个主要的衣壳蛋白p72和 60个戊蛋白构成,此外至少有三种蛋白质通过对临近蛋白的粘连来保 持衣壳结构的稳定,急性病例临床症状以高热、病程短、死亡率高、 内脏器官广泛性出血以及呼吸系统和神经系统功能紊乱为主要特征。 直至2020年仍未有针对asfv的特效疫苗或是抗病毒药物可以有效 的在疫情爆发时及时控制病毒的传播。
14.术语“非洲猪瘟病毒p34蛋白”、“非洲猪瘟病毒p14蛋白”是指 非洲猪瘟病毒编码一种名为p220的多聚蛋白,该p220多聚蛋白存在 于成熟病毒粒子的核衣壳中,占病毒蛋白总量的30%左右,在病毒组 装和病毒感染中发挥着重要的作用。p220多聚蛋白在蛋白酶的作用 下可有序的裂解为p150、p34、p37和p14。p150、p34、p37和p14 在病毒衣壳的组装过程中起着至关重要的作用,其中,p34、p14属于 p220中重要的结构蛋白,对病毒内核蛋白的包装起着重要的作用。
15.术语“非洲猪瘟病毒c129r蛋白”是指锰依赖的超氧化物歧化酶。
16.术语“非洲猪瘟病毒dp96r蛋白”是指抑制ⅰ型ifn表达和nf
‑ꢀ
κb活化,又称“pdp96r蛋白”。
17.术语“非洲猪瘟病毒a104r蛋白”是指dna结合蛋白,参与病 毒转录、dna复制及基因组包装,又称“pa104r蛋白”。
18.术语“非洲猪瘟病毒p54蛋白”是指非洲猪瘟病毒表达的早期膜 蛋白,由or fe183l基因编码,含跨膜结构域,定位于内质网衍生 的内膜前体,在病毒吸附易感细胞和入侵过程中发挥重要作用,是重 要的结构蛋白。
19.术语“非洲猪瘟病毒p17蛋白”是指非洲猪瘟病毒表达的晚期膜 蛋白,由orf d117l基因编码,位于病毒内膜的跨膜蛋白。
20.术语“非洲猪瘟病毒p22蛋白”是指非洲猪瘟病毒跨膜结构域, 位于病毒颗粒外部。
21.术语“非洲猪瘟病毒p72蛋白”是指产生于病毒感染晚期,由orfb646l基因编码,为非洲猪瘟病毒重要的抗原蛋白,是病毒二十面体 的主要成分,对于病毒衣壳的形成至关重要。
22.术语“非洲猪瘟病毒p30蛋白”是指非洲猪瘟病毒表达的早期膜 蛋白,由orf cp204l基因编码,通常在感染后2-4小时产生,在整 个感染期间持续表达,与病毒入侵宿主细胞有关,是重要的结构蛋白。 术语“简并序列”是指同一种氨基酸具有两个或更多个密码子的现象, 这样的序列就叫简并序列。
23.术语“抗原(antigen)”是指能诱导机体发生免疫应答的物质,即 能被t/b淋巴细胞表面的抗原受体(tcr/bcr)特异性识别与结合, 活化t/b细胞,使之增殖分化,产生免疫应答产物(致敏淋巴细胞或 抗体),并能与相应产物在体内外发生特异性结合的物质。
24.本发明所用术语“疫苗”、“疫苗组合物”指含有非洲猪瘟病毒蛋白 抗原的药物组合物,该药物组合物可诱发、刺激或增强猪只针对非洲 猪瘟的免疫反应。
25.术语“免疫量”应当理解为“免疫有效量”,又称免疫保护量或产生 免疫应答的有效量,为可在接受者体内有效诱导免疫应答的抗原量, 该量足以预防或改善疾病的体征或症状,包括不利的健康影响或其并 发症。所述免疫应答可能足以用于诊断目的或其它试验,或可能适合 用于预防疾病的征兆或症状,包括由病原体引起的感染所造成的不利 的健康结果或其并发症。体液免疫力或由细胞介导的免疫力或此二者 均可被诱导。动物对免疫原性组合物的免疫应答可通过例如测量抗体 效价、淋巴细胞增殖分析而间接评估,或在以野生型毒株攻击后通过 监测征兆或症状来直接评估,而该由疫苗提供的保护性免疫力可通过 测量例如受试者的临床征兆如死亡率、发病率的减少、温度数值、受 试者总体生理状况及总体健康和表现来评估。所述免疫应答可包括但 不限于诱导细胞性和/或体液免疫力。
26.术语“药学上可接受的载体”是指在本发明疫苗组合物中除非洲 猪瘟病毒蛋白抗原之外的其它所有成分,不刺激机体不阻碍使用化合 物的生物学活性和特性的载体或者稀释剂,优选为佐剂。术语“佐剂
”ꢀ
可包括铝胶佐剂;皂苷(saponin),如quil a、qs-21(cambridge biotechincorporation,cambridge ma)、gpi-0100(galenica pharmaceuticalsincorporation,birmingham al);油包水乳剂;水包油乳剂;水包油 包水乳剂;丙烯酸或甲基丙烯酸的聚合物;顺丁烯二酸酐和链烯基 (alkenyl)衍生物的共聚物选出的化合物。术语“乳剂”可尤其基于轻 液体石蜡油(european pharmacopea类型);因烯烃寡聚产生的类异 戊二烯油(isoprenoid oil),如角鲨烷(squalane)或角鲨烯油(squaleneoil),尤其异丁烯或葵烯;酸或醇的含线性烷基的酯,更尤其植物油、 油酸乙酯、丙二醇二-(辛酸酯/葵酸酯)、甘油三-(辛酸酯/葵酸酯) 或丙二醇二油酸酯;支链脂肪酸或醇的酯,尤其异硬脂酸酯。油与乳 化剂组合使用以便形成乳剂。乳化剂优选非离子表面活性剂,尤其山 梨聚糖的酯、二缩甘露醇(mannide)的酯(如无水甘露醇油酸酯)、 脂肪族二元醇(glycol)的酯、聚甘油(polyglycerol)的酯、丙二醇 的酯以及油酸的酯、异硬脂酸的酯、蓖麻油酸的酯或羟基硬脂酸的酯, 它们任选乙氧基化,还有聚氧丙烯-聚氧乙烯嵌段共聚物,尤其 pluronic产品,特别是l121。参见hunter等编写的《the theory andpractical application of adjuvants》(ed.by des stewart-tull,john wileyand sons,new york,1995:51-94)和todd等编写的《vaccine》(1997, 15:564-570)。例如,可使用powell m和newman m编写的《vaccinedesign,the subunit and adiuvant approach》(plenum press,1995)第 147页描述的spt乳剂及第183页描述的mf59乳剂。术语“丙烯酸 或甲基丙烯酸的聚合物”优选为交联的丙烯酸或甲基丙烯酸聚合物, 尤其是与糖(sugar)的聚链烯基醚或聚醇交联,这些化合物已知被称 为卡波姆(carbomer,商品名carbopol)(phameuropa,1996,8(2))。 本领域技术人员还可参见美国专利us2909462,其描述了这类丙烯酸 聚合物,其与聚羟基化的化合物交联,所述化合物具有至少3个羟基, 优选不超过8个,其中至少3个羟基的氢原子被具有至少2个碳原子 的不饱和脂烃基(aliphatic radical)取代。优选的基团是那些含有2-4 个碳原子的基团,例如乙烯基、烯丙基和其它烯属不饱和基团 (ethylenically unsaturated group)。所述不饱和基团自身可包含其它 取代基,如甲基。这些产品以卡波普的名义出售,(bf goodrich,ohio, usa)特别合适。它们
与烯丙基蔗糖或与烯丙基季戊四醇(allylpentaerythritol)交联。这其中可提及卡波普974p、934p和971p,最 优选使用卡波普971p。术语“顺丁烯二酸酐和链烯基衍生物的共聚物
”ꢀ
也可考虑顺丁烯二酸酐与乙烯的共聚物ema(monsanto),这些聚 合物在水中溶解产生酸性溶液,经中和,优选中和至生理ph,以便 产生佐剂溶液,能向其中掺入免疫原性、致免疫性或疫苗性组合物本 身。术语“佐剂”还包括,但不限于,ribi佐剂系统(ribi incorporation)、 block co-polymer(cytrx,atlanta ga)、saf-m(chiron,emeryvilleca)、单磷酰脂质a(monophosphoryl lipid a)、avridine脂质-胺 佐剂、大肠杆菌不耐热肠毒素(重组或其它)、霍乱毒素、ims 1314、 胞壁酰二肽、gel佐剂等。优选地,所述佐剂包括矿物油、铝胶佐剂、 皂苷、油包水乳剂、水包油乳剂、水包油包水乳剂、丙烯酸或甲基丙 烯酸的聚合物、顺丁烯二酸酐和链烯基(alkenyl)衍生物的共聚物、 ribi佐剂系统、block co-polymer、saf-m、单磷酰脂质a、avridine 脂质-胺佐剂、大肠杆菌不耐热肠毒素、霍乱毒素、ims 1314、胞壁 酰二肽、montanide isa 206或gel佐剂中的一种或几种。
27.术语“冻干保护剂”是指是除赋形剂外,给予药物有效成分在冷 冻干燥过程及冻干后储存阶段保护药物药效的成分。
28.术语“剂型”是指药物制剂的形态。也指根据药物性质,以及治 病和处方的要求制成的药剂(成品药)。合适的剂型是为了发挥药物 的最佳疗效,减少毒副作用,以及便于使用、贮存和运输。
29.术语“注射剂(injection)”是指药物制成的供注入体内的无菌溶 液(包括乳浊液和混悬液)以及供临用前配成溶液或混悬液的无菌粉 末或浓溶液,可以是注射水针剂(溶媒为水)、注射油针剂(溶媒为油); 尚有用其它溶媒的注射剂,如乙醇(氢化可的松注射液的溶媒就是乙 醇)、甘油、丙二醇(peg)等。
30.术语“注射用粉末”是指在无菌环境下将药液冷冻,将原料药“掺
”ꢀ
在某些辅料或溶在某些溶媒中,经过一定的加工处理制成不同形式的 制剂。术语“预防”在涉及非洲猪瘟病毒感染时是指抑制非洲猪瘟病毒 的复制、抑制非洲猪瘟病毒的传播或防止非洲猪瘟病毒在其宿主体内 定居,以及减轻非洲猪瘟病毒感染的疾病或病症的症状。
31.发明详述
32.本发明提供了一种非洲猪瘟病毒亚单位疫苗组合物,其中,所述 非洲猪瘟病毒亚单位疫苗组合物的蛋白抗原由非洲猪瘟病毒p34、p14、c129r、dp96r、a104r、p54、p17、p22、p72、p30蛋白组成, 所述非洲猪瘟病毒亚单位疫苗组合物还包括药学上可接受的载体;其 中,所述非洲猪瘟病毒p34蛋白为seq id no.1或其简并序列编码; 所述非洲猪瘟病毒p14蛋白为seq id no.2或其简并序列编码;所述 非洲猪瘟病毒c129r蛋白为seq id no.3或其简并序列编码;所述 非洲猪瘟病毒dp96r蛋白为seq id no.4或其简并序列编码;所述 非洲猪瘟病毒a104r蛋白为seq id no.5或其简并序列编码;所述 非洲猪瘟病毒p54蛋白为seq id no.6或其简并序列编码;所述非洲 猪瘟病毒p17蛋白为seq id no.7或其简并序列编码;所述非洲猪瘟 病毒p22蛋白为seq id no.8或其简并序列编码;所述非洲猪瘟病毒 p72蛋白为seq id no.9或其简并序列编码;以及所述非洲猪瘟病毒 p30蛋白为seq id no.10或其简并序列编码。
33.根据较佳的实施方式,所述非洲猪瘟病毒p34蛋白为seq idno.1编码;所述非洲猪瘟病毒p14蛋白为seq id no.2编码;所述 非洲猪瘟病毒c129r蛋白为seq id no.3编码;
所述非洲猪瘟病毒 dp96r蛋白为seq id no.4编码;所述非洲猪瘟病毒a104r蛋白为 seq id no.5编码;所述非洲猪瘟病毒p54蛋白为seq id no.6编码; 所述非洲猪瘟病毒p17蛋白为seq id no.7编码;所述非洲猪瘟病毒 p22蛋白为seq id no.8编码;所述非洲猪瘟病毒p72蛋白为seq idno.9编码;以及所述非洲猪瘟病毒p30蛋白为seq id no.10编码。
34.根据较佳的实施方式,本领域技术人员可以根据常规技术知识, 选择编码所述非洲猪瘟病毒p34、p14、c129r、dp96r、a104r、p54、 p17、p22、p72、p30蛋白的其他的简并序列。其他简并序列可以根 据具体表达体系的偏爱密码子选择。
35.根据较佳的实施方式,所述非洲猪瘟病毒p34、p14、c129r、 dp96r、a104r、p54蛋白为大肠杆菌表达系统表达,其编码序列根 据大肠杆菌表达系统的偏爱密码子选择。根据较佳的实施方式,所述 非洲猪瘟病毒p17、p22、p72、p30蛋白为sf9昆虫细胞表达系统表达, 其编码序列根据sf9昆虫细胞表达系统的偏爱密码子选择。
36.根据较佳的实施方式,所述非洲猪瘟病毒亚单位疫苗组合物的剂 型选自溶液型注射剂、混悬型注射剂、注射用粉末、缓释微球制剂、 控释微球制剂、缓控释植入剂。
37.根据较佳的实施方式,所述非洲猪瘟病毒亚单位疫苗组合物的剂 型为溶液型注射剂、混悬型注射剂、或注射用粉末。
38.根据较佳的实施方式,所述非洲猪瘟病毒亚单位疫苗组合物的给 药方式选自皮下注射给药、口服给药、口腔给药、舌下给药、鼻腔给 药、肺部给药、结肠给药、直肠给药、透皮给药。根据更佳的实施方 式,所述非洲猪瘟病毒亚单位疫苗组合物的给药方式为皮下注射给 药。
39.根据较佳的实施方式,所述非洲猪瘟病毒亚单位疫苗组合物的剂 型为溶液型注射剂、混悬型注射剂;所述非洲猪瘟病毒p34蛋白含量 为≥8μg/ml;所述非洲猪瘟病毒p14蛋白含量为≥8μg/ml;所述非洲 猪瘟病毒c129r蛋白含量为≥8μg/ml;所述非洲猪瘟病毒dp96r蛋 白含量为≥8μg/ml;所述非洲猪瘟病毒a104r蛋白含量为≥8μg/ml; 所述非洲猪瘟病毒p54蛋白含量为≥12μg/ml;所述非洲猪瘟病毒p17 蛋白含量为≥12μg/ml;所述非洲猪瘟病毒p22蛋白含量为≥12μg/ml; 所述非洲猪瘟病毒p72蛋白含量为≥12μg/ml;所述非洲猪瘟病毒p30 蛋白含量为≥12μg/ml。
40.根据较佳的实施方式,所述非洲猪瘟病毒p34蛋白含量为8~24 μg/ml;所述非洲猪瘟病毒p14蛋白含量为8~24μg/ml;所述非洲猪 瘟病毒c129r蛋白含量为8~24μg/ml;所述非洲猪瘟病毒dp96r蛋 白含量为8~24μg/ml;所述非洲猪瘟病毒a104r蛋白含量为8~24μ g/ml;所述非洲猪瘟病毒p54蛋白含量为12~36μg/ml;所述非洲猪 瘟病毒p17蛋白含量为12~36μg/ml;所述非洲猪瘟病毒p22蛋白含 量为12~36μg/ml;所述非洲猪瘟病毒p72蛋白含量为12~36μg/ml; 所述非洲猪瘟病毒p30蛋白含量为12~36μg/ml。
41.根据较佳的实施方式,所述非洲猪瘟病毒p34蛋白含量选自 8μg/ml、9μg/ml、10μg/ml、11μg/ml、12μg/ml、13μg/ml、14μg/ml、15μg/ml、16μg/ml、17μg/ml、18μg/ml、19μg/ml、20μg/ml、21μg/ml、 22μg/ml、23μg/ml、24μg/ml。所述非洲猪瘟病毒p14蛋白含量选自 8μg/ml、9μg/ml、10μg/ml、11μg/ml、12μg/ml、13μg/ml、14μg/ml、 15μg/ml、16μg/ml、17μg/ml、18μg/ml、19μg/ml、20μg/ml、21μg/ml、 22μg/ml、23μg/ml、或24μg/ml。所述非洲猪瘟病毒c129r蛋白含量 选自8μg/ml、9μg/ml、10μg/ml、11μg/ml、12μg/ml、13μg/ml、14μg/ml、 15μg/ml、16μg/ml、17μg/ml、18μg/ml、19μg/ml、20μg/ml、21μg/ml、 22μg/ml、23μg/ml、或24μg/
ml。所述非洲猪瘟病毒dp96r蛋白含量 选自8μg/ml、9μg/ml、10μg/ml、11μg/ml、12μg/ml、13μg/ml、14μg/ml、 15μg/ml、16μg/ml、17μg/ml、18μg/ml、19μg/ml、20μg/ml、21μg/ml、 22μg/ml、23μg/ml、24μg/ml。所述非洲猪瘟病毒a104r蛋白含量选 自8μg/ml、9μg/ml、10μg/ml、11μg/ml、12μg/ml、13μg/ml、14μg/ml、 15μg/ml、16μg/ml、17μg/ml、18μg/ml、19μg/ml、20μg/ml、21μg/ml、 22μg/ml、23μg/ml、24μg/ml。所述非洲猪瘟病毒p54蛋白含量选自 12μg/ml、13μg/ml、14μg/ml、15μg/ml、16μg/ml、17μg/ml、18μg/ml、 19μg/ml、20μg/ml、21μg/ml、22μg/ml、23μg/ml、24μg/ml、25μg/ml、 26μg/ml、27μg/ml、28μg/ml、29μg/ml、30μg/ml、31μg/ml、32μg/ml、 33μg/ml、34μg/ml、35μg/ml、36μg/ml。所述非洲猪瘟病毒p17蛋白 含量选自12μg/ml、13μg/ml、14μg/ml、15μg/ml、16μg/ml、17μg/ml、 18μg/ml、19μg/ml、20μg/ml、21μg/ml、22μg/ml、23μg/ml、24μg/ml、 25μg/ml、26μg/ml、27μg/ml、28μg/ml、29μg/ml、30μg/ml、31μg/ml、 32μg/ml、33μg/ml、34μg/ml、35μg/ml、36μg/ml。所述非洲猪瘟病毒 p22蛋白含量选自12μg/ml、13μg/ml、14μg/ml、15μg/ml、16μg/ml、 17μg/ml、18μg/ml、19μg/ml、20μg/ml、21μg/ml、22μg/ml、23μg/ml、 24μg/ml、25μg/ml、26μg/ml、27μg/ml、28μg/ml、29μg/ml、30μg/ml、 31μg/ml、32μg/ml、33μg/ml、34μg/ml、35μg/ml、或36μg/ml。所述 非洲猪瘟病毒p72蛋白含量选自12μg/ml、13μg/ml、14μg/ml、15μg/ml、 16μg/ml、17μg/ml、18μg/ml、19μg/ml、20μg/ml、21μg/ml、22μg/ml、 23μg/ml、24μg/ml、25μg/ml、26μg/ml、27μg/ml、28μg/ml、29μg/ml、30μg/ml、31μg/ml、32μg/ml、33μg/ml、34μg/ml、35μg/ml、或36μg/ml。 所述非洲猪瘟病毒p30蛋白含量选自12μg/ml、13μg/ml、14μg/ml、 15μg/ml、16μg/ml、17μg/ml、18μg/ml、19μg/ml、20μg/ml、21μg/ml、 22μg/ml、23μg/ml、24μg/ml、25μg/ml、26μg/ml、27μg/ml、28μg/ml、 29μg/ml、30μg/ml、31μg/ml、32μg/ml、33μg/ml、34μg/ml、35μg/ml、 或36μg/ml。
42.根据较佳的实施方式,所述非洲猪瘟病毒p34蛋白含量为8~16 μg/ml;所述非洲猪瘟病毒p14蛋白含量为8~16μg/ml;所述非洲猪 瘟病毒c129r蛋白含量为8~16μg/ml;所述非洲猪瘟病毒dp96r蛋 白含量为8~16μg/ml;所述非洲猪瘟病毒a104r蛋白含量为8~16μ g/ml;所述非洲猪瘟病毒p54蛋白含量为12~24μg/ml;所述非洲猪 瘟病毒p17蛋白含量为12~24μg/ml;所述非洲猪瘟病毒p22蛋白含 量为12~24μg/ml;所述非洲猪瘟病毒p72蛋白含量为12~24μg/ml; 所述非洲猪瘟病毒p30蛋白含量为12~24μg/ml。
43.根据较佳的实施方式,所述非洲猪瘟病毒p34蛋白、p14蛋白、 c129r蛋白、dp96r蛋白、a104r蛋白、p54蛋白、p17蛋白、p22 蛋白、和p30蛋白均选择较低含量,即便非洲猪瘟病毒蛋白抗原总用 量较单一组分抗原用量降低,也能获得更高的抗体滴度,保证更好的 免疫效果。
44.根据较佳的实施方式,所述非洲猪瘟病毒p34蛋白含量为8μ g/ml;所述非洲猪瘟病毒p14蛋白含量为8μg/ml;所述非洲猪瘟病 毒c129r蛋白含量为8μg/ml;所述非洲猪瘟病毒dp96r蛋白含量 为8μg/ml;所述非洲猪瘟病毒a104r蛋白含量为8μg/ml;所述非 洲猪瘟病毒p54蛋白含量为12μg/ml;所述非洲猪瘟病毒p17蛋白含 量为12μg/ml;所述非洲猪瘟病毒p22蛋白含量为12μg/ml;所述非 洲猪瘟病毒p72蛋白含量为12μg/ml;所述非洲猪瘟病毒p30蛋白含 量为12μg/ml。
45.根据较佳的实施方式,所述非洲猪瘟病毒p34蛋白含量为16μ g/ml;所述非洲猪瘟病毒p14蛋白含量为16μg/ml;所述非洲猪瘟病 毒c129r蛋白含量为16μg/ml;所述非洲猪瘟
病毒dp96r蛋白含量 为16μg/ml;所述非洲猪瘟病毒a104r蛋白含量为16μg/ml;所述 非洲猪瘟病毒p54蛋白含量为24μg/ml;所述非洲猪瘟病毒p17蛋白 含量为24μg/ml;所述非洲猪瘟病毒p22蛋白含量为24μg/ml;所述 非洲猪瘟病毒p72蛋白含量为24μg/ml;所述非洲猪瘟病毒p30蛋白 含量为24μg/ml。
46.根据较佳的实施方式,本发明所述的非洲猪瘟病毒亚单位疫苗组 合物中,所述非洲猪瘟病毒蛋白抗原含量为100-300μg/ml。
47.非洲猪瘟病毒蛋白含量可选自100μg/ml、110μg/ml、120μg/ml、 130μg/ml、140μg/ml、150μg/ml、160μg/ml、170μg/ml、180μg/ml、 190μg/ml、200μg/ml、210μg/ml、220μg/ml、230μg/ml、240μg/ml、 250μg/ml、260μg/ml、270μg/ml、280μg/ml、290μg/ml、300μg/ml。
48.根据较佳的实施方式,所述药学上可接受的载体包括佐剂,所述 佐剂包括:(1)矿物油、铝胶佐剂、皂苷、阿夫立定、dda;(2) 油包水乳剂、水包油乳剂、水包油包水乳剂;或(3)丙烯酸或甲基 丙烯酸的聚合物、顺丁烯二酸酐和链烯基衍生物的共聚物;以及ribi 佐剂系统、block co-polymer、saf-m、单磷酰脂质a、avridine脂质
ꢀ‑
胺佐剂、大肠杆菌不耐热肠毒素、霍乱毒素、ims 1314、胞壁酰二 肽、montanide isa 206、gel佐剂中的一种或几种;优选地,皂苷为 quil a、qs-21、gpi-0100;所述佐剂含量为5%-60%v/v,优选从 30%-60%v/v,更优选50%v/v。
49.根据较佳的实施方式,所述佐剂为montanide isa 206佐剂,所述 佐剂含量为50%v/v。
50.根据较佳的实施方式,所述药学上可接受的载体包括冻干保护 剂,所述冻干保护剂选自糖、多元醇、聚合物、表面活性剂、盐、胺、 或氨基酸。
51.根据较佳的实施方式,所述的药学上可接受的载体包括药物、免 疫刺激剂、抗氧化剂、表面活性剂、着色剂、挥发性油、缓冲剂、分 散剂、推进剂和防腐剂;所述免疫刺激剂包括α-干扰素、β-干扰素、 γ-干扰素、粒细胞巨噬细胞集落刺激因子(gm-csf)、巨噬细胞集 落刺激因子(m-csf)和白介素2(il2)。
52.为了制备这样的组合物,可以使用本领域公知的方法。
53.本发明还提供了所述的非洲猪瘟病毒亚单位疫苗组合物的应用, 其中,所述应用是指在制备预防非洲猪瘟病毒感染的药物中的应用。 根据较佳的实施方式,所述的非洲猪瘟病毒亚单位疫苗组合物能发挥 协同增效的免疫保护作用,对猪有更好的免疫效果。
54.本发明还提供一种非洲猪瘟病毒蛋白的制备方法,所述方法包 括:
55.(1)人工合成所述非洲猪瘟病毒蛋白基因,通过基因工程手段 连接至克隆载体即蛋白的克隆载体;
56.(2)将构建的所述蛋白的克隆载体以及表达载体通过酶切,构 建包含蛋白基因的表达载体即蛋白的表达载体;
57.(3)将所述蛋白的表达载体导入受体菌进行诱导表达,并对表 达的蛋白进行鉴定以获得非洲猪瘟病毒蛋白。
58.作为本发明的一种实施方式,本发明所述的非洲猪瘟病毒蛋白可 通过原核表达系统来制备,也可通过真核表达系统或化学合成方法来 制备。
59.根据较佳的实施方式,所述非洲猪瘟病毒p34、p14、c129r、 dp96r、a104r、p54蛋白基因的表达载体为大肠杆菌表达系统克隆 载体。
60.根据较佳的实施方式,所述非洲猪瘟病毒p17、p22、p72、p30 蛋白基因的表达载体为sf9昆虫细胞表达系统表达载体。本发明还提 供一种含有所述非洲猪瘟病毒蛋白的基因序列的表达载体。
61.根据较佳的实施方式,所述非洲猪瘟病毒p34、p14、c129r、 dp96r、a104r、p54蛋白基因的表达载体为大肠杆菌表达系统克隆 载体。
62.根据较佳的实施方式,所述非洲猪瘟病毒p17、p22、p72、p30 蛋白基因的表达载体为sf9昆虫细胞表达系统表达载体。
63.本发明还提供了非洲猪瘟病毒蛋白抗原的组合,其中,所述非洲 猪瘟病毒蛋白抗原由非洲猪瘟病毒p34、p14、c129r、dp96r、a104r、 p54、p17、p22、p72、p30蛋白组成;其中,所述非洲猪瘟病毒p34 蛋白为seq id no.1或其简并序列编码;所述非洲猪瘟病毒p14蛋白 为seq id no.2或其简并序列编码;所述非洲猪瘟病毒c129r蛋白 为seq id no.3或其简并序列编码;所述非洲猪瘟病毒dp96r蛋白 为seq id no.4或其简并序列编码;所述非洲猪瘟病毒a104r蛋白 为seq id no.5或其简并序列编码;所述非洲猪瘟病毒p54蛋白为 seq id no.6或其简并序列编码;所述非洲猪瘟病毒p17蛋白为seqid no.7或其简并序列编码;所述非洲猪瘟病毒p22蛋白为seq idno.8或其简并序列编码;所述非洲猪瘟病毒p72蛋白为seq id no.9 或其简并序列编码;以及所述非洲猪瘟病毒p30蛋白为seq id no.10 或其简并序列编码。
64.根据较佳的实施方式,本领域技术人员可以根据常规技术知识, 选择编码所述非洲猪瘟病毒p34、p14、c129r、dp96r、a104r、p54、 p17、p22、p72、p30蛋白的其他的简并序列。其他简并序列可以根 据具体表达体系的偏爱密码子选择。
65.根据较佳的实施方式,所述非洲猪瘟病毒p34、p14、c129r、 dp96r、a104r、p54蛋白为大肠杆菌表达系统表达,其编码序列根 据大肠杆菌表达系统的偏爱密码子选择。根据较佳的实施方式,所述 非洲猪瘟病毒p17、p22、p72、p30蛋白为sf9昆虫细胞表达系统表达, 其编码序列根据sf9昆虫细胞表达系统的偏爱密码子选择。
66.根据较佳的实施方式,所述非洲猪瘟病毒p34蛋白为seq idno.1编码;所述非洲猪瘟病毒p14蛋白为seq id no.2编码;所述 非洲猪瘟病毒c129r蛋白为seq id no.3编码;所述非洲猪瘟病毒 dp96r蛋白为seq id no.4编码;所述非洲猪瘟病毒a104r蛋白为 seq id no.5编码;所述非洲猪瘟病毒p54蛋白为seq id no.6编码; 所述非洲猪瘟病毒p17蛋白为seq id no.7编码;所述非洲猪瘟病毒 p22蛋白为seq id no.8编码;所述非洲猪瘟病毒p72蛋白为seq idno.9编码;以及所述非洲猪瘟病毒p30蛋白为seq id no.10编码。 根据较佳的实施方式,所述非洲猪瘟病毒蛋白抗原的组合还包括药学 上可接受的载体,所述药学上可接受的载体包括佐剂,所述佐剂包括: (1)矿物油、铝胶佐剂、皂苷、阿夫立定、dda;(2)油包水乳剂、 水包油乳剂、水包油包水乳剂;或(3)丙烯酸或甲基丙烯酸的聚合 物、顺丁烯二酸酐和链烯基衍生物的共聚物;以及ribi佐剂系统、 block co-polymer、saf-m、单磷酰脂质a、avridine脂质-胺佐剂、 大肠杆菌不耐热肠毒素、霍乱毒素、ims 1314、胞壁酰二肽、montanideisa 206、gel佐剂中的一种或几种;优选地,皂苷为quil a、qs-21、 gpi-0100;所述佐剂含量为5%-60%v/v,优选从30%-60%v/v,更 优选50%v/v。
67.根据较佳的实施方式,所述佐剂为montanide isa 206佐剂,所述 佐剂含量为50%v/v。
68.根据较佳的实施方式,所述药学上可接受的载体包括冻干保护 剂,所述冻干保护剂选自糖、多元醇、聚合物、表面活性剂、盐、胺、 或氨基酸。
69.根据较佳的实施方式,所述非洲猪瘟病毒p34、p14、c129r、 dp96r、a104r、p54、p17、p22、p72、p30蛋白的剂型选自溶液型 注射剂、混悬型注射剂、注射用粉末、缓释微球制剂、控释微球制剂、 缓控释植入剂。
70.根据较佳的实施方式,所述非洲猪瘟病毒p34、p14、c129r、 dp96r、a104r、p54、p17、p22、p72、p30蛋白的剂型选自溶液型 注射剂、混悬型注射剂、注射用粉末、缓释微球制剂、控释微球制剂、 缓控释植入剂。
71.根据较佳的实施方式,所述非洲猪瘟病毒p34、p14、c129r、 dp96r、a104r、p54、p17、p22、p72、p30蛋白的剂型为溶液型注 射剂、混悬型注射剂、或注射用粉末。
72.根据较佳的实施方式,所述非洲猪瘟病毒蛋白抗原的组合的给药 方式选自皮下注射给药、口服给药、口腔给药、舌下给药、鼻腔给药、 肺部给药、结肠给药、直肠给药、透皮给药。根据更佳的实施方式, 所述非洲猪瘟病毒蛋白抗原的组合的给药方式为皮下注射给药。
73.根据较佳的实施方式,所述非洲猪瘟病毒p34、p14、c129r、 dp96r、a104r、p54、p17、p22、p72、p30蛋白的剂型为溶液型注 射剂、或混悬型注射剂;所述非洲猪瘟病毒p34蛋白含量为≥8μg/ml; 所述非洲猪瘟病毒p14蛋白含量为≥8μg/ml;所述非洲猪瘟病毒 c129r蛋白含量为≥8μg/ml;所述非洲猪瘟病毒dp96r蛋白含量为 ≥8μg/ml;所述非洲猪瘟病毒a104r蛋白含量为≥8μg/ml;所述非洲 猪瘟病毒p54蛋白含量为≥12μg/ml;所述非洲猪瘟病毒p17蛋白含 量为≥12μg/ml;所述非洲猪瘟病毒p22蛋白含量为≥12μg/ml;所述 非洲猪瘟病毒p72蛋白含量为≥12μg/ml;所述非洲猪瘟病毒p30蛋 白含量为≥12μg/ml。
74.根据较佳的实施方式,所述非洲猪瘟病毒p34蛋白含量为 8~24μg/ml;所述非洲猪瘟病毒p14蛋白含量为8~24μg/ml;所述非洲 猪瘟病毒c129r蛋白含量为8~24μg/ml;所述非洲猪瘟病毒dp96r 蛋白含量为8~24μg/ml;所述非洲猪瘟病毒a104r蛋白含量为 8~24μg/ml;所述非洲猪瘟病毒p54蛋白含量为12~36μg/ml;所述非 洲猪瘟病毒p17蛋白含量为12~36μg/ml;所述非洲猪瘟病毒p22蛋白 含量为12~36μg/ml;所述非洲猪瘟病毒p72蛋白含量为12~36μg/ml; 所述非洲猪瘟病毒p30蛋白含量为12~36μg/ml。
75.根据较佳的实施方式,所述非洲猪瘟病毒p34蛋白含量为8~16 μg/ml;所述非洲猪瘟病毒p14蛋白含量为8~16μg/ml;所述非洲猪 瘟病毒c129r蛋白含量为8~16μg/ml;所述非洲猪瘟病毒dp96r蛋 白含量为8~16μg/ml;所述非洲猪瘟病毒a104r蛋白含量为8~16μ g/ml;所述非洲猪瘟病毒p54蛋白含量为12~24μg/ml;所述非洲猪 瘟病毒p17蛋白含量为12~24μg/ml;所述非洲猪瘟病毒p22蛋白含 量为12~24μg/ml;所述非洲猪瘟病毒p72蛋白含量为12~24μg/ml; 所述非洲猪瘟病毒p30蛋白含量为12~24μg/ml。
76.根据较佳的实施方式,所述非洲猪瘟病毒p34蛋白、p14蛋白、c129r蛋白、dp96r蛋白、a104r蛋白、p54蛋白、p17蛋白、p22 蛋白、和p30蛋白均选择较低的含量,即便非洲猪瘟病毒蛋白抗原总 用量较单一组分抗原用量降低,也能获得更高的抗体滴度,保证更好 的免疫效果。作为本发明的最优选的实施方式,所述非洲猪瘟病毒p34 蛋白含量为8μg/ml;所述非洲猪瘟病毒p14蛋白含量为8μg/ml;所述 非洲猪瘟病毒c129r蛋白含量为8μg/ml;所述非洲猪瘟病毒dp96r 蛋白含量为8μg/ml;所述非洲猪瘟病毒a104r蛋白含量为8μg/ml; 所
述非洲猪瘟病毒p54蛋白含量为12μg/ml;所述非洲猪瘟病毒p17 蛋白含量为12μg/ml;所述非洲猪瘟病毒p22蛋白含量为12μg/ml;所 述非洲猪瘟病毒p72蛋白含量为12μg/ml;所述非洲猪瘟病毒p30蛋 白含量为12μg/ml。
77.作为本发明的最优选的实施方式,所述非洲猪瘟病毒p34蛋白含 量为16μg/ml;所述非洲猪瘟病毒p14蛋白含量为16μg/ml;所述非洲 猪瘟病毒c129r蛋白含量为16μg/ml;所述非洲猪瘟病毒dp96r蛋 白含量为16μg/ml;所述非洲猪瘟病毒a104r蛋白含量为16μg/ml; 所述非洲猪瘟病毒p54蛋白含量为24μg/ml;所述非洲猪瘟病毒p17 蛋白含量为24μg/ml;所述非洲猪瘟病毒p22蛋白含量为24μg/ml;所 述非洲猪瘟病毒p72蛋白含量为24μg/ml;所述非洲猪瘟病毒p30蛋 白含量为24μg/ml。
78.本发明还提供了所述的非洲猪瘟病毒蛋白抗原的组合的应用,其 中,所述应用是指在制备预防非洲猪瘟病毒感染的药物中的应用。
79.根据较佳的实施方式,所述的非洲猪瘟病毒抗原的组合能发挥协 同增效的免疫保护作用,对猪有更好的免疫效果。
80.下面结合具体实施例来进一步描述本发明,本发明的优点和特点 将会随着描述更为清楚。但这些实施例仅是范例性的,并不对本发明 的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发 明的精神和范围下可以对本发明技术方案的细节和形式进行修改或 替换,但这些修改和替换均落入本发明的保护范围内。
81.本发明实施例中所用到的化学试剂均为分析纯,购自国药集团。 本发明所述的实验方法,若无特殊说明,均为常规方法;所述的生物 材料,若无特殊说明,均可从商业途径获得。
82.实施例1非洲猪瘟病毒p34、p14、c129r、dp96r、a104r、p54 蛋白的原核表达
83.由苏州金唯智生物科技有限公司合成相应编码序列表seq idno.11所示表达载体的核苷酸序列,命名为pnvc1载体。
84.由苏州金唯智生物科技有限公司合成相应编码序列表seq idno.1~seq id no.6所示p34、p14、c129r、dp96r、a104r、p54 蛋白的核苷酸序列,并将合成的核苷酸克隆到pnvc1载体上,命名 为重组质粒pnvc1-p34、pnvc1-p14、pnvc1-c129r、pnvc1-dp96r、 pnvc1-a104r、pnvc1-p54。
85.分别将上述重组质粒pnvc1-p34、pnvc1-p14、pnvc1-c129r、 pnvc1-dp96r、pnvc1-a104r、pnvc1-p54转化感受态大肠杆菌 bl21(de3),构建表达菌株,接种卡那霉素抗性的50ml lb液体培 养基,37℃,230转/分振荡培养12小时后,转接入1l lb液体培养 基中,37℃培养,制备发酵用种子液。
86.使用发酵罐为上海保兴生物公司50l发酵罐,配制30l培养基装 入发酵罐,121℃灭菌30分钟。第二天将3l种子液接入发酵罐,培 养菌液浓度达到od600大约10左右时将培养温度降至25℃,加入 iptg至终浓度为0.5mm诱导培养12小时。发酵密度大约为40左右 (od600)停止培养,离心收集菌体。
87.重悬菌体,采用均质机以800bar压力破碎菌体3次。13500rpm, 离心40min,留取上清,通过12%sds-page电泳检测。采用硫酸铵 分级沉淀法进行蛋白粗纯,随后进行色谱纯化,纯化后的蛋白经 sds-page电泳,显示目的蛋白均得到了纯化和富集。
88.实施例2非洲猪瘟病毒p17、p22、p72、p30蛋白的真核表达
89.由苏州金唯智生物科技有限公司合成相应编码序列表seq idno.7~seq id no.10所示p17、p22、p72、p30蛋白的核苷酸序列,并 将合成的核苷酸克隆到pfb载体上,命名为重组质粒pfb-p17、 pfb-p22、pfb-p72、pfb-p30。
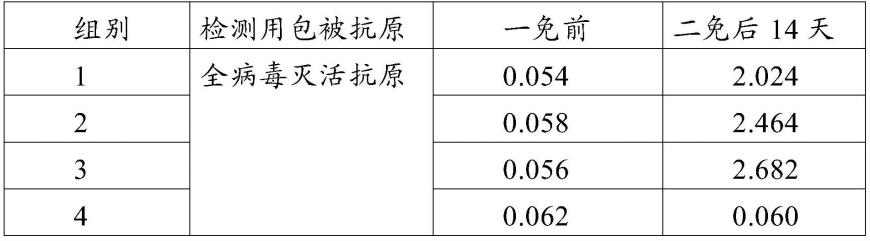
90.分别将上述重组质粒pfb-p17、pfb-p22、pfb-p72、pfb-p30转 化到dh10bac感受态细胞中,经蓝白斑筛选,挑取白色单一菌落至 含卡那、四环素、庆大霉素三种抗性的液体lb培养基中摇菌过夜, 按bac-to-bac操作说明上的方法提取重组bacmid,分别命名为 bac-p17、bac-p22、bac-p72、bac-p30。
91.参考cellfectinⅱreagent转染试剂盒操作说明,将重组bacmidbac-p17、bac-p22、bac-p72、bac-p30转染sf9昆虫细胞,置于27℃ 恒温培养箱培养大约72h,细胞病变明显后,收获细胞上清,为p1 代重组杆状病毒,分别标记为rbac-p17、rbac-p22、rbac-p72、rbac-p30。 将p1代重组杆状病毒按1:20~1:40的体积比加入sf9的细胞摇瓶中, 27℃继续培养,直到72h左右细胞病变明显时,收获上清标记为p2 代重组杆状病毒。取p2代重组杆状病毒按照1:100的体积比接种1l 体积sf9细胞,接种48h-72h收获细胞,1000
×
g离心10min收集感 染细胞。
92.用细胞裂解液(25mm nahco3,ph 8.3)裂解细胞沉淀30分钟, 10000
×
g,4℃离心10min获得裂解上清,通过western blot确认目的 蛋白得到表达。用镍柱亲和层析进行蛋白粗纯,随后进行分子筛纯化, 纯化后的蛋白经sds-page电泳,显示目的蛋白均得到了纯化和富 集。
93.实施例3非洲猪瘟病毒亚单位疫苗组合物的制备
94.将实施例1制备得到的p34、p14、c129r、dp96r、a104r、p54 蛋白,实施例2制备得到的p17、p22、p72、p30蛋白加入到佐剂中, 加的过程不断用转速为800rpm乳化机搅拌12min,混匀,4℃保存, 即为含有非洲猪瘟病毒多组分蛋白抗原的亚单位疫苗组合物。适用于 本发明的佐剂可以为本领域技术人员公知的佐剂。在本发明中,选用 佐剂为双相佐剂(水包油包水乳剂),例如可以是佐剂isa 206(法 国赛比克公司)。制备的疫苗中各组分的具体配比见表1。
95.表1本发明非洲猪瘟病毒亚单位疫苗组合物成分配比
96.组分疫苗1疫苗2疫苗3p34(μg/ml)81624p14(μg/ml)81624c129r(μg/ml)81624dp96r(μg/ml)81624a104r(μg/ml)81624p54(μg/ml)122436p17(μg/ml)122436p22(μg/ml)122436p72(μg/ml)122436p30(μg/ml)122436isa 206双相佐剂(v/v%)50%50%50%
97.实施例4非洲猪瘟病毒亚单位疫苗组合物免疫原性试验
98.取非洲猪瘟病毒抗原、抗体均为阴性的体重20kg左右的健康易 感仔猪20头,随机分为4组,每组5头。第1组免疫疫苗1,第2 组免疫疫苗2,第3组免疫疫苗3,第4组为空白对照组。免疫组免 疫途径为颈部肌肉注射2ml,对照组免疫等量的pbs+佐剂。免疫两 次,间隔14天。第1次免疫前及第2次免疫后14天采血。
99.用非洲猪瘟全病毒灭活抗原(购自欧洲联盟非洲猪瘟参考实验室 (european union reference laboratory for africanswine fever,url-asf))包被酶标板,4℃包被过夜;弃包被液, 用洗涤液洗涤后;加入封闭液(称取蔗糖50g,加入200ml新生牛血 清、1ml proclin300,补加pbs(0.01mol/l,ph值7.4)定容至1000ml), 2-8℃封闭16-24小时,弃去封闭液后干燥,密封后于2-8℃保存备用。
100.样品稀释液:取氯化钠8g、磷酸氢二钠2.9g、磷酸二氢钾0.24g、 氯化钾0.2g、纯化水600ml、proclin300 1ml、新生牛血清200ml、 pur染料0.028g,完全溶解后用纯化水定容至1000ml,混匀后0.22μm 过滤后无菌分装,2-8℃保存。
101.洗涤液:取氯化钠160g、磷酸氢二钠58g、磷酸二氢钾4.8g、氯 化钾4g、超纯水800ml、吐温20 10ml,完全溶解后用纯化水定容至 1000ml,用0.22μm滤膜过滤,无菌分装。使用时用蒸馏水稀释20 倍。
102.二抗:酶标的羊抗猪二抗,使用时进行1:2000稀释。
103.显色液:取磷酸氢二钠14.7g、柠檬酸9.3g、过氧化脲0.3g,溶 于纯化水,定容至1000ml,混匀、过滤后无菌分装,为显色剂a。 取四甲基联苯二胺(tmb)0.2g、无水乙醇10ml,溶于纯化水定容 至1000ml,混匀、过滤后无菌分装,为显色剂b。
104.终止液:2m h2so4。
105.检测时在酶标反应孔中先加入90μl样品稀释液,然后加入10μl 待检血清,阴性、阳性对照,37℃温育30分钟,用洗涤液洗板三次, 羊抗猪酶标抗体100μl/孔加入反应板,37℃温育30分钟,用洗涤液 洗板三次,加入显色剂a、显色剂b各50μl/孔,37℃显色10分钟, 加终止液50μl/孔终止反应,用酶标仪读取吸光度od
450nm
,根据判定 结果进行判定。
106.判定标准:od值≥0.19阳性,od值<0.19为阴性。
107.检测结果见表2。
108.表2非洲猪瘟病毒亚单位疫苗组合物免疫原性试验结果
[0109][0110]
结果显示,非洲猪瘟病毒亚单位疫苗组合物均具有良好的免疫原 性,抗体检测均为阳性。表明,本发明的非洲猪瘟病毒亚单位疫苗采 用多组分非洲猪瘟病毒蛋白抗原,免疫效果好。
[0111]
实施例5非洲猪瘟病毒蛋白免疫原性验证试验
[0112]
1.非洲猪瘟病毒单组分亚单位疫苗组合物的制备
[0113]
将实施例1制备得到的p34、p14、c129r、dp96r、a104r、p54 蛋白,实施例2制备得到的p17、p22、p72、p30蛋白分别加入到佐 剂中,加的过程不断用转速为800rpm乳化机搅拌12min,混匀,4℃ 保存,即为含有非洲猪瘟病毒单组分蛋白抗原的亚单位疫苗组合物。 适用于本发明的佐剂可以为本领域技术人员公知的佐剂。在本发明 中,选用佐剂为双相佐剂(水包油包水乳剂),例如可以是佐剂isa 206(法国赛比克公司)。制备的疫苗中各组分的具体配比见表3、表 4。
[0114]
表3非洲猪瘟病毒单组分亚单位疫苗组合物成分配比1
[0115][0116]
表4非洲猪瘟病毒单组分亚单位疫苗组合物成分配比2
[0117][0118]
2.非洲猪瘟病毒单组分亚单位疫苗组合物免疫原性试验
[0119]
取非洲猪瘟病毒抗原、抗体均为阴性的体重20kg左右的健康易 感仔猪55头,随机分为11组,每组5头。第5组-第14组分别免疫 疫苗4-疫苗13,第15组为空白对照组。免疫组免疫途径为颈部肌肉 注射2ml,对照组免疫等量的pbs+佐剂。免疫两次,间隔14天。第 1次免疫前及第2次免疫后14天采血。
[0120]
参照实施例4非洲猪瘟病毒抗体检测试剂盒制备方法,分别用非 洲猪瘟病毒p34蛋白、p14蛋白、c129r蛋白、dp96r蛋白、a104r 蛋白、p54蛋白、p17蛋白、p22蛋白、p72蛋白、p30蛋白包被酶标 板,制备非洲猪瘟病毒抗体检测试剂盒。
[0121]
检测结果见表5。
[0122]
表5非洲猪瘟病毒单组分亚单位疫苗组合物免疫原性试验结果1
[0123][0124]
表6非洲猪瘟病毒单组分亚单位疫苗组合物免疫原性试验结果2
[0125][0126]
表7非洲猪瘟病毒单组分亚单位疫苗组合物免疫原性试验结果3
[0127][0128]
表8非洲猪瘟病毒单组分亚单位疫苗组合物免疫原性试验结果4
[0129][0130]
表9非洲猪瘟病毒单组分亚单位疫苗组合物免疫原性试验结果5
[0131][0132]
表10非洲猪瘟病毒单组分亚单位疫苗组合物免疫原性试验结果6
[0133][0134]
表11非洲猪瘟病毒单组分亚单位疫苗组合物免疫原性试验结果7
[0135][0136]
表12非洲猪瘟病毒单组分亚单位疫苗组合物免疫原性试验结果8
[0137][0138]
表13非洲猪瘟病毒单组分亚单位疫苗组合物免疫原性试验结果9
[0139][0140]
表14非洲猪瘟病毒单组分亚单位疫苗组合物免疫原性试验结果10
[0141][0142]
结果显示,非洲猪瘟病毒单组分亚单位疫苗组合物均能引起不同 程度的免疫反应,抗体检测均为阳性。表明,本发明的非洲猪瘟病毒 亚单位疫苗采用的非洲猪瘟病毒蛋白抗原,均具有免疫原性,以此制 备的非洲猪瘟病毒多组分亚单位疫苗免疫效果更好,抗体水平更高。
[0143]
比较表2、表5~14中检测的od值,本发明非洲猪瘟病毒亚单位 疫苗组合物当抗原总用量(即免疫剂量2ml的本发明非洲猪瘟病毒亚 单位疫苗组合物中各抗原蛋白含量总和)仅为200μg(疫苗1)或400μg (疫苗2),其检测的od
400nm
值分别为2.024和2.464,而表5~14 中检测的非洲猪瘟病毒单组分亚单位疫苗组合物抗原用量(即免疫剂 量2ml的非洲猪瘟病毒单组分亚单位疫苗组合物中抗原蛋白含量)为 400μg,较疫苗1或疫苗2抗原总用量更高或相当,其检测的od
400nm
值均远小于疫苗1或疫苗2免疫后血清中抗体od
400nm
值,说明本发 明非洲猪瘟病毒亚单位疫苗组合物中各抗原组分之间产生了协同增 效作用,能产生更强的免疫反应,抗体滴度更高。
[0144]
以上所述仅是本发明的优选实施例而已,并非对本发明做任何形 式上的限制,虽然本发明已以优选实施例揭露如上,然而并非用以限 定本发明,任何熟悉本专业的技术人员,在不脱离本发明技术方案的 范围内,当可利用上述揭示的技术内容作出些许更动或修饰为等同变 化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明 的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均 仍属于本发明技术方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1