一种递送抗肿瘤药物的羧甲基壳聚糖纳米凝胶
1.本发明涉及一种纳米凝胶,具体涉及一种递送抗肿瘤药物的羧甲基壳聚糖纳米凝胶。
背景技术:
2.纳米微粒对肿瘤组织具有一定的靶向性,刺激响应性聚合物构筑的纳米粒子可用作新型的抗癌药物载体。然而真正实用的、能响应肿瘤细胞ph值(6.5
‑
7.2)的直接靶向肿瘤的释放体系目前还没有开发成功。其中智能材料的选择是制约该类体系发展的关键因素。一方面要求材料具有良好的生物相容性和可降解性;另一方面是对材料ph值响应的要求,因为肿瘤细胞与正常细胞的ph值相差极小,且在中性附近,使得这种超灵敏的ph敏感材料极难寻找。因此阻碍了酸敏材料用作肿瘤靶向载体的应用。
技术实现要素:
3.一方面,本发明提供了一种递送抗肿瘤药物的羧甲基壳聚糖纳米凝胶的制备,所述纳米凝胶的制备包括以下步骤:
4.1)甲基丙烯酸缩水甘油酯(gma)修饰的cmcs制备
5.将羧甲基壳聚糖cmcs加入去离子水中,搅拌至完全溶解后,过0.45μm微孔滤膜进行简单纯化,得到cmcs溶液;在cmcs溶液中分别滴加gma,磁力搅拌48h后用1.0m的盐酸溶液将反应液ph调节为7,装入透析袋(mwco:8~14kda)透析24h除去未反应的杂质,得到甲基丙烯酸缩水甘油酯修饰的羧甲基壳聚糖gcmcs;
6.2)二硫键交联的羧甲基壳聚糖纳米凝胶制备
7.取步骤1)中反应得到的30ml甲基丙烯酸缩水甘油酯修饰的羧甲基壳聚糖gcmcs透析保留液,加热至60℃,在n2保护下加入30mgn,n'双(丙烯酰)胱胺bac和6mg过硫酸钾kps持续反应3h,待冷却后加入透析袋(mwco:8~14kda)透析5天除去小分子杂质,产物冻干后得到二硫键交联的羧甲基壳聚糖纳米凝胶gcmcs
‑
ss;
8.3)叶酸修饰的羧甲基壳聚糖纳米凝胶制备
9.叶酸在二甲基亚砜(dmso)中完全超声溶解后,加入n
‑
羟基琥珀酰亚胺nhs,水溶性缩合剂edc
·
hcl和三乙胺搅拌30min后,再加入gcmcs
‑
ss水溶液(10ml,20mg/ml)在常温下反应24h后用氢氧化钠调节反应液ph至9,将反应液装入透析袋在磷酸盐缓冲液pbs(ph=7.4)中透析3天,再在去离子水中透析2天;透析保留液经冷冻干燥得到叶酸修饰的羧甲基壳聚糖纳米凝胶(gcmcs
‑
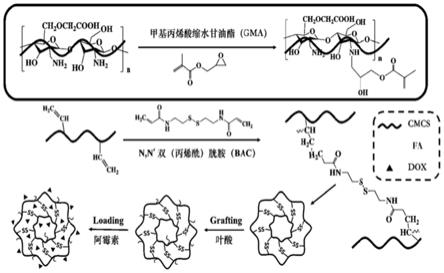
fa);
10.4)装载阿霉素的叶酸修饰羧甲基壳聚糖纳米载药凝胶制备
11.将阿霉素加入gcmcs
‑
fa水溶液(1mg/ml)中,搅拌4h后将溶液转移至透析袋(mwco:8~14kda)中透析24h,透析保留液经冷冻干燥得到负载阿霉素的叶酸修饰羧甲基壳聚糖纳米载药凝胶(gcmcs
‑
fa
‑
dox)。
12.作为优选,所述步骤1)中羧甲基壳聚糖与去离子水的重量体积g/ml比为1:200。
13.作为优选,所述步骤1)中羧甲基壳聚糖与甲基丙烯酸缩水甘油酯的重量体积比为2:3。
14.作为优选,所述步骤2)中bac与甲基丙烯酸缩水甘油酯修饰的羧甲基壳聚糖gcmcs的重量体积比mg/ml为1:1。
15.作为优选,所述步骤2)中bac与kps的重量比为1:1。
16.作为优选,所述步骤3)中叶酸与二甲基亚砜的重量体积比mg/ml为50:3。
17.作为优选,所述步骤3)中叶酸:n
‑
羟基琥珀酰亚胺:水溶性缩合剂edc
·
hcl为25:7:20;
18.所述水溶性缩合剂edc
·
hcl和三乙胺的重量体积比g/ml为2:15。
19.作为优选,所述步骤3)中叶酸与gcmcs
‑
ss溶液的重量体积比g/ml为1:40。
20.作为优选,所述步骤4)中阿霉素与gcmcs
‑
fa溶液的重量体积比mg/ml为1:4。
21.另一方面,本发明提供了一种根据上述方法制备得到的递送抗肿瘤药物的羧甲基壳聚糖纳米凝胶;本发明制备的纳米凝胶可以有效传递抗肿瘤药物,且可以提高肿瘤细胞对药物的摄取量。
22.本发明提供了一种递送抗肿瘤药物的羧甲基壳聚糖纳米凝胶,本发明采用甲基丙烯酸缩水甘油酯(gma)对cmcs进行改性,以含二硫键的n,n
‑
双(丙烯酰)半胱胺(bac)为交联剂将接枝上双键的gcmcs进行交联,再采用肿瘤主动靶向分子叶酸(fa)对其进行修饰,制备得到靶向纳米凝胶,用于抗肿瘤药物阿霉素(dox)的递送;该纳米凝胶负载dox后,在肿瘤环境下高浓度的gsh刺激下,其结构中的二硫键裂解,进而释放出dox,发挥杀伤肿瘤细胞的作用;叶酸的修饰使纳米凝胶增添了主动靶向作用,该载体在体内循环过程中保持稳定,到达肿瘤部位后,通过刺激响应可以定点释放负载药物,提高肿瘤组织和细胞内的药物浓度,从而提高疗效,体外药物释放实验表明该纳米载体具有ph/gsh双重响应性药物释放行为。
附图说明
23.图1为负载阿霉素的叶酸修饰羧甲基壳聚糖纳米载药凝胶制备的流程图。
24.图2为实施例2中的透射电镜图。
25.其中(a)为0.15gcmcs
‑
ss,(b)为0.3gcmcs
‑
ss,(c)为0.5gcmcs
‑
ss,(d)为0.3gcmc
‑
fa和(e,f)为0.3gcmc
‑
fa
‑
dox的透射电镜图。
26.图3为实施例3中的粒径分布图及zeta电位图。
27.其中(a)为0.15gcmcs
‑
ss,0.3gcmcs
‑
ss和0.5gcmcs
‑
ss粒径分布图;(b)为0.3gcmcs
‑
fa和0.3gcmcs
‑
fa
‑
dox粒径分布图;(c)0.15gcmcs
‑
ss的zeta电位;(d)0.3gcmcs
‑
ss的zeta电位;(e)0.5gcmcs
‑
ss的zeta电位;(f)0.3gcmcs
‑
fa的zeta电位。
28.图4为实施例4中的红外光谱图。
29.其中(a)为gcmcs,0.15gcmcs,0.3gcmcs和0.5gcmcs的红外光谱图;(b)为0.3gcmcs
‑
ss,0.3gcmcs
‑
fa和0.3gcmcs
‑
fa
‑
dox的红外光谱图。
30.图5为实施例5中的xps能谱分析图。
31.其中(a)为0.3gcmcs
‑
fa的xps能谱分析图,(b)为0.3gcmcs
‑
fa
‑
dox的xps能谱分析图。
32.图6为实施例6中0.3gcmcs
‑
fa
‑
dox在不同的ph中的的释放曲线图。
33.其中(a)ph 7.4释放曲线,(b)ph 5.2释放曲线。
34.图7为实施例7中的细胞存活率图。
35.(a)为gcmcs
‑
ss和gcmcs
‑
fa与hepg
‑
2共培养24h后细胞存活率。
36.(b)为gcmcs
‑
ss和gcmcs
‑
fa与hct
‑
116共培养24h后细胞存活率。
37.(c)为游离dox和gcmcs
‑
fa
‑
dox与hepg
‑
2共培养24h后细胞存活率。
38.(d)为游离dox和gcmcs
‑
fa
‑
dox与hct
‑
116共培养24h后细胞存活率。
具体实施方式
39.下列实施例用于进一步解释说明本发明,但是,它们并不构成对本发明范围的限制或限定。
40.实施例1
41.1)甲基丙烯酸缩水甘油酯(gma)修饰的cmcs制备
42.将0.2g cmcs加入40ml去离子水中,搅拌至完全溶解后,过0.45μm微孔滤膜进行简单纯化,得到cmcs溶液。在cmcs溶液中分别滴加0.15ml,0.3ml和0.5ml的gma,磁力搅拌48h后用1.0m的盐酸溶液将反应液ph调节为7,装入透析袋(mwco:8~14kda)透析24h除去未反应的杂质,得到不同比例甲基丙烯酸缩水甘油酯修饰的羧甲基壳聚糖(0.15gcmcs,0.3gcmcs,0.5gcmcs)。
43.2)二硫键交联的羧甲基壳聚糖纳米凝胶制备
44.取30ml gcmcs透析保留液,加热至60℃,在n2保护下加入30mg bac和6mg kps持续反应3h,待冷却后加入透析袋(mwco:8~14kda)透析5天除去小分子杂质,产物冻干后得到二硫键交联的羧甲基壳聚糖纳米凝胶(0.15gcmcs
‑
ss,0.3gcmcs
‑
ss,0.5gcmcs
‑
ss)。
45.3)叶酸修饰的羧甲基壳聚糖纳米凝胶制备
46.0.25g叶酸在15ml二甲基亚砜(dmso)中完全超声溶解后,加入0.07g nhs,0.20gedc
·
hcl和1.5ml三乙胺搅拌30min后,再加入gcmcs
‑
ss溶液(10ml,20mg/ml)在常温下反应24h后用氢氧化钠调节反应液ph至9,将反应液装入透析袋在pbs(ph=7.4)中透析3天,再在去离子水中透析2天。透析保留液经冷冻干燥得到叶酸修饰的羧甲基壳聚糖纳米凝胶(gcmcs
‑
fa)。
47.4)装载阿霉素的叶酸修饰羧甲基壳聚糖纳米载药凝胶制备
48.将10mg阿霉素加入40ml gcmcs
‑
fa溶液(1mg/ml)中,搅拌4h后将溶液转移至透析袋(mwco:8~14kda)中透析24h。透析保留液经冷冻干燥得到负载阿霉素的叶酸修饰羧甲基壳聚糖纳米载药凝胶(gcmcs
‑
fa
‑
dox)。相关制备的流程如图1所示。
49.实施例2
50.将实施例1制备的不同规格的纳米凝胶溶液滴于400目铜网表面,自然晾干后置于透射电镜下观察。结果如图2是所示,观察二硫键交联不同比例gma修饰的羧甲基壳聚糖透射电镜图(图2(a,b,c)),可以看出添加不同比例的gma对纳米粒径有一定的影响,其中0.3gcmcs
‑
ss的粒径最小且分布均匀,故选择该比例进行下一步研究;图2(d)表明叶酸修饰后的纳米凝胶粒径有所减小;图2(e,f)是装载阿霉素后的纳米凝胶透射电镜图,从图中可以看出纳米载体周围包覆了阿霉素,可知阿霉素装载成功。
51.实施例3
52.使用zetasizer动态光散射(dls)测量了纳米凝胶的粒径和不同ph下pbs溶液中纳米凝胶的zeta电位。不同比例gma添加下gcmcs
‑
ss粒径分布以及0.3gcmcs
‑
fa和0.3gcmcs
‑
fa
‑
dox的粒径分布和zeta电位如图3所示。0.3gcmcs
‑
ss粒子大小(141.7
±
33.6nm)比0.15gcmcs
‑
ss(248.9
±
35.4nm)和0.5gcmcs
‑
ss(269.3
±
20.8nm)都要小,这与透射电镜表征结果是一致的。0.3gcmcs
‑
fa由于叶酸的接枝,粒径大小(160.2
±
50.6nm)略微增大,而装载dox后胶束尺寸明显增大(220.4
±
38.4nm)。从zeta电位结果可以看出,在不同ph下产物的zeta电位不同。在ph 4.5时,0.15gcmcs
‑
ss,0.3gcmcs
‑
ss和0.5gcmcs
‑
ss的zeta电位分别为7.01
±
0.21mv,
‑
6.60
±
0.13mv和
‑
7.04
±
0.49mv,电位有逐渐降低的趋势是由于更多的gma的成功修饰,在另外三个ph下也有这种趋势且随着ph的增加,由于羧基的去质子化作用,产物的zeta电位降低。在ph 5.2时,三种gcmcs
‑
ss的zeta电位分别为
‑
4.61
±
0.53mv,
‑
13.87
±
0.29mv和
‑
17.07
±
0.93mv;在ph 7.4时,三种gcmcs
‑
ss的zeta电位分别为
‑
20.4
±
2.23mv,
‑
19.73
±
0.85mv和
‑
24.7
±
1.80mv;在ph 8.0时,三种gcmcs
‑
ss的zeta电位分别为
‑
22.90
±
1.32mv,
‑
27.00
±
1.34mv和
‑
30.97
±
0.83mv。接枝fa后gcmcs
‑
ss在不同ph下的zeta电位降低为
‑
15.66
±
0.21mv,
‑
19.70
±
0.72mv,
‑
35.1
±
2.70mv和
‑
38.5
±
1.25mv,这是由于gcmcs表面的氨基减少,羧基增加所致,说明了fa修饰成功。
53.实施例4
54.利用德国bruker tensor ii红外光谱仪对产物进行了红外光谱分析(ftir),波数范围为500~4000cm
‑1。
55.图4(a)为不同gma和cmcs比例下产物的红外图谱,(b)为纳米凝胶载药前后的红外图谱。比较gma修饰前后的cmcs红外光谱测量(图4(a))可以看出,在约1710cm
‑1处出现了新的峰,即gma上c=c双键的伸缩振动吸收峰,表明了gma的成功修饰。约3000cm
‑1处的条带是由于ch和ch2基团的存在,随着gma添加比例的增加,该处吸收峰逐渐增强,说明接枝后烷基含量增加,cmcs上存在更多的gma。
56.通过bac交联合成了gcmcs
‑
ss纳米凝胶,图4(b)表明约1710cm
‑1处的双键特征峰消失,gcmcs上的双键与交联剂发生加成反应进行交联,导致双键的消失,证明了反应的成功进行。而比较fa修饰前后峰强度发现1418cm
‑1处的氨基吸收峰有所减弱,表明羧甲基壳聚糖分子链上的氨基与fa发生了反应。
57.实施例5
58.对装载药物前后的产物进行x射线光电子能谱(xps)分析,c1s谱如图5所示。图5(a)为0.3gcmcs
‑
fa的xps能谱图,图中结合能283.25、284.90、286.70和287.05ev处的峰,分别对应c
‑
c、c
‑
o和c
‑
o
‑
c、c=n和o
‑
c=o基团。装载dox后(图5(b))峰位置发生了位移,峰强度发生了改变。c
‑
c和c=c、c
‑
o和c
‑
o
‑
c、c=n和o
‑
c=o基团对应的峰位移至284.70、286.45、288.10和289.05ev处。由于dox的成功装载,所有峰的结合能均发生了增加。并且c
‑
c峰由7.98%增加到73.45%,这可能是由于dox结构中c
‑
c和苯环c=c的引入。图5(b)中含氧基团的峰值强度比先前降低,含氧基团c
‑
o和c
‑
o
‑
c的百分比随之由84.29%降低为17.23%,o
‑
c=o的百分比也由6.49%降低为0.72%,说明gcmcs
‑
fa中的羧基在装载dox的过程中发挥了重要作用。
59.实施例6
60.阿霉素标准曲线绘制
61.实验采用紫外分光光度法测dox的浓度。精确称取dox 10mg,配置成10mg/ml的母液,将母液稀释成1.6、4、8、10、16μg/ml的dox溶液,在480nm处测量吸光值绘制dox标准曲线。
62.药物装载率和包封率
63.取实施例1中的透析渗出液,测定游离的dox含量(ws),透析保留液经过冻干后称重为w
g
,计初始dox加入质量为(w
d
)用以下公示计算羧甲基壳聚糖纳米凝胶药物装载率(lc)和包封率(ee):
[0064][0065][0066]
称取40mg gcmcs
‑
fa
‑
dox置于40ml含0、5、10mm gsh的磷酸缓冲液pbs(ph 7.4)溶液和含0、5、10mm gsh的醋酸缓冲液(abs)溶液(ph 5.2)的中,装入透析袋后将透析袋置于装有100ml与保留液一样pbs的烧杯中,在37℃下以80rpm恒温震荡,定点收集2ml渗出液,并补充等量pbs。测量渗出液中dox含量(w
t
),计算与开始加入dox总量(w0)的比值,以绘制释放曲线。实验重复三次,获取平均值。药物释放度计算方法如下:
[0067][0068]
经测试和计算,研究发现gcmcs
‑
fa中dox的lc和ee分别为15.6
±
0.12%和94.77
±
0.83%,可以看出,纳米凝胶表现出了优秀的载药性能。不同ph和gsh浓度下其体外释放结果如图6所示。从图6中可以看出在ph 5.2时,dox的释放率更高,表明了该纳米凝胶具有较好的ph敏感释药性能;dox的释放在10h后逐渐稳定,表明该纳米水凝胶结构稳定。在0mm gsh环境中,gcmcs
‑
fa在ph为7.4的条件下,48h后的dox累积释放量约为13.8%;在ph为5.2时,48h后的dox累积释放量约为23.2%。增加环境中的gsh(5mm)浓度,gcmcs
‑
fa表现出了明显的谷胱甘肽刺激响应性释药,ph 7.4下10h dox释放量由11.3%增加至48.7%,ph 5.2下10h dox释放量由17.6%增加至60.3%。48h后在两种ph下的dox释放量分别为55.3%和65.1%,与0mm gsh相比释放量增加了近3倍。将环境中的gsh浓度增加到10mm后,ph 7.4下10h dox释放量达到了69.2%,48h后达到了74.3%;ph 5.2下10h dox释放量达到了84.9%,48h后达到了90.7%。上述结果表明,该纳米水凝胶在正常生理条件下有提前释药的可能性较低,在而肿瘤部位高浓度gsh和低ph的协同环境作用下能够提升药物释放效果。
[0069]
实施例7
[0070]
研究采用mtt法评估产物对hepg
‑
2和hct
‑
116肿瘤细胞的细胞毒性。hepg
‑
2细胞在gibco dmem培养基(含10%胎牛血清,100u/ml青霉素和100μg/ml链霉素)中,hct
‑
116细胞在mccoy’s 5a培养基(含10%胎牛血清)中培养至90%密度后,将其以每孔6
×
104个细胞密度接种至96孔板中,每孔180μl。在5%co2细胞培养箱中37℃下培养24h后加入不同浓度梯度的0.3gcmcs
‑
ss、0.3gcmcs
‑
fa、0.3gcmcs
‑
fa
‑
dox和dox,每孔20μl,共培养24h后在避光下每孔加入20μl 5mg/ml的mtt溶液于培养箱中孵育4h,弃去培养液后每孔加入150μl的dmso,避光震荡20min,用酶标仪测定吸光值(490nm),以od1表示仅含培养基的对照孔吸光值,od2为药物共培养的细胞吸光值,用以下公示计算细胞存活率:
[0071][0072]
为了研究产物对hepg
‑
2和hct
‑
116肿瘤细胞生长的影响,我们用gcmcs
‑
ss、gcmcs
‑
fa、游离dox和gcmcs
‑
fa
‑
dox和细胞共培养后测定其存活率,结果如图7所示。从图7(a)和(b)可以看出空载的纳米凝胶gcmcs
‑
ss和gcmcs
‑
fa均没有变现出明显的细胞毒性。在gcmcs
‑
ss和gcmcs
‑
fa浓度高达100μg/ml时,hepg
‑
2的存活率为91.33%和92.03%,hct
‑
116的存活率为97.59%和96.51%,这代表空载的纳米凝胶有着很好的生物相容性。图7(c)和(d)为游离dox和gcmcs
‑
fa
‑
dox与hepg
‑
2和hct
‑
116共培养后的细胞存活率。对于hepg
‑
2和hct
‑
116,游离dox和gcmcs
‑
fa
‑
dox都表现出了明显的剂量依赖性的细胞毒性。随着dox终浓度由2μg/ml增加至20μg/ml,与游离dox共培养的hepg
‑
2细胞存活率从70.15%下降至23.07%,hct
‑
116细胞存活率从63.68%下降至21.83%;与gcmcs
‑
fa
‑
dox共培养的hepg
‑
2细胞存活率从60.66%下降至18.15%,hct
‑
116细胞存活率从49.69%下降至13.43%。gcmcs
‑
fa
‑
dox的抑制细胞增殖效果比游离的dox表现更好,而且对表面叶酸高表达的hct
‑
116有着比表面叶酸低表达的hepg
‑
2更高的细胞毒性。叶酸修饰的载药纳米凝胶与肿瘤细胞表面叶酸受体特异性结合,提高了药物传递能力,增强了其对肿瘤细胞的细胞毒性。
[0073]
实施例8
[0074]
为了检测肿瘤细胞对纳米凝胶的摄取效果和叶酸靶向效果,用hepg
‑
2肿瘤细胞(低表达叶酸受体)和hct
‑
116肿瘤细胞(高表达叶酸受体)进行了细胞摄取评价。将hepg
‑
2肿瘤细胞和hct
‑
116肿瘤细胞以每孔0.5
×
106个细胞的密度接种于6孔板中(含1ml培养液)培养24h后,分别加入1ml pbs、dox、和0.3gcmcs
‑
fa
‑
dox,每组当量dox浓度为10μg/ml,共同孵育12h后弃去培养液,每个孔用pbs清洗3次,加入1ml 10μg/ml的hoechst 33258置于培养箱中染色25min,吸去染色剂,用pbs清洗3次,用荧光倒置显微镜观察记录。
[0075]
研究将游离dox和gcmcs
‑
fa
‑
dox与hepg
‑
2和hct
‑
116细胞共孵育12h,考察了纳米凝胶的细胞摄取性。在荧光倒置显微镜下观察,蓝色荧光代表细胞核,红色荧光代表dox分布。从实验结果可以发现,游离dox可通过自由扩散或胞吞进入细胞内,然而负载dox的gcmcs
‑
fa与hepg
‑
2和hct
‑
116细胞孵育12h后细胞的红色荧光强度远高于游离dox孵育的细胞,这为纳米凝胶提高了细胞内摄取提供了证据。另外,fa的修饰增强了hct
‑
116细胞对dox的摄取,由于靶向配体fa可被hct
‑
116细胞膜上高表达的fa受体识别,故在荧光显微镜下观察到hepg
‑
2细胞的红色荧光强度低于hct
‑
116细胞。因此,gcmcs
‑
fa
‑
dox可提高药物的肿瘤细胞摄取。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1