一种靶向肝星状细胞的仿生纳米药物的制备方法及其应用
1.本发明涉及纳米药物制剂领域,特别是一种靶向肝星状细胞的仿生纳米药物的制备方法及其应用。
背景技术:
2.肝纤维化是长期慢性肝损伤导致的肝脏持续修复的过程,其特征是各种病因导致细胞外基质(ecm)的过度沉积,其中包括胆汁酸淤积、病毒感染、酒精性肝病,以及非酒精性脂肪型肝炎等。肝纤维化是一个高度动态和可逆的过程,比其他任何类型的器官纤维化都具有更大的可塑性。小分子、蛋白质、sirna、mirna和质粒等多种药物被用于抗纤维化治疗。然而,迄今为止未能提供有效的抗纤维化治疗,尚未有抗肝纤维化的药物获批。肝星状细胞(hscs)在肝纤维化的病理发展中起着关键作用。在正常肝脏中,肝星状细胞位于窦周间隙,主要功能是储存脂滴,处于静息状态。当肝脏发生慢性损伤后,肝星状细胞被激活,分化为肌成纤维细胞,具有收缩、促炎和增殖等特性,合成并分泌大量的胶原,是纤维化形成的主要驱动因素。通过调节肝星状细胞的活化,增殖或促进其凋亡来抑制肝星状细胞合成分泌胶原的能力在许多研究中表明可以减缓肝纤维化进程。肝损伤时由于肠道细菌和肠壁通透性增加,门脉系统和血液循环中的lps水平增加。lps通过hscs表面tlr4活化nf-kb。活化的hscs内nf-kb活性增加,导致炎症因子表达升高,放大肝脏炎症损伤反应,促进了hscs存活。有研究表明nf-kb抑制剂bay 11-7082可以诱导hscs凋亡,延缓肝纤维化进程。由于bay 11-7082溶解性差,全身使用会对机体产生副作用。因此,将bay 11-7082高效递送至肝星状细胞,提高其生物利用度是肝纤维化治疗的一个有效策略。
3.肝脏特殊的生理解剖特征使特定粒径和表面性质的纳米颗粒在肝脏中积累。与大多数其他组织不同,肝窦内皮细胞没有基底膜,且含有窗孔。因此,在没有聚集或蛋白结合等干扰的情况下,在全身注射后,大多数纳米颗粒表现出快速的被动肝脏积聚。库普弗细胞对纳米颗粒的摄取随着纳米颗粒粒径的增加而增加。所以,大尺寸的纳米颗粒会更快地在肝脏中积累,血液循环时间也会更短。随着纳米颗粒粒径的减小,库普弗细胞对纳米颗粒的摄取也会减少,体内循环时间延长,增加了其他肝细胞对纳米颗粒的摄取机率。通常,粒径小于150nm的纳米颗粒可以避免被库普弗细胞摄取,穿过肝窦内皮细胞窗孔,然后到达肝星状细胞和肝细胞。正常的肝窦内皮细胞有窗孔,直径在50-200nm。因此,静脉注射直径小于200nm的纳米颗粒可以通过肝窦内皮细胞窗孔。然而,在纤维化肝脏中,抗纤维化药物无法顺利到达肝星状细胞中发挥作用。因为肝星状细胞只占肝细胞总数的5-8%。此外沉积在窦周间隙的ecm和内皮细胞的失窗孔化抑制了抗纤维化药物在肝脏的富集,到达肝星状细胞的药物减少了。因此靶向递送药物至肝星状细胞是成功治疗肝纤维化的关键因素,目前靶向肝星状细胞的纳米载体通常是利用化学修饰的方法将靶向配体修饰在纳米药物表面,合成较为繁琐。因此,靶向肝星状细胞的纳米载体的改进和创新是目前亟需解决的问题。
技术实现要素:
4.针对上述情况,为解决现有技术之缺陷,本发明之目的就是提供一种靶向肝星状细胞的仿生纳米药物的制备方法及其应用,可有效解决目前靶向肝星状细胞的纳米载体通常是利用化学修饰的方法将靶向配体修饰在纳米药物表面,合成较为繁琐的问题。
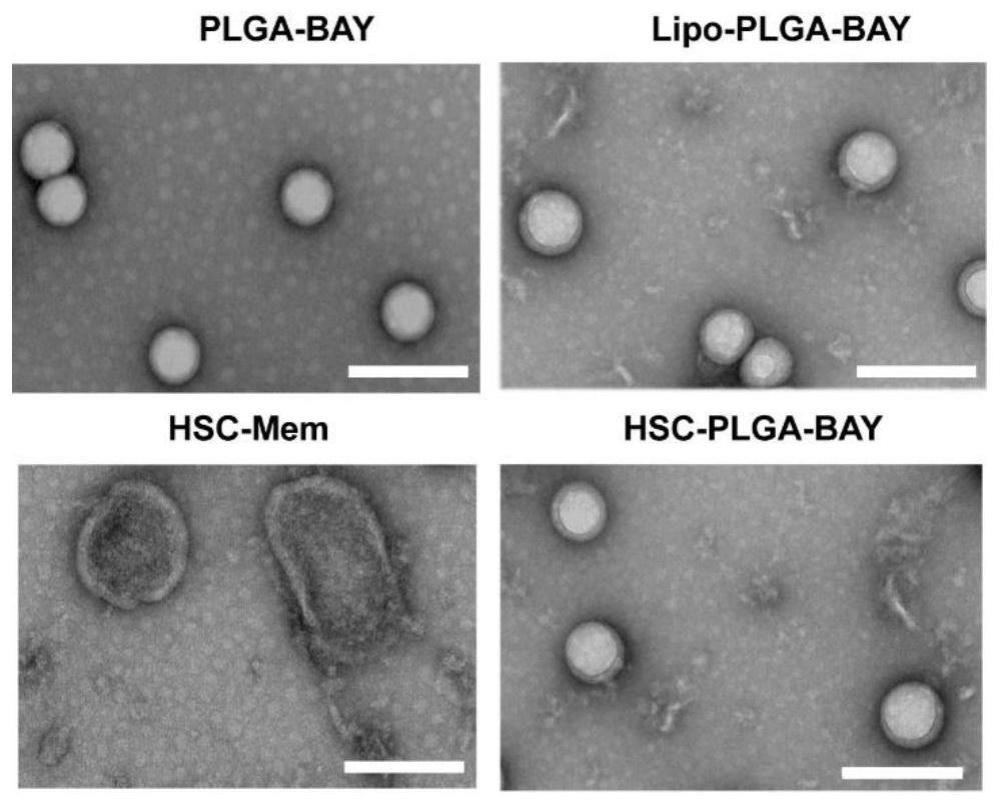
5.本发明解决的技术方案是,利用肝星状细胞的同源靶向功能,包裹诱导肝星状细胞(hscs)凋亡的疏水性小分子药物bay 11-7082,通过超声共挤出的方法得到具有肝星状细胞靶向的纳米药物;具体包括以下步骤:1)制备plga-bay纳米颗粒:称取20mg的plga(聚乳酸-羟基乙酸共聚物)与2.5mg bay 11-7082溶于1ml二氯甲烷中;加入0.2ml水,用细胞破碎仪超声,超声条件为功率285w,5分钟,开1s,关2s;加入2ml质量浓度为2%的胆酸钠水溶液,用细胞破碎仪超声,超声条件为功率285w,5分钟,开1s,关2s;将超声好的液体逐滴滴加到10ml 0.5%的胆酸钠水溶液,分散10分钟;将分散好的溶液进行旋蒸,除去二氯甲烷,旋蒸至无气泡产生;将旋蒸得到的溶液离心,离心条件为12000rpm,25℃,20分钟;离心结束后,弃掉上清,用水洗两次,离心,最终得到的plga-bay纳米颗粒重悬至1ml水中,备用;2)制备hsc-plga-bay纳米药物:将plga-bay纳米颗粒与肝星状细胞膜按照5:1 的质量比混合,超声,功率为 100 w,超声5分钟,之后用脂质体挤出器挤出,依次过400nm,200nm,100nm孔径的膜,最终得到肝星状细胞膜修饰的纳米药物。
6.所述的肝星状细胞膜提取方法为:1)准备starting buffer;225 mm甘露醇,75mm蔗糖,30mm tris-hcl;2)准备 isolation buffer;225 mm甘露醇,75mm蔗糖,30mm tris-hcl,0.5% bsa,0.5mm egta,加入100μlpmsf;3)待购买的原代hsc长至80%密度,弃掉培养基,pbs冲洗,加入5ml pbs,将培养皿置于冰上;4)用细胞刮刀小心刮取细胞,离心,离心条件为:1000rpm,4℃,5分钟,离心结束后,取出离心管,弃掉上清;5)沉淀加入isolation buffer,15cm皿加4ml,重悬;6)将细胞悬液经细胞破碎仪破碎,破碎功率30%,时间为 5 分钟;7)离心,离心条件为:3000g,4℃,5分钟,离心结束后收集上清,转移至新的离心管内;8)再次离心,离心条件为:10000 g,4℃,10分钟,收集上清,转移至超离管内;9)超速离心,离心条件为:100000 g,4℃,2小时,离心结束后取出离心管,弃掉上清,沉淀用pbs重悬,然后将其转移至预冷的 ep 管里;10)nanodrop蛋白定量,-80 ℃保存,即得。
7.所述的肝星状细胞膜修饰的纳米药物在抗肝纤维化治疗药物中的应用。
8.本发明仿生纳米药物可以诱导肝星状细胞凋亡,减少胶原分泌,缓解炎症微环境最终达到抗肝纤维化的目的,本发明制备方法简便,生物相容性好,为靶向肝星状细胞提供了一种新的思路,是仿生纳米药物上的创新。
tris (ph 6.8)溶液,10% sds 溶液,10%过硫酸铵溶液和temed溶液,充分混匀后沿玻璃板壁快速加入;迅速将洗净的梳子缓慢插入浓缩胶,待浓缩胶凝固后小心去除梳子,用三次水轻轻冲洗;将玻璃板安装到电泳架中,缓慢加入电泳液,内槽加满,外槽没过电泳丝2cm即可;将准备好的蛋白样品及预染marker 缓慢加入加样孔;以恒压80v进行电泳,当蛋白样品进入分离胶时将电压调整为120v,继续电泳,直至样品跑至分离胶下缘,终止电泳。取出玻璃板,用小铲小心的分开两块玻璃板, 切去上层浓缩胶,将分离胶小心转移至考马斯亮蓝染液中;室温孵育2小时;回收考马斯亮蓝染液,加入脱色液,过夜,待蓝色背景脱去,拍照。从图3可以看出肝星状细胞膜膜蛋白保留相对完整。
18.三、纳米颗粒肝星状细胞靶向性aml12细胞膜提取方法与肝星状细胞膜提取方法相同,aml12细胞长到合适密度进行细胞膜提取,作为对照。同时,用薄膜水化法合成脂质体,具体操作如下将 mpeg
ꢀ‑ꢀ
dspe:hspc:chol =1:9:1 (质量比)加入5ml的三氯甲烷,充分溶解后转移至100ml圆底烧瓶进行旋蒸,温度为37 ℃,旋蒸30分钟,至圆底烧瓶出现一层均匀的薄膜,然后继续旋蒸1小时,封口膜密封,置于干燥器中,后续备用。lipo-plga合成方法如下:按 plga与脂质体按照5 :1的质量比,加入适plga纳米颗粒水溶液进行水化,超声,功率为100 w,超声5分钟,之后用脂质体挤出器挤出,待用。
19.将hsc,aml12细胞以合适的密度接种至12孔板;培养过夜,弃去培养基, 缓慢加入pbs清洗细胞,更换新的培养基;将bay11-7082替换为荧光染料did,将包载did的纳米颗粒加入孔板内,细胞培养箱孵育2小时(使用荧光分光光度计进行统一定量);胰酶消化,完全培养基终止消化,以250g的速度,离心5分钟,将细胞收集至1.5ml ep管中离心,弃去上清后加入0.2 ml培养基重悬;流式细胞仪检测。从图4可以看出,肝星状细胞修饰的纳米颗粒具有良好的肝星状细胞靶向性。
20.四、cck法检测仿生纳米药物对hscs的抑制作用将原代hscs以合适密度接种于96孔板;配置不同浓度的药物(4μm,2μm,1μm,0.5μm,0μm),待细胞贴壁后,加入不同浓度药物,置于细胞培养箱,孵育24小时;24小时后吸走培养基,加入含有 10% cck-8 的完全培养基,置于细胞培养箱,孵育1小时;取出96孔板,酶标仪检测562 nm处吸光度,如图5所示。
21.本发明提供了靶向肝星状细胞的仿生纳米药物纳米药物结构稳定,粒径约为110nm,表面电势为-22mv,粒径分布均匀,且有良好的包封率;肝星状细胞对hsc-plga纳米颗粒有较高的摄取;hsc-plga-bay纳米药物可以抑制肝星状细胞增殖。
22.本发明使用了一种仿生策略载带nf-kb抑制剂,其优势在于:(1)解决了bay 11-7082的溶解性差,生物利用度低的问题;(2)减少了机体其他细胞对于bay 11-7082非特异性的摄取;(3)合成简便,避免了繁琐的化学修饰;(4)可装载不同机制的抗纤维化药物,根据临床需要,灵活组合,具有良好的工业应用前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1