基于ZnO复合介孔二氧化硅的可降解硅基载体材料及其制备方法与应用
基于zno复合介孔二氧化硅的可降解硅基载体材料及其制备方法与应用
技术领域
1.本发明属于药物载体材料领域,涉及基于zno复合介孔二氧化硅的可降解硅基载体材料 及其制备方法,以及该载体材料作为药物载体的应用。
背景技术:
2.介孔硅纳米颗粒因具有良好的生物相容性、大的比表面积、合适的孔径以及可调的孔尺 寸,可将治疗药物运送到不同的癌组织,被认为是理想的药物载体候选材料之一。然而,硅 基纳米材料的生物可降解性一直备受关注,因介孔硅中的si-o-si骨架十分稳定,介孔硅在有 机体内的降解时间可长达2~3周。介孔硅被人体免疫系统识别后会被网状内皮系统吸收,但 因其难以生物降解,容易长时间在体内积聚和滞留,这会对器官和组织造成未知的伤害,而 对于注射到人体的药物,特别是诊断试剂而言,在执行完其功能后,必须在合理的时间内完 全清除。早在2003年,关于介孔硅基材料作为药物载体的文章就有2300余篇,但至今却未 见任何关于介孔硅材料的临床报告,相比之下,脂质体的临床研究就已经有1600多项,生物 可降解性成为了介孔硅在临床应用中的最大挑战。另一方面,硅基载体的释药率不高,一般 在10%~30%,这主要是孔道载药使得多数药物由于分子间相互作用力而粘附在孔道内壁而未 能释放造成的,导致了药物利用度不高的问题。以上两方面的原因使得得硅基载体材料的临 床应用受限,也是现有硅基材料在生物学应用时所面临的主要难题。
3.近几年来,可降解型多孔硅的研究逐渐成为本领域热点。可降解材料通过其自身的降解 可避免硅基材料在有机体内长期积累的问题,同时,材料降解可增加载体内壁与肿瘤组织的 接触程度,促进药物的释放,有望提高药物的利用度。可降解硅基载体颗粒的研究已有一些 报道,有通过氧化还原和酶解的硅烷偶联剂的共掺杂,利用癌细胞和正常细胞内环境的差异 性,构建出不同癌细胞特异性的生物可降解药物控释系统的报道;也有利用羟基磷灰石、氧 化钙、mno2和fe3o4等无机纳米颗粒的酸敏感性来构建生物可降解药物控释系统的报道,但 一些金属氧化物溶解后形成的离子产物具有毒副作用,例如,mno2虽然对ph十分敏感,但 在ph=5.5时会溶解形成mn
4+
,mn
4+
具有神经毒性,在生物体内会产生毒副作用,限制了其 生物应用。因此,为了解决现有硅基材料在生物学应用中所面临的难题,有必要开发出降解 性能优异、降解后对机体毒副作用小的硅基载体材料。
技术实现要素:
4.针对现有硅基载体材料的可降解性差或降解产物会对基体造成毒副作用的问题,本发明 的目的之一是提供基于zno复合介孔二氧化硅的可降解硅基载体材料及其制备方法,以赋予 硅基载体材料良好的生物可降解性、优异的靶向能力和药物控释性能,本发明的目的之二是 提供该载体材料作为药物载体的应用。
5.为实现上述发明目的,本发明采用的技术方案如下:
6.一种基于zno复合介孔二氧化硅的可降解硅基载体材料,该载体材料是表面通过谷胱甘 肽响应型功能基团接枝封堵阀门的zno复合介孔二氧化硅纳米颗粒,所述zno复合介孔二 氧化硅纳米颗粒是内部负载有zno量子点的介孔二氧化硅,封堵阀门为聚乙二醇-叶酸,接 枝封堵阀门的谷胱甘肽响应型功能基团的结构如式(ⅰ)所示,
[0007][0008]
封堵阀门封堵住zno复合介孔二氧化硅介孔硅纳米颗粒的孔口,该载体材料中的二硫键 能被谷胱甘肽切断,二硫键被切断后,封堵阀门脱落而打开zno复合介孔二氧化硅介孔硅纳 米颗粒的孔口,同时,该载体材料中的zno量子点能在酸性环境中溶解而促进载体材料的降 解。
[0009]
上述载体材料的技术方案中,载体材料中结构如式(ⅰ)所示的接枝封堵阀门的谷胱甘 肽响应型功能基团的含量为25wt.%~35wt.%。
[0010]
上述载体材料的技术方案中,载体材料中作为改性基础的zno复合介孔二氧化硅纳米颗 粒的粒径优选为90~110nm。zno复合介孔二氧化硅纳米颗粒内部负载的zno量子点的粒径 优选为3~4nm。
[0011]
本发明还提供了基于zno复合介孔二氧化硅的可降解硅基载体材料的制备方法,包括以 下步骤:
[0012]
(1)制备zno量子点硅烷偶联剂
[0013]
将zno量子点分散于无水n,n-二甲基甲酰胺中形成分散液a,向分散液a中加入3-氨 丙基三乙氧基硅烷,在75~85℃反应0.5~1h,固液分离,所得固相即为氨基化zno量子点; 将氨基化zno量子点分散于四氢呋喃中形成分散液b,向分散液b中加入[3-(甲氧基硅烷) 丙基]琥珀酸酐,室温反应10~14h,固液分离,分别用四氢呋喃和无水乙醇洗涤所得固相, 即得zno量子点硅烷偶联剂;
[0014]
控制3-氨丙基三乙氧基硅烷与[3-(甲氧基硅烷)丙基]琥珀酸酐的体积比为1:(0.8~1.2), 按照每1g zno量子点添加0.4~0.8ml3-氨丙基三乙氧基硅烷的比例加入3-氨丙基三乙氧基硅 烷;
[0015]
(2)制备zno复合介孔二氧化硅纳米颗粒
[0016]
将zno量子点硅烷偶联剂分散于无水乙醇中形成分散液c,调节十六烷基三甲基溴化铵 水溶液的ph值至10~11并加热至75~85℃,将分散液c和原硅酸四乙酯分别加入十六烷基 三甲基溴化铵水溶液中,在75~85℃反应1~3h,固液分离,分别用水和乙醇洗涤所得固相, 即得zno复合二氧化硅纳米颗粒;
[0017]
zno量子点硅烷偶联剂、十六烷基三甲基溴化铵与原硅酸四乙酯的比例关系为(25~30) g:(200~210)g:1l;
[0018]
(3)制备二硫键修饰的zno复合介孔二氧化硅纳米颗粒
[0019]
对zno复合二氧化硅纳米颗粒进行巯基化修饰,将所得巯基修饰的zno复合介孔二氧 化硅纳米颗粒分散于无水乙醇中形成分散液e,向分散液e中加入2,2'-二硫二吡啶,室温反 应10~14h,固液分离,将收集到的颗粒用水洗涤,即得二硫键修饰的zno复合介孔二
氧化 硅纳米颗粒;
[0020]
巯基修饰的zno复合介孔二氧化硅纳米颗粒与2,2'-二硫二吡啶的质量比为1:(1~1.2);
[0021]
(4)制备基于zno复合介孔二氧化硅的可降解硅基载体材料
[0022]
将二硫键修饰的zno复合介孔二氧化硅纳米颗粒分散于ph值为7.5~8.5的pbs缓冲液 溶液中形成分散液f,向分散液f中加入巯基-聚乙二醇-叶酸,室温反应10~14h,固液分离, 将收集到的颗粒用水洗涤,即得基于zno复合介孔二氧化硅的可降解硅基载体材料;
[0023]
二硫键修饰的zno复合介孔二氧化硅纳米颗粒与巯基-聚乙二醇-叶酸的质量比为1: (1~1.2)。
[0024]
上述制备方法的步骤(3)中,一种可行的对zno复合二氧化硅纳米颗粒进行巯基化修 饰的方法如下:
[0025]
将zno复合二氧化硅纳米颗粒分散于无水乙醇中形成分散液d,在氮气保护下向分散液 d中滴加3-巯丙基三甲氧基硅烷,加热回流10~14h,分离出反应产物并用水和乙醇洗涤,然 后加入酸性乙醇溶液中,加热回流1~2h,将反应产物用乙醇洗涤后加入硝酸铵的乙醇溶液中, 加热回流除去十六烷基三甲基溴化铵,用水和乙醇洗涤后得到巯基修饰的zno复合二氧化硅 纳米颗粒;
[0026]
3-巯丙基三甲氧基硅烷的滴加总量与zno复合二氧化硅纳米颗粒的质量比为 (0.6~1.9):1,硝酸铵的乙醇溶液浓度为20~40g/l;分散液d中zno复合二氧化硅纳米颗 粒的浓度为6~10mg/ml。
[0027]
上述制备方法中,分散液a中zno量子点的浓度优选为5~10mg/ml;分散液b中氨基 化的zno量子点的浓度优选为5~10mg/ml;分散液c这zno量子点硅烷偶联剂的浓度优选 为10~20mg/ml,十六烷基三甲基溴化铵水溶液的浓度优选为2~5mg/ml。
[0028]
上述制备方法中,分散液e中巯基修饰的zno复合介孔二氧化硅纳米颗粒的浓度优选为 2~5mg/ml,分散液f中二硫键修饰的zno复合介孔二氧化硅纳米颗粒的浓度优选为2~5 mg/ml。
[0029]
上述制备方法中,zno量子点参照现有技术制备即可,一种可行的制备zno量子点的方 法为:
[0030]
将醋酸锌溶于无水乙醇形成5~20mg/ml的溶液,回流1~3h,冷却至室温,滴加koh 浓度为30~50mg/ml的koh乙醇溶液,在室温反应1~2h,离心,收集到的颗粒即为zno 量子点。
[0031]
本发明还提供了上述基于zno复合介孔二氧化硅的可降解硅基载体材料作为药物载体的 应用。
[0032]
在应用时,将二硫键修饰的zno复合介孔二氧化硅纳米颗粒加入抗癌药物的溶液中,在 避光条件下于50~60℃反应2~4h,以使抗癌药物分子进入二硫键修饰的zno复合介孔二氧 化硅纳米颗粒的孔道中,固液分离,洗涤除去二硫键修饰的zno复合介孔二氧化硅纳米颗粒 表面的抗癌药物,将所得负载药物的二硫键修饰的zno复合介孔二氧化硅纳米颗粒分散于ph 值为7.5~8.5的pbs缓冲液溶液,加入巯基-聚乙二醇-叶酸,室温反应10~14h形成封堵阀门 将抗癌药物封堵在孔道内,固液分离,水洗,即得载药纳米颗粒。所述抗癌药物最好是亲水 性的抗癌药物。
图,b-g图分别对应si、o、c、n、zn)。
[0045]
图6是实施例3中zno量子点、zno-nh2和znotms的xrd图(a图)、红外光谱图(b图)以及zno-nh2的荧光光谱图(c图),a图中,曲线a、b、c分别代表znotms、 zno-nh2和zno量子点的xrd图,b图中,曲线a、b、c分别代表znotms、zno-nh2和zno量子点的红外光谱图,c图中,曲线a、b分别代表ph=7.4和ph=5.0。
[0046]
图7实施例1制备的zno@msn和对比例1制备的msn的xps光谱图,其中,a图为 zno@msn和msn的xps光谱,b~d图分别为zno@msn的n1s(b)、zn 2p(c)和o1s(d) 分谱。
[0047]
图8是实施例1制备的zno@msn和对比例1制备的msn的
29
si固相核磁谱图(a图)、 zno@msn和msn的
29
si固相核磁拟合谱图(b~c图)。
[0048]
图9是zno@msn(曲线d)、zno@msn-sh(曲线c)、zno@msn-ss-pyr(曲线b) 以及zno@msn-ss-peg-fa(曲线a)的红外光谱图。
[0049]
图10是zno@msn-sh和zno@msn-ss-pyr的拉曼光谱图。
[0050]
图11是zno@msn(曲线a)、zno@msn-sh(曲线b)、zno@msn-ss-pyr(曲线 c)和zno@msn-ss-peg-fa(曲线d)的热重损失曲线。
[0051]
图12是zno@msn、zno@msn-sh和zno@msn-ss-peg-fa的低温氮气吸附-脱附等 温曲线(a图)以及bjh孔径分布图(b图)。
[0052]
图13是zno@msn在ph=5.0(a~f图)和ph=7.4(g~i图)的条件下浸泡不同时间后的 的透射电镜图。
[0053]
图14是zno@msn在ph=5.0和ph=7.4的条件下浸泡不同时间后zn
2+
量的变化图。
[0054]
图15是在不同gsh浓度和不同ph值条件下dox@zno@msn-ss-peg-fa的药物累计 释放曲线。
[0055]
图16是体外细胞毒性评价的细胞活性测试结果,其中a图为l02细胞与不同浓度的 zno@msn、zno@msn-ss-peg-fa和dox@zno@msn-ss-peg-fa共同孵育48h后的细 胞活性图,图中的每一组条形图中,从左至右依次代表zno@msn、zno@msn-ss-peg-fa 和dox@zno@msn-ss-peg-fa;b图为mcf-7细胞与不同浓度zno@msn、 zno@msn-ss-peg-fa、dox@zno@msn-ss-peg-fa以及dox共同孵育48h后的细胞活 性图,图中的每一组条形图中,从左至右依次代表zno@msn、zno@msn-ss-peg-fa、 dox@zno@msn-ss-peg-fa和dox。
[0056]
图17是dox@zno@msn-ss-peg-fa、dox@zno@msn-ss-peg分别与mcf-7细胞 孵育1、3、6h后细胞内锌离子含量图,图中的每一组条形图中,从左至右依次代表对照组、 dox@zno@msn-ss-peg和dox@zno@msn-ss-peg-fa。
[0057]
图18是mcf-7细胞和dox@zno@msn-ss-peg-fa颗粒共同培养1、3、6h的激光共 聚焦显微镜图像,从左到右依次是明场图像,dapi通道,dox通道和叠加通道(所有标尺 为10μm)。
具体实施方式
[0058]
以下通过实施例对本发明提供的基于zno复合介孔二氧化硅的可降解硅基载体材料及其 制备方法与应用作进一步的说明,以下描述的实施例仅仅是本发明的一部分实施例,而不是 全部的实施例。基于本发明的发明内容,本领域普通技术人员在未做出创造性劳动的前提下 所得到的所有实施方式,都属于本发明所保护的范围。
[0059]
下述实施例和对比例中采用的化学试剂的信息如表1所示,采用的仪器和设备信息如表 2所示。
[0060]
表1化学试剂信息
[0061][0062]
表2仪器和设备信息
[0063][0064][0065]
实施例1
[0066]
本实施例中,制备基于zno复合介孔二氧化硅的可降解硅基载体材料。
[0067]
zno复合介孔二氧化硅纳米颗粒(zno@msn)的合成路线如图1所示,首先对zno量 子点进行表面修饰,然后与3-氨基丙基三乙氧基硅烷(aptes)反应得到氨基化zno量子点 (zno-nh2),接着氨基化zno量子点与[3-(甲氧基硅烷)丙基]琥珀酸酐反应,得到zno量 子点硅烷偶联剂(znotms)。采用十六烷基三甲基溴化铵(ctab)作为模板剂,加入原硅 酸四乙酯(teos)与znotms的均相混合液,水解即得zno@msn。
[0068]
基于zno复合介孔二氧化硅的可降解硅基载体材料(zno@msn-ss-peg-fa)的合成路 线如图2所示,zno@msn与3-巯基丙基三甲氧基硅烷(mpts)反应得到巯基修饰的zno 复
合介孔二氧化硅纳米颗粒(zno@msn-sh);接着加入2,2'-二硫二吡啶,反应得到二硫键 修饰的zno复合介孔二氧化硅纳米颗粒(zno@msn-ss-pyr);为了在颗粒表面修饰peg 和叶酸基团,最后加入巯基-聚乙二醇3400-叶酸(sh-peg3400-fa)反应,得到 zno@msn-ss-peg-fa。
[0069]
具体步骤如下:
[0070]
(1)制备zno量子点硅烷偶联剂(znotms)
[0071]
将二水合醋酸锌溶于无水乙醇形成10mg/ml的溶液,在80℃回流反应2h,冷却至室 温,滴加koh浓度为40mg/ml的koh乙醇溶液(将koh溶于无水乙醇中得到),在25℃ 反应1h,冷却至室温,离心,收集到的颗粒即为zno量子点。
[0072]
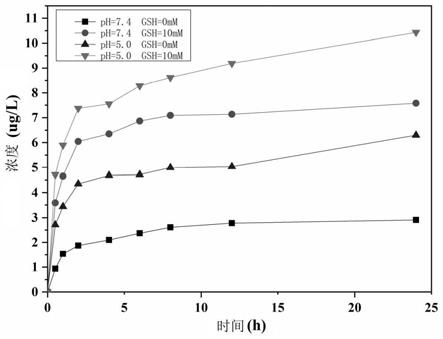
将zno量子点超声分散于无水n,n-二甲基甲酰胺中形成分散液a,分散液a中zno量 子点的浓度为6.67mg/ml,向分散液a中加入aptes,在80℃搅拌反应30min,离心,收 集到的颗粒即为zno-nh2;将所得zno-nh2分散在四氢呋喃中形成分散液b,分散液b中 zno-nh2的浓度为6.67mg/ml,向分散液b中加入[3-(甲氧基硅烷)丙基]琥珀酸酐,室温 反应12h,离心,将收集到的颗粒分别用四氢呋喃和无水乙醇洗涤3次,得到znotms。
[0073]
该步骤中,控制aptes与[3-(甲氧基硅烷)丙基]琥珀酸酐的体积比为1:1,按照每1g zno 量子点添加0.5mlaptes的比例加入aptes。
[0074]
(2)制备zno复合介孔二氧化硅纳米颗粒(zno@msn)
[0075]
将znotms分散于无水乙醇中形成浓度为15mg/ml的分散液c,将ctab浓度为2.1 mg/ml的ctab溶液的ph值用naoh溶液调节至11并加热至80℃,将分散液c和teos 分别逐滴加入至ctab溶液中,在80℃反应2h,冷却至室温,离心,将收集到的颗粒分别 用水和乙醇洗涤3次,即得zno@msn。
[0076]
该步骤中,znotms的质量、ctab的质量与teos的体积的比例关系为25g:208g:1l。
[0077]
(3)制备巯基修饰的zno复合介孔二氧化硅纳米颗粒(zno@msn-sh)
[0078]
将zno@msn分散于无水乙醇中形成浓度为6mg/ml的分散液d,在氮气保护下向分散 液d中滴加mpts,mpts的滴加总量与zno@msn的质量比为0.6:1,在80℃回流反应12 h,反应期间持续通入氮气,反应结束后,冷却至室温,离心、集到颗粒并用水和乙醇洗涤, 将洗涤后的颗粒分散于酸性乙醇溶液中,酸性乙醇溶液为浓盐酸-乙醇混合液,浓盐酸-乙醇 混合液中浓盐酸(浓度37%)与无水乙醇的体积比为1:9,在80℃反应1h,离心、收集颗 粒,用水和乙醇洗涤3次,再分散于浓度为20g/l的硝酸铵乙醇溶液中,80℃回流反应1h, 离心、收集颗粒并用水和乙醇洗涤3次,即得zno@msn-sh。
[0079]
(4)制备二硫键修饰的zno复合介孔二氧化硅纳米颗粒(zno@msn-ss-pyr)
[0080]
将zno@msn-sh分散于无水乙醇中形成浓度为4mg/ml的分散液e,向分散液e中加 入2,2'-二硫二吡啶,zno@msn-sh与2,2'-二硫二吡啶的质量比为1:1,室温搅拌反应12h, 离心,收集颗粒,用纯水洗涤,即得zno@msn-ss-pyr。
[0081]
(5)制备基于zno复合介孔二氧化硅的可降解硅基载体材料(zno@msn-ss-peg-fa)
[0082]
将zno@msn-ss-pyr分散于ph值为8.07的pbs缓冲液溶液中形成浓度为1.5mg/ml 的分散液f,加入sh-peg3400-fa,zno@msn-ss-pyr与sh-peg3400-fa的质量比为1:1, 室温反应12h,固液分离,将收集到的颗粒用水洗涤,得到的聚乙二醇-叶酸修饰的zno复 合介孔二氧化硅纳米颗粒即为zno@msn-ss-peg-fa。
[0083]
对比例1
[0084]
本对比例中,制备介孔硅纳米颗粒(msn)。
[0085]
将250mg的ctab和120ml纯水加入烧瓶中形成ctab水溶液,向烧瓶中加入2mol/l 的naoh溶液调节ctab水溶液的ph值至11,超声30min使溶液澄清,将烧瓶转入油浴内 加热至80℃,按照teos与ctab水溶液的体积比为1:100的比例逐滴加入teos,在80℃ 回流反应2h,离心、收集颗粒,用纯水和乙醇分别清洗3次,得到的白色颗粒即为msn。
[0086]
对比例2
[0087]
本对比例中,制备聚乙二醇修饰的zno复合介孔二氧化硅纳米颗粒 (zno@msn-ss-peg)。
[0088]
本对比例的操作与实施例1基本相同,不同之处仅在于将步骤(5)中的sh-peg3400-fa 替换为sh-peg3400。
[0089]
实施例2
[0090]
本实施例中,在实施例1制备的zno@msn-ss-peg-fa上负载抗癌药物阿霉素(dox), 步骤如下:
[0091]
将10mg的zno@msn-ss-peg-fa加入浓度为2mg/ml的dox溶液中,在避光条件下 于50℃振荡搅拌4h,以使dox分子进入zno@msn-ss-pyr的孔道中,固液分离、收集颗 粒,用纯水多次洗涤以除去zno@msn-ss-pyr表面的dox,将所得负载药物的 zno@msn-ss-pyr分散于ph值为8.07的pbs缓冲液溶液,加入sh-peg3400-fa, zno@msn-ss-pyr与sh-peg3400-fa的质量比为1:1,室温反应12h,固液分离、水洗,即 得载药纳米颗粒dox@zno@msn-ss-peg-fa。
[0092]
通过测定洗出液在481nm处的吸光度来计算溶液中的游离药物的量(记作游离量),根 据下式计算dox@zno@msn-ss-peg-fa的载药量:
[0093][0094]
结果表明dox@zno@msn-ss-peg-fa的载药量为13%,说明zno@msn-ss-peg-fa 对dox具有较好的负载能力。
[0095]
实施例3
[0096]
本实施例中,对实施例1中各步骤制备的产物进行性能测试。
[0097]
1.形貌分析
[0098]
通过透射电镜(tem)观察步骤zno-nh2的微观结构,结果如图3所示,zno-nh2的平 均粒径为3.6
±
0.3nm,且观察到了明显的晶格条纹,条纹间距为0.26nm,与zno量子点的 (001)晶面符合。
[0099]
通过tem观察zno@msn的微观结构,结果如图4所示,zno@msn呈类球形或椭球 形结构,大小均一且分散性良好,zno@msn的平均粒径为102
±
2nm,其孔道完整且呈现 贯通形孔道。
[0100]
为了探究zno@msn中元素的分布情况,通过扫描透射显微镜和能量色散x射线能谱 (stem-edx)分别对si、o、c、n和zn元素进行了分析,结果如图5所示,图5的(a) 图为扫描透射显微镜图,(b)~(f)图依次为si、o、c、n和zn的能量色散x射线能谱 图,由图5可知,除了si和o均匀分布于zno@msn内部之外,c、n和zn集中分布在颗 粒的内部,其中c和n是合成硅烷偶联剂znotms时引入的,说明zno@msn制备成功。
[0101]
2.物相与组分分析
[0102]
通过xrd对zno量子点的每一步修饰进行验证,如图6的a图所示,合成的zno量子 点的xrd谱图与六方纤锌矿结构的标准卡片(36-1451)完全对应,表明zno量子点成功合 成。zno-nh2在2θ=24
°
有一个较弱的峰,这是由于aptes中硅的引入所导致的二氧化硅的 无定形峰,在加入[3-(甲氧基硅烷)丙基]琥珀酸酐反应后,zno量子点的峰值仍然与标准图谱 一致,说明zno量子点经修饰后,物相并未发生改变,同时二氧化硅的峰增强,表明在修饰 过程中,颗粒的二氧化硅含量增加,这是由于修饰过程中硅烷偶联剂的引入,也可间接证明 znotms的修饰成功。
[0103]
测定zno-nh2在不同ph下的荧光发射光谱,如图6的c图所示,在ph=7.4的缓冲溶液 中,zno-nh2在530nm有明显的峰,而在ph=5.0的缓冲溶液中,未出现明显的峰形。说明 zno量子点在ph=7.4可稳定存在,具有荧光性,表明zno-nh2成功合成。而在ph=5.0时由 于酸敏感性溶解成zn
2+
,不再具有荧光性能,这也证实了zno量子点具有酸响应性。
[0104]
为了进一步验证zno量子点的成功引入,对实施例1制备的zno@msn和对比例1制 备的msn进行xps检测,结果如图7所示,相较于msn,zno@msn除了存在二氧化硅的 si 2p(102.34ev)、si 2s(152.01ev)和o1s(531.14ev)的特征峰外,还存在zn 2p(1020.71 和1043.77ev)和n1s(399.11ev)的特征峰,表明zno@msn中存在锌元素和氮元素,证 明zno量子点通过znotms被成功引入。对于zn 2p的能谱进行分峰,在1020.71和1043.77 ev出现了zn 2p1/2和zn 2p3/2的特征峰,同时对o1s的能谱进行分峰,在528.7,531.13 和531.88ev出现了对应于zn-o,si-o,h-o的特征峰,这些结果证实了zno@msn的成功 合成,锌元素以zn-o结合存在于zno@msn中。
[0105]
进一步地,对zno@msn和msn进行
29
si ssnmr(固相核磁技术)测试,测试二者的 硅的化学环境,结果如图8所示,二者都含有q峰,对于q峰分峰,可以看到q2,q3和q4特征峰,这分别归属于si(osi)2(oh)2、si(osi)3oh和si(osi)4引起的si化学位移。一般以 q4/q3的值代表二氧化硅骨架的交联程度,比值越大则说明颗粒中si-o-si的交联程度越大。 对q4和q3峰进行分析,结果如表3所示。
[0106]
表3zno@msn和msn的
29
si ssnmr拟合数据
[0107][0108]
由表3可知,zno@msn中,q4/q3的值小于msn,说明zno@msn的si-o-si的交联 程度较低,这有利于其生物降解。除了q峰,在zno@msn中还出现了t峰,这是si-c键 存在引起的si化学位移,si-c键存在于zno@msn表面的修饰基团中,这也证明了 zno@msn的成功合成。
[0109]
3.修饰基团的结构鉴定
[0110]
为证实每一步的反应是否成功,对zno@msn、zno@msn-sh、zno@msn-ss-pyr和 zno@msn-ss-peg-fa进行傅立叶红外光谱(ft-ir)分析,结果如图9所示。zno@msn 在3436cm-1
和1080cm-1
处的特征峰分别是硅羟基(si-oh)的吸收峰和硅氧四面体(sio4) 的反对称伸缩振动峰。zno@msn-sh主要由巯基和侧链上的亚甲基确定,谱图上的2930cm-1
和1450cm-1
两个谱带分别是c-h的不对称弯曲振动峰和c-h的伸缩振动峰,说明巯基被成 功引入。二硫键是通
过表面的巯基与2,2'-二硫二吡啶反应引入的,在zno@msn-ss-pyr谱图 上面新增了1564cm-1
谱带,属于c-n的特征峰,这是由于吡啶的引入引起的,证明二硫键的 成功引入。相比于zno@msn-ss-pyr,zno@msn-ss-peg-fa的红外谱图新增了1352cm-1
和1260cm-1
两个谱带,这是聚乙二醇中的c-o-c键的特征峰,证明了peg的成功引入。
[0111]
由于巯基与二硫键在红外光谱上信号较弱,因此对zno@msn-sh和zno@msn-ss-pyr 进行了拉曼光谱测试,如图10所示,zno@msn-sh在2508cm-1
和2540cm-1
有非常明显的 峰,这是拉曼光谱巯基的特征峰,说明巯基被成功引入。而在接枝2,2'-二硫二吡啶啶后,拉 曼光谱在在2508cm-1
和2540cm-1
处的特征峰消失,在509cm-1
新增了二硫键特征峰,这是 由于巯基发生二硫交换反应后,巯基被二硫键所取代,因此巯基对应的特征峰消失,而二硫 键的特征峰出现,说明二硫键被成功引入。
[0112]
采用热重分析法(tga)对分别对zno@msn、zno@msn-sh、zno@msn-ss-pyr和 zno@msn-ss-peg-fa测试它们表面的有机官能团的含量,结果如图11所示,zno@msn 的失重为10%,这主要是由于zno@msn的结合水和表面的羟基的减少造成的, zno@msn-sh的失重增加至15%,这是由于修饰在介孔硅表面的硅烷偶联剂引起的,硅烷 偶联剂末端为巯基。当修饰了吡啶后,颗粒的失重增加至18.8%,这是由于被修饰的吡啶基 团所导致颗粒的有机物含量上升。zno@msn-ss-peg-fa的失重增加至40%,这是因为修饰 的巯基-聚乙二醇-叶酸使得有机物的含量大大增加。tga结果也证实了实施例1中每一步修 饰的成功。
[0113]
4.介孔性质表征
[0114]
通过氮气吸脱附分析对zno@msn、zno@msn-sh以及zno@msn-ss-peg-fa的比表 面积、孔容积、孔径分布情况进行了测量,结果如图12及表4所示。zno@msn的吸附曲 线和脱附曲线符合国际纯粹与应用化学联合会(iupac)分类中的iv型,h1滞后环,是典 型的mcm41型介孔材料,孔容、孔径和比表面积分别为0.858cm3/g,3.51nm,918.1m2/g。 在相对压力p/p0为0.2~0.4时,可观察到样品的吸脱附曲线存在明显的滞后环,这是由于氮 气吸附在介孔内部产生的毛细凝聚现象而产生明显的滞后环,表明zno@msn存在均一的介 孔结构。在修饰巯基后,zno@msn-sh同样存在h1型滞后环,说明zno@msn经功能化 后仍然保存稳定的介孔结构,且zno@msn-sh的孔容、孔径和比表面积都略减少,分别为 0.711cm3/g,3.08nm,784.9m2/g,这是由于接枝的巯基部分修饰在孔口,使得孔径和孔容稍 有减小。而在修饰sh-peg3400-fa后,zno@msn-ss-peg-fa的曲线类型发生了较大变化, 属于ⅱ型等温吸附曲线,且孔容和比表面积减小为0.309cm3/g和146.5m2/g,这是由于 sh-peg3400-fa接枝在孔道处堵塞了孔道,使得孔容和比表面积大大减小,同时由孔径分布 图可以看出,修饰sh-peg3400-fa之后,得到的zno@msn-ss-peg-fa几乎没有孔道,这 也说明封堵阀门具有优良的封堵能力。
[0115]
表4zno@msn、zno@msn-sh和zno@msn-ss-peg-fa的 比表面积、孔容和孔径值
[0116][0117]
实施例4
[0118]
本实施例中,考察实施例1制备的zno@msn的降解行为。
[0119]
将zno@msn浸泡于ph=5.0以及ph=7.4的pbs缓冲液中,测试zno@msn的降解性 能,结果如图13所示。
[0120]
由图13可知,当zno@msn在ph=5.0的pbs缓冲液中浸泡1天后,因zno被酸溶解, zno@msn的表面和内部出现了一些空缺;浸泡3天后,其内部的空缺进一步增多;浸泡5 天后,部分zno@msn的边缘开始降解;浸泡7天后,zno@msn已降解成碎片结构;浸泡 14天后,碎片进一步降解变小。当zno@msn在ph=7.4的pbs缓冲液中浸泡7天和14天, zno@msn并未发生明显的改变,说明zno@msn在ph=5.0的弱酸环境中可快速降解,具 有良好的可降解性能。
[0121]
为了进一步分析zno@msn在降解过程中锌离子的溶出情况,通过icp-oes检测在不 同浸泡时间点,zno@msn在ph=5.0以及ph=7.4的pbs缓冲液中锌离子的浓度变化,结果 如图14所示,在ph=5.0的pbs缓冲液中,锌离子浓度快速增加,在浸泡20h时,锌离子已 经溶出了37%;浸泡50h后,溶出的锌离子已达到总锌离子含量的51%。而在ph=7.4的pbs 缓冲溶液中浸泡50h,锌离子几乎没有溶出。结合zno@msn降解过程的tem图可知, zno@msn在ph=5.0的pbs缓冲液中zno快速溶解并大量释放锌离子,形成空缺,随着浸 泡时间的延长,空缺逐渐增加,最终使得zno@msn降解。
[0122]
实施例5
[0123]
本实施例中,对实施例2制备的载药颗粒进行体外药物控释实验。
[0124]
测试在不同ph值的pbs缓冲溶液和不同浓度谷胱甘肽(gsh)溶液中载药颗粒的释放 动力学曲线,结果如图15所示。
[0125]
由图15可知,在ph=7.4的pbs缓冲溶液中,载药颗粒中的dox几乎没有释放,说明 封堵阀门对孔口具有良好的封堵能力,在含10mmol/lgsh的ph=7.4的pbs溶液中,载药 颗粒中的dox在前2h快速释放,在24h时的释放量是不含gsh时的3倍,这是由于二硫 键被gsh切断,封堵阀门脱落,负载在孔道内的dox大量释放造成的,说明载药颗粒对gsh 有很好的响应性。在ph=5的pbs缓冲溶液中,载药颗粒在前2h的dox释放量是ph=7.4 时的2倍,在12h后,dox仍然在持续释放,这是由于在弱酸性条件下,zno逐渐溶解, 载药颗粒逐渐降解而释放dox。在含10mmol/lgsh的ph=5的pbs溶液中,相比于在ph=5 的pbs缓冲溶液中时,dox释放得更快,在24h之后,dox的释放仍在持续,说明在封堵 阀门脱落的同时载药颗粒也逐渐降解,使得负载于内部的dox持续释放。以上实验结果说 明载药颗粒对ph和gsh具有双重响应性能。
[0126]
实施例6
[0127]
本实施例中,评价实施例1合成的各材料的体外细胞毒性。
[0128]
选用人正常肝细胞(l02 cells)作为实验细胞,与不同浓度(6.25、12.5、25、50、100、 200μg/ml)的zno@msn、zno@msn-ss-peg-fa和dox@zno@msn-ss-peg-fa共同 孵育48h,通过mtt比色法按下式计算细胞活性:
[0129][0130]
测试结果如图16的a图所示,在200μg/ml的zno@msn-ss-peg-fa中,l02细胞的 活性可达到89%,说明zno@msn-ss-peg-fa对l02细胞细胞毒性可忽略。浓度为200μg/ml 的
dox@zno@msn-ss-peg-fa对l02细胞也具有较好的生物相容性,说明它适合在药物 控释系统中应用。
[0131]
为了验证dox@zno@msn-ss-peg-fa对癌细胞的疗效,选用人乳腺癌细胞mcf-7作 为实验细胞,与不同浓度(6.25、12.5、25、50、100、200μg/ml)的zno@msn、zno@m sn-ss-peg-fa、dox@zno@msn-ss-peg-fa和dox共同孵育48h,结果如图16的b图 所示。zno@msn与zno@msn-ss-peg-fa对mcf-7细胞都有着一定的抑制增长作用。随 着浓度的增加,mcf-7细胞的存活率逐渐降低,当浓度为200μg/ml时,zno@msn与zn o@msn-ss-peg-fa组的细胞活性分别为71%和55%。这与其在正常细胞l02中的情况有显 著差异,说明zno@msn和zno@msn-ss-peg-fa本身对mcf-7细胞有一定的细胞毒性, 且后者的抑制作用更加明显。这主要是因为在zno@msn-ss-peg-fa表面修饰了peg-fa, 可与癌细胞表面过量表达的叶酸受体结合,更容易进入细胞有关。
[0132]
在dox@zno@msn-ss-peg-fa实验组中,当浓度为200μg/ml时,mcf-7细胞的活 性进一步降低至28%。而对于zno@msn-ss-peg-fa实验组,当浓度为200μg/ml时,l02 细胞细活性为89%,而mcf-7细胞活性为60%。这一差异说明细胞质基质中高浓度的gsh 能切断载药颗粒表面接枝的封堵阀门触发dox的释放,杀死癌细胞。
[0133]
以上实验结果说明在正常细胞l02中,zno@msn-ss-peg-fa无细胞毒性,但其对癌细 胞中却有细胞抑制作用,这是由于在癌细胞的弱酸环境中,zno溶出成为锌离子,对于细胞 具有一定的细胞毒性,而在正常细胞的中性环境中,zno不会溶解,没有细胞毒性。当负载 抗癌药物dox时,癌细胞中高浓度的gsh会切断连二硫键,导致封堵阀门脱落,dox大量 释放,与锌离子一起实现协同抗癌作用。
[0134]
将mcf-7细胞与实施例1制备的zno@msn-ss-peg-fa以及对比例2制备的 zno@msn-ss-peg共同孵育1h、3h和6h,以未添加纳米颗粒或载药颗粒的情况作为对照 组。将细胞破碎,取细胞内液测试锌离子浓度,结果如图17所示。在对照组中,随着孵育时 间延长,锌离子的浓度并未发生变化,当加入zno@msn-ss-peg后,锌离子浓度增加,说 明其中的zno在mcf-7细胞的酸性细胞微环境中溶解成为锌离子,使得细胞质中锌离子浓 度增加,随着孵育时间的增加,可发现细胞质中锌离子的含量也在增加,说明 zno@msn-ss-peg可被mcf-7细胞有效内化,且其中的zno可溶解成为锌离子。 zno@msn-ss-peg-fa组释放的锌离子浓度明显大于相同条件下的zno@msn-ss-peg,说 明表面表面修饰的叶酸基团可被癌细胞表面的叶酸受体识别,使得更多的载药颗粒内化, zno@msn-ss-peg-fa具有更好的靶向性。
[0135]
实施例7
[0136]
本实施例中,为了分析载药颗粒所载药物在细胞内的释放规律,采用激光共聚焦显微镜 分析了dox@zno@msn-ss-peg-fa在mcf-7细胞中的吞噬过程和药物释放行为。
[0137]
使用dapi染料对细胞核染色,在358nm激发下,细胞核呈现蓝色,dox在488nm处 激发,可观察到绿色荧光。分别拍摄dox@zno@msn-ss-peg-fa与mcf-7细胞孵育不同 时间的图片,如图18所示,在1h时,dox通道可观察到绿色信号,而在3h和6h时,dox 通道观察到的绿色荧光明显增强,通过叠加通道可观察到绿色荧光主要集中在细胞质内,细 胞核中也能检测到部分dox的绿色荧光,说明载药颗粒可被mcf-7细胞摄取,同时在mcf-7 细胞内释放dox,达到良好的控释效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1