一种基于影像组学的PD-1疗效预测模型及其构建方法
一种基于影像组学的pd-1疗效预测模型及其构建方法
技术领域
1.本发明属于精准医疗技术领域,具体涉及一种基于影像组学的pd-1疗效预测模型及其构建方法。
背景技术:
2.肝细胞癌(hcc)是全球第四大最常见的癌症相关死亡原因并且是一个重大的全球健康问题。而免疫治疗的出现极大地改变了肝细胞癌的治疗策略。但并不是所有患者可以从免疫治疗中获益。再加上免疫治疗费用昂贵以及有可能导致的严重不良反应,使得在接受免疫治疗前根据治疗效果对患者进行有效地分层十分必要。
3.目前已有的研究运用放射组学来预测肝细胞癌对免疫治疗的反应。yuan等人建立了影像组学列线图,以评估肝癌患者的抗pd-1治疗效果。然而,他们直接在患者层面进行评估、特征提取和预测。
4.而且肿瘤突变负荷(tmb)已被证实为抗pd-1治疗的潜在预测性生物标志物。这可能与高的tmb增加肿瘤新抗原产生从而增强免疫识别和细胞杀伤的可能性有关。然而,缺乏足够的肿瘤标本进行测序、周转时间长、评估成本高以及平台之间的差异等限制了tmb的标准化以及广泛使用。因此,有必要探索一些容易获得的预测因子,以帮助临床医生做出合理的决策。
技术实现要素:
5.本发明的目的在于提供一种预测肝癌患者pd-1治疗疗效的标志物、肝癌影像组学数据处理方法、处理系统、装置以及存储介质。
6.本发明所采取的技术方案是:
7.本发明的第一方面,提供一种预测肝癌患者pd-1治疗疗效的标志物,包括original_glcm_inversevariance、log-sigma-1-0-mm-3d_gldm_dependencenonuniformitynormalized、log-sigma-1-0-mm-3d_ngtdm_busyness、log-sigma-2-0-mm-3d_glszm_sizezonenonuniformitynormalized、log-sigma-4-0-mm-3d_glcm_clusterprominence、log-sigma-5-0-mm-3d_ngtdm_strength和wavelet-hhl_firstorder_skewness。
8.在本发明的一些实施方式中,所述标志物用于pd-1疗效预测的评分公式根据logistic回归模型确定。
9.在本发明的一些实施方式中:所述评分公式为:分值=original_glcm_inversevariance
×
0.070785+log-sigma-1-0-mm-3d_gldm_dependencenonuniformitynormalized
×
0.020274+log-sigma-1-0-mm-3d_ngtdm_busyness
×‑
0.004109+log-sigma-2-0-mm-3d_glszm_sizezonenonuniformitynormalized
×
0.005323+log-sigma-4-0-mm-3d_glcm_clusterprominence
×
0.019042+log-sigma-5-0-mm-3d_ngtdm_strength
×
0.003045+wavelet-hhl_firstorder_skewness
×
0.024414。
10.本发明的第二方面,提供检测标志物的物质在制备预测肝癌患者pd-1治疗疗效的
产品中的应用,所述标志物如本发明第一方面所述。
11.在本发明的一些实施方式中,所述物质为检测标志物的试剂和/或仪器。
12.在本发明的一些优选实施方式中,所述检测标志物的物质包括cect、mri、pet-ct检测标志物的试剂和/或仪器。
13.本发明的第三方面,提供一种肝癌影像组学数据处理方法,包括以下步骤:
14.获取肝癌患者影像图像;
15.提取影像图像中放射组学特征,筛选放射组学关键特征;
16.计算所述多个放射组学关键特征的线性组合;所述线性组合的计算结果为用于评价pd-1治疗反应性和预后生存的预测值;
17.根据所述预测值与预设阈值的大小关系,将所述肝癌患者划分为pd-1治疗反应性和预后生存高危组或pd-1治疗反应性和预后生存低危组。
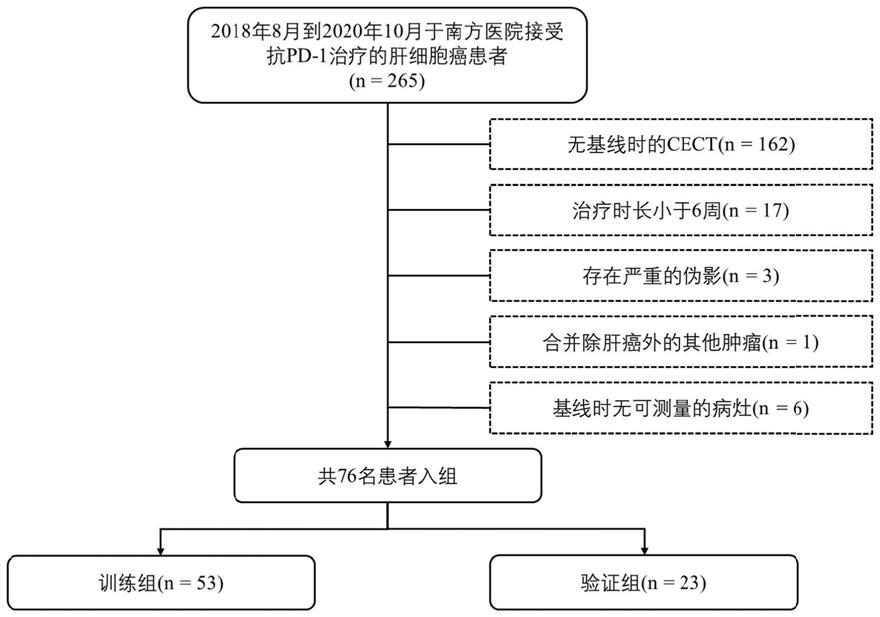
18.在本发明的一些实施方式中,所述影像图像为cect图像、mri图像或pet-ct图像。
19.在本发明的一些实施方式中,所述筛选放射组学关键特征是通过lasso逻辑回归执行的。
20.在本发明的一些实施方式中,所述放射组学关键特征包括本发明第一方面所述的标志物。
21.在本发明的一些实施方式中,所述计算所述多个放射组学关键特征的线性组合这一步骤,所用的公式为:
22.分值=original_glcm_inversevariance
×
0.070785+log-sigma-1-0-mm-3d_gldm_dependencenonuniformitynormalized
×
0.020274+log-sigma-1-0-mm-3d_ngtdm_busyness
×‑
0.004109+log-sigma-2-0-mm-3d_glszm_sizezonenonuniformitynormalized
×
0.005323+log-sigma-4-0-mm-3d_glcm_clusterprominence
×
0.019042+log-sigma-5-0-mm-3d_ngtdm_strength
×
0.003045+wavelet-hhl_firstorder_skewness
×
0.024414;所述分值为预测值。
23.在本发明的一些实施方式中,所述根据所述预测值与预设阈值的大小关系,将所述肝癌患者划分为pd-1治疗反应性和预后生存高危组或pd-1治疗反应性和预后生存低危组;具体为:
24.当所述预测值大于等于0.02时,将所述肝癌患者划分为pd-1治疗反应性和预后生存高危组;当评分小于0.02时,将所述肝癌患者划分为pd-1治疗反应性和预后生存低危组。
25.在本发明的一些实施方式中,通过预后生存分析进一步预测疾病进展,优选为无进展生存期的生存分析。
26.本发明的第四方面,提供一种肝癌影像组学数据处理系统,包括:
27.图像模块,用于获取肝癌患者的影像图像;
28.影像组学数据计算模块,提取影像图像中放射组学特征,筛选放射组学关键特征;
29.预测值计算模块,用于计算所述多个放射组学关键特征的线性组合;所述线性组合的计算结果用于评价pd-1治疗反应性和预后生存的预测值;
30.肝癌患者分组模块,用于根据所述预测值与预设阈值的大小关系,将所述肝癌患者划分为pd-1治疗反应性和预后生存高危组或pd-1治疗反应性和预后生存低危组。
31.在本发明的一些优选实施方式中,所述影像图像为cect图像、mri图像或pet-ct图
像。
32.本发明的第五方面,提供一种肝癌影组学数据处理装置,包括存储器和处理器,所述存储器用于存储至少一个程序,所述处理器用于加载所述至少一个程序以执行本发明第三方面所述的方法。
33.本发明的第六方面,提供一种存储介质,其中存储有处理器可执行的指令,所述处理器可执行的指令在由处理器执行时用于执行本发明第三方面所述的方法。
34.本发明的有益效果是:
35.本发明发现采用了基于病变的方法,在病变水平上评估和预测提取的特征,通过研究发现影像组学评分可能是抗pd-1治疗的肝细胞癌患者病灶反应性的预测因素,且平均影像组学评分可能具备筛选接受抗pd-1治疗劣效患者的能力,具有一定的临床价值。
36.进一步采用ct影像对患者ct图像进行病灶区域的分隔、特征提取、关键特征筛选并建立了影像组学的评分公式,建立预测模型,对pd-1疗效进行预测,根据患者影像学特征的分值将患者区分为有效组和无效组,从而辅助后续治疗方案的指定,具有良好的临床指导意义。同时,对得到的预后生存模型的性能进行了验证,保证了预后预测模型的准确性。
附图说明
37.图1为本发明研究的流程图。
38.图2为使用lasso逻辑回归选择影像组学特征。使用了10倍交叉验证选择lasso回归中的参数λ;垂直黑色虚线表示在均方差最小时λ为0.0688395。
39.图3为筛选后的影像组学特征和权重。
40.图4为影像组学评分预测病灶反应性的roc曲线。其中图4a为训练组中roc曲线;图4b为验证组中的roc曲线。
41.图5为患者水平的平均影像组学评分的kaplan-meier曲线图。以患者水平的平均影像组学评分0.02为分界值,大于等于0.02为高危组,小于0.02为低危组。图5a为训练组;图5b为验证组。
具体实施方式
42.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
43.实施例1基于cect的影像组学评分作为接受抗pd-1治疗的肝细胞癌病灶反应性的预测因素的构建
44.本研究收集了2018年8月至2020年10月之间在南方医科大学南方医院接受抗pd-1治疗的hcc患者。这项研究得到了南方医科大学南方医院审查委员会的批准,并符合《赫尔辛基宣言》。
45.纳入标准如下:(a)经过活检或者根据aasld治疗指南诊断为hcc;(b)接受抗pd-1治疗。
46.排除具有以下特征的患者:(a)基线检查时对比增强ct(contrast enhanced ct,
cect)不可用;(b)治疗时间《6周;(c)存在成像伪影;(d)除hcc外存在其他恶性肿瘤史;(e)基线检查时没有可测量的靶病变。
47.可测量的靶病变被定义为任何肿瘤病变(原发性或转移性病变),其整个边界在cect上可被识别。不能与周围组织准确区分的病变、边界不清的病变以及在基线检查或后续cect扫描时无法追踪到的病变,均未划定并排除。最后,hcc患者被随机分为两组:训练组(n=53)和验证组(n=23)。流程图可见图1。
48.于南方医科大学南方医院就诊的所有患者均使用两种多排ct(mdct)系统其中一种进行cect检查:the somatom(siemens medical systems)和the brilliance ict 256(philips healthcare)。扫描特征可见表1。
49.表1扫描特征
50.参数somatombrilliance ict256管电压(kvp)120120管电流(ma)autoauto探测器准直(mm)64
×
0.6128
×
0.625视野(mm)250
–
500300-400矩阵尺寸512
×
512512
×
512轮换时间(s)0.50.5切片间隔(mm)00切片厚度(mm)1-51-5
51.使用泵式注射器(ulrich ct plus 150,ulrich medical)以2.0
–
3.0ml/s的流速静脉注射造影剂(1.5ml/kg,ultravist 370,拜耳先灵制药),以获得cect图像。分别在注射后0s、30s、60s和120s获得四期(未增强期、肝动脉期、门静脉期和延迟期)ct图像。
52.使用recist标准,根据基线检查和随访之间病变直径的相对变化,评估每个病灶的反应性。进展性疾病(pd)定义为:根据动脉期cect,与基线值相比,靶病变直径增加至少20%。
53.两名放射科医生使用itk-snap(3.6.0版)对动脉期cect的病灶进行勾画分割。具体操作步骤:
①
将需要分割的格式为“dicom”的动态增强ct图像文件导入itk-snap软件(具体为:file
→
open main image
→
file format设置为dicom image series
→
browse
…
输入文件路径
→
next
→
finish);
②
设置适合的窗宽和窗位(tools
→
image contrast
→
contrast adjustment);
③
选择polygon drawing mode控件(tools
→
active main tool
→
polygon drawing mode)设置为手动分割模式。点击鼠标左键沿着病灶边缘进行手动分割;
④
选择paintbrush mode控件(tools
→
active main tool
→
paintbrush mode)对分割的边界进行精细调整。左键为对鼠标点击区域进行标记,右键则进行擦除。在界面左侧下缘segmentation labels控件对label参数进行调整;
⑤
确认分割边界与肿瘤边界完全吻合后,点击右下角accept完成该层面的勾画,如果边界偏差较大,也可点击右下角clear进行清除后重新勾画;
⑥
逐层完成后续层面的分割,并将分割后产生的二值化标签(binarization label)即mask文件以“nifti”的格式进行保存(segmentation
→
save segmentation image
→
file format设置文件的格式为“nifti”格式
→
finish);
⑦
将原始的格式为“dicom”的动态增强ct图像文件保存为“nifti”格式文件(file
→
save image
→
main image
→
file format设置为“nifti”格式
→
finish)。最终,训练组共163个可测量的靶病变(51个病灶发现pd),验证组共68个可测量的靶病变(24个病灶发现pd)。
54.在python(版本3.8,https://www.python.org/)的环境下运行pyradiomics包(版本3.0.1,http://github.com/radiomics/pyradiomics#readme)从“nifti”格式影像文件和勾画后的mask文件中提取影像组学特征。详细为,从原始图像以及不同的图像变换中提取影像组学特征,包括laplacian of gaussian filters(σ=1.0、2.0、3.0、4.0、5.0)、wavelet decompositions、non-linear transformations(exponential,square,square root,and logarithm)、exponential、gradient和lbp3d。
55.总共从病灶中提取了2038个放射组学特征。为保证研究的再现性,排除了从两位影像科医师处提取的组内相关系数(icc)小于0.75的特征,剩余1889个特征。对于剩余的特征,在python(版本3.8,https://www.python.org/)的环境下运行sklearn包(版本0.0,https://pypi.org/project/scikit-learn/)实现lasso逻辑回归十倍交叉验证选择关键特征,并用于计算影像组学评分(图2)。最后,选择了7个关键特征(图3)。然后通过回归系数加权,计算影像组学评分。具体公式为:
56.the radiomics signature(影像组学评分)=original_glcm_inversevariance
×
0.070785+log-sigma-1-0-mm-3d_gldm_dependencenonuniformitynormalized
×
0.020274+log-sigma-1-0-mm-3d_ngtdm_busyness
×‑
0.004109+log-sigma-2-0-mm-3d_glszm_sizezonenonuniformitynormalized
×
0.005323+log-sigma-4-0-mm-3d_glcm_clusterprominence
×
0.019042+log-sigma-5-0-mm-3d_ngtdm_strength
×
0.003045+wavelet-hhl_firstorder_skewness
×
0.024414。
57.影像组学评分在训练组中的auc为0.751(95%ci,0.671
–
0.831),在验证组中auc为0.733(95%ci,0.608
–
0.858)(图4)。在患者层面的分析中,计算每个患者的平均影像组学评分,用于对无进展生存期(pfs)进行kaplan
–
meier生存分析。
58.以平均影像组学评分0.02为分界值,大于等于0.02为高危组,小于0.02为低危组。训练组和验证组的kaplan
–
meier曲线显示两组在rfs上存在显著差异(p《0.05)(图5)。在训练组中,高危组和低危组的中位pfs分别为1.90个月(95%ci,1.40-)和4.42个月(95%ci,3.90-6.10)。在验证组,高危组和低危组的中位pfs分别为2.53个月(95%ci,1.83-)和5.87个月(95%ci,4.03-14.00)。
59.综上,影像组学评分可能是抗pd-1治疗的肝细胞癌患者病灶反应性的预测因素,具有一定的临床价值。
60.上述具体实施方式对本发明作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1