普鲁士蓝及其类似物在制备预防、延缓或治疗细胞焦亡相关疾病药物中的应用的制作方法
1.本技术涉及医药领域,具体涉及疾病治疗领域,进一步涉及对细胞焦亡相关疾病治疗的技术领域。
背景技术:
2.细胞焦亡(pyroptosis)是一种最近发现的细胞程序性死亡方式,表现为细胞不断胀大直至细胞膜破裂,导致细胞内容物的释放进而激活强烈的炎症反应。自2015年以来,邵峰院士等人发现,caspase-1和caspase-11/4/5是通过切割一个叫做gasdermin-d(gsdmd)的蛋白而诱发细胞焦亡的,gsdmd在被caspase-1或caspase-11/4/5切割后,释放出其n端结构域,该结构域具有结合膜脂并在细胞膜上打孔的活性,这样就导致细胞渗透压的变化而发生胀大直至最终细胞膜的破裂(shi et al.,nature 2015;ding et al.,nature 2016)。细胞焦亡是机体重要天然免疫反应,在拮抗感染和内源危险信号中发挥重要作用。细胞焦亡广泛参与感染性疾病、神经系统相关疾病和动脉粥样硬化性疾病等的发生发展,对细胞焦亡的深入研究有助于认识其在相关疾病发生发展和转归中的作用,为临床防治提供新方法。同时,作为炎症的主要肇事者,开发细胞焦亡激动剂或拮抗剂可以改变炎症性疾病的治疗,并可能导致更好的疫苗佐剂或免疫治疗。到目前为止,开发抑制细胞焦亡的特定化合物一直是一个挑战。
3.普鲁士蓝(亚铁氰化铁)及其类似物早期主要用于涂料中。fda于2003年批准普鲁士蓝作为铊和铯的解毒剂,充分显示了普鲁士蓝良好的生物安全性,引起了人们极大的研究兴趣,并在生物医学领域取得了许多进展。如普鲁士蓝纳米颗粒作为高载药量的药物递送系统。在生物医学成像方面,普鲁士蓝纳米颗粒兼具光声成像和磁共振成像,在干细胞示踪和多模态疾病诊断方面也有不少的研究。近年来发现的纳米酶活性,进一步促进了普鲁士蓝纳米颗粒在抗炎、抗肿瘤及超声成像等方面的应用。
4.本课题组致力于普鲁士蓝及其类似物的药物活性研究,发现普鲁士蓝及其类似物具有抑制细胞焦亡的作用。
技术实现要素:
5.发明人对普鲁士蓝及其类似物的药理作用及其内在机理进行了详细研究,惊奇地发现普鲁士蓝及其类似物具有抑制细胞焦亡的作用,从而完成了本发明。
6.据此,本发明的目的是,提供通过抑制细胞焦亡来有效地预防、缓解和/或治疗与细胞焦亡相关的疾病的治疗药物。
7.普鲁士蓝及其类似物(pbzyme)是一种典型的配位框架材料,可用通式axm1[m2(cn)6]y
·
zh2o来表示,其中m1、m2是由氰基连接的过渡金属如sc、ti、v、cr、mn、fe、co、ni、cu、zn,a是嵌入pba框架间隙的阳离子,例如li+、na+、k+等碱金属离子。x、y、z分别代表相应原子、基团或分子数目。
[0008]
第一方面,本发明提供一种预防、缓解和/或治疗与细胞焦亡相关的疾病的药物组合物,所述组合物含有有效量的普鲁士蓝及其类似物,其中普鲁士蓝及其类似物具有抑制细胞焦亡的作用。
[0009]
与细胞焦亡相关的疾病包括与循环有关的疾病,例如动脉粥样硬化、动脉硬化、外周血管疾病、外周血管发作(特别是脑部血管发作、肺部血管发作或肠道血管发作)、动脉瘤、慢性静脉功能不全或静脉曲张;肾疾病,例如急性肾疾病、急性肾损伤、肾缺血、肾小球性肾炎、急性或慢性间质性肾病、肾动脉硬化、糖尿病性肾病、急性或慢性肾衰竭;心血管疾病,例如心脏缺血和/或血管缺血、心肌梗死、缺血性心脏病、慢性或急性心力衰竭、心律失常、心房颤动、心室纤颤、阵发性心动过速、肥厚型心肌病、缺氧(anoxia)等。神经系统疾病,例如中风、短暂性脑缺血发作、产前脑缺氧、成年或儿童脑缺氧;以及神经退行性疾病,例如阿尔茨海默氏病(alzheimer’s disease)、帕金森氏病(parkinson'sdisease)、亨廷顿病(huntington's disease)、肌萎缩性侧索硬化症和婴儿型脊髓性肌萎缩;肌肉疾病,例如肌肉萎缩症,例如杜兴氏肌肉萎缩症(duchenne's muscular dystrophy)、强直性肌肉萎缩症、肌病和肌无力;器官特异性炎症或系统性炎症或自身免疫性疾病,例如类风湿性关节炎、慢性炎症性肠道疾病、牛皮癣、血管炎、支气管哮喘、慢性阻塞性肺疾病和嗜酸性粒细胞性鼻窦炎(eosinophilic sinusitis)或系统性狼疮;骨骼疾病、关节疾病、结缔组织疾病和软骨疾病,例如骨质疏松症、骨髓炎、关节炎(包括例如骨关节炎和银屑病关节炎)、缺血性坏死、进行性骨化性纤维增殖症、佝偻病、库兴氏综合征(cushing's syndrome);脑缺血发作或肢体疾病;皮肤疾病,例如皮炎、湿疹、牛皮癣、衰老或愈合过程改变;血液疾病和血管疾病,例如贫血、血管淀粉样变性、出血、镰状细胞病、红细胞破碎综合征、嗜中性粒细胞减少症、白细胞减少症、骨髓再生不良、全血细胞减少症、血小板减少症和血友病;肺部疾病,例如肺炎、哮喘、慢性阻塞性肺病,例如慢性支气管炎和肺气肿;胃肠道疾病,例如溃疡或肠系膜梗塞;肝疾病,例如病毒性肝炎或其他传染原(infectious agent)引起的肝炎、酒精性肝炎、自身免疫性肝炎、暴发型肝炎、肝纤维化、肝硬化、酒精性肝病(ald)、由毒素或药物引起的肝病;脂肪变性(steatosis),例如非酒精性脂肪性肝炎(nash)或酒精、药物或肝缺血的伴随外源性中毒;代谢性疾病,例如糖尿病、尿崩症、葡萄糖耐受不良综合征、肥胖症、高脂血症、下丘脑-垂体轴功能障碍、甲状腺炎、无β脂蛋白血症、半乳糖血症、痛风、糖原病、威尔逊氏病(wilson'sdisease)或韦伯病weber-christian disease);胰腺疾病,例如急性胰腺炎或慢性胰腺炎。
[0010]
更进一步,其给予有治疗需求的患者,所述患者可以是人体或是动物体,动物体可以是犬类、猫等宠物或家畜类动物如马、驴、羊、牛、猪等。
[0011]
进一步,本发明的预防、缓解和/或治疗与细胞焦亡相关的疾病的药物组合物,该组合物含有多种活性成分,其中普鲁士蓝及其类似物是第一活性成分,用于抑制组织细胞焦亡的发生。第二活性成分可以是不同于普鲁士蓝及其类似物的抑制细胞焦亡的药物;和/或是
[0012]
促进机体机能的活性物质;和/或是改善疾病的症状的药物;和/或者药学上可接受的活性成分。
[0013]
本发明的预防、缓解和/或治疗与细胞焦亡相关疾病的药物组合物,该组合物还含有药学可接受的载体和/或辅料,所述载体或辅料可以为分散剂、增溶剂、稳定剂、防腐剂、
甜味剂、调味剂、抗结块剂、润滑剂、崩解剂、吸附剂等。特别地,可用于制剂的试剂或介质(液体和/或注射剂和/或固体)为:甲基纤维素、羟甲基纤维素、羧甲基纤维素、环糊精、聚山梨酯80、甘露醇、明胶、乳糖、植物油或动物油等。优选使用植物油。本发明药物组合物可制成以下形式:悬浮液或即用注射溶液或临时注射溶液、凝胶剂、油剂、片剂、栓剂、粉剂、胶囊剂、颗粒剂、混悬剂、乳剂、聚合物、纳米颗粒、微球、直肠用胶囊、灌肠剂、糊剂、软膏剂、硬膏剂、饮剂、埋植剂、喷雾剂、气雾剂等,可选地通过剂型或装置进行控释和/或缓释。施用可通过本领域技术人员已知的任何方法,优选口服施用或胃肠外施用,例如通过腹膜内注射、脑内注射、鞘内注射、静脉内注射、动脉内注射或肌内注射。口服施用或静脉内施用是优选的。对于长期治疗,优选施用途径为舌下、口服或经皮。对于注射,化合物通常包装为液体溶液或悬浮液,例如可使用注射器或输液器注射。
[0014]
第二方面,本发明提供一种通过抑制细胞焦亡来有效地预防、缓解和/或治疗与细胞焦亡相关的疾病的方法,所述方法施予所需要的患者有效量的普鲁士蓝及其类似物。
[0015]
第三方面,本发明进一步提供一种用于通过保护神经细胞的活性来有效的预防、缓解和/或治疗神经退行性疾病的方法,所述方法施予所需要的患者有效量的普鲁士蓝及其类似物。所述神经退行性疾病包括阿尔茨海默氏病(alzheimer’s disease)、帕金森氏病(parkinson's disease)、亨廷顿病(huntington's disease)、肌萎缩性侧索硬化症和婴儿型脊髓性肌萎缩;普鲁士蓝及其类似物作为药物通过抑制细胞焦亡介导的神经细胞死亡来预防、缓解和/或治疗神经退行性疾病。
[0016]
第四方面,本发明提供一种抑制小胶质细胞焦亡的抑制剂,所述抑制剂含有一定量的普鲁士蓝及其类似物,所述抑制剂作为试验制剂用于构建小胶质细胞焦亡的细胞模型。
附图说明
[0017]
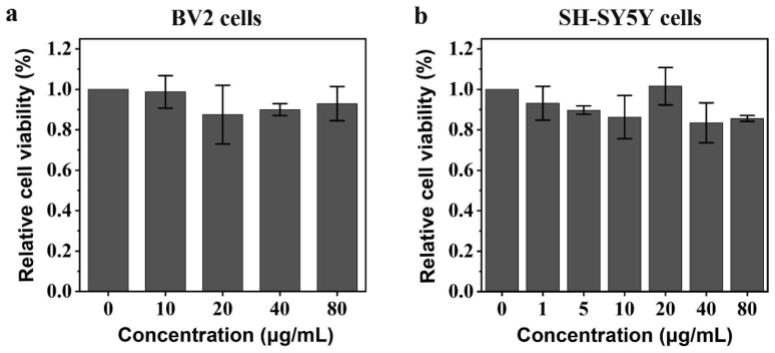
图1:bv2细胞(a)和sh-sy5y细胞(b)在与不同浓度的pbzyme孵育后的细胞活力。数据表示为每组5的平均值
±
sd。单向方差分析用于统计分析。
[0018]
图2:pbzyme和pbzyme-fitc的uv-vis-nir吸光度。(b)pbzyme和pbzyme-cy5.5的uv-vis-nir吸光度。(c)水、pbzyme和pbzyme-fitc的荧光图像。(d)水、pbzyme和pbzyme-cy5.5的荧光图像。
[0019]
图3:pbzymes在小胶质细胞bv2细胞中的细胞内吞作用的机制。(a)bv2细胞中pbzyme内吞作用的示意图。用无血清培养基(对照)、阿米洛利(一种巨胞饮作用抑制剂)和甲基-β-环糊精(mβcd,一种小窝蛋白介导的内吞作用抑制剂)预处理的bv2细胞的共聚焦图像,然后与40μg/毫升pb酶。(b)不同预处理后bv2细胞中fitc标记的pbzyme荧光强度的定量分析。n=4个独立实验,***p《0.001,**p《0.01,具有多重比较检验的单向方差分析。比例尺,20微米。
[0020]
图4:pbzymes在shsy5y细胞中的细胞内吞作用的机制。用无血清培养基(对照)、甲基-β-环糊精(mβcd,一种小窝蛋白介导的内吞作用抑制剂)和阿米洛利(一种巨胞饮作用抑制剂)预处理的shsy5y细胞的共聚焦图像,然后与40μg共孵育/ml pb酶。n=3独立。比例尺,20微米。
[0021]
图5:bv2细胞焦亡的典型特征。bv2小胶质细胞在mptp/atp处理后产生大量气球状
囊泡(红色箭头)并吸收碘化丙啶(pi)。比例尺,50微米。
[0022]
图6:用pbs(对照)或mptp/atp(100μm mptp处理16小时,最终2.5mm atp处理45分钟)后bv2细胞的扫描电子显微照片(sem)。(a)对照细胞的细胞膜完整光滑,无明显穿孔。(b)mptp/atp处理的细胞具有不规则的边缘和缺乏突起,质膜破裂(红色箭头)并形成不同大小的膜凹坑和孔(荧光绿色箭头)。比例尺,1微米。
[0023]
图7:pbzyme抑制mptp/atp诱导的bv2小胶质细胞炎质体的活化和装配,减弱多巴胺能神经元的死亡,并引起线粒体膜电位损伤。(a)扫描电子显微镜显示,在用mptp(100μm,16小时)和atp(2.5mm,最后45分钟)处理后bv2细胞膜上存在孔,在pbzyme预处理后没有或减少了孔形成;比例尺分别为5μm和1μm。(b)nlrp3表达的蛋白质印迹分析结果;裂解的半胱天冬酶-1(p20);来自bv2细胞培养物上清液的asc用pbs引发(对照),mptp(100μm,16h)然后用atp(2.5mm,45min)引发,或mptp(100μm,16h)用pbzyme(40μg/ml,2h)然后用atp(2.5mm,45min)和pbzyme(40μg/ml,18h)预处理(每组n=3)。定量细胞培养上清液中切割的胱天蛋白酶-1(c)和切割的gsdmd(d)水平,标准化为β-肌动蛋白水平。bv2小胶质细胞培养上清液中促炎细胞因子il-1β(e)和il-18(f)水平的elisa分析(每组n=4)。(g)在bv2小胶质细胞中的nlrp3和asc的免疫细胞化学。箭头表示nlrp3(绿色)和asc(红色)的斑点样聚集体。比例尺,100μm。(h)共培养的bv2小胶质细胞和sh-sy5y细胞的代表性免疫荧光图像,所述细胞用mptp处理(100μm,16小时),然后用atp处理(2.5mm,45分钟),之后用抗th(红)抗体染色。dapi表示核信号(蓝色)。比例尺,200μm。(i)在存在或不存在pbzyme的情况下,在与mptp(100μm,16h)温育,随后用atp(2.5mm,45min)处理之前和之后,sh-sy5y细胞的线粒体膜电位。比例尺,100μm。数据是平均值
±
sd。被包装物p<0.001,被包装物p<0.01,被包装物p<0.05。(j)用dcfh染色后,用mptp(100μm,16小时)和atp(2.5mm,最后45分钟)处理bv2小胶质细胞的流式细胞术分析。显示ros阳性细胞的dcfh直方图。)
[0024]
图8:脑室内注射pbzyme减轻了mptp诱导的pd小鼠模型中的运动缺陷。(a)注射cy5.5标记的pbzyme后3d,正常小鼠和mptp小鼠主要器官的荧光成像。(b)存在或不存在pbzyme处理时mptp诱导的pd小鼠模型的处理方案。(c)在转棒试验中的跌落潜伏期。(d)每组中的极测试时间。(e)前肢握力测定。开场参数:行驶距离(f)、行驶中央区域(g)和移动持续时间(h)。(i)使用ethovision追踪软件追踪小鼠的运动热图。数据是每组9至10只小鼠的平均值
±
sd。通过单向方差分析(anova)然后进行tukey's多重比较检验以进行非配对成对比较来评估差异。被包装物p<0.001,被包装物p<0.01,被包装物p<0.05。
[0025]
图9:sh-sy5y细胞未经处理(对照)或用mptp(100μm,16小时)引发,然后进行atp处理(2.5mm,15分钟),然后用无血清培养基补充,并在存在或不存在pbzyme(40μg/ml)处理。然后,将细胞用pi染色并通过流式细胞术进行分析。
[0026]
图10:用于检测细胞内ros的bv2细胞的代表性dcfh-da荧光图像,在它们与mptp(100μm,16小时)和atp(2.5mm,最后45分钟)一起在存在或不存在pbzyme的情况下孵育之前和之后。
[0027]
图11:icv注射cy5.5-pbzyme后正常小鼠脑荧光成像的动态监测。
[0028]
图12:pbzyme在mptp诱导的pd小鼠模型中拯救黑质纹状体多巴胺能变性。(a)来自黑质中th阳性神经元(上图,n=6,比例尺,500μm)和纹状体区域中纹状体纤维(下图,n=6,比例尺,1mm)的免疫组织化学的代表性显微照片。(b)黑质区th阳性神经元的无偏差立体计
数。(c)纹状体中th阳性神经元纤维的相对密度。通过uplc-tqms定量纹状体中的多巴胺代谢物hva(d)和dopac(e)。(f)代表性的免疫印迹说明th在黑质和纹状体中的表达。相对于β-肌动蛋白水平标准化的黑质(g)和纹状体(h)中th水平的定量。数据是平均值
±
sd。通过单向anova,然后通过tukey's多重比较检验来评估差异。被包装物p<0.001,被包装物p<0.01,被包装物p<0.05。
[0029]
图13:小鼠脑内pbzyme(蓝点)分布的代表性曙红染色显微照片,在脑室内注射后3天。(a)低倍显微照片显示pbzyme沿心室外围分布并在注射后渗透到外围脑实质中。比例尺,1毫米。圆圈内是散布到远处的蓝色圆点。(b-c)高倍显微照片显示pb在侧脑室周围的实质中扩散。圆圈内是散布到远处的蓝色圆点。比例尺,50μm
[0030]
图14:用pbs、mptp(25毫克/千克,腹膜内注射,每天一次,持续五天)和mptp(30毫克/千克,腹膜内注射,每天一次,持续五天)处理的c57bl/6j小鼠的免疫印迹。蛋白质印迹显示纹状体中th的表达,表明帕金森小鼠模型成功建立。
[0031]
图15:不同治疗后小鼠黑质中il-1β和il-6的定量(每组n=4只小鼠)。数据是平均值
±
sd。单向方差分析用于统计分析。**p《0.01,*p《0.05。
[0032]
图16:pbzyme在pd小鼠模型中降低炎性小体活化和小胶质细胞nlrp3和asc表达。显示了来自黑质组织裂解物的nlrp3(b)、切割的半胱天冬酶-1(p20,c)和asc(d)的代表性western印迹(a)和定量分析(n=每组5只小鼠)。黑质组织切片中主要炎性组分nlrp3(e,绿色)和asc(g,红色)的免疫荧光染色;比例尺,200μm。使用无偏差立体学方法定量黑质组织切片中nlrp3阳性(f)和asc阳性(h)神经元。数据表示为平均值
±
sd。双向anova用于统计学分析,随后进行tukey's多重比较检验。被包装物p<0.001,被包装物p<0.01,被包装物p<0.05。(i)代表性的蛋白质印迹法是在存在或不存在pbzyme的情况下用mptp或pbs处理的小鼠中脑组织表达gfap、iba-1和inos的结果。gfap(j)、iba-1(k)和inos(l)水平的定量,标准化为β-肌动蛋白的定量。误差棒代表平均值
±
sem。(m)黑质中gfap的免疫染色。比例尺,100μm。(n)柱状图显示黑质中gfap阳性细胞的数量。(o)黑质中iba-1的免疫染色。比例尺,100μm。(p)条形图显示黑质中iba-1阳性细胞的数量。数据是平均值
±
sd。被包装物p<0.001,被包装物p<0.01,被包装物p<0.05。
[0033]
图17:pbzyme治疗降低了pd小鼠模型中nlrp3炎性体的激活。显示了来自黑质组织裂解物的代表性蛋白质印迹(a)和gsdmd(b)和asc(c)的定量分析(每组n=3只小鼠)。数据表示为平均值
±
sd。**p《0.01。
[0034]
图18:用抗iba1抗体(绿色)(一种特定的小胶质细胞标记物)染色的小鼠脑切片中sn的代表性免疫荧光染色。dapi代表核信号(蓝色)。比例尺,20微米。
[0035]
图19:用抗gfap抗体(绿色)(一种特定的星形胶质细胞标记物)染色的小鼠脑切片中sn的代表性免疫荧光染色。dapi代表核信号(蓝色)。比例尺,20微米。
具体实施方式
[0036]
本发明的普鲁士蓝及其类似物的日剂量将是达到所需治疗效果的最小剂量。对于人类,普鲁士蓝及其类似物的剂量通常可为0.01mg/kg/天至150mg/kg/天,优选为0.1mg/kg/天至50mg/kg/天,甚至更优选为0.2mg/kg/天至40mg/kg/天,非常优选为0.25mg/kg/天至30mg/kg/天,极其优选为4mg/kg/天至30mg/kg/天。每日施用的量可以以每日摄取一剂、
两剂、三剂、四剂、五剂、六剂或更多剂施用,或在一天中以适当时间间隔摄取多个亚剂量。所选择的量可取决于多种因素,特别是施用途径、施用持续时间、进行施用的时间、化合物消除速率、与化合物或组合物组合使用的不同产物、个体的年龄、体重和身体状况以及个体的病史、他或她所面对的病理情况或衰退过程的性质以及医学上已知的任何其他信息。医生的处方可能以低于通常所用剂量的剂量开始,然后逐渐增加这些剂量,以更好地控制可能出现的副作用。
[0037]
实施例1:验证普鲁士蓝及其类似物的作用的实验方法
[0038]
材料:
[0039]
mptp-hcl购自sigma-aldrich(st louis,usa);hoechst33342,碘化丙啶(pi),线粒体膜电位测定试剂盒和jc-1购自beyotime(中国上海);细胞计数试剂盒-8测定购自dojindo(kumamoto,日本)。
[0040]
普鲁士蓝(pbzyme)的制备:
[0041]
在磁力搅拌下,将铁氰化钾和聚乙烯吡咯烷酮溶解在浓度为1m的盐酸溶液中,得到澄清的黄色溶液。然后将黄色溶液置于80℃的烘箱中20小时以获得蓝色溶液,将蓝色溶液离心并用水洗涤以获得pbzyme。
[0042]
pbzyme清除ros的测定:
[0043]
pbzyme清除的ros包括h2o2、超氧阴离子和羟基自由基。esr谱是通过使用bruker emx esr获得的。ctpo用作捕集剂以检测由h2o2产生的氧,在加入h2o2之前,用惰性气体对ctpo、盐水和各种浓度的pbzyme进行脱氧。将上述反应混合物用毛细管填充,并放入bruker esr空腔中。用uv光照射dmpo、tio2和各种浓度的pbzyme。然后,在置于石英毛细管中之后,用特定参数(200g扫描宽度;1g场调制;20mw微波功率)获得esr谱。为了产生超氧化物,选择黄嘌呤-黄嘌呤氧化酶系统作为超氧化物阴离子产生剂。
[0044]
pbzyme的动力学分析:
[0045]
将pbzyme加入到含有不同浓度(0,5,10,50mm)h2o2或不同浓度(0,20,40,200mm)tmb的底物溶剂中,用微量培养板读数器记录650nm处的吸光度。获得pbzyme的初速度,并通过michaelis-menten方程(方程1)拟合各种浓度的各自对h2o2或tmb的曲线。最大速度(vmax)和michaelis-menten常数(km)通过michaelis-menten方程获得。
[0046][0047]
其中vo是催化反应的初始速度,vmax是最大速度,[s]是浓度,km是michaelis-menten常数。
[0048]
结合fitc和cy5.5的pbzyme的合成。将pbzyme(1ml)分别与fitc和cy5.5(10mg,中国上海阿拉德技术有限公司)混合,在室温下磁力搅拌过夜。然后用盐水以16000rpm离心20分钟连续3次,获得fitc-和cy5.5-缀合的pbzyme。小鼠:
[0049]
成年雄性c57bl/6j小鼠(12-14周龄)获自上海slac实验室动物公司(中国上海)并在上海第六人医院饲养。所有小鼠都在标准条件下饲养:12小时的光/暗循环,自由获取食物和水、湿度(相对湿度,30%)和恒温(22-24℃)。
[0050]
脑室内立体定向注射。对于立体定位手术,用2%异氟烷麻醉小鼠,并将小鼠头部
固定在人工引导的立体定位仪器上。在用95%酒精消毒手术部位三次后,在头骨上进行中线头皮切口。在前囟后面0.46mm、左侧1.0mm、前囟水平面以下1.8mm(小鼠侧脑室的定位)钻出1mm的钻孔。用连接到电动纳米注射器将总体积3μl的pbzyme或pbs灌注到脑室内。
[0051]
mptp诱导的pd模型小鼠:
[0052]
在mptp-hcl(sigma-aldrich,美国)处理前24小时开始,通过脑室内注射给小鼠施用pbzyme(3μl,1mg/ml)。接下来,小鼠接受亚急性治疗方案:通过腹膜内注射以30mg/kg/天连续七次剂量的mptp。
[0053]
行为实验:
[0054]
为了评价小鼠的运动协调和探索性行为,进行旋转杆试验、杆试验、握力试验和开放场试验。所有行为测试在亮/暗圆圈的亮相中在13:00-18:00之间进行。在每个实验之前,使小鼠在行为程序室中适应至少30分钟。
[0055]
罗氏试验:
[0056]
该试验以检测mptp给药后的运动功能,对于转杆实验,在正式试验前,在转杆上训练小鼠5分钟,以10rpm/min的速度适应连续三天。最后一次mptp注射后三天,将小鼠置于加速转杆装置上,并记录每次下落的潜伏期。在5分钟内将速度从4rpm均匀加速至40rpm。如果动物从横档上掉下或抓住旋转杆并旋转两至三个连续的旋转而不试图在横档上行走,则认为试验结束。在两次试验之间的中断时间至少为30分钟。)
[0057]
杆测试:
[0058]
该杆由直径为9mm的75cm金属杆制成,用绷带纱布包裹。将小鼠面朝上放置在杆顶附近。记录到达杆的底部所花费的总时间。在实际测试之前,连续两天训练小鼠。每个训练期考虑三个试验。在测试日,分三个阶段评价小鼠,并记录总时间。停止测试和记录的最大截止时间为60秒。记录调低时间和总时间。
[0059]
握力测试:
[0060]
根据制造商的说明书(bioseb),使用握力测量仪测量握力。简言之,将小鼠用尾巴握住并放在网格上,然后使其处于几乎水平的位置。将网格平滑地水平移动直到小鼠释放网格。分析3次连续测量的平均值。
[0061]
野外试验:
[0062]
开放区域用于测定运动活动和探索性行为,开放场设备是80
×
80cm。将小鼠面对活动场所的壁引入,并允许自由探索活动场所20分钟,连续两天,跟踪动物(ethovision11.0 xt,noldus,information technology)以测量总的移动距离、平均速度、移动时间并记录运动热图。
[0063]
伊红染色:
[0064]
在施用pbzyme后72小时,收集小鼠脑并固定在4%pfa中。石蜡包埋后,根据标准方案用e染色对15μm厚的脑切片进行染色。染色后,通过mif nikon sweptfield显微镜和nis element ar软件(nikon corporation,tokyo,japan)获得图像。
[0065]
纹状体多巴胺及其代谢物的uplc/tqms分析:
[0066]
为了测定小鼠脑的纹状体多巴胺水平,将解剖的小鼠脑的纹状体在ripa缓冲液(50mm tris)中匀浆。通过超高效液相色谱-三重四极质谱(uplc-tqms)定量每个样品的多巴胺及其代谢物二羟基苯乙酸(dopac)和高香草酸(hva)。收集纹状体组织,立即在干冰上
冷冻,并在-80℃下储存直至分析。在分析当天,称量脑组织约10mg,加入200μl甲醇和小钢球进行超声研磨,在13200rpm离心10分钟,取200μl上清液,加入200μl乙腈进行剩余沉淀,然后再次离心。将上清液混合两次,共400μl,浓缩并蒸发,加入95μl水和5μl内标(醋氨酚),涡旋混合均匀,再次离心,并取上清液。上清液分为两部分,一部分用于agilent平台(agilent,uhplc-tqms,waters beh c18柱)分离多巴胺,一部分用于tq平台(waters,xevo uplc-tqms,waters beh c18柱)检测hva和dopac。使用chromeleon uplc软件进行数据采集和分析。
[0067]
免疫组织化学研究:
[0068]
在最终行为试验后24小时将小鼠惊吓,并灌注冰冷的pbs和4%多聚甲醛(pfa)。收集脑并用4%pfa在4℃固定16小时。处理来自黑质纹状体系统的脑切片用于免疫组织化学研究,切片用4%马血清在室温下封闭2小时,然后与针对酪氨酸羟化酶(th,ab137869)、iba-1(abcam,ab178846)和gfap(abcam,ab53554)的抗体在4℃下孵育过夜,接着与生物素缀合的抗兔抗体或生物素缀合的抗小鼠抗体、cy3-或alexa488标记的二抗孵育。通过前述的立体方法和图像j软件,对来自sn和纹状体区域的th阳性da神经元、iba-1和gfap阳性细胞进行计数和确定。
[0069]
免疫荧光染色:
[0070]
取出脑并用pfa在4℃固定过夜,培养的细胞用pfa在室温下固定15分钟,脑冠状切片和细胞分别在pbst(0.01mol/l)中洗涤三次。随后,用10%驴血清封闭脑切片和细胞1小时。洗涤步骤后,将切片或细胞与酪氨酸羟化酶的第一抗体(th,abcam,ab112),iba-1(abcam,ab178846),gfap(abcam,ab53554),nlrp3(novus,nbp2-12446)或acs/tms(cst,67824s)在4℃下孵育过夜。用pbs洗涤后,脑切片或细胞与pbs中的0.1%triton x-100和5%驴血清孵育,然后与alexa fluor594或alexa fluor488标记的二抗在室温下孵育1小时。使用dapi(beyotime biotechnology,c1099,中国)复染法使细胞核可见。通过mif nikon sweptfield显微镜和nis element ar软件(nikon corporation,tokyo,japan)获得免疫荧光图像,然后通过imagej软件分析在阈值的信号强度范围内的选择区域。
[0071]
western印迹分析:
[0072]
从小鼠脑中快速切除纹状体和黑质组织,并加入裂解物缓冲液匀浆30分钟。12000g 4℃离心15分钟后,用bca蛋白检测试剂盒定量溶胞产物的蛋白浓度。将细胞在含有蛋白酶抑制剂的缓冲液中裂解。用甲醇/氯仿沉淀细胞培养物上清液。等量的可溶性裂解物蛋白通过8-16%梯度sds-page凝胶进行分级分离,然后转移至硝酸纤维素膜。用5%bsa封闭该膜1小时,并在4℃下用抗th(th,abcam,ab112)、抗iba-1(abcam,ab178846)、gfap(abcam,ab53554)、inos(cst,13120s)、抗-胱冬酶原-1(abcam,ab179515)、抗-切割的胱冬酶-1(invitrogen,pa5-99390)、抗-gsdmd(abcam,ab215203)、抗-acs/tms(cst,67824s)、抗-nlrp3(novus,nbp2-12446)和β-肌动蛋白(sigma-aldrich)抗体孵育过夜,然后在室温下hrp-缀合的兔二抗山羊(abcam,ab6721)孵育1小时。免疫反应性条带通过增强化学发光(millipore,burlington,ma)显现。最后,使用荧光成像系统(proteinsimple,sata clara,ca,usa)分析成像。用imagej软件处理条带。
[0073]
定量rt-qpcr:
[0074]
按照产品的说明书,使用trizol试剂(invitrogen公司,carlsbad,ca)收获脑组织
和细胞以纯化总rna,然后通过primescript rt master mix(takara,tokyo,japan)将每个样品的1μg总rna逆转为cdna。进行三次pcr测定,并在用比较ct方法对gadph标准化后获得il-1β、il-6、tnf-α和il-18mrna基因的倍数变化(倍数变化=2-δδct
),用于定量rt-pcr的引物如下:
[0075]
小鼠il-1β:
[0076]
5'-tac atc agc acc tca caa gc-3'和5'-aga aac agt cca gcc cat act-3';小鼠il-6:
[0077]
5'-acc aag acc atc caa ttc atc-3'和5'-ctg acc aca gtg agg aat gtc-3';酶联免疫吸附测定(elisa):
[0078]
收集脑组织样品和细胞上清液,用于定量测定炎症因子的蛋白水平。il-1β、il-18的水平通过elisa试剂盒(由r&d systems,minneapolis,mn,usa提供)根据产品说明书的方案测定。
[0079]
细胞培养:
[0080]
小鼠bv2细胞、人sh-sy5y细胞从中国科学学院的细胞库中购买,bv2维持在添加了10%fbs和1%p/s的高葡萄糖dulbecco改进的eagle培养基(dmem)中。sh-sy5y细胞用补充了10%fbs和1%p/s和5%谷氨酰胺的dmem/f12(1:1,v:v)维持。细胞在37℃5%co2气氛中培养,每天更换培养基。
[0081]
细胞活力测定:
[0082]
为了评价pbzyme对细胞活性的影响,测定了标准细胞计数试剂盒-8(cck-8,dojindo,kumamoto,日本)。将sh-sy5y细胞和bv2细胞预先接种到96孔板中24小时,然后与不同浓度(0,10,20,40,80,160μg/ml)的pbzyme再培养24小时。将10μl cck-8溶液加入每个孔中,并分别再温育2小时。将未用pbzyme预处理的细胞设定为对照组。使用微量培养板分光光度计(bio-tek,winooski,vt)在450nm测量吸光度。
[0083]
pbzyme的胞吞和胞吞途径:
[0084]
为了研究参与pbzyme内化的内吞作用和内吞途径,使用两种特异性内吞抑制剂:(1)阿米洛利,一种微胞饮作用的抑制剂;(2)甲基-β-环糊精(mβcd),小窝蛋白介导的胞吞作用的抑制剂。bv2和sh-sy5y细胞分别在无血清培养基中与阿米洛利(100μm,30分钟)或mβcd(2.5mm,30分钟)预温育。然后用含有抑制剂和pbzyme(40μg/ml)的新鲜无血清培养基替换该培养基,并进一步温育14小时。然后洗涤细胞,并通过使用共焦激光扫描显微镜(nikon a1r,tokyo,japan)成像,图像j用于定量分析。
[0085]
炎性小体/半胱天冬酶-1活化的测定:
[0086]
为了诱导nlrp3炎性体活化,bv2小胶质细胞用mptp引发(100,16小时),并用强的nlrp3激活剂-atp活化(2.5mm,45分钟)。炎性小体成功活化被定义为在western印迹中来自细胞培养上清液的活性胱天蛋白酶-1(caspase-1)(p20)和切割的-gsdmd的存在,以及通过elisa试剂盒确定的细胞上清液中il-1β和il-18水平的增加。
[0087]
活细胞荧光染色:
[0088]
bv2细胞在12孔板中培养,用hoechst33342(标记细胞核)和pi(标记通过破裂细胞膜进入的坏死细胞)联合染色,用于检测在焦亡过程中bv2坏死。在nikon显微镜下记录亮场和荧光图像。
[0089]
组织和细胞内ros的测量:
[0090]
为了测定小鼠脑中ros的产生,将冷冻脑切片用双红乙锭(dhe,20μm)(50102es02,yeasen biotech有限公司,中国上海)在室温下染色60分钟。然后用dapi对细胞核进行染色。通过监测2',7'-二氯荧光素二乙酸酯(dcfh-da)探针(s0033m,beyotime biotechnology,上海,中国)的荧光来测定细胞内ros水平。将bv2细胞(3
×
104)种植在黑色6孔板中并培养24小时。用pbzyme(40μg/ml)预处理细胞2小时。之后,将mptp(100μm)加入到孔中,细胞再培养16小时,用atp活化(2.5mm,最后45分钟)。用pbs洗涤细胞两次,然后用10μm dcfh-da在37℃染色30分钟。用无血清培养基洗涤三次后,在nikon sweptfield显微镜(nikon corporation,tokyo,japan)和流式细胞仪(facsverse,bd)下观察细胞内ros的水平。
[0091]
线粒体膜电位测定:
[0092]
用jc-1测定试剂盒评价线粒体膜电位,将sh-sy5y细胞(3
×
104)接种在6孔板上,培养24小时。用pbzyme(40μg/ml)预处理2小时后,向孔中加入mptp(100μm)并再培养16小时。用hbss洗涤细胞两次,然后用jc-1(beyotime biotechnology,上海,中国)在37℃染色30分钟。荧光图像是用nikon显微镜(nikon corporation,tokyo,japan)获得的。
[0093]
pbzyme的体内荧光成像。为了监测脑室内注射体内后脑中pbzyme的积累,在mptp给药后,小鼠接受单次静脉内注射cy5.5-标记的pbzyme(3μl,1mg/ml)。在pbzyme注射后72小时在小鼠中进行荧光成像(visque invivo elite,viehorks,korea)。随后,处死小鼠,获取脑、心脏、肝、脾、肺、肾用于荧光成像。
[0094]
统计分析:
[0095]
所有数据表示为平均值
±
标准偏差(sd),所有实验重复至少三次。将蛋白质印迹中蛋白质水平的定量标准化为β-肌动蛋白。使用不成对t检验分析两组之间的差异,使用单向anova检验然后使用tukey's多重比较检验,或当适用时的双向anova,评估3组或更多组之间的差异。所有统计学分析以95%置信度进行,并且所有研究的显著性差异选择为p<0.05。数据显示为p值,以p<0.05、p<0.01、p<0.001、p<0.0001表示。所有统计分析都是用graphpad prism6.0(graphpad software,san diego,ca)和originlab software8.6(originlab,hampton,ma,usa)进行的。)
[0096]
实施例2:实验结果
[0097]
一、pbzyme的细胞保护作用
[0098]
在mptp诱导的pd细胞模型中研究了pbzyme的细胞保护作用,首次研究了pbzyme对bv2和sh-sy5y细胞的细胞毒性。细胞计数试剂盒-8(cck-8)分析表明,浓度为10、20、40和80μg/ml的pbzyme对小鼠bv2细胞和sh-sy5y细胞没有明显的细胞毒性(图1)。此外,还研究了pbzyme在bv2细胞和sh-sy5y细胞内吞的潜在机制,结果表明,阿米洛利和甲基β-环糊精(mβcd)降低了pbzyme的摄取,表明pbzyme可通过至少两条途径内化到bv2和sh-sy5y细胞中,其中小窝蛋白介导的内吞作用在细胞摄取中起关键作用(图2-3)。
[0099]
二、pbzyme有效地减少了细胞焦亡
[0100]
炎症小体“启动”诱导炎症小体成分(如nlrp3和asc)的上调,从而促进炎症小体复合体的组装和激活。细胞焦亡的形态学特征是由gsdmd或gsdme诱导的质膜破裂形成多个泡状突起。为了观察mptp/atp是否诱导小胶质细胞细胞焦亡,我们进行了连续活细胞成像实
验,观察bv2细胞的形态学变化。如图4所示,bv2小胶质细胞产生大量气球状小泡(红色箭头)并吸收碘化丙啶(pi),这是典型的细胞焦亡特征。此外,与pbs处理的细胞相比,用mptp(100μm,16h)刺激小胶质细胞并用atp(2.5mm,最后45min)激活小胶质细胞后,观察到明显的形态学异常。这些异常中最突出的是质膜破裂(红色箭头)和穿过bv2细胞表面形成膜孔(荧光绿色箭头)图(5-6)。值得注意的是,在pbzyme治疗组中观察到气孔数量显著减少,进一步说明pbzyme治疗有效地减少了细胞焦亡。
[0101]
三、pbzyme作为细胞焦亡抑制剂,通过减少nlrp3炎性体的激活和组装,有效地减轻了细胞焦亡。
[0102]
western blotting结果显示,mptp/atp处理引发的细胞培养上清液中切割的caspase-1(p20)、asc和切割的gsdmd的处理稳健(图7-b)。pbzyme显著降低p20、asc和切割gsdmd的表达水平(图7b-7d),表明细胞外切割的caspase-1和asc在炎症体驱动的病理过程中发挥作用,pbzyme减轻小胶质细胞nlrp3炎症体的激活。此外,il-1β和il-18是炎症小体激活和细胞焦亡过程中释放的关键炎症介质,与炎症激活程度有关。对mptp/atp激活的小胶质细胞中的il-1β和il-18浓度进行量化,发现与对照组相比,mptp/atp刺激在细胞培养上清液中释放了大量的il-1β和il-18。然而,用pbzyme处理小胶质细胞可显著减少il-1β和il-18的释放(图7e-7f)。免疫化学染色显示,pbzyme处理降低了mptp/atp处理的小胶质细胞中nlrp3和特征性asc斑点的表达(图7g)。这些结果表明,pbzyme作为细胞焦亡抑制剂,通过减少nlrp3炎性体的激活和组装,有效地减轻了细胞焦亡。
[0103]
四、pbzyme作为细胞焦亡抑制剂通过抑制小胶质细胞nlrp3炎性体激活拯救多巴胺能神经元
[0104]
研究某些神经母细胞瘤细胞是否与pbvnl2和pbvnl3共同培养的神经母细胞瘤细胞死亡。对细胞进行酪氨酸羟化酶(th,多巴胺能神经元的神经标记物)免疫荧光染色,以通过激活小胶质细胞nlrp3炎性体确认神经元丢失。mptp/atp处理显著减少了与bv2共培养后th阳性sh-sy5y细胞的数量。然而,pbzyme处理明显挽救了th阳性细胞的数量(图7h)。此外,扫描电子显微镜(sem)显示,与mptp/atp处理相比,pbzyme处理后的小胶质细胞神经元聚集模型(图6)中的小胶质细胞孔隙形成显著减少,这些发现进一步支持pbzyme作为细胞焦亡抑制剂通过抑制小胶质细胞nlrp3炎性体激活拯救多巴胺能神经元;因此,pbzyme可能是一种潜在的疾病修饰治疗剂,用于挽救受损的黑质多巴胺能神经元。
[0105]
五、pbzyme具有强大的ros清除能力
[0106]
nlrp3可被各种刺激物激活,线粒体ros被认为是nlrp3炎性体激活的潜在介质。为了确定pbzyme减轻nlrp3炎性体激活的潜在机制,进一步研究了pbzyme对ros水平和线粒体膜电位的影响。来源于神经胶质细胞中mptp的mpp+可通过抑制线粒体电子传递链复合物i诱导线粒体ros的产生。正如预期的那样,mptp/atp处理导致bv2细胞中线粒体ros的产生显著增加。有趣的是,通过流式细胞术(图7j)和dcfh荧光染色(图10)测定,pbzyme明显减少线粒体ros的产生,这表明pbzyme具有强大的ros清除能力。此外,采用双荧光线粒体膜电位检测试剂盒(jc-1)检测sh-sy5y细胞线粒体膜的去极化。对照sh-sy5y细胞中的红色荧光探针显示高线粒体电位,表明细胞处于正常电位,而mptp处理的细胞显示绿色荧光,表明线粒体电位明显降低。pbzyme可防止sh-sy5y细胞线粒体膜去极化,这表明pbzyme可防止mptp诱导的线粒体膜损伤(图7i)。基于以上结果,pbzyme作为细胞焦亡抑制剂,可能通过清除线粒体
ros抑制小胶质细胞nlrp3炎性体的组装并激活caspase-1,进一步抑制小胶质细胞细胞焦亡。
[0107]
六、pbzyme可显著减轻运动障碍,改善行为协调性和肌力
[0108]
在mptp诱导的pd小鼠模型中,探索了pbzyme作为细胞焦亡抑制剂的详细治疗效果。为了监测脑内pbzyme的积累,正常c57bl/6j小鼠和mptp诱导的pd小鼠仅接受一次脑室内注射cy5.5标记的pbzyme(3μl,1mg/ml)。在注射后第3天,采集主要器官,包括大脑、心脏、肝脏、脾脏、肺和肾脏,进行荧光成像。结果表明,pbzyme在大脑中积累(图8a)。曙红染色用于观察小鼠脑内的pbzyme(染色蓝点)分布,如图13所示,注射后第3天,pbzyme分布在侧脑室周围并渗透到周围脑实质,表明pbzyme可能被小胶质细胞吸收。
[0109]
pd患者通常表现为运动功能障碍,如震颤、强直和运动迟缓。因此,我们研究了脑室内微量注射pbzyme是否可以减少运动功能障碍,改善行为协调性和肌力。为了在小鼠中诱发pd样症状,我们如前所述向小鼠腹腔注射mptp。图8b给出了mptp诱导的pd小鼠模型所遵循的实验方案的示意图。用pbzyme(3μl,1mg/ml)或磷酸盐缓冲盐水(pbs)在小鼠侧脑室内随机预处理。侧脑室注射24小时后,小鼠接受亚急性mptp和pbs方案,即每天七次注射mptp和pbs(图8b)。将小鼠分为四组:经pbs处理的pd小鼠(mptp组)、经pbzyme处理的pd小鼠(mptp-pbzyme组)、经pbzyme处理的假小鼠(pb组)和未经任何处理的假小鼠(对照组)。小鼠纹状体抗th蛋白印迹显示成功建立了pd小鼠模型(图7)。
[0110]
根据一系列行为测试(图8c-8i)确定,服用mptp会导致严重的运动功能障碍,pd的特征性表现与之前的研究一致。rotarod测试为检测运动功能提供了一种方便的方法,极点试验是评价小鼠运动协调能力的一种典型方法。第10天,进行旋转试验和电极试验,以评估pbzyme是否能够缓解mptp治疗小鼠的运动功能障碍。pbzyme处理显著增加mptp诱导的pd小鼠的轮状体潜伏期(图8c),并显著缩短爬杆时间(图8d)。同样,pbzyme治疗显著提高了前肢的力量(图8e)。在野外试验中,mptp诱导的pd小鼠的行走距离、中心区域和活动时间显著缩短,然而,pbzyme治疗后,mptp诱导的pd小鼠的自发行为显著改善(图8e-8i)。值得注意的是,使用pbzyme治疗的正常小鼠没有表现出明显的行为障碍,这表明pbzyme具有良好的生物安全性(图8c-8i)。总之,这些行为测试结果表明,在mptp诱导的pd小鼠模型中,给予pbzyme可显著减轻运动障碍。
[0111]
七:pbzyme对神经退行性变的影响
[0112]
通过免疫组织化学染色、超高效液相色谱-三重四极杆质谱(uplc-tqms)、免疫印迹和免疫荧光染色。mptp给药导致黑质区和纹状体多巴胺能纤维中th阳性神经元显著丢失(图12a和图13)。有趣的是,pbzyme挽救了mptp诱导的多巴胺能神经元和纹状体多巴胺能纤维的丢失(图12a-12c)。同样,uplc-tqms结果表明,用pbzyme处理可阻断多巴胺及其代谢物二羟基苯乙酸(dopac)和高香草酸(hva)的消耗(图12d-12e,图13)。此外,western印迹结果表明,pbzyme减弱了纹状体和中脑组织中th表达的降低(图12f-12h)。综上所述,这些发现表明,在mptp诱导的pd小鼠模型中,pbzyme治疗可减轻多巴胺能神经元的丢失。
[0113]
在mptp诱导的pd小鼠模型中,小胶质细胞nlrp3炎性体激活是多巴胺能神经元丢失和随后运动功能障碍的有害因素。研究pbzyme是否能够抑制nlrp3炎性体的激活和组装,并减少神经炎症。测定小鼠腹侧中脑(vmb)区il-1β和il-6的mrna表达水平。mptp治疗导致vmb组织中il-1β和il-6水平显著升高(图15),这被认为是神经退行性疾病的病理引物。然
而,在pbzyme治疗后,在mptp诱导的小鼠中观察到il-1β和il-6水平显著降低(图14),这表明pbzyme可减轻pd小鼠模型中的神经炎症。
[0114]
炎症小体接合器(nlrp3和asc斑点)的形成是炎症小体激活的一个特定标记。然后,我们通过western blotting检测mptp治疗小鼠黑质中nlrp3、切割的caspase-1(p20)和asc的表达(图16a-16d)。pbzyme处理导致mptp处理小鼠黑质中nlrp3、p20和asc表达显著降低,表明pbzyme抑制nlrp3炎症体成分的激活(图16a-16d)。值得注意的是,mptp给药增加了小鼠黑质区域nlrp3和asc斑点的形成,但在pbzyme治疗后,增加的更少(图16a-16d)。我们还通过免疫荧光染色检测了活性nlrp3和asc的表达,以研究pbzyme对黑质炎症体信号激活的影响。与我们在western blotting结果中的发现一致,pbzyme处理显著抑制nlrp3和asc的激活(图16e-16h)。总的来说,这些结果表明,mptp处理的小鼠黑质中存在强烈的小胶质细胞激活,并且在mptp诱导的pd小鼠模型中,pbzyme可显著阻断黑质纹状体nlrp3炎症体激活。
[0115]
八、pbzyme有效地减轻了神经炎症
[0116]
新证据支持神经炎症是人类和动物pd发生的一个促成因素。胶质纤维酸性蛋白(gfap,一种星形胶质细胞标记物)、游离钙结合接合器分子1(iba1,一种小胶质细胞标记物)和诱导型一氧化氮合酶(inos)的表达在存在或不存在pbyzme的情况下,在用mptp或pbs处理的小鼠中脑组织中测定。mptp给药诱导星形胶质细胞和小胶质细胞的强烈激活以及inos的高表达。有趣的是,pbzyme治疗显著降低了mptp治疗小鼠黑质中gfap、iba-1和inos的表达(图16i-16l)。此外,通过免疫染色(图16m-16p,)确定,pbzyme治疗的pd小鼠黑质中gfap和iba-1的星形胶质细胞增生和小胶质细胞增生的激活减少,证实pbzyme有效地减轻了神经炎症激活。mptp治疗pd小鼠黑质的二氢乙胺(dhe)染色显示,注射后5天荧光强度显著增加(图14),表明mptp诱导ros的广泛激活。然而,在mptp处理的小鼠中,pbzyme处理显著减少了ros的产生。重要的是,对照组和pbzyme治疗组之间的主要器官的生化分析和h&e染色没有显示出显著差异,进一步证实了pbzyme在体内的生物安全性(图17-19)。
[0117]
本研究结果支持使用pbzyme减轻nlrp3炎症体的激活并减轻神经炎症,从而挽救多巴胺能神经退行性变,作为pd和其他神经退行性疾病的治疗方法。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1