一种基于光触发活性氧敏感的具备肿瘤细胞膜靶向的纳米药物载体
1.本实用新型涉及药物载体技术领域,具体涉及到一种基于光触发活性氧敏感的具备肿瘤细胞膜靶向的纳米药物载体。
背景技术:
2.耐药性一般是细胞膜p-gp过表达引起的,其能将不同类型的化疗药排除细胞外,进而致使药物失去杀灭肿瘤的能力。为了解决这个难题,研究者们已经广泛地设计出各种各样的药物递送系统,用以规避p-gp转运蛋白介导的药物泵出。尽管如此,这些纳米载药系统主要将药物递送至细胞质中,药物在这个位置仍然很容易被p-gp泵识别并消除,最终导致低浓度的药物作用于靶位点。
3.近年来,纳米载药体系(nanoparticles,np)在生物成像,疾病诊断和治疗方面有着广泛的应用;同时如何提高纳米载药体系的生物多样性也被广泛的研究。纳米载药体系不仅具有药物靶向作用,还可以维持疏水性药物的生物活性,降低药物的毒副作用。鉴于此,提供一种基于光触发活性氧敏感的具备肿瘤细胞膜靶向的纳米药物载体也就显得十分的有意义。
技术实现要素:
4.针对上述不足,本实用新型的目的是提供一种基于光触发活性氧敏感的具备肿瘤细胞膜靶向的纳米药物载体,解决现有纳米载药系统易被p-gp泵识别并消除而导致药物浓度低的问题。
5.为达上述目的,本实用新型所采用的技术方案是:提供一种基于光触发活性氧敏感的具备肿瘤细胞膜靶向的纳米药物载体,包括载药内核层,载药内核层由具有活性氧敏感性的高分子聚合载药胶束相互交织而成,载药内核层外部依次设置有靶向识别层、负电荷层和保护层。
6.本实用新型的有益效果:本实用新型提供一种基于光触发活性氧敏感的具备肿瘤细胞膜靶向的纳米药物载体,在静脉注射后血液循环过程中,负电荷层能防止纳米颗粒因静电结合血液中的阴离子蛋白而团聚形成大颗粒,从而阻止被网状内皮系统快速代谢,延长药物作用半衰期;采用由具有活性氧敏感性的高分子聚合载药胶束相互交织而成作为载药内核层,在可见光照射下可产生产生的ros能直接破坏纳米药物载体整体结构,实现纳米药物载体解体释放药物。本实用新型通过载药内核层、靶向识别层、负电荷层和保护层的相互协同,可以提高药物的溶解度,大大延长药物作用时间,大幅度增加药物的肿瘤分布,同时通过光触发活性氧实现药物在肿瘤细胞膜的靶向控释作用提高生物利用度,实现实现光动力转换效应,提高纳米药物载体生物安全性,同时还能通过跟踪纳米颗粒在体外细胞或者体内组织里的动态位置来引导抗肿瘤治疗进程,解决了现有纳米载药系统易被p-gp泵识别并消除而导致药物浓度低的问题。
7.进一步地,载药内核层、靶向识别层、负电荷层和保护层的厚度比为 2~5:1~2:1~2:1~2,优选为3:1:1:1。
8.采取上述进一步地方案的有益效果:载药内核层、靶向识别层、负电荷层和保护层的厚度比适宜,可提高纳米药物载体的生物利用度和生物安全性。
9.进一步地,靶向识别层为肿瘤细胞膜包被磷酸脂肪酸双分子层表面过表达的cd44受体蛋白特异性识别层。
10.采取上述进一步地方案的有益效果:通过靶向识别层可实现药物在肿瘤细胞膜的靶向控释作用。
11.进一步地,负电荷层为带有负电荷的阴离子组成。
12.采取上述进一步地方案的有益效果:负电荷层能防止纳米颗粒因静电结合血液中的阴离子蛋白而团聚形成大颗粒,从而阻止被网状内皮系统快速代谢,延长药物作用半衰期。
13.进一步地,保护层为包被的磷酸-脂肪酸叠合高分子层。
14.采取上述进一步地方案的有益效果:可提高纳米药物载体生物安全性。
15.进一步地,高分子聚合载药胶束上具有光触发结构。
16.采取上述进一步地方案的有益效果:本实用新型中高分子聚合载药胶束上具有光激发结构,可实现光动力转换效应,其还能作为自发光剂的来跟踪纳米颗粒在体外细胞或者体内组织里的动态位置,从而引导抗肿瘤过程。
17.进一步地,高分子聚合载药胶束的制备,包括以下过程:
18.1.乙酰化的硫酸软骨素多糖聚合体系(ac-cs)
19.①
对硫酸软骨素(cs)进行乙酰化聚合处理,将硫酸软骨素分散于甲酰胺,快速聚合混匀后,有机试剂吡啶和醋酸酐快速聚合使混合液澄清透明;
20.②
将上述混合液移至分子截留量为1000的透析袋中,用去离子水透析来得到纯化的乙酰化的硫酸软骨素聚合物;
21.③
待透析完后,将溶液进行冻干处理以获得乙酰化的硫酸软骨素(ac-cs) 冻干体系;
22.2.乙酰化的硫酸软骨素多糖聚合体系(ac-cs)与光敏剂二氢卟吩e6(ce6) 的共价接枝
23.①
乙酰化的硫酸软骨素多糖聚合体系和4-二甲氨基吡啶分别分散至二甲基亚砜分子内部;
24.②
向上述混合体系中分别加入光敏剂二氢卟吩e6、n-羟基琥珀酰亚胺和 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐;
25.③
将乙酰化的硫酸软骨素多糖共价聚合接枝二氢卟吩e6(ac-cs-ce6)的混合纳米药物递送体系转移至分子截留量为1000的透析袋内,用去离子水透析来纯化样品;经过冻干获得最终的高分子聚合载药胶束(ac-cs-ce6)。
26.综上所述,本实用新型具有以下优点:
27.1、本实用新型提供了一种基于光触发活性氧敏感的具备肿瘤细胞膜靶向的纳米药物载体,通过载药内核层、靶向识别层、负电荷层和保护层的相互协同,可以提高药物的溶解度,大大延长药物作用时间,大幅度增加药物的肿瘤分布,同时通过光触发活性氧实现
药物在肿瘤细胞膜的靶向控释作用提高生物利用度,实现实现光动力转换效应,提高系统生物安全性,同时还能通过跟踪纳米颗粒在体外细胞或者体内组织里的动态位置来引导抗肿瘤治疗进程。
附图说明
28.图1为本实用新型纳米药物载体的示意图;
29.图2为本实用新型纳米药物载体的解体示意图;
30.图3为本实用新型中载药内核层的局部示意图;
31.图4为本实用新型中纳米药物载体的工作流程示意图;
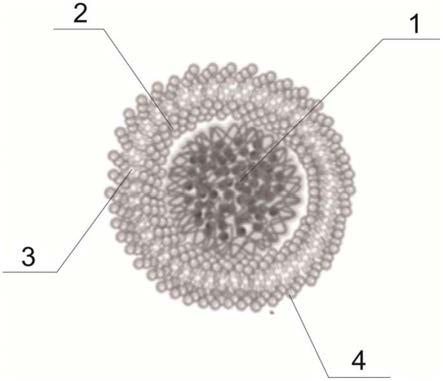
32.其中,1、载药内核层;2、靶向识别层;3、负电荷层;4、保护层;5、被载药物一;6、高分子聚合载药胶束;7、光触发结构;8、被载药物二。
具体实施方式
33.下面结合附图对本实用新型的具体实施方式做详细的说明。
34.本实用新型的一个实施例中,如图1-3所示,提供一种基于光触发活性氧敏感的具备肿瘤细胞膜靶向的纳米药物载体,包括载药内核层1,载药内核层1由具有活性氧敏感性的高分子聚合载药胶束6相互交织而成,载药内核层1外部依次设置有靶向识别层2、负电荷层3和保护层4;其中,载药内核层1、靶向识别层2、负电荷层3和保护层4的厚度比为3:1:1:1;靶向识别层2肿瘤细胞膜包被磷酸脂肪酸双分子层表面过表达的cd44受体蛋白特异性识别层;负电荷层 3为带有负电荷的阴离子组成;保护层4为包被的磷酸-脂肪酸叠合高分子层,高分子聚合载药胶束6上具有光激发结构7。
35.本例中基于光触发活性氧敏感的具备肿瘤细胞膜靶向的纳米药物载体的制备和使用过程,包括以下步骤:
36.1.乙酰化的硫酸软骨素多糖聚合体系(ac-cs)
37.①
对硫酸软骨素(cs)进行乙酰化聚合处理,将硫酸软骨素分散于甲酰胺,快速聚合混匀后,有机试剂吡啶和醋酸酐快速聚合使混合液澄清透明;
38.②
将上述混合液移至分子截留量为1000的透析袋中,用去离子水透析来得到纯化的乙酰化的硫酸软骨素聚合物;
39.③
待透析完后,将溶液进行冻干处理以获得乙酰化的硫酸软骨素(ac-cs) 冻干体系;
40.2.乙酰化的硫酸软骨素多糖聚合体系(ac-cs)与光敏剂二氢卟吩e6(ce6) 的共价接枝,
41.①
乙酰化的硫酸软骨素多糖聚合体系和4-二甲氨基吡啶分别分散至二甲基亚砜分子内部;
42.②
向上述混合体系中分别加入光敏剂二氢卟吩e6、n-羟基琥珀酰亚胺和 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐。
43.③
将乙酰化的硫酸软骨素多糖共价聚合接枝二氢卟吩e6(ac-cs-ce6)的混合纳米药物递送体系转移至分子截留量为1000的透析袋内,用去离子水透析来纯化样品。经过冻干获得最终的高分子聚合载药胶束(ac-cs-ce6)。
44.3.乙酰化的硫酸软骨素多糖共价聚合接枝二氢卟吩e6(ac-cs-ce6)双载化疗药物二氢青蒿素(dha)-被载药物一5和阿霉素dox-被载药物二5,制得dox+dha@ac-cs-ce6纳米药物递送载体
45.①
取二氢青蒿素和阿霉素分散于微量的二甲基亚砜分子内部;
46.②
之后继续分散于少量的四氢呋喃分子内部,同时与之前的乙酰化的硫酸软骨素多糖共价聚合接枝二氢卟吩e6(ac-cs-ce6)同步混合后,超声高速震荡混匀于去离子水分子内部;
47.③
四氢呋喃完全挥发后,将纳米药物递送系统转入分子截留量1000的透析袋内,并用去离子水透析来除去未载入纳米药物递送体系中的二氢青蒿素和阿霉素;冻干获得乙酰化的硫酸软骨素多糖共价聚合接枝二氢卟吩e6 (ac-cs-ce6)双载化疗药物二氢青蒿素与阿霉素即是dox+dha@ac-cs-ce6 纳米药物递送载体。
48.4.光触发活性氧敏感的纳米药物递送载体解体释放二氢青蒿素和阿霉素
49.660nm红光在功率密度0.5w/cm2条件下照射5分钟触发乙酰化的硫酸软骨素多糖共价聚合接枝二氢卟吩e6(ac-cs-ce6)双载化疗药物二氢青蒿素与阿霉素纳米药物递送载体解体从而释放二氢青蒿素与阿霉素。ac-cs-ce6具有活性氧ros敏感性,而ac-cs-ce6胶束在光照660nm下产生的ros能直接破坏硫酸软骨素多糖骨架,从而降解成寡聚糖或单糖。紫外uv-vis所取二氢青蒿素于300nm处的特征紫外吸收,对标dox+dha从载药纳米颗粒释放的累积量,表征二氢青蒿素dha与阿霉素dox的药物累积释放趋势。
50.本实用新型通过载药内核层、靶向识别层、负电荷层和保护层的相互协同,可以提高药物的溶解度,大大延长药物作用时间,大幅度增加药物的肿瘤分布,同时通过光触发活性氧实现药物在肿瘤细胞膜的靶向控释作用提高生物利用度,实现实现光动力转换效应,提高系统生物安全性,同时还能通过跟踪纳米颗粒在体外细胞或者体内组织里的动态位置来引导抗肿瘤治疗进程。
51.虽然结合附图对本实用新型的具体实施方式进行了详细地描述,但不应理解为对本专利的保护范围的限定。在权利要求书所描述的范围内,本领域技术人员不经创造性劳动即可作出的各种修改和变形仍属本专利的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1