改进的骨移植替代配制物的制作方法
改进的骨移植替代配制物
1.相关申请的交叉引用
2.本技术要求2020年1月31日提交的美国临时申请第62/968,794号的优先权权益,其内容以引用方式整体并入。
3.引言
4.骨结构缺损出现在多种情况下,例如创伤、疾病和手术。在各种外科领域,包括颌颅面、牙周病科和骨科都需要有效修复骨缺损。许多天然和合成材料和组合物已用于刺激骨缺损部位的愈合。与用于修复其它类型组织的组合物一样,骨修复材料的生物学和机械特性对于确定材料在任何特定应用中的有效性和适用性很重要。
5.美国专利第9,180,224号公开了骨移植接合剂组合物,所述组合物将理想的吸收率与高机械强度和骨传导性结合在一起。然而,目前可用的合成骨修复配制物和试剂盒并没有为所有骨移植应用提供理想的功能特征。由于许多原因,本领域仍需要将理想的吸收率与易于处理、注射和骨传导性相结合的骨移植胶合剂配制物。
技术实现要素:
6.本公开涉及用于治疗骨囊肿的骨移植替代配制物,所述骨囊肿由于尺寸和/或在体内的位置而难以用已知配制物治疗。大体积的骨囊肿(例如骨盆骨囊肿可具有约20ml至约120ml的空隙;股骨囊肿可具有约20ml至约100ml的空隙;且其它大骨囊肿为至多约200ml)将需要在注射时按顺序制备多个当前可用配制物的注射器,以填充体积。如此大体积的骨囊肿还需要在移植物体积被递送之前不会开始凝固的骨修复配制物。理想情况下,大体积的骨囊肿将用1-3个较大的骨移植材料注射器填充,以确保在凝固之前进行递送。此外,在大注射器中不会凝固的材料将有益地减少患者所需的注射次数。
7.许多囊肿需要第二针头穿刺以进行排气,且在理想情况下,可使用更细和更长的针头或插管填充囊肿,从而使得注射部位尺寸最小。相反,小体积骨缺损需要具有较长凝固时间的骨修复材料配制物,所述配制物可通过细长的针头或插管到达目的地,而无需过度用力以进行施用。类似地,足部和上肢或其它小骨中的软骨下囊肿均需要第二针头用于排气,以及用更细的针头或插管注射配制物。
8.因此,本公开涉及用于治疗骨囊肿的骨移植替代配制物,所述骨囊肿由于尺寸和/或在体内的位置而难以用已知配制物治疗。本公开还涉及用于制备所述配制物的试剂盒,以及使用所述配制物治疗骨损伤的方法。
9.例如,本公开涉及一种骨移植替代配制物,其含有包含半水合硫酸钙粉末、一水合磷酸二氢钙粉末和β-磷酸三钙粉末的微粒组合物组分,其中按微粒组合物组分的总重量计,半水合硫酸钙粉末的存在量为约65重量%至约85重量%;和水溶液组分,其中骨移植替代配制物的液体重量与粉末重量比(l/p)为约0.35至约0.40。本公开还涉及一种如下获得的骨移植替代配制物:通过组合包含半水合硫酸钙粉末、一水合磷酸二氢钙粉末和β-磷酸三钙粉末制备微粒组合物组分,其中按微粒组合物组分的总重量计,半水合硫酸钙粉末的存在量为约65重量%至约85重量%;和组合微粒组合物组分与水溶液组分,其中骨移植替
磷酸三钙颗粒。在本公开的试剂盒的至少一个方面,半水合硫酸钙粉末为α-半水合硫酸钙粉末。
17.在本公开的试剂盒的至少一个方面,所得骨移植替代配制物的液体重量与粉末重量比(l/p)为约0.36。在本公开的试剂盒的至少一个方面,所得骨移植替代配制物的液体重量与粉末重量比(l/p)为约0.39。在本公开的试剂盒的至少一个方面,所得骨移植配制物的注射力为约11n至约40n,其中注射力测量使用14ml注射器(14.4mm id)和11号
×
10cm针头进行,且柱塞位移为4.4mm/s。在本公开的试剂盒的至少一个方面,骨移植胶合剂配制物在干燥环境中的维卡凝固时间为约30分钟至约55分钟。在本公开的试剂盒的至少一个方面,所得骨移植配制物在潮湿环境中的维卡凝固时间为约29分钟至约45分钟。
18.在本公开的试剂盒的至少一个方面,水溶液组分包含约2.7%wt/v至约4.6%wt/v的量的乙醇酸、约1.4%wt/v至约2.4%wt/v的量的氢氧化钠和水。在本公开的试剂盒的至少一个方面,水溶液组分包含约2.8%wt/v至约3.1%wt/v的量的乙醇酸、约1.4%wt/v至约1.7%wt/v的量的氢氧化钠和水。
19.在本公开的试剂盒的至少一个方面,按微粒组合物组分的总重量计,磷酸钙组分的存在量为约14重量%至约34重量%。在本公开的试剂盒的至少一个方面,按微粒组合物组分的总重量计,一水合磷酸二氢钙粉末的存在量为约3重量%至约7重量%。在本公开的试剂盒的至少一个方面,按微粒组合物组分的总重量计,β磷酸三钙粉末的存在量为约4.1重量%至约8.6重量%。在本公开的试剂盒的至少一个方面,按微粒组合物组分的总重量计,β磷酸三钙颗粒(当存在时)的存在量为约8重量%至约12重量%。在本公开的试剂盒的至少一个方面,微粒组合物组分进一步包含促进剂。
20.在本公开的试剂盒的至少一个方面,所得骨移植替代配制物是可注射的。在本公开的试剂盒的至少一个方面,所得骨移植替代配制物能够用作植入物的涂层。在本公开的试剂盒的至少一个方面,所得骨移植替代配制物可通过至多10cm长的11至16号针头与体积为至多60ml的注射器的组合手动注射。在本公开的试剂盒的至少一个方面,表示为每天重量损失的平均百分比的由骨移植替代配制物得到的胶合剂在去离子水中的平均体外溶解率为约6%至约15%。
21.本公开进一步涉及治疗骨缺损的方法,所述方法包括将根据本文所述的任何方面的骨移植替代配制物施用于骨缺损。
22.在本文公开的用于治疗骨缺损的方法的一个方面,骨缺损是具有至多200ml的空隙的大骨囊肿。在本文公开的用于治疗骨缺损的方法的一个方面,骨缺损是具有约25ml至约120ml的空隙的骨盆骨囊肿。在本文公开的用于治疗骨缺损的方法的一个方面,骨缺损是具有约25ml至约100ml的空隙的股骨囊肿。在本文公开的用于治疗骨缺损的方法的一个方面,骨移植替代配制物用40ml注射器(24.2mm id)和16号
×
6cm针头施用。在本文公开的用于治疗骨缺损的方法的一个方面,骨移植替代配制物用40ml注射器(24.2mm id)和15号
×
4英寸针头施用。在本文公开的用于治疗骨缺损的方法的一个方面,骨移植替代配制物用40ml注射器(24.2mm id)和13号
×
10cm针头施用。在本文公开的用于治疗骨缺损的方法的一个方面,所述骨缺损是小体积骨缺损,例如软骨下囊肿。在本文公开的用于治疗骨缺损的方法的一个方面,缺损位于小骨中,除了用于注射配制物的细针头或插管外,还需要第二针头用于排气。在本文公开的用于治疗骨缺损的方法的一个方面,骨缺损具有约2ml至约5ml
的空隙。在本文公开的用于治疗骨缺损的方法的一个方面,骨移植替代配制物用14ml注射器(14.4mm id)和16号
×
6cm针头施用。在本文公开的用于治疗骨缺损的方法的一个方面,骨移植替代配制物用14ml注射器(14.4mm id)和16号
×
10cm插管施用。在本文公开的用于治疗骨缺损的方法的一个方面,骨移植替代配制物用14ml注射器(14.4mm id)和15号
×
4英寸针头施用。在本文公开的用于治疗骨缺损的方法的一个方面,骨移植替代配制物用14ml注射器(14.4mm id)和13号
×
10cm针头施用。
附图说明
23.已经如此概括地描述了本公开,现在将参看附图,其中:
24.图1图示了骨移植替代配制物的注射力与配制物的l/p比之间的关系,其中使用了如实施例1中所述的水溶液as2。
25.图2图示了骨移植替代配制物的注射力与配制物的l/p比之间的关系,其中使用了如实施例1中所述的水溶液as1、as30、as3和as4。
26.图3图示了如实施例2中所述的与使用具有不同尺寸的针头的14ml注射器注射约7cc示例性移植物相关的注射力。
27.图4图示了如实施例2中所述的与使用具有不同尺寸的针头的40ml注射器注射约25cc示例性移植物相关的注射力。
28.图5图示了如实施例3中所述的使用14ml注射器进行多次注射的工作时间。
29.图6图示了如实施例3中所述的使用40ml注射器进行多次注射的工作时间。
30.图7图示了如实施例4中所述的使用14ml注射器进行单次注射的工作时间。
31.图8图示了如实施例4中所述的使用40ml注射器进行单次注射的工作时间。
具体实施方式
32.现在将详细参考本公开的某些方面,其实例在附图中示出。尽管将结合图示的方面来描述本公开,但是应理解,它们并不旨在将本公开限制于那些方面。相反,本公开旨在涵盖所有替代、修改和等效物,它们可以包括在由所附权利要求书限定的公开内容内。
33.本文所使用的小节标题仅出于组织性目的并且不解释为以任何方式限制所需主题。在以引用方式并入的任何文献与本说明书中定义的任何术语相矛盾的情况下,以本说明书为准。尽管结合各个方面描述了本教导,但并不旨在将本教导限于这些方面。相反,本教导包括本领域技术人员将理解的各种替代、修改和等效物。
34.本文提及“约”一个值或参数还包括(和描述)涉及所述值或参数本身的方面。
35.除非上下文另有明确规定,否则在本文和所附权利要求书中使用的单数形式“一(a/an)”和“所述”包括复数个指示物。
36.应理解,本文所述的本公开的所有方面和实施方案可包括“包含”方面和实施方案、“由”其“组成”和“基本上由”其“组成”。应理解,“基本上由”所述要素“组成”的方法或组合物仅包括指定的步骤或材料,以及那些不实质影响那些方法和组合物的基本和新颖特征的步骤或材料。
37.例如,已经在美国专利第9,180,224号中描述了骨移植胶合剂粉末。然而,美国专利第9,180,224号中教导的配制物要保持约0.2至约0.3,且优选约0.2至约0.25范围内的液
体与粉末重量比(l/p)。此外,美国专利第9,180,224号论述了如果需要将凝固时间调整为更快凝固,则在粉末中使用促进剂。令人惊讶的是,已经发现液体与粉末比(l/p)为约0.35至约0.40、例如约0.36至约0.39的骨移植替代配制物具有显著更长的凝固时间。更令人惊讶的是,尽管在l/p为约0.35至约0.40的所公开配制物中存在额外液体,但对应硬化胶合剂的体外溶解率与具有较低l/p比的本领域配制物形成的硬化胶合剂相当,如以下实施例中所述地测量。此外,l/p比为约0.35至约0.40的配制物需要显著降低施用所需的注射力。
38.本文所述配制物的改进的可工作性特征(更长的凝固时间和更低的注射力)允许在更大的注射器中使用以填充大骨囊肿体积,以及允许在细长的针头中用于小骨缺损和较大缺损,期望或需要所述缺损对骨周围的组织的破坏非常小。此外,本文公开的配制物具有较长的凝固时间和较低的注射力,可治疗大体积骨囊肿以及脆弱的骨损伤,例如软骨下囊肿,而不影响其溶解率,以及最终用新骨替代。相当的溶解率使得所公开的配制物一旦在需要修复的骨内凝固就可以提供与现有技术配制物相同的吸收行为。如下文更详细论述的,据信由于混合物的硫酸钙组分的相对快速吸收,本公开的骨移植替代配制物在体内施用后将变成磷酸钙材料的高度多孔基质。剩余的磷酸钙多孔基质为自然愈合过程中的骨长入提供了极好的支架。
39.本文所述的配制物由可用作骨移植替代物的微粒组合物制成,所述微粒组合物在与水溶液混合后开始硬化或凝固。如本文所用,术语“凝固时间”、“维卡凝固时间”、“维卡针落测试”等是指根据以下“实验”部分中详细描述的“用于凝固时间测量的维卡针落测试”的测量值。微粒组合物包括半水合硫酸钙(下文称为“csh”)粉末和包含一水合磷酸二氢钙(下文称为“mcpm”)粉末和β-磷酸三钙(下文称为“β-tcp”)粉末的形成透钙磷石的磷酸钙混合物。包括β-tcp颗粒将提供具有三相吸收的移植物。
40.使用本文公开的配制物产生包含二水合硫酸钙(下文称为“csd”)的骨移植替代胶合剂,csd是csh与水之间反应的产物。胶合剂的csd组分赋予胶合剂良好的机械强度,刺激骨生长,并相对较快地被吸收,从而在植入时迅速产生胶合剂的互连多孔结构。因此,胶合剂的csd组分可以迅速被骨组织向植入部位内生长所取代。
41.两种磷酸钙组分在与水溶液混合时反应形成透钙磷石。与仅包含csd的胶合剂相比,胶合剂中透钙磷石的存在减慢了骨移植替代胶合剂的吸收率。因此,本公开的双相骨移植替代配制物提供了由csd组分和透钙磷石组分定义的双重吸收率。
42.本文所公开的配制物的微粒组合物包含按微粒组合物组分的总重量计约65重量%至约85重量%的量的csh粉末。例如,csh粉末以约70重量%至约80重量%,例如约75重量%的量存在。
43.在本公开的至少一个方面,本文公开的配制物的csh是α-半水合硫酸钙,与β形式相比,其在凝固形成csd时表现出更高的机械强度。微粒组合物的csh部分对于为所得骨移植替代接合剂提供机械强度以及有助于在相对较短时间段内凝固或硬化的能力很重要。如本领域已知的,csh具有式caso4·
1/2h2o,并且将与水反应形成二水合硫酸钙(caso4·
h2o)。据信,用本公开的配制物形成的骨移植替代接合剂中csd的存在有助于骨缺损部位的骨组织的快速再生。
44.在一个方面,csh粉末进一步包括能够加速csh转化为二水合物形式的促进剂。促进剂的实例包括二水合硫酸钙、硫酸钾、硫酸钠或其它离子盐。在本公开的一个方面,促进
剂是涂有蔗糖(可从vwr scientific products获得)的二水合硫酸钙晶体(可从u.s.gypsum获得)。按微粒组合物组分的总重量计,促进剂典型地以至多约1.0重量%的量存在。在一些方面,微粒组合物包括约0.001至约0.5重量%、更典型地约0.01至约0.3重量%的促进剂。
45.本公开的微粒组合物组分的磷酸钙部分包含mcpm粉末(ca(h2po4)2·
h2o)和β-tcp粉末(ca3(po4)2)。如本领域所理解的,mcpm与β-tcp的主要反应产物是透钙磷石,也称为二水合磷酸二钙(cahpo4·
h2o)(dcpd)。形成透钙磷石的粉末还可参与其它反应,所述反应将导致形成具有比dcpd更高的热力学稳定性的某些磷酸钙,例如羟基磷灰石、磷酸八钙等。一定量的β-tcp粉末还可在胶合剂中保持未反应。
46.如将理解的,mcpm是磷酸二氢钙(mcp)的水合物形式。如本文所用,提及mcpm旨在包括mcp,mcp只是mcpm的无水形式,在溶液中释放相同数量的钙离子和磷酸离子。然而,如果使用mcp代替mcpm,则将需要增加用于形成骨移植替代胶合剂的水量,以考虑mcp中缺少的水分子(如果希望产生与使用mcpm时所形成完全相同的溶解产物)。
47.如本文所述,与硫酸钙胶合剂相比,本公开的骨移植替代胶合剂的透钙磷石组分用于减缓骨移植替代胶合剂的体内吸收。反过来,透钙磷石组分的吸收率减慢可使骨移植替代胶合剂能够在骨缺损部位提供更长时间段的结构支撑,这可能有助于某些应用中的愈合过程。尽管不受任何特定操作理论束缚,但据信本公开的骨移植替代配制物在体内施用后由于混合物的硫酸钙组分的相对快速吸收将变成磷酸钙材料的高度多孔基质。剩余的磷酸钙多孔基质为自然愈合过程中的骨长入提供了极好的支架。
48.存在于微粒组合物组分中的mcpm粉末和β-tcp粉末的量可以变化并且主要取决于骨移植替代胶合剂中所需的透钙磷石的量。按微粒组合物组分的总重量计,形成透钙磷石的磷酸钙组合物(即,mcpm和β-tcp粉末的组合量)的存在量将典型地为约8至约34重量%,例如约10至约20重量%,例如约15重量%。mcpm和β-tcp的相对量可基于它们在透钙磷石形成反应中的等摩尔化学计量关系进行选择。在一个方面,按微粒组合物组分的总重量计,mcpm粉末的存在量为约3至约7重量%,且β-tcp的存在量为约4.1至约8.6重量%。
49.将形成透钙磷石的磷酸钙粉末一起储存在均匀混合物中可导致在将微粒组合物组分与水溶液组分混合以形成骨移植替代胶合剂时产生的透钙磷石的量减少,这继而可以不希望的方式改变骨移植替代配制物的特性。结果,在至少一个方面,两种磷酸钙粉末或者在干燥环境中包装在一起并且在储存期间密封以防止水分侵入,或者在储存期间独立包装。在至少一个方面,两种磷酸钙粉末独立包装,其中每种粉末或者单独包装而没有本公开的微粒组合物的其它组分,或者与一种或多种剩余组分(例如csh粉末)混合。
50.在某些方面,本公开的微粒组合物组分还将包括多个中值粒度大于β-tcp粉末的中值粒度的β-tcp颗粒。β-tcp颗粒典型地具有约75至约1,000微米、如约100至约400微米且例如约180至约240微米的中值粒度。所述颗粒用于进一步降低骨移植替代胶合剂的吸收率并有助于支架形成。β-tcp颗粒典型地以按微粒组合物组分的总重量计至多约20重量%,例如按微粒组合物组分的总重量计至多约15重量%,例如至多约10重量%的量存在。在至少一个方面,β-tcp颗粒以微粒组合物组分的约8至约12重量%的量存在。β-tcp颗粒可在最终胶合剂中提供相对惰性的第三相,其展现的吸收率比由mcpm与β-tcp粉末反应形成的透钙磷石还要慢。因此,颗粒的存在可进一步改变所得骨移植替代胶合剂的吸收特性。
51.本公开中使用的β-tcp颗粒和β-tcp粉末均可使用市售的β-tcp粉末作为起始材料形成,例如可从plasma biotal ltd.(derbyshire,uk)获得的β-tcp粉末。在一个方面,微粒组合物的β-tcp组分通过首先在球磨机中将市售的β-tcp粉末湿磨至小于1.0微米的中值粒度,且接着通过过滤器排出所得浆料以去除研磨介质而形成。此后,可使用本领域已知的多种技术中的任一种,例如离心、重力分离、压滤、蒸发等将β-tcp的固体饼与任何剩余的液体组分分离。接着将干饼通过一系列筛进行处理,以产生两种具有不同中值粒度的独立β-tcp组分。干燥的β-tcp饼典型地在筛分期间或之前进行研磨以使饼破碎。在至少一个方面,筛系统产生粒度范围为约125至约355微米的生坯(即未烧制)状态的β-tcp组分和粒度范围为约75至约355微米的生坯状态的另一β-tcp组分。此后,通过在炉中进行热处理,将两种β-tcp组分烧结且从而致密化。在一个方面,炉处理包括在约1100-1200℃的温度下加热氧化铝板上的β-tcp粉末组分约三个小时。典型地将温度升高至所需的烧结温度,且在冷却期间以不大于约5-6℃/分钟的速率使温度回落。
52.在烧结过程之后,具有约125至约355微米的生坯状态粒度的致密β-tcp颗粒可用作微粒组合物的颗粒组分。具有约75至约355微米的生坯(即未烧制)状态粒度的烧结β-tcp组分可在球磨机中干磨大约一至四小时,以形成具有小于约20微米的中值粒度的β-tcp粉末,接着可将其用于本文所述的微粒组合物组分中。
53.选择与微粒组合物组分混合以形成本公开的骨移植替代配制物的水性组分以提供具有所需稠度和硬化或凝固时间的配制物。以达到至少约0.35、更优选至少约0.36的液体与粉末质量比(l/p)所需的量提供水溶液。优选的l/p范围为约0.35至约0.40,更优选约0.36至约0.39。
54.合适的水性组分的实例包括水(例如无菌水、去离子水)和其与乙醇酸的溶液,任选地包括一种或多种选自由以下组成的组的添加剂:氯化钠、氯化钾、硫酸钠、硫酸钾、edta、硫酸铵、乙酸铵和乙酸钠。在一个方面,所用的水性混合溶液是盐水溶液或磷酸盐缓冲盐水溶液。示例性水溶液是水,例如可从baxter international(deerfield,ill.)等获得的灌溉用水(water for irrigation)。另一种水溶液是可从baxter international(deerfield,ill.)等获得的0.9%nacl盐水溶液。在至少一个方面,混合溶液是使用naoh中和至ph 7.0的0.6m乙醇酸溶液。在至少一个方面,水溶液是使用naoh中和至ph 7.0的约0.36m乙醇酸溶液。在至少一方面,水溶液是使用naoh中和至ph 7.0的约0.39m乙醇酸溶液。在至少一方面,水溶液是使用naoh中和至ph7.0的约0.4m乙醇酸溶液。在至少一个方面,水溶液是使用naoh中和至ph 7.0的约0.5m乙醇酸溶液。在至少一个方面,水溶液包含约2.7%重量/体积(wt/v)至约4.6%wt/v的量的乙醇酸、约1.4%wt/v至约2.4%wt/v的量的氢氧化钠和水的组合。在至少一个方面,水溶液包含约2.8%wt/v至约3.1%wt/v的量的乙醇酸、约1.4%wt/v至约1.7%wt/v的量的氢氧化钠和水的组合。在至少一个方面,水是去离子水。本文提及的乙醇酸包括游离酸和盐形式两者。
55.根据本公开的骨移植替代配制物可通过使用本领域已知的手动或机械混合技术和设备将微粒组合物组分与水溶液组分混合来形成。在本公开的一个方面,配制物的组分在大气压和不会导致混合物的水性组分冻结或显著蒸发的温度下混合。在本公开的另一方面,配制物的组分在低于大气压下(例如在真空下)混合。混合后,均匀组合物典型地具有糊状稠度,但混合物的粘度和流动性可根据其中的添加剂而变化。骨移植替代配制物可在递
送装置中混合,或可在干净的容器中混合且接着转移至递送装置,例如注射器,并注射至目标部位,例如以填充骨缺损的裂缝或空隙。在一些方面,配制物可以通过经由例如至多10厘米长的11至16号针头与体积为至多60ml的注射器的组合进行手动压缩来注射。与40ml注射器一起使用的针头尺寸的非限制性实例包括16号
×
6cm针头;16号
×
10cm插管;15号
×
4英寸针头;13号
×
10cm针头;和具有类似长度的更大针头。
56.如本文所论述,根据维卡针落测试,本公开的骨移植替代配制物与具有较低液体与粉末比的现有配制物相比表现出更长的凝固时间,但保持相当的溶解率。如本文所用,术语“凝固时间”、“维卡针落测试”、“维卡凝固时间”等是指根据以下“实验”部分中详细描述的“用于凝固时间测量的维卡针落测试”的测量值。本公开的骨移植替代配制物通常将展现约30至约55分钟、更优选约37至约45分钟的干燥环境中的维卡凝固时间。本公开的骨移植替代配制物通常将展现约29至约45分钟、更优选约30至约37分钟的湿润环境中的维卡针凝固时间。配制物的凝固可发生在各种环境中,包括空气、水、体内以及在任何数量的体外条件下。
57.如本文所论述,本公开的骨移植替代配制物保持与具有较低液体与粉末比的现有配制物相当的胶合剂溶解率。胶合剂晶格结构的溶解率可导致缺损内及时的后续新骨生长。如本文所用,术语“溶解率”、“胶合剂溶解率”、“体外溶解率”等是指根据以下“实验”部分中详细描述的“胶合剂溶解测试测量”的测量值。来自本文公开的配制物的骨移植替代胶合剂表现出约6%至约15%的由骨移植替代配制物得到的胶合剂在去离子水中的平均体外溶解率,所述溶解率表示为每天重量损失的平均百分比,如下所述地测量。表示为每天重量损失的平均百分比的去离子水中的体外溶解率是通过从100减去四天后剩余的百分比(由胶合剂溶解测试确定)并除以4来计算。
58.本公开的骨移植替代配制物的注射力为约11n至约40n,其中注射力测量使用14ml注射器(14.4mm内径(id))和11号
×
6cm针头进行,且柱塞位移为4.4mm/s。如本文所用,“注射力”是指根据以下“实验”部分中详细描述的“注射力”的测量值。
59.当用于本方法时,本文公开的骨移植替代配制物可以有利地具有延长的工作时间。较长的工作时间在外科手术过程中是有益的,因为它为外科医生提供了额外的时间和灵活性,并减少了骨替代剂的浪费和由于制备额外的骨移植替代配制物而导致的手术延误。如本文所用的“工作时间”在实施例中进行了描述,且可取决于注射器的体积(例如14ml或40ml)以及所使用的骨移植替代配制物的体积。
60.本公开的骨移植替代配制物可进一步包括本领域已知的其它添加剂。添加剂可作为固体或液体添加至本公开的微粒组合物或水性混合溶液中。用于硫酸钙组合物的添加剂的一个实例是设计用于改变组合物的稠度和凝固时间的增塑剂。这种增塑成分可延缓半水合硫酸钙糊状物的凝固,从而增加组合物在与水溶液混合后凝固所需的时间。示例性增塑剂包括甘油和其它多元醇、乙烯醇、硬脂酸、透明质酸、纤维素衍生物和其混合物。作为增塑剂成分,烷基纤维素是特别优选的。示例性烷基纤维素包括甲基羟丙基纤维素、甲基纤维素、乙基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、羧甲基纤维素、乙酸丁酸纤维素和其混合物或盐。
61.示例性添加剂还包括生物活性剂。如本文所用,术语“生物活性剂”是指提供一些可在体内或体外证明的药理作用的任何药剂、药物、化合物、物质组合物或混合物。生物活
性剂的实例包括但不限于肽、蛋白质、酶、小分子药物、染料、脂质、核苷、寡核苷酸、多核苷酸、核酸、细胞、病毒、脂质体、微粒和胶束。它包括对患者产生局部或全身作用的药剂。
62.在至少一个方面,生物活性剂的种类包括骨诱导或骨传导材料、抗生素、化疗剂、杀虫剂(例如抗真菌剂和抗寄生虫剂)、抗病毒剂、抗炎剂和镇痛剂。示例性抗生素包括环丙沙星(ciprofloxacin)、四环素、土霉素(oxytetracycline)、金霉素(chlorotetracycline)、头孢菌素(cephalosporins)、氨基糖苷类(例如妥布霉素(tobramycin)、卡那霉素(kanamycin)、新霉素、红霉素、万古霉素(vancomycin)、庆大霉素(gentamycin)和链霉素)、杆菌肽、利福平(rifampicin)、n-二甲基利福平、氯霉素和其衍生物。示例性化疗剂包括顺铂、5-氟尿嘧啶(5-fu)、紫杉醇和/或泰索帝(taxotere)、异环磷酰胺、甲氨蝶呤(methotrexate)和盐酸阿霉素。示例性镇痛剂包括盐酸利多卡因(lidocaine hydrochloride)、比哌卡因(bipivacaine)和非甾体抗炎药,例如酮咯酸氨丁三醇。示例性抗病毒剂包括更昔洛韦(gancyclovir)、齐多夫定(zidovudine)、金刚烷胺、阿糖腺苷、利巴韦林(ribaravin)、曲氟尿苷、阿昔洛韦(acyclovir)、双脱氧尿苷、针对病毒组分或基因产物的抗体、细胞因子和白介素。示例性抗寄生虫剂为喷他脒(pentamidine)。示例性抗炎剂包括c-1-抗胰蛋白酶和c-1-抗糜蛋白酶。
63.有用的抗真菌剂包括大扶康(diflucan)、酮康唑(ketaconizole)、制霉菌素(nystatin)、灰黄霉素(griseofulvin)、米可定(mycostatin)、咪康唑(miconazole)和其衍生物,如全部教导均以引用方式并入本文中的美国专利第3,717,655号中所述;双二胍,例如洗必泰(chlorhexidine);且更具体地说季铵化合物,例如溴化度米芬(domiphen)、氯化度米芬、氟化度米芬、苯扎氯铵(benzalkonium chloride)、氯化十六烷基吡啶鎓、地喹氯铵(dequalinium chloride)、1-(3-氯烯丙基)-3,5,7-三氮杂-1-氮阳离子金刚烷氯化物(可从dow chemical company以商标dowicil 200商购)的顺式异构体和其类似物,如全部教导均以引用方式并入本文中的美国专利第3,228,828号所述、十六烷基三甲基溴化铵以及苄索氯铵(benzethonium chloride)和甲基苄索氯铵,例如全部教导均以引用方式并入本文中的美国专利第2,170,111号、第2,115,250号和第2,229,024号中所述;碳酰替苯胺(carbanilide)和水杨酰苯胺(salicylanilide),例如3,4,4-三氯碳酰替苯胺和3,4,5-三溴水杨酰苯胺;羟基联苯,例如二氯酚(dichlorophene)、四氯酚(tetrachlorophene)、六氯酚(hexachlorophene)和2,4,4-三氯-2'-羟基二苯醚,以及有机金属和卤素防腐剂,例如吡啶硫酮锌、磺胺嘧啶银(silver sulfadiazone)、尿嘧啶银、碘等,且例如全部教导均以引用方式并入本文中的美国专利第2,710,277号和第2,977,315号中所述,以及聚乙烯吡咯烷酮,例如全部教导均以引用方式并入本文中的美国专利第2,706,701号、第2,826,532号和第2,900,305号中所述。
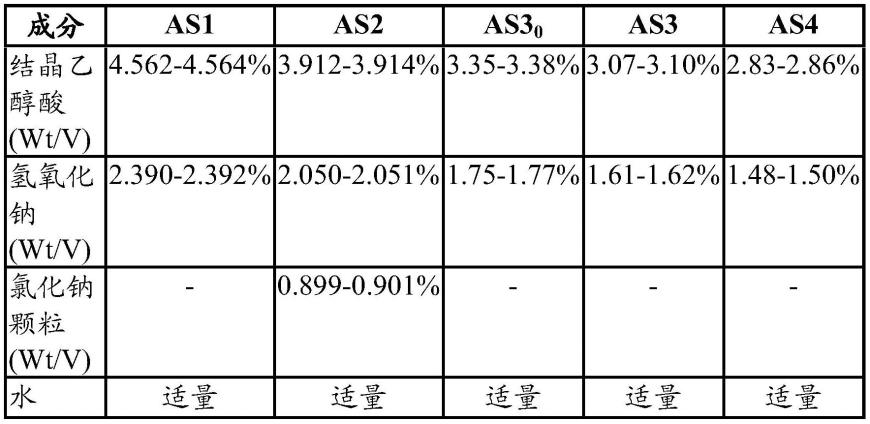
64.如本文所用,术语“生长因子”包括调节其它细胞,特别是结缔组织祖细胞的生长或分化的任何细胞产物。
65.可根据本公开使用的生长因子包括但不限于成纤维细胞生长因子(例如fgf-1、fgf-2、fgf-4);血小板衍生生长因子(pdgf),包括pdgf-ab、pdgf-bb和pdgf-aa;骨形态发生蛋白(bmp),例如bmp-1至bmp-18中的任一种;成骨蛋白(例如op-1、op-2或op-3);转化生长因子-o、转化生长因子-b(例如(b1、b2或b3);lim矿化蛋白(lmp);类骨质诱导因子(oif);血管生成素;内皮素;生长分化因子(gdf);admp 1;肝细胞生长因子和角质形成细胞生长因
子、成骨素(骨形态发生蛋白-3);肝素结合生长因子(hbgf),例如hbgf-1和hbgf-2;刺猬蛋白家族,包括印度刺猬、音猬和沙漠刺猬;白细胞介素(il),包括il-1至-6;集落刺激因子(csf),包括csf-1、g-csf和gm-csf;上皮生长因子(egf);和胰岛素样生长因子(例如igf-i和-ii);脱矿质骨基质(dbm);细胞因子;骨桥蛋白;和骨粘连蛋白,包括上述蛋白质的任何同种型。微粒dbm是一种优选的骨诱导添加剂。
66.生物活性剂也可以是抗体。合适的抗体包括例如stro-1、sh-2、sh-3、sh-4、sb-10、sb-20和碱性磷酸酶抗体。此类抗体描述于haynesworth等,bone(1992),13:69-80;bruder,s.等,trans ortho res soc(1996),21:574;haynesworth,s.e.等,bone(1992),13:69-80;stewart,k.等,j bone miner res(1996),11(增刊):s142;flemming je等,“embryonic human skin.”developmental dynamics.212:119-132,(1998);和bruder s.p.等,bone(1997),21(3):225-235中,其全部教导以引用方式并入本文中。
67.生物活性剂的其它实例包括骨髓抽吸物、血小板浓缩物、血液、同种异体骨、松质骨片、合成衍生或天然衍生的矿物质片(例如磷酸钙或碳酸钙)、间充质干细胞和硫酸钙的大块、碎片和/或球粒。
68.本公开还涉及包含本公开配制物的组分的骨移植替代物试剂盒。典型地,试剂盒包含一个或多个封装如本文所述的微粒组合物组分的容器和一个或多个封装无菌水溶液的独立容器。试剂盒将典型地含有描述试剂盒使用方法的书面说明集。在本公开的至少一个方面,骨移植替代试剂盒将包含用于将微粒组合物组分与水溶液混合以形成骨移植配制物的设备,例如真空混合设备。另外,试剂盒将典型地包括用于将骨移植配制物递送至骨缺损部位的装置,例如注射装置(例如针头和注射器)。
69.在至少一个方面,微粒组合物组分和无菌水溶液组分将在包装于试剂盒中之前通过辐照灭菌。
70.如本文所述,在某些方面,本公开的试剂盒会将两种磷酸钙粉末组分分离至不同的容器或隔室中以避免储存期间的反应。有许多包装配置可实现这一目标。例如,在一个方面,试剂盒包括一个用于csh粉末的容器、一个用于β-tcp粉末的容器和一个用于mcpm粉末的容器。在另一方面,试剂盒包括用于微粒组合物组分的两个容器,一个容器包括β-tcp粉末和csh组分,且第二容器含有mcpm粉末。在另一方面,mcpm粉末单独包装在独立容器中,并且β-tcp粉末和csh粉末包装在一起,但在独立隔室中。在至少一个方面,csh是α-半水合硫酸钙粉末。在至少一个方面,试剂盒进一步包括β-磷酸三钙颗粒。
71.在本文所述的任何方面,任何微粒容器可进一步包括乙醇酸盐的结晶粉末和/或β-tcp颗粒,或这些组分可独立包装在它们自己的容器中。当存在时,适于加速csh向csd转化的促进剂典型地与csh粉末混合。在至少一个方面,试剂盒包括一个封装mcpm粉末的容器,和封装混合的剩余微粒成分的第二容器。例如csh粉末、csh促进剂、β-tcp粉末、β-tcp颗粒和乙醇酸结晶粉末中的一种或多种。
72.在至少一个方面,将粉末形式的乙醇酸独立包装,以便必要时,在将溶液与剩余微粒组分混合之前,它可以在水溶液中复原。然而,试剂盒的水溶液组分也可含有溶液形式的乙醇酸。在至少一个方面,乙醇酸是在对试剂盒的水性组分辐照灭菌之后添加的。
73.重要的是要利用试剂盒中包装的所有水溶液组分,以确保达到一致的凝固时间。在至少一个方面,水溶液组分被包装在高度疏水的容器中,例如玻璃注射器或其它玻璃容
器,其不易滞留会使骨移植替代胶合剂的性能特征发生变化的量的残留溶液。
74.本公开还提供了治疗骨缺损的方法,所述方法包括将本文所述的骨移植替代配制物施用于骨缺损部位。在混合微粒组合物组分与水溶液组分后,例如在凝固前通过注射装置以可流动形式施用骨移植替代配制物。在至少一个方面,骨缺损是大体积骨囊肿,例如空隙为约25ml至约120ml的骨盆骨囊肿;空隙为约25ml至100ml的股骨囊肿;和其它至多约200ml的大骨囊肿。在至少一个方面,可通过手动压缩40ml注射器(24.2mm id)并通过针头,例如16号、6cm针头;15号
×
4英寸针头;13号
×
10cm针头;或具有类似长度的更大针头进行施用。在至少一个方面,骨缺损是小体积骨缺损,例如软骨下囊肿,例如在足部或上肢中。在至少一个方面,缺损在小骨中,除了用于注射配制物的细针头或插管外,还需要第二针头用于排气。在至少一个方面,骨缺损的大小为约2ml至约5ml,并且可通过手动压缩14ml注射器(14.4mm id)并通过针头,例如18号
×
6英寸针头;16号
×
6cm针头;16号
×
10cm插管;15号
×
4英寸针头;13号
×
10cm针头;或更长的更大针头进行施用。
75.在另一方面,本公开的骨移植替代配制物可掺入骨科植入物之上或之中(例如作为涂层),例如适于关节置换的各种装置中的任一种。骨移植替代配制物典型地作为外涂层或作为装置的多孔外部组件的孔内的填充材料掺入此类装置中。在这方面,骨移植替代配制物有利于植入装置周围区域的骨长入。示例性骨科植入物包括膝关节置换装置(例如约束型或非约束型膝关节植入装置、铰接膝关节装置、金属平台膝关节装置和髌骨装置)、髋关节置换装置(例如髋臼组件和股骨组件)、肘关节置换装置(例如约束型、半约束型和非约束型装置)、股骨上端装置、肱骨上端装置、腕关节置换装置(例如半约束型2部分和3部分关节装置)、肩部装置、被动肌腱装置、脊柱装置(例如胸腰椎固定装置、颈椎固定装置和脊柱融合器)、手指/脚趾装置、骨干装置和克氏针(k-wire)。
76.本公开将通过以下非限制性实施例进一步说明。
77.实验
78.以下实施例证明了骨替代移植配制物的改进的可工作性(更长的凝固时间和更低的注射力),同时保持了硬化骨移植材料的所需溶解特性。改进的可工作性特性允许在更大的注射器中使用以填充大骨囊肿体积,以及允许在细长的针头中用于小骨缺损和/或较大缺损,期望或需要所述缺损对骨周围的组织的破坏非常小。
79.用于凝固时间测量的维卡针落测试-干燥环境
80.使用直径1mm、长5cm且总重量为300g的维卡针测量凝固时间。在astm c-472中可以找到有关vicat设备的更详细说明。以产生均匀、可流动糊状物的方式混合被测试的样品。维卡针落测试的样品大小范围为在大约5ml聚乙烯杯中轻敲成饼的约3cc至约5cc材料。或者,维卡针落测试的样品大小范围为在大约20ml聚乙烯杯中轻敲成饼的约10cc至约15cc材料。根据维卡针落测试的凝固时间定义为水溶液接触微粒组合物的时间与维卡针从胶合剂样品的上表面落下后不会穿过样品高度的50%的时间之间经过的时间量。使针在其自身重量的作用下,仅在重力作用下,通过垂直于圆柱状样品饼的顶部和底部平面的线落下。针典型地在第一次落下后每60秒落下一次,且在凝固时间接近时每30秒落下一次。杯、混合装备和材料转移装备没有被重复使用。
81.用于凝固时间测量的维卡针落测试-潮湿环境
82.使用直径1mm、长5cm且总重量为300g的维卡针测量凝固时间。在astm c-472中可
以找到有关vicat设备的更详细说明。以产生均匀、可流动糊状物的方式混合被测试的样品。维卡针落测试的样品大小范围为在大约5ml聚乙烯杯中轻敲成饼的约3cc至约5cc材料。或者,维卡针落测试的样品大小范围为在大约20ml聚乙烯杯中轻敲成饼的约10cc至约15cc材料。对于湿试样测试,通过在聚乙烯杯的内表面刮下一小抹刀而在样品与20ml聚乙烯杯之间产生一个窄通道。使用小注射器,用加热至37℃的小牛血清填充间隙;至多大约1mm厚的血清层流到试样顶部。根据维卡针落测试的凝固时间定义为水溶液接触微粒组合物的时间与维卡针从胶合剂样品的上表面落下后不会穿过样品高度的50%的时间之间经过的时间量。使针在其自身重量的作用下,仅在重力作用下,通过垂直于圆柱状样品饼的顶部和底部平面的线落下。针典型地在第一次落下后每60秒落下一次,且在凝固时间接近时每30秒落下一次。杯、混合装备和材料转移装备没有被重复使用。
83.胶合剂溶解测试测量
84.通过以下方法确定材料的溶解率。将试样在硅胶模具中浇铸成尺寸为4.8mm外径和3.3mm高的圆柱体。使用含有圆柱形空隙的3.3mm厚的硅胶片材作为模具。圆柱形空隙的外径为4.8mm且高为3.3mm,并定向为使得空隙的圆形面与硅胶片材的表面平行且在同一平面内。
85.将一个薄聚乙烯片材放在桌子上。将聚乙烯网状物置于聚乙烯片材的顶部;片材和网状物具有相同的尺寸(不包括厚度)并且定位成使得网状物从顶部遮盖片材。接下来,将较小尺寸的硅胶模具放置在网状物的顶部(不包括厚度)。模具的任何部分都没有挂在网状物或片材的边缘。
86.接着将要测试的材料混合在一起形成均匀的糊状物。接着使用抹刀将糊状物擦过模具顶部,使空隙与材料填充在一起。当模具被填充时,网状物允许空气从空隙中排出。进行了几次擦拭以确保材料完全渗透到模具底部并通过网状物挤出并且挤到下部聚乙烯片材上。用抹刀在模具顶部进行最后一次擦拭,以去除大部分多余的材料,并为试样产生光滑的顶面。
87.接着将与第一聚乙烯片材尺寸相同的另一聚乙烯片材放置在模具顶部,使其完全覆盖模具顶部。接着用手指以轻柔的摩擦动作将此片材轻轻地压在模具上。
88.整个系统:片材、网状物、模具和片材接着作为一个整体被拾起并以原来的顶部现在朝下的方式翻转。顶部聚乙烯片材(最初是底部)和网状物被去除,并且再次使用抹刀将材料擦拭到由于去除空气而产生的试样顶部(之前是底部)的空隙中。用抹刀在模具顶部进行最后一次擦拭,以去除大部分多余的材料。将片材(无网状物)返回到模具顶部。
89.在第二聚乙烯片材与试样和模具(无网状物)直接接触后,将试样留在模具中固化至少8小时。在至少8小时过去后,用手将试样脱模。通过在手指间滚动试样来去除任何仍附着在球粒表面上的飞边。所有有缺陷的试样都被取消测试资格并被丢弃。有缺陷的试样被定义为不呈现圆柱形的试样,这可能是由夹带的空气、脱模时产生的缺陷和/或试样本身的物理损坏造成的。
90.所有无缺陷的试样都以单层形式散布在盘或托盘上。接着将盘或托盘和试样在40℃的烘箱中干燥至少4小时,且接着从烘箱中取出并使其在室内条件(21-27℃;20-50%相对湿度)下冷却30分钟。从产生的试样中,任意选择五(5)个试样用于溶解测试。选择的每个试样都与一个干净的圆柱形烧结玻璃提取套管配对,所述套管具有以下尺寸:大约85-90mm
的总高度、距套管顶部80mm的4mm装配玻璃底座(40-60微米孔)、25mm外径和22mm内径。测量每个提取套管的质量(0.01mg)并记录。测量每个试样的质量(0.01mg)并记录。为每对(试样和套管)指定一个聚乙烯瓶(300ml)。瓶的尺寸使得套管和试样可容易地放入瓶中和从瓶中取出,并在填充275ml水时产生一个比套管高的水柱。在室温(21-27℃)下,向瓶中填充275ml去离子水。
91.将试样放入其对应的套管中,且将套管放入瓶中;注意防止材料的任何部分从套管中漏出。将瓶盖上盖子并放入37℃的水浴中,不搅拌,并记录时间。试样浸入水中24小时后,取回含有试样的套管。使水通过烧结玻璃底座从套管中排出。接着将含有试样的套管在40℃烘箱中干燥4小时或直至完全干燥(通过重量法测定)。接着使含有试样的套管在室内条件(21-27℃;20-50%相对湿度)下冷却30分钟。
92.接着将含有球粒的套管称重至0.01mg的精度。从组合的质量中减去已知的空套管质量,得到单独的试样质量。从初始试样质量中减去此质量产生因溶解而损失的质量。此损失质量除以试样初始质量,且其乘以100的乘积得到因溶解而损失的质量%。此时,将含有球粒的套管放回含有室温(21-27℃)下的新鲜去离子水(275ml)的瓶中,且将瓶盖上盖子并放回水浴中。24小时后,重复干燥和称重过程。每浸泡24小时后用新鲜的去离子水重复这些操作,直到测试终止或材料完全溶解。
93.在下表2中,四天后剩余的质量%通过从100减去四天后损失的质量%来计算。
94.注射力
95.通过以下方法确定将移植物从14ml注射器(14.4mm id)喷射并通过jamshidi型针头进入5ml或10ml杯,或从40ml注射器(24.2mm id)进入50ml杯所需的力。在14ml或40ml注射器中制备指定量的移植物。混合后,通过注射器的鲁尔接头连接jamshidi型针头。在带有1kn测力传感器的mts测试框架中,针头的底部位于距测试杯底部12.7mm。在微粒组合物组分和移植物的水溶液组分混合后5分钟开始,以4.4mm/s的速率向注射器/针头系统施加力。以50hz的速率对力相对于距离的数据进行采样,直到将试样喷射至5ml测试杯中。将15mm位移处的阻力记录为喷射试样所需的注射力。
96.实施例1:组a-f和比较组j
97.对分类为组a-f和比较组j的具有不同液体与粉末比(l/p)的骨移植配制物样品评估维卡凝固时间(干燥和潮湿两者)和胶合剂溶解率。在14ml注射器中使用大约7cc移植物的注射力,用11号10cm针头对相同组进行测试。每组的实验配制物的微粒组成保持不变,且包含75%半水合硫酸钙、6.7
±
0.1%一水合磷酸二氢钙、8.3%β磷酸三钙粉末和10%β磷酸三钙颗粒(任选地含有0.1%蔗糖涂布的二水合硫酸钙)。l/p在使用不同水溶液的配制物之间变化,其定义于下表1中:....................
98.表1测试水溶液中组分的浓度
[0099][0100]
将组a-f和比较组j中的每一者的各个样品的特性测试结果取平均值,并在下表2中与标准偏差一起提供。另外,图1和图2图示了骨移植替代配制物的注射力与使用as2、as30和as3的骨移植配制物的l/p比之间的关系。
[0101]
表2
[0102][0103][0104]
结论:
[0105]
将液体与粉末比(l/p)调节至约0.35至约0.40范围内出人意料地提供了具有更长凝固时间的骨移植替代配制物,而所得胶合剂的溶解率与具有较低l/p的本领域现有配制物相当。l/p比为约0.35至约0.40的骨移植替代配制物也展现显著较低的注射力。相当的溶解率加上更长的凝固时间和更低的注射力提供了可置于更大注射器和/或更细规格的针头中以用于不同骨损伤的骨替代移植配制物,并且一旦在需要修复的骨内凝固,仍提供与现有技术胶合剂相同的吸收行为。
[0106]
实施例2:不同尺寸针头的注射力
–
14ml注射器
[0107]
在14ml注射器中制备两个用相同量的粉末但不同量的溶液制备的移植物。除非标明为“开孔”连接,否则每个针头都通过鲁尔接头与注射器连接。对于以下针头尺寸测量了与将大约7cc组e移植物注入10ml杯中相关的力:11号6cm(n=8)、11号10cm(n=3)、13号10cm(n=3)、13号10cm
–
开孔(n=3)、15号4in(n=3)、16号6cm(n=2)和16号6cm
–
开孔(n=3)。对于以下针头尺寸测试了将大约5cc比较(组j)移植物注入10ml杯中的相关力:11号6cm(n=9)、11号10cm(n=3)和15号4in(n=3)。结果图示于图3中。
[0108]
实施例3:使用40ml注射器的不同尺寸针头的注射力
[0109]
在40ml注射器中制备两个用相同量的粉末但不同量的溶液制备的移植物。除非标明为“开孔”,否则每个针头都通过鲁尔接头与注射器连接。对于以下针头尺寸测量了与将大约25cc组e移植物注入50ml杯中相关的力:11号6cm(n=2)、11号10cm(n=2)、13号10cm(n=3)、13号10cm
–
开孔(n=3)、15号4in(n=2)、16号6cm(n=2)和16号6cm
–
开孔(n=2)。对于以下针头尺寸测试了将大约20cc比较(组j)移植物注入50ml杯中的相关力:图4中的11号6cm(n=2)和11号10cm(n=2)。
[0110]
实施例4:工作时间-多次喷射14ml和40ml注射器
[0111]
在设计成促进移植物的混合和递送的(14.4mm id)或40ml(24.2mm id)注射器中制备指定量的移植物。在制备移植物后,将具有确定规格和插管长度的针头连接到注射器上。喷射时间点由组合溶液与粉末(即开始移植物制备)后的分钟数确定。通过在指定的时间点压缩注射器柱塞以在3、5、7分钟和之后的1-2分钟间隔的每个时间点挤出0.4-0.8ml来促进喷射。记录了以下里程碑和对应的时间点:第一次喷射的时间(例如3分钟);接合了一个主轴驱动器(用于旋转柱塞),因为手动压缩几乎不会产生喷射;太难喷射(即几乎没有喷射,包括在有主轴驱动器的情况下);以及没有剩余的可见移植物。
[0112]
在14ml注射器中制备组e,4cc和7cc的移植物样品(n=2/体积)。制备后,通过鲁尔接头将13号10cm针头连接至注射器上。14ml注射器中样品的结果图示于图5中。
[0113]
在40ml注射器中制备组e,15cc、18cc、20cc和25cc的移植物样品(n=2/体积)。制备后,通过鲁尔接头将13号10cm针头连接至注射器上。14ml注射器中样品的结果图示于图6中。
[0114]
实施例4:工作时间-单次喷射
–
14ml和40ml注射器
[0115]
在设计成促进移植物的混合和递送的14ml(14.4mm id)或40ml(24.2mm id)注射器中制备指定量的移植物。制备移植物后,通过鲁尔接头将具有确定规格和插管长度的针头连接至注射器上;或者,通过开孔接头将周围带有o形环的针头连接至注射器(即移除了鲁尔接头)。时间点由组合溶液与粉末(即开始移植物制备)后的分钟数确定。通过在指定的时间点压缩注射器柱塞以挤出注射器中所有可见的移植物来促进喷射。对于每个时间点,
仅通过手动压缩(即不使用主轴驱动器)挤出所有移植物的难度以1(非常容易)至10(非常困难)的等级进行评级。
[0116]
在14ml注射器中制备组e,7cc的移植物样品。制备后,将13号10cm针头通过鲁尔接头(n=1/时间点),或开孔接头和注射器上的o形环(n=1/时间点)连接至注射器上。在以下时间点喷射样品:3、6、9、11、14、17、20和26分钟。从14ml注射器喷射样品的结果图示于图7中。
[0117]
在40ml注射器中制备组e,25cc的移植物样品(n=2/体积)。制备后,将13号10cm针头通过鲁尔接头(n=1/时间点),或开孔接头和注射器上的o形环(n=1/时间点)连接至注射器上。在以下时间点喷射样品:3分钟和6分钟。从40ml注射器喷射样品的结果图示于图8中。
[0118]
实施例5:治疗约2ml的软骨下囊肿
[0119]
可使用本公开的骨移植替代配制物填充具有约2ml空隙的软骨下囊肿。在治疗时,将6.2g如本文所述的微粒组合物与2.4g如本文所述的水溶液在14ml混合注射器中混合。接着通过合适的针头(例如16号
×
6cm针头;16号
×
10cm插管;15号
×
4英寸针头;13号
×
10cm针头;和具有类似长度的更大针头)从14ml混合注射器(14.4mm id)手动递送配制物。
[0120]
实施例6:治疗约5ml的骨囊肿
[0121]
可使用本公开的骨移植替代配制物填充具有约5ml空隙的骨囊肿。在治疗时,将10.9g如本文所述的微粒组合物与4.1g如本文所述的水溶液在14ml混合注射器中混合。接着通过合适的针头(例如16号
×
6cm针头;15号
×
4英寸针头;13号
×
10cm针头;和具有类似长度的更大针头)从14ml混合注射器(14.4mm id)手动递送配制物。
[0122]
实施例7:治疗约25ml的骨囊肿
[0123]
可使用本公开的骨移植替代配制物填充具有约25ml空隙的骨囊肿。在治疗时,将35g如本文所述的微粒组合物与13.2g如本文所述的水溶液在40ml混合注射器中混合。接着通过合适的针头(例如16号
×
6cm针头;15号
×
4英寸针头;13号
×
10cm针头;和具有类似长度的更大针头)从40ml混合注射器(24.2mm id)手动递送配制物。
[0124]
出于清楚和理解的目的,已通过说明和举例对前述公开内容进行了一些详细描述。因此,应理解,本文的描述旨在为说明性且并非限制性的。因此,本公开的范围不应参考本文的描述来确定,而应替代地参考以下随附权利要求书连同所述权利要求书所赋予权利的等效物的全部范围来确定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1