产生工程化记忆样NK细胞及其组合物的方法与流程
产生工程化记忆样nk细胞及其组合物的方法
1.相关申请的交叉引用
2.本技术要求2020年3月10日提交的美国临时专利申请序列号62/987,612;2020年12月1日提交的美国临时专利申请序列号63/119,959;2020年12月3日提交的美国临时专利申请序列号63/121,127;以及2021年1月8日提交的美国实用新型申请号17/144,834的利益。每份申请的全部内容通过引用并入本文。
3.政府赞助声明
4.这项发明是在国家卫生研究院(nih)资助的ca197605号拨款下,在政府支持下完成的。政府对这项发明拥有一定的权利。
背景技术:
5.用于治疗癌症的基于细胞的免疫疗法正在开发中。目前正在探索将t细胞、单核细胞衍生细胞(如巨噬细胞、树突状细胞)和自然杀伤细胞(nk)过继性细胞移植用于癌症治疗的方法(见例如andreesen,r.等人(1990)cancer res 50:7450-7456;ruggri,l.等人(2002)science 295:2097-2100;rezvani,k.(2019)bone marrow transplantation 54:785-788)。具体而言,过继性细胞疗法(act)是目前正在测试的癌症治疗方法之一,该疗法向患者施用离体激活/扩增的nk细胞。这些方法包括使用取自患者的自体nk细胞,这些细胞在离体下激活/扩增,然后再重新注入以对抗肿瘤,例如转移性肿瘤。需要加强act nk的持久性、体内扩增和效应功能的策略。
6.嵌合抗原受体(car)t细胞治疗已成为治疗癌症的策略之一。嵌合抗原受体(car)是基因工程化的人工跨膜受体,将抗原(如配体)的特定特异性赋予免疫效应细胞(如t细胞、自然杀伤细胞或其他免疫细胞),从而在识别和结合抗原时激活效应细胞。然而,由于正常组织中抗原表达较低,目前靶向谱系限制性或肿瘤相关抗原(taa)的car可能伴有严重毒性(见coulie等人,nat rev cancer 14:135(2014);srivastava&riddell,j immunol 200:459(2018))。此外,由于肿瘤细胞存活不需要taa,因此taa表达的缺失是肿瘤对car-t治疗产生耐药性的主要原因(见srivastava&riddell,j immunol 200:459(2018))。因此,需要更有效的car治疗策略。
技术实现要素:
7.在一些方面,本公开提供了一种工程化细胞因子诱导的记忆样(ml)人nk细胞或所述细胞的群体,其中所述工程化nk细胞或所述细胞的群体表达包含细胞内结构域、跨膜结构域和细胞外结合结构域的嵌合抗原受体(car)多肽,其中,所述细胞外结合结构域特异性结合包含npm1c新表位的抗原,所述npm1c新表位与i类主要组织相容性复合体(mhc i类)蛋白复合。
8.在一些方面,本公开的工程化nk细胞包含car,所述car包含细胞外结合结构域,其:(a)不结合或基本不结合单独的mhc i类蛋白,且/或(b)不结合或基本不结合与mhc i类蛋白复合的对照肽,任选地,其中所述对照肽为ny-eso-1表位或流感病毒m1表位。
9.在一些方面,本公开的工程化nk细胞包含car,所述car包含细胞外结合结构域,其与包含npm1c新表位的抗原结合,所述npm1c新表位与mhc i类蛋白复合,其中所述npm1c新表位包含氨基酸序列x1x2x3x4x5x6x7x8x9,其中x1选自a、v、l或i,其中x2选自a、t、s、v、l、i、m或q,其中x3选自q或n,其中x4选自d或e,其中x5选自l、i、v、m、a或f,其中x6选自c、s或a,其中x7选自l、i、v、m、a或f,其中x8选自a、v、l或i,以及其中x9选自l、i、v、m或a。在一些方面,x1选自a或v,其中x2选自v、i或l,其中x3选自q或n,其中x4选自d或e,其中x5选自l或i,其中x6选自c或s,其中x7选自v、l或i,其中x8选自a或v,以及其中x9选自v、i或l。在一些方面,x1是a,其中x2选自v、i或l,其中x3是q,其中x4是d,其中x5是l,其中x6是c,其中x7是l,其中x8是a,以及其中x9选自v、i或l。
10.在任一上述或相关方面,所述npm1c新表位包含选自以下的氨基酸序列:aiqdlclav(seq id no:1)或aiqdlcvav(seq id no:71)。在一些方面,所述npm1c新表位包含选自以下的氨基酸序列:claveevsl(seq id no:72)、veevslrk(seq id no:73)、aveevslr(seq id no:74)、aveevslrk(seq id no:75)、claveevslrk(seq id no:76)。在一些方面,新表位包含氨基酸序列aiqdlclav(seq id no:1)。
11.在任一上述方面或相关方面,新表位的长度为7、8、9、10、11或12个氨基酸残基。
12.在任一上述或相关方面,mhc i类蛋白是hla-a*02蛋白或由hla-a*02等位基因组编码。在一些方面,mhc i类蛋白由hla-a*02:01等位基因编码。
13.在一些方面,本公开的工程化nk细胞包括car,所述car包含细胞外结构域,所述细胞外结构域包含:
14.(i)包含vh互补决定区(cdr)1、vh cdr2和vh cdr3的重链可变区(vh),所述vh cdr1、vh cdr2和vh cdr3是具有seq id no:5的氨基酸序列的vh的cdr,和/或
15.(ii)包含vl互补决定区(cdr)1、vl cdr2和vl cdr3的轻链可变区(vl),所述vl cdr1、vl cdr2和vl cdr3是具有seq id no:3的氨基酸序列的vl的cdr。
16.在一些方面,本公开的工程化nk细胞包含car,所述car包含细胞外结构域,所述细胞外结构域包含:包含vh cdr1、vh cdr2和vh cdr3的vh,其中所述vh cdr1具有氨基酸序列gftfssya(seq id no:9),所述vh cdr2具有氨基酸序列isgsggst(seq id no:10),以及所述vh cdr3具有氨基酸序列arlgyptttllpfdy(seq id no:11)。在一些方面,细胞外结构域包含:包含vl cdr1、vl cdr2和vl cdr3的vl,其中所述vl cdr1具有氨基酸序列qsissy(seq id no:6),所述vl cd2具有氨基酸序列aas(seq id no:7),以及所述vl cd3具有氨基酸序列qqsystplt(seq id no:8)。
17.在一些方面,本公开的工程化nk细胞包含car,所述car包含细胞外结构域,所述细胞外结构域包含vh和vl,其中所述vh包含与seq id no:5的氨基酸序列具有至少90%同一性或至少95%同一性的氨基酸序列,和/或其中所述vl包含与seq id no:3的氨基酸序列具有至少90%同一性,或至少95%同一性的氨基酸序列。
18.在一些方面,本公开的工程化nk细胞包含car,所述car包含细胞外结构域,所述细胞外结构域包含vh和vl,其中所述vh包含seq id no:5的氨基酸序列,和/或其中所述vl包含seg id no:3的氨基酸序列。
19.在一些方面,本公开的工程化nk细胞包含car,所述car包含细胞外结构域,其为scfv。在一些方面,所述scfv是人scfv。在一些方面,所述scfv包含:包含vh cdr1、vh cdr2
和vh cdr3的vh,其中vh cdr1具有氨基酸序列gftfssya(seq id no:9),所述vh cdr2具有氨基酸序列isgsggst(seq id no:10),以及所述vh cdr3具有氨基酸序列arlgyptttllpfdy(seq id no:11)。在一些方面,所述scfv包含:包含vl cdr1、vl cdr2和vl cdr3的vl,其中所述vl cdr1具有氨基酸序列qsissy(seq id no:6),所述vl cd2具有氨基酸序列aas(seq id no:7),以及所述vl cd3具有氨基酸序列qqsystplt(seq id no:8)。在一些方面,所述scfv包含vh和vl,其中所述vh包含与seq id no:5的氨基酸序列具有至少90%同一性或至少95%同一性的氨基酸序列,和/或其中所述vl包含与seq id no:3的氨基酸序列具有至少90%同一性或至少95%同一性的氨基酸序列。在一些方面,所述scfv包含vh和vl,其中所述vh包含seq id no:5的氨基酸序列,和/或其中所述vl包含seq id no:3的氨基酸序列。
20.在一些方面,所述scfv包含接头。在一些方面,所述接头是肽接头。在一些方面,所述肽接头是gly-ser接头。在一些方面,所述gly-ser接头选自(gly4ser)(seq id no:58)、(gly4ser)2(seq id no:59)、(gly4ser)3(seq id no:60)和(gly4ser)4(seq id no:61)。在一些方面,所述gly-ser接头包含氨基酸序列sgssggsssg(seq id no:4)。
21.在任一上述或相关方面,所述scfv具有与seq id no:2的氨基酸序列具有至少80%同一性、至少85%同一性、至少90%同一性或至少95%同一性的氨基酸序列;任选地,其中所述scfv包含:(a)包含vh cdr1、vh cdr2和vh cdr3的vh,其中所述vh cdr1具有氨基酸序列gftfssya(seq id no:9),所述vh cdr2具有氨基酸序列isgsggst(seq id no:10),以及所述vh cdr3具有氨基酸序列arlgyptttllpfdy(seq id no:11);和/或(b)包含vl cdr1、vl cdr2和vl cdr3的vl,其中所述vl cdr1具有氨基酸序列qsissy(seq id no:6),所述vl cd2具有氨基酸序列aas(seq id no:7),以及所述vl cd3具有氨基酸序列qqsystplt(seq id no:8)。在一些方面,所述scfv包含seq id no:2的氨基酸序列。
22.在任一上述或相关方面,所述抗原在癌细胞表面上。在一些方面,所述癌症是急性髓系白血病(aml)。
23.在任一上述或相关方面,所述细胞外结构域以100nm或更小、50nm或更小、20nm或更小、10nm或更小、0.5nm至100nm、或1nm至15nm的平衡解离常数(kd)与抗原结合。
24.在一些方面,本公开的工程化nk包含car,所述car包含跨膜结构域,其中所述跨膜结构域选自cd3-ζ、cd8、cd28、dap12、2b4、nkg2d、cd16、nkp44或nkp46的跨膜结构域。在一些方面,本公开的工程化nk包含car,所述car包含细胞内结构域,其中所述细胞内结构域包含一种或多种共刺激分子的一个或多个共刺激结构域,所述共刺激分子选自:cd27、cd28、4-1bb、ox40、cd30、cd40、pd-1、icos、2b4、dap10、cd137和dap12。在一些方面,细胞内结构域包含cd3-ζ信号传导结构域和4-1bb共刺激结构域;其中所述跨膜结构域包含cd8跨膜结构域,且其中所述car多肽还包含cd8铰链区。在一些方面,所述细胞内结构域包含:包含seq id no:27中所示氨基酸序列的cd3-ζ信号传导结构域,以及包含seq id no:26中所示氨基酸序列的4-1bb共刺激结构域;其中所述car多肽包含cd8跨膜结构域和cd8铰链区,其中所述cd8跨膜结构域和所述cd8铰链区包含seq id no:25中所示氨基酸序列;其中,所述细胞外结合结构域包含抗体或其抗原结合片段,以及包含seq id no:23中所示氨基酸序列的前导序列。
25.在任一上述或相关方面,所述细胞外结合结构域是包含seq id no:24中所述氨基酸序列的scfv,或是包含与seq id no:24的氨基酸序列具有至少70%同一性、至少75%同
一性、至少80%同一性、至少85%同一性、至少90%同一性或至少95%同一性的氨基酸序列的scfv。
26.在任一上述或相关方面,所述细胞内结构域还包含自裂解肽序列和细胞因子,其中所述自裂解肽的裂解释放所述细胞因子。在一些方面,所述细胞因子是il-12、il-7、il-13、il-15、tnf-α、ifn-γ或ccl19。
27.在任一上述或相关方面,本公开的工程化nk细胞包含car多肽,所述car多肽包含seq id no:22中所示氨基酸序列,或包含与seq id no:22的氨基酸序列具有至少70%同一性、至少75%同一性、至少80%同一性、至少85%同一性、至少90%同一性或至少95%同一性的氨基酸序列。
28.在任一上述或相关方面,本公开的工程化nk细胞或细胞的群体在原代人nk细胞或者原代人nk细胞的群体暴露于以下细胞因子的一种或多种或任何组合后被激活:il-2、il-12、il-7、il-15、il-21和il-18,任选地,其中所述细胞因子为重组人细胞因子。在一些方面,在暴露于il-12和il-15的组合;il-12和il-18的组合;il-15和il-18的组合;或il-12、il-15和il-18的组合后,所述工程化nk细胞或细胞的群体被激活。在一些方面,nk细胞或所述细胞的群体暴露于:浓度范围为1-20ng/ml的il-12;浓度范围为1-50ng/ml的il-15和浓度范围为10-100ng/ml的il-18,任选地,其中nk细胞或所述细胞的群体暴露于约10ng/ml il-12、约1ng/ml il-15和约50ng/ml il-18约3-48小时、约7-24小时、约16-20小时、约12-24小时或约14-16小时,任选地约16小时。
29.在任一上述或相关方面,所述car多肽是在原代人nk细胞或所述细胞的群体暴露于一种或多种细胞因子后引入的。
30.在任一上述方面或相关方面,本公开的工程化nk细胞或细胞的群体:
31.(i)在存在一种或多种细胞因子和/或肿瘤靶标的情况下,相对于对照人nk细胞或人nk细胞系,产生增加的ifnγ;
32.(ii)相对于对照人nk细胞或人nk细胞系,具有增强的抗体依赖性细胞毒性;和/或
33.(iii)相对于对照人nk细胞或人nk细胞系,具有更强的抗肿瘤功效,
34.任选地,其中所述对照nk细胞是在单独存在il-15的情况下激活的人nk细胞,或在单独存在il-15的情况下激活的人nk细胞系。
35.在任一上述或相关方面,相对于对照人nk细胞或人nk细胞系,在本公开的工程化nk细胞或者所述细胞的群体中,以下多肽中的一种或多种的表达增加:cd94/nkg2a、nkp30、nkp44、nkg2d和cd25,任选地其中所述对照人nk细胞是在单独存在il-15的情况下激活的人nk细胞,或所述对照人nk细胞系是在单独存在il-15的情况下激活的人nk细胞系。
36.在任一上述或相关方面,相对于对照人nk细胞或人nk细胞系,在本公开的工程化nk细胞或者所述细胞的群体中,以下多肽中的一种或多种基本上没有变化:kir、cd57、nkg2c、dnam-1和cd137,任选地其中所述对照人nk细胞是在单独存在il-15的情况下激活的人nk细胞,或所述对照人nk细胞系是在单独存在il-15的情况下激活的人nk细胞系。
37.在任一上述或相关方面,相对于对照人nk细胞或人nk细胞系,本公开的工程化nk细胞或者所述细胞的群体中cd16和/或cd11b的表达降低,任选地其中所述对照人nk细胞是在单独存在il-15的情况下激活的人nk细胞,或所述对照人nk细胞系是在单独存在il-15的情况下激活的人nk细胞系。
38.在任一上述或相关方面,本公开的工程化nk细胞或所述细胞的群体为cd25+nkg2a+nkp30+nkp44+。
39.在任一上述或相关方面,本公开的工程化nk细胞或所述细胞的群体表达il-15多肽,任选地表达人il-15多肽。在一些方面,所述il-15多肽是分泌型il-15多肽或膜结合型il-15多肽。在一些方面,膜结合型il-15多肽是il-15与异源跨膜结构域的融合体。
40.在任一上述或相关方面,本公开的工程化nk细胞或细胞的群体在体内给药后扩增1.5倍、2倍、3倍或4倍。
41.在任一上述或相关方面,本公开的工程化nk细胞或细胞的群体在体内给药后表现出对细胞因子或激活受体再刺激的增强的反应。在一些方面,所述增强的反应维持数周至数月,任选地维持2周至3个月、3周至2个月或约1个月。
42.在任一上述或相关方面,当与呈递与mhc i类蛋白复合的npm1c新表位的靶细胞接触时,工程化nk细胞或所述细胞的群体(i)相对于对照nk细胞的群体,ifn-γ的表达增加;(ii)相对于对照nk细胞的群体,颗粒酶b的表达增加;(iii)相对于对照nk细胞的群体,一种或多种激活标记物的表达增加,其中所述一种或多种激活标记物选自:cd25、cd69、icos、cd226、cd107a和cd62l;(iv)相对于对照nk细胞的群体,一种或多种激活受体的表达增加,其中所述一种或多种激活受体选自:nkp30、nkg2d、nkp44;(v)相对于对照nk细胞的群体,一种或多种成熟标记物的表达增加,其中所述一种或多种成熟标记物选自:cd56和nkg2a;(vi)相对于对照nk细胞的群体,cd57的表达降低;(vii)相对于对照nk细胞的群体,tigit的表达增加;和/或(viii)相对于对照nk细胞的群体,trail的表达降低;任选地,其中(i)-(viii)中任一对照nk细胞的群体是细胞因子诱导的ml nk细胞的未转导群体。在一些方面,当工程化nk细胞或所述细胞的群体与呈递与mhc i类蛋白复合的npm1c新表位的靶细胞接触时,ifn-γ的表达增加。在一些方面,当工程化nk细胞或所述细胞的群体与呈递与mhc i类蛋白复合的npm1c新表位的靶细胞接触时,一种或多种激活标记物的表达增加。在一些方面,所述激活标记物为cd107a。在一些方面,所述激活标记物是cd62l。在一些方面,当工程化nk细胞或所述细胞的群体与呈递与mhc i类蛋白复合的npm1c新表位的靶细胞接触时,一种或多种激活受体的表达增加。在一些方面,所述激活受体是nkg2d。在一些方面,当工程化nk细胞或所述细胞的群体与呈递与mhc i类蛋白复合的npm1c新表位的靶细胞接触时,cd57的表达降低。在一些方面,当工程化nk细胞或所述细胞的群体与呈递与mhc i类蛋白复合的npm1c新表位的靶细胞接触时,cd56和nkg2a的表达增加。在一些方面,当工程化nk细胞或所述细胞的群体与呈递与mhc i类蛋白复合的npm1c新表位的靶细胞接触时,tigit的表达增加。在一些方面,当工程化nk细胞或所述细胞的群体与呈递与mhc i类蛋白复合的npm1c新表位的靶细胞接触时,trail的表达降低。
43.在一些方面,本公开提供了一种药物组合物,其包含本文所述的工程化nk细胞或细胞的群体和药学上可接受的载体。
44.在一些方面,本公开提供了一种生产本公开的工程化nk细胞或细胞的群体的方法,其中所述方法包括:
45.(i)获得原代人nk细胞或所述细胞的群体;
46.(ii)将nk细胞或所述细胞的群体与一定量的il-12、il-15、il-18、或其任何组合接触一段时间,所述一段时间足以获得细胞因子诱导的记忆样nk细胞或者所述细胞的群
体;
47.(iii)在一定条件下将步骤(ii)的nk细胞或所述细胞的群体与编码所述car多肽的慢病毒载体接触,以转导所述nk细胞或所述细胞的群体;
48.(iv)分离表达car多肽的nk细胞或所述细胞的群体;和
49.(v)任选地,扩增分离后的细胞。
50.在一些方面,所述原代人nk细胞或所述细胞的群体来源于ipsc、脐血或pbmc。在一些方面,所述原代人nk细胞或所述细胞的群体是自体或同种异体的。
51.在一些方面,步骤(ii)中所述的一段时间为约12-16小时,任选地约14-16小时,任选地约16小时。在一些方面,步骤(iii)还包括在(iv)之前将所述nk细胞或所述细胞的群体静息约24-72小时。
52.在一些方面,所述慢病毒载体是狒狒包膜糖蛋白(baev-gp)假型慢病毒。在一些方面,所述慢病毒载体是包含baev-gp的假型慢病毒载体,例如,其中baev-gp包含seq id no:107的氨基酸序列。
53.在任一上述或相关方面,相对于对照人nk细胞或nk细胞系,所述细胞因子诱导的记忆样nk细胞或所述细胞的群体产生水平增加的ifnγ,任选地其中所述对照人nk细胞是在单独存在il-15的情况下激活的人nk细胞,或所述对照人nk细胞系是在单独存在il-15的情况下激活的人nk细胞系。
54.在一些方面,本公开提供了一种产生表达异源多肽的工程化细胞因子诱导的记忆样(ml)nk细胞的群体的方法,所述方法包括:在一定条件下,将表达asct-2的细胞因子诱导的ml nk细胞的群体与编码异源多肽的假型慢病毒载体接触,以转导该群体,其中,所述假型慢病毒载体包含与asct-2结合的糖蛋白,从而产生表达异源多肽的工程化细胞因子诱导的ml nk细胞的群体。在一些方面,所述细胞因子诱导的ml nk细胞从原代人nk细胞的群体中获得。在一些方面,原代人nk细胞的群体来源于ipsc、脐血或pbmc。在一些方面,原代人nk细胞的群体是自体或同种异体的。在一些方面,相对于对照人nk细胞的群体,细胞因子诱导的ml nk细胞的群体中asct-2的表达增加约1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、2倍、2.5倍、3倍、3.5倍或4倍,任选地其中所述对照人nk细胞的群体在单独存在il-15的情况下被激活。在一些方面,通过暴露于il-12、il-18和il-15预激活所述细胞因子诱导的ml nk细胞的群体。在一些方面中,通过暴露于il-12和il-18预激活所述细胞因子诱导的ml kn细胞的群体。在一些方面,所述细胞因子诱导的ml nk细胞的群体被预激活约8-24小时,任选地12-20小时,任选地约12-16小时,任选地约14-16小时,任选地约16小时。在一些方面,通过暴露于约10ng/ml il-12、约50ng/ml il-15和约50ng/ml il-18约3-48小时、约7-24小时、约16-20小时、约12-24小时、约14-16小时或约16小时预激活所述细胞因子诱导的ml nk细胞的群体。在一些方面,通过暴露于约10ng/ml il-12和约50ng/ml il-18约3-48小时、约7-24小时、约16-20小时、约12-24小时、约14-16小时或约16小时的时间,细胞因子诱导的ml nk细胞的群体被预激活。在一些方面,所述细胞因子诱导的ml nk细胞的群体在暴露于一种或多种细胞因子之后和接触之前静息一段时间,其中所述一段时间为约24-72小时。在一些方面,所述细胞因子诱导的ml nk细胞的群体的至少约10%被转导。在一些方面,细胞因子诱导的ml nk细胞的群体的约10-90%,任选地约35-80%,任选地约40-60%,任选地约60%被转导。在一些方面,所述糖蛋白是一种逆转录病毒糖蛋白。在一些方面,所述逆转录病毒
糖蛋白是狒狒包膜(baev)糖蛋白。在一些方面,所述baev糖蛋白包含seq id no:107所示氨基酸序列。
55.在一些方面,本公开提供了一种生产表达异源多肽的工程化细胞因子诱导的记忆样(ml)nk细胞的群体的方法,所述方法包括:(i)获得原代人nk细胞的群体;(ii)将il-12、il-18和il-15与原代人nk细胞的群体接触一段时间,所述一段时间足以获得表达asct-2的细胞因子诱导的ml nk细胞的群体;和(iii)在一定条件下将(ii)的群体与编码异源多肽的假型慢病毒载体接触,以转导细胞因子诱导的ml nk细胞的群体;其中,所述假型慢病毒载体包含与asct-2结合的糖蛋白;从而产生表达异源多肽的工程化的细胞因子诱导的ml nk细胞的群体。
56.在一些方面,本公开提供了一种生产表达异源多肽的工程化细胞因子诱导的记忆样(ml)nk细胞的群体的方法,所述方法包括:(i)获得原代人nk细胞的群体;(ii)将原代人nk细胞的群体与il-12和il-18接触一段时间,所述一段时间足以获得表达asct-2的细胞因子诱导的ml nk细胞的群体;和(iii)在一定条件下将(ii)的群体与编码异源多肽的假型慢病毒载体接触,以转导细胞因子诱导的ml nk细胞的群体;其中,所述假型慢病毒载体包含与asct-2结合的糖蛋白;从而产生表达异源多肽的工程化的细胞因子诱导的ml nk细胞的群体。
57.在任一上述或相关方面,所述糖蛋白是逆转录病毒糖蛋白。在一些方面,所述逆转录病毒糖蛋白是狒狒包膜(baev)糖蛋白。在一些方面,所述baev糖蛋白包含seq id no:107所示的氨基酸序列。在一些方面,所述原代人nk细胞的群体来源于ipsc、脐血或pbmc。在一些方面,所述原代人nk细胞是自体或同种异体的。在一些方面,步骤(ii)中所述的一段时间为约12-16小时,任选地约14-16小时,任选地约16小时。在一些方面,作为(iii)的结果的转导的细胞因子诱导的记忆样nk细胞的群体的比例为至少10%。在一些方面,细胞因子诱导的记忆样nk细胞的群体的约10-90%,任选地约35-80%,任选地约40-60%,任选地约60%被转导。
58.在任一上述或相关方面,所述细胞因子诱导的ml nk细胞的群体(i)在存在一种或多种细胞因子和/或肿瘤靶标的情况下,相对于对照人nk细胞系产生增加的ifnγ;(ii)相对于对照人nk细胞系具有增强的抗体依赖性细胞毒性;和/或(iii)相对于对照人nk细胞系具有增强的抗肿瘤功效,任选地其中所述对照人nk细胞系是在单独存在il-15的情况下激活的人nk细胞系。在一些方面,相对于对照人nk细胞系,所述细胞因子诱导的nk细胞的群体中以下一种或多种多肽的表达增加:cd94/nkg2a、nkp30、nkp44、nkg2d和cd25。在一些方面,相对于对照人nk细胞系,所述细胞因子诱导的nk细胞的群体中cd94增加。在一些方面,相对于对照人nk细胞系,所述细胞因子诱导的nk细胞的群体中nkp30增加。在一些方面,相对于对照人nk细胞系,所述细胞因子诱导的nk细胞的群体中nkp44增加。在一些方面,相对于对照人nk细胞系,所述细胞因子诱导的nk细胞的群体中nkg2d增加。在一些方面,相对于对照人nk细胞系,所述细胞因子诱导的nk细胞的群体中cd25增加。在一些方面,相对于对照人nk细胞系,所述细胞因子诱导的nk细胞的群体中以下一种或多种多肽基本没有变化:kir、cd57、nkg2c、dnam-1和cd137。在一些方面,相对于对照人nk细胞系,所述细胞因子诱导nk细胞的群体中kir基本没有变化。在一些方面,相对于对照人nk细胞系,所述细胞因子诱导的nk细胞的群体中cd57基本没有变化。在一些方面,相对于对照人nk细胞系,所述细胞因子诱
id no:5的氨基酸序列的vh的cdr,和/或(ii)包含vl互补决定区(cdr)1、vl cdr2和vl cdr3的轻链可变区(vl),所述vl cdr1、vl cdr2和vl cdr3是具有seq id no:3的氨基酸序列的vl的cdr。在一些方面,所述细胞外结构域包含:包含vh cdr1、vh cdr2及vh cdr3的vh,其中所述vh cdr1具有氨基酸序列gftfssya(seq id no:9),所述vh cdr2具有氨基酸序列isgsggst(seq id no:10),以及所述vh cdr3具有氨基酸序列arlgyptttllpfdy(seq id no:11)。在一些方面,所述细胞外结构域包含:包含vl cdr1、vl cdr2和vl cdr3的vl,其中所述vl cdr1具有氨基酸序列qsissy(seq id no:6),所述vl cd2具有氨基酸序列aas(seq id no:7),以及所述vl cd3具有氨基酸序列qqsystplt(seq id no:8)。在一些方面中,所述细胞外结构域包含vh和vl,其中所述vh包含与seq id no:5的氨基酸序列具有至少90%同一性或至少95%同一性的氨基酸序列,和/或其中所述vl包含与seq id no:3的氨基酸序列具有至少90%同一性或至少95%同一性的氨基酸序列。在一些方面,所述细胞外结构域包含vh和vl,其中所述vh包含seq id no:5的氨基酸序列,和/或其中所述vl包含seq id no:3的氨基酸序列。
64.在任一上述或相关方面,所述car的细胞外结构域包含scfv。在一些方面,所述scfv是人scfv。在一些方面,所述scfv包含:包含vh cdr1、vh cdr2和vh cdr3的vh,其中所述vh cdr1具有氨基酸序列gftfssya(seq id no:9),所述vh cdr2具有氨基酸序列isgsggst(seq id no:10),以及所述vh cdr3具有氨基酸序列arlgyptttllpfdy(seq id no:11)。在一些方面,所述scfv包含:包含vl cdr1、vl cdr2和vl cdr3的vl,其中所述vl cdr1具有氨基酸序列qsissy(seq id no:6),所述vl cd2具有氨基酸序列aas(seq id no:7),以及所述vl cd3具有氨基酸序列qqsystplt(seq id no:8)。在一些方面中,所述scfv包含vh和vl,其中所述vh包含与seq id no:5的氨基酸序列具有至少90%同一性或至少95%同一性的氨基酸序列,和/或其中vl包含与seq id no:3的氨基酸序列最少90%同一性或最少95%同一性的氨基酸序列。在一些方面,所述scfv包含vh和vl,其中所述vh包含seq id no:5的氨基酸序列,和/或其中所述vl包含seq id no:3的氨基酸序列。在一些方面,所述scfv包含接头。在一些方面,所述接头是肽接头。在一些方面,所述肽接头是gly-ser接头。在一些方面,所述gly-ser接头选自(gly4ser)(seq id no:58)、(gly4ser)2(seq id no:59)、(gly4ser)3(seq id no:60)和(gly4ser)4(seq id no:61)。在一些方面,所述gly-ser接头包含氨基酸序列sgssggsssg(seq id no:4)。
65.在任一上述或相关方面,所述scfv具有与seq id no:2的氨基酸序列具有至少80%同一性、至少85%同一性、至少90%同一性或至少95%同一性的氨基酸序列;任选地其中所述scfv包含:(a)包含vh cdr1、vh cdr2和vh cdr3的vh,其中所述vh cdr1具有氨基酸序列gftfssya(seq id no:9),所述vh cdr2具有氨基酸序列isgsggst(seq id no:10),以及所述vh cdr3具有氨基酸序列arlgyptttllpfdy(seq id no:11);和/或(b)包含vl cdr1、vl cdr2和vl cdr3的vl,其中所述vl cdr1具有氨基酸序列qsissy(seq id no:6),所述vl cd2具有氨基酸序列aas(seq id no:7),以及所述vl cd3具有氨基酸序列qqsystplt(seq id no:8)。在一些方面,所述scfv包含seq id no:2的氨基酸序列。
66.在任一上述或相关方面,所述car的细胞外结合结构域特异性结合包含npm1c新表位的抗原,所述npm1c新表位与i类主要组织相容性复合体(mhc i类)蛋白复合,其中所述抗原在癌细胞表面上。在一些方面,所述癌症是急性髓系白血病(aml)。在一些方面,所述细胞
外结构域以100nm或更小、50nm或更小、20nm或更小、10nm或更小、0.5nm至100nm、或1nm至15nm的平衡解离常数(kd)结合抗原。
67.在一些方面,所述car包含跨膜结构域,其中所述跨膜结构域选自cd3-ζ、cd8、cd28、dap12、2b4、nkg2d、cd16、nkp44或nkp46的跨膜结构域。在一些方面中,所述car包含细胞内结构域,其中,所述细胞内结构域包含一种或多种共刺激分子的一个或多个共刺激结构域,所述共刺激分子选自:cd27、cd28、4-1bb、ox40、cd30、cd40、pd-1、icos、2b4、dap10、cd137和dap12。在一些方面,所述细胞内结构域包含cd3-ζ信号传导结构域和4-1bb共刺激结构域;其中所述跨膜结构域包含cd8跨膜结构域,其中所述car多肽还包含cd8铰链区。在一些方面,所述细胞内结构域包含:包含seq id no:27中所示氨基酸序列的cd3-ζ信号传导结构域,以及包含seq id no:26中所示氨基酸序列的4-1bb共刺激结构域;其中,所述car多肽包含cd8跨膜结构域和cd8铰链区,其中所述cd8跨膜结构域和cd8铰链区包含seq id no:25中所示氨基酸序列;其中,所述细胞外结合结构域包含抗体或其抗原结合片段,以及包含seq id no:23中所示氨基酸序列的前导序列。
68.在任一上述或相关方面,所述car的细胞外结合结构域是包含seq id no:24中所示氨基酸序列的scfv,或是包含与seq id no:24的氨基酸序列具有至少70%同一性、至少75%同一性、至少80%同一性、至少85%同一性、至少90%同一性或至少95%同一性的氨基酸序列的scfv。
69.在任一上述或相关方面,所述car多肽包含seq id no:22中所示氨基酸序列,或包含与seq id no:22的氨基酸序列具有至少70%同一性、至少75%同一性、至少80%同一性、至少85%同一性、至少90%同一性或至少95%同一性的氨基酸序列。
70.在任一上述或相关方面,所述car的细胞内结构域还包含自裂解肽序列和细胞因子,其中所述自裂解肽的裂解释放所述细胞因子。在一些方面,所述细胞因子是il-12、il-7、il-13、il-15、tnf-α、ifn-γ或ccl19。在一些方面,所述细胞因子是il-15多肽。在一些方面,所述il-15多肽在表达后分泌。在一些方面,所述car多肽包含seq id no:102中所示氨基酸序列,或包含与seq id no:102的氨基酸序列具有至少70%同一性、至少75%同一性、至少80%同一性、至少85%同一性、至少90%同一性或至少95%同一性的氨基酸序列。在一些方面,所述il-15多肽与异源跨膜结构域融合,其中所述异源跨膜结构域是cd8跨膜结构域。在一些方面,所述il-15多肽表达为膜结合型il-15多肽。在一些方面,所述car多肽包含seq id no:100中所示氨基酸序列,或包含与seq id no:100的氨基酸序列具有至少70%同一性、至少75%同一性、至少80%同一性、至少85%同一性、至少90%同一性或至少95%同一性的氨基酸序列。
71.在一些方面,本公开提供了表达car的工程化细胞因子诱导的ml nk细胞的群体,所述car包含细胞外结合结构域,所述细胞外结合结构域与包含与i类主要组织相容性复合体(mhc i类)蛋白复合的npm1c新表位的抗原特异性结合,该群体根据本文所述方法制备。在一些方面,在存在呈递与mhc i类蛋白复合的npm1c新表位的靶细胞的情况下,工程化ml nk细胞的群体中(i)ifnγ的表达增加;(ii)相对于对照nk细胞的群体,颗粒酶b的表达增加;(iii)相对于对照nk细胞的群体,一种或多种激活标记物的表达增加,其中所述一种或多种激活标记物选自:cd25、cd107a、cd69、icos、cd226和cd62l;(iv)相对于对照nk细胞的群体,一种或多种激活受体的表达增加,其中所述一种或几种激活受体选自:nkp30、nkg2d、
nkp44;(v)相对于对照nk细胞的群体,一种或多种成熟标记物的表达增加,其中所述一种或多种成熟标记物选自:cd56和nkg2a;(vi)相对于对照nk细胞的群体,cd57的表达降低;(vii)相对于对照nk细胞的群体,tigit的表达增加;和/或(viii)相对于对照nk细胞的群体,trail的表达降低;任选地其中所述对照nk细胞的群体是细胞因子诱导的ml nk细胞的未转导群体。在一些方面,当工程化nk细胞或所述细胞的群体与呈递与mhc i类蛋白复合的npm1c新表位的靶细胞接触时,ifnγ的表达增加。在一些方面,当工程化nk细胞或所述细胞的群体与呈递与mhc i类蛋白复合的npm1c新表位的靶细胞接触时,一种或多种激活标记物的表达增加。在一些方面,所述激活标记物为cd107a。在一些方面,所述激活标记物是cd62l。在一些方面,当工程化nk细胞或所述细胞的群体与呈递与mhc i类蛋白复合的npm1c新表位的靶细胞接触时,一种或多种激活受体的表达增加。在一些方面,所述激活受体是nkg2d。在一些方面,当工程化nk细胞或所述细胞的群体与呈递与mhc i类蛋白复合的npm1c新表位的靶细胞接触时,cd57的表达降低。在一些方面,当工程化nk细胞或所述细胞的群体与呈递与mhc i类蛋白复合的npm1c新表位的靶细胞接触时,cd56和nkg2a的表达增加。在一些方面,当工程化nk细胞或所述细胞的群体与呈递与mhc i类蛋白复合的npm1c新表位的靶细胞接触时,tigit的表达增加。在一些方面,当工程化nk细胞或所述细胞的群体与呈递与mhc i类蛋白复合的npm1c新表位的靶细胞接触时,trail的表达降低。
72.在一些方面,本公开提供了一种治疗有需要的受试者中癌症的方法,其中,包含所述癌症的细胞的细胞表面显示与mhc i类蛋白复合的npm1c新表位,该方法包括以足以治疗癌症的量向受试者施用本文所述的工程化nk细胞或细胞的群体或药物组合物。在一些方面,所述癌症是aml。在一些方面,所述治疗癌症的方法是一种减轻受试者中癌症负荷的方法或增加受试者存活期的方法。
73.在其他方面,本公开提供了一种治疗有需要的受试者中aml的方法,该方法包括以足以治疗aml的量向受试者施用本文所述的工程化nk细胞或细胞的群体或药物组合物。
74.在任一上述或相关方面,所述aml是复发性aml或难治性aml。
75.在其他方面,本公开提供了一种防止aml缓解受试者中aml复发的方法,该方法包括向所述受试者施用本文所述的工程化nk细胞或细胞的群体或药物组合物。
76.在任一上述或相关方面,本文所述的任何方法包括在施用步骤之前,检测受试者是否表达npm1c或受试者在npm1基因中是否有npm1c突变,以及如果受试者表达npm1c或有npm1c突变,则继续施用步骤。
77.在任一上述或相关方面,本公开的工程化nk细胞或细胞的群体在体内给药后表现出增强的扩增。
78.在任一上述或相关方面,本文所述的任何方法还包括施用一种或多种额外的治疗剂或程序。
79.在一些方面,本公开提供了如本文所述的工程化nk细胞或细胞的群体或药物组合物在制造用于治疗受试者中癌症的药物中的用途,其中包含所述癌症的细胞的细胞表面显示与mhc i类蛋白复合的npm1c新表位;任选地,其中该用途与一种或多种额外的治疗剂或程序联合。
80.在任一上述或相关方面,所述受试者是人。
81.在其他方面,本公开提供了一种试剂盒,其包含一个或多个容器,包括:(i)本文所
述的工程化nk细胞或细胞的群体或药物组合物;(ii)任选地,一种或多种额外的治疗剂,以及(iii)用于治疗受试者中癌症的说明书。
附图说明
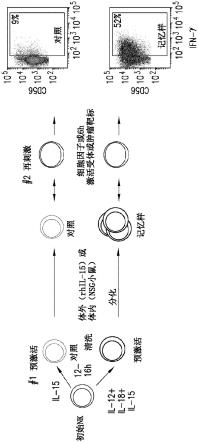
82.图1显示人细胞因子诱导的记忆样(在本文可互换地称为“记忆样”、“ciml”、“ml”)nk细胞分化的概要。通常,使用il-12、il-15和il-18(或单独使用il-15作为对照)的组合预激活初始nk细胞12-16小时,清洗并允许其在体外(使用低剂量il-15存活)或体内(在使用rh il-2或rhil-15的nsg小鼠中存活)分化。il-12/15/18预激活导致广泛增殖,并分化为记忆样nk细胞。在第二次(再)刺激后,与对照或初始nk细胞相比,记忆样nk细胞表现出增强的反应。在这个实例中,ifn-γ产生被显示为对白血病靶细胞的反应的原型nk细胞功能读数。
83.图2a-2c显示lsl-r和asct2在原代常规和ciml nk细胞中的表达。图2a是展示人nk(hnk)细胞中ldl-r表达百分比(%)的图,这些细胞是常规的原代人nk细胞(cnk)或细胞因子诱导的记忆样nk细胞。图2b是展示cnk或ciml nk细胞中asct2表达的百分比(%)的图。图2c是描绘狒狒包膜糖蛋白假型慢病毒(baev lv)靶向的asct1/2的nk细胞上的相对表达与水泡性-口炎-病毒-g蛋白假型慢病毒(vsvg-lv)靶向的ldl-r的相对表达的示意图。
84.图3a显示在nk细胞上表达的抗-npm1c car的示意图及其对由hla-a2复合体在aml细胞上呈递的aiq(aiqdlclav;seq id no:1)(aiq-hla-a2复合体)的识别。还显示抗-npm1c-car载体的示意图。图3b提供流式细胞术数据,显示t细胞上表达的抗-npm1c car识别aiq-hla-a2复合体。
85.图4显示aml中npm1突变。示意图改编自xie等人nat biomed eng(2021)5:124。
86.图5显示使用非常规慢病毒转导方法(baev假型慢病毒)优化后的ciml nk细胞的car编辑。图中所示为量化抗-npm1c nk细胞和未转导(ut)细胞中car scfv和gfp表达的流式图。
87.图6a是展示用于生成细胞因子诱导的记忆样nk细胞并使用慢病毒(例如,baev假型)用car构建体进行转导以生成表达car的ciml nk细胞的方法。
88.图6b是展示用50ng/ml il-15、10ng/ml il-12和50ng/ml il-18的组合刺激nk细胞16小时后asct2表达的百分比(%)的图。
89.图6c-6e提供量化asct mrna表达的倍数变化的图表,其在用il-12和il-18(图6c-6d)或il-12、il-18和il-15(图6e)的组合刺激的hnk细胞中通过qpcr进行量化。对照细胞未经处理或单独用il-15、单独用il-12或单独用il-18处理。
90.图6f是展示在用不同细胞因子组合预激活的ml nk细胞中用编码抗-npm1c car的狒狒包膜糖蛋白假型慢病毒(baev lv)进行转导的转导效率的直方图。
91.图7a显示从不同的人供体中获得的ml-nk细胞转染编码抗-npm1c car的baev lv的转导率的图,通过使用流式细胞术测量car表达来确定(表示为%蛋白l结合)。
92.图7b显示用编码gfp的baev-lv转导的原代人和小鼠ciml nk细胞中的有效基因表达。用重组人il-12、il-18和il-15过夜预激活来自pbmc的原代hnk细胞,以生成人ciml nk细胞。用重组小鼠il-12、il-18和il-15过夜预激活来自脾脏的小鼠nk细胞,以生成小鼠ciml nk细胞。
93.图7c提供基于成熟和发育阶段的hnk细胞表型标记物特征。
94.图7d提供一种通过流式细胞术分析对活的cd56
+
cd3-细胞进行设门,根据成熟阶段区分较不成熟的(nk1=cd56
亮
cd16-)、中等成熟的(nk2=cd56
暗
cd16
+
kir-或nk3=cd56
暗
cd16
+
kir
+
cd57-)或完全成熟的(nk4=cd56
暗
cd16
+
kir
+
cd57
+
)hnk细胞亚群的策略。
95.图7e提供量化根据图7d中描述的设门策略区分的hnk细胞亚群nk1-nk4的asct2表面表达的条形图。hnk细胞取自四个不同的人供体。
96.图7f提供量化根据图7d中描述的设门策略区分的hnk细胞亚群nk1-nk4的asct2表面表达的直方图。图中所示为从一名人供体获得的hnk细胞数据。
97.图8a显示carml-nk细胞的有效抗aml功能。图中所示为与npm1c
+
hla-a2
+
靶细胞共培养后,量化未转导(ut)细胞和抗-npm1c-carmlnk细胞中ifnγ和cd107a表达的流式图(左侧面板)和相应的条形图(右侧面板)。
98.图8b-8g显示与oci-aml3(npm1c+hla-a2+)细胞共培养后,与未转导nk细胞相比,通过使用baev-lv转导了抗-npm1ccar的ciml-nk细胞的表型标记物分析。量化基于通过cytof收集的大量细胞术数据。图8b提供cd107a、细胞因子(ifnγ)和细胞毒性标记物(颗粒酶b)的量化;图8c提供激活标记物(cd25、cd69、icos、cd226、cd62l)的量化;图8d提供激活受体(nkp30、ngd2d、nkp44)的量化;图8e提供成熟标记物(cd56、nkg2a、cd57)的量化;图8f提供耗竭标记物tigit的量化;以及图8g提供凋亡标记物trail的量化。
99.图9a是测量15天期间未转导(ut)mlnk细胞、car-s15(表达分泌型il15的抗-npm1ccarmlnk细胞)或car-m15(表达膜结合型il15的抗-npm1ccarmlnk细胞)的体外培养中的细胞扩增的图。
100.图9b-9c提供示出转导后car维持表达的条形图(图9b)和相应的流式图(图9c)。在转导后第4天和第23天,在未转导(ut)细胞、仅抗-npm1ccar的mlnk细胞、car-s15mlnk细胞和car-m15mlnk细胞中测量car表达。car表达表示为活性nk细胞中%蛋白l结合。
101.图10a提供展示当与表达npm1c:hla-a2的靶细胞共培养时,car-s15mlnk细胞和car-m15mlnk细胞表达ifnγ的图。使用靶细胞oci-aml3(npm1c+,hla-a2+,luc+;上图)或oci-aml2(npm1c-,hla-a2+,luc+;下图)以1:1的效应细胞:靶细胞比共培养nk细胞。对照细胞是未转导mlnk细胞。细胞共培养5小时并使用流式细胞术分析ifnγ的表达。
102.图10b提供了展示car-s15mlnk细胞和car-m15mlnk细胞诱导表达npm1c:hla-a2的靶细胞凋亡的线形图,用凋亡靶细胞的百分比(%)衡量。靶细胞为oci-aml3(npm1c+,hla-a2+,luc+;上图)或oci-aml2(npm1c-,hla-a2+,luc+;下图)。以指示的e:t比率将细胞与未转导的ml-nk细胞、car-s15ml-nk或carm15ml-nk共培养4小时,然后使用流式细胞仪分析annexinv染色。
103.图10c提供展示在与未转导ml-nk细胞、仅抗carnpm1c的ml-nk细胞、car-s15ml-nk细胞或car-m15ml-nk细胞以不同的e:t比率培养24小时后靶细胞(oci-aml3(npm1c+、hla-a2+、luc+;左图)或oci-aml2(npm1c-、hla-a2+、luc+;右图)中的细胞存活的线形图。
104.图10d-10g显示,靶向衍生自细胞内npm1c的新表位的工程化记忆样nkcar对急性髓系白血病(aml)表现出强大的活性和特异性。图10d显示转导后72小时原代人cimlnk细胞中高效慢病毒介导的(baev-lv)car编辑。图10e显示与抗-npm1ccar和膜结合型il-15的共转导促进car-cimlnk细胞在体外的扩增。图10f显示流式细胞术分析前,仅用抗-npm1ccar转导或用抗-npm1ccar和mil-15共转导并用oci-aml3靶细胞(npm1c+hla-2a+)刺激4小
时的ciml nk细胞中ifn-γ和cd107a的表达。图10g显示与仅用抗-npm1c car转导或用抗-npm1c car和mil-15共转导的ciml nk细胞共培养4小时的oci-aml3(npm1c+hla-2a+)靶细胞的杀伤。
105.图11a提供生成抗-npm1c-car-ml nk细胞和生成含有oci-aml3-luc细胞的小鼠以及随后用car细胞治疗和监测肿瘤负荷的时间线。
106.图11b提供参与图11a中概述的研究的小鼠中荧光素酶表达的图像。在第3天、第10天和第13天对接受未转导细胞或表达分泌型il-15(s15)、膜结合型il-15(m15)或仅表达car(无il-15)的抗-npm1c car ml nk细胞的小鼠进行荧光素酶测定。
107.图11c提供展示携带肿瘤oci-aml3细胞的小鼠中的整体(总)荧光素酶表达(如图11b所示)的线形图。
108.图12显示自然杀伤(nk)细胞的细胞分选。
109.图13是显示nk细胞响应是由激活和抑制信号的净平衡决定的示意图。
110.图14是展示nk细胞过继转移策略的示意图。
111.图15是显示免疫系统中记忆的示意图。改编自rosenblum等人,2016年。
112.图16显示使用il-12和il-18激活常规nk细胞诱导分化为记忆样nk细胞。见romee等人,blood,2012年;romee等人,science tm,2016年。
113.图17显示记忆样nk细胞在复发/难治性aml中首次人类中的第1阶段研究。
114.图18显示ciml nk细胞在过继转移后增殖和扩增。改编自romee等人,science tm,2016年。
115.图19显示记忆样nk细胞是安全的,具有良好的临床活性。见romee等人,science tm,2016年。
116.图20是概述干细胞移植后复发患者的1a/b期研究的示意图。基于单倍体中的nk细胞缺陷以及单倍体hct后复发患者没有有效和安全的治疗选择,启动了一项记忆样nk细胞的第一阶段研究。如左图所示,移植后复发与预后极差相关,hla错配可能是使用dli的危险情况,并增加gvhd的风险。使用nk细胞并从与原始干细胞移植相同的供体中生成记忆样nk细胞,免疫相容。然后他们服用7剂低剂量il-2。
117.图21显示记忆样nk(“mem-nk”)细胞的大规模体内扩增和延长/持续的持久性。显示了约500倍的扩增。ciml nk细胞在至少65天可检测,与在小鼠中观察到的情况相似,也证实了这些细胞在人类中的半衰期较长。长期的持久性使其作为nk细胞免疫疗法方法的平台非常有吸引力。
118.图22显示第28天成熟nk细胞的扩增,treg的扩增最小。
119.图23显示母细胞浆细胞样dc肿瘤(bpdcn)患者通过记忆样nk细胞输注获得缓解。
120.图24显示晚期头颈癌中ctla-4抑制加记忆样nk细胞免疫细胞治疗。有数据显示nk浸润可预测h&n癌症患者的pfs。此外,ctal4阻断ipi可诱导肿瘤内treg耗竭。例如,一项1期试验将记忆样nk细胞与ipi结合,然后给予长效il-15超级激动剂。
121.图25显示抗体募集分子(arm)是新的双特异性nk细胞接合剂。
122.图26显示在使用自体hct的mrd
+
mm中cd38 arm加记忆样nk细胞的第i/第ii阶段试验。
123.图27显示用于car开发的记忆样nk细胞平台的开发。
124.图28显示phiv-car-cd19hscfv-p2a-gfp(8606bp)的载体图。
具体实施方式
125.本公开提供了产生表达异源多肽(例如,本文描述的car)的细胞因子诱导的记忆样自然杀伤(nk)细胞的群体的方法。如本文所述,本公开的方法相对于传统的细胞转导方法(例如,使用整合水泡性口炎病毒g(vsvg)糖蛋白的典型假型慢病毒载体的方法),在细胞因子诱导的记忆样nk细胞的群体中提供更高的转导效率。如本文所示,与vsvg糖蛋白结合的ldl受体在nk细胞(例如,常规nk细胞或细胞因子诱导的记忆样nk细胞)中表达不佳。在不受理论约束的情况下,ldl受体的不良表达阻止了vsvg糖蛋白假型慢病毒载体在nk细胞中的有效摄取。
126.相反,发现细胞因子诱导的记忆样nk细胞表达丙氨酸、丝氨酸、半胱氨酸转运体2(asct2)的水平升高。如本文所示,相对于对照nk细胞(例如,仅用il-15激活的常规nk细胞),用(i)il-12和il-18或(ii)il-12-、il-18和il-15预激活的细胞因子诱导的记忆样nk细胞表达asct2水平增加约1.5-2倍。在一些方面,相对于对照nk细胞(例如,仅用il-15激活的常规nk细胞),asct水平增加约1.5-3倍。此外,还发现,结合asct2的糖蛋白的假型慢病毒载体在细胞因子诱导的nk细胞中产生了高水平的转导(例如,至少10%、20%、30%、40%、50%、60%、70%、80%或90%)。在一些实施方式中,逆转录病毒糖蛋白是一种与asct2结合的狒狒包膜(baev)糖蛋白。此外,已证明相对于表达低水平asct2的对照nk细胞(例如,仅用il-15激活的常规nk细胞),表达高水平asct2的细胞因子诱导的记忆样nk细胞中转导增加。在不受理论约束的情况下,细胞因子诱导的记忆样nk细胞的asct表达增加,使能够有效结合和摄取包含asct2结合糖蛋白(例如baev)的假型慢病毒载体。
127.因此,在一些方面,本公开提供了产生表达异源多肽(例如,本文所述的car多肽)的细胞因子诱导的记忆样nk细胞的群体的方法,该方法包括将表达asct2的细胞因子诱导的记忆样nk细胞的群体与包含结合asct的糖蛋白(例如baev)的假型慢病毒载体接触。在一些方面,提供表达asct2的细胞因子诱导的记忆样nk细胞的群体包括将原代人nk细胞的群体与il-12、il-18和il-15接触。在一些方面,提供表达asct2的细胞因子诱导的记忆样nk细胞的群体包括将原代人nk细胞的群体与il-12和il-18接触。在一些方面,将原代人nk细胞的群体接触足够的一段时间以获得细胞因子诱导的记忆样nk细胞的群体,例如,细胞因子诱导的记忆样nk细胞的群体,其相对于对照nk细胞(例如,仅接触il-15的常规nk细胞)具有一个或多个优化的特性。
128.此外,本公开至少部分基于人原代nk细胞的群体中asct2的表达与nk细胞成熟和/或发育阶段相关的发现。如本文所示,人原代nk细胞的群体中表达较不成熟、不太发达的“干细胞样”标记物和/或增殖表型(例如,cd56
亮
cd16
低/-nkg2a
+
cd57-kir-)的亚群,相对于表达更成熟和/或更发达的表型(例如cd56
暗
cd16
+
nkg2a
+/-kir
+
cd57
+
)表型标记物的亚群,asct2表达水平增加。在不受理论约束的情况下,人们认为,相对于具有更成熟表型和更低asct表达的人原代nk细胞,较不成熟的人原代nk细胞高表达asct2会导致使用带有结合asct糖蛋白的假型慢病毒(例如,baev)的转导效率的提高。
129.此外,本公开提供表达新型嵌合抗原受体(car)的细胞因子诱导的工程化记忆样自然杀伤(nk)细胞,所述嵌合抗原受体(car)靶向新表位,所述新表位来源于npm1c(核磷蛋
白中的四核苷酸重复,约35%的aml患者癌基因突变的驱动因素)中确定的肿瘤特异性致癌驱动基因突变产生的细胞内新抗原。突变产生一个新表位,由最常见的hla-a2等位基因呈递。
130.本公开的表达抗-npm1c car的细胞因子诱导的记忆样nk细胞(“ml nk”细胞)已被证明在体外和体内有效杀死npm1c表达细胞。在不受理论约束的情况下,人们认为,本公开的表达工程化car的ml nk细胞至少通过避免、减少或消除细胞因子释放综合征、神经毒性和/或移植物抗宿主病(gvhd),提供优于表达car的t细胞的治疗益处。相对于常规nk细胞,本发明的表达工程化car的ml nk细胞已被证明具有增强干扰素γ(inf-γ)产生的作用以及具有对肿瘤细胞的细胞毒性。如本文所示,将抗-npm1c car引入此类ml nk细胞导致细胞诱导表达npm1c的靶细胞凋亡,并降低此类靶细胞的总体存活率。此外,当将表达npm1c的aml细胞注射到小鼠体内时,本公开的表达工程化car的ml nk细胞降低了体内的总体肿瘤负荷。如本文进一步描述的,当这种细胞表达人分泌型或膜结合型il-15时,表达工程化car的ml nk细胞的功效增强。特别是,本公开的表达人膜结合型il-15的工程化car表达ml nk细胞显示出更高的持久性和存活率,和更强的功效。
131.因此,本文所述表达car多肽的ml nk细胞可用于靶向免疫疗法,以治疗携带npm1c突变的癌症。例如,本文公开的表达car多肽的ml nk细胞可用于治疗aml的靶向免疫疗法。在一个方面,本文提供表达car的ml nk细胞,当npm1c新表位与mhc i类蛋白(例如hla-a2)复合(或由其呈递)时,所述car特异性结合包含该表位的抗原。在一个方面中,本文提供表达car的ml nk细胞,该car特异性结合具有以下氨基酸序列的一个或多个新表位:aiqdlclav(seq id no:1)、aiqdlcvav(seq id no:71)、claveevsl(seq id no:72)、veevslrk(seq id no:73)、aveevslr(seq id no:74)、aveevslrk(seq id no:75)、claveevslrk(seq id no:76),当这种表位与mhc i类蛋白(如hla-a2)复合时。在一个方面,本文提供表达car的ml nk细胞,该car不结合或基本上不结合单独的mhc i类蛋白。在一个方面,本文提供表达car的ml nk细胞,该car不结合或基本不结合与mhc i类蛋白复合的对照肽(例如,其中所述对照肽是ny-eso-1表位(例如,包含seq id no:62的肽)或流感病毒m1表位(如,包含seg id no:63的肽)。在一个方面,本文提供的是表达car的ml nk细胞,其不结合或基本上不结合单独的npm1c新表位(无mhc i类蛋白)。在一些方面,所述npm1c新表位包含氨基酸序列aiqdlclav(seq id no:1),并且所述mhc i类蛋白是hla-a2蛋白(例如,由hla-a*02:01等位基因编码的蛋白)。在一些方面,抗原位于癌细胞(例如,其中癌症为npm1c+,例如,其中癌症为aml)表面上。在一个方面,本文提供表达car的ml nk细胞,该car与包含aiqdlclav(seq id no:1)的氨基酸序列特异性结合,所述氨基酸序列与hla-a2蛋白(例如,由hla-a*02:01等位基因编码的蛋白)复合。
132.在一个方面,本文提供的药物组合物包含本文所述的表达car的记忆样nk细胞(以及任选的药学上可接受的载体)。
133.在一个方面,本文所述细胞因子诱导的记忆样nk细胞表达的car多肽包含细胞内结构域、跨膜结构域和细胞外结构域,其中所述细胞外结构域特异性结合包含aiqdlclav(seq id no:1)的氨基酸序列,该氨基酸序列与hla-a2蛋白(例如,由hla-a*02:01等位基因编码的蛋白)复合。
134.在一个方面,car多肽的表达将ml nk细胞靶向在其表面显示npm1c新表位的癌细
胞(例如,其中癌症为aml),所述npm1c新表位与i类主要组织相容性复合体(mhc i类)蛋白(例如,hla-a2)复合。在一个方面,car多肽的表达将ml nk细胞靶向癌细胞(例如,其中癌症为aml),其表面显示与hla-a2蛋白(例如,由hla-a*02:01等位基因编码的蛋白)复合的氨基酸序列aiqdlclav(seq id no:1)。
135.在一个方面,本文提供治疗受试者(例如人类)癌症的方法,其中包含该癌症的细胞的细胞表面显示与mhc i类蛋白(例如hla-a2)复合的npm1c新表位,该方法包括向受试者施用本文所述的表达抗-npm1c car的记忆样nk细胞或所述细胞的群体。在一个方面,包含该癌症的细胞的细胞表面显示与mhc i类蛋白(例如hla-a2)复合的npm1c新表位。在一个方面,包含该癌症的细胞的细胞表面显示与hla-a2蛋白(例如,由hla-a*02:01等位基因编码的蛋白)复合的包含aiqdlclav(seq id no:1)的氨基酸序列。
136.在一些方面,本文提供治疗受试者(例如,人)npm1c阳性癌症的方法,该方法包括向受试者施用本文所述的表达抗-npm1c car的记忆样nk细胞或所述细胞的群体。
137.在一个方面,本文提供治疗受试者(例如,人)aml的方法,所述方法包括向受试者施用本文所述的表达抗-npm1c car的记忆样nk细胞或所述细胞的群体。
138.表达抗-npm1c嵌合抗原受体的细胞因子诱导的记忆样nk细胞
139.在一些实施方式中,本公开提供一种细胞因子诱导的记忆样(ml)nk细胞或所述细胞的群体,其设计用于表达嵌合抗原受体(car)多肽,所述嵌合抗原受体多肽包含细胞外结构域,其特异性结合包含npm1c新表位的抗原,所述npm1c新表位与i类主要组织相容性复合体(mhc i类)蛋白复合。
140.嵌合抗原受体多肽
141.在一些实施方式中,对细胞因子诱导的记忆样nk细胞工程化以表达car多肽。在一些实施方式中,car多肽包含:包含抗体或其抗原结合片段或本文所述双特异性分子的细胞外结构域。
142.car是一种基因工程化的人工膜结合型蛋白,当在免疫效应细胞(例如,细胞因子诱导的记忆样nk细胞)中表达时,将这种免疫效应细胞导向抗原,并通常刺激免疫效应细胞杀死显示抗原的细胞。因此,car可用于向免疫效应细胞给予所需的抗原特异性,例如抗肿瘤特异性(尤其是car的细胞外结构域给予的抗原特异性)。
143.car通常包含结合细胞上显示的一种或多种抗原的细胞外结构域、跨膜结构域和细胞内结构域,所述细胞外结构域与一种或几种抗原结合后,将激活信号传递给免疫效应细胞。在某些实施方式中,car包含三个结构域:1)细胞外结构域,通常包含信号肽、配体或抗原识别区域(例如scfv)和柔性间隔区;2)跨膜(tm)结构域;3)通常包含一种或多种信号传导结构域的细胞内结构域(也称为细胞质结构域)。car的细胞外结构域位于细胞外,暴露于细胞外空间,因此可以与配体/抗原相互作用。tm域允许car锚定在效应细胞的细胞膜中。car的细胞内结构域可包含一个或多个来源于信号转导蛋白的细胞质结构域,该信号转导蛋白与来源于细胞外结构域的蛋白质不同。细胞内结构域在car与其配体/抗原结合时有助于效应细胞激活。在一些实施方式中,效应细胞激活包括诱导细胞因子和趋化因子的产生,以及激活效应细胞的细胞溶解活性。在一些实施方式中,car将细胞毒性重定向至肿瘤细胞。
144.car的抗原结合结构域与其靶细胞表面的靶抗原结合,导致car聚集,并向含car的
细胞传递激活刺激。在一些实施方式中,car的主要特征是它们能够重定向免疫效应细胞特异性,从而触发增殖、细胞因子产生、吞噬或产生可以主要组织相容性(mhc)独立方式介导靶抗原表达细胞的细胞死亡的分子,开拓单克隆抗体、可溶性配体或细胞特异性共受体的细胞特异性靶向能力。
145.在一些实施方式中,本文提供的car多肽包含结合新抗原(例如,癌症或肿瘤新抗原)的细胞外结构域。癌症新抗原是由于癌细胞发生突变而仅存在于癌细胞中的抗原。癌抗原可在细胞内表达,并由癌细胞表面的mhc i类蛋白呈递。例如,本文所设想的car多肽靶向的癌症新抗原可以是npm1c:hla-a2。在一些实施方式中,本文所述的抗体或抗原结合片段(例如,scfv)用于制备car多肽。在一些实施方式中,使用结合npm1c:hla-a2的抗体或其抗原结合片段(例如,scfv)来生成car多肽。在一些实施方式中,car多肽的细胞外结合结构域与突变的核磷蛋白新表位(例如npm1c新表位)结合,该表位与i类主要组织相容性复合体(mhc i类)蛋白(例如hla-2)复合(或由其呈递)。
146.在一些方面,本文提供的car多肽包含细胞外(抗原结合)结构域、跨膜结构域和细胞内(细胞质)结构域,当抗原结合结构域与抗原结合时,所述细胞内(细胞质)结构域包含足以刺激nk细胞的cd3ζ序列的细胞质序列,并且任选地当抗原结合域与抗原结合时,包含提供nk细胞的共刺激的一个或多个(例如,二个、三个或四个)共刺激蛋白的细胞质序列(例如,b7-h3、btla、cd2、cd7、cd27、cd28、cd30、cd40、cd40l、cd80、cd160、cd244、icos、lag3、lfa-1、light、nkg2c、4-1bb、ox40、pd-1、pd-l1、tim3、2b4、dap10、cd137、dap12中的一个或多个的细胞质序列以及特异性结合cd83的配体)。
147.在一些实施方式中,car还可以包括接头。包括示例性细胞外(抗原结合)结构域、接头、跨膜结构域和细胞内(细胞质)结构域的car和表达car的免疫效应细胞的其他方面在以下中描述,如kakarla等人,cancer j.20:151-155,2014;srivastava等人,trends immunol.36:494-502,2015;nishio等人,oncoimmunology 4(2):e988098,2015;ghorashian等人,br.j.haematol.169:463-478,2015;levine,cancer gene ther.22:79-84,2015;jensen等人,curr.opin.immunol.33:9-15,2015;singh等人,cancer gene ther.22:95-100,2015;li等人,zhongguo shi yan xue ye xue za zhi 22:1753-1756,2014;gill等人,immunol.rev.263:68-89,2015;magee等人,discov.med.18:265-271,2014;gargett等人,front.pharmacol.5:235,2014;yuan等人,zhongguo shi yan xue ye xue za zhi 22:1137-1141,2014;pedgram等人,cancer j.20:127-133,2014;eshhar等人,cancer j.20:123-126,2014;ramos等人,cancer j.20:112-118,2014;maus等人,blood 123:2625-2635,2014;jena等人,curr.hematol.malig.rep.9:50-56,2014;maher等人,curr.gene ther.14:35-43,2014;riches等人,discov.med.16:295-302,2013;cheadle等人,immunol.rev.257:83-90,2014;davila等人,int.j.hematol.99:361-371,2014;xu等人,cancer lett.343:172-178,2014;kochenderfer等人,nat.rev.clin.oncol.10:267-276,2013;hosing等人,curr.hematol.malig.rep.8:60-70,2013;hombach等人,curr.mol.med.13:1079-1088,2013;xu等人,leuk.lymphoma 54:255-260,2013;gilham等人,trends mol.med.18:377-384,2012;lipowska-bhalla等人,cancer immunol.immunother.61:953-962,2012;chmielewski等人,cancer immunol.immunother.61:1269-1277,2013;jena等人,blood 116:1035-1044,2010;dotti
等人immunology reviews 257(1):107-126,2013;dai等人,journal of the national cancer institute 108(7):djv439,2016;wang和riviere,molecular therapy-oncolytics 3:16015,2016;美国专利申请公开号2018/0057609;2018/0037625;2017/0362295;2017/0137783;2016/0152723;2016/0206656;2016/0199412;2016/0208018;2015/0232880;2015/0225480;2015/0224143;2015/0224142;2015/0190428;2015/0196599;2015/0152181;2015/0140023;2015/0118202;2015/0110760;2015/0099299;2015/0093822;2015/0093401;2015/0051266;2015/0050729;2015/0024482;2015/0023937;2015/0017141;2015/0017136;2015/0017120;2014/0370045;2014/0370017;2014/0369977;2014/0349402;2014/0328812;2014/0322275;2014/0322216;2014/0322212;2014/0322183;2014/0314795;2014/0308259;2014/0301993;2014/0296492;2014/0294784;2014/0286973;2014/0274909;2014/0274801;2014/0271635;2014/0271582;2014/0271581;2014/0271579;2014/0255363;2014/0242701;2014/0242049;2014/0227272;2014/0219975;2014/0170114;2014/0134720;2014/0134142;2014/0120622;2014/0120136;2014/0106449;2014/0106449;2014/0099340;2014/0086828;2014/0065629;2014/0050708;2014/0024809;2013/0344039;2013/0323214;2013/0315884;2013/0309258;2013/0288368;2013/0287752;2013/0287748;2013/0280221;2013/0280220;2013/0266551;2013/0216528;2013/0202622;2013/0071414;2012/0321667;2012/0302466;2012/0301448;2012/0301447;2012/0060230;2011/0213288;2011/0158957;2011/0104128;2011/0038836;2007/0036773和2004/0043401,所有这些都通过本引用并入本文。
148.包括示例性细胞外(抗原结合)结构域、接头、跨膜结构域和细胞内(细胞质)结构域的car和表达car的免疫效应细胞的其他方面在以下中描述:wo 2016/168595;wo 12/079000;2015/0141347;2015/0031624;2015/0030597;2014/0378389;2014/0219978;2014/0206620;2014/0037628;2013/0274203;2013/0225668;2013/0116167;2012/0230962;2012/0213783;2012/0093842;2012/0071420;2012/0015888;2011/0268754;2010/0297093;2010/0158881;2010/0034834;2010/0015113;2009/0304657;2004/0043401;2014/0322253;2015/0118208;2015/0038684;2014/0024601;2012/0148552;2011/0223129;2009/0257994;2008/0160607;2008/0003683;2013/0121960;2011/0052554和2010/0178276,所有这些都通过本引用并入本文。
149.在一些方面,本文提供的car包含细胞内结构域、跨膜结构域和细胞外结构域,其中细胞外结构域包含任何抗体或其抗原结合片段,或本文描述的双特异性分子。在一些方面,本文提供的嵌合抗原受体(car)包含细胞内结构域、跨膜结构域和细胞外结合结构域,其中细胞外结合结构域包含任何抗体或其抗原结合片段或本文描述的双特异性分子,其中该抗体、其抗原结合片段或双特异性分子与包含npm1c新表位的抗原结合,该npm1c表位与i类主要组织相容性复合体(mhc i类)蛋白复合(或由其呈递)。
150.在一些方面,本文提供的嵌合抗原受体(car)具有实施例部分中描述的npm1c car的细胞内、跨膜和/或细胞外结构域(例如,参见实施例1)。
151.在一些方面,本文提供的car包含细胞内结构域,其包含选自以下的一个或多个共刺激分子的一个或多个共刺激结构域:cd27、cd28、4-1bb、ox40、cd30、cd40、pd-1、icos、
2b4、dap10、cd137和dap12。在特定实施方式中,本文提供的car包含:包含cd3-ζ信号传导结构域并且可选地包含4-1bb共刺激结构域的细胞内结构域。在一些方面,本文提供的car包含cd3-ζ、cd8、cd28、nkg2d、cd16、nkp44或nkp46的跨膜结构域。在特定实施方式中,本文提供包含cd8跨膜结构域的跨膜结构域的car。在一些方面,本文提供的car包含含有本文所述任何抗体或其抗原结合片段的细胞外结构域(例如,scfv)。在特定实施方式中,本文提供的car包含含有本文所述的任何抗体或其抗原结合片段的细胞外结构域(例如,scfv),其特异性结合包含突变的核磷蛋白表位(例如,npm1c新表位)的抗原,该表位与i类主要组织相容性复合体(mhc i类)蛋白(例如,hla-a2)复合(或由其呈递)。在特定实施方式中,本文提供的car包含含有本文描述的任何抗体或抗原结合片段的细胞外结构域(例如,scfv),其与包含aiqdlclav(seq id no:1)新表位的抗原特异性结合,所述新表位与i类主要组织相容性复合体(mhc i类)蛋白(例如,hla-a2)复合(或由其呈递)。在特定实施方式中,本文提供的car多肽包含含有本文所述的任何抗体或抗原结合片段的细胞外结构域(例如,scfv),其包含vh和vl,其中所述vh包含seq id no:5的氨基酸序列或与seq id no:5具有至少75%、80%、85%、90%、95%、98%或99%同一性的氨基酸序列,并且其中所述vl包含seq id no:3的氨基酸序列或与seq id no:3具有至少75%、80%、85%、90%、95%、98%或99%同一性的氨基酸序列。在特定实施方式中,本文提供的car多肽包含含有本文所述任何抗体或其抗原结合片段的细胞外结构域(例如,scfv),其包含vh,其中所述vh包含具有seq id no:9的氨基酸序列的vh cdr1、具有seq id no:10的氨基酸序列的vh cdr2、具有seq id no:11的氨基酸序列的cdr3,和/或包含vl,其包含具有seq id no:6的氨基酸序列的vl cdr1、具有seq id no:7的氨基酸序列的vl cdr2和具有seq id no:8的氨基酸序列的vl cdr3。在特定实施方式中,本文提供的car多肽包含含有本文所述的任何抗体或抗原结合片段的细胞外结构域(例如,scfv),其包含:包含为具有seq id no:5的氨基酸序列的vh的cdr的vh cdr1、vh cdr2和vh cdr3,和/或包含:包含为具有seq id no:3的氨基酸序列的vl的cdr的vl cdr1、vl cdr2和vl cdr3。在特定实施方式中,本文提供的是car多肽,其包含细胞外结构域,该细胞外结构域包含具有seq id no:2的氨基酸序列的scfv,或包含与seq id no:2具有至少75%、80%、85%、90%、95%、98%或99%同一性的氨基酸序列的scfv。
152.car的细胞外(抗原结合)结构域
153.在一些实施方式中,在细胞因子诱导的记忆样nk细胞中表达的car多肽包含细胞外结构域。在一些实施方式中,细胞外结构域包含抗原结合结构域。
154.抗原结合结构域的非限制性示例包括:单克隆抗体(例如,igg1、igg2、igg3、igg4、igm、ige和igd)(例如,全人或嵌合(例如,人源化)抗体)、抗体的抗原结合片段(例如,fab、fab'或f(ab')2片段)(例如全人或嵌合(例如,人源化)抗体的片段)、双价抗体、三价抗体、四价抗体、微型抗体、scfv、scfv-fc、(scfv)2、scfab、bis-scfv、hc-igg、bite、单结构域抗体(例如,v-nar结构域或vhh结构域)、ignar和多特异性(例如,双特异性抗体)抗体。在一些实施方式中,抗原结合结构域包含scfv。本领域已知制备这些抗原结合结构域的方法。
155.在一些实施方式中,抗原结合结构域包括能够特异性结合到目标抗原的抗体的至少一个(例如,一个、二个、三个、四个、五个或六个)cdr(例如,来自免疫球蛋白轻链可变结构域的三个cdr中的任何一个和/或免疫球蛋白重链可变结构域中三个cdr中的任何一个),例如免疫球蛋白分子(例如轻链或重链免疫球蛋白分子)和免疫球蛋白分子的免疫活性(抗
原结合)片段。
156.在一些实施方式中,抗原结合结构域是单链抗体(例如,v-nar结构域或vhh结构域,或如本文所述的任何单链抗体)。在一些实施方式中,抗原结合结构域是整个抗体分子(例如,人、人源化或嵌合抗体)或多元抗体(例如,双特异性抗体)。
157.在一些实施方式中,抗原结合结构域包括抗体片段和多特异性(例如,双特异性)抗体或抗体片段。抗体及其抗原结合片段的实例包括但不限于:单链fv(scfv)、fab片段、fab'片段、f(ab')2、二硫键fv(sdfv)、fv和包含vl或vh结构域的片段。
158.本文提供的其他抗原结合结构域是多克隆、单克隆、多特异性(多元,例如,双特异性)、人抗体、嵌合抗体(例如,人-鼠嵌合抗体)、单链抗体、细胞内抗体(即,内抗体)及其抗原结合片段。抗体或其抗原结合片段可以是任何类型(例如,igg、ige、igm、igd、iga和igy)、类别(例如igg1、igg2、igg3、igg4、iga1和iga2)或亚类。
159.抗原结合结构域的其他示例是igg的抗原结合片段(例如,igg1、igg2、igg3或igg4的抗原结合片段)(例如人或人源化igg(例如人或人源化igg1、igg2、igg3或igg4)的抗原结合片段)、iga的抗原结合片段(例如,iga1或iga2的抗原结合片段)(例如,人或人源化iga(例如,人或者人源化iga1或者iga2)的抗原结合片段)、igd的抗原结合片段(例如,人或人源化igd抗原结合片段)、ige的抗原结合片段(例如,人或人源化ige的抗原结合片段)或igm的抗原结合片段(例如,人或人源化igm的抗原结合片段)。
160.在一些实施方式中,例如,在盐水或磷酸盐缓冲盐水中,抗原结合结构域可以以约或高于1x10-7
m(例如,约或高于1x10-8
m、约或高于1x10-9
m、约或高于500nm、约或者高于100nm、约或者高于25nm、约或高于15nm、约或高于7nm、约或高于5nm,或者约或高于1nm)的亲和力(kd)与特定抗原(例如肿瘤相关抗原)结合。
161.如本领域技术人员所理解的,要包括在car中的抗原结合结构域的选择取决于要在需要的受试者中被靶向的限定细胞(例如癌细胞或肿瘤)表面的配体的类型和数量。例如,可以选择抗原结合结构域来识别肿瘤特异性抗原(tsa),例如癌症新抗原。例如,所述肿瘤特异性抗原可以是与mhc i类蛋白(例如hla-a2)复合(或由其呈递)的nmp1c新抗原,例如npm1c:hla-a2。在一些实施方式中,nmp1c新抗原包含氨基酸序列aiqdlclav(seq id no:1)。
162.在一些实施方式中,car多肽包含识别急性髓系白血病的肿瘤抗原的抗原结合结构域。在一些实施方式中,所述肿瘤抗原是肿瘤特异性抗原(tsa),例如急性髓系白血病新抗原。tsa是肿瘤细胞特有的,不会在体内其他细胞上发生。在一个实施方式中,所述肿瘤抗原是肿瘤特异性抗原。在某些实施方式中,所述肿瘤特异性抗原通过对患者的肿瘤细胞进行测序并识别仅在肿瘤中发现的突变蛋白来确定。这些抗原被称为“新抗原”。一旦新抗原被识别,就可以产生针对它的治疗性抗体,并用于本文所述的方法。在一个实施方式中,所述新抗原是npm1c新抗原。在一个实施方式中,nmp1c新抗原与mhc i类蛋白(例如,hla-a2)复合(或由其呈递)(例如npm1c:hla-a2)。
163.car效应细胞(例如car ml nk细胞)可能靶向的肿瘤抗原(例如肿瘤相关抗原(taa)和肿瘤特异性抗原(tsa))包括但不限于npm1c:hla-a2。在一个实施方式中,所述肿瘤特异性抗原是npm1c:hla-a2。
164.在一些实施方式中,car包含细胞外结构域,其特异性地结合包含新表位(例如,癌
症新表位)的抗原,该新表位与mhc蛋白(例如,mhc i类蛋白)复合(或由其呈递)。在一些实施方式中,所述细胞外结构域不结合或基本上不结合单独的mhc蛋白。在一些实施方式中,所述细胞外结构域不结合或基本上不结合与mhc蛋白复合的对照肽。在一些实施方式中,所述细胞外结构域不结合或基本上不结合单独的新表位(无mhc蛋白)。
165.功能性mhc i类分子包含重α链和β2-微球蛋白链。mhc i类分子的肽结合通过肽氨基酸侧链与mhc分子肽结合槽内的离散口袋相互作用实现,mhc分子的肽结合槽由重链的α1和α2结构域形成。通常,对于人白细胞抗原(hla),主要结合能分别来自肽的位置2和c端中的残基与mhc分子的b和f结合口袋的相互作用,尽管肽中的侧链可以促进或减少mhc结合能力(参见例如guo等人,(1992)nature 360:364;silver等人,(1992)nature 360:367;gorga等人,(1992)proteins 12;87;madden(1995)annu rev immunol 13:587;madden等人,(1993)cell 75;693;madden等人,(1992)cell 70:1035;bjorkman等人,(1987)nature 329:512;saper等人,(1991)j mol biol 219:277)。对于具有9个氨基酸残基的肽,c端残基(位置9)与mhc分子的f结合口袋相互作用。
166.mhc分子具有极强的多态性,在i类a和b基因座上已鉴定出数千种等位基因变体。大多数多态性发生在肽结合口袋中,因此mhc分子具有一系列肽结合特异性。尽管存在多态性,但本领域已知hla i类分子可根据共享肽结合特异性聚为组(即超型)。每个组(超型)由肽一致序列定义,该序列反映了肽的位置,即“锚定残基”或对mhc结合很重要的残基。例如a2超型的hla-i类分子(即hla-a2或hla-a*02等位基因组编码的蛋白质)与位于位置2的小残基和脂肪族残基(如丙氨酸、酪氨酸、丝氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸、谷氨酰胺)以及位于肽的c端的脂肪族(如亮氨酸、异亮氨酸、缬氨酸、蛋氨酸)或小疏水残基(例如,丙氨酸、缬氨酸)共享肽的特异性结合(参见,例如,sidney等人(2008)bmc immunology 9:1)。
167.在一些实施方式中,细胞外结构域与包含急性髓系白血病(aml)相关突变核磷蛋白新表位的抗原结合(例如,特异性结合),该新表位与mhc i类蛋白(例如hla-a2)复合(或由其呈递)(例如npm1c:hla-a2)。
168.aml的基因组分析显示,与大多数其他成人癌症相比,aml患者的突变负荷较低,平均每个aml患者有13个编码突变(见ley等人,n engl j med 368:2059(2013);alexandrov等人,nature 500:415(2013);kandoth等人,nature 502 333(2013))。然而,aml的体细胞突变通常发生在相同的基因中(见ley等人,n engl j med 368:2059(2013);papaemmanuil等人,n engl j med 374:2209(2016))并且这些热点突变产生的新抗原因此成为肿瘤特异性免疫疗法的诱人靶点(见van der lee等人,j clin invest 129:774(2019))。最常见的突变是编码核磷蛋白(npm1;由npm1编码)的关键驱动基因中的4核苷酸重复,这种突变发生在30-35%的成人aml患者中(见ley等人,n engl j med 368:2059(2013);papaemmanuil等人,n engl j med 374:2209(2016);falini等人,n engl j med 352:254(2005))。npm1的这种突变导致其细胞质定位异常,突变蛋白被称为npm1c。aml相关npm1c突变蛋白产生一种hla i类限制的并在具有hla-a*02:01等位基因和其他一些等位基因的白血病患者的白血病母细胞上出现的白血病新抗原。例如,npm1c产生白血病特异性新抗原表位(aiqdlclav(seq id no:1),缩写为aiq),由最常见的hla-a*0201等位基因(约占人类人口的50%)呈递(见greiner等人,blood 120:1282(2012))。
169.在一些实施方式中,细胞外结构域与包含npm1c新表位的抗原结合,该新表位与mhc i类蛋白(例如hla-a2)复合(或由其呈递)。npm1c新表位的长度是对结合mhc i类分子的肽来说合理的任何长度。在一些实施方式中,npm1c新表位的长度为5-20个氨基酸、6-19个氨基酸、7-18个氨基酸、8-17个氨基酸、8-16个氨基酸、8-15个氨基酸、8-15个氨基酸、8-14个氨基酸、8-13个氨基酸、8-12个氨基酸、9-12个氨基酸或9-11个氨基酸。在一些实施方式中,npm1c新表位的长度为20、19、18、17、16、15、14、13、12、11、10、9、8、7、6或5个氨基酸。在一些实施方式中,npm1c新表位的长度为12个氨基酸。在一些实施方式中,npm1c新表位的长度为11个氨基酸。在一些实施方式中,npm1c新表位的长度为10个氨基酸。在一些实施方式中,npm1c新表位的长度为9个氨基酸。在一些实施方式中,npm1c新表位的长度为8个氨基酸。在一些实施方式中,npm1c新表位是长度为10、15、20、30、40、50或100个氨基酸残基的多肽内的20、19、18、17、16、15、14、13、12、11、10、9、8、7、6或5个连续氨基酸的肽。
170.在一些实施方式中,npm1c新表位结合mhc i类蛋白hla-a2。在一些实施方式中,结合hla-a2的npm1c新表位包含氨基酸序列,其中所述氨基酸序列的位置2是小脂肪族残基(例如,丙氨酸、酪氨酸、丝氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸、谷氨酰胺),并且其中所述氨基酸序列的c端残基是脂肪族残基(例如亮氨酸、异亮氨酸、缬氨酸、蛋氨酸)或小疏水残基(如丙氨酸、缬氨酸)。在一些实施方式中,结合hla-a2的npm1c新表位包含氨基酸序列,其中所述氨基酸序列的位置2是缬氨酸、异亮氨酸或亮氨酸,所述氨基酸序列的c端残基是缬氨酸,亮氨酸或异亮氨酸。在一些实施方式中,其中所述npm1c新表位的长度为8个氨基酸残基,c端氨基酸为位置8。在一些实施方式中,其中所述npm1c新表位的长度为9个氨基酸残基,c端氨基酸为位置9。在一些实施方式中,其中所述npm1c新表位的长度为10个氨基酸残基,c端氨基酸为位置10。在一些实施方式中,其中所述npm1c新表位的长度为11个氨基酸残基,c端氨基酸为位置11。其中所述npm1c新表位的长度为12个氨基酸残基,c端氨基酸为位置12。
171.本领域已知来自npm1c的与hla-a2结合的新表位。例如,greiner(2012)blood 120:1282确定了与hla-a2结合的9-mer npm1c新表位的氨基酸序列,其包括:aiqdlclav(seq id no:1)和aiqdlcvav(seq id no:71)。作为另一个例子,van der lee(2019)j clin invest 129:774确定了与hla-a2 i类分子结合的npm1c新表位的氨基酸序列,其包括claveevsl(seq id no:72),以及与其他hla单倍型编码的mhc i类分子结合的npm1c新表位的氨基酸序列,其包括veevslrk(seq id no:73)、aveevslr(seq id no:74)、aveevslrk(seq id no:75)和claveevslrk(seq id no:76)。
172.在一些实施方式中,细胞外结构域结合(例如,特异性结合)包含突变的核磷蛋白的新表位的抗原,该表位与mhc i类蛋白(例如npm1c:hla-a2)复合(或由其呈递),其中核磷蛋白中的突变是由于编码核磷蛋白的基因中的四核苷酸重复引起的。在一些实施方式中,细胞外结构域与包含细胞质(位于细胞质中)突变核磷蛋白新表位的抗原结合(例如,特异性结合),该表位与mhc i类蛋白(例如npm1c:hla-a2)复合(或由其呈递)。在一些实施方式中,所述新表位来自突变核磷蛋白的8、9、10、11或12氨基酸肽。在一些实施方式中,所述新表位来自突变核磷蛋白的10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100个氨基酸残基的8、9、10、11或12氨基酸肽。在一些实施方式中,所述新表位来自在突变核磷蛋白c端的10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100个氨基
酸残基的8、9、10、11或12氨基酸肽。在一些实施方式中,所述突变核磷蛋白包含由seq id no:56所示的氨基酸序列。在一些方面,所述突变核磷蛋白新表位是来自包含氨基酸序列为seq id no:56的蛋白质的8、9、10、11或12氨基酸肽。在一些实施方式中,所述突变核磷蛋白新表位是来自由seq id no:56所示的氨基酸序列的10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100个氨基酸残基的8、9、10、11或12氨基酸肽。在一些实施方式中,突变的核磷蛋白新表位是来自在具有由seq id no:56所示的氨基酸序列的蛋白质的c端的10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100个氨基酸残基的8、9、10、11或12氨基酸肽。在一些实施方式中,细胞外结构域与抗原特异性结合,该抗原包含:包含氨基酸序列为seq id no:56的蛋白的新表位,所述新表位与mhc i类蛋白(例如hla-a2蛋白)复合(或由其呈递)。
173.在一些实施方式中,突变核磷蛋白包含c端氨基酸序列mtdqeaiqdlclaveevslrk(seq id no:57)。在一些实施方式中,细胞外结构域与包含含有c端氨基酸序列mtdqeaiqdlclaveevslrk(seq id no:57)的npm1c蛋白的新表位的抗原特异性结合,该新表位与mhc i类蛋白(例如,hla-a2蛋白)复合(或由其呈递)。在一些实施方式中,所述新表位是来自npm1c蛋白的c端氨基酸序列mtdqeaiqdlclaveevslrk(seq id no:57)的8、9、10、11或12氨基酸肽。在一些实施方式中,细胞外结构域与包含npm1c新表位的抗原特异性结合,该新表位与hla-a2蛋白或由hla-a*02等位基因组编码的蛋白(即npm1c:hla-a2)复合(或由其呈递)。在一些实施方式中,npm1c是人npm1c。
174.在一些实施方式中,细胞外结构域与包含细胞质突变核磷蛋白新表位的抗原结合(例如,特异性结合),所述新表位与mhc i类蛋白(例如,hla-a2蛋白或由hla-a*02等位基因组编码的蛋白复合(或由其呈递),其中所述新表位的氨基酸序列包括:aiqdlclav(seq id no:1)、aiqdlcvav(seq id no:71)、claveevsl(seq id no:72)、veevslrk(seq id no:73)、aveevslr(seq id no:74)、aveevslrk(seq id no:75)或claveevslrk(seq id no:76)。在一些实施方式中,细胞外结构域与包含选自以下的由hla-a2呈递的氨基酸序列的抗原结合:aiqdlclav(seq id no:1)、aiqdlcvav(seq id no:71)、claveevsl(seq id no:72)、veevslrk(seq id no:73)、aveevslr(seq id no:74)、aveevslrk(seq id no:75)和claveevslrk(seq id no:76)。在一些实施方式中,细胞外结构域与包含由hla-a2呈递的氨基酸序列aiqdlclav(seq id no:1)的抗原结合。
175.在一些实施方式中,细胞外结构域不结合或基本上不结合单独的mhc i类蛋白和/或不结合或基本上不结合与mhc i类蛋白复合的对照肽(例如,其中所述对照肽与新表位具有相同数量的氨基酸,但来自于不同于新表位所来自的蛋白质的蛋白质)。
176.在一些实施方式中,细胞外结构域不结合或基本上不结合单独的细胞质突变核磷蛋白新表位(无mhc i类蛋白,例如hla-a2)。
177.在一些实施方式中,npm1c新表位包含氨基酸序列aiqdlclav(seq id no:1),且mhc i类蛋白是hla-a2蛋白(例如,由hla-a*02:01等位基因编码的蛋白质)。在一些实施方式中,npm1c新表位包含选自以下的氨基酸序列:aiqdlcvav(seq id no:71)、claveevsl(seq id no:72)、veevslrk(seq id no:73)、aveevslr(seq id no:74)、aveevslrk(seq id no:75)和claveevslrk(seq id no:76),且mhc i类蛋白是hla-a2蛋白(例如,由hla-a*02:01等位基因编码的蛋白质)。
178.在一些实施方式中,细胞外结构域特异性结合包含新表位的抗原,所述新表位包含氨基酸序列aiqdlclav(seq id no:1),所述氨基酸序列与i类主要组织相容性复合体(mhc i类)蛋白复合,其中氨基酸序列aiqdlclav(seq id no:1)的任何一个、二个、三个、四个、五个或六个氨基酸被取代。在一些实施方式中,细胞外结构域特异性结合包含新表位的抗原,所述新表位包含与i类主要组织相容性复合体(mhc i类)蛋白复合的氨基酸序列aiqdlclav,其中氨基酸序列aiqdlclav的任何一个、二个、三个或四个氨基酸被取代。在一些实施方式中,氨基酸取代是保守的氨基酸取代。在一些实施方式中,氨基酸取代是具有与aiqdlclav序列(seq id no:1)中现有残基的大小相似的氨基酸残基的取代。在一些实施方式中,氨基酸取代不影响(或基本上不影响)细胞外结构域与抗原的结合。
179.在一些实施方式中,细胞外结构域与包含新表位的抗原特异性结合,所述新表位包含氨基酸序列aiqdlclav,其与i类主要组织相容性复合体(mhc i类)蛋白复合,其中氨基酸序列aiqdlclav(seq id no:1)的一个、二个或多个锚定残基被取代(例如,seq id no:1的位置2和/或位置9,例如,aiqdlclav(seq id no:1)的下划线残基)。在一些实施方式中,氨基酸取代不影响(或基本上不影响)细胞外结构域与抗原的结合或新表位与i类主要组织相容性复合体(mhc i类)蛋白(例如,hla-a2)的结合。在一些实施方式中,aiqdlclav(seq id no:1)的第二位置的氨基酸残基i被氨基酸残基l(亮氨酸)取代。在一些实施方式中,aiqdlclav(seq id no:1)第二位置的氨基酸残基i被氨基酸残基v(缬氨酸)、m(蛋氨酸)、酪氨酸(t)、丝氨酸(s)、谷氨酰胺(q)或a(丙氨酸)取代。在一些实施方式中,aiqdlclav(seq id no:1)第九位置的氨基酸残基v被氨基酸残基i(异亮氨酸)、l(亮氨酸)、m(蛋氨酸)或a(丙氨酸)取代。
180.在一些实施方式中,细胞外结构域特异性结合包含新表位的抗原,所述新表位包含与i类主要组织相容性复合体(mhc i类)蛋白复合的氨基酸序列aiqdlclav,其中氨基酸序列aiqdlclav(seq id no:1)的任何一个、二个、三个、四个、五个或六个氨基酸被取代,其中所述取代是保守氨基酸取代。在一些实施方式中,细胞外结构域与包含新表位的抗原特异性结合,所述新表位包含表1中示出的氨基酸序列,其与mhc i类蛋白复合。
181.表1:aiq新表位的保守取代
[0182][0183]
在一些实施方式中,细胞外结构域特异性结合与i类主要组织相容性复合体(mhc i类)蛋白复合的氨基酸序列aiqdlclav(seq id no:1),其中所述氨基酸序列aiqdlclav(seq id no:1)的任何一个、二个、三个、四个、五个或六个氨基酸被取代,其中,细胞外结构域对与mhc i类蛋白复合的氨基酸序列aiqdlclav(seq id no:1)具有相同或基本相同的结合亲和力。在一些实施方式中,细胞外结构域特异性结合与i类主要组织相容性复合体(mhc i类)蛋白复合的氨基酸序列aiqdlclav(seq id no:1),其中氨基酸序列aiqdlclav(seq id no:1)的任何一个、二个、三个、四个、五个或六个氨基酸被取代,其中细胞外结构域以相同或更好的亲和力特异性结合与mhc i类蛋白复合的氨基酸序列aiqdlclav(seq id no:1)。在一些实施方式中,细胞外结构域结合与i类主要组织相容性复合体(mhc i类)蛋白复合的氨基酸序列aiqdlclav(seq id no:1),其中氨基酸序列aiqdlclav(seq id no:1)的任何一个、二个、三个、四个、五个或六个氨基酸被取代,其中抗体或抗原结合片段的kd为0.1至100nm(例如,0.1至50nm、0.1至25nm、1 0.1至15nm)。在一些实施方式中,细胞外结构域结合与i类主要组织相容性复合体(mhc i类)蛋白复合的氨基酸序列aiqdlclav(seq id no:1),其中氨基酸序列aiqdlclav(seq id no:1)的任何一个、二个、三个、四个、五个或六个氨基酸被取代,其中细胞外结构域以小于100nm(例如,小于50nm、小于25nm、小于15nm、小于7nm、小于6nm、小于5nm、小于4nm、小于3nm、小于2nm、小于1nm、小于0.9nm、小于0.8nm、小于0.7nm、小于0.6nm、小于0.5nm、小于0.4nm、小于0.3nm、小于0.2nm、或小于0.1nm)的kd结合。
[0184]
在一些实施方式中,细胞外结构域结合由mhc i类蛋白如hla-a2(npm1c:hla-a2)呈递的npm1c表位,并且具有抗癌或抗肿瘤作用(例如,体内抗癌作用,任选地,其中癌症为aml)。
[0185]
在一些实施方式中,细胞外结构域特异性结合包含与i类主要组织相容性复合体(mhc i类)蛋白复合的npm1c新表位的抗原,其中细胞外结构域包含重链可变区(vh)和轻链可变区域(vl)。在一些实施方式中,新表位包含含有aiqdlclav(seq id no:1)的氨基酸序
列。在一些实施方式中,mhc i类蛋白由包含hla-a*02等位基因组的hla-a等位基因编码。在一些实施方式中,hla-a等位基因是hla-a*02:01。
[0186]
在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗体或其抗原结合片段,其具有本文所述的重链可变区和/或轻链可变区。在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗体或其抗原结合片段,其具有本文所述的一个或多个互补决定区(cdr)(例如,具有npm1c-scfv的cdr,参见,例如,序列部分和实施例)。在一些实施方式中,结合npm1c:hla-a2的细胞外结构域包含scfv。特异性结合npm1c:hla-a2的scfv的示例性氨基酸序列在seq id no:2中示出。在一些实施方式中,scfv包含与seq id no:2中所示氨基酸序列具有至少75%、至少80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性的氨基酸序列,scfv包含与seq id no:2中所示氨基酸序列具有至少75%、80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性的氨基酸序列,其中,与seq id no:2中所示氨基酸序列的同一性差异的至少95%位于scfv的框架区(或不在互补决定区(cdr)中)。
[0187]
在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗体或其抗原结合片段,该抗体或其抗原结合片段包含具有氨基酸序列seq id no:5的重链可变区(vh)。在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗体或其抗原结合片段,该抗体或其抗原结合片段包含与seq id no:5中所示氨基酸序列具有至少75%、至少80%、至少85%、至少90%、至少95%、至少98%或至少99%氨基酸序列同一性的重链可变区(vh)。在一些实施方式中,vh包含与seq id no:5中所示氨基酸序列具有至少75%、80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性的氨基酸序列,其中,与seq id no:5中所示氨基酸序列的同一性差异的至少95%位于vh的框架区(或不在互补决定区(cdr)中)。
[0188]
在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗体或其抗原结合片段,该抗体或其抗原结合片段包含氨基酸序列为seq id no:3(npm1c scfv的vl的氨基酸序列)的轻链可变区(vl)。在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗体或其抗原结合片段,该抗体或抗原结合片段包含轻链可变区(vl),该轻链可变区域包含与seq id no:3中所示氨基酸序列具有至少75%、至少80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性的氨基酸序列。在一些实施方式中,vl包含与seq id no:3中所示氨基酸序列具有至少75%、80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性的氨基酸序列,其中,与seq id no:3中所示氨基酸序列同一性差异的至少95%或所有差异位于vl的框架区(或不在互补决定区(cdr)中)。
[0189]
在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗体或其抗原结合片段,该抗体或抗原结合片段包含具有氨基酸序列seq id no:5的重链可变区(vh)和具有氨基酸序列seq id no:3的轻链可变区(vl)。在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗体或其抗原结合片段,该抗体或抗原结合片段包含重链可变区(vh),该重链可变区域包含与seq id no:5中所示氨基酸序列具有至少75%、至少80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性的氨基酸序列,以及轻链可变区(vl),其包含与seq id no:3中所示氨基酸序列具有至少75%、至少80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性的氨基酸序列。在一些实施方式中,vh和vl各自包含分别与seq id no:5和seq id no:3中所示氨基酸序列具有至少75%、80%、至少85%、至少90%、至少95%、至少98%或至少99%同一性的氨基酸序列,其中与seq id no:5和seq id no:3中所
verlag,berlin(2001))。contact cdr位置根据本领域已知的方法确定。在一个方面,使用contact系统确定cdr。在一些实施方式中,细胞外结构域包含具有使用contact系统确定的npm1c scfv的一个或多个互补决定区(cdr)的抗-npm1c:hla-a2抗原结合片段。
[0196]
在一些实施方式中,细胞外结构域包含抗原结合片段,该抗原结合片段特异性结合由hla-a2呈递的npm1c表位,并且根据上述任一系统定义,包含npm1c scfv的一个、二个或三个vh cdr和/或一个、二个或三个vl cdr。例如,在一些实施方式中,细胞外结构域包含抗原结合片段,该抗原结合片段特异性结合由hla-a2呈递的npm1c表位,并且如imgt所定义,包含npm1c scfv的一个、二个或全部三个vh cdr和/或一个、二个或全部三个vl cdr。
[0197]
如本领域所知,vh和vl包含被框架区包围的cdr(cdr和fr序列在vh和vr中以以下顺序出现:fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4)。任选地,框架区是人框架区。
[0198]
在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗原结合片段,该片段包含重链可变区(vh),其具有氨基酸序列为seq id no:5的vh的一个、二个或全部三个vh cdr。在一些实施方式中,如imgt所定义,细胞外结构域包含抗-npm1c:hla-a2-抗原结合片段,其包含具有氨基酸序列为seq id no:5的vh的一个、二个或全部三个vh cdr。
[0199]
在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗原结合片段,该抗原结合片段包含轻链可变区(vl),该轻链可变区具有氨基酸序列为seq id no:3的vl的一个、二个或全部三个vl cdr。在一些实施方式中,如imgt所定义,细胞外结构域包含抗-npm1c:hla-a2抗原结合片段,该抗原结合片段包含具有氨基酸序列为seq id no:3的vl的一个、二个或全部三个vl cdr。
[0200]
在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗原结合片段,该抗原结合片段包含具有氨基酸序列为seq id no:5的vh的一个、二个或全部三个vh cdr的重链可变区(vh),以及具有氨基酸序列为seq id no:3的vl的一、二个或者全部三个vl cdr的轻链可变区(vl)。
[0201]
在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗原结合片段,该抗原结合片段包含重链可变区(vh),该重链可变区具有氨基酸序列为seq id no:9的vh cdr1、氨基酸序列为seq id no:10的vh cdr2和/或氨基酸序列为seq id no:11的vh cdr3。在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗原结合片段,该抗原结合片段包含重链可变区(vh),该重链可变区具有氨基酸序列为seq id no:9的vh cdr1、氨基酸序列为seq id no:10的vh cdr2和氨基酸序列为seq id no:11的vh cdr3,其中seq id no:9、seq id no:10或seq id no:11的一个、二个、三个、四个或五个氨基酸已被取代。在一些实施方式中,氨基酸取代是保守取代。在一些实施方式中,氨基酸取代是具有类似大小的氨基酸残基的取代。在某些实施方式中,氨基酸取代不影响(或基本上不影响)或改善与抗原的结合。
[0202]
在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗原结合片段,该抗原结合片段包含轻链可变区(vl),该轻链可变区具有氨基酸序列为seq id no:6的vl cdr1、氨基酸序列为seq id no:7的vl cdr2和/或氨基酸序列为seq id no:8的vl cdr3。在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗原结合片段,该抗原结合片段包含轻链可变区(vl),该轻链可变区具有氨基酸序列为seq id no:6的vl cdr1、氨基酸序列为seq id no:7的vl cdr2和/或氨基酸序列为seq id no:8的vl cdr3,其中seq id no:6、seq id no:7或seq id no:8的一个、二个、三个、四个或五个氨基酸已被取代。在一些实施方式中,氨基
酸取代是保守取代。在一些实施方式中,氨基酸取代是具有类似大小的氨基酸残基的取代。在某些实施方式中,氨基酸取代不影响(或基本上不影响)或改善与抗原的结合。
[0203]
在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗原结合片段,该抗原结合片段包含具有氨基酸序列为seq id no:9的vh cdr1、氨基酸序列为seq id no:10的vh cdr2和氨基酸序列为seq id no:11的vh cdr3的重链可变区(vh),和/或具有氨基酸序列为seq id no:6的vl cdr1、氨基酸序列为seq id no:7的vl cdr2和氨基酸序列为seq id no:8的vl cdr3的轻链可变区(vl)。在某些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗原结合片段,该抗原结合片段包含具有氨基酸序列为seq id no:9的vh cdr1、氨基酸序列为seq id no:10的vh cdr2和氨基酸序列为seq id no:11的vh cdr3的重链可变区(vh),以及具有氨基酸序列为seq id no:6的vl cdr1、氨基酸序列为seq id no:7的vl cdr2和氨基酸序列为seq id no:8的vl cdr3的轻链可变区(vl)。在一些实施方式中,细胞外结构域包含抗-npm1c:hla-a2抗原结合片段,该抗原结合片段包含本文描述的vh和vl,其中vh和/或vl cdr的一个、二个、三个、四个或五个氨基酸已被取代。
[0204]
在一些方面,只要保持与npm1c:hla-a2的特异性结合,本文所述vh和/或vl区中的一个或多个cdr可以因一个、二个、三个、四个或五个氨基酸而异。
[0205]
在一些方面,本文提供的抗体片段已经亲和成熟,即,与所描述的抗体或片段相比,在一个或多个互补决定区中具有一个或更多的改变,其中所述一个或多个改变导致抗体或片段相对于所描述的抗体或者片段对抗原的亲和力的提高。在一些方面,本文提供的抗体或片段对抗原(例如npm1c:hla-a2)的kd小于100nm(例如,小于50nm、小于25nm、小于15nm、小于7nm、小于6nm、小于5nm、小于4nm、小于3nm、小于2nm、小于1nm、小于0.9nm、小于0.8nm、小于0.7nm、小于0.6nm、小于0.5nm、小于0.4nm、小于0.3nm、小于0.2nm或小于0.1nm)。在一些方面,本文提供的抗体或片段对抗原(例如,npm1c:hla-a2)的kd小于15nm、小于10nm、小于7nm、小于5nm或小于1nm(例如,0.01至15nm、0.01至10nm、0.01至7nm、0.01至5nm、0.01至1nm、0.1至15nm、0.1至10nm、0.1至7nm、0.1至5nm、0.1至1nm、1至15nm、1至10nm、1至7nm、1至5nm、5至15nm、5至10nm、或5至7nm)。
[0206]
在一些实施方式中,细胞外结构域包含抗原结合片段,该抗原结合片段包含三个轻链可变区互补决定区(vl cdr 1-3)和三个重链可变区互补决定区(vh cdr 1-3)。在一些方面,vh cdr1包含与seq id no:9中所示氨基酸序列具有至少80%序列同一性、或至少81%序列同一性、或至少82%序列同一性、或至少83%序列同一性、或至少84%序列同一性、或至少85%序列同一性、或至少86%序列同一性、或至少87%序列同一性、或至少88%序列同一性、或至少89%序列同一性、或至少90%序列同一性、或至少91%序列同一性、或至少92%序列同一性、或至少93%序列同一性、或至少94%序列同一性、或至少95%序列同一性、或至少96%序列同一性、或至少97%序列同一性、或至少98%序列同一性、或至少99%序列同一性的氨基酸序列。在一些方面,vh cdr2包含与seq id no:10中所示氨基酸序列具有至少80%序列同一性、或至少81%序列同一性、或至少82%序列同一性、或至少83%序列同一性、或至少84%序列同一性、或至少85%序列同一性、或至少86%序列同一性、或至少87%序列同一性、或至少88%序列同一性、或至少89%序列同一性、或至少90%序列同一性、或至少91%序列同一性、或至少92%序列同一性、或至少93%序列同一性、或至少94%序列同一性、或至少95%序列同一性、或至少96%序列同一性、或至少97%序列同一
性、或至少98%序列同一性、或至少99%序列同一性的氨基酸序列。在一些方面,vh cdr3包含与seq id no:11中所示氨基酸序列具有至少80%序列同一性、或至少81%序列同一性、或至少82%序列同一性、或至少83%序列同一性、或至少84%序列同一性、或至少85%序列同一性、或至少86%序列同一性、或至少87%序列同一性、或至少88%序列同一性、或至少89%序列同一性、或至少90%序列同一性、或至少91%序列同一性、或至少92%序列同一性、或至少93%序列同一性、或至少94%序列同一性、或至少95%序列同一性、或至少96%序列同一性、或至少97%序列同一性、或至少98%序列同一性、或至少99%序列同一性的氨基酸序列。
[0207]
在一些方面,vl cdr1包含与seq id no:6中所示氨基酸序列具有至少80%序列同一性、或至少81%序列同一性、或至少82%序列同一性、或至少83%序列同一性、或至少84%序列同一性、或至少85%序列同一性、或至少86%序列同一性、或至少87%序列同一性、或至少88%序列同一性、或至少89%序列同一性、或至少90%序列同一性、或至少91%序列同一性、或至少92%序列同一性、或至少93%序列同一性、或至少94%序列同一性、或至少95%序列同一性、或至少96%序列同一性、或至少97%序列同一性、或至少98%序列同一性、或至少99%序列同一性的氨基酸序列。在一些方面,vl cdr2包含与seq id no:7中所示氨基酸序列具有至少80%序列同一性、或至少81%序列同一性、或至少82%序列同一性、或至少83%序列同一性、或至少84%序列同一性、或至少85%序列同一性、或至少86%序列同一性、或至少87%序列同一性、或至少88%序列同一性、或至少89%序列同一性、或至少90%序列同一性、或至少91%序列同一性、或至少92%序列同一性、或至少93%序列同一性、或至少94%序列同一性、或至少95%序列同一性、或至少96%序列同一性、或至少97%序列同一性、或至少98%序列同一性、或至少99%序列同一性的氨基酸序列。在一些方面,vl cdr3包含与seq id no:8中所示氨基酸序列具有至少80%序列同一性、或至少81%序列同一性、或至少82%序列同一性、或至少83%序列同一性、或至少84%序列同一性、或至少85%序列同一性、或至少86%序列同一性、或至少87%序列同一性、或至少88%序列同一性、或至少89%序列同一性、或至少90%序列同一性、或至少91%序列同一性、或至少92%序列同一性、或至少93%序列同一性、或至少94%序列同一性、或至少95%序列同一性、或至少96%序列同一性、或至少97%序列同一性、或至少98%序列同一性、或至少99%序列同一性的氨基酸序列。
[0208]
在一些实施方式中,细胞外结构域包含与抗原(例如npm1c:mhc i类)具有至少10-7
m的结合亲和力(kd)的抗原结合片段。在某些实施方式中,抗原结合片段与npm1c:mhc i类抗原(例如,npm1c:hla-a2)具有至少10-7
m或更高、至少10-8
m或更高、至少10-9
m或更高、至少500nm或更高、至少250nm或更高、至少100nm或更高、至少50nm或更高、至少25nm或更高、至少20nm或更高、至少15nm或更高、至少10nm或更高的结合亲和力(kd)。在一些方面,抗体或其抗原结合片段与npm1c:mhc i类抗原(例如,npm1c:hla-a2)具有至少约25nm或更高、至少约15nm或更高、或至少约10nm或更高的结合亲和力(kd)。在一些方面,抗原结合片段与npm1c:hla-a2抗原,与npm1c:mhc i类抗原(例如,npm1c:hla-a2)具有在(或从...到...)0.1nm和500nm、0.1nm与100nm、0.5nm与100nm、0.1nm和50nm、0.5nm和50nm、0.1nm和25nm、0.5nm和25nm、0.1nm和15nm、0.5nm和15nm、0.1nm和10nm、或0.5nm和10nm、或1nm到100nm之间(或两者之间的任何值)的结合亲和力(kd)。在一些方面,抗原结合片段与npm1c:mhc i类
抗原(例如,npm1c:hla-a2)具有在(或从...到...)约0.1nm和约100nm或约0.5nm和约100nm之间的结合亲和力(kd)。在一些方面,抗原结合片段与npm1c:mhc i类抗原(例如,npm1c:hla-a2)具有在约0.1nm和约50nm或约0.5nm到约50nm之间的结合亲和力(kd)。
[0209]
在一些实施方式中,细胞外结构域包含抗原结合片段,该抗原结合片段对npm1c:mhc i类抗原(例如,npm1c:hla-a2)具有至少0.5
±
0.02x10
4 ms-1
或更高的kon。在一些方面,本文描述的抗原结合片段对npm1c:mhc i类抗原(例如,npm1c:hla-a2)具有至少1
±
0.02x10
4 ms-1
或更高的kon。在一些方面,本文描述的抗原结合片段对npm1c:mhc i类抗原(例如,npm1c:hla-a2)具有至少2.5
±
0.02x10
4 ms-1
或更高的kon。在一些方面,本文描述的抗原结合片段对npm1c:mhc i类抗原(例如,npm1c:hla-a2)具有至少5
±
0.02x10
4 ms-1
或更高的kon。在一些方面,本文描述的抗原结合片段对npm1c:mhc i类抗原(例如,npm1c:hla-a2)具有在(或从...到...)0.5
±
0.02x10
4 ms-1
和50
±
0.02x10
4 ms-1
之间的kon。在一些方面,本文描述的抗原结合片段对npm1c:mhc i类抗原(例如,npm1c:hla-a2)具有在(或从...到...)1
±
0.02x10
4 ms-1
和10
±
0.02x104ms-1
之间的kon。
[0210]
在一些实施方式中,细胞外结构域包含抗原结合片段,该抗原结合片段对npm1c:mhc i类抗原(例如,npm1c:hla-a2)具有小于50
±
0.02x10-4
s-1
的koff。在一些方面,本文所述的抗原结合片段对npm1c:mhc i类抗原(例如,npm1c:hla-a2)具有小于10
±
0.02x10-4
s-1
的koff。在一些方面,本文所述的抗原结合片段对npm1c:mhc i类抗原(例如,npm1c:hla-a2)具有小于5
±
0.02x10-4
s-1
的koff。在一些方面,本文所述的抗原结合片段对npm1c:mhc i类抗原(例如,npm1c:hla-a2)具有在(或从...到...)5
±
0.02x10-4
s-1
和50
±
0.02x10-4
s-1
之间的koff。在一些方面,本文所述的抗原结合片段对npm1c:mhc i类抗原(例如,npm1c:hla-a2)具有在(或从...到...)1
±
0.02x10-4
s-1
和15
±
0.02x10-4
s-1
之间的koff。
[0211]
本文提供的抗原结合分子特异性结合抗原(例如npm1c:hla-a2)。在一些方面,由抗原结合分子结合的抗原由癌细胞表面上的mhc i类分子(例如hla-a2)呈递。在一些实施方式中,所示癌细胞是aml细胞。
[0212]
在一些实施方式中,细胞外结构域包含单链抗体,例如单链fv(scfv)。在一些方面,scfv是人或人源化的scfv。在一些方面,scfv包含接头。在一些方面,接头是肽接头。在一些方面,肽接头是gly-ser接头。在一些方面,gly-ser接头选自(gly4ser)1(seq id no:58)、(gly4ser)2(seq id no:59)、(gly4ser)3(seq id no:60)和(gly4ser)4(seq id no:61)。在一些方面,gly-ser接头包含氨基酸序列sgssggsssg(seq id no:4)。在一些实施方式中,细胞外结构域包含抗体的抗原结合片段,其中该片段可以是但不限于fv片段、fab片段、f(ab')片段、f(ab')2片段或二硫键fv(sdfv)。在一个实施方式中,细胞外结构域包含fv片段。在一个实施方式中,细胞外结构域包含fab片段。在一个实施方式中,细胞外结构域包含f(ab’)片段。在一个实施方式中,细胞外结构域包含f(ab')2片段。
[0213]
跨膜结构域
[0214]
在一些实施方式中,本文提供的car多肽包含跨膜结构域。在一些实施方式中,跨膜结构域衍生自天然来源。在一些实施方式中,跨膜结构域衍生自任何膜结合型或跨膜蛋白质。可用于本文所述car中的跨膜结构域的非限制性示例可衍生自t细胞受体的α、β或ζ链、cd28、cd3ε、cd33、cd37、cd64、cd80、cd45、cd4、cd5、cds、cd9、cd16、cd22、cd86、cd134、cd137或cd154(例如,包含至少其跨膜序列或跨膜序列的一部分)。在一个实施方式中,跨膜
结构域来自cd4分子。在一个实施方式中,跨膜结构域来自cd8分子。
[0215]
在一些实施方式中,跨膜结构域是合成的。例如,在跨膜结构域来自合成来源的一些实施方式中,跨膜结构域可包括(例如,主要包括)疏水残基(例如,亮氨酸和缬氨酸)。在一些实施方式中,合成跨膜结构域包括在合成跨膜结构域末端的苯丙氨酸、色氨酸和缬氨酸的至少一个(例如,至少二个、至少三个、至少四个、至少五个或至少六个)三联体。在一些实施方式中,car的跨膜结构域包括cd8铰链结构域。
[0216]
在一些实施方式中,跨膜结构域与细胞质结构域中的序列天然地关联。在一些实施方式中,跨膜结构域通过一个或多个(例如,二个、三个、四个、五个、六个、七个、八个、九个或十个)氨基酸取代被修饰,以避免该结构域与其他跨膜结构域(例如,相同或不同表面膜蛋白的跨膜结构域)结合,从而最小化与受体复合体的其他成员的相互作用。
[0217]
在一些实施方式中,本文所述car多肽的跨膜结构域包含cd8铰链和跨膜区。在一些实施方式中,跨膜结构域包含seq id no:25中所示氨基酸序列。在一些实施方式中,跨膜结构域包含与seq id no:25中所示氨基酸序列具有至少90%、95%、96%、97%、98%或99%同一性的氨基酸序列。在一些实施方式中,跨膜结构域由seq id no:33中所示核苷酸序列编码。在一些实施方式中,跨膜结构域由与seq id no:33中所示核苷酸序列具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性的核苷酸序列编码。
[0218]
在一些实施方式中,本文提供的car的跨膜结构域包含cd3ζ、cd8、cd28、dap12、2b4、nkg2d、cd16、nkp44、fcyriiia、nkp30、actkir、nkg2c、il15rb或nkp46的跨膜结构域。在一些实施方式中,本文提供的car的跨膜结构域包含cd3ζ、cd8或cd28的跨膜结构域。在一些该实施方式中,car的细胞内结构域包含共刺激分子的共刺激结构域,所述共刺激分子选自cd27、cd28、4-1bb、ox40、cd30、cd40、pd-1、icos、及其任何组合。
[0219]
细胞内(细胞质)结构域
[0220]
在一些实施方式中,本文所述car多肽包含细胞内结构域。细胞内结构域可以是已知的任何多肽结构域,其功能是传递信号,例如引起nk细胞或ml nk细胞等免疫效应细胞的激活。这种结构域或基序可传递初级抗原结合信号,该信号是激活t淋巴细胞所必需的,以响应car细胞外结构域与靶抗原的结合。细胞内结构域的示例包括但不限于ilr链、cd28、4-1bb和cd3ζ。
[0221]
通常,细胞内结构域包含itam(免疫受体酪氨酸激活基序)。
[0222]
在一个实施方式中,细胞内结构域是或包含cd3ζ信号传导序列(例如,其包含itam的部分)。在一个实施方式中,细胞内结构域包含淋巴细胞受体链。在一个实施方式中,细胞内结构域包含tcr/cdr3复合蛋白。在一个实施方式中,细胞内结构域包含fc受体亚单位。在一个实施方式中,细胞内结构域包含il-2受体亚单位。
[0223]
本文提供的car的细胞内结构域可以包括两类不同的细胞质信号传导序列:通过tcr(初级细胞质信号传导序列)启动抗原依赖性激活的信号传导序列(例如,cd3ζ细胞质信号传导序列)和以抗原独立的方式提供二级或共刺激信号的一种或多种共刺激蛋白的细胞质序列(二级细胞质信号传导序列)。
[0224]
在某些实施方式中,本文提供的是包含细胞内信号传导结构域的car,其包括当抗原结合结构域与抗原结合时足以刺激t细胞的cd3ζ的细胞质序列,并且任选地包括提供nk细胞的共刺激的一种或多种共刺激蛋白的细胞质序列(例如,cd27、cd28、4-1bb、ox40、
cd30、cd40l、cd40、pd-1、pd-l1、icos、lfa-1、cd2、cd7、cd160、light、btla、tim3、cd244、cd80、lag3、nkg2c、b7-h3、2b4、dap10、cd137、dap12、dnam-1、nkp80、ntba、cracc、cd2、cd3ζ、一种或多种整合素、il-15r、il-18r、il-12r、il-21r、ire1a、特异性结合cd83的配体中的一种或多种的细胞质序列以及本文所描述或本领域已知的itam序列中的任何序列)。在一些实施方式中,共刺激蛋白的整个细胞内信号传导结构域包括在car的细胞内结构域中。在一些实施方式中,细胞内结构域包括共刺激蛋白的细胞内信号传导结构域的截短部分(例如,在表达car的免疫效应细胞中转导效应器功能信号的细胞内信号传导结构域的截短部分)。在一些实施方式中,car的细胞内结构域可设计为仅包含cd3ζ信号传导结构域,或与在car有用的任何其他所需细胞质信号传导序列组合。在一些实施方式中,car的细胞质结构域可以包括cd3ζ链部分和共刺激细胞质信号传导序列。共刺激细胞质信号传导序列是指car的一部分,其包括共刺激蛋白(例如,cd27、cd28、4-ibb(cd137)、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关性抗原-1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3,以及特异性结合cd83的配体)的细胞质信号传导序列。
[0225]
在一些实施方式中,car的细胞内结构域内的细胞质信号传导序列以随机顺序定位。在一些实施方式中,car的细胞内结构域内的细胞质信号传导序列以特定顺序彼此连接。在一些实施方式中,接头(例如,本文所述的任何接头)可用于在不同细胞质信号传导序列之间形成链接。
[0226]
在一些实施方式中,细胞内结构域设计为包括cd3ζ的细胞质信号传导序列和共刺激蛋白cd28的细胞质信号传导序列。在一些实施方式中,细胞内结构域设计为包括cd3ζ的胞质信号传导序列以及共刺激蛋白4-ibb的胞质信号传导序列。在一些实施方式中,细胞内结构域被设计为包括cd3ζ的细胞质信号传导序列和共刺激蛋白cd28和4-1bb的细胞质信号传导序列。在一些实施方式中,细胞内结构域不包括4-1bb的细胞质信号传导序列。
[0227]
在一些实施方式中,car多肽包含seq id no:26中所示氨基酸序列。在一些实施方式中,car多肽包含与seq id no:26中所示氨基酸序列具有至少90%、95%、96%、97%、98%或99%同一性的氨基酸序列。在一些实施方式中,car多肽包含seq id no:27中所示氨基酸序列。在一些实施方式中,car多肽包含与seq id no:27中所示氨基酸序列具有至少90%、95%、96%、97%、98%或99%同一性的氨基酸序列。
[0228]
在一些实施方式中,car多肽包含seq id no:26和27中所示氨基酸序列。在一些实施方式中,car多肽包含与seq id no:26和27中所示氨基酸序列具有至少90%、95%、96%、97%、98%或99%同一性的氨基酸序列。
[0229]
在一些实施方式中,编码car多肽的核苷酸序列包含seq id no:34中所示核酸序列。在一些实施方式中,编码car多肽的核苷酸序列包含与seq id no:34中所示核酸序列具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性的核酸序列。在一些实施方式中,编码car多肽的核苷酸序列包含seq id no:35中所示核酸序列。在一些实施方式中,编码car多肽的核苷酸序列包含与seq id no:35所示核酸序列具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性的核酸序列。
[0230]
在一些实施方式中,编码car多肽的核苷酸序列包含seq id no:34和35中所示核酸序列。在一些实施方式中,编码car多肽的核苷酸序列包含与seq id no:34和35中所示核酸序列具有至少90%、95%、96%、97%、98%或99%同一性的核酸序列。
[0231]
在一些实施方式中,car包含一个或多个衍生自诸如cd28、cd137(又称4-lbb)、cd134(又名ox40)和cd278(又称icos)等蛋白质的共刺激结构域。在一些实施方式中,car不包含衍生自cd137的共刺激结构域。
[0232]
在某些实施方式中,细胞内结构域进一步包含细胞因子。在一些实施方式中,细胞内结构域还包含自裂解结构域(例如,p2a自裂解肽)和细胞因子,其中所述自裂解结构域的裂解释放所述细胞因子。在一些实施方式中,自裂解结构域(例如p2a自裂解肽)和细胞因子位于car蛋白及其细胞内结构域的c端。在一些实施方式中,细胞因子是以下一种或多种:il-12、il-7、il-13、il-15、il-4、il-10、tnf-α、ifn-γ、tgf-β和ccl19。在一个实施方式中,细胞因子是il-12。在一个实施方式中,细胞因子是il-7。在一个实施方式中,细胞因子是il-13。在一个实施方式中,细胞因子是il-15。在一个实施方式中,细胞因子是il-4。在一个实施方式中,细胞因子是il-10。在一个实施方式中,细胞因子为tnf-α。在一个实施方式中,细胞因子是ifn-γ。在一个实施方式中,细胞因子是tgf-β。在一个实施方式中,细胞因子为ccl19。本领域已知经修饰以表达细胞因子的免疫效应细胞(参见,例如,adachi等人,2018,nature biotechnology,doi:10.1038/nbt.4086;liu等人,2019,j.immunol.,doi:10.4049/jimmunol.1800033;krenciute等人,2017,cancer immunol.res.597):571-581,doi:10.1158/2326-6066,cir-16-0376;liu等人,2018,leukemia 32:520-531)。在某些实施方式中,本文所述免疫效应细胞以表达细胞因子的修饰与adachi等人,2018,nature biotechnology,doi:10.1038/nbt.4086;liu等人,2019,j immunol.,doi:10.4049/jimmunol.1800033;krenciute等人,2017,cancer immunol.res.597):571-581,doi:10.1158/2326-6066,cir-16-0376;或liu等人,2018,leukemia 32:520-531中所述的相同,或依照本文所描述的方法。
[0233]
car结构域之间的接头
[0234]
在一些实施方式中,本文所述car多肽包含car中至少一个结构域之间的接头。在一些实施方式中,本文所述的car在:1)细胞外(抗原结合)结构域和跨膜结构域之间,和/或(2)跨膜结构域和细胞内(细胞质)结构域之间包括接头。在一些实施方式中,接头可以是多肽接头。例如,接头的长度可以在约1个氨基酸和约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、约90个氨基酸、约80个氨基酸、约70个氨基酸、约60个氨基酸、约50个氨基酸、约40个氨基酸、约35个氨基酸、约30个氨基酸、约25个氨基酸、约20个氨基酸、约18个氨基酸、约16个氨基酸、约14个氨基酸、约12个氨基酸、约10个氨基酸、约8个氨基酸、约6个氨基酸、约4个氨基酸、或约2个氨基酸之间;约2个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、约90个氨基酸、约80个氨基酸、约70个氨基酸、约60个氨基酸、约50个氨基酸、约40个氨基酸、约35个氨基酸、约30个氨基酸、约25个氨基酸、约20个氨基酸、约18个氨基酸、约16个氨基酸、约14个氨基酸、约12个氨基酸、约10个氨基酸、约8个氨基酸、约6个氨基酸、或约4个氨基酸;约4个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、约90个氨基酸、约80个氨基酸、约70个氨基酸、约60个氨基酸、约50个氨基酸、约40个氨基酸、约35个氨基酸、约30个氨基酸、约25个氨基酸、约20个氨基酸、约18个氨基酸、约16个氨基酸、约14个氨基酸、约12个氨基酸、约10个氨基酸、约8个氨基酸、或约6个氨基酸;约6个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、
约90个氨基酸、约80个氨基酸、约70个氨基酸、约60个氨基酸、约50个氨基酸、约40个氨基酸、约35个氨基酸、约30个氨基酸、约25个氨基酸、约20个氨基酸、约18个氨基酸、约16个氨基酸、约14个氨基酸、约12个氨基酸、约10个氨基酸、或约8个氨基酸;约8个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、约90个氨基酸、约80个氨基酸、约70个氨基酸、约60个氨基酸、约50个氨基酸、约40个氨基酸、约35个氨基酸、约30个氨基酸、约25个氨基酸、约20个氨基酸、约18个氨基酸、约16个氨基酸、约14个氨基酸、约12个氨基酸、或约10个氨基酸;约10个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、约90个氨基酸、约80个氨基酸、约70个氨基酸、约60个氨基酸、约50个氨基酸、约40个氨基酸、约35个氨基酸、约30个氨基酸、约25个氨基酸、约20个氨基酸、约18个氨基酸、约16个氨基酸、约14个氨基酸、或约12个氨基酸;约12个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、约90个氨基酸、约80个氨基酸、约70个氨基酸、约60个氨基酸、约50个氨基酸、约40个氨基酸、约35个氨基酸、约30个氨基酸、约25个氨基酸、约20个氨基酸、约18个氨基酸、约16个氨基酸、或约14个氨基酸;约14个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、约90个氨基酸、约80个氨基酸、约70个氨基酸、约60个氨基酸、约50个氨基酸、约40个氨基酸、约35个氨基酸、约30个氨基酸、约25个氨基酸、约20个氨基酸、约18个氨基酸、或约16个氨基酸;约16个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、约90个氨基酸、约80个氨基酸、约70个氨基酸、约60个氨基酸、约50个氨基酸、约40个氨基酸、约35个氨基酸、约30个氨基酸、约25个氨基酸、约20个氨基酸、或约18个氨基酸;约18个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、约90个氨基酸、约80个氨基酸、约70个氨基酸、约60个氨基酸、约50个氨基酸、约40个氨基酸、约35个氨基酸、约30个氨基酸、约25个氨基酸、或约20个氨基酸;约20个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、约90个氨基酸、约80个氨基酸、约70个氨基酸、约60个氨基酸、约50个氨基酸、约40个氨基酸、约35个氨基酸、约30个氨基酸、或约25个氨基酸;约25个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、约90个氨基酸、约80个氨基酸、约70个氨基酸、约60个氨基酸、约50个氨基酸、约40个氨基酸、约35个氨基酸、或约30个氨基酸;约30个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、约90个氨基酸、约80个氨基酸、约70个氨基酸、约60个氨基酸、约50个氨基酸、约40个氨基酸、或35个氨基酸;约35个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、约90个氨基酸、约80个氨基酸、约70个氨基酸、约60个氨基酸、约50个氨基酸、或约40个氨基酸;约40个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、约90个氨基酸、约80个氨基酸、约70个氨基酸、约60个氨基酸、或约50个氨基酸;约50个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、约90个氨基酸、约80个氨基酸、约70个氨基酸、或约60个氨基酸;约60个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约150个氨基酸、约100个氨基酸、约90个氨基酸、约80个氨基酸、或约70个氨基酸;约70个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、约90个氨基酸、或约80个氨基
酸;约80个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、约100个氨基酸、或约90个氨基酸;约90个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、约200个氨基酸、或约100个氨基酸;约100个氨基酸到约500个氨基酸、约400个氨基酸、约300个氨基酸、或约200个氨基酸;约200个氨基酸到约500个氨基酸、约400个氨基酸、或约300个氨基酸;约300个氨基酸到约500个氨基酸或约400个氨基酸;或约400个氨基酸到约500个氨基酸。
[0235]
car的制备方法
[0236]
本领域技术人员已知制备car多肽和编码此类多肽的核酸分子的方法。本文描述了示例方法。
[0237]
适用于本文所述car的抗体和片段可通过本领域已知的任何方法制备。
[0238]
制备抗体片段的方法在本领域是众所周知的。例如,fab和f(ab')2片段可以通过使用诸如胃蛋白酶(产生f(ab')2片段)或木瓜蛋白酶(产生fab片段)等酶的免疫球蛋白分子的蛋白水解裂解来产生。制备scfv片段的方法也为本领域所知(参见例如,ahmad等人,2012,clinical and developmental immunology,doi:10.1155/2012/980250;wang等人,2006,anal.chem.78,997-1004;pansri等人,2009,bmc biotechnology 9:6;chao等人,2006,nature protocols 1(2):755-768)。具有所需抗原结合特性的scfv可通过噬菌体展示技术或酵母表面展示技术进行筛选。scfv可以通过短多肽接头(使用重组表达技术)融合免疫球蛋白重链和轻链的可变结构域来构建。制备单链结构域抗体(例如,缺乏轻链的抗体)的方法在本领域是众所周知的(参见,例如,riechmann&muyldermans,1999,j immunol 231:25-38;nuttall等人,2000,curr pharm biotechtol 1(3):253-263;muyldermans,2001,j biotechnol 74(4):277-302)。
[0239]
生产双特异性抗体的方法在本领域是众所周知的(参见,例如,konterman,2012,mabs 4:182-197;gramer等人,2013,mabs 5:962-973)。
[0240]
在所选cdr氨基酸序列为短序列(例如,长度小于10-15个氨基酸)的实施方式中,编码cdr的核酸可以如shiraishi等人(2007)nucleic acids symposium series 51(1):129-130和美国专利号6995259中所述进行化学合成。对于编码受体抗体的给定核酸序列,编码cdr的核酸序列区域可以替换为使用标准分子生物学技术的化学合成的核酸。化学合成的核酸的5'端和3'端可以合成为包含粘性端限制酶位点,用于将核酸克隆到编码供体抗体可变区的核酸中。
[0241]
可以使用本领域已知的任何基于免疫学或生物化学的方法,在体外或体内筛选和/或测试本文所述的任何抗体,以了解其调节归属于抗原(例如npm1c:hla-a2)的任何活性或功能的能力。
[0242]
本文所述多肽可以使用分子生物学和蛋白质化学领域中已知的多种技术来生产。例如,编码抗体的重链和轻链多肽之一或两者的核酸可以插入包含转录和翻译调控序列的表达载体,其中包括例如启动子序列、核糖体结合位点、转录起始和终止序列、翻译起始和终止序列、转录终止信号、聚腺苷酸化信号和增强子或激活子序列。调控序列包括启动子和转录起始和终止序列。此外,该表达载体可以包括一个以上的复制系统,从而可以在两种不同的生物体中保持,例如在哺乳动物或昆虫细胞中进行表达,在原核生物宿主中进行克隆和扩增。
[0243]
几种可能的载体系统可用于从哺乳动物细胞中的核酸表达本文所述的任何多肽(例如,克隆的重链和轻链多肽)。一类载体依赖于将所需的基因序列整合到宿主细胞基因组中。可以通过同时引入抗药性基因,如大肠杆菌gpt(mulligan和berg(1981)proc natl acad sci usa 78:2072)或tn5 neo(southern和berg(1982)mol appl genet 1:327),来选择具有稳定整合dna的细胞。可选择标记基因既可以与待表达的dna基因序列相连,也可以通过共转染引入同一细胞(wigler等人(1979)cell 16:77)。第二类载体利用dna元件赋予染色体外质粒自主复制能力。这些载体可来源于动物病毒,例如牛乳头瘤病毒(sarver等人(1982)proc natl acad sci usa,79:7147)、巨细胞病毒、多瘤病毒(deans等人proc natl acad sci usa 81:1292)或sv40病毒(lusky和botchan(1981)nature 293:79)。
[0244]
表达载体可以适于核酸后续表达的方式引入细胞。引入方法主要取决于靶细胞类型,如下所述。示例方法包括capo4沉淀、脂质体融合、阳离子脂质体、电穿孔、病毒感染、右旋糖酐介导的转染、聚凝胺介导的转基因、原生质体融合和直接微量注射。
[0245]
表达多肽的合适宿主细胞包括酵母、细菌、昆虫、植物和哺乳动物细胞。特别令人感兴趣的是大肠杆菌等细菌、酿酒酵母(saccharomyces cerevisiae)和毕赤酵母(pichia pastoris)等真菌、sf9等昆虫细胞、哺乳动物细胞系(如人类细胞系)以及原代细胞系。
[0246]
多肽可以在足以使蛋白质表达的条件和持续时间下通过培养用含有编码抗体或片段的核酸的表达载体转化的宿主细胞而从细胞中产生。蛋白质表达的这些条件将随着表达载体和宿主细胞的选择而变化,并且本领域技术人员将通过常规实验容易确定。例如,在大肠杆菌中表达的抗体可以从包涵体中重新折叠(参见,例如,hou等人(1998)cytokine 10:319-30)。细菌表达系统及其使用方法在本领域是众所周知的(参见current protocols in molecular biology,wiley&sons,和molecular cloning
‑‑
a laboratory manual
‑‑3rd ed.,cold spring harbor laboratory press,new york(2001))。密码子、合适的表达载体和合适的宿主细胞的选择取决于许多因素,并且可以根据需要轻松优化。本文所述抗体(或其片段)可在哺乳动物细胞或其他表达系统中表达,包括但不限于酵母、杆状病毒和体外表达系统(参见例如kaszubska等人(2000)protein expression and purification 18:213-220)。
[0247]
表达后,可以分离出多肽。标准纯化方法包括电泳、分子、免疫学和色谱技术,所述色谱技术包括离子交换、疏水、亲和和反相hplc色谱。例如,可以使用标准抗-抗体柱(例如,蛋白-a或蛋白-g柱)纯化抗体。超滤和透析技术以及蛋白质浓缩也很有用。例如,见scopes(1994)“protein purification,第三版,”springer-verlag,纽约城,纽约。所需的纯化程度取决于所需的用途。在一些情况下,不需要纯化表达的抗体或其片段。
[0248]
本领域已知用于测定多肽的产量或纯度的方法,并且包括,例如,布拉德福德分析、uv光谱分析、biuret蛋白质分析、lowry蛋白质分析、氨基黑蛋白质分析、高压液相色谱(hplc)、质谱(ms)和凝胶电泳方法(例如,使用蛋白质染色,例如考马斯蓝或胶体银染色)。
[0249]
多肽可以在表达和纯化后进行修饰。修饰可以是共价修饰或非共价修饰。可通过例如使多肽的靶向氨基酸残基与能够与选定侧链或末端残基反应的有机衍生剂反应,将这些修饰引入多肽。可使用多种标准(包括例如,抗体或片段的结构分析或氨基酸序列分析)中的任何一种,选择合适的修饰位点。
[0250]
在一些实施方式中,多肽可与异源部分偶联。异源部分可以是例如异源多肽、治疗
剂或细胞毒性剂(例如毒素或药物),或可检测标签,例如但不限于放射性标签、酶标签、荧光标签、重金属标签、发光标签或亲和标签,例如生物素或链亲和素。合适的异源多肽包括,例如,用于纯化抗体或片段的抗原标签(例如,flag(dykddddk(seq id no:44))、多组氨酸(6-his;hhhhhh(seq id no:45)、血凝素(ha;ypydvpdya(seq id no:46))、谷胱甘肽-s-转移酶(gst)或麦芽糖结合蛋白(mbp))。异源多肽还包括可用作诊断或检测标记的多肽(例如酶),例如荧光素酶、荧光蛋白(例如绿色荧光蛋白(gfp))或氯霉素乙酰转移酶(cat)。合适的放射性标签包括,例如,32p、33p、14c、125i、131i、35s和3h。合适的荧光标签包括但不限于荧光素、异硫氰酸荧光素(fitc)、绿色荧光蛋白(gfp)、dylight
tm 488、藻红蛋白(pe)、碘化丙啶(pi)、percp、pe alexa700、cy5、别藻蓝蛋白和cy7。发光标签包括,例如,任何一种发光镧系元素(例如,铕或铽)螯合物。例如,合适的铕螯合物包括二乙烯三胺五乙酸(dtpa)或四氮杂环十二烷-1,4,7,10-四乙酸(dota)的铕螯合物。酶标签包括,例如,碱性磷酸酶、cat、荧光素酶和辣根过氧化物酶。
[0251]
两种蛋白质(例如抗体和异源部分)可以使用许多已知化学交联剂中的任何一种进行交联。此类交联剂的示例是通过包括“受阻”二硫键的链接连接两个氨基酸残基的交联剂。在这些链接中,交联单元内的二硫键通过例如还原型谷胱甘肽或二硫还原酶的作用而受到保护(通过阻碍二硫键两侧的基团),不被还原。一种合适的试剂,4-琥珀酰亚胺氧羰基-α-甲基-α(2-吡啶二硫代)甲苯(smpt),利用一种蛋白质上的末端赖氨酸和另一蛋白质的末端半胱氨酸在两种蛋白质之间形成这种链接。也可以使用通过每个蛋白质上不同偶联部分交联的异双功能试剂。其他有用的交联剂包括但不限于连接两个氨基(例如,n-5-叠氮-2-硝基苯甲酰氧基琥珀酰亚胺)、两个巯基(例如,1,4-双-马来酰亚胺丁烷)、氨基和巯基(比如,间马来酰亚胺苯甲酰-n-羟基琥珀酰亚胺酯)、氨基和羧基(例如4-[对-叠氮水杨酰氨基]丁胺)以及精氨酸侧链中存在的氨基和胍基(例如,对-叠氮苯基乙二醛一水合物)的试剂。
[0252]
在一些实施方式中,放射性标记可直接偶联到多肽的氨基酸主链。或者,放射性标记可以作为更大分子(例如,间-[125i]碘苯基-n-羟基琥珀酰亚胺([125i]mipnhs)中的125i)的一部分包括在内,该分子与游离氨基结合形成相关蛋白质的间碘苯基(mip)衍生物(参见,例如,rogers等人(1997)j nucl med 38:1221-1229)或螯合物(例如,与dota或dtpa),而螯合物又与蛋白质主链结合。本领域已知将放射性标签或含有它们的大分子/螯合物与本文所述多肽结合的方法。此类方法涉及在促进放射性标签或螯合物与蛋白质结合的条件(例如ph、盐浓度和/或温度)下将蛋白质与放射性标签孵育(参见例如,美国专利号6,001,329)。
[0253]
蛋白质化学领域中已知将荧光标记(有时称为“荧光团”)与蛋白质(例如抗体)结合的方法。例如,荧光团可以使用附着在荧光团上的琥珀酰亚胺(nhs)酯或四氟苯基(tfp)酯部分与蛋白质的自由氨基(例如赖氨酸)或巯基(例如半胱氨酸)偶联。在一些实施方式中,荧光团可偶联异双官能交联剂部分,例如磺酸基smcc。合适的偶联方法涉及在促进荧光团与蛋白质结合的条件下将抗体蛋白或其片段与荧光团孵育。例如,见welch和redvanly(2003)“handbook of radiopharmaceuticals:radiochemistry and applications,”john wiley and sons(isbn 0471495603)。
[0254]
在一些实施方式中,本文所述多肽可以糖基化。在一些实施方式中,本文所述的多
scfv;(ii)cd8跨膜结构域;(iii)4-1bb细胞内结构域;和(iv)cd3ζ信号传导结构域。
[0261]
在一些实施方式中,car多肽包含氨基酸序列,该氨基酸序列包含:(i)抗-npm1c scfv;(ii)cd28跨膜结构域;(iii)cd28细胞内结构域;和(iv)cd3ζ信号传导结构域。
[0262]
在一些实施方式中,car多肽包含氨基酸序列,该氨基酸序列包含:(i)抗-npm1c scfv;(ii)dap12跨膜结构域;和(iii)dap12细胞内结构域。
[0263]
在一些实施方式中,car多肽包含氨基酸序列,该氨基酸序列包含:(i)抗-npm1c scfv;(ii)cd28跨膜结构域;(iii)2b4细胞内结构域;和(iv)cd3ζ信号传导结构域。
[0264]
在一些实施方式中,car多肽包含氨基酸序列,该氨基酸序列包含:(i)抗-npm1c scfv;(ii)2b4跨膜结构域;(iii)2b4细胞内结构域;和(iv)cd3ζ信号传导结构域。
[0265]
在一些实施方式中,car多肽包含氨基酸序列,该氨基酸序列包含:(i)抗-npm1c scfv;(ii)cd28跨膜结构域;(iii)cd28胞内结构域;(iv)4-1bb细胞内结构域;和(v)cd3ζ信号传导结构域。
[0266]
在一些实施方式中,car多肽包含氨基酸序列,该氨基酸序列包含:(i)抗-npm1c scfv;(ii)cd16跨膜结构域;(iii)2b4细胞内结构域;和(iv)cd3ζ信号传导结构域。
[0267]
在一些实施方式中,car多肽包含氨基酸序列,该氨基酸序列包含:(i)抗-npm1c scfv;(ii)nkp44跨膜结构域;(iii)dap10细胞内结构域;和(iv)cd3ζ信号传导结构域。
[0268]
在一些实施方式中,car多肽包含氨基酸序列,该氨基酸序列包含:(i)抗-npm1c scfv;(ii)nkp46跨膜结构域;(iii)2b4细胞内结构域;和(iv)cd3ζ信号传导结构域。
[0269]
在一些实施方式中,car多肽包含氨基酸序列,该氨基酸序列包含:(i)抗-npm1c scfv;(ii)nkg2d跨膜结构域;(iii)2b4细胞内结构域;和(iv)cd3ζ信号传导结构域。
[0270]
在一些实施方式中,car多肽包含氨基酸序列,该氨基酸序列包含:(i)抗-npm1c scfv;(ii)nkg2d跨膜结构域;(iii)4-1bb细胞内结构域;和(iv)cd3ζ信号传导结构域。
[0271]
在一些实施方式中,car多肽包含氨基酸序列,该氨基酸序列包含:(i)抗-npm1c scfv;(ii)nkg2d跨膜结构域;(iii)2b4细胞内结构域;(iv)dap12细胞内结构域;和(v)cd3ζ信号传导结构域。
[0272]
在一些实施方式中,car多肽包含氨基酸序列,该氨基酸序列包含:(i)抗-npm1c scfv;(ii)nkg2d跨膜结构域;(iii)2b4细胞内结构域;(iv)dap10细胞内结构域;和(v)cd3ζ信号传导结构域。
[0273]
在一些实施方式中,car多肽包含氨基酸序列,该氨基酸序列包含:(i)抗-npm1c scfv;(ii)nkg2d跨膜结构域;(iii)4-1bb细胞内结构域;(iv)2b4细胞内结构域;和(v)cd3ζ信号传导结构域。
[0274]
在一些实施方式中,car多肽包含氨基酸序列,该氨基酸序列包含:(i)抗-npm1c scfv;(ii)nkg2d跨膜结构域;和(iii)cd3ζ信号传导结构域。
[0275]
在一些实施方式中,car多肽包含氨基酸序列,该氨基酸序列包含:(i)包含seq id no:24中所示氨基酸序列的抗-npm1c scfv;(ii)包含seq id no:25中所示氨基酸序列的cd8铰链和跨膜结构域;(iii)包含seq id no:26中所示氨基酸序列的4-1bb细胞内结构域;和(iv)包含seq id no:27中所示氨基酸序列的cd3ζ信号传导结构域。在一些实施方式中,car多肽还包含il-15多肽,其包含seq id no:97中所示氨基酸序列。在一些实施方式中,il-15多肽还包含异源跨膜结构域。
[0276]
在一些实施方式中,car多肽由核苷酸序列编码,其包含:(i)由seq id no:32中所示核酸序列编码的抗-npm1c scfv;(ii)由seq id no:33中所示核酸序列编码的cd8铰链和跨膜结构域;(iii)由seq id no:34中所示核酸序列编码的4-1bb细胞内结构域;和(iv)由seq id no:35中所示核酸序列编码的cd3ζ信号传导结构域。在一些实施方式中,编码car的核苷酸序列还包括seq id no:98中所示编码il-15多肽的核酸序列。在一些实施方式中,编码il-15多肽的核酸序列可操作地连接至编码异源跨膜结构域的核酸序列。
[0277]
在一些实施方式中,car多肽由核苷酸序列编码,其包含:(i)由与seq id no:32中所示核酸序列具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性的核酸序列编码的抗-npm1c scfv;(ii)由与seq id no:33中所示核酸序列具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性的核酸序列编码的cd8铰链和跨膜结构域;(iii)由与seq id no:34中所示核酸序列具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性的核酸序列编码的4-1bb细胞内结构域;和(iv)由与seq id no:35中所示核酸序列具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性的核酸序列编码的cd3ζ信号传导结构域。在一些实施方式中,编码car的核苷酸序列还包括与seq id no:98中所示编码il-15多肽的核酸序列具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性的核酸序列。在一些实施方式中,编码il-15多肽的核酸序列可操作地连接至编码异源跨膜结构域的核酸序列。
[0278]
编码car多肽的载体
[0279]
在一些方面,本文所述car多肽由载体编码。
[0280]
一旦制备或分离了本文所述car多肽的编码序列,就可以将这些序列克隆到任何合适的载体或复制子中。“编码序列”或“编码”所选多肽(例如car多肽)的序列是一种核酸分子,当置于适当的调节序列(或“控制元件”)的控制下时,它在体内转录(对于dna)并翻译(对于mrna)为多肽。编码序列的边界由5'(氨基)端的起始密码子和3'(羧基)端的翻译终止密码子决定。编码序列可以包括但不限于来自病毒、原核或真核mrna的cdna、来自病毒或原核dna的基因组dna序列以及甚至合成dna序列。转录终止序列可能位于编码序列的3'处。编码序列的转录和翻译通常由“控制元件”调节,包括但不限于转录启动子、转录增强子元件、转录终止信号、聚腺苷酸化序列(位于翻译终止密码子的3'处)、优化翻译起始的序列(位于编码序列的5'处)和翻译终止序列。
[0281]
本领域技术人员已知许多克隆载体,选择合适的克隆载体是一个选择问题。使用本领域已知的标准程序执行与其他序列的连接。
[0282]
如本文所用,术语“载体”具有本领域普通技术人员通常理解的相同含义,并指能够运输其连接的另一核酸分子的核酸分子。一种类型的载体是“质粒”,它是指环状的双链dna环,其中可以连接额外的dna片段。另一种类型的载体是病毒载体,其中额外的dna片段可以连接到病毒基因组中。某些载体能够在引入它们的宿主细胞中自主复制(例如,具有细菌复制原点的细菌载体和游离型哺乳动物载体)。其他载体(例如,非游离型哺乳动物载体)可在引入宿主细胞后整合到宿主细胞的基因组中,从而与宿主基因组一起复制。此外,某些载体能够指导与其可操作地连接的基因的表达。此类载体在本文中称为“重组表达载体”(或简称“表达载体”)。一般来说,重组dna技术中使用的表达载体通常以质粒的形式存在。在本说明书中,“质粒”和“载体”可以互换使用,因为质粒是最常用的载体形式。然而,本发
明旨在包括具有同等功能的其他形式的表达载体,例如病毒载体(例如,复制缺陷型逆转录病毒、腺病毒和腺相关病毒)。
[0283]
此外,术语“载体”可以指能够转移或运输另一核酸分子的核酸分子。转移核酸可以连接到载体核酸分子上,例如插入载体核酸分子中。载体可以包括直接在细胞中自主复制的序列,也可以包括足以整合到宿主细胞dna中的序列。例如,有用载体包括质粒(例如dna质粒或rna质粒)、转座子、粘粒、细菌人工染色体和病毒载体。有用的病毒载体包括,例如,复制缺陷逆转录病毒和慢病毒。
[0284]
如本文所用,术语“转导”或“细胞转导”是指使用dna或rna病毒将核酸转移到细胞中的过程。
[0285]
在一些方面,在表达载体中提供本文所述的核酸分子。在一些实施方式中,载体包含对操作连接到适当表达控制序列的肽进行编码的核酸分子。在将核酸分子插入载体之前或之后,影响这种操作性连接的方法是众所周知的。表达控制序列包括启动子、激活子、增强子、操纵子、核糖体核酸酶域、起始信号、终止信号、帽信号、多聚腺苷酸化信号以及其他与转录或翻译控制相关的信号。
[0286]“启动子”是启动编码多核苷酸的多肽转录的核苷酸序列。启动子可以包括诱导型启动子(其中可操作地连接到启动子的多核苷酸序列的表达由分析物、辅因子、调节蛋白等诱导)、抑制型启动子(其中可操作地连接到启动子上的多核苷酸序列的表达通过分析物、辅助因子、调节蛋白质等抑制)和组成型启动子。此外,此类启动子还具有组织特异性,例如,cd80启动子仅在某些免疫细胞中可诱导,而myod启动子仅可在肌肉细胞中诱导。意在术语“启动子”或“控制元件”包括全长启动子区域和这些区域的功能(例如,控制转录或翻译)片段。如果启动子与共刺激分子的启动子区、其补体具有相同或基本相同的碱基对序列,或者如果启动子显示如下所述序列同一性,则启动子“衍生自”编码共刺激分子基因。
[0287]
在一些实施方式中,本文所述核酸分子提供于病毒载体中。如本文所用,术语“病毒载体”可指,例如,包括有助于核酸分子转移或整合到细胞基因组的病毒衍生核酸元件的核酸分子(例如,转移质粒),或介导核酸转移的病毒颗粒。病毒颗粒可包括各种病毒组分,有时除核酸外还包括宿主细胞组分。
[0288]
适合使用的病毒载体包括,例如,逆转录病毒、腺病毒和腺相关载体、疱疹病毒、猿病毒40(sv40)和牛乳头瘤病毒载体(例如,参见gluzman(ed.),eukaryotic viral vectors,csh laboratory press,cold spring harbor,n.y.)。如本文所用,术语“逆转录病毒载体”可指经修饰以表达目的基因(即编码候选多肽或异源多肽的基因)的逆转录病毒。逆转录病毒载体可用于通过利用病毒感染过程将基因(即编码候选多肽或异源多肽的基因)高效转移到宿主细胞。克隆到逆转录病毒基因组中(即,使用分子生物学技术插入)的外源或异源靶基因可以有效地传递给易受逆转录病毒感染的宿主细胞。已知的基因操作可能会破坏逆转录病毒基因组的复制能力。由此产生的复制缺陷型载体可用于将新的遗传物质引入细胞,但它们不能被复制。辅助病毒或包装细胞系可用于允许载体颗粒从细胞中组装和释放。此类逆转录病毒载体可包含编码一个或多个目的基因的核酸序列(即,多顺反子核酸序列可编码多个目的基因)、5'逆转录病毒长链末端重复序列(5'ltr)和3'包含逆转录病毒长链末端重复(3'ltr)的复制缺陷型逆转录病毒基因组。
[0289]
在一些实施方式中,病毒载体是慢病毒载体。如本文所用,术语“慢病毒载体”是指
可并入非分裂细胞的慢病毒家族(例如,hiv、miv、马传染性贫血病毒、山羊关节炎脑炎病毒)。(参见,例如,美国专利号5,994,136和6,013,516,所有这些均通过引用并入本文中)。
[0290]
在一些实施方式中,病毒载体是假型慢病毒载体。如本文所用,术语“伪慢病毒载体”或“假型慢病毒载体”是指包含异源膜蛋白,例如异源病毒包膜以改变其取向性的慢病毒载体。例如,见cronin等人(2005)curr.gene ther.5:387-398。例如,在一些实施方式中,囊膜糖蛋白来自水泡性口炎病毒(vsvg)。假型慢病毒载体具有一组不同的自然发生或工程化病毒包膜,可实现特定细胞类型的靶向转导。例如,已开发出具有狒狒逆转录病毒包膜糖蛋白(baev-lvs)的假型慢病毒载体。与vsvg假型慢病毒载体相比,用修饰后的baevg假型化的慢病毒载体可将nk细胞转导20倍或更高,这在很大程度上是因为激活的nk细胞导致asct-2上调,使其对使用baev假型慢病毒载体转导高度敏感。
[0291]
在一些实施方式中,病毒载体能够表达car多肽。在一些实施方式中,病毒载体包含含有复制原点的核酸序列。在一些实施方式中,病毒载体是质粒。在一些实施方式中,病毒载体是表达结构,其通常是用于将特定基因导入目标细胞的质粒。一旦表达载体进入细胞内,基因编码的蛋白质就由细胞转录和翻译机制核糖体复合物产生。在一些实施方式中,质粒被设计成包含作为增强子和启动子区域并导致表达载体上携带的基因的高效转录的调控序列。本公开的病毒载体表达大量稳定信使rna,从而表达蛋白质。
[0292]
在一些实施方式中,病毒载体具有表达信号,例如强启动子、强终止密码子、调节启动子和克隆基因之间的距离以及插入转录终止序列和ptis(便携式翻译起始序列)。
[0293]
在一些实施方式中,病毒载体是环状质粒或线性核酸。环状质粒和线性核酸能够指导特定核苷酸序列在适当的受试细胞中的表达。在一些实施方式中,病毒载体包含可操作地连接编码car多肽的核苷酸序列的启动子,其可操作地连接终止信号。在一些实施方式中,包含编码car多肽的核苷酸序列的病毒载体意味着其至少一个组分相对于其至少一种其他组分是异源的。在一些实施方式中,表达盒中核苷酸序列的表达受组成型启动子或诱导型启动子的控制,诱导型启动子仅在宿主细胞暴露于某些特定外部刺激时启动转录。
[0294]
细胞因子诱导的记忆样自然杀伤细胞
[0295]
在一些实施方式中,本公开提供包含本文所述car多肽的工程化细胞因子诱导的记忆样(ml)自然杀伤(nk)细胞或所述细胞的群体。在一些实施方式中,ml nk细胞或细胞的群体从自体或同种异体nk细胞(例如人类供体nk细胞)分化或衍生而来。在一些实施方式中,ml nk细胞或细胞的群体从脐血(例如,人类脐血)的nk细胞分化或衍生而来。在一些实施方式中,ml nk细胞或细胞的群体从人pbmc分化或衍生而来。在一些实施方式中,ml nk细胞或细胞的群体从ipsc衍生的nk细胞(例如,人类ipsc)分化或衍生而来。
[0296]
在一些实施方式中,ml nk细胞或细胞的群体从cd56+cd3-人nk细胞分化而来。在一些实施方式中,从人pbmc(例如,供体人pbmc,例如,自体或同种异体)纯化cd56+cd3-人nk细胞。在一些实施方式中,从pbmc纯化》95% cd56+cd3-人nk细胞。在一些实施方式中,使用免疫密度细胞分离,例如rosettesep,分离cd56+cd3-人nk细胞。在一些实施方式中,用于从pbmc纯化cd56+cd3-人nk细胞的方法包括(i)使用特定抗体将非nk细胞与红细胞交联以形成免疫花环;(ii)将细胞进行密度梯度离心,以使免疫花环沉淀;(iii)分离nk细胞。
[0297]
在一些实施方式中,人nk(hnk)细胞的群体包含处于不同成熟和/或发育阶段的子集。在一些实施方式中,成熟和/或发育的阶段由表型标记物的表达决定。在一些实施方式
中,成熟和/或发育阶段基于图7c中所示的表型标记物来确定。在一些实施方式中,较不成熟、不太发达、更像干细胞和/或高度增殖的hnk细胞子集表达以下表型标记物:cd56
亮
cd16
低/-nkg2a
+
kir-cd57-。在一些实施方式中,处于中间成熟和/或发育阶段的hnk细胞子集表达以下表型标记物:cd56
暗
、cd16
+
nkg2a
+/-kir-cd57-或cd56
暗
cd16
+
nkg2a
+/-kir
+
cd57-。在一些实施方式中,成熟和/或发达的hnk细胞子集表达以下表型标记物:cd56
暗
cd16
+
nkg2a
+/-kir
+
cd57
+
。在一些实施方式中,例如通过流式细胞仪测定,相对于较成熟和/或者较发达的hnk细胞子集的asct的平均表达水平,较不成熟和/或较不发达的hnk细胞子集的asct2的平均表达水平增加(例如,约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、2.5倍、3倍)。
[0298]
在一些实施方式中,例如通过流式细胞仪测定,相对于cd56
暗
cd16
+
nkg2a
+/-kir-cd57-的hnk细胞子集的asct的平均表达水平,cd56
亮
cd16
低/-nkg2a
+
kir-cd57-的hnk细胞子集的asct2的平均表达水平增加(例如,约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、2.5倍、3倍)。在一些实施方式中,例如通过流式细胞仪测定,相对于cd56
暗
cd16
+
nkg2a
+/-kir
+
cd57-的hnk细胞子集的asct的平均表达水平,cd56
亮
cd16
低/-nkg2a
+
kir-cd57-的hnk细胞子集的asct2的平均表达水平增加(例如,约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、2.5倍、3倍)。在一些实施方式中,例如通过流式细胞仪测定,相对于cd56
暗
cd16
+
nkg2a
+/-kir
+
cd57
+
的hnk细胞子集的asct的平均表达水平,cd56
亮
cd16
低/-nkg2a
+
kir-cd57-的hnk细胞子集的asct2的平均表达水平增加(例如,约1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、2.5倍、3倍)。
[0299]
表型
[0300]
在一些实施方式中,与对照nk细胞或细胞的群体相比,细胞因子诱导的记忆样(ml)nk细胞表达一组独特的标记物。在一些实施方式中,对照nk细胞是在单独存在il-15(例如,人il-15)的情况下激活的人nk细胞或在单独存在il-15的情况下激活的人nk细胞系。在一些实施方式中,对照nk细胞与衍生出ml nk细胞的nk细胞具有相同的表型。
[0301]
在一些实施方式中,在对照nk细胞上表达的至少一种细胞表面标记物的表达减少。在一些实施方式中,在对照nk细胞上表达的至少一种细胞表面标记物不在ml nk细胞上表达。在一些实施方式中,未在对照nk细胞上表达的至少一种细胞表面标记物的表达在ml nk细胞上表达。在一些实施方式中,至少一种在对照nk细胞上具有低表达水平的细胞表面标记物的表达在ml nk细胞上增加。
[0302]
在一些实施方式中,ml nk细胞或所述细胞的群体的特征如下所述:berrien-elliott,m.m.等人cancer discovery,doi:10.1158/2159-8290.cd-20-0312,2020年12月;romee.r.等人sci transl med vol.8(357),2016年9月21日,通过引用并入本文。
[0303]
在一些实施方式中,相对于对照nk细胞,在ml nk细胞或所述细胞的群体中以下一种或多种多肽的表达增加:cd94/nkg2a、nkp30、nkp44、nkgd2和cd25。在一些实施方式中,相对于对照nk细胞,在ml nk细胞或所述细胞的群体中以下一种或几种多肽的表达增加:cd94/nkg2a、nkp30、nkp44、nkp46、nkg2d、cd62l和cd25。在一些实施方式中,相对于对照nk细胞,在ml nk细胞或所述细胞的群体中以下一种或多种多肽增加:trail、cd69、cd62l、nkg2a和nkp30。在一些实施方式中,多肽的表达增加至少1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或10倍。
[0304]
在一些实施方式中,ml nk细胞的群体包含trail+cd69+cd62l+nkg2a+nkp30+nk细胞的增加频率。在一些实施方式中,细胞的群体的频率增加至少1.5、2、3、4、5、6、7、8、9或10倍。在一些实施方式中,ml nk细胞的群体包含cd27+cd127+nk细胞的降低频率。在一些实施方式中,细胞的群体的频率降低至少1.5、2、3、4、5、6、7、8、9或10倍。
[0305]
在一些实施方式中,相对于对照nk细胞,在ml nk细胞或所述细胞的群体中cd16和/或cd11b的表达降低。在一些实施方式中,该多肽的表达降低至少1.5、2、3、4、5、6、7、8、9或10倍。
[0306]
在一些实施方式中,相对于原代/常规nk细胞,在ml nk细胞或所述细胞的群体中以下一种或多种多肽的表达基本上没有变化:kir、cd57、nkg2c、dnam-1、cd137和cd11b。
[0307]
在一些实施方式中,ml nk细胞或所述细胞的群体具有以下表型:cd11b
高
cd27
低
klrg1
高
cd43
高
。
[0308]
在一些实施方式中,ml nk细胞或所述细胞的群体是cd25+nkg2a+nkp30+nkp44+。
[0309]
在一些实施方式中,与对照nk细胞相比,ml nk细胞增加了cd56表达。在一些实施方式中,与对照nk细胞相比,ml nk细胞增加了cd69表达。在一些实施方式中,与对照nk细胞相比,ml nk细胞增加了nkg2a表达。在一些实施方式中,与对照nk细胞相比,ml nk细胞已增加nkg2c的表达。在一些实施方式中,与对照nk细胞相比,ml nk细胞增加了cd94的表达。在一些实施方式中,与对照nk细胞相比,ml nk细胞增加了nkp46的表达。
[0310]
在一些实施方式中,本文所述的细胞表面标记物的表达在暴露于至少一种细胞因子的2-24或14-16小时内诱导。在一些实施方式中,本文所述的表达谱在暴露于至少一种细胞因子的2-24或14-16小时内诱导。
[0311]
功能特性
[0312]
在一些实施方式中,与对照nk细胞相比,细胞因子诱导的记忆样(ml)nk细胞具有增强的功能特性。在一些实施方式中,对照nk细胞是在单独存在il-15的情况下激活的人nk细胞,或在单独存在il-15的情况下激活的人nk细胞系。在一些实施方式中,对照nk细胞与衍生出ml nk细胞的nk细胞具有相同的表型。
[0313]
在一些实施方式中,本文所述的记忆样(ml)nk细胞具有增强的增殖能力。在一些实施方式中,与对照nk细胞相比,ml nk细胞增殖增加。本领域技术人员已知测量细胞增殖的方法,包括但不限于测量细胞数量和/或测量增殖标记物。在一些实施方式中,使用细胞质增殖染料测量增殖,其中细胞渗透性荧光化学物质与细胞溶质成分结合并在每次细胞分裂中稀释一半。这种染料可以在体外和体内使用。示例包括测量羧基荧光素二乙酸酯(cfse)。在一些实施方式中,通过量化细胞周期相关蛋白的水平来测量增殖。多种技术可用于测量细胞增殖。技术示例包括流式细胞术、western blot分析和组织显微镜。可以使用人工方法测定细胞增殖,包括计数细胞总数。
[0314]
在一些实施方式中,记忆样(ml)nk细胞产生ifnγ。在一些实施方式中,相对于对照nk细胞(例如,人nk细胞或激活的人nk细胞),ml nk细胞中ifnγ的产生增加。在一些实施方式中,ml nk细胞在刺激nk细胞后增加了ifnγ的产生。在一些实施方式中,nk细胞由激活受体或肿瘤靶标刺激。在一些实施方式中,与对照nk细胞相比,ml nk细胞在暴露于癌细胞后增加了ifnγ的产生。在一些实施方式中,与对照nk细胞相比,ml nk细胞在暴露于癌细胞时增加了ifnγ的产生。在一些实施方式中,与常规nk细胞相比,ifnγ产生增加至少10%、
至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或至少99%。在一些实施方式中,ifnγ的产生在激活后1-7天、7-14天、14-21天和至多30天的刺激后增加。在一些实施方式中,ml nk细胞在植入受试者后1-7天保持ifnγ增加。在一些实施方式中,ml nk细胞在植入受试者后至少1个月、至少两个月或至少三个月保持ifnγ增加。在一些实施方式中,ml nk细胞在植入后至少一周、至少两周、至少三周、至少一个月、至少两个月或至少三个月保持ifnγ增加。在一些实施方式中,ml nk细胞将增强的ifnγ传递给子代细胞。
[0315]
在一些实施方式中,相对于对照nk细胞,ml nk细胞具有增强的抗体依赖性细胞毒性(adcc)。adcc是一种可以杀死包括肿瘤细胞和病毒感染细胞的敏感靶标的过程,其中nk细胞是效应子。当nk细胞表面的受体识别与细胞表面结合的iggl或igg3抗体时,就会触发adcc。这会触发含有穿孔素和颗粒酶的细胞质颗粒的释放,导致靶细胞死亡。本领域技术人员已知测量nk细胞adcc的方法。
[0316]
在一些实施方式中,相对于对照nk细胞,ml nk细胞具有增强的抗肿瘤功效。本领域技术人员已知并在此描述用于测量nk细胞抗肿瘤功效的方法。
[0317]
在一些实施方式中,ml nk细胞(i)在存在一种或多种细胞因子和/或肿瘤靶点的情况下产生增加的ifnγ;(ii)增强了adcc;(iii)增强抗肿瘤功效;或(iv)(i)-(iii)的任何组合。
[0318]
制备记忆样nk细胞的方法
[0319]
在一些实施方式中,nk细胞分化为记忆样(ml)nk细胞。在一些实施方式中,nk细胞被激活,然后在一段时间(例如,小时、天)内分化为ml nk细胞。在一些实施方式中,nk细胞的激活导致分化为ml nk细胞。在一些实施方式中,使用诸如il-2、il-7、il-12、il-15、il-18和il-21等细胞因子及其任何组合来激活nk细胞。
[0320]
在一些实施方式中,nk细胞通过暴露于il-12和il-15;il-12和il-18;il-15和il-18;或il-12、il-15和il-18一段时间而被激活。
[0321]
在一些实施方式中,nk细胞通过暴露于浓度范围为1-20ng/ml的il-12一段时间而被激活。在一些实施方式中,用至少1ng/ml、至少2ng/ml、至少3ng/ml、至少4ng/ml、至少5ng/ml、至少6ng/ml、至少7ng/ml、至少8ng/ml、至少9ng/ml、至少10ng/ml、至少15ng/ml或至少20ng/ml的il-12激活nk细胞。在一些实施方式中,用10ng/ml的il-12激活nk细胞。
[0322]
在一些实施方式中,nk细胞通过暴露于浓度范围为1-50ng/ml的il-15一段时间而被激活。在一些实施方式中,nk细胞通过暴露于浓度范围为1-100ng/ml的il-15一段时间而被激活。在一些实施方式中,用至少50ng/ml、至少60ng/ml、至少70ng/ml、至少80ng/ml、至少90ng/ml、至少95ng/ml、至少100ng/ml、至少110ng/ml、至少120ng/ml、至少130ng/ml、至少140ng/ml、至少150ng/ml的il-15激活nk细胞。在一些实施方式中,用1ng/ml的il-15激活nk细胞。在一些实施方式中,用50ng/ml的il-15激活nk细胞。
[0323]
在一些实施方式中,nk细胞通过暴露于浓度范围为10-100ng/ml的il-18一段时间而被激活。在一些实施方式中,用50ng/ml的il-18激活nk细胞。在一些实施方式中,用至少20ng/ml、至少30ng/ml、至少40ng/ml、至少50ng/ml、至少60ng/ml、至少70ng/ml、至少80ng/ml、至少90ng/ml、至少95ng/ml或至少100ng/ml的il-18激活nk细胞。在一些实施方式中,用50ng/ml il-18激活nk细胞。
[0324]
在一些实施方式中,nk细胞通过暴露于1-20ng/ml il-12、1-50ng/ml il-15和10-100ng/ml il-18一段时间而被激活。在一些实施方式中,nk细胞通过暴露于10ng/ml il-12、1ng/ml il-15和50ng/ml的il-18一段时间而被激活。在一些实施方式中,nk细胞通过暴露于10ng/ml il-12、50ng/ml il-15和50ng/ml il-18一段时间而被激活。
[0325]
在一些实施方式中,nk细胞在细胞因子存在下孵育足够长的时间以形成细胞因子激活的记忆样(ml)nk细胞。在一些实施方式中,足以形成细胞因子激活的记忆样(ml)nk细胞的时间在约8到约24小时、约12小时或约16小时之间。在一些实施方式中,足以形成细胞因子激活的记忆样(ml)nk细胞的时间在约16小时到约20小时之间。在一些实施方式中,足以形成细胞因子激活的记忆样(ml)nk细胞的时间至少为约1小时;约2小时;约3小时;约4小时;约5小时;约6小时;约7小时;约8小时;约9小时;约10小时;约11小时;约12小时;约13小时;约14小时;约15小时;约16小时;约17小时;约18小时;约19小时;约20小时;约21小时;约22小时;约23小时;约24小时;约25小时;约26小时;约27小时;约28小时;约29小时;约30小时;约31小时;约32小时;约33小时;约34小时;约35小时;约36小时;约37小时;约38小时;约39小时;约40小时;约41小时;约42小时;约43小时;约44小时;约45小时;约46小时;约47小时;或约48小时。
[0326]
在一些实施方式中,ml nk细胞通过暴露于至少一种细胞因子12-24小时、12-48小时或14-16小时而被激活。在一些实施方式中,ml nk细胞通过暴露于至少一种细胞因子16-20小时而被激活。在一些实施方式中,ml nk细胞通过暴露于至少一种细胞因子16小时而被激活。
[0327]
在一些实施方式中,ml nk细胞通过暴露于1-20ng/ml il-12、1-50ng/ml il-15和10-100ng/ml l il-18 12-24小时或14-16小时而被激活。在一些实施方式中,ml nk细胞通过暴露于10ng/ml il-12、1ng/ml il-15和50ng/ml il-18 12-24小时或14-16小时而被激活。在一些实施方式中,ml nk细胞通过暴露于10ng/ml il-12、50ng/ml il-15和50ng/ml il-18 12-24小时、16-20小时或14-16小时而被激活。
[0328]
在一些实施方式中,用il-15在体外维持ml nk细胞。在一些实施方式中,用1ng/ml的il-15来维持ml nk细胞。在一些实施方式中,ml nk细胞每天、每两天、每三天、每四天或每五天与il-15接触一次。在一些实施方式中,ml nk细胞每两天与il-15接触一次。在一些实施方式中,ml nk细胞每三天与il-15接触一次。
[0329]
在一些实施方式中,通过将nk细胞与表达至少一种细胞因子的细胞共培养来激活nk细胞。在一些实施方式中,ml nk细胞通过将nk细胞与一种或多种树突状细胞和巨噬细胞的共培养生成。在一些实施方式中,ml nk细胞通过将nk细胞与树突状细胞共培养生成。在一些实施方式中,当与nk细胞共培养时,树突状细胞分泌足够的il-12、il-15和il-18中的任一种或多种以产生ml nk细胞。在一些实施方式中,ml nk细胞通过将nk细胞与巨噬细胞共培养生成。在一些实施方式中,当与nk细胞共培养时,巨噬细胞分泌足够的il-12、il-15和il-18中的任一种或多种以产生ml nk细胞。
[0330]
示例记忆样nk细胞
[0331]
在一些实施方式中,ml nk细胞或所述细胞的群体包含如本文所述的表型和至少一个功能特征。
[0332]
在一些实施方式中,ml nk细胞或所述细胞的群体为cd25+nkg2a+nkp30+nkp44+,
并且相对于对照nk细胞,在存在一种或多种细胞因子和/或肿瘤靶标的情况下产生ifnγ。
[0333]
在一些实施方式中,ml nk细胞或所述细胞的群体是cd25+nkg2a+nkp30+nkp44+并且(i)相对于对照nk细胞,在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ以及(ii)相对于对照nk细胞具有增强的adcc活性。
[0334]
在一些实施方式中,ml nk细胞或所述细胞的群体是cd25+nkg2a+nkp30+nkp44+并且(i)相对于对照nk细胞,在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ,以及(ii)相对于对照nk细胞具有增强的抗肿瘤功效。
[0335]
在一些实施方式中,ml nk细胞或所述细胞的群体是cd25+nkg2a+nkp30+nkp44+,并且(i)相对于对照nk细胞具有增强的抗肿瘤功效,以及(ii)相对于对照nk细胞具有增强的adcc活性。
[0336]
在一些实施方式中,ml nk细胞或所述细胞的群体是cd25+nkg2a+nkp30+nkp44+并且(i)相对于对照nk细胞,在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ;(ii)相对于对照nk细胞具有增强的adcc活性;和(iii)相对于对照nk细胞具有增强的抗肿瘤功效。
[0337]
在一些实施方式中,相对于对照nk细胞,ml nk细胞或所述细胞的群体具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达,并且在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ。
[0338]
在一些实施方式中,ml nk细胞或所述细胞的群体(i)具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ;和(iii)具有增强的adcc活性,其中(i)-(iii)是相对于对照nk细胞。
[0339]
在一些实施方式中,ml nk细胞或所述细胞的群体(i)具有增加的cd94/nkg2a、nkp30、nkp244、nkg2d、cd25、或其任何组合的表达;(ii)在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ;和(iii)具有增强的抗肿瘤功效,其中(i)-(iii)是相对于对照nk细胞。
[0340]
在一些实施方式中,ml nk细胞或所述细胞的群体(i)具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)具有增强的adcc活性;和(iii)具有增强的抗肿瘤功效,其中(i)-(iii)是相对于对照nk细胞。
[0341]
在一些实施方式中,ml nk细胞或所述细胞的群体(i)具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ;(iii)具有增强的adcc活性;和(iv)具有增强的抗肿瘤功效,其中(i)-(iv)是相对于对照nk细胞。
[0342]
在一些实施方式中,ml nk细胞或所述细胞的群体(i)具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)具有降低的cd16和/或cd11lb的表达;(iii)在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ,其中(i)-(iii)是相对于对照nk细胞。
[0343]
在一些实施方式中,ml nk细胞或所述细胞的群体(i)具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)具有降低的cd16和/或cd11lb的表达;(iii)在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ;和(iv)具有增强的
adcc活性,其中(i)-(iv)是相对于对照nk细胞。
[0344]
在一些实施方式中,ml nk细胞或所述细胞的群体(i)具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)具有降低的cd16和/或cd11lb的表达;(iii)在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ;和(iv)具有增强的抗肿瘤功效,其中(i)-(iv)是相对于对照nk细胞。
[0345]
在一些实施方式中,ml nk细胞或所述细胞的群体(i)具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)具有降低的cd16和/或cd11lb的表达;(iii)具有增强的adcc活性;和(iv)具有增强的抗肿瘤功效,其中(i)-(iv)是相对于对照nk细胞。
[0346]
在一些实施方式中,ml nk细胞或所述(i)的群体具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)具有降低的cd16和/或cd11lb的表达;(iii)在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ;(iv)具有增强的adcc活性;和(v)具有增强的抗肿瘤功效,其中(i)-(v)是相对于对照nk细胞。
[0347]
在一些实施方式中,ml nk细胞或所述(i)的群体是cd56
亮
、cd16
低/-、nkg2a
+
、kir-、cd57;(ii)高度增殖;(iii)较不成熟;(iv)具有增加的asct2的表达,其中(i)-(iv)是相对于对照nk细胞,其是cd56
暗
、cd16
+
、nkg2a
+/-、kir-、cd57-;cd56
暗
、cd16
+
、nkg2a
+/-、kir
+
、cd57-;或cd56
暗
、cd16
+
、nkg2a
+/-、kir
+
、cd57
+
。
[0348]
提高细胞转导效率的方法
[0349]
本公开涉及提高细胞转导效率的方法。在实施方式中,该方法包括将至少一个asct2
+
细胞与包含编码候选多肽的载体的细胞培养基接触。在实施方式中,asct2
+
细胞已被细胞因子激活。在一些方面,本公开涉及提高细胞转导效率的方法,包括将至少一个asct2
+
细胞与包含编码候选多肽的狒狒包膜(baev)慢病毒载体的细胞培养基接触。
[0350]
丙氨酸/丝氨酸/半胱氨酸转运体,包括asct1(由slc1a4编码)(asct1(人),基因名称slc1a4,基因id:6509)和asct2(由slc1a5编码)(asct2(人),基因名称slc1a5,基因id:6510),介导小中性氨基酸如ala、ser、cys和thr的钠依赖性交换。它们的结构预测与谷氨酸转运体的结构相似。例如,丙氨酸/丝氨酸/半胱氨酸优先转运体2(asct2)是一种广泛表达的、特异性广的钠依赖性中性氨基酸交换器,似乎在细胞外和细胞内氨基酸库的调节中发挥作用。在生理条件下,asct2在体内广泛分布。asct2与癌症有关。例如,asct2的过度表达是由myc等致癌基因驱动的,已在前列腺癌、肺癌、乳腺癌、肾癌、胃肠道癌、肝癌、女性生殖道癌和神经系统癌中观察到。
[0351]
如本文所述,asct2的表达水平在原代常规nk细胞中丰富,在细胞因子诱导的记忆样(ciml)nk细胞内进一步增强。asct2是狒狒包膜糖蛋白baev-gp的受体,表明nk细胞(如原代nk细胞和ciml nk细胞)的低效转导可以利用非常规的baev假型慢病毒来克服。因此,asct2的存在或水平(即asct2+细胞)导致细胞更容易接受baev慢病毒载体的转导。
[0352]
在一些实施方式中,asct2
+
细胞可通过存在或不存在asct2或其表达来表征。例如,asct2的存在或不存在或其表达可以通过本领域已知的技术来确定。例如,进行免疫分析的程序被描述,例如在“elisa:theory and practice:methods in molecular biology",vol.42,j.r.crowther(编)human press,totowa,nj,1995;"immunoassay",e.diamandis和t.christopoulus,academic press,inc.,san diego,ca,1996;和"
memory-like nk cells."blood 120.24(2012):4751-4760。例如,静息nk细胞被il-7、il-12、il-15、il-18、il-21等细胞因子或其任何组合激活。参考图1,例如,用il-12、il-18和任选地il-15预激活初始nk细胞,以产生细胞因子诱导的记忆样nk细胞。在实施方式中,ciml nk细胞可以通过相对于对照细胞(例如尚未被激活的细胞)增强的ifn-γ产生来识别。记忆样nk细胞的其他合适的生物标记物包括但不限于cd94、nkg2a、nkg2c、cd69和nkp46。
[0362]
在一个实施方式中,nk细胞(例如,细胞因子诱导的记忆样(ciml)nk细胞、静息nk细胞和初始nk细胞)可以用白细胞介素12家族的细胞因子预激活。例如,白细胞介素12家族的成员包括异二聚体细胞因子il-12(包括亚单位il-12a(p35)和il-12b(p40))、il-23(包括亚单位il-12b(p40)和il-23p19)、il-27(包括亚单位ebi3和il-27p28)和il-35(包括亚单位ebi3与il-12a(p35))。ebi3是il-12p40的同源物。无需受理论约束,nk细胞(例如,细胞因子诱导的记忆样(ciml)nk细胞、静息nk细胞和初始nk细胞)可以用il-12b(p40)亚单位或其同源物(如ebi3)预激活。另见sun等人,cytokine.2015oct;75(2):249
–
255,通过引用将其全部并入。
[0363]
在一些实施方式中,细胞是哺乳动物细胞,例如哺乳动物nk细胞。术语“哺乳动物细胞”可以指来自哺乳动物的细胞。在实施方式中,细胞是人类细胞,例如人nk细胞,而在其他实施方式中,则从牲畜(domestic animals)、实验动物、家畜(livestock)或宠物(例如啮齿动物、牛、猪、绵羊、山羊、狗、猫、马、兔子等)获得细胞。本发明并不打算局限于任何特定物种的细胞,因为本发明可用于任何类型的哺乳动物细胞。本发明还可用于从任何类型的动物获得的正常细胞、癌细胞、癌前细胞、健康细胞、疾病细胞、病毒感染细胞、来自不同组织的细胞、处于不同发育阶段的细胞,例如成人细胞和胎儿细胞等。在进一步实施方式中,本发明可用于从任何类型的动物获得的突变细胞,包括自然发生的突变细胞、使用敲除技术进行基因工程化的突变细胞以及插入、删除或替换、化学诱导的突变细胞和辐射诱导的突变细胞等。本发明还可用于来自任何类型动物的原代培养细胞、细胞系细胞和感染病原体(例如病毒、细菌、原生动物、真菌等)的细胞。
[0364]
如本文所述,本公开的各个方面针对提高细胞转导效率的方法。例如,该方法包括将至少一个asct2
+
细胞与包含编码靶基因的载体的细胞培养基接触。在实施方式中,该方法可以包括获取、隔离或识别asct2
+
细胞的步骤。在实施方式中,可通过用一种或多种细胞因子(例如il-12、il-18和/或il-15)培养(或激活)asct2-细胞来提供asct2
+
细胞。“培养”细胞可指在适合细胞存活和/或生长和/或增殖的条件下将细胞与细胞培养基接触。参考图1,例如,初始nk细胞是asct-细胞,其在与一种或多种细胞因子培养并由其预激活后,分化为细胞因子诱导的记忆样nk细胞,即asct2
+
细胞。在一些实施方式中,细胞可以培养一段时间。例如,细胞可以在用一种或多种细胞因子预激活之前、期间或之后培养。例如,在用il-12、il-18和/或il-15预激活后,细胞可以用il-15培养一段时间。另一个例子是,细胞可以在转导之前、期间或之后培养。
[0365]
因此,实施方式可以包括获取、分离或识别asct2
+
细胞的步骤,例如细胞因子诱导的记忆样(ciml)nk细胞。如本文所述,asct2的表达水平在细胞因子诱导的记忆样(ciml)nk细胞中增强,因此asct2的表达水平或蛋白质水平可用于识别asct2
+
细胞。asct2是狒狒包膜糖蛋白baev-gp的受体,表明利用非传统的baev假型慢病毒可以克服nk细胞(如ciml nk细胞)的无效转导。因此,asct2的存在或水平(即asct2
+
细胞)导致细胞更容易接受baev慢
病毒载体的转导。
[0366]
候选多肽
[0367]
控制细胞生长、增殖和死亡的肿瘤特异性抗原可以在细胞内。细胞内蛋白质的识别需要能够识别hla分子呈递的抗原肽。正常情况下,nk细胞无法识别包括hla分子呈递的新表位在内的表位。因此,如本文所述,基因工程化nk细胞可以靶向细胞内抗原。例如,一组称为t细胞受体(tcr)样/模拟抗体的特定抗体针对这些细胞内抗原。细胞内肿瘤特异性抗原可以通过主要组织相容性复合体(mhc)i类信号传导通路,并在肿瘤细胞表面呈递肿瘤特异性肽/mhc复合体。tcr样抗体以与真正的tcr相同的方式识别肿瘤细胞表面的肽/mhc复合体。t细胞表面表达的tcr对肽/mhc复合体的识别可以触发多种效应,如t细胞增殖和分化以及细胞因子或趋化因子的分泌。然而,tcr样抗体对肽/mhc复合体的识别可以触发比t细胞中tcr更广泛的药理学途径。tcr样抗体可触发adcc、cdc、抗体依赖性细胞吞噬(adcp)或直接诱导细胞凋亡。此类抗体靶标包括但不限于mage1、gp100、htert、muc1、ny-eso-1、flt3、tp53、剪接体因子、mage3、hcgβ、her2/neu、melan-a/mart-1、tarp、p53、酪氨酸酶、p68、mif、蛋白酶3、wt1、ha-1h和prame。例如,见he,qinghua等人,"tcr-like antibodies in cancer immunotherapy."journal of hematology&oncology 12.1(2019):99。
[0368]
核磷蛋白1(npm1)是参与核糖体组装/转运、细胞质/核运输、dna聚合酶α活性调节、中心体复制和p53调节的磷酸蛋白。npm1由人npm1基因编码,是急性髓细胞白血病(aml)的细胞内靶标。npm1中导致细胞质定位的突变可称为突变蛋白细胞质核磷蛋白1(npm1c)。npm1c在其c端包含一个核输出信号(nes)。
[0369]
在一些实施方式中,候选多肽包含嵌合抗原受体(或car)。“嵌合抗原受体”是指一种人工免疫细胞受体,其被设计用于识别和结合肿瘤细胞表达的抗原。car可以设计用于免疫效应细胞,例如t细胞或nk细胞,并且可以是信号传导结构域(例如t细胞受体(tcr)复合体)和抗原识别结构域(如抗体的单链片段(scfv))的嵌合体(enblad等人,human gene therapy.,2015,26(8):498-505)。
[0370]
因此,car可用于将抗体或其片段的特异性嫁接到nk细胞或t细胞上,其中其编码序列的转移由逆转录病毒载体促进。这些受体被称为嵌合体,因为它们由不同来源的部分组成。当遇到靶细胞(例如癌细胞)时,car nk细胞通过以下机制破坏癌细胞,例如:细胞增殖的一般刺激,细胞对其他活细胞的毒性程度增加(即细胞毒性),以及免疫系统中细胞分泌因子的产生增加,这对生物体内的其他细胞有影响。
[0371]
如本文所用,本文所述的载体,例如baev lv,表达目的基因(即,编码候选多肽的基因、编码异源多肽的基因、编码本文所述car的基因)。如本文所用,候选多肽可指希望在asct2+细胞上或在asct2+细胞中表达的任何多肽或其片段。例如,候选多肽可以是抗体或其片段、毒素、激素、生长因子、受体或信号传导分子。在一些实施方式中,候选多肽或异源多肽是本文所述的car。合适的候选多肽包含抗体及其片段,其非限制性实例包含免疫检查点抗体(即免疫检查点抑制剂)。此类抗体靶标包括但不限于4-1bb配体、b7-h3、b7-h4、btla、cd27、cd28、cd30、cd40、ido、light、粘连蛋白2、ox40、cd70、cd80、cd86、cd96、cd137、cd153、cd154、cd155、cd223、ox40l、pd-1、pd-l1、tigit、cd226、cd273、cd357、ctla-4、dr3、半乳凝素9、gitrl、icos、icoslg、tim3、tl1a、tnfrsf14和vista。
[0372]
如本文所用,术语“转导”或“细胞转导”可指使用dna或rna病毒将核酸转移到细胞
中的过程。
[0373]
相对于传统慢病毒转导方法,本文所述的实施方式可以改善或提高转导效率。“提高转导效率”或“改善转导效率”可以指假型慢病毒载体改善靶细胞(例如asct2+ciml nk细胞)群体的百分比或比例的能力,其中编码多肽的基因在细胞内跨质膜传递。免疫荧光显微镜、流式细胞术和其他合适的方法可用于评估转导效率。在一些实施方式中,本文所述的方法可以实现至少25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%或85%的转导效率,例如通过免疫荧光显微镜、流式细胞术、facs和其他合适的方法进行测量。例如,本文描述的方法可以在约3天后导致至少40%的细胞转导。
[0374]
提高细胞转导效率的示例方法
[0375]
在方面中,本发明提供了一种提高细胞转导效率的方法。例如,该方法包括将至少一个asct2
+
细胞(例如nk细胞)与包含编码候选多肽的狒狒包膜(baev)慢病毒载体的细胞培养基接触。在实施方式中,已用白细胞介素-12家族成员和il-18激活asct2
+
细胞。在实施方式中,已用il-12、il-18和il-15激活asct2
+
细胞。在实施方式中,该方法包括获取、分离或识别nk细胞,并用白细胞介素-12家庭成员和il-18以及任选的il-15激活nk细胞(例如asct2-细胞)的步骤。在进一步实施方式中,白细胞介素-12家族成员包括il-12、il-23、il-27或il-35。在进一步实施方式中,激活nk细胞产生asct2
+
细胞。在实施方式中,asct2
+
细胞是细胞因子诱导的记忆样(ciml)nk细胞。在进一步实施方式中,该方法包括获取、分离或识别细胞因子诱导的记忆样(ciml)nk细胞的步骤。在某些实施方式中,相对于对照细胞,asct2
+
的表达或水平增加。在进一步实施方式中,对照细胞是未激活的nk细胞。在实施方式中,对照细胞是成熟nk细胞。在实施例中,相对于对照细胞,asct2
+
细胞中asct2表达增加约20%至约30%。在实施方式中,asct2的存在或水平导致细胞更容易接受baev慢病毒载体的转导。在实施方式中,已使用il-7、il-12、il-15、il-18、il-21、il-23、或其任何组合中的一种或多种激活asct2
+
细胞。在实施方式中,asct2
+
细胞是哺乳动物细胞。在进一步实施方式中,哺乳动物细胞是人细胞。在进一步实施方式中,从外周血单个核细胞(pbmc)分离人细胞。在实施方式中,用狒狒包膜糖蛋白(baev-gp)假型化慢病毒载体。在实施方式中,约3天后转导至少一种asct2
+
细胞的至少40%。在实施方式中,相对于传统慢病毒转导方法,转导效率提高。在实施方式中,候选多肽包括抗体或其片段、毒素、激素、生长因子、受体、或信号传导分子、或其嵌合抗原受体。在进一步实施方式中,抗体或片段对检查点抑制剂是特异性的。在进一步实施方式中,抗体是抗t细胞受体抗体或t细胞受体样抗体。在进一步实施方式中,抗体或其片段对npm1、npm1c、mage1、gp100、htert、muc1、ny-eso-1、flt1、tp53、剪接体因子、mage3、hchβ、her2/neu、melan-a/mart-1、tarp、p53、酪氨酸酶、p68、mif、蛋白酶3、wt1、ha-1h或prame是特异性的。在实施方式中,抗体靶向肿瘤特异性细胞内蛋白。在进一步实施方式中,细胞内蛋白质包含npm1c。在实施方式中,培养基包含12/15/15/21和il-7。
[0376]
本发明的方面还涉及由本文所述的任何方法产生的细胞。
[0377]
此外,本发明的方面涉及治疗癌症的方法。例如,这些方法包括向有需要的受试者施用由本文所述的任何一种方法产生的细胞。
[0378]
此外,本发明的方面涉及制造基因工程化细胞的方法。例如,此类方法包括将至少一个asct2
+
细胞与包含编码多肽的狒狒包膜(baev)慢病毒载体的细胞培养基接触。在实施方式中,已用白细胞介素12家族成员和il-18激活asct2
+
细胞。在实施方式中,白细胞介素
12家族成员包括il-12、il-23、il-27或il-35。
[0379]
本发明的方面还涉及通过将至少一个asct2
+
细胞与包含编码多肽的狒狒包膜(baev)慢病毒载体的细胞培养基接触而产生的基因工程化细胞。在实施方式中,已使用白介素-12家族成员和白介素-18激活asct2
+
细胞。
[0380]
此外,本发明的方面涉及免疫疗法,其包括通过本文所述的任何方法产生的细胞,或通过将至少一个asct2
+
细胞与包含编码多肽的狒狒包膜(baev)慢病毒载体的细胞培养基接触而产生的基因工程化细胞。在实施方式中,在asct2
+
细胞中已被白介素-12家族成员和白介素-18激活。
[0381]
此外,本发明的方面涉及治疗癌症的方法。例如,这些方法包括向有需要的受试者施用免疫疗法,免疫疗法包括通过本文所述任何方法产生的细胞,或通过将至少一个asct2
+
细胞与包含编码多肽的狒狒包膜(baev)慢病毒载体的细胞培养基接触而产生的基因工程化细胞。在实施方式中,已使用白介素-12家族成员和il-18激活asct2
+
细胞。
[0382]
从随后的描述中,本发明的其他目的和优点将变得显而易见。
[0383]
细胞因子诱导的记忆样nk细胞的转导方法
[0384]
本文提供用于产生表达异源多肽的细胞因子诱导的记忆样nk细胞的群体的方法。在一些实施方式中,异源多肽包含本文所述的任何car多肽。
[0385]
在一些实施方式中,该方法包括用假型慢病毒载体转导细胞因子诱导的记忆样nk细胞的群体。如本文所述,假型慢病毒载体包含异源糖蛋白,例如来自不同包膜病毒的糖蛋白。在一些实施方式中,假型慢病毒载体能够基于糖蛋白识别的受体是否存在或由宿主细胞表达来识别和转导特定宿主细胞。例如,典型假型慢病毒载体包含与ldl受体结合的糖蛋白vsv-g,其中假型慢病毒载体识别并转导表达ldl受体的宿主细胞。在不受理论约束的情况下,ldl受体在nk细胞(例如,传统nk细胞、细胞因子诱导的记忆样nk细胞)上表达不佳,导致使用包含vsv-g糖蛋白的假型慢病毒载体在这些细胞中的转导效率无效。
[0386]
因此,本公开的方法包括用假型慢病毒载体转导细胞因子诱导的记忆样nk细胞的群体,该假型慢病毒载体包含与细胞上存在的受体结合的异源糖蛋白。在一些实施方式中,细胞因子诱导的记忆样nk细胞表达asct-2,并且假型慢病毒载体包含结合asct-2的糖蛋白。在不受理论约束的情况下,asct-2在细胞因子诱导记忆样nk细胞上的大量表达导致在这些细胞中使用包含结合asct-2的糖蛋白的假型慢病毒载体进行有效转导。
[0387]
在一些实施方式中,结合asct-2的糖蛋白是保持与asct-2结合的baev糖蛋白或其变体。在一些实施方式中,结合asct-2糖蛋白包含与seq id no:107具有至少70%、75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的氨基酸序列。在一些实施方式中,结合asct-2的糖蛋白包含seq id no:107。在一些实施方式中,与asct-2结合的糖蛋白由seq id no:107组成。
[0388]
在一些实施方式中,结合asct-2的糖蛋白包含由与seq id no:108具有至少70%、75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的核苷酸序列编码的多肽。在一些实施方式中,结合asct-2的糖蛋白包含由seq id no:108所示核苷酸序列编码的多肽。在一些实施方式中,结合asct-2的糖蛋白由seq id no:108所示核苷酸序列编码的多肽组成。
[0389]
在一些实施方式中,群体包括表达asct-2的细胞因子诱导的记忆样nk细胞。在一
些实施方式中,产生表达异源多肽的细胞因子诱导的记忆样nk细胞的群体的方法包括将细胞因子诱导的记忆样nk细胞的群体与编码异源多肽的假型慢病毒载体接触(例如,在一定条件下,以转导细胞因子诱导的记忆样nk细胞的群体),其中,假型慢病毒载体包含与asct-2结合的糖蛋白(例如,baev)。
[0390]
在一些实施方式中,该方法包括根据本文描述的方法提供细胞因子诱导的记忆样nk细胞的群体。在一些实施方式中,相对于对照nk细胞的群体,细胞因子诱导的记忆样nk细胞的群体包括一种或多种表型标记物和/或本文所述的功能特征。在一些实施方式中,细胞因子诱导的记忆样nk细胞的群体从原代人nk细胞的群体中获得。在一些实施方式中,对照nk细胞的群体从相同或不同的原代人nk细胞的群体中获得。在一些实施方式中,根据本文描述的方法,原代人nk细胞的群体衍生自(例如,自体或同种异体)ipsc、脐血或pbmc。在一些实施方式中,细胞因子诱导的记忆样nk细胞的群体和对照nk细胞的群体从相同的原代人nk细胞的群体中获得,其中原代人nk细胞的群体根据本文描述的方法衍生自(例如,自体或同种异体)ipsc、脐血或pbmc。
[0391]
在一些实施方式中,通过预激活原代人nk细胞的群体来获得细胞因子诱导的记忆样nk细胞的群体。在一些实施方式中,根据romee r等人blood.2012;120(24)和/或romee r,sci.transl.med.2016;21:357ra123(通过引用并入本文)中描述的方法获得细胞因子诱导的记忆样nk细胞的群体。在一些实施方式中,通过暴露于一种或多种细胞因子一段时间预激活原代人nk细胞的群体。在一些实施方式中,一种或多种细胞因子选自:il-12、il15、il18、及其组合。在一些实施方式中,通过暴露于il-12和il-15;il-12和il-18;il-18和il-15;或il-12、il-15和il-18一段时间预激活原代人nk细胞的群体。
[0392]
在一些实施方式中,通过预激活原代人nk细胞的群体获得细胞因子诱导的记忆样nk细胞的群体,其中原代人nk细胞的群体暴露于约1ng/ml至约20ng/ml浓度范围内的il-12;约1ng/ml至约50ng/ml浓度范围内的il-15;和约10ng/ml和约100ng/ml浓度范围内的il-18一段时间。在一些实施方式中,将原代人nk细胞的群体暴露于约5ng/ml至约15ng/ml浓度范围内的il-12;约25ng/ml至约75ng/ml浓度范围内的il-15;和约25ng/ml至约75ng/ml浓度范围内的il-18一段时间。在一些实施方式中,将原代人nk细胞的群体暴露于约5ng/ml至约15ng/ml浓度范围内的il-12;和约25ng/ml至约75ng/ml浓度范围内的il-18一段时间。在一些实施方式中,将原代人nk细胞的群体暴露于浓度约为5、6、7、8、9、10、11、12、13、14或15ng/ml的il-12;浓度约为40、45、50、55或60ng/ml的il-15;和浓度约为40、45、50、55或60ng/ml的il-18一段时间。在一些实施方式中,将原代人nk细胞的群体暴露于浓度约为5、6、7、8、9、10、11、12、13、14或15ng/ml的il-12;和浓度约为40、45、50、55或60ng/ml的il-18一段时间。
[0393]
在一些实施方式中,通过暴露于一种或多种细胞因子约8到约24小时之间的一段时间预激活原代人nk细胞的群体。在一些实施方式中,通过暴露于一种或多种细胞因子约12到约20小时之间的一段时间预激活原代人nk细胞的群体。在一些实施方式中,通过暴露于一种或多种细胞因子约12到约16小时之间的一段时间预激活原代人nk细胞的群体。在一些实施方式中,通过暴露于一种或多种细胞因子约16至约20小时之间的一段时间预激活原代人nk细胞的群体。在一些实施方式中,通过暴露于一种或多种细胞因子约14至约16小时之间的一段时间预激活原代人nk细胞的群体。在一些实施方式中,通过暴露于一种或多种
细胞因子约12、13、14、15、16、17、18、19或20小时的一段时间预激活原代人nk细胞的群体。
[0394]
在一些实施方式中,通过预激活原代人nk细胞的群体获得细胞因子诱导的记忆样nk细胞的群体,其中原代人nk细胞的群体暴露于il-12、il-15和il-18约8小时到约24小时之间的一段时间。在一些实施方式中,原代人nk细胞的群体暴露于il-12、il-15和il-18约12小时到约20小时之间的一段时间。在一些实施方式中,原代人nk细胞的群体暴露于il-12、il-15和il-18约12到约16小时之间的一段时间。在一些实施方式中,原代人nk细胞的群体暴露于il-12、il-15和il-18约16小时到约20小时之间的一段时间。在一些实施方式中,原代人nk细胞的群体暴露于il-12、il-15和il-18约14小时到约16小时之间的一段时间。在一些实施方式中,原代人nk细胞的群体暴露于il-12、il-15和il-18约12、13、14、15、16、17、18、19或20小时之间的一段时间。
[0395]
在一些实施方式中,通过预激活原代人nk细胞的群体获得细胞因子诱导的记忆样nk细胞的群体,其中原代人nk细胞的群体暴露于il-12和il-18约8小时到约24小时之间的一段时间。在一些实施方式中,原代人nk细胞的群体暴露于il-12和il-18中约12小时到约20小时之间的一段时间。在一些实施方式中,原代人nk细胞的群体暴露于il-12和il-18约12到约16小时之间的一段时间。在一些实施方式中,原代人nk细胞的群体暴露于il-12和il-18约16小时到约20小时之间的一段时间。在一些实施方式中,原代人nk细胞的群体暴露于il-12和il-18约14小时到约16小时之间的一段时间。在一些实施方式中,原代人nk细胞的群体暴露于il-12和il-18约12、13、14、15、16、17、18、19或20小时之间的一段时间。
[0396]
在一些实施方式中,通过预激活原代人nk细胞的群体获得细胞因子诱导的记忆样nk细胞的群体,其中原代人nk细胞的群体暴露于约1ng/ml至约20ng/ml浓度范围内的il-12;约1ng/ml至约50ng/ml浓度范围内的il-15;以及约10ng/ml至约100ng/ml浓度范围内的il-18,持续约8小时到约24小时之间;约12小时到16小时之间;约16小时到约20小时之间;约14到16小时之间;或约12、13、14、15、16、17、18、19或20小时。在一些实施方式中,原代人nk细胞的群体暴露于约5ng/ml至约15ng/ml浓度范围内的il-12;约25ng/ml至约75ng/ml浓度范围内的il-15;以及约25ng/ml和约75ng/ml浓度范围内的il-18,持续约8小时到约24小时之间;约12小时到约16小时之间;约16小时到约20小时之间;约14到约16小时之间;或约12、13、14、15、16、17、18、19或20小时。在一些实施方式中,将原代人nk细胞的群体暴露于浓度约5、6、7、8、9、10、11、12、13、14或15ng/ml的il-12;浓度约40、45、50、55或60ng/ml的il-15;以及浓度约40、45、50、55或60ng/ml的il-18,持续约8小时到约24小时之间;约12小时到16小时之间;约16小时到约20小时之间;约14到16小时之间;或约12、13、14、15、16、17、18、19或20小时。
[0397]
在一些实施方式中,通过预激活原代人nk细胞的群体获得细胞因子诱导的记忆样nk细胞的群体,其中原代人nk细胞的群体暴露于约1ng/ml至约20ng/ml浓度范围内的il-12;以及约10ng/ml至约100ng/ml浓度范围内的il-18,持续约8小时到约24小时之间;约12小时到约16小时之间;约16小时到约20小时之间;约14到约16小时之间;或约12、13、14、15、16、17、18、19或20小时。在一些实施方式中,原代人nk细胞的群体暴露于约5ng/ml至约15ng/ml浓度范围内的il-12;以及约25ng/ml至约75ng/ml浓度范围内的il-18,持续约8小时到约24小时之间;约12小时到16小时之间;约16小时到约20小时之间;约14到约16小时之间;或约12、13、14、15、16、17、18、19或20小时。在一些实施方式中,将原代人nk细胞的群体
暴露于浓度约5、6、7、8、9、10、11、12、13、14或15ng/ml的il-12;以及浓度约40、45、50、55或60ng/ml的il-18,持续约8小时到约24小时之间;约12小时到约16小时之间;约16小时到约20小时之间;约14到约16小时之间;或约12、13、14、15、16、17、18、19或20小时。
[0398]
在一些实施方式中,细胞因子诱导的记忆样nk细胞的群体在预激活后转导。在一些实施方式中,根据本文描述的方法,细胞因子诱导的记忆样nk细胞的群体在转导之前静息一段时间。在一些实施方式中,细胞因子诱导的记忆样nk细胞的群体在静息期间暴露于il-15。在一些实施方式中,静息包括暴露于浓度约0.5ng/ml和10ng/ml之间的il-15。在一些实施方式中,静息包括暴露于浓度约0.5ng/ml和5ng/ml之间的il-15。在一些实施方式中,静息包括暴露于浓度约0.5ng/ml和2ng/ml之间的il-15。在一些实施方式中,静息包括暴露于浓度约0.5、0.6、0.7、0,8、0.9、1.0、1.5或2ng/ml的il-15。在一些实施方式中,在转导之前,进行静息的时间约12小时到约96小时之间、约12小时到约72小时之间、约12小时到约48小时之间、约12小时到约24小时之间、约24小时到约72小时之间或约24小时到约48小时之间。
[0399]
在一些实施方式中,通过将原代人nk细胞仅暴露于il-15一段时间来获得对照nk细胞的群体。在一些实施方式中,通过将原代人nk细胞暴露于浓度约40、45、50、55或60ng/ml的il-15,任选地持续时间约8到约24小时之间、约16到约20小时之间、约12到约16小时之间、约14到约16小时之间或约16小时之间,获得对照nk细胞的群体。在一些实施方式中,通过暴露于il-15来维持对照nk细胞的群体。在一些实施方式中,通过暴露于浓度约0.5、0.6、0.7、0,8、0.9、1.0、1.5或2ng/ml的il-15持续时间约12到约96小时之间、约12到约72小时之间、约12小时到约48小时之间、约12小时到约24小时之间、约24小时到约72小时之间、或约24小时到约48小时之间。
[0400]
在一些实施方式中,如本文进一步描述的,细胞因子诱导的记忆样nk细胞的群体相对于对照nk细胞的群体(例如,在单独存在il-15的情况下激活的对照nk细胞的群体)表达一种或多种独特标记物。在一些实施方式中,如本文进一步描述的,细胞因子诱导的记忆样nk细胞的群体相对于对照nk细胞的群体(例如,在单独存在il-15的情况下激活的对照nk细胞的群体)具有一个或多个独特的功能特征。
[0401]
在一些实施方式中,细胞因子诱导的记忆样nk细胞的群体相对于对照nk细胞的群体(例如,在单独存在il-15的情况下激活的对照nk细胞的群体)增加了asct-2表达。在一些实施方式中,细胞因子诱导的记忆样nk细胞的群体相对于对照nk细胞的群体增加了asct-2的表面表达。本领域已知测量表面标记物表达的方法,包括流式细胞术、成像质谱(例如,cytof)、组织学和显微镜。在一些实施方式中,例如,通过流式细胞术测量,细胞因子诱导的记忆样nk细胞的群体相对于对照nk细胞的群体增加了asct-2的表面表达,其中增加为至少1.1倍、约1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、2倍、2.5倍、3倍、3.5倍或4倍。在一些实施方式中,增加约为1.5-3倍。
[0402]
在一些实施方式中,细胞因子诱导的记忆样nk细胞的群体相对于对照nk细胞的群体增加了asct-2rna转录物的表达。定量rna表达的方法在本领域已知,包括定量pcr和rna测序。在一些实施方式中,相对于对照记忆样nk细胞的群体,细胞因子诱导的记忆样nk细胞的群体中asct-2rna转录物的表达增加至少约1.1倍、约1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍或5倍。在一些实施方式中,asct-2rna转录
物的表达增加约2倍至约4倍。
[0403]
在一些实施方式中,通过将表达asct-2的细胞因子诱导的记忆样nk细胞的群体与编码异源多肽的假型慢病毒载体在一定条件下接触以转导细胞因子诱导的ml nk细胞的群体,获得表达异源多肽(例如,本文所述car)的工程化细胞因子诱导的记忆样nk细胞的群体,其中,假型慢病毒载体包含结合asct-2的糖蛋白(例如,baev)。
[0404]
本领域已知获得假型慢病毒载体的方法。在一些实施方式中,假型慢病毒载体是通过(i)将一个或多个慢病毒包装质粒、穿梭质粒和/或包膜质粒转染到靶细胞(例如,a293t细胞)中;(ii)培养靶细胞至接近或完全汇合;(iii)收集细胞培养基;以及(iv)收集假型慢病毒载体。在一些实施方式中,使用本领域所述的方法(例如流式细胞术)来测定假型慢病毒载体的滴度。
[0405]
在一些实施方式中,工程化细胞因子诱导的记忆样nk群体与足以转导该群体的滴度的假型慢病毒载体(例如,baev慢病毒载体)接触。在一些实施方式中,将工程化细胞因子诱导的记忆样nk群体与感染复数(moi)约为5x103、6x103、7x103、8x103、9x103、10x103、11x103、12x103、13x103、14x103或15x103的假型慢病毒载体(例如,baev慢病毒载体)接触。在一些实施方式中,工程化细胞因子诱导的记忆样nk群体与假型慢病毒载体(例如,baev慢病毒载体)接触一段时间,约在1小时到约5小时之间,任选地约1小时到约1.5小时。
[0406]
在一些实施方式中,将细胞因子诱导的记忆样nk群体与编码异源多肽(例如,本文所述的car多肽)的假型慢病毒载体(例如,baev慢病毒载体)接触导致群体的至少约10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%或90%转导。在一些实施方式中,通过使用本领域已知的方法量化编码异源多肽和/或异源多肽的mrna的表达来测量转导。在一些实施方式中,通过利用本领域已知方法(例如,通过流式细胞术或cytof)量化异源多肽的表面表达来测量传导。
[0407]
在一些实施方式中,所述方法还包括分离细胞因子诱导的记忆样nk细胞的群体。在一些实施方式中,所述方法还包括扩大细胞的群体。
[0408]
表达细胞因子的nk细胞
[0409]
在一些实施方式中,对ml nk细胞进行工程化以表达细胞因子。
[0410]
在一些实施方式中,对ml nk细胞进行工程化以表达il-15多肽。在一些实施方式中,对ml nk细胞进行工程化以表达膜结合型il-15多肽。在一些实施方式中,膜结合型il-15多肽包含异源跨膜结构域。在一些实施方式中,对ml nk细胞进行工程化以表达分泌型il-15多肽。
[0411]
在一些实施方式中,对ml nk细胞进行工程化以表达il-15多肽,该多肽包含seq id no:96中所示氨基酸序列。在一些实施方式中,对ml nk细胞进行工程化以表达包含与seq id no:96中所示氨基酸序列具有至少90%、95%、96%、97%、98%或99%同一性的氨基酸序列的il-15多肽。
[0412]
在一些实施方式中,对ml nk细胞进行工程化以表达il-15多肽,该多肽包含seq id no:96中所示氨基酸序列并可操作地与异源跨膜结构域连接。在一些实施方式中,对ml nk细胞进行工程化以表达il-15多肽,该多肽包含与seq id no:96中所示氨基酸序列具有至少90%、95%、96%、97%、98%或99%同一性的氨基酸序列,并且可操作地与异源跨膜结构域连接。
[0413]
在一些实施方式中,对ml nk细胞进行工程化以表达il15ra。在一些实施方式中,对ml nk细胞进行工程化以表达以下中的至少一种:(i)通过使用自裂解肽共同表达il15和il15ra;(ii)il15和il5ra的融合蛋白;(iii)il15/il15ra融合蛋白,其il15ra的细胞内结构域为截短型;(iv)il15与il15ra的膜结合型sushi结构域的融合蛋白;(v)il15和il15r的融合蛋白;(vi)ili5r的同型二聚体;和(v)与跨膜结构域融合的il-15多肽。
[0414]
在一些实施方式中,对ml nk细胞进行工程化以表达以下中的至少一种:(i)通过使用自裂解肽共同表达il15和il15ra;(ii)il15和il5ra的融合蛋白;(iii)il15/il15ra融合蛋白,其il15ra的细胞内结构域为截短型;(iv)il15与il15ra的膜结合型sushi结构域的融合蛋白;(v)il15和il15r的融合蛋白;(vi)ili5r的同型二聚体;(v)与跨膜结构域融合的il-15多肽,其中(i)-(v)中的任何一种都可以在分开的构建体或双顺反子构建体中与car共同表达。在一些实施方式中,细胞表面外源性细胞因子或受体的部分或全部肽在本文提供的细胞中瞬时表达。
[0415]
在一些实施方式中,对ml nk细胞进行工程化以表达il-15、膜结合il-15、分泌型il-15和il-15ra中的任一种或多种。在一些实施方式中,当工程化表达本文所述的任何il-15多肽时,工程化ml nk细胞提高了细胞增殖和存活时间。在一些实施方式中,与不表达il-15多肽的记忆样nk细胞相比,工程化表达il-15多肽的记忆样nk细胞提高了细胞增殖。
[0416]
在一些实施方式中,与对照nk细胞相比,工程化表达il-15多肽的记忆样nk细胞提高了细胞增殖。在一些实施方式中,表达il-15多肽的工程化记忆样nk细胞的增殖速度比不表达il-15多肽的传统nk细胞或ml nk细胞快至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%。在一些实施方式中,当表达本文所述的任何il15多肽时,与传统nk细胞相比,记忆样nk细胞提高了细胞存活时间。在一些实施方式中,工程化ml nk细胞比传统nk细胞存活长至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%。
[0417]
示例性表达抗-npm1c car的细胞因子诱导的记忆样nk细胞在一些实施方式中,本文提供表达本文所述任何嵌合抗原受体(car)多肽的细胞因子诱导的记忆样人nk细胞。在一些实施方式中,用编码本文所述任何嵌合抗原受体(car)多肽的核酸转化细胞因子诱导的记忆样nk细胞或所述细胞的群体。
[0418]
在一些实施方式中,本文提供细胞因子诱导的记忆样人nk细胞,其被工程化以表达(i)包含scfv的car多肽,scfv包含seq id no:24中所示氨基酸序列,以及(ii)包含seq id no:96中所示氨基酸序列的il-15多肽。
[0419]
在一些实施方式中,本文提供细胞因子诱导的记忆样人nk细胞,其被工程化以表达(i)包含scfv的car多肽,该scfv包含seq id no:24中所示氨基酸序列,以及(ii)包含seq id no:96中所示氨基酸序列的膜结合型il-15多肽。
[0420]
在一些实施方式中,本文提供细胞因子诱导的记忆样人nk细胞,其被工程化以表达(i)包含scfv的car多肽,该scfv包含seq id no:24中所示氨基酸序列,以及(ii)包含seq id no:96中所示氨基酸序列并与异源跨膜结构域融合的il-15多肽。
[0421]
在一些实施方式中,抗-npm1c car ml nk细胞或所述细胞的群体表达包含含有seq id no:24中所示氨基酸序列的scfv的car多肽,并且是cd25+nkg2a+nkp30+nkp 44+,并且相对于对照nk细胞,在存在一种或多种细胞因子和/或肿瘤靶标的情况下产生ifnγ。
[0422]
在一些实施方式中,ml nk细胞或所述细胞的群体表达包含含有seq id no:24中所示氨基酸序列的scfv的car多肽,是cd25+nkg2a+nkp30+nkp44+,并且(i)相对于对照nk细胞,在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ,以及(ii)相对于对照nk细胞,具有增强的adcc活性。
[0423]
在一些实施方式中,ml nk细胞或所述细胞的群体表达包含含有seq id no:24中所示氨基酸序列的scfv的car多肽,是cd25+nkg2a+nkp30+nkp44+,并且(i)相对于对照nk细胞,在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ,以及(ii)相对于对照nk细胞,具有增强的抗肿瘤功效。
[0424]
在一些实施方式中,ml nk细胞或所述细胞的群体表达包含含有seq id no:24中所述氨基酸序列的scfv的car多肽,是cd25+nkg2a+nkp30+nkp44+,并且(i)相对于对照nk细胞具有增强的抗肿瘤功效,并且(ii)相对于对照nk细胞具有增强的adcc活性。
[0425]
在一些实施方式中,ml nk细胞或所述细胞的群体表达包含含有seq id no:24中所示氨基酸序列的scfv的car多肽,是cd25+nkg2a+nkp30+nkp44+,并且(i)相对于对照nk细胞,在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ;(ii)相对于对照nk细胞具有增强的adcc活性;和(iii)相对于对照nk细胞具有增强的抗肿瘤功效。
[0426]
在一些实施方式中,ml nk细胞或所述细胞的群体表达包含含有seq id no:24中所示氨基酸序列的scfv的car多肽,具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达,并相对于对照nk细胞,在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ。
[0427]
在一些实施方式中,ml nk细胞或所述细胞的群体表达包含含有seq id no:24中所示氨基酸序列的scfv的car多肽,并且(i)具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ;和(iii)具有增强的adcc活性,其中(i)-(iii)是相对于对照nk细胞。
[0428]
在一些实施方式中,ml nk细胞或所述细胞的群体表达包含含有seq id no:24中所示氨基酸序列的scfv的car多肽,并且(i)具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ;和(iii)具有增强的抗肿瘤功效,其中(i)-(iii)是相对于对照nk细胞。
[0429]
在一些实施方式中,ml nk细胞或所述细胞的群体表达包含含有seq id no:24中所示氨基酸序列的scfv的car多肽,并且(i)具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)具有增强的adcc活性;和(iii)具有增强的抗肿瘤功效,其中(i)-(iii)是相对于对照nk细胞。
[0430]
在一些实施方式中,ml nk细胞或所述细胞的群体表达包含含有seq id no:24中所示氨基酸序列的scfv的car多肽,(i)具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ;(iii)具有增强的adcc活性;和(iv)具有增强的抗肿瘤功效,其中(i)-(iv)是相对于对照nk细胞。
[0431]
在一些实施方式中,ml nk细胞或所述细胞的群体表达包含含有seq id no:24中所示氨基酸序列的scfv的car多肽,并且(i)具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)具有降低的cd16和/或cd11lb的表达;(iii)在一种或多种
细胞因子和/或肿瘤靶标的存在下产生ifnγ,其中(i)-(iii)是相对于对照nk细胞。
[0432]
在一些实施方式中,mlnk细胞或所述细胞的群体表达包含含有seqidno:24中所示氨基酸序列的scfv的car多肽,并且(i)具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)具有降低的cd16和/或cd11lb的表达;(iii)在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ;和(iv)具有增强的adcc活性,其中(i)-(iv)是相对于对照nk细胞。
[0433]
在一些实施方式中,mlnk细胞或所述细胞的群体表达包含含有seqidno:24中所示氨基酸序列的scfv的car多肽,并且(i)具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)具有降低的cd16和/或cd11lb的表达;(iii)在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ;和(iv)具有增强的抗肿瘤功效,其中(i)-(iv)是相对于对照nk细胞。
[0434]
在一些实施方式中,mlnk细胞或所述细胞的群体表达包含含有seqidno:24中所示氨基酸序列的scfv的car多肽,并且(i)具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)具有降低的cd16和/或cd11lb的表达;(iii)具有增强的adcc活性;和(iv)具有增强的抗肿瘤功效,其中(i)-(iv)是相对于对照nk细胞。
[0435]
在一些实施方式中,mlnk细胞或所述细胞的群体表达包含含有seqidno:24中所示氨基酸序列的scfv的car多肽,并且(i)具有增加的cd94/nkg2a、nkp30、nkp44、nkg2d、cd25、或其任何组合的表达;(ii)具有降低的cd16和/或cd11lb的表达;(iii)在一种或多种细胞因子和/或肿瘤靶标的存在下产生ifnγ;(iv)具有增强的adcc活性;和(v)具有增强的抗肿瘤功效,其中(i)-(v)是相对于对照nk细胞。
[0436]
在一些实施方式中,本文提供的mlnk细胞衍生自从外周血、脐血或淋巴中分离或扩增的nk细胞。在一些实施方式中,nk细胞是同种异体的。在一些实施方式中,nk细胞是自体的。
[0437]
在一些实施方式中,本文提供的mlnk细胞对其所要施用(在其修饰以表达本文所述的car后)的受试者是自体的。在一些实施方式中,本文提供的mlnk细胞对其所要施用(在其修饰以表达本文所述的car后)的受试者是同种异体的。如果使用同种异体mlnk细胞制备表达car的免疫效应细胞,则免疫效应细胞可以与一种或多种免疫抑制剂共同施用。
[0438]
在一些实施方式中,mlnk细胞衍生自患有疾病或病况(例如癌症,例如aml)的患者,并在体外进行遗传修饰以表达对本文所述任何抗原(例如新抗原)具有特异性的至少一种car。例如,该抗原可以是由mhci类蛋白呈递的癌症新抗原(例如,包含与mhci类蛋白复合的突变的核磷蛋白新表位的抗原,例如npm1c:hla-a2)。在一些实施方式中,随后施用遗传修饰以表达对由mhci类蛋白所呈递的癌症新抗原(npm1c:hla-a2)具有特异性的car的mlnk细胞以治疗患者的癌症(例如,npm1c-阳性癌症,例如,aml)。在一些实施方式中,mlnk细胞执行至少一种效应功能(例如诱导细胞因子),该效应功能由配体或抗原与car的特异性结合刺激或诱导,并且对于治疗同一患者的疾病或病况有用。
[0439]
刺激包含car的mlnk细胞(例如,通过car的细胞外结构域与癌症新抗原结合)可导致激活car细胞的一种或多种抗癌活性。例如,在一些实施方式中,刺激carmlnk细胞可导致car细胞的细胞溶解活性或辅助活性增加,包括细胞因子的分泌。
[0440]
在一些实施方式中,car效应细胞(例如,car-mlnk细胞)包含结合本文所述任何
抗原(例如,npm1c:hla-a2)的car分子。在一些实施方式中,包含在本文所公开的方法中有用的car分子的ml nk细胞表达car,所述car包含细胞外结构域,所述细胞外结构域结合与mhc i类蛋白(例如,hla-a2)复合(或由其呈递)的npm1c新表位,例如npm1c:hla-a2。在一些实施方式中,包含在本文所公开的方法中有用的car分子(例如,car-ml nk细胞)的免疫效应细胞表达包含npm1c:hla-a2结合结构域的car。
[0441]
在一些实施方式中,car构建体能够在记忆样自然杀伤(ml nk)细胞中表达或发挥作用。
[0442]
在一些实施方式中,与不表达car的nk细胞相比,表达car的ml nk细胞对靶细胞的细胞毒性增加。本领域技术人员已知用于测量细胞毒性的方法,包括但不限于测量目的靶细胞的细胞数、测量细胞死亡/存活标记物和发光度。例如,在一些实施方式中,流式细胞术分析用于量化总细胞数。在一些实施方式中,使用live/dead fixable染色试剂盒对细胞染色,并使用流式细胞术量化。在一些实施方式中,使用表达荧光素酶的靶细胞来测量细胞毒性。当与效应细胞一起培养时,靶细胞裂解物的发光用于计算细胞毒性。
[0443]
在一些实施方式中,表达car的ml nk细胞(例如,包含npm1c:hla-a2结合结构域的car)在与表达由car抗原识别结构域靶向的抗原(例如,npm1c:hla-a2)的靶细胞接触时,具有增加的一种或多种表型和/或功能标记物的表达。在一些实施方式中,具有增加表达的一种或多种表型和/或功能标记物选自:(i)ifnγ;(ii)颗粒酶b;(iii)一种或多种激活标记物,选自:cd25、cd69、icos、cd226、cd107a和cd62l;(iv)一种或多种激活受体,选自:nkp30、nkg2d、nkp44;(vi)一种或多种成熟标记物,选自:cd56和nkg2a;和/或(viii)tigit,其中(i)-(viii)是相对于对照nk细胞(例如,非car表达的ml nk细胞)。在一些实施方式中,相对于对照nk细胞(例如,非car表达的ml nk细胞),表达car的ml nk细胞(例如,包含npm1c:hla-a2结合结构域的car)与表达由car抗原识别结构域靶向的抗原(例如,npm1c:hla-a2)的靶细胞接触时,具有增加的ifnγ的表达。在一些实施方式中,相对于对照nk细胞(非car表达的ml nk细胞),表达car的ml nk细胞(例如,包含npm1c:hla-a2结合结构域的car)与表达由car抗原识别结构域靶向的抗原(例如,npm1c:hla-a2)的靶细胞接触时,具有增加的颗粒酶b的表达。在一些实施方式中,相对于对照nk细胞(例如,非car表达的ml nk细胞),表达car的ml nk细胞(例如,包含npm1c:hla-a2结合结构域的car)与表达由car抗原识别结构域靶向的抗原(例如,npm1c:hla-a2)的靶细胞接触时,具有增加的cd107a的表达。在一些实施方式中,相对于对照nk细胞(例如,非car表达的ml nk细胞),表达car的ml nk细胞(例如,包含npm1c:hla-a2结合结构域的car)与表达由car抗原识别结构域靶向的抗原(例如,npm1c:hla-a2)的靶细胞接触时,具有增加的tigit的表达。在一些实施方式中,相对于对照nk细胞(例如,非car表达的ml nk细胞),表达car的ml nk细胞(例如,包含npm1c:hla-a2结合结构域的car)与表达由car抗原识别结构域靶向的抗原(例如,npm1c:hla-a2)的靶细胞接触时,具有增加的激活标记物的表达。在一些实施方式中,激活标记物是cd62l。在一些实施方式中,激活标记物是cd25。在一些实施方式中,激活标记物是cd69。在一些实施方式中,激活标记物是icos。在一些实施方式中,激活标记物为cd226。在一些实施方式中,表达car的ml nk细胞(例如,包含npm1c:hla-a2结合结构域的car)与表达由car抗原识别结构域靶向的抗原(例如,npm1c:hla-a2)的靶细胞接触时,具有增加的激活受体的表达。在一些实施方式中,激活受体是nkg2d。在一些实施方式中,激活受体是nkp30。在一些实施方式中,激活受体是
nkp44。
[0444]
在一些实施方式中,表达car的ml nk细胞(例如,包含npm1c:hla-a2结合结构域的car)在与表达由car抗原识别结构域靶向的抗原(例如,npm1c:hla-a2)的靶细胞接触时,具有降低的一种或多种表型和/或功能标记物的表达。在一些实施方式中,具有降低表达的一种或多种表型和/或功能标记物选自(i)cd57;和/或(ii)trail,其中(i)-(ii)是相对于对照nk细胞(例如,非car表达的ml nk细胞)。在一些实施方式中,相对于对照nk细胞(例如,非car表达的ml nk细胞),表达car的ml nk细胞(例如,包含npm1c:hla-a2结合结构域的car)与表达由car抗原识别结构域靶向的抗原(例如,npm1c:hla-a2)的靶细胞接触时,具有降低的trail的表达。在一些实施方式中,相对于对照nk细胞(例如,非car表达的ml nk细胞),表达car的ml nk细胞(例如,包含npm1c:hla-a2结合结构域的car)与表达由car抗原识别结构域靶向的抗原(例如,npm1c:hla-a2)的靶细胞接触时,具有降低的cd57的表达。
[0445]
在一些实施方式中,表达car的ml nk细胞(例如,包含npm1c:hla-a2结合结构域的car)与表达由car抗原识别结构域靶向的抗原(例如npm1c:hla-a2)的靶细胞接触时,具有:(i)增加的ifnγ的表达;(ii)增加的颗粒酶b的表达;(iii)增加的选自cd25、cd107a、cd69、icos、cd226和cd62l中的一种或多种激活标记物的表达;(iv)增加的选自nkp30、nkg2d、nkp44中的一种或多种激活受体的表达;(v)增加的一种或多种选自cd56和nkg2a的成熟标记物的表达;(vi)降低的cd57的表达;(vii)增加的tigit的表达;和/或(viii)降低的trail的表达;其中(i)-(vii)是相对于对照nk细胞(例如,非car表达的ml nk细胞)。在一些实施方式中,相对于对照nk细胞(例如,非car表达的ml nk细胞),表达car的ml nk细胞(例如,包含npm1c:hla-a2结合结构域的car)与表达由car抗原识别结构域靶向的抗原(例如,npm1c:hla-a2)的靶细胞接触时,具有增加的ifnγ的表达和增加的cd107a的表达。在一些实施方式中,相对于对照nk细胞(例如,非car表达的ml nk细胞),表达car的ml nk细胞(例如,包含npm1c:hla-a2结合结构域的car)与表达由car抗原识别结构域靶向的抗原(例如,npm1c:hla-a2)的靶细胞接触时,具有增加的ifnγ、cd107a和颗粒酶b的表达。在一些实施方式中,相对于对照nk细胞(例如,非car表达的ml nk细胞),表达car的ml nk细胞(例如,包含npm1c:hla-a2结合结构域的car)与表达由car抗原识别结构域靶向的抗原(例如,npm1c:hla-a2)的靶细胞接触时,具有增加的ifnγ、cd107a、颗粒酶b的表达;和相对于对照nk细胞(例如,非car表达的ml nk细胞)降低的trail的表达。
[0446]
表达car的细胞因子诱导的记忆样nk细胞的制备方法
[0447]
本文提供的方法可用于产生本文所述的任何细胞因子诱导的记忆样nk细胞,其包含本文所述任何car多肽。
[0448]
在一些实施方式中,使用本领域技术人员已知的任何方法将编码car多肽的car多肽或核酸分子引入ml nk细胞或所述细胞的群体。例如,在一些实施方式中,通过电穿孔、转染或转导将编码本文所述car多肽的核酸分子引入细胞。
[0449]
在一些实施方式中,通过转导将编码car多肽的核酸分子引入ml nk细胞。在一些实施方式中,通过转导将包含编码car多肽的核酸分子的慢病毒引入ml nk细胞。
[0450]
本领域已知的各种不同方法可用于将编码本文所述car多肽的核酸中的任何一种或包含编码本文所述car多肽的核酸的表达载体引入ml nk细胞。
[0451]
在一些实施方式中,本文所述的用于产生表达car的ml nk细胞的方法包括:(i)从
外周血、脐血或淋巴(例如,从外周血液单核细胞(pmbc))获得细胞,(ii)任选地纯化所获得的细胞,(iii)任选地扩增细胞,(iv)激活细胞(例如,使用诸如但不限于il-15、il-12和il-18的细胞因子)以形成细胞因子诱导的记忆样nk细胞,(v)任选地扩增被激活的细胞,(vi)用包含本文所述car多肽的表达载体转导细胞,(vii)分离表达car的细胞,以及(viii)任选的扩增所分离的细胞。
[0452]
在一些实施方式中,本文描述的用于生产表达car的ml nk细胞的方法包括:(i)获得多能干细胞(ipsc)(ii)诱导ipsc分化为nk细胞,(ii)将nk细胞预激活为细胞因子诱导的记忆样nk细胞;(iii)任选地扩增被激活的细胞,(iv)用包含本文所述car多肽的表达载体转导被激活的细胞,(v)分离表达car的ml nk细胞,以及(vi)任选地扩增所分离的细胞。
[0453]
在一些实施方式中,本文所述的任何遗传修饰均使用慢病毒转导到细胞中。在一些实施方式中,本文所述的任何car多肽使用狒狒逆转录病毒包膜糖蛋白变体(baev-lv)转导到ml nk细胞。nk细胞表达baev受体、丙氨酸、丝氨酸、半胱氨酸转运体2(asct2)。在一些实施方式中,baev-lv转导如bari,r.等2019frontiers in immuno.vol.10,2001中所述执行,本文通过引用并入。在一些实施方式中,本文所述的任何car多肽使用水泡性口炎病毒gp(vsv-g)-lv转导到ml nk细胞中。nk细胞表达vsv-g受体低密度脂蛋白(ldl-r)。在一些实施方式中,vsv-g-lv转导如tom
á
s,h.等人2019mol ther methods clin dev.15:1-8所述执行,本文通过引用并入。在一些实施方式中,baev的糖蛋白取代vsv糖蛋白。在一些实施方式中,vsv基因组表达baev糖蛋白。
[0454]
在一些实施方式中,在存在il-15的情况下,通过病毒载体(例如慢病毒)将car多肽转导到细胞因子诱导的ml nk细胞中,转导时间足以将car通过病毒转导到该细胞中,从而产生表达car的ml n k细胞。在一些实施方式中,足以形成表达car的ml nk细胞的时间量在约12小时和约24小时之间。在一些实施方式中,足以将car通过病毒转导到ml nk细胞中(形成表达car的ml nk细胞)的时间可以为至少约1小时;约2小时;约3小时;约4小时;约5小时;约6小时;约7小时;约8小时;约9小时;约10小时;约11小时;约12小时;约13小时;约14小时;约15小时;约16小时;约17小时;约18小时;约19小时;约20小时;约21小时;约22小时;约23小时;约24小时;约25小时;约26小时;约27小时;约28小时;约29小时;约30小时;约31小时;约32小时;约33小时;约34小时;约35小时;约36小时;约37小时;约38小时;约39小时;约40小时;约41小时;约42小时;约43小时;约44小时;约45小时;约46小时;约47小时;或约48小时。
[0455]
在一些实施方式中,使用包含编码car多肽的核酸的载体转导的ml nk细胞在存在il-15的情况下孵育足够的时间以表达载体并形成表达car的ml nk细胞。在一些实施方式中,足以形成表达car的ml nk细胞的时间在约3天到约8天之间。在一些实施方式中,足以形成ml nk细胞的时间可以为至少约1天;约2天;约3天;约4天;约5天;约6天;约7天;约8天;约9天;约10天;约11天;约12天;约13天;或约14天。
[0456]
组合物
[0457]
在一些方面,本文提供包含本文公开的任何表达抗-npm1c car的细胞因子诱导的记忆样nk细胞或所述细胞的群体的组合物(例如,药物组合物)。
[0458]
药物组合物可包含药学上可接受的载体。本领域已知适当的药学上可接受的载体,包括但不限于赋形剂和稳定剂(参见,例如,remington’s pharmaceutical sciences
(1990)mack publishing co.,easton,pa)。
[0459]
药物组合物可以是无菌组合物,其包含细胞、栓系装置(例如,脂质纳米粒子)和/或蛋白质或肽,优选在药学上可接受的载体中(例如,一种或多种相容的固体或液体填料、稀释剂或包封物质,其适于施用于人体或本文所设想的其他受试者)。载体可以是天然或合成的有机或无机成分,细胞、栓系装置(例如脂质纳米粒子)和/或蛋白质或肽与之结合以便于施用。药物组合物的组分以排除可能实质上损害其所需的药物效率的相互作用的方式混合。
[0460]
药学上可接受的载体可包括但不限于缓冲剂、乳化剂、悬浮剂、分散剂、等渗剂、润湿剂、螯合剂、隔离剂、ph缓冲剂、溶解度增强剂、抗菌剂、麻醉剂和/或抗氧化剂。
[0461]
用于配制药物组合物的各种赋形剂和用于制备该组合物的技术为本领域所知(参见remington:the science and practice of pharmacy,第21版,a.r.gennaro,lippincott,williams&wilkins,baltimore,md,2006;通过引用全部并入本文)。常规赋形剂介质的使用可在本公开范围内考虑,除非任何常规赋形物介质可能与物质或其衍生物不兼容,例如通过产生任何不良生物效应或与药物组合物的任何其他成分以有害方式相互作用。赋形剂可能包括,例如:抗粘着剂、抗氧化剂、粘合剂、涂料、压缩助剂、崩解剂、染料(颜色)、软化剂、乳化剂、填料(稀释剂)、成膜剂或涂料、助流剂(流动增强剂)、润滑剂、防腐剂、印刷油墨、吸附剂、悬浮剂或分散剂、甜味剂和水合水。示例赋形剂包括但不限于:生理盐水、丁基羟基甲苯(bht)、碳酸钙、磷酸钙(二元)、硬脂酸钙、交联羧甲基纤维素、交联聚乙烯吡咯烷酮、柠檬酸、交联聚维酮、半胱氨酸、乙基纤维素、明胶、羟丙基纤维素、羟丙甲基纤维素、乳糖、蔗糖、葡萄糖、硬脂酸镁、麦芽糖、麦芽醇、甘露醇、蛋氨酸、甲基纤维素、尼泊金甲酯、微晶纤维素、聚乙二醇、甘油、乙醇、聚乙烯吡咯烷酮、聚维酮、淀粉(例如预糊化淀粉)、丙烯、对羟基苯丙酯、棕榈酸视黄酯、虫胶、硅胶、二氧化硅、羧甲基纤维素钠、柠檬酸钠、硬脂酸钠、淀粉乙醇酸钠、山梨醇、淀粉(玉米)、硬脂酸、滑石、基质膏、二氧化钛、维生素a、维生素e、维生素c和木糖醇。
[0462]
在一些实施方式中,本文所公开的药物组合物可包括至少一种药学上可接受的盐。可包括在本公开组合物中的药学上可接受的盐的示例包括但不限于酸式盐、碱或碱土金属盐、碱性残留物的矿物或有机酸盐,例如胺;酸性残留物的碱或有机盐,如羧酸;等。代表性酸式盐包括乙酸盐、乙酸、己二酸盐、海藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯磺酸、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡酸盐、十二烷基硫酸盐、乙磺酸盐、富马酸盐、葡庚糖酸盐、甘油磷酸盐、半硫酸盐、庚酸盐、己酸盐、氢溴酸盐、盐酸盐、氢碘化物、2-羟基乙磺酸盐、乳糖醛酸盐、乳酸盐、月桂酸盐、月桂硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、三甲基乙酸盐、丙酸酯、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、甲苯磺酸酯、十一酸盐、戊酸盐等。代表性碱或碱土金属盐包括钠、锂、钾、钙、镁等,以及无毒铵、季铵和胺阳离子,包括但不限于铵、四甲基铵、四乙基铵、甲胺、二甲胺、三甲胺、三乙胺、乙胺等。
[0463]
所述药物组合物可以被调配成适合施用于受试者(例如,人)。药物组合物可配制用于任何给药途径。
[0464]
当需要全身递送药物组合物时,可以配制药物组合物以通过注射(例如,通过团注
或连续输注)进行肠外给药。这些制剂可以配制为液体溶液、悬浮液、乳剂或固体形式,适合在注射前制成溶液或悬浮液。注射用制剂可以单位剂型呈现,例如安瓿或多剂量容器。非肠道药物制剂包括成分的水溶液。水性注射悬浮液可能含有增加悬浮液粘度的物质,例如羧甲基纤维素钠、山梨醇或右旋糖酐。或者,成分悬浮液可以制备为油基悬浮液。合适的亲脂溶剂或载体包括脂肪油,如芝麻油,或合成脂肪酸酯,如油酸乙酯或甘油三酯,或脂质体。如果经肠给药,合适的药学上可接受的载体可包括但不限于生理盐水或磷酸盐缓冲盐水(pbs),或含有例如聚乙二醇、聚丙烯二醇或葡萄糖的溶液。
[0465]
本文所述car表达细胞或所述细胞的群体可在本文所公开的药物组合物中以治疗有效量使用或存在。治疗有效量可通过标准临床技术确定。
[0466]
除本文所述car表达细胞或所述细胞的群体外,本文所述的药学上可接受的组合物可包括额外的抗癌剂(例如,本文所描述的任何一种、两种、三种或多种抗癌剂)。
[0467]
治疗方法和用途
[0468]
仅在美国,2015年就诊断出约20830例新的aml病例,10460例因此病而死亡。由于年龄较大是aml的一个危险因素,随着人口老龄化,疾病发病率可能会增加。能够耐受常规化疗和同种异体干细胞移植的患者可以获得完全缓解,然而,大多数患者会复发并死于该疾病。因此,有必要利用我们对癌症免疫疗法不断发展的理解开发毒性更小、更有效的靶向疗法。
[0469]
在一些实施方式中,本公开提供了用于治疗有需要的受试者癌症(例如,抑制癌症增殖、抑制癌症进展)的方法,包括向受试者施用表达本文所述car多肽的任何免疫效应细胞(例如,ml nk细胞)或本文所述的任何药物组合物。在某些实施方式中,本公开提供治疗npm1c阳性癌症的方法。如本文所用,“npm1c阳性癌症”是指包含npm1基因突变(例如,npm1中的4nt重复突变)的肿瘤细胞的癌症,其中与表达野生型npm1细胞相比,npm1的突变导致npm1蛋白的细胞质定位增加。本领域已知测量癌症中基因表达以确定存在特定基因突变(例如,npm1中的4nt重复突变)的方法,并且包括对从受试者收集的恶性肿瘤样本(例如,血液、骨髓、肿瘤和/或组织样本)的分析。在一些实施方式中,使用实时定量聚合酶链反应(rt-pcr)、微滴式数字pcr、sanger测序和第二代测序(例如,全基因组测序,例如,全外显子测序)来执行检测基因中的小重复、插入或缺失的方法。在一些方面,检测到npm1c阳性癌症的npm1基因发生突变(例如,该基因第12外显子中的4碱基对移码插入、在替代阅读框中编码c端11个氨基酸的突变、或导致包含以下c端氨基酸序列的蛋白质表达的npm1突变:mtdqeaiqdlclaveevslrk(seq id no:57))。在一些实施方式中,npm1c阳性癌症包含npm1蛋白细胞质定位增加的肿瘤细胞。本领域已知评估npm1细胞定位的方法,例如,使用标记的抗npm1抗体并通过显微镜或流式细胞术评估定位。在一些实施方式中,与从健康非癌组织样本分离的细胞相比,从npm1c阳性癌症分离的肿瘤细胞具有增加的npm1蛋白的细胞质定位。
[0470]
在一些实施方式中,本公开提供治疗有需要的受试者npm1c阳性癌症的方法(例如,抑制癌症的增殖或进展),包括向受试者施用表达本文所描述的car多肽的ml nk细胞、所述细胞的群体或本文所述药物组合物。
[0471]
在一些实施方式中,本公开提供治疗有需要受试者的aml(例如,抑制aml的增殖或进展),包括向受试者施用表达本文所述car多肽的任何ml nk细胞、所述细胞的群体或本文所述的任何药物组合物。在某些实施方式中,本公开提供治疗npm1c阳性aml。
[0472]
在一些实施方式中,表达car多肽的ml nk细胞、所述细胞的群体或本公开的药物组合物可用于开发治疗癌症的靶向免疫疗法。
[0473]
在一些实施方式中,表达car多肽的ml nk细胞、所述细胞的群体或本公开的药物组合物可用于治疗aml。
[0474]
在一些实施方式中,表达car多肽的ml nk细胞、所述细胞的群体或本公开的药物组合物可以用作细胞毒性剂来杀死aml细胞。
[0475]
在一些实施方式中,本公开提供在携带编码hla-a2的等位基因(即hla-a*02:01等位基因)的受试者中治疗npm1c阳性癌症(例如aml)的方法。在一些实施方式中,npm1c阳性癌症(例如,aml)包括表达hla-a2的肿瘤细胞。确定hla表达的方法在本领域已知,并且包括流式细胞术、免疫组织化学和使用识别hla-a2标记抗体的western blot。hla表达也可以通过rt-pcr和rna测序确定。
[0476]
在一些实施方式中,本公开提供用于治疗有需要的受试者的癌症(例如npm1c阳性癌症,例如aml)的方法,其中包含癌症的细胞的细胞表面显示与mhc i类蛋白(例如hla-a2)复合的npm1c新表位,所述治疗包括向受试者施用表达本文所述car多肽的ml nk细胞、所述细胞的群体或本文所述的任何药物组合物。
[0477]
在一些实施方式中,本公开提供用于治疗有需要的受试者的癌症(例如npm1c阳性癌症,例如aml)的方法,其中包含癌症的细胞的细胞表面显示与mhc i类蛋白(例如hla-a2或由hla-a*02等位基因组编码的蛋白,如由hla-a*02:01等位基因编码的蛋白)复合的aiqdlclav(seq id no:1)新表位,治疗包括向受试者施用表达本文所述car多肽的任何.ml nk细胞或本文所述的任何药物组合物。
[0478]
在一些实施方式中,本公开提供减少患有癌症(例如,其中癌症为npm1c阳性,例如,其中癌症为aml)的受试者中癌症负荷或增加患有癌症的受试者的存活期的方法,包括向受试者施用表达本文所述car多肽的任何ml nk细胞或本文所述的任何药物组合物。在某些实施方式中,包含癌症的细胞的细胞表面显示与mhc i类蛋白(例如hla-a2)复合的npm1c新表位(例如,seq id no:1)。
[0479]
在一些实施方式中,本公开提供用于预防癌症缓解的受试者的癌症的方法,包括向受试者施用表达本文所述car多肽的任何ml nk细胞或本文所述的任何药物组合物。
[0480]
在一些实施方式中,癌症是复发癌症。在一些实施方式中,癌症是难治性癌症。在一个实施方式中,癌症是晚期癌症。在一些实施方式中,癌症对一种或多种其他疗法(例如,化疗、放疗、干细胞移植或另一免疫疗法)具有抗性。
[0481]
在一些实施方式中,本公开提供用于预防有需要的受试者的aml的方法,包括向受试者施用表达本文所述car多肽的任何ml nk细胞或本文所述的任何药物组合物。在一个实施方式中,本公开提供用于预防aml缓解受试者的aml的方法。
[0482]
在一些实施方式中,待治疗的癌症是aml。在一些实施方式中,癌症是复发性aml。在一些实施方式中,癌症是难治性aml。在一些实施方式中,癌症是晚期aml。在一些实施方式中,癌症是对一种或多种其他疗法(例如,化疗、放疗、干细胞移植或另一免疫疗法)具有抗性的aml。
[0483]
本文所述的任何治疗的有效性可以通过在(例如,向接受治疗的受试者或接受治疗的癌症的动物模型)施用疗法前后评估参数(例如,肿瘤负荷)来评估。本领域已知的任何
分析都可用于评估本文所述疗法的治疗效果。
[0484]
给药方法
[0485]
本文所述的疗法可通过包括但不限于肠外给药途径的任何合适方法给药于受试者。在一些实施方式中,该组合物经肠外给药于患者。合适的肠外给药途径的非限制性示例包括静脉给药、肌肉给药、动脉给药、皮下给药、瘤内给药、鞘内给药和腹腔给药。在一些实施方式中,本文所述的疗法是静脉给药。在一些实施方式中,本文所述的疗法是腹腔给药。在一些实施方式中,本文所述的疗法是肌肉给药。在一些实施方式中,本文所述的疗法是皮下给药。在某些实施方式中,给药是静脉内、鞘内、骨内或进入脊髓。在一个实施方式中,本文所述的疗法是给药到脊髓或椎管内。在一个实施方式中,本文所述的疗法是鞘内给药。在一个实施方式中,本文所述的疗法是骨内给药。在一个实施方式中,本文所述的疗法被给药到骨髓内。
[0486]
适当剂量将随治疗的特定癌症、接受治疗的受试者年龄、体重和身体状况、癌症严重程度、给药途径、治疗持续时间、接受治疗的受试者反应性、同时或联合治疗(如有)的性质、具体用药途径以及健康从业者知识和专业知识范围内的类似因素而变化。在某些实施方式中,将使用最大容许剂量,即根据可靠的医学判断的最高安全剂量。在优选实施方式中,应以有效量施用治疗。有效量是足以提供医学上所需结果的组合物的剂量。
[0487]
例如,如果受试者患有肿瘤,有效量可能是减少肿瘤体积或负荷的量(例如,通过肿瘤成像确定)。有效量也可以通过血液或其他体液或组织(例如活检)中癌细胞的存在和/或频率来评估。如果肿瘤正在影响组织或器官的正常功能,则可以通过测量组织或器官正常功能来评估有效量。
[0488]
在某些实施方式中,以约或至少1x104、5x104、1x105、5x105、1x106、5x106、1x107、5x107、1x108、5x108、1x109、5x109、1x100
10
、5x100
10
、1x10
11
或5x10
11
、1x10
112
或5x10
12
个细胞(或两者之间的任何值或范围)的量施用工程化的ml nk免疫效应细胞。
[0489]
在一些实施方式中,使用本文描述的任何car ml nk细胞治疗的患者经历完全缓解。在一些实施方式中,患者以0.5x106个细胞/kg的剂量服用任何工程化的ml nk细胞。在一些实施方式中,患者以1.0x106个细胞/kg的剂量服用car-ciml nk细胞。在一些实施方式中,患者以1.0x106个细胞/kg的剂量服用car-ciml nk细胞。
[0490]
本文所述治疗的各种给药方案包括一段时间内的单次给药或多次给药。给药方法包括但不限于丸剂给药和输注(例如,持续或脉冲输注)。
[0491]
本文所述方法中使用的治疗方案可包括每周两次、每周一次、每两周一次、每三周一次、每月一次或四周一次、每六周一次、每两个月或八周一次或每三个月或十二周一次进行治疗。在某些实施方式中,受试者接受单剂量本文所述的任何治疗。在某些实施方式中,受试者从至少两个、至少三个、至少四个、至少五个、至少六个、至少八个或至少十个剂量接受本文所述的任何治疗。在某些实施方式中,本文所述的治疗每天、每隔一天或每周两次进行。在某些实施方式中,本文所述的治疗进行一段时间,例如一周、两周、三周、四周、六周、两个月、三个月、四个月、五个月、六个月或一年。
[0492]
在一些实施方式中,初始治疗期(其中治疗是单次、每周两次、每周一次、两周两次或每月一次)之后是不给药抗体的停药期(例如,一周、两周、三周、一个月或四周、六周、两个月或八周、三个月、四个月、五个月、六个月或一年),紧接着是第二个治疗期(即进行治
疗,例如单次、每周两次、每周一次、两周两次或每月一次)。这样的初始治疗和这样的第二治疗周期可以持续,例如,两周、三周、四周、六周、两个月或三个月(其中初始治疗周期可以与第二治疗期相同或不同)。
[0493]
患者群体
[0494]
根据本文所述方法接受治疗的受试者包括但不限于人类和非人类脊椎动物。在某些实施方式中,根据本文描述的方法接受治疗的受试者是哺乳动物,例如家庭宠物(例如,狗、猫、兔子、雪貂等)、牲畜或农场动物(例如,奶牛、猪、绵羊、山羊、猪、鸡或其他家禽)、马(例如,纯种马)、猴、实验动物(例如小鼠、老鼠、兔子等),诸如此类。受试者还包括鱼类和其他水生物种。在优选实施方式中,根据本文所述方法治疗的受试者是人。在一个实施方式中,本公开可在可能受益于治疗急性髓细胞白血病(aml)的靶向免疫疗法的任何受试者中实施。在一些实施方式中,本公开用于具有npm1c阳性癌症(例如,aml)的受试者。
[0495]
在一些方面,本公开的治疗方法和用途可在患有(例如,已被诊断患有)可能(或可能)受益于本文所述任何免疫疗法的癌症的任何受试者中实施。患有癌症的受试者(例如npm1c阳性癌症,例如aml)是具有可检测癌细胞的受试者。本公开设想将表达本文所述car多肽的ml nk细胞给药于患有癌症(例如,npm1c阳性癌症,例如aml)的受试者。
[0496]
在一些方面,本公开的治疗方法和用途可用在患有以(例如已知具有、预期具有或检测到具有)npm1基因突变(例如,该基因第12外显子中的4碱基对移码插入、在替代阅读框中编码c端11个氨基酸的突变、或导致表达包含以下c端氨基酸序列的蛋白质表达的npm1突变:mtdqeaiqdlclaveevslrk(seq id no:57))为特征的癌症的任何受试者中实施。在某些实施方式中,本公开的治疗方法和用途可在患有以突变npm1蛋白(例如,具有细胞质定位的npm1c突变蛋白、具有c端结构域突变的蛋白质、缺乏折叠c端结构域的突变蛋白质、包含以下c端氨基酸序列的蛋白质:mtdqeaiqdlclaveevslrk(seq id no:57)、由seq id no:56所示的蛋白质或npm1c)的表达(例如,已知表达、预期表达或检测到表达)为特征的癌症的任何受试者中实施。本领域已知npm1c的突变的c端序列(参见例如van der lee等人,2019,j.clin.invest.129(2):774-785,其通过引用全部并入本文,参见例如,图1)。在一些方面,本公开的治疗方法和用途可在任何患有癌症的受试者中实施,其中,包含所述癌症的细胞的细胞表面显示(例如,已知显示、预期显示或检测到显示)与i类主要组织相容性复合体(mhc i类)蛋白质(例如hla-a2)复合的突变核磷蛋白新表位(例如npm1c新表位,例如aiqdlclav(seq id no:1))。在一些方面,本公开的治疗方法和用途在患有癌症的任何受试者中实施,其中i类主要组织相容性复合体(mhc i类)蛋白(例如hla-a2)在包含癌症的细胞的细胞表面上显示或呈递npm1c新表位(例如aiqdlclav(seq id no:1))。
[0497]
可选地,对将要根据本文所述方法治疗的潜在患者的癌细胞测试npm1基因或npm1蛋白的突变,或测试以确定包含癌症的细胞的细胞表面是否显示包含与i类主要组织相容性复合体(mhc i类)蛋白(例如hla-a2)复合的npm1c新表位(例如aiqdlclav(seq id no:1))的抗原。在一些方面,
[0498]
如果此类测试对npm1基因突变或npm1蛋白突变呈阳性,或被确定在癌细胞的细胞表面上显示包含与i类主要组织相容性复合体(mhc i类)蛋白(例如hla-a2)复合的npm1c新表位(例如aiqdlclav(seq id no:1))的抗原,则根据本文所述的方法对患者进行治疗。
[0499]
在一些方面,本公开的治疗方法和用途可在患有急性髓细胞白血病(aml)的受试
者中实施。在具体实施方式中,本公开的治疗方法和用途在被诊断患有aml的受试者中实施。
[0500]
本领域已知用于诊断拟通过本文所述方法治疗的癌症的测试,并且普通医生将熟悉这些测试。这些实验室测试包括但不限于显微镜分析、培养依赖性测试(如培养物)和核酸检测测试。这些包括湿涂片、染色增强显微镜、免疫显微镜(如fish)、杂交显微镜、颗粒凝集、酶联免疫吸附试验、尿液筛查试验、dna探针杂交、血清学试验等。除进行上面所列的实验室测试外,医生通常需要完整的病史并进行完整的体检。
[0501]
aml的检测方法包括但不限于白血病细胞pbmc流式细胞术,然后是pcr和npm1c突变测序。aml诊断的临床方法是众所周知的。aml发展的风险因素包括吸烟、化疗、放疗、某些血液疾病和年龄。
[0502]
在一个实施方式中,接受治疗的受试者被诊断患有早期癌症(例如aml)。在一个实施方式中,接受治疗的受试者被诊断患有晚期癌症(例如aml)。
[0503]
在某些实施方式中,接受治疗的受试者具有任何阶段的aml进展。
[0504]
在一些方面,接受治疗的受试者以前曾接受过一种或多种其他癌症治疗(例如化疗、放疗或干细胞移植)。在某些实施方式中,接受治疗的受试者先前接受过一种或多种其他癌症治疗(例如,化疗、放疗或干细胞移植),并且受试者的癌症已经复发。在某些实施方式中,接受治疗的受试者先前接受过一种或多种其他癌症治疗(例如,化疗、放疗或干细胞移植),并且受试者对一种或几种其他癌症治疗产生了耐药性。在某些实施方式中,接受治疗的受试者处于缓解状态(例如,癌症的部分缓解或完全缓解)。在某些实施方式中,接受治疗的受试者对一种或多种其他癌症治疗(例如,化疗、放疗或干细胞移植)是难治性的。
[0505]
在其他实施方式中,本文所考虑的是根据本公开的治疗方法和用途,治疗可能(或可能)受益于本文所述任何免疫疗法的有患癌症风险的受试者。有患癌症风险(如aml)的受试者患癌症的概率高于正常人。例如,这些受试者包括(已被证明与罹患癌症的可能性较高相关的)基因异常的受试者、有癌症家族倾向的受试者、暴露于致癌剂(即致癌物)(如烟草、石棉或其他化学毒素)的受试者、以及之前接受过癌症治疗且病情明显缓解的受试者。本公开考虑向有患癌症(例如,aml)风险的受试者给药表达本文所述car多肽的ml nk细胞。
[0506]
在一些实施方式中,接受治疗的受试者是成年人。在一个实施方式中,受试者是18岁以上的人类受试者。在一个实施方式中,受试者是21岁以上的人类受试者。在一个实施方式中,受试者是45岁以上的人类受试者。在一个实施方式中,受试者是65岁以上的人类受试者。在一个实施方式中,受试者是18岁以下的人类受试者。在一个实施方式中,受试者是45岁以下(或18至45岁,或21至45岁)的人类受试者。在一个实施方式中,受试者是65岁以下(或18至65岁、21至65岁或45至65岁)的人类受试者。
[0507]
联合疗法
[0508]
在一些方面,本文所述的治疗方法和用途还包括用增强治疗反应(例如增强受试者的抗肿瘤反应和/或对肿瘤具有细胞毒性)的额外药剂(例如化疗药剂)治疗受试者。
[0509]
在一些方面,本文所述的疗法与一种或多种抗癌疗法(例如,化疗、放疗、干细胞移植、具有抗癌活性的小分子、另一种抗癌免疫疗法(例如,另一种抗肿瘤抗体或其片段,或另一种t细胞疗法)、或本领域已知的任何其他抗癌疗法)联合施用于受试者。
[0510]
在一些方面,本文所述表达car的ml nk细胞与一种或多种抗癌疗法(例如化疗、放
疗、干细胞移植、具有抗癌活性的小分子、另一种抗癌免疫疗法(例如,另一种抗肿瘤抗体或其片段、或另一种t细胞疗法),或本领域已知的任何其他抗癌疗法)联合施用于受试者。
[0511]
在一些方面,本文所述的一种或多种表达car的ml nk细胞或包含同样细胞的组合物与干细胞移植或另一种抗癌免疫疗法(例如,另一种抗肿瘤抗体或其片段,或另一t细胞疗法)联合施用于受试者。对于包含car的ml nk细胞的给药,本文考虑任何不会对这些细胞的活性产生负面影响的联合疗法。
[0512]
用于联合疗法的合适治疗剂包括小分子化疗剂,包括蛋白酪氨酸激酶抑制剂,以及生物抗癌剂,例如抗癌抗体,包括但不限于下文进一步讨论的那些。
[0513]
在一些方面,联合疗法包括向受试者施用免疫检查点抑制剂以增强抗肿瘤免疫,例如pd-1抑制剂、pd-l1抑制剂、pd-l2抑制剂或ctla-4抑制剂。免疫检查点的其他调节剂可能针对tim-3、ox-40、ox-40l或icos。在一个实施方式中,调节免疫检查点的药剂是抗体(例如,pd-1、pd-l1、pd-l2、ctla-4、tim-3或ox-40的拮抗抗体)。在另一实施方式中,调节免疫检查点的药剂是蛋白质或小分子调节剂。在另一实施方式中,药剂(例如mrna)编码免疫检查点的抗体调节剂。在一个实施方式中,本文所述的任何疗法均与tim-3抑制剂联合施用。在一个实施方式中,本文所述的任何疗法均与pd-1抑制剂联合施用。在一个实施方式中,本文所述的任何疗法均与pd-l1抑制剂联合施用。在一个实施方式中,本文所述的任何疗法均与ctla-4抑制剂联合施用。可用于联合疗法的免疫检查点抑制剂的非限制性示例包括派姆单抗(pembrolizumab)、阿仑单抗(alemtuzumab)、纳武利尤单抗(nivolumab)、匹地利珠单抗(pidilizumab)、奥法木单抗(ofatumumab)、利妥昔单抗(rituximab)、medi0680、pdr001、amp-224、pf-06801591、bgb-a317、regn2810、shr-1210、tsr-042、affimer、阿维单抗(avelumab)(msb0010718c)、阿特珠单抗(atezolizumab)(mpdl3280a)、德瓦鲁单抗(durvalumab)(medi4736)、bms936559、伊匹单抗(ipilimumab)、曲美木单抗(tremelimumab)、age1884、medi6469和moxr0916。
[0514]
在具体实施方式中,本文所述的疗法与化疗联合施用于受试者。可用于本文所述联合疗法的化学治疗剂类型的实例包括但不限于烷基化剂、亚硝基脲剂、抗代谢物、铂络合物衍生物、拓扑异构酶抑制剂、芳香化酶抑制剂、衍生自植物的生物碱、激素拮抗剂、抗肿瘤抗生素和p-糖蛋白抑制剂。可用于本文所述的联合疗法的化疗药物的具体实例包括但不限于紫杉醇(taxol)、紫杉醇(paclitaxel),白蛋白结合型紫杉醇、5-氟尿嘧啶(5-fu)、吉西他滨、阿霉素、柔红霉素、秋水仙素、米托蒽醌、三苯氧胺、环磷酰胺、甲氯雷他明、马法兰、苯丁酸氮芥、尿嘧啶氮芥、氮芥、异环磷酰胺、苯达莫司汀、卡莫司汀、洛莫司汀、塞莫司汀、福莫司汀、链脲佐菌素、噻替帕、丝裂霉素、亚丝醌、四嗪、六甲蜜胺、达卡巴嗪、米托唑胺、替莫唑胺、甲基苄肼、六甲基三聚氰胺、六甲蜜胺、克瘤灵(hexalen)、曲磷胺、雌莫司汀、曲奥舒凡、甘露舒凡、三亚胺醌、卡波醌、尼莫司汀、雷莫司汀、硫唑嘌呤、磺胺、氟嘧啶、硫嘌呤、硫鸟嘌呤、巯嘌呤、克拉屈滨、卡培他滨、培美曲塞、氟达拉滨、甲氨蝶呤、羟基脲、奈拉滨或氯法拉滨、阿糖胞苷、地西他滨、普拉曲沙、氟尿苷、硫鸟嘌呤、阿扎胞苷、克拉屈宾、喷司他丁、巯基嘌呤、伊马替尼、达克霉素、柔红霉素、博来霉素、放线菌素、藤黄霉素、表柔比星、伊达比星、普卡霉素、长春新碱、长春花碱、长春瑞滨、长春地辛、长春氟宁、紫杉醇、多西他赛、依托泊苷、替尼泊苷、小长春花、长春花、紫杉烷、伊立替康、拓扑替康、喜树碱、替尼泊苷、吡柔比星、新生霉素、美巴龙(merbarone)、阿克拉霉素、安吖啶、抗雄激素、抗雌激素、比卡鲁胺、甲
氧孕酮、氟西米斯特龙、己烯雌酚、雌二醇、奥曲肽、甲地孕酮、雷洛昔芬、托瑞米芬、氟维司群、强的松、氟他胺、亮丙瑞林、戈舍瑞林、氨基谷氨酰亚胺、睾酮、阿那曲唑、来曲唑、依西美坦、伏氯唑、福美坦、法曲唑、雄烯酮、白藜芦醇、麦斯明、儿茶酸、芹菜素-依利双醇异甘草素、倒捻子素、胺碘酮、阿奇霉素、卡托普利、克拉霉素、环孢霉素、胡椒碱、槲皮素、奎尼丁、奎宁、利血平、利托那韦、tariquidar、维拉帕米、顺铂、卡铂、奥沙利铂、反铂、奈达铂、赛特铂、三联铂和卡铂。
[0515]
在具体实施方式中,本文所述的疗法与一种或多种化学疗法联合施用于受试者以治疗aml。在一些实施方式中,一种或多种化学疗法选自:阿糖胞苷、柔红霉素、依达比星、克拉屈滨、氟达拉滨、米托蒽醌、依托泊甙、6-硫代鸟嘌呤、羟基脲、强的松、地塞米松、甲氨蝶呤、6-巯基嘌呤、氮杂胞苷和地西他滨。
[0516]
在具体实施方式中,本文所述的疗法联合放疗施用于受试者。
[0517]
在具体实施方式中,本文所述的任何疗法联合干细胞移植施用于受试者。
[0518]
在某些实施方式中,可以在一种或多种额外抗癌疗法之前、期间(即,同时)或之后施用本文所述的任何疗法。在一个实施方式中,根据本文所述方法治疗的受试者之前未接受过抗癌疗法。在一个实施方式中,根据本文所述方法治疗的受试者以前接受过抗癌疗法(例如,化疗、放疗或干细胞移植)。
[0519]
试剂盒
[0520]
本发明的方面涉及试剂盒。
[0521]
术语“试剂盒”可以指一套促进样品处理、方法、化验、分析或操作的物品。该试剂盒可以包括使用该试剂盒的说明(例如,本发明方法的说明)、方法所需的材料、溶液、成分、试剂、化学品或酶,以及其他可选成分。
[0522]
例如,可在试剂盒中提供本文所述的细胞、载体和培养基。在一个实施方式中,该试剂盒包括(a)包含包括载体或其成分的组合物的容器,以及任选地包括(b)信息材料。所述信息材料可以是描述性、指导性、市场营销或其他材料,其中包括本文所述的方法和/或用于治疗益处的药剂的使用。在一个实施方式中,所述试剂盒还包括第二药剂,例如细胞。例如,所述试剂盒包括:包含载体或含有同样载体的组合物的第一容器,和包括第二药剂(例如细胞)的第二容器。
[0523]
试剂盒的信息材料不受其形式的限制。在一个实施方式中,信息材料可以包括关于化合物的生产、化合物的分子量、浓度、有效期、批次或生产地点信息等的信息。在一个实施方式中,信息材料包括转导试剂盒的细胞的方法或向受试者施用遗传修饰细胞的方法,例如,以合适的剂量、剂型或给药模式(例如,本文描述的剂量、剂型或给药模式)来治疗受试者)。信息可以多种格式提供,包括印刷文本、计算机可读材料、视频记录或音频记录,或提供实质性材料的链接或地址的信息。
[0524]
除载体和/或细胞外,试剂盒中的组合物还可以包括其他成分,例如溶剂或缓冲液、培养基、稳定剂或防腐剂。其试剂盒的组合物可以任何形式提供,例如液体、干燥或冻干形式,并且可以基本上是纯的和/或无菌的。当组合物以液体溶液提供时,液体溶液可以是水溶液或醇溶液。当以干燥形式提供组合物或其组分时,例如,通过添加合适的溶剂进行重构。溶剂,例如无菌水或缓冲液,可以任选性地提供在试剂盒中。
[0525]
该试剂盒可以包括一个或多个容器,用于盛装组合物或含有药剂的组合物。在一
些实施方式中,试剂盒包含用于组合物和信息材料的单独容器、分隔器或隔间。例如,组合物可以装在瓶子、小瓶或注射器中,信息材料可以装在塑料套筒或塑料袋中。在其他实施方式中,试剂盒的单独元件包含在一个单独的未分割容器中。例如,该组合物包含在具有信息材料以标签的形式附在其上的瓶子、小瓶或注射器中。在一些实施方式中,试剂盒包括多个(例如,一包)单独的容器,每个容器包含一种或多种药剂的单位剂型(例如,本文所述的剂型)。容器可以包括组合单位剂量,例如,包括(例如,以所需比例)载体和/或细胞和第二药剂的单位。例如,该试剂盒包括多个注射器、安瓿、铝箔包、泡罩包或医疗装置,例如,每个包含一个组合单位剂量。试剂盒的容器可以是气密的、防水的(例如,不渗透水分变化或蒸发)和/或不透光的。该试剂盒任选地包括适于施用该组合物的装置,例如注射器或其他合适的递送装置。所述装置可以预装一种或两种药剂,也可以是空的,但适合装载。
[0526]
在一个方面,本文提供的试剂盒包括一个或多个容器,其包含:(i)表达本文所述car多肽的ml nk细胞、所述细胞的群体或本文所述药物组合物;(ii)任选地,一种或多种附加抗癌剂(例如化疗剂),以及(iii)用于治疗受试者癌症的说明。
[0527]
在一个实施方式中,试剂盒可在相同或单独的合适容器中包含表达car多肽的ml nk细胞,以及药学上可接受的载体(例如,缓冲液),所述car多肽与包含与mhc i类蛋白(例如,npm1c:hla-a2)复合的npm1c新表位物的抗原结合。
[0528]
合适的容器可包括但不限于小瓶、微孔、试管、烧瓶、瓶子、注射器、输液袋或其他容器装置,其中可放置(在某些情况下,可适当地等分)表达本文所述car多肽的ml nk细胞。如果提供了额外的组分,则试剂盒可以包含额外的容器,用于放置该组分。容器还可以包括保留所需小瓶的注塑或吹塑塑料容器。容器和/或试剂盒可以包括带有使用说明和/或警告的标签。
[0529]
定义
[0530]
如本文所用,术语“npm1c”是指突变的核磷蛋白(npm1),其由具有细胞质定位的npm1基因中的4核苷酸重复产生。野生型npm1基因编码的人类核磷蛋白具有seq id no:54(登录号nm_002520)所示的氨基酸序列。由具有4核苷酸重复的npm1基因编码的示例性npm1c蛋白具有seq id no:56所示的氨基酸序列。此外,所述示例性npm1c蛋白的c端氨基酸序列包含mtdqeaiqdlclaveevslrk(seq id no:57),与野生型核磷蛋白相关的突变序列部分以粗体突出显示(参见例如van der lee等人,2019,jci 129(2):774-785;verhaak,r.等人(2005)blood 106:3747)。在一些实施方式中,本公开的npm1c新表位包含衍生自包含氨基酸序列mtdqeaiqdlclaveevslrk(seq id no:57)的npm1c蛋白的新表位。在一些实施方式中,本公开的npm1c新表位包含衍生自npm1c的部分的新表位,该npm1c具有包含mtdqeaiqdlclaveevslrk(seq id no:57)的氨基酸序列。
[0531]
如本文所用,术语“npm1c:hla-a2”是指与hla-a2蛋白复合的npm1c的新表位。在一些实施方式中,npm1c的新表位包含氨基酸序列aiqdlclav(seq id no:1)。
[0532]
如本文所用,当用于修改数值时,术语“约”表示数值上下至多10%的偏差仍在所述数值的预期含义范围内。
[0533]
如本文所用,术语“vh”或“v
h“是指抗体的重链可变区。
[0534]
如本文所用,术语“vl”或“v
l“是指抗体的轻链可变区。
[0535]
如本文所用,关于参考多肽序列的术语“氨基酸序列同一性百分比(%)”或“序列
同一性百分比”定义为在对齐序列并引入空位(如有必要)以实现最大序列同一性百分后,候选序列中与参考多肽序列中的氨基酸残基相同的氨基酸残基的百分比。可通过本领域已知的各种方式,例如,使用公开可用的计算机软件,例如blastp、blast-2、align(例如,align-2)或megalign(dnastar)软件,实现用于确定氨基酸序列同一性百分比的对齐。为了获得用于比较的空位对齐,可以使用gapped blast,如altschul等人,(1997)nucleic acids res.25(17):3389-3402所述。此外,可以使用已纳入gcg软件包中的gap程序(可访问http://www.gcg.com)中的needleman和wunsch(j.mol.biol.(48):444-453(1970))算法,使用blossum 62矩阵或pam250矩阵,空位权重为16、14、12、10、8、6或4,长度权重为1、2、3、4、5或6。
[0536]
如本文所用,术语“抗体”通常指包含两个轻链多肽和两个重链多肽的抗体(除非使用该术语的上下文另有说明)。抗体包括不同的抗体同种型,包括igm、igg、iga、igd和ige抗体。术语“抗体”包括但不限于多克隆抗体、单克隆抗体、嵌合的或嵌合抗体、人源化抗体、灵长类抗体、去免疫抗体和全人类抗体。抗体可由多种物种中的任何物种(例如哺乳动物,例如人类、非人灵长类动物(例如猩猩、狒狒或黑猩猩)、马、牛、猪、绵羊、山羊、骆驼、狗、猫、兔子、豚鼠、沙鼠、仓鼠、大鼠和小鼠)制备或衍生而来。抗体可以是纯化抗体或重组抗体。
[0537]
如本文所用,术语“抗体片段”、“抗原结合片段”或类似术语是指保留与目标抗原结合能力的抗体片段。这些片段包括但不限于单链抗体、单链fv片段(scfv)、fab片段、fab'片段和f(ab')2片段。该术语还包括,例如,单结构域抗体,例如骆驼单结构域抗体。例如,见muyldermans等人(2001)trends biochem sci 26:230-235;nuttall等人(2000)curr pharm biotech 1:253-263;reichmann等人(1999)j immunol meth 231:25-38;pct申请公布号wo 94/04678和wo 94/25591;美国专利号6,005,079,全部通过引用并入本文。在一些实施方式中,本公开提供了包含两个vh结构域的单结构域抗体,这两个结构域被修饰以形成单结构域抗体。此外,抗体片段的定义中还包括内抗体、微型抗体、三价抗体和二价抗体,并且与本文所述的方法兼容。例如,见todorovska等人(2001)j immunol methods 248(1):47-66;hudson和kortt(1999)j immunol methods 231(1):177-189;poljak(1994)structure 2(12):1121-1123:1121-1123;rondon和marasco(1997)annual review of microbiology 51:257-283,其中每一项的公开均通过引用以其整体纳入本文。
[0538]
如本文所用,术语“氨基酸取代”或“被取代”(当该术语指代被取代的氨基酸时)是指用不同的氨基酸残基取代预定氨基酸序列中的至少一个现有氨基酸残基。术语“氨基酸插入”是指将至少一个额外的氨基酸并入预定氨基酸序列。虽然插入通常包括由一个或两个氨基酸残基的插入组成,但也可以进行较大的“肽插入”。取代或插入的氨基酸残基可以是自然产生的,也可以是非自然产生的(修饰的)。术语“氨基酸缺失”是指从预定氨基酸序列中去除至少一个氨基酸残基。
[0539]
如本文所用,“保守氨基酸取代”是指将氨基酸残基替换为具有类似侧链的氨基酸残基。本领域已定义具有类似侧链的氨基酸残基家族,包括:
[0540]
(1)疏水侧链:正亮氨酸、met、ala、val、leu;
[0541]
(2)中性亲水侧链:cys、ser、thr、asn、gln;
[0542]
(3)酸性侧链:aap、glu;
[0543]
(4)碱性侧链:his、lys、arg;
[0544]
(5)影响链方向的侧链:gly,pro;以及
[0545]
(6)芳香侧链:trp、tyr、phe。
[0546]
例如,非保守氨基酸取代是用具有实质不同侧链的氨基酸残基(即属于不同家族成员的氨基酸残基)取代氨基酸残基。
[0547]
在一些实施方式中,通过考虑氨基酸残基的亲水指数来进行保守氨基酸取代。根据每个氨基酸的疏水性和电荷特性,为其指定一个亲水指数。它们是:ile(+4.5);val(+4.2);leu(+3.8);phe(+2.8);cys(+2.5);met(+1.9);ala(+1.8);gly(-0.4);thr(-0.7);ser(-0.8);trp(-0.9);tyr(-1.3);pro(-1.6);his(-3.2);glu(-3.5);gln(-3.5);asp(-3.5);asn(-3.5);lys(-3.9);和arg(-4.5)。本领域理解亲水性氨基酸指数在赋予多肽的交互功能方面的重要性(例如,参见kyte等人(1982)j mol biol 157:105-131)。在一些实施方式中,通过将一个氨基酸残基替换为具有相同或类似(例如,在约+2、+1.5、+1、+0.5、-0.5、-1、-1.5或-2)亲水指数的另一氨基酸残基来进行保守氨基酸取代。
[0548]
在一些实施方式中,通过考虑氨基酸残基的亲水性来进行保守氨基酸取代。指定了以下亲水性值:arg(+3.0);lys(+3.0
±
1);asp(+3.0
±
1);glut(+0.2);gly(0);thr(-0.4);pro(-0.5
±
1);ala(-0.5);his(-0.5);cys(-1.0);met(-1.3);val(-1.5);leu(-1.8);ile(-1.8);tyr(-2.3);phe(-2.5);和trp(-3.4)。在一些实施方式中,通过将一个氨基酸残基替换为具有相同或类似(例如,在约+2、+1.5、+1、+0.5、-0.5、-1、-1.5或-2范围内)亲水性的另一氨基酸残基来进行保守氨基酸取代。氨基酸取代示例如表2所示。
[0549]
表2:保守氨基酸取代
[0550][0551]
nle=正亮氨酸
[0552]
dbu=2,4-二氨基丁酸
[0553]
如本文所用,术语“细胞因子诱导的记忆样nk细胞”或“ml nk细胞”是指来源于nk细胞的nk细胞,其在离体下用至少一种细胞因子激活并且在缺乏相同细胞因子的情况下激发后保持增强的记忆样功能。
[0554]
如本文所用,术语“ciml nk细胞”是指衍生自nk细胞的nk细胞,其已被至少一种细胞因子激活,并表现出增强的激活和干扰素γ反应。
[0555]
如本文所用,术语“分离的核酸分子”是指从其自然环境的成分中分离出来的核酸分子。分离的核酸分子存在于与其自然染色体位置不同的位置。
[0556]
如本文所用,术语“新表位”是指包含由疾病特异性突变产生的肽的疾病特异性抗原,该肽被识别为与自身不同,并呈递在受疾病影响的细胞(但不是正常细胞)的表面。“肿瘤新表位”或“癌症新表位“是指肿瘤或癌症特异性抗原,其包含由肿瘤或癌症特异性突变产生的肽,这些突变被认为与自身不同,并存在于肿瘤/癌细胞(但不是正常细胞)的表面。肿瘤或癌症特异性新表位的呈递发生在肿瘤细胞内肿瘤或癌症特异性抗原的细胞内加工和裂解之后,从而产生一个或多个包含肿瘤或癌症特异性突变的8-15个氨基酸的不同肽。结合mhc i类或ii类分子以分别呈递给cd8+或cd4+t细胞的这些肽子集构成肿瘤新表位。
[0557]
如本文所用,术语“k
d”或“kd”或“k
d”具有本领域技术人员通常理解的相同含义,并指抗体(或其抗原结合片段)和抗原之间的结合反应的平衡解离常数。kd值是抗体解离速率常数(koff)与抗体结合速率常数(kon)之比的数学表示。kd值与抗体与抗原的结合亲和力呈负相关。kd值越小,抗体对其抗原的亲和力越大。亲和力可以通过本领域已知的任何方法进行测量。
[0558]
如本文所用,术语“koff”或“k
off”具有本领域技术人员通常理解的相同含义,并指抗体从抗体/抗原复合物中解离的解离速率常数。koff值是每秒衰变或解离的复合物分数的数学表示,用单位sec-1
表示。
[0559]
如本文所用,术语“kon”或“k
on”具有本领域技术人员通常理解的相同含义,并指抗体与抗原结合的结合速率常数。kon值是抗体和抗原的1摩尔(1m)溶液中每秒形成的抗体/抗原复合物数量的数学表示,以单位m-1
sec-1
表示。
[0560]
如本文所用,术语“特异性结合”、“特异地结合”、“选择性结合”和“选择地结合”意指其抗体或抗原结合片段或胞外结构域,其对特定抗原或表位(例如,npm1c:hla-a2)表现出可观的亲和力,并且通常不结合或基本不结合其他抗原和表位(例如,单独的hla-a2,例如,单独的npm1c新表位,例如,与hla-a2复合的非npm1c新表位)。“合适”或首选结合包括kd为10-7
、10-8
、10-9
或10-10
m或更好的结合。抗体-抗原相互作用的kd(亲和力常数)表示50%抗体和抗原分子结合在一起的抗体浓度。因此,在合适的固定抗原浓度下,50%的较高亲和力抗体(即强亲和力抗体)将以与较低亲和力抗体得到相同结合百分比所需相比较低的抗体浓度结合抗原分子。因此,较低的kd值表示较高(较强)的亲和力。如本文所用,“更好”的亲和力是更强的亲和力,并且比它们的比较者具有更低的数值,10-7
m的kd数值更低,因此表示比10-6
m的kd更好的亲和力。通常优选比10-7
m更好,优选比10-8
m更好(即kd值更低,因此更强)的亲和力。还考虑了与本文所述值中间的值,优选结合亲和力可以表示为一系列亲和力,例如,本文公开的结合npm1c:hla-a2的抗体的优选结合亲和力为10-7
到10-12
m,更优选为10-8
到10-12
m。
[0561]“不结合”或“基本上不结合”抗原的抗体、抗原结合片段或细胞外结构域是不会明显与非靶抗原(例如,单独的mhc i类蛋白,例如,单独的新表位,例如,与mhc i级蛋白复合的对照肽)结合的抗体、抗原结合片段或细胞外结构域。例如,在一个实施方式中,特异性结合npm1c:hla-a2的抗体对npm1c:hla-a2比对例如单独的hla-a2、单独的npm1c新表位、和/或与hla-a2复合的非npm1c新表位表现出高出至少两个、优选三个或四个或更多数量级的结合亲和力(即,表现出低两个、三个、四个或多个数量级的kd值的结合)。可以根据任何公认的确定这种结合的方法来确定特异性或选择性结合,所述方法包括例如根据scatchard分析、biacore分析、生物层干涉法和/或竞争性(竞争)结合分析。
[0562]
如本文所用,术语“hla-a”具有本领域普通技术人员通常理解的相同含义,并指由人类hla-a位点编码的一组人类白细胞抗原(hla)。hla是人类特有的主要组织相容性复合体(mhc)抗原。hla-a是人类mhc i类细胞表面受体的三种主要类型之一。其他是hla-b和hla-c。hla-a蛋白是一种异二聚体,由重α链和较小的β链组成。α链由变体hla-a基因编码,β链(β2-微球蛋白)是不变的β2微球蛋白分子。β2微球蛋白由人类基因组的单独区域编码。hla-a*02(a*02)是hla-a血清型组中的一种人类白细胞抗原血清型。血清型由hla-aα链的α2结构域的抗体识别决定。对于a*02,α链由hla-a*02基因编码,β链由b2m位点编码。
[0563]
如本文所用,术语“有效剂量”或“有效量”是指足以实现或至少部分实现所需治疗效果的量。
[0564]
以下示例是作为示例提供的,而不是作为限制。根据本文提供的一般描述,可以实施本发明的各种其他实施方式。
[0565]
其他实施方式
[0566]
e1.一种提高细胞转导效率的方法,该方法包括将至少一个asct2
+
细胞与包含狒狒包膜(baev)慢病毒载体的细胞培养基接触,所述慢病毒载体编码候选多肽,其中所述asct2
+
细胞已被白介素-12家族成员和il-18激活。
[0567]
e2.根据实施方式e1所述的方法,其中用il-12、il-18和il-15激活所述asct2
+
细胞。
[0568]
e3.根据实施方式e1所述的方法,其包括获取、分离或识别nk细胞,并用白细胞介素-12家族成员和il-18以及任选的il-15激活所述nk细胞的步骤。
[0569]
e4.根据实施方式e1或e3所述的方法,其中所述白细胞介素-12家族成员包括il-12、il-23、il-27或il-35。
[0570]
e5.根据实施方式e3所述的方法,其中所述nk细胞为asct2-。
[0571]
e6.根据实施方式e3的方法,其中激活所述nk细胞产生asct2
+
细胞。
[0572]
e7.根据实施方式e1所述的方法,其中所述asct2
+
细胞是nk细胞。
[0573]
e8.根据实施方式e1所述的方法,其中所述asct2
+
细胞是细胞因子诱导的记忆样(ciml)nk细胞。
[0574]
e9.根据实施方式e8所述的方法,其包括获取、分离或识别细胞因子诱导的记忆样(ciml)nk细胞的步骤。
[0575]
e10.根据实施方式e1所述的方法,其中asct2
+
的表达或水平相对于对照细胞增加。
[0576]
e11.根据实施方式e10所述的方法,其中所述对照细胞是未激活的nk细胞。
[0577]
e12.根据实施方式e10所述的方法,其中所述对照细胞是成熟的nk细胞。
[0578]
e13.根据实施方式e10所述的方法,其中相对于对照细胞,所述asct2
+
细胞中asct2表达增加约20%至约30%。
[0579]
e14.根据实施方式e1所述的方法,其中asct2的存在或水平导致细胞更容易接受baev慢病毒载体的转导。
[0580]
e15.根据实施方式e1所述的方法,其中使用一种或多种il-7、il-12、il-15、il-18、il-21、il-23、或其任何组合激活asct2
+
细胞。
[0581]
e16.根据实施方式e1所述的方法,其中所述asct2
+
细胞是哺乳动物细胞。
[0582]
e17.根据实施方式e16所述的方法,其中所述哺乳动物细胞是人类细胞。
[0583]
e18.根据实施方式e17所述的方法,其中所述人类细胞从外周血单个核细胞(pbmc)中分离。
[0584]
e19.根据实施方式e1所述的方法,其中所述慢病毒载体用狒狒包膜糖蛋白(baev-gp)假型化。
[0585]
e20.根据实施方式e1所述的方法,其中至少40%的至少一种asct2
+
细胞在约3天后转导。
[0586]
e21.根据实施方式e1所述的方法,其中相对于传统慢病毒转导方法,转导效率提高。
[0587]
e22.根据实施方式e1所述的方法,其中所述候选多肽包括抗体或其片段、毒素、激素、生长因子、受体或信号传导分子或嵌合抗原受体。
[0588]
e23.根据实施方式e22所述的方法,其中所述嵌合抗原受体包含抗体或其片段。
[0589]
e24.根据实施方式e22或实施方式e23所述的方法,其中所述抗体或片段对检查点抑制剂具有特异性。
[0590]
e25.根据实施方式e22或实施方式e23所述的方法,其中所述抗体是抗t细胞受体抗体或t细胞受体样抗体。
[0591]
e26.根据实施方式e25所述的方法,其中所述抗体或其片段对npm1、npm1c、mage1、gp100、htert、muc1、ny-eso-1、flt3、tp53、剪接体因子、mage3、hcgβ、her2/neu、melan-a/mart-1、tarp、p53、酪氨酸酶、p68、mif、蛋白酶3、wt1、ha-1h或prame具有特异性。
[0592]
e27.根据实施方式e22或实施方式e23所述的方法,其中所述抗体靶向肿瘤特异性细胞内蛋白。
[0593]
e28.根据实施方式e27所述的方法,其中所述细胞内蛋白包含npm1c。
[0594]
e29.根据实施方式e1所述的方法,其中所述培养基包含12/15/15/21和il-7。
[0595]
e30.一种通过实施方式e1-e29中任一项所述的方法产生的细胞。
[0596]
e31.一种治疗癌症的方法,所述方法包括向有需要的受试者施用通过实施方式e1-e29中任一项所述的方法产生的细胞。
[0597]
e32.一种制备基因工程化细胞的方法,包括将至少一个asct2
+
细胞与包含编码多肽的狒狒包膜(baev)慢病毒载体的细胞培养基接触,其中asct2
+
细胞已被白细胞介素-12家族成员和il-18激活。
[0598]
e33.根据实施方式e32所述的方法,其中所述白细胞介素-12家族成员包括il-12、il-23、il-27或il-35。
[0599]
e34.一种通过实施方式e32所述的方法产生的基因工程化细胞。
[0600]
e35.一种包含实施方式e30所述的细胞或实施方式e34所述的基因工程化细胞的免疫疗法。
[0601]
e36.一种治疗癌症的方法,所述方法包括向有需要的受试者施用实施方式e35所述的免疫疗法。
[0602]
实施例
[0603]
利用免疫细胞识别、反应和杀死肿瘤细胞的能力的细胞疗法是治疗晚期恶性肿瘤的一种有希望的方法。已经实现了对t细胞的有效细胞转导,但对nk细胞没有实现,这是改
进基于nk细胞的癌症免疫疗法的一个主要技术缺陷。nk细胞是固有的淋巴细胞,可以清除病毒感染和恶性转化的细胞。传统慢病毒转导方法使用由水泡性口炎病毒g(vsvg)假型化的典型慢病毒;然而,已知nk细胞对vsvg假型慢病毒转导具有很强的抗性,基因编辑率为1-3%。如本文所述,我们已经确定了提高nk细胞转导效率的组合物和方法。通过研究nk细胞独特的受体表达模式,我们的数据表明,与ldl-r形成鲜明对比的是,asct2的表达水平在原代常规nk细胞中丰富,在细胞因子诱导的记忆样(ciml)nk细胞内进一步增强。asct2是狒狒包膜糖蛋白(baev-gp1)的氨基酸转运体和相应受体。通过利用非常规的baev假型慢病毒,我们克服了原代人nk细胞和ciml nk细胞中的转导障碍。我们关于baev慢病毒的数据证实,原代nk细胞很容易接受这种非常规的基因编辑方法,而ciml nk细胞比其初始细胞更容易接受慢病毒转导,这与其asct2表达水平密切相关。我们对ciml nk细胞的转导效率现在接近40-70%。
[0604]
缩写
[0605]
aiq、aiqdlclav(seq id no:1);aml,急性髓系白血病;allosct,同种异体造血干细胞移植;bli,生物发光成像;car,嵌合抗原受体;car-nk,嵌合抗原受体nk细胞;facs,荧光激活细胞分选;fbs,胎牛血清;gil,gilgfvftl(seq id no:63);hsc,造血干细胞;macs,磁激活细胞分选;npm1,核磷蛋白;npm1c,突变核磷蛋白;scfv,单链可变片段;sll,sllmwitqc(seq id no:62);taa,肿瘤相关抗原;hspc,造血干/祖细胞。
[0606]
以下实施例所用的以下材料和方法
[0607]
细胞系培养
[0608]
oci-aml3细胞购自atcc。oci-aml2细胞购自dsmz。oci-aml3细胞和oci-aml2在添加10%fbs(life tech和vwr)和2mm l-谷氨酰胺(thermo fisher scientific)的rpmi 1640培养基(gibco)中培养。
[0609]
car载体设计
[0610]
由抗-npm1c单链抗体(seq id no:2)、cd8α前导序列、细胞外铰链结构域和跨膜结构域、4-1bb共刺激结构域和cd3ζ激活结构域组成的car序列由integrated dna technologies(idt)定制合成。在一些构建体中,car通过可切割的接头与分泌型或膜结合型il-15核苷酸序列连接。phiv载体(质粒#21373)用xbai和clai双酶切。在对载体主干进行凝胶纯化后,根据制造商的协议,使用hifi dna组装主混合物(新英格兰生物实验室)基于其5'和3'端的重叠部分组装phiv主干、car片段和p2a-gfp片段。使用以下测序引物对所得质粒进行测序:5'-gttaggccagcttggcacttgatgt-3'(seq id no:69)(正向)和5'-aggcacaatcagcattggtagctg-3'(seq id no:70)(反向)。具有正确序列的质粒命名为phiv-car-gfp。
[0611]
表达car的原代人nk细胞的产生
[0612]
用phiv-car-gfp、baev-gp(或pcmv-vsvg)、pcmv-δ8.9和padv质粒转染293t细胞生成慢病毒。在48小时和72小时收集培养上清液,并在25000rpm、4℃下通过超速离心2小时沉淀慢病毒颗粒。用100μl无血清dmem培养基悬浮慢病毒颗粒,并在-80℃冷冻。使用ficoll离心法从供体外周血单个核细胞(pbmc)中分离出人nk细胞,并使用rosette sep(stemcell technologies,≥95% cd56+cd3-)进行纯化。通过涂布3-5x106个细胞使用rhil-12(10ng/ml)+rhil-18(50ng/ml)+rhil-15(50ng/ml)或对照条件(rhil-15,50ng/ml)激活16小时对
nk细胞进行预激活,用pbs洗涤3次以去除细胞因子,并在添加有rhil-15(1ng/ml)的含有10%人ab血清(sigma-aldrich)的完全rpmi 1640培养基中培养以支持存活,其中每2-3天用新鲜细胞因子替换50%的培养基。预激活后1天,用慢病毒(moi=10)转导nk细胞。car-nk细胞在添加1ng/ml rhil-15的培养基中扩增。细胞在预激活和转导后静息10天。
[0613]
通过测定荧光素酶活性进行细胞毒性试验
[0614]
使用表达荧光素酶的靶细胞系对car-nk细胞进行细胞毒性试验。将nk细胞与靶细胞以指定的效应子与靶标(e:t)比率孵育24小时。然后将细胞在pbs中清洗一次,在荧光素酶细胞培养裂解试剂(promega)中溶解,然后与荧光素酶分析试剂(promega)混合。使用平板分光光度计(infinite m200pro,tecan)分析裂解产物的发光。仅靶细胞的发光作为基线对照。使用以下公式计算每个样品的特异性裂解率:特异性裂解(%)=100
×
{1
–
[(car-t组的发光/单独的靶细胞的发光)/(未转导t组的发光/单独的靶细胞的发光)]}。
[0615]
体内car-nk细胞对靶细胞的杀伤作用
[0616]
nod-scid il2rg
null
(nsg)小鼠购自jackson laboratories,并安置在dana-farber癌症研究所的特定无病原体(spf)动物饲养场。所有用小鼠进行的实验都得到了机构动物护理和使用委员会(institutional animal care and use committee)的批准。简而言之,通过尾静脉注射,将表达荧光素酶的oci-aml3细胞(1
×
106)在200μl pbs中注入受照射的nsg小鼠体内。4天后,将总计1x106个nk细胞的500k car-nk细胞注射到荷瘤小鼠体内。使用xenogen ivis-200光谱相机每三天进行一次生物发光成像(bli)。
[0617]
慢病毒的示例制备:
[0618]
(1)质粒的扩增:
[0619]
所有3种慢病毒包装质粒均在stbl3化学感受态大肠杆菌(thermo fisher c737303)中生长。为了增加经验证的质粒,使用100ml含有100μg/ml氨苄西林的lb液体培养基用于midi prep(qiagen#2945),或1000ml含有100μg/ml氨苄西林的lb液体培养基用于endo-free maxi prep(qiagen#12362)。
[0620]
(2)培养293t细胞:
[0621]
293t细胞在20ml 10% fbs dmem中培养,达到100%汇合。细胞未通过15次分裂。细胞不能传代生长到接近100%汇合度。150mm x25mm组织培养皿(thermo fisher scientific#0877224)。完全的dmem培养基(含10%fbs+p/s+2mm l-glut)
[0622]
(3)293t细胞的转染:
[0623]
转染前2-3天,平板5e6细胞/15cm平板。允许增长到几乎100%汇合度。使用前将所有转染试剂加热至室温。转染如下:
[0624][0625][0626]
以螺旋方式逐滴转移至293t,使培养皿均匀。
[0627]
(可选):转染后8小时,检查合胞体形成和(如果适用)荧光。
[0628]
第+2天(转染后48小时):收获并用15ml预热的完全dmem替换。上清液在4℃下储存一天,然后与二次收获物一起进行浓缩。
[0629]
第+3天(转染后72小时):收获。漂洗和抛板。
[0630]
(4)慢病毒浓度
[0631]
收集病毒上清液。
[0632]
将上清液在离心机中旋转5分钟350xg,使细胞碎片沉淀。将上清液(0.45um注射器过滤器)过滤到超离心管中。添加培养基至总体积约35ml,用支架平衡。
[0633]
旋转2小时,25000rpm,4℃
[0634]
倒出上清液;完全去除剩余的培养基,并添加100ul无血清dmem培养基,使沉淀在4℃下溶解过夜。不要用移液管上下移液。
[0635]
5.第二天,用移液器轻轻上下移液混合(小心不要形成气泡),然后转移到1.5ml eppendorf管中。
[0636]
向超离心管中加入100μl无血清dmem培养基进行清洗。用移液管轻轻上下移液并转移至相同的1.5ml eppendorf管中。
[0637]
在-80℃冷冻20-50μl等分样品。
[0638]
(5)慢病毒滴定
[0639]
使用jurkat细胞系,通过facs滴定病毒。
[0640]
在完全rpmi中培养jurkat(含10%fbs、p/s和2mm l-glut)。
[0641]
每种病毒以100万/1ml 12孔x 2孔(重复)进行铺板,补充1ul聚凝胺(f.c.10ug/ml),另外两个孔用于未转导的对照。每个孔添加1μl浓缩baev慢病毒。
[0642]
在离心机中以1000xg的速度在32℃下旋转1小时,制动关闭(brake off)或低制动(brake-low)(以防溢出)。
[0643]
72小时时,gfp+(或scfv+)的流量。
hsct)是一种有效的治疗方法,但由于疾病进展、年龄、复发病变或缺乏hla匹配的供体,许多患者并不适合,长期临床成功率受到移植物抗宿主病(gvhd)、感染和器官毒性的限制。移植物抗白血病(gvl)是allo hsct的潜在免疫疗法基础,传统上被认为是t细胞造成的,但最近的研究发现,自然杀伤(nk)细胞对额外的gvl起着重要作用(venstrom jm等人n.engl.j.med.2012;367(9):805
–
816;cooley s,blood.2010;116(14):2411
–
9)。在这里,我们描述了一种基于天然nk细胞记忆的过继免疫疗法中武装nk细胞的新方法。
[0663]
细胞因子诱导的记忆样(ciml)nk细胞与癌症免疫疗法。
[0664]
利用免疫细胞识别、反应和杀死肿瘤细胞的能力的细胞疗法是治疗晚期恶性肿瘤的一种有希望的方法。在这种情况下,使用嵌合抗原受体(car)t细胞观察到的显著临床反应证明了这种方法的巨大潜力。然而,许多癌症中缺乏肿瘤特异性抗原、肿瘤靶抗原丢失、体内持久性差、严重毒性(包括细胞因子释放综合征(crs)和神经毒性)仍然是car t细胞疗法的主要挑战。此外,car t细胞输注后复发的患者的治疗选择非常有限。nk细胞是固有的淋巴细胞,本质上可以清除病毒感染和恶性转化的细胞。传统的nk细胞在早期临床试验中显示出一定的前景,但这些输注在少数患者中的缓解时间相对较短。最近,范式转换研究表明,nk细胞表现出先天免疫记忆。我们发现,il-12、il-15和il-18的短暂体外预激活可激活和分化静息nk细胞,以生成具有强大抗白血病活性的细胞因子诱导的记忆样(ciml)nk细胞(图1)(romee r等blood.2012;120(24))。在我们的首次人体1期试验中,ciml nk在50%以上复发难治性aml患者中诱导了临床反应,无明显毒性(romee r,sci.transl.med.2016;21:357ra123)。此外,过继移植到患者体内后,细胞增殖、扩增并保持增强的抗白血病活性。id.这些数据表明ciml nk细胞疗法是有效、安全的,并具有抗白血病的临床活性。ciml nk细胞目前正在几项研究中进行评估,包括我们正在进行的对allo-hsct后复发的髓系恶性肿瘤患者的试验。
[0665]
ciml nk cell作为car平台。
[0666]
最近使用同种异体脐血衍生nk细胞作为生成cd19-car平台的研究表明,复发性b细胞恶性肿瘤患者的临床反应很有希望(rezvani等人,ash 2018)。值得注意的是,临床反应取得了最小的毒性且没有出现严重的细胞因子释放综合征(crs)或神经毒性。这些临床观察表明,nk细胞为遗传修饰的过继细胞疗法提供了新的细胞平台。我们将以这些观察结果为基础,结合之前的ciml nk细胞疗法临床经验,开发产生ciml nk car的方法,并评估这些遗传修饰的nk细胞在临床前模型中的疗效。基于临床前动物模型和未经遗传修饰的ciml nk细胞治疗的患者体内的良好安全性、增殖增加、持久性和抗白血病功能增强,ciml nk细胞为nk细胞car的开发提供了独特的平台。此外,它们固有的靶向髓系母细胞倾向性使它们对于aml具有吸引力,而car t细胞在aml中由于缺乏良好的表面靶向抗原仅显示出轻微益处或无益处。
[0667]
aml中car靶标
[0668]
aml是一种分子多样性恶性肿瘤。npm1c的突变导致蛋白质的异常细胞质定位和/或被mhc呈递。我们已经成功地生成并验证了一种新的car构建体,它能够靶向aml母细胞表面npm1c产生的新抗原。
[0669]
使用记忆样nk细胞平台生成靶向npm1c的car。
[0670]
本文所述的实施方式包括针对具有突变npm1c的aml的基于nk细胞car。与tcr和传
统car方法相比,我们的方法在武装nk细胞方面具有优势。nk细胞可以识别并杀死无hla表达或低hla表达的靶细胞。这一点很重要,因为缺乏hla表达或hla分子水平低的白血病细胞可以被nk细胞杀死,而那些表达高水平hla的白血病细胞能够被我们的car-nk细胞有效杀死。由于抗原丢失是car-t治疗后肿瘤抵抗的一种机制,我们的car-nk细胞可以有效降低治疗抵抗和疾病复发。不受理论约束的情况下,我们的mem-nk car方法将显著增强对白血病细胞的靶向,而不影响正常造血干细胞和祖细胞,这曾是aml中基于t细胞的car方法的挑战之一。
[0671]
ciml car-nk细胞体外生成方法的优化。
[0672]
我们正在使用我们的car构建体优化ciml nk细胞的转导。ciml nk是由传统外周血nk细胞(来自正常健康志愿供体)通过我们之前描述的方法生成的(romee r等人blood.2012;120(24)和romee r,sci.transl.med.2016;21:357ra123))。将用我们的car构建体对常规和ciml nk细胞(来自同一供体)进行转导,并比较它们的转导效率。数据显示,细胞因子激活的nk细胞更容易接受慢病毒转导以及核转染。对转导后的nk细胞进行体外针对oci-aml3(hla-a2+抗原+)、gmb(hla-a2-抗原-)和k562(hla阴性但对nk细胞敏感)的活性评估。我们还将测试它们针对来自患者的hla-a2+抗原+原发性aml细胞的活性。我们还开发了一个nk细胞特异性cytof面板(panel),它允许我们以单个细胞的方式评估多达38个标记物,从而进行详细的免疫亚群分析。
[0673]
我们正在扩展本文的实施方式,以有效靶向aml和其他髓系恶性肿瘤(例如,mds、mpn)中的其他突变蛋白。
[0674]
使用异种移植和pdx小鼠模型比较ciml nk和t细胞car(具有相同car构建体)在体外和体内的活性。
[0675]
我们将评估ciml car-nk细胞和t细胞car(具有相同构建体)在异种移植和pdx小鼠模型中的体外和体内激活、增殖、持久性和疗效。动物将在过继移植后7、14、28和60天被处死,以评估体内细胞的持久性、扩增性和活性(基于bli肿瘤成像和存活)以及衰竭。我们还将评估这些细胞进入这些小鼠的关键器官(包括骨髓和脾脏)的运输/归巢情况。
[0676]
优化扩增方法,为早期临床试验开发现成产品。
[0677]
将比较使用饲养层细胞系(il21/41bb转导的k562细胞)和无饲养层方法(sutlu等人,cytotherapy 2010)的各种体外扩增方法,以获得最佳短期扩增和新鲜输注,而无需冻存(sutlut等人cytotherapy.2010;12(8):1044
–
55;denman cj等人plos one.2012;7(1):e30264)。这些扩增方法也将在clinimacs prodigy系统上进行测试,该系统允许在自动化和封闭系统中进行制造过程,因此非常适合我们未来的试验。我们将开发一种周转时间短的自动化细胞制造方法,可以方便地出口到其他gmp设施。在优化了本文所述的流程后,我们将把此流程转移到dana farber的cmcf(细胞操纵核心设施)。我们已经有2个用于制造ciml nk细胞的活性ind,并且我们已经验证了这些细胞的制造工艺。我们打算提交我们使用ciml nk细胞car的ind。
[0678]
实施例2:基于asct2表达的记忆样nk细胞转导效率的优化
[0679]
生产遗传修饰的、高效car-nk细胞的技术方面至关重要。已经实现了对t细胞的有效转导,但对nk细胞没有实现,这是改进基于nk细胞的癌症免疫疗法的一个主要技术缺陷。传统慢病毒转导方法使用由水泡性口炎病毒g(vsvg)假型化的典型慢病毒;然而,已知nk细
胞对vsvg假型慢病毒转导具有很强的抗性,基因编辑率为1-3%。
[0680]
评估ciml nk细胞是否具有与常规nk细胞不同的受体表达,可以用来介导假型慢病毒的转导。ciml nk细胞是如romee,r.等人blood 120,4751-4760(2012)和romee,r.等人sci transl med 8,357ra123(2016)中描述的从正常健康志愿供体分离的常规外周血nk细胞制备而成,如图1所示。简而言之,使用ficoll离心法和rosette sep(stemcell technologies,≥95%cd56+cd3-)从供体外周血单个核细胞中分离hnk细胞。通过涂布3-5x106个细胞并使用rhil-12(10ng/ml)+rhil-18(50ng/ml)+rhil-15(50ng/ml)或对照条件(rhil-15,50ng/ml)激活16个小时对hnk细胞进行预激活,用pbs洗涤3次以去除细胞因子,并在添加有rhil-15(1ng/ml)的含有10%人ab血清(sigma-aldrich)的完全rpmi 1640培养基中培养以支持存活,其中每2-3天用新鲜细胞因子替换50%的培养基。
[0681]
通过流式细胞术评估vsvg蛋白连接的受体ldl-r的表达。发现传统nk细胞和ciml nk细胞都低表达ldl-r(图2a)。因此,nk细胞中的转导阻断(即,使用vsvg-lv)可归因于其低密度脂蛋白受体(ldl-r)的最低表达,该受体是vsvg蛋白的相应受体(图2c)。vsvg蛋白与ldl-r的连接对于靶细胞侵袭后慢病毒粘附至关重要,因此是转导效率的限制因素(图2c)。通过研究nk细胞独特的受体表达模式,我们的数据显示,与ldl-r形成鲜明对比的是,asct2的表达水平在原代常规nk细胞中丰富,在细胞因子诱导的记忆样(ciml)nk细胞内进一步增强(romee,r.等人blood 120,4751-4760(2012);romee,r.等人scientifica(cairo)2014,205796(2014);romee,r.等人sci transl med 8,357ra123(2016))(图2b;图2c)。asct2是狒狒包膜糖蛋白(baev-gp1)的氨基酸转运体和相应受体。因此,不希望受到理论的约束,利用非传统的baev假型慢病毒,我们将克服原代人nk细胞,特别是ciml nk细胞中的转导阻断(图2c)。
[0682]
实施例3:生成抗-npm1c car记忆样nk细胞。
[0683]
嵌合抗原受体(car)t细胞疗法是一种已知的靶向癌症抗原的方法。然而,car-t细胞由于其持久性和副作用而受到限制。需要产生保持活性并显示对癌细胞具有效力的car-nk细胞。
[0684]
ciml nk细胞作为car平台。
[0685]
使用同种异体脐血衍生的nk细胞作为生成cd19 car平台的研究已经显示出复发性b细胞恶性肿瘤患者的临床反应(liu等人nejm.(2020)382:545-53)。临床反应取得了最小的毒性且没有出现严重的细胞因子释放综合征(crs)或神经毒性,这表明nk细胞是遗传修饰的过继细胞疗法的一个新的细胞平台。我们将以这些观察结果为基础,结合我们之前的细胞因子诱导的记忆样(ciml)nk细胞治疗临床经验(romee r等blood(2012)120(24):4751-4760;romee r等人sci transl med(2016)8(357):357ra123),以开发生成ciml nk car的方法,并评估这些遗传修饰的nk细胞在临床前模型中的疗效。基于临床前动物模型和未经遗传修饰的ciml nk细胞治疗的患者中所见的良好安全性、增殖增加、持久性和抗白血病功能增强,ciml nk细胞(图1)为nk细胞car的开发提供了独特的平台。id.
[0686]
突变npm1c作为aml的car靶标。
[0687]
大多数car-t细胞疗法以肿瘤相关抗原(taa)为靶标,其由于正常组织中低水平表达,可能导致在靶/脱肿瘤(on-target/off-tumor)毒性,并且由于肿瘤细胞失去抗原表达,可能产生肿瘤耐药性。克服这个缺点的一种方法是靶向肿瘤特异性致癌驱动基因突变。核
磷蛋白中的四个核苷酸重复,被称为npm1c,是约30%aml中的致癌驱动基因突变。npm1c产生由hla-a*0201等位基因表达的白血病特异性新抗原(aiqdlclav;seq id no:1)。利用酵母表面展示技术,我们分离出了一个与npm1c表位-hla-a2复合物特异结合的人类单链可变片段(scfv)。先前识别的靶向该抗原的scfv在美国临时申请号62/987,612中描述(在此通过引用并入)。我们通过将框架中的scfv克隆到包含cd8α铰链和跨膜(tm)结构域、4-1bb共刺激结构域和cd3z激活结构域随后是自分裂p2a和egfp的car主干中,创建了car构建体(图3a和表3)。
[0688]
表3抗-npm1c car构建体的组成
[0689]
组成(5’to 3’)seq id no(aa)seq id no(dna)前导序列2331抗-npm1c scfv2432cd8铰链&跨膜25334-1bb共刺激结构域2634cd3z激活结构域2735p2a2836egfp2937全长构建体2230
[0690]
如前所述,抗-npm1c car-t细胞特异性识别aiq-hla-a2复合体。简而言之,与生物素化aiq-hla-a2孵育,随后进行链亲和素-apc染色的gfp+抗-npm1c car-t细胞(具有seq id no:30的抗-npm1c car)显示与aiq-hala-a2复合体(图3b)结合,但不与呈递对照肽表位(例如,sll;sllmwitqc(seq id no:62))的hla-a2或单独的hla-a2结合(数据未显示)。未转导的t细胞未显示与三种复合体中的任何一种结合。这些结果证实了npm1c-car-t细胞(抗-npm1c car为seq id no:30)对aiq-hla-a2复合体的特异性。含有分离的scfv的工程化car-t细胞在体外和体内对npm1c+hla-a2+白血病细胞都表现出强大的细胞毒性,但对npm1c-hla-a2+或hla-a2-肿瘤细胞没有表现出毒性(数据未显示)。
[0691]
在这里,我们将利用car构建体转导的ciml nk细胞,开发一种针对aml的基于nk细胞的car,其能够识别与hla-a*0201复合的npm1c新抗原。nk细胞可以识别并杀死没有或低hla表达的靶细胞。这一点很重要,因为具有低水平hla的白血病细胞可以通过car非依赖机制被nk细胞杀死,而那些表达高水平hla和更多npm1c新抗原-hla-a2靶标的白血病细胞则可以被npm1c car-nk细胞靶向和杀死。由于抗原丢失是car-t治疗后肿瘤抵抗的重要机制,npm1c car-nk细胞可以有效降低治疗抵抗和疾病复发。
[0692]
car ciml nk细胞的强大抗aml功能。
[0693]
如下文所述,我们已通过非常规慢病毒转导方法将抗-npm1c car导入ciml nk细胞,并实现了50%以上的car编辑效率(图5)。与未经转导的细胞相比,携带抗-npm1c car的ciml nk细胞(根据seq id no:30)获得了增强的抗aml功能,这表现为用npm1c+靶向aml细胞(oci-aml3)触发后ifnγ产生水平的升高以及脱粒标记物cd107a的表达增加。总之,我们构建了一个car-nk平台,以特异有效地靶向肿瘤特异性细胞内蛋白,如npm1c。
[0694]
记忆样nk细胞
[0695]
细胞因子诱导的记忆样(ciml)nk细胞是具有通过使用包括il-12、il-18和il-15
在内的细胞因子预激活而引起的长期增强功能的nk细胞。即使在没有初始细胞因子刺激的情况下,ciml nk细胞在未来感染或挑战时也会产生回忆反应。为了生成ciml nk细胞,使用了实施例2的方法。简言之,从人类中分离出外周血单个核细胞,并用rhil-12(10ng/ml)+rhil-18(50ng/ml)+rhil-15(50ng/ml)或对照条件(rhil-15,50ng/ml)刺激16小时,清洗3次以去除细胞因子,并培养在添加有rhil-15(1ng/ml)的含有10%人ab血清(sigma-aldrich)的完全rpmi 1640培养基中以支持存活。
[0696]
转导
[0697]
原代人和小鼠nk细胞的转导面临着各种挑战,不同的基因转移方法的成功率很低。为了介导这一过程,使用了一种基于假型慢病毒的方法。已知vsvg-(囊泡-气孔-病毒-g蛋白)和baev-lv(狒狒包膜糖蛋白)都能成功地将遗传物质转移到nk细胞。nk细胞表达vsvg受体低密度脂蛋白(ldl-r)和baev受体丙氨酸、丝氨酸、半胱氨酸转运体2(asct2)。使用流式细胞术在常规(非细胞因子诱导)和ml nk细胞上测量这两种受体的表面表达。如实施例2中所描述的,发现ldl-r水平(图2a)表达低于asct2(图2b)。因此,为了产生更有效的慢病毒方法,将来自baev的糖蛋白(氨基酸序列由seq id no:107示出;核苷酸序列由seq id no:108示出)插入编码序列中,以产生具有baev糖蛋白的假型慢病毒,该baev糖蛋白将识别asct2。图28描绘了用baev糖蛋白假型化并编码抗cd19 car的慢病毒构建体的图。制备表达图3a和表3中标识的抗-npm1c car的慢病毒表达构建体并用baev-糖蛋白假型化(称为“baev lv”)。在ef-1-α启动子的控制下,将该构建体克隆到慢病毒包装质粒中,并通过瞬时转染hek 293t细胞生成慢病毒。含lv上清液的滴度通过facs定量。
[0698]
为了了解在car转导前用不同细胞因子诱导ml nk细胞是否影响asct2的表达,对细胞进行诱导和表达检测。具体而言,收集了人外周血单个核细胞(pbmc),并从样本中纯化了人nk(hnk)细胞。然后,使用上述剂量(即rhil-12为10ng/ml;rhil-18为50ng/ml,rhil-15为50ng/ml),用不同的il-15、il-12和/或il-18的组合刺激hnk细胞16小时。然后洗涤细胞并使用上述baev lv慢病毒转导用抗-npm1c car(seq id no:30中所示的核苷酸序列)转导,72小时后,生成功能性抗-npm1c-car-ml hnk细胞(图6a)。
[0699]
当用il-15、il-12和il-18中的一种或多种刺激hnk细胞时,如流式细胞术所测,asct2的表面表达随着il-15、il-12、il-18中多于一种的刺激而增加(图6b)。具体而言,同时使用il-15、il-12和il-18处理比单独使用il-15更能增加表达。
[0700]
使用定量pcr(qpcr)进一步证实ciml nk细胞中asct2的表达是否在mrna水平上相对于传统nk细胞发生改变。简而言之,使用上述方法从三个不同的健康人供体的pbmc中分离出原代人nk细胞。hnk细胞以每孔3-5x106个细胞进行铺板,并通过暴露于(i)rhil-12(10ng/ml)+rhil-18(50ng/ml);或(ii)rhil-12(10ng/ml)+rhil-18(50ng/ml)+rhil-15(50ng/ml)激活16小时。对照条件是暴露于单独的rhil-12(10ng/ml)、暴露于单独的rhil-18(50ng/ml)或暴露于单独的rhil-15(50ng/ml)。激活后,用pbs洗涤细胞3次以去除细胞因子,并提取rna用于qpcr分析。使用δδct方法定量asct2rna转录。图6c-6e为来自三个不同人类供体的激活hnk细胞提供定量。如图所示图6c-6d,相对于对照hnk细胞,用il-12和il-18激活的nk细胞asct2 rna转录物的表达增加,尤其是与仅用il-15激活的对照hnk细胞相比。如图6e所示,用il-15、il-12和il-18激活的nk细胞的asct2 rna转录物相对于仅用il-15-激活的对照hnk细胞增加了3倍以上。
[0701]
总之,这些发现表明,用il-12和il-18或所有三种细胞因子(il-12、il-18、il-15)激活可以提高hnk细胞中asct2 rna转录物的表达和表面表达,并可以提高baev-lv的转导效率。
[0702]
然后用抗-npm1c car转导ml nk细胞,并测量转导效率。具体来说,上面描述的car构建体包含gfp报告子。检测转导细胞中gfp的表达水平。图6f显示使用所有三种细胞因子的预激活提高了baev-lv的转导效率。
[0703]
在不同人类供体获得的ciml-nk细胞中评估了baev-lv慢病毒转导的转导。使用蛋白质l通过流式细胞术测量car表达(参见,例如,zheng等人(2012)j.transl med.10:29)。如图7a所示,六个不同供体的总体转导率(转导后通过蛋白l结合确定的抗-npm1c car的表达)为56
±
14%。
[0704]
此外,在从人和小鼠供体获得的ciml-nk细胞中评估了baev-lv慢病毒转导的转导。如上所述,通过用从pbmc获得的原代hnk细胞的rhil-12、rhil-15和rhil-18预激活获得人ciml nk细胞。通过采集小鼠脾细胞,分离小鼠nk细胞,并用重组小鼠il-12、il-15和il-18预激活,获得小鼠ciml-nk细胞。baev假型慢病毒编码gfp(lenti-gfp(baev))。如图7b所示,在人和小鼠ciml-nk细胞中,通过gfp表达测量的转导率均较高。
[0705]
实施例4:ml nk细胞亚群中asct2的表达
[0706]
进一步评估asct2在nk细胞亚群中的表达是否存在差异。如图7c所示,hnk细胞根据其发育和成熟阶段表达不同的表型标记物。下表4显示了从较不成熟(例如,更“干样”)到完全成熟的特征表型标记物。
[0707]
表4:基于成熟阶段的hnk细胞亚群表型标记物
[0708][0709]
流式细胞术分析用于根据上述表型标记分析人nk细胞亚群,并测定每个亚群的asct2表达。简言之,如实施例3所述,从四个不同的人类供体获得的新鲜或冷冻pbmc中分离出hnk细胞。然后将hnk细胞静置一夜。用靶向cd56、cd3、cd16、kir、cd57和asct2的标记抗体对细胞进行染色,清洗,然后进行流式细胞术分析。使用的设门策略如图7d所示,它允许识别以下hnk亚群(按照从较不成熟到更成熟的顺序):
[0710]
(i)nk1:cd56亮;cd16-/低;
[0711]
(ii)nk2:cd56暗;cd16+;kir-;
[0712]
(iii)nk3:cd56暗;cd16+;kir-;cd57-;
[0713]
(iv)nk4:cd56暗;cd16+;kir+;cd57+。
[0714]
如图7e-7f所示,表达高表面水平asct2的群体比例与hnk细胞亚群的成熟阶段相关。具体来说,hnk细胞的asct2表面表达从高到低依次为nk1》nk2》nk3》nk4。来自不同人类供体的hnk细胞亚群的数据是一致的。
[0715]
实施例5:抗-npm1ccar-mlnk细胞对急性髓系白血病有效
[0716]
已知急性髓系白血病(aml)表达npm1c。为了研究抗-npm1ccar-mlnk细胞是否比未转导的nk细胞更有效地对抗aml,将每个细胞的群体与aml细胞系一起培养,并测定ifn-γ和cd107a(这两样都是nk细胞激活的标记物)的表达。具体而言,将npm1c+/hla-a2+的oci-aml3细胞与抗-npm1ccar-mlnk细胞共培养4小时。收集细胞并进行流式细胞术分析。对细胞进行cd56、cd107a和ifnγ染色。与未转导细胞(用il15、il12和il18刺激的mlnk细胞)相比,抗-npm1c-car-mlnk细胞显示ifn-γ和cd107a的表达增加(图8a)。在靶细胞aml存在的情况下,与未转导的细胞相比,这种表达增加表明更高的活力与nk细胞激活。
[0717]
质谱流式细胞技术允许对单个细胞的大量参数进行高通量分析,并用于人nk细胞的深层免疫表型(straussalbee(2015)scitranslmed7:297ra115;amir等人(2013)natbiotech31:545))。因此,使用nk特异性cytof面板对与npm1c+靶细胞共培养后的抗-npm1ccarmlnk细胞的表达谱进行了广泛分析(例如,见romee等人(2016)scitranslmed8:357ra123)。简而言之,抗-npm1ccarml-nk细胞或未转导的mlnk淋巴细胞与oci-aml3细胞共培养6小时。然后使用质谱流式细胞技术面板对细胞进行分析。对三名人类供体的多样性进行了评估。如前所述进行量化(diggins等人(2015)methods82:55)。如图8b所示,相对于未转导的nk细胞,carml-nk细胞中的cd107a、ifnγ和颗粒酶b增强。这些数据表明,car-nk细胞具有更强的杀伤白血病细胞的功能。如图8c所示,carml-nk细胞中的多个激活标记物(cd25、cd69、icos和cd226)增加。激活标记物cd62l也增加了(尤其是在来自一个供体的carmlnk细胞中)。这些数据表明car-nk细胞比未转导的细胞更活跃。如图8d所示,car-nk细胞中的多个激活受体(nkp30、nkg2d和nkp44)增加。总的来说,这些数据表明car-nk细胞表达的激活受体水平高于未转导的nk细胞。如图8e所示,car-nk细胞中的某些成熟标记物(cd56、nkg2a)增强,而标记物cd57降低。这些数据表明,与未转导的nk细胞相比,car-nk细胞较不成熟。如图8f所示,耗竭标记物tigit在car-nk细胞中增强。如图8g所示,car-nk细胞中的凋亡标记物trail减少,表明car-nk细胞相对于未转导的nk细胞具有更长的寿命。
[0718]
实施例6:与il-15共转导可提高抗-npm1ccar-mlnk细胞的效力
[0719]
评估与il-15共转导是否会进一步增强抗-npm1ccar-mlnk细胞的效力。慢病毒构建体的制备是为了编码一种抗-npm1ccar,该car通过p2a自裂解肽与膜结合型il-15(mil-15)或可进行分泌的可溶型il-15(sil-15)连接。mil-15包括c端cd8铰链和跨膜结构域。mil-15和sil-15的全长氨基酸序列和核苷酸序列如表5所示。制备了一种用baev糖蛋白假型化的慢病毒表达构建体,以编码抗-npm1c-mil-15或抗-npm1c-sil15(分别称为“car-m15”和“car-s15”)。当用car-m15或car-s15转导cimlnk细胞时,转导的细胞在体外保持扩增,类似于未转导(ut)细胞(图9a)。如实施例3所述,与仅用抗-npm1ccar转导的cimnlnk细胞进行比较。即使在整个扩增过程中,当通过流式细胞术在转导后第4天和第23天测量时,car的表面表达(通过蛋白质l结合百分比测量)仍保持(图9b-9c)。
[0720]
表5:具有与膜结合型il-15(mil-15)或分泌型il-15(sil-15)融合的抗-npm1ccar构建体的序列信息
[0721][0722]
接下来,比较抗-npm1c car-ml nk细胞对表达npm1c的aml靶细胞和缺乏npm1c表达的aml细胞的特异性杀伤作用。为此,研究了抗-npm1c car-ml-nk细胞除了对npm1c+细胞的效力外,是否对npm1c-aml细胞具有效力。用car-s15 lv或car-m15 lv转导ciml nk细胞。检测两株表达荧光素酶的aml细胞系的靶细胞杀伤作用;oci-aml3(npm1c+、hla-a2+、luc+)和oci-aml2(npm1c-、hla-a2+、luc+)。首先,以抗-npm1c car-ciml nk细胞与aml细胞的1:1比例共培养细胞,并在共培养后5小时收集。在与npm1c+(oci-aml3)细胞共培养的抗-npm1c car“ml nk细胞中,通过流式细胞术分析测量的ifnγ表达增加(图10a)。
[0723]
此外,通过在不同效应物与靶细胞(e:t)比率下共培养4小时来测量靶细胞(aml)的凋亡率。与npm1c阴性细胞相比,表达npm1c的效应细胞的凋亡增加(图10b)。两种car构建体均能成功诱导npm1c阳性细胞的凋亡,用annexin v流式细胞术检测显示早期凋亡。
[0724]
通过将nk细胞与每个aml细胞系共培养24小时,然后测量荧光素酶的表达,进一步检测有效的细胞杀伤作用。与仅用抗-npm1c car转导的ml nk细胞进行比较。当以不同的e:t比率培养24小时时,oci-aml3细胞(图10c的左面板)中靶细胞的存活率降低,而npm1c-oci-aml2细胞(图10c的右面板)中的存活率不受影响。此外,与il15共转导的ml nk细胞显示,相对于仅用抗-npm1c car转导的ml nk细胞,表达npm1c的靶细胞的杀伤作用增强。总之,这些结果证明了抗-npm1c car-ciml nk细胞(尤其是与il-15共转导时)对表达npm1c的aml细胞的成功效力,并且对不表达npm1c的aml细胞没有细胞毒性作用。
[0725]
对单独用car或car和mil15转导的ciml nk细胞进行进一步比较。如上所述,使用编码抗-npm1c car的baev lv在转导后72小时进行测量,发现car转导在原代人ciml nk细胞中有效(图10d)。然而,通过使用baev-lv共转导car和mil-15,相对于仅编码car的baev lv转导的细胞,观察到更强的扩增(图10e)。仅在用oci-aml靶细胞刺激4小时后,用baev转导的编码car和mil-15的ciml nk细胞中的ifn-γ和cd107a的表达与用baev转导的仅编码car的ciml nk细胞中的相似(图10f)。然而,在共培养4小时后测量时,用car和mil-15共转导的ciml nk细胞在杀死靶oci-aml3细胞方面更有效(图10g)。使用7-aad通过流式细胞术
分析测定细胞死亡。
[0726]
实施例7:抗-npm1c car-ml“nk细胞在体内证明对aml的疗效
[0727]
为了检测体内抗-npm1c car-ml nk细胞的抗白血病活性,对aml小鼠模型进行分析。如图11a所示,从健康人类供体的外周血单个核细胞中分离出nk细胞。分离后,用实施例3中所述的细胞因子培养细胞以生成ml-nk细胞。在第-10天,使用实施例3中描述的转导方法用抗-npm1c-car(seq id no:30)转导细胞。当培养细胞时,在第-7天,辐射小鼠以消除免疫细胞,并在第-5天注射1x106个aml3luc细胞。第0天,向小鼠注射nk细胞。注射包括具有约500k抗-npm1c-car ml nk细胞的1x106个细胞总量。在第3天、第10天和第13天使用荧光素酶构建体的成像测量aml负荷(图11b)。抗-npm1c car-ml nk(以及分泌型il15或膜结合型il15)治疗的小鼠在第12天显示aml负荷降低(图11c)。这些结果表明,与未转导的nk细胞相比,抗-npm1c car-ciml nk细胞在降低总体aml负荷方面具有成功的效力。
[0728]
实施例8:抗aml肿瘤的体内疗效
[0729]
car ciml nk细胞对液体和实体肿瘤的体内疗效和安全性正在得到验证。我们将评估携带npm1c-car(三种构建体)的ciml nk细胞和用相同构建体转导的car-t细胞的体内抗白血病活性。不希望受到理论的约束,我们独特的ciml-nk car方法将增强对白血病母细胞的靶向性,而不会影响正常造血干细胞和祖细胞或造成严重毒性,这曾是基于t细胞的car方法在aml中的主要挑战之一。简而言之,我们将使用先前注射luc+oci-aml3的nsg小鼠,在异种移植小鼠模型中评估其激活、增殖、持续性和疗效。动物将在过继移植后7、14、28和60天被处死,以评估体内持续性、扩增性和活性(基于生物发光肿瘤成像和存活)。我们还将评估这些细胞进入这些小鼠的关键器官(包括骨髓和脾脏)的运输/归巢情况。鉴于nk细胞耗竭是一个活跃的研究领域,因为它会对其抗肿瘤活性产生负面影响(felices等人,2018年),我们将通过我们的nk特异性cytof面板和靶标再刺激(即oci-aml3和k562)时的ifn-γ分泌来表征细胞的体内耗竭。我们还将比较il-2、il-15和il-15/il-15rα的效力,以优化过继转移的ciml car-nk细胞在nsg小鼠中的扩增和持久性。这将包括测试不同的剂量策略,以防止nk细胞耗竭。在异种移植小鼠初步优化后,我们将在dfci提供的npm1c+患者衍生异种移植(pdx)模型中验证该策略。
[0730]
我们还尝试了经典的vsvg假型慢病毒,其转导效率在常规和ciml nk细胞中非常低,仅为1-3%。例如,使用baev慢病毒,我们还比较了用不同细胞因子(il-15、il-15+il-12和il-15+il-12+il18)预激活的nk细胞的转导性能,发现后者(产生ciml nk细胞(romee等人,2016))表现最好。
[0731]
实施例9:用于癌症免疫疗法的car ml nk细胞的有利特性
[0732]
本文所述的car记忆样nk细胞与其他工程化表达tcr的nk细胞之间的差异包括,例如:
[0733]
在大多数正在进行的工程化nk细胞试验中,使用记忆样(“ciml”)原代nk细胞与其他非记忆样nk细胞或nk细胞系(例如nk92细胞系)进行比较(xie等人,2020)。另见mensali等人,2019;walseng等人,2017年。
[0734]
亲和力:我们基于scfv的car构建体对肽/mhc复合体的亲和力比其基于tcr的对应物对肽-mhc复合体的亲和力高约100倍。car与靶细胞的结合越强,nk细胞的激活越强,杀伤活性也越强。在t细胞中,tcr与肽/mhc的相互作用需要共受体,如cd4或cd8,以补偿弱结合
亲和力;相比之下,nk细胞没有完整的tcr信号传导室来理想地支持优化的信号传导和随后强健的激活和功能诱导。
[0735]
迄今为止,t细胞和nk细胞系(nk92细胞)已被转导以表达能够靶向细胞内抗原的tcr。虽然可以用tcr转导原代nk细胞和原代nk-ciml细胞,但与基于scfv的car构建体相比,它们的抗原/表位的亲和性要低得多,这种转导可能存在很大缺陷。使用基于scfv的car构建体,我们能够获得良好的转导率,并靶向细胞内抗原,这是原代nk细胞和记忆样(“ciml”)nk细胞所没有的。此外,与tcr相比,scfv的长度更短,也使我们能够在结构中添加额外的模块,如膜或分泌型il-15,同时保持较高的转导率。
[0736]
实施例10
[0737]
靶向衍生自细胞内npm1c的新表位的工程化记忆样nk car对急性髓系白血病具有强大的活性和特异性
[0738]
简介:急性髓系白血病(aml)仍然是一个治疗挑战。正在出现开发毒性更小、更有效的疗法的需求。自然杀伤细胞(nk)具有许多对有效癌症治疗至关重要的关键属性—“生来就是要杀死”,但没有明显的移植物抗宿主病风险、细胞因子释放综合征或神经毒性。此外,它们固有的靶向髓样母细胞的倾向使其对aml具有吸引力。尽管在血癌方面取得了可喜的临床结果,但由于nk细胞寿命短、增殖不足以及缺乏特定的肿瘤靶向性,以nk细胞为基础的疗法的发展仍然具有挑战性。在这里,我们利用一种新的方法来武装nk细胞用于基于固有细胞记忆的过继免疫疗法。嵌合抗原受体(car)显著增强免疫效应细胞的抗肿瘤特异性和活性。我们的car-nk细胞以aml中肿瘤特异性新表位为靶标,并在设计中利用有效的功能途径来提高疗效并使毒性最小化。
[0739]
方法:
[0740]
1.突变npm1c作为aml的car靶标。大多数car-t细胞疗法以肿瘤相关抗原(taa)为靶标,这可能导致在靶/脱肿瘤毒性以及肿瘤耐药性。克服这些缺点的一种方法是靶向肿瘤特异性致癌驱动基因突变。核磷蛋白中的四个核苷酸重复,被称为npm1c,是约35%aml中的致癌驱动基因突变。该突变产生一个新表位,由hla-a2等位基因呈递。利用酵母表面展示技术,我们分离出一个人单链可变片段(scfv),该片段特异性地结合npm1c表位-hla-a2复合物,而不是单独的hla-a2或装载对照肽的hla-a2。
[0741]
2.细胞因子诱导的记忆样(ciml)nk细胞作为car平台。基于我们在临床前模型(romee等人,blood 2012)和使用未经修饰的ciml nk细胞治疗的患者(romee等人,science trans med 2016)中观察到的良好安全性、增殖增强、持久性和抗白血病功能增强,ciml nk细胞可以为nk细胞car的发展提供独特的平台。
[0742]
3.原代nk细胞的高效基因编辑。我们利用基于ciml nk细胞上高表达的独特蛋白的非传统假型慢病毒,克服了原代人和小鼠nk细胞中的转导障碍。
[0743]
结果:
[0744]
1.含有分离的scfv的工程化car-t细胞在体外和体内对npm1c hla-a2白血病细胞(oci-aml3)和原代aml母细胞具有强大的细胞毒性作用,但对npm1c hla-a2淋巴瘤细胞(oci-aml2)或hla-a2肿瘤细胞(pc-3)无效。
[0745]
2.然而,抗-npm1c car-t细胞的体内抗白血病疗效是短暂的(与过继转移未转导的t细胞的对照小鼠相比,总存活时间从28天延长到42天,中位存活时间从21天延长到37
天),具有不可忽视的毒性。
[0746]
3.利用一种非传统的假型慢病毒转导来自健康志愿供体血液(n=5名供体)的ciml nk细胞,我们成功地生成了具有高转导效率的抗-npm1c car-nk细胞(使用moi=10:转导率平均48%,范围32%-65%;与之相比,使用vsvg假型慢病毒的传统方法的转导率为2%,范围0.8%-4.5%)。
[0747]
4.在car设计中利用关键细胞因子途径可显著提高car-nk细胞存活率(细胞存活率从29.7%提高到75.2%)和增殖率(以ki-67水平从60.2%提高到94.5%为标志)。
[0748]
5.抗-npm1c car显著促进了ciml nk细胞对具有npm1c癌基因(oci-aml3)的aml的抗肿瘤功能(以cd107a、ifnγ为代表)和肿瘤特异性杀伤(通过annexin v和7-aad测得)。
[0749]
6.具有car和细胞因子信号传导的双武装ciml nk细胞对aml靶标具有最佳特异性和可持续性。
[0750]
结论:这些结果表明,新型car-ciml nk细胞可作为治疗npm1c+hla-a2+aml的有效细胞免疫疗法,具有潜在降低的在靶/脱肿瘤毒性和肿瘤耐药性。我们的研究将推动临床上针对髓系恶性肿瘤的car-nk细胞疗法的新概念和设计。
[0751]
我们开发了新的基因构建体,以靶向衍生自npm1c的新表位,npm1c是发生在30%aml中驱动癌基因突变。
[0752]
利用非传统的假型慢病毒和记忆样nk细胞作为car开发平台,我们优化了体外生成npm1c-car-nk细胞的转导方法(转导率~50%)。
[0753]
car-nk细胞对npm1c+aml细胞具有强大的特异性作用。
[0754]
使用异种移植小鼠模型的初步结果支持体内car-nk细胞具有强大的抗白血病功效(尤其是对于膜结合型il-15的构建体)。
[0755]
安全性:
[0756]
即使不匹配的自然杀伤(nk)细胞也不会导致严重gvhd
[0757]
nk细胞car是安全的(无crs/无神经毒性),其应答率与cll中的car t细胞相似(liu等人,nejm,2020)。
[0758]
疗效:
[0759]
car t细胞在aml/mds中的疗效有限
[0760]
第一阶段试验中记忆样nk细胞对aml的强大反应(romee等人,stm,2016)
[0761]
携带car的记忆样nk细胞对髓系母细胞的双重靶向作用(抗原表达触发car而hla缺失触发直接nk细胞细胞毒性)
[0762]
序列
[0763]
[0764]
[0765]
[0766]
[0767]
[0768]
[0769]
[0770]
[0771]
[0772]
[0773]
[0774]
[0775][0776]
其他参考
[0777]
greiner j,ono y,hofmann s,schmitt a,mehring e,m,guillaume p,k,mytilineos j,h,schmitt m.mutated regions of nucleophosmin 1elicit both cd4+and cd8+t-cell responses in patients with acute myeloid leukemia.blood.2012;120(6):1282
–
1289.
[0778]
greiner j,schneider v,schmitt m,m,k,wiesneth m,h,hofmann s.immune responses against the mutated region of cytoplasmatic npm1 might contribute to the favorable clinical outcome of aml patients with npm1 mutations(npm1mut).blood.2013;122(6):1087
–
8.
[0779]
felices m,lenvik aj,mcelmurry r,chu s,hinderlie p,bendzick l,geller ma,tolar j,blazar br,miller js.continuous treatment with il-15exhausts human nk cells via a metabolic defect.jci insight.2018;3(3).
[0780]
kohn,d.b.&hollis,r.p.envelope,please.and the award goes to.blood 124,1203-1204(2014).
[0781]
bald,t.,krummel,m.f.,smyth,m.j.,&barry,k.c.(2020).the nk cell-cancer cycle:advances and new challenges in nk cell-based immunotherapies.nat immunol,21(8),835-847.doi:10.1038/s41590-020-0728-z
[0782]
chan,c.j.,smyth,m.j.,&martinet,l.(2014).molecular mechanisms of natural killer cell activation in response to cellular stress.cell death differ,21(1),5-14.doi:10.1038/cdd.2013.26
[0783]
chiossone,l.,dumas,p.y.,vienne,m.,&vivier,e.(2018).natural killer cells and other innate lymphoid cells in cancer.nat rev immunol,18(11),671-688.doi:10.1038/s41577-018-0061-z
[0784]
felices,m.,lenvik,a.j.,mcelmurry,r.,chu,s.,hinderlie,p.,bendzick,l.,...miller,j.s.(2018).continuous treatment with il-15exhausts human nk cells via a metabolic defect.jci insight,3(3).doi:10.1172/jci.insight.96219
[0785]
hashimoto,n.,tsuboi,a.,kagawa,n.,chiba,y.,izumoto,s.,kinoshita,m.,...sugiyama,h.(2015).wilms tumor 1 peptide vaccination combined with temozolomide against newly diagnosed glioblastoma:safety and impact on immunological response.cancer immunol immunother,64(6),707-716.doi:10.1007/s00262-015-1674-8
[0786]
romee,r.,rosario,m.,berrien-elliott,m.m.,wagner,j.a.,jewell,b.a.,schappe,t.,...fehniger,t.a.(2016).cytokine-induced memory-like natural killer cells exhibit enhanced responses against myeloid leukemia.sci transl med,8(357),357ra123.doi:10.1126/scitranslmed.aaf2341
[0787]
smith,c.c.,wang,q.,chin,c.s.,salerno,s.,damon,l.e.,levis,m.j.,...shah,n.p.(2012).validation of itd mutations in flt3 as atherapeutic target in human acute myeloid leukaemia.nature,485(7397),260-263.doi:10.1038/nature11016
[0788]
thomas,r.,al-khadairi,g.,roelands,j.,hendrickx,w.,dermime,s.,bedognetti,d.,&decock,j.(2018).ny-eso-1based immunotherapy of cancer:current perspectives.front immunol,9,947.doi:10.3389/fimmu.2018.0094
[0789]
wang,e.,&aifantis,i.(2020).rna splicing and cancer.trends cancer,6(8),631-644.doi:10.1016/j.trecan.2020.04.011
[0790]
xie,g.,dong,h.,liang,y.,ham,j.d.,rizwan,r.,&chen,j.(2020).car-nk cells:a promising cellular immunotherapy for cancer.ebiomedicine,59,102975.doi:10.1016/j.ebiom.2020.102975
[0791]
mensali,n.,dillard,p.,hebeisen,m.,lorenz,s.,theodossiou,t.,myhre,m.r.,...walchli,s.(2019).nk cells specifically tcr-dressed to kill cancer cells.ebiomedicine,40,106-117.doi:10.1016/j.ebiom.2019.01.031
[0792]
walseng,e.,koksal,h.,sektioglu,i.m.,fane,a.,skorstad,g.,kvalheim,g.,...walchli,s.(2017).a tcr-based chimeric antigen receptor.sci rep,7(1),10713.doi:10.1038/s41598-017-11126-y
[0793]
等效物
[0794]
本领域技术人员将认识到或能够确定,仅使用常规实验,本文所述特定物质和程序的众多等效物。这些等效物被认为在本发明的范围内,并包含在以下权利要求中。
[0795]
援引并入
[0796]
本文引用的所有参考文献,如专利、专利申请和出版物的披露,在此以引用的方式纳入全文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1