用于图像引导的放疗的方法与流程
1.本公开涉及用于治疗肿瘤的方法。特别地,本公开涉及在有需要的受试者中通过磁共振图像引导的放疗治疗肿瘤的方法,所述方法包括以下步骤:
2.(i)向有需要的受试者施用有效量的含有高z元素的纳米颗粒,所述纳米颗粒具有用于磁共振成像的对比度增强和/或用于放疗的放射增敏特性,和
3.(ii)借助于磁共振成像引导的线性加速器(mr-linac)将所述受试者暴露于磁共振图像引导的放疗,
4.其中所述含有高z元素的纳米颗粒是含有原子z数高于40,优选高于50的元素的纳米颗粒,并且所述纳米颗粒具有20nm或更小,例如1-10nm,优选2-8nm的平均流体动力学直径。
背景技术:
5.放射疗法(也称为放疗)是最常用的抗肿瘤策略之一。所有癌症患者的一半以上用单独的电离辐射(ir)或与手术或化疗联合治疗。在医学物理学中实现的最近进展(随着低/高能量放射的发展,单-、低-或高-分割时间表的实施和所用剂量率的多样化)和创新医学技术(例如3d-构象放疗(3d-crt)、调强放疗(imrt)、立体定向放射外科(srs)和功能成像)的发展有助于更好地将有效剂量的放射递送到肿瘤上,同时保留周围的健康组织,这是放疗最常见的副作用。
6.将磁共振(mr)扫描器与线性加速器组合在单个机器中是最近的发展,其可以极大地改进癌症放疗的结果。特别地,mr成像提供了改进肿瘤勾画的机会,特别是对于软组织癌症。同时进行mr成像和电离辐射治疗的可能性允许考虑肿瘤随时间的空间演变。此外,实时mr成像可以补偿由于呼吸而处于危险中的肿瘤和器官的运动。
7.但是,这些新兴治疗方案的一个限制是市场上销售的造影剂难以在那种情况下使用。它们在肿瘤中具有短的剩磁(remanence),这意味着,为了提高实时成像的对比度,必须在每次放疗之前进行一次注射。除了给患者和护理者产生过度负担之外,这可能是安全问题,因为已经开发并验证了市售造影剂对患者的有限暴露。
8.因此,需要改进使用mr图像引导的放疗的方案。
9.本发明人出乎意料地发现,某些含有高z元素的纳米颗粒在肿瘤内为mr成像和/或放射增敏特性提供合适的对比度,持续数天。这种纳米颗粒在人肿瘤中的这种出乎意料长的剩磁使得发明人能够设计将磁共振图像引导的放疗与使用这种含有高z元素的纳米颗粒作为造影剂和/或放射增敏剂组合的新的治疗策略,其中纳米颗粒的单次施用使得磁共振图像引导的放疗的多个部分能够用于治疗有需要的受试者中的肿瘤。
10.发明概述
11.因此,本公开涉及含有高z元素的纳米颗粒,其用于在有需要的受试者中治疗肿瘤的方法,所述方法包括:
12.(i)向有需要的受试者施用有效量的含有高z元素的纳米颗粒,所述纳米颗粒具有
用于磁共振成像的对比度增强和/或用于放疗的放射增敏特性,和
13.(ii)借助于磁共振成像引导的线性加速器(mr-linac)将所述受试者暴露于磁共振图像引导的放疗,
14.其中所述含有高z元素的纳米颗粒是含有原子z数高于40,优选高于50的元素的纳米颗粒,并且所述纳米颗粒具有20nm或更小,例如1-10nm,优选2-8nm的平均流体动力学直径。
15.在某些实施方案中,所述mr-linac优选选自具有0.5t的磁场强度场或更低强度场(例如0.35t)的mr-linac。
16.在某些实施方案中,所述纳米颗粒包含稀土金属或稀土金属的混合物作为高z元素。例如,所述纳米颗粒可以包含钆、铋或它们的混合物作为高z元素。
17.在某些实施方案中,所述纳米颗粒包含高z元素的螯合物,例如稀土元素的螯合物。典型地,所述纳米颗粒包含:
18.(i)聚有机硅氧烷,
19.(ii)与所述聚有机硅氧烷共价结合的螯合物,
20.(iii)被所述螯合物络合的高z元素。
21.在具体实施方案中,所述纳米颗粒包含:
22.(i)聚有机硅氧烷,其硅重量比为纳米颗粒总重量的至少8%,优选8%-50%,
23.(ii)与所述聚有机硅氧烷共价结合的螯合物,其比例为每个纳米颗粒5-100个,优选5-20个,和
24.(iii)与所述螯合物络合的高z元素。
25.在某些实施方案中,所述纳米颗粒包含用于络合高z元素的螯合物,其通过在所述纳米颗粒上接枝一种或多种以下螯合剂获得:dota、dtpa、edta、egta、bapta、nota、dotaga和dtpaba,或它们的混合物。
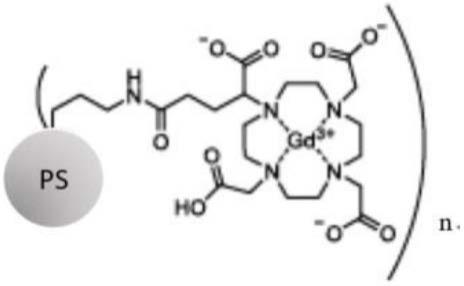
26.在特别优选的实施方案中,所述纳米颗粒是钆螯合聚硅氧烷纳米颗粒,更优选为下式:
[0027][0028]
其中ps是聚硅氧烷的基质,并且,
[0029]
n为5-50,优选5-20,并且其中流体动力学直径为1-10nm,例如2-8nm。
[0030]
在某些实施方案中,所述治疗方法包括第一肿瘤预填充步骤,其包括在第一次暴露于放疗之前的2-10天,优选2-7天的时间内向有需要的所述受试者施用有效量的所述含高z元素的纳米颗粒作为放射增敏剂。
[0031]
有利地,所述受试者可以暴露于磁共振图像引导的放疗的至少一个或多个附加疗
程,而无需进一步施用用于磁共振成像的造影剂。
[0032]
典型地,在单次施用有效量的所述含高z纳米颗粒之后,将所述受试者暴露于2个或更多个磁共振图像引导的放疗疗程,例如2-7个疗程。在更具体的实施方案中,所述受试者在5-7天内暴露于2个或更多个磁共振图像引导的放疗疗程,典型地在每个疗程之间具有2或3天的最小时间线。
[0033]
在某些实施方案中,受试者暴露于约3gy-约20gy的磁共振图像引导的放疗的每疗程电离辐射剂量,并且总剂量优选以最多10次,例如1-10次施用。
[0034]
通过本公开的方法靶向的肿瘤可以是实体瘤,优选选自
[0035]
·
子宫颈癌、直肠癌、肺癌、头颈癌、前列腺癌、结肠直肠癌、肝癌和胰腺癌的原发性肿瘤,和
[0036]
·
骨转移,典型地经历分次内运动(intrafraction movement),例如胸骨。
[0037]
在某些实施方案中,所述纳米颗粒以浓度50-150mg/ml,优选80-120mg/ml,例如100mg/ml作为可注射溶液施用,优选通过静脉内注射。例如,对于磁共振图像引导的放疗施用的治疗有效量为50mg/kg-150mg/kg,典型为80-120mg/kg,例如100mg/kg。
附图说明
[0038]
图1.mri增强vs施用剂量。图表上的每个点对应于在最长直径大于1cm的转移灶中测量的mri增强值。在每个剂量、合并的15-30mg/kg剂量、合并的50-75mg/kg和100mg/kg之间发现mri增强具有统计学差异。
[0039]
图2.mri增强vs aguix浓度。图表上的每个点对应于mri增强和在患者#13的最长直径大于1cm的转移灶中测量的aguix浓度值。黑色曲线对应于应用于一系列点的线性回归。虚线曲线对应于95%的置信带。
[0040]
图3.施用纳米颗粒后一周的mri增强。将患者#13的部分信号增强图(颜色编码)叠加到向患者静脉注射后2小时(左侧图像)和一周后(右侧图像)获得的原始3d t1加权图像上。箭头指向aguix增强的转移灶。
[0041]
图4.使用来自viewray的mridian的multihance(a)和aguix(b)的mri阳性信号。
[0042]
图5.使用来自viewray的mridian的multihance和aguix的信号强度。
[0043]
图6.aguix(a)和bi-aguix(50/50)(b)的mri信号的比较。
[0044]
图7.使用来自viewray的mridian定量平均信号强度(c)。
[0045]
图8.静脉内施用aguix纳米颗粒后,使用来自viewray和truefisp(a)或t1加权(b)的mridian对皮下nsclc肿瘤成像(肿瘤以白色圈出)。肿瘤内施用aguix纳米颗粒后,使用来自viewray和truefisp序列(c)的mridian对皮下nsclc肿瘤成像。
[0046]
发明详述
[0047]
本公开部分源于如发明人所显示的令人惊讶的发现,即某些纳米颗粒在人肿瘤中长期剩磁,以及它们用作mr造影剂和/或放射增敏剂在用mr图像引导的放疗的多个疗程的癌症治疗中的优势。
[0048]
如本文所用,术语“造影剂”旨在表示在医学成像中使用的任何产品或组合物,其目的是人为地增加造影,从而可以可视化相对于相邻或非病理结构的特定的解剖结构(例如某些组织或器官)或病理解剖结构(例如肿瘤)。术语“成像剂”旨在表示在医学成像中使
用的任何产品或组合物,其目的是产生使得可以可视化相对于相邻或非病理性结构的特定的解剖结构(例如某些组织或器官)或病理解剖结构(例如肿瘤)的信号(下文也称为对比度增强)。造影剂或成像剂如何工作的原理取决于所使用的成像技术。
[0049]
使用磁共振成像(mri)、计算机断层扫描成像、正电子发射断层扫描成像或它们的任何组合来进行成像。如本文所用,术语“mr造影剂”是指能够增强磁共振成像中的对比度的造影剂。
[0050]
如本文所用,术语“放射增敏”将容易被本领域普通技术人员理解并且通常指增加癌细胞对放疗(例如,光子辐射、电子辐射、质子辐射、重离子辐射等)的过敏性的过程。
[0051]
用于本公开的治疗方法中的含有高z的纳米颗粒
[0052]
不受任何特定理论的束缚,据信本公开的治疗方法的有利效果特别与纳米颗粒的两个特征相关:
[0053]
(i)它们含有高z元素,典型地是具有用于mr成像的放射增敏特性和/或对比度增强特性的高z阳离子络合物;
[0054]
(ii)它们的平均流体动力学直径较小。
[0055]
如本文所用,所述高z元素是原子z数高于40,例如高于50的元素。
[0056]
在具体实施方案中,所述高z元素选自重金属,更优选au、ag、pt、pd、sn、ta、zr、tb、tm、ce、dy、er、eu、la、nd、pr、lu、yb、bi、hf、ho、pm、sm、in和gd,以及它们的混合物。
[0057]
高z元素优选为阳离子元素,或者作为氧化物和/或硫属化物或卤化物包含在纳米颗粒中,或者作为与螯合剂(诸如有机螯合剂)的络合物。
[0058]
纳米颗粒的粒度分布例如使用商业粒度仪测量,诸如基于pcs(光子相关光谱)的malvern z
ê
tasizer nano-s粒度仪。
[0059]
为了本公开的目的,术语“平均流体动力学直径”或“平均直径”旨在表示颗粒直径的调和平均值。标准iso 13321:1996中也描述了测量该参数的方法。
[0060]
具有例如20nm或更小,特别是1-10nm,甚至更优选1-8nm或例如2-8nm,或通常约5nm的平均流体动力学直径的纳米颗粒适用于本文公开的方法。特别地,它们已被证明在静脉注射后在肿瘤中提供优异的被动靶向作用,和快速肾脏消除(因此毒性低)。
[0061]
优选地,所述纳米颗粒包含至少50重量%的钆(gd)、镝(dy)、镥(lu)、铋(bi)或钬(ho),或它们的混合物,(相对于纳米颗粒中高z元素的总重量),例如至少50重量%的钆,作为纳米颗粒中的高z元素。
[0062]
在特别优选的实施方案中,用于本公开的方法的所述纳米颗粒是基于钆的纳米颗粒。
[0063]
在具体实施方案中,所述高z元素是与有机螯合剂络合的阳离子元素,例如选自具有羧酸、胺、硫醇或膦酸酯基团的螯合剂。
[0064]
在优选实施方案中,除了高z元素和任选的螯合剂之外,纳米颗粒还包含生物相容性涂层。适用于这种生物相容性的试剂包括但不限于生物相容性聚合物,诸如聚乙二醇、聚环氧乙烷、聚丙烯酰胺、生物聚合物、多糖或聚硅氧烷。
[0065]
在具体实施方案中,选择纳米颗粒,使得它们每个颗粒的弛豫度r1为50-5000mm-1
.s-1
(在37℃和1.4t下)和/或gd重量比为至少5%,例如5%-30%。
[0066]
在一个具体实施方案中,具有非常小的流体动力学直径,例如1-10nm,优选2-8nm
的所述纳米颗粒是包含高z元素的螯合物,例如稀土元素的螯合物的纳米颗粒。在某些实施方案中,所述纳米颗粒包含钆或铋的螯合物。
[0067]
在可以与任何前述实施方案组合的具体实施方案中,所述含有高z元素的纳米颗粒包含:
[0068]
·
聚有机硅氧烷,
[0069]
·
与所述聚有机硅氧烷共价结合的螯合物,
[0070]
·
被所述螯合物络合的高z元素。
[0071]
如本文所用,术语“螯合剂”是指能够络合一种或多种金属离子的一个或多个化学部分。
[0072]
示例性螯合剂包括但不限于1,4,7-三氮杂环壬烷三乙酸(nota)、1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(dota)、1,4,7-三氮杂环壬烷-l-戊二酸-4,7-二乙酸(nodaga)、乙二胺四乙酸(edta)、二亚乙基三胺五乙酸(dtpa)、环己基-l,2-二胺四乙酸(cdta)、乙二醇-0,0'-双(2-氨基乙基)-n,n,n',n'-四乙酸(egta)、n,n-双(羟基苄基)-乙二胺-n,n'-二乙酸(hbed)、三乙烯四胺六乙酸(ttha)、羟基乙二胺三乙酸(hedta)、1,4,8,11-四氮杂环十四烷-n,n',n",n"'-四乙酸(teta)和1,4,7,10-四氮杂-1,4,7,10-四-(2-氨基甲酰基甲基)-环十二烷(tcmc)和1,4,7,10-四氮杂环十二烷,1-(戊二酸)-4,7,10-三乙酸(dotaga)。
[0073]
在优选实施方案中,所述螯合剂选自以下:
[0074][0075]
其中波浪键表示将螯合剂连接到形成纳米颗粒的生物相容性涂层的连接基团的键。
[0076]
在可优选与前述实施方案组合的具体实施方案中,所述稀土元素螯合物是钆和/或铋的螯合物,优选dota或dotaga螯合gd
3+
和/或bi
3+
。在更具体的实施方案中,所述稀土元素螯合物是钆和铋的螯合物,其中(钆的摩尔数)/(铋的摩尔数)之比等于1。
[0077]
在具体和优选的实施方案中,每个纳米颗粒的高z元素的比例,例如每个纳米颗粒的稀土元素,例如钆(任选与dotaga螯合)的比例为3-100个,优选5-50个,例如5-20个,典型为约10个。在这样的比例下,即使当与具有低磁场强度(例如0.35t或0.5t mr-linac)的mr-linac一起使用时,纳米颗粒对于mr成像具有优异的弛豫性和对比度增强特性。
[0078]
在具体实施方案中,杂化纳米颗粒为核-壳型。基于由稀土氧化物和任选官能化的聚有机硅氧烷基质组成的核的核-壳型纳米颗粒是已知的(特别参见wo2005/088314、wo2009/053644)。
[0079]
纳米颗粒可以进一步用允许纳米颗粒靶向特定组织的分子功能化。所述试剂可以通过共价偶联而偶联至纳米颗粒,或通过非共价键合而捕获,例如通过包封或亲水/疏水相互作用或使用螯合剂。
8nm,典型为2-6nm的所述超细纳米颗粒。
[0100]
关于这些超细或无核纳米颗粒、合成它们的方法及其用途的进一步细节描述于专利申请wo2011/135101、wo2018/224684或wo2019/008040中,其以引用方式并入。
[0101]
获得用于本公开治疗方法的纳米颗粒的优选实施方案的方法
[0102]
通常,本领域技术人员将能够容易地生产根据本公开使用的纳米颗粒。更具体地说,将注意到以下元素:
[0103]
对于基于镧系元素氧化物或羟基氧化物的核的核-壳型纳米颗粒,将使用以醇为溶剂的生产方法,例如如p.perriat et al.,j.coll.int.sci,2004,273,191;o.tillementet al.,j.am.chem.soc.,2007,129,5076and p.perriat et al.,j.phys.chem.c,2009,113,4038中所描述。
[0104]
对于pos基质,可以使用若干衍生自stoeber(stoeber,w;j.colloid interf sci1968,26,62)创建的那些的技术。也可以使用如louis等(louis et al.,2005,chemistryof materials,17,1673-1682)或国际申请wo 2005/088314中所描述的用于涂覆的方法。
[0105]
在实践中,例如超细纳米颗粒的合成在mignot et al chem.eur.j.2013,19,6122-6136中描述:典型地,核/壳型的前体纳米颗粒由镧系元素氧化物核(通过修饰的多元醇途径)和聚硅氧烷壳(通过溶胶/凝胶)形成;该物体具有例如约5-10nm的流体动力学直径。
[0106]
因此,可以通过以下出版物中描述的方法之一,在醇中生产尺寸非常小的镧系元素氧化物核(可调节至小于10nm):p.perriat et al.,j.coll.int.sci,2004,273,191;o.tillement et al.,j.am.chem.soc.,2007,129,5076和p.perriat et al.,j.phys.chem.c,2009,113,4038。
[0107]
例如,这些核可以根据以下出版物中所描述的方案涂有聚硅氧烷层:c.louiset al.,chem.mat.,2005,17,1673和o.tillement et al.,j.am.chem.soc.,2007,129,5076。
[0108]
将对于预期金属阳离子而言特定的螯合剂(例如,gd
3+
的dotaga)接枝到聚硅氧烷的表面;也可以将其一部分插入层内,但是控制聚硅氧烷的形成是复杂的,并且简单的外部接枝以这些非常小的尺寸提供了足够的接枝比例。
[0109]
通过透析或切向过滤的方法,在包含适当大小的孔的膜上将纳米颗粒与合成残余物分离。
[0110]
核会因溶解(例如,通过改变ph值或将络合分子引入溶液中)而破坏。然后,核的这种破坏允许聚硅氧烷层的散射(根据缓慢的侵蚀或坍塌的机理),这使得最终可以得到具有复杂形态的聚硅氧烷物体,其特征尺寸约为聚硅氧烷层厚度的大小,即远小于目前为止生产的物体。
[0111]
因此,去除核使得可以将粒径从直径约5-10纳米降低至8nm以下,例如2-8nm。此外,与相同尺寸但仅在表面包含m(例如钆)的理论聚硅氧烷纳米颗粒相比,该操作使得可以增加每nm3的m(例如钆)数。可以通过由edx测量的m/si原子比来评估纳米尺寸的m数。典型地,每个超细纳米颗粒的该m数为5-50。
[0112]
在一个具体实施方案中,根据本发明的纳米颗粒包含具有酸功能的螯合剂,例如dota或dotaga。例如,在适当量的靶分子存在下,使用edc/nhs(1-乙基-3-(3-二甲基氨基丙
基)碳二亚胺/n-氢琥珀酰亚胺)激活纳米颗粒的酸功能。例如,然后通过切向过滤来纯化如此接枝的纳米颗粒。
[0113]
或者,根据本公开的纳米颗粒可以通过合成方法(“一锅法”)获得或可获得,其包括将至少一种在生理ph下带负电荷的羟基硅烷或烷氧基硅烷和至少一种选自聚氨基多元羧酸的螯合剂与以下混合:
[0114]-至少一种在生理ph下呈中性的羟基硅烷或烷氧基硅烷,和/或
[0115]-至少一种在生理ph下带正电荷并包含氨基官能团的羟基硅烷或烷氧基硅烷,
[0116]
其中:
[0117]-中性硅烷与带负电荷的硅烷的摩尔比a定义如下:0≤a≤6,优选0.5≤a≤2;
[0118]-带正电荷的硅烷与带负电荷的硅烷的摩尔比b定义如下:0≤b≤5,优选0.25≤b≤3;
[0119]-中性和带正电的硅烷与带负电的硅烷的摩尔比c定义如下:0≤c≤8,优选1≤c≤4。
[0120]
根据这种一锅法合成方法的一个更具体实施方案,该方法包括将至少一种在生理ph下带负电的烷氧基硅烷(所述烷氧基硅烷选自aptes-dotaga、taned、cest及其混合物)与以下混合:
[0121]-至少在生理ph下呈中性的烷氧基硅烷,所述烷氧基硅烷选自tmos、teos及其混合物,和/或
[0122]-在生理ph下带正电荷的aptes,
[0123]
其中:
[0124]-中性硅烷与带负电荷的硅烷的摩尔比a定义如下:0≤a≤6,优选0.5≤a≤2;
[0125]-带正电荷的硅烷与带负电荷的硅烷的摩尔比b定义如下:0≤b≤5,优选0.25≤b≤3;
[0126]-中性和带正电的硅烷与带负电的硅烷的摩尔比c定义如下:0≤c≤8,优选1≤c≤4。
[0127]
根据一个具体实施方案,一锅法合成方法包括将在生理ph下带负电的aptes-dotaga与以下混合:
[0128]-至少一种在生理ph下呈中性的烷氧基硅烷,所述烷氧基硅烷选自tmos、teos及其混合物,和/或
[0129]-在生理ph下带正电荷的aptes,
[0130]
其中:
[0131]-中性硅烷与带负电荷的硅烷的摩尔比a定义如下:0≤a≤6,优选0.5≤a≤2;
[0132]-带正电荷的硅烷与带负电荷的硅烷的摩尔比b定义如下:0≤b≤5,优选0.25≤b≤3;
[0133]-中性和带正电的硅烷与带负电的硅烷的摩尔比c定义如下:0≤c≤8,优选1≤c≤4。
[0134]
aguix纳米颗粒
[0135]
在特别优选的实施方案中,所述基于钆螯合聚硅氧烷的纳米颗粒是下式的超细aguix纳米颗粒:
[0136][0137]
其中ps是聚硅氧烷,n平均为约10,并且流体动力学直径为4
±
2nm,并且质量为约10
±
1kda。
[0138]
所述aguix纳米颗粒也可以用平均化学式来描述:
[0139]
(gdsi
3-8c24-34n5-8o15-30h40-60
,1-10h2o)n[0140]
用于根据所公开方法的纳米颗粒的药物制剂
[0141]
当用作药物时,本文提供的用于其用途的包含所述高z纳米颗粒的组合物可以以纳米颗粒悬浮液的药物制剂的形式施用。这些制剂可以如本文或别处所述制备,并且取决于是否需要局部或全身治疗以及取决于待治疗的区域,可以通过多种途径施用。
[0142]
特别地,如本文所述使用的所述药物制剂含有作为活性成分的本文提供的含有高z纳米颗粒的混悬液以及一种或多种药学上可接受的载体(赋形剂)。在制备本文提供的药物制剂中,纳米颗粒组合物可以例如与赋形剂混合或被赋形剂稀释。当赋形剂用作稀释剂时,它可以是固体、半固体或液体材料,其用作纳米颗粒组合物的媒介物、载体或介质。
[0143]
因此,药物制剂可以是粉末、锭剂、酏剂、混悬剂、乳剂、溶液、糖浆、气雾剂(作为固体或液体介质)、无菌注射溶液、无菌包装粉末等形式。
[0144]
在具体实施方案中,如本文所述使用的所述药物制剂是包含在预填充小瓶中的冻干粉末,以例如在水溶液中重构以用于静脉内注射。在具体实施方案中,所述冻干粉末包含作为活性成分的如本文所述的有效量的所述含有高z的纳米颗粒,典型是基于钆螯合聚硅氧烷的纳米颗粒,并且更具体地,aguix纳米颗粒。在某些具体实施方案中,所述冻干粉末含有每瓶约200mg-15g,例如每瓶280-320mg aguix,典型是每瓶300mg aguix或约800mg-1200mg,例如每瓶1g aguix。
[0145]
这种粉末还可包含一种或多种附加赋形剂,特别是cacl2,例如0.5-0.80mg cacl2,典型是0.66mg cacl2。
[0146]
所述冻干粉末可以在水溶液中,典型是注射用水中重构。因此,在具体实施方案中,根据本公开使用的所述药物溶液是注射用溶液,其包含作为活性成分的如本文所述的有效量的所述含有高z的纳米颗粒,典型是基于钆螯合聚硅氧烷的纳米颗粒并且特别是aguix纳米颗粒。
[0147]
例如,用于本文公开的方法的所述注射用溶液是基于钆螯合聚硅氧烷的纳米颗粒的溶液,典型为aguix纳米颗粒,浓度为50-150mg/ml,例如80-120mg/ml,典型为100mg/ml,任选地包含一种或多种另外的药学上可接受的赋形剂,例如0.1-0.3mg/ml的cacl2,典型地0.22mg/ml的cacl2。
[0148]
本公开的治疗方法
[0149]
本公开涉及在有需要的受试者中治疗肿瘤的方法,所述方法包括:
[0150]
(i)向有需要的受试者施用有效量的含有高z元素的纳米颗粒,所述纳米颗粒具有用于磁共振成像的对比度增强和/或用于放疗的放射增敏特性,和
[0151]
(ii)借助于mr-linac将所述受试者暴露于磁共振图像引导的放疗,
[0152]
其中所述含有高z元素的纳米颗粒是含有原子z数高于40,优选高于50的元素的纳米颗粒,并且所述纳米颗粒具有20nm或更小,例如1-10nm,优选2-8nm的平均流体动力学直径。
[0153]
本公开还涉及用于在有需要的受试者中治疗肿瘤的方法中的含高z元素的纳米颗粒,所述方法包括:
[0154]
(i)向有需要的受试者施用有效量的含有高z元素的纳米颗粒,所述纳米颗粒具有用于磁共振成像的对比度增强和/或用于放疗的放射增敏特性,和
[0155]
(ii)借助于mr-linac将所述受试者暴露于磁共振图像引导的放疗,
[0156]
其中所述含有高z元素的纳米颗粒是含有原子z数高于40,优选高于50的元素的纳米颗粒,并且所述纳米颗粒具有20nm或更小,例如1-10nm,优选2-8nm的平均流体动力学直径。
[0157]
本公开还涉及包含高z元素的纳米颗粒,其用于制备用于在有需要的受试者中治疗肿瘤的药物,所述治疗包括
[0158]
(i)向有需要的受试者施用有效量的含有高z元素的纳米颗粒,所述纳米颗粒具有用于磁共振成像的对比度增强和/或用于放疗的放射增敏特性,和
[0159]
(ii)借助于mr-linac将所述受试者暴露于磁共振图像引导的放疗,
[0160]
其中所述含有高z元素的纳米颗粒是含有原子z数高于40,优选高于50的元素的纳米颗粒,并且所述纳米颗粒具有低于20nm,例如1-10nm,优选低于8nm,更优选2-8nm的平均流体动力学直径。
[0161]
如本文所用,术语“含有高z元素的纳米颗粒”是指之前章节中所述的纳米颗粒。
[0162]
在优选实施方案中,所述含有高z元素的纳米颗粒具有磁共振成像(mri)的对比度增强和放射增敏特性。在这点上,用于本公开的治疗方法中的优选实施方案是超细纳米颗粒,并且更优选的实施方案是aguix纳米颗粒,如之前章节中所述,其被动靶向肿瘤并且显示对于mr成像特别良好的对比度增强,显著的放射增敏性质。
[0163]
如本文所用,术语“治疗(treating)”或“治疗(treatment)”是指以下一项或多项:(1)抑制疾病;例如,抑制正在经历或表现出疾病、病症或失调的病理学或症状学的个体的疾病、病症或失调(即,阻止病理学和/或症状学的进一步发展);和(2)改善疾病;例如,改善正在经历或表现出疾病、病症或失调的病理学或症状学的个体的疾病、病症或失调(即,逆转病理学和/或症状学),诸如降低疾病的严重性或降低或减轻疾病的一种或多种症状。特别地,关于肿瘤的治疗,术语“治疗”可以指抑制肿瘤的生长,或减小肿瘤的尺寸。
[0164]
本文可互换使用的术语“患者”和“受试者”是指动物界的任何成员,包括哺乳动物和无脊椎动物。例如,小鼠、大鼠、其他啮齿动物、兔、狗、猫、猪、牛、羊、马、灵长类动物、鱼和人。优选地,受试者是哺乳动物或人,包括例如患有肿瘤的受试者。
[0165]
在具体实施方案中,所述肿瘤是实体瘤。
[0166]
显然,使用mr图像引导的放疗和之前章节中所述的纳米颗粒的本方法能够更好地
可视化和跟踪病变,允许将通过放疗治疗的肿瘤的体积最大化,同时将对健康组织的有害影响最小化。
[0167]
该方法特别适用于治疗受分次间和分次内运动影响的部位(如胸部、腹部和骨盆)中的肿瘤。
[0168]
因此,在一个优选实施方案中,所述肿瘤位于一个或多个以下部位:
[0169]
·
腹部,特别是寡转移(oligometastases)、胰腺/十二指肠、肝胆管、胃、肉瘤或腹部其他部位
[0170]
·
骨盆和下肢,特别是下胃肠道、前列腺、膀胱、寡转移、四肢,
[0171]
·
头颈和脑,以及中枢神经系统,
[0172]
·
胸部,特别是肺和纵隔、食管、寡转移、骨、乳房。
[0173]
在一个具体实施方案中,所述实体瘤选自:
[0174]
(i)子宫颈癌、直肠癌、肺癌、乳腺癌、头颈癌、前列腺癌、膀胱癌、结肠直肠癌、肝癌和胰腺癌的原发性肿瘤,或
[0175]
(ii)骨或肝转移,典型是经历分次内运动的骨转移,如胸骨。
[0176]
本公开的用于治疗癌症的方法包括向受试者的肿瘤施用有效量的如上所述的所述含高z纳米颗粒的步骤。施用的量应足以在mr图像引导的放疗期间将纳米颗粒用作mr成像造影剂和/或放射增敏剂。优选地,纳米颗粒以足够的量施用,以在mr图像引导的放疗中组合用作mr成像造影剂和放射增敏剂。
[0177]
纳米颗粒可以使用不同的可能途径施用于受试者,诸如局部(肿瘤内(it)、动脉内(ia))、皮下、静脉内(iv)、皮内、气道(吸入)、腹膜内、肌内、鞘内、眼内或口服途径。
[0178]
在具体实施方案中,纳米颗粒是静脉内施用的。实际上,本文公开的含高z纳米颗粒通过被动靶向,例如通过增强的渗透性和滞留效应,有利地靶向人肿瘤。
[0179]
纳米颗粒可以在施用第一疗程放疗之前例如5分钟,15分钟,30分钟,45分钟,1小时,2小时,4小时,6小时,12小时或24小时施用于具有待治疗肿瘤的受试者。
[0180]
在一个具体实施方案中,在该方法之前可以进行一个或多个疗程的放疗,而不使用任何放射增敏剂。这可用于例如前列腺癌,其中进行靶向前列腺的一种或多种放疗,然后施用作为放射增敏剂的纳米颗粒并通过磁共振图像引导的放疗更具体将辐射递送至肿瘤。
[0181]
在另一个具体实施方案中,所述方法包括肿瘤的第一肿瘤预填充步骤。
[0182]
这样的预填充步骤包括在第一次暴露于放疗之前的2-10天,优选2-7天的时间内向有需要的所述受试者施用有效量的所述含高z元素的纳米颗粒作为放射增敏剂。
[0183]
实际上,考虑到肿瘤的纳米颗粒的剩磁,可能有利的是用含有高z元素的纳米颗粒以2-10天的时间“预填充”肿瘤,然后在施用放疗的第一次辐射之前,将纳米颗粒再次施用(例如,5分钟,15分钟,30分钟,45分钟,1小时,2小时,4小时,6小时,12小时,24小时)至具有待治疗肿瘤的受试者。
[0184]
因此,在具体实施方案中,本方法包括:
[0185]
(i)在第一次照射肿瘤之前的2-10天,优选2-7天的时间内向所述有需要的受试者注射第一有效量的含高z元素的纳米颗粒作为放射增敏剂,
[0186]
(ii)在第一次照射肿瘤之前的1小时-12小时之间的时间内注射第二有效量的相同或不同的含高z元素的纳米颗粒,和,
[0187]
(iii)将所述受试者暴露于一个或多个磁共振图像引导的放疗疗程。
[0188]
在可与前述实施方案组合的其它实施方案中,适当时,可在一个或多个放疗疗程后进行纳米颗粒的进一步注射或施用。
[0189]
典型地,当使用分次放疗时,在多个放疗疗程期间,可以进一步每周注射一次纳米颗粒。例如,在一个具体实施方案中,本文公开的方法还包括至少一个额外的步骤:在一个或多个分次mr图像引导的放疗疗程后的5-10天内注射治疗有效量的相同或不同的含高z元素的纳米颗粒,例如在所述分次mr图像引导的放疗的第一疗程的注射步骤后7天。
[0190]
在优选实施方案中,所述纳米颗粒是基于钆螯合聚硅氧烷的纳米颗粒(例如aguix纳米颗粒),并且在每个注射步骤静脉内施用的治疗有效量为50mg/kg-150mg/kg,典型为80-120mg/kg,例如100mg/kg。
[0191]
图像引导的放疗的步骤
[0192]
根据本公开的方法,通过磁共振成像引导的线性加速器(mr-linac)将受试者暴露于磁共振成像引导的放疗。
[0193]
如本文所用,术语“放射治疗”(也称为“放疗”)用于用对应于电离辐射的辐射治疗肿瘤性质的疾病。电离辐射沉积能量,其通过破坏其遗传物质来伤害或破坏正在治疗的区域(目标组织)中的细胞,使这些细胞无法继续生长。典型地,所述电离辐射是光子,例如x射线。根据它们具有的能量的量,射线可用于破毁机体表面或深处的癌细胞。x射线束的能量越高,x射线可以进入靶组织的深度就越深。
[0194]
线性加速器产生能量日益增加的x射线。使用机器将辐射(诸如x射线)聚焦在癌症位点上称为外部束放疗。
[0195]
对于mr-linac,电离辐射典型为2mev-25mev,特别是4mev-18mev,典型为4mev或6mev。
[0196]
如本文所使用,术语“磁共振图像引导的放疗”是指磁共振成像单元与放疗单元的组合使用,其允许在治疗递送之前和期间对处于危险中的目标体积和器官进行实时成像,并根据需要重新计划。磁共振图像引导的放疗特别适用于受分次间和分次内运动影响的部位,例如胸部、腹部和骨盆。典型地,与锥面束计算机断层扫描相比,利用磁共振图像引导的放疗可以改进处于危险中的器官和靶标的可视化,这可以允许计划适应和减少毒性。该技术可以使用用于精确和准确剂量的自动射束门控。当肿瘤移动时,射束自动停止。因此,临床医生可以在提高剂量的同时有信心地缩小界限。
[0197]
用于图像引导的放疗的任何mr-linac可用于本公开的治疗方法中。
[0198]
目前使用的mr-linac包括垂直束场系统(例如,elekta和viewray),其现在是商业产品。其它系统包括内联定向(aurora-rt)以及垂直和内联定向(australian)。目前mr-linac系统的场强从0.35t变化;例如mridian(viewray),0.5t(aurora-rt,magnetx)和1.5t(unity,elekta)。liney et al clinical oncology 30(2018)686-691描述了mr-linac系统及其使用模式的进一步细节。
[0199]
在优选实施方案中,在本公开的方法中使用的mr-linac具有0.5t或更低的磁场强度,例如0.35t。这样的实施方案对于之前章节中描述的超细纳米颗粒或aguix纳米颗粒是特别优选的。
[0200]
典型地,使用mr-linac的磁共振图像引导的放疗的疗程包括以下步骤:
[0201]
1.模拟步骤
[0202]
典型地,在mr图像引导的放疗之前,采集治疗前计算机断层扫描(ct)和mri。有风险的靶标和器官可以由放射肿瘤学家根据治疗前数据进行轮廓测定。
[0203]
2.重新定位步骤,如有必要,进行适应性计划步骤
[0204]
在每个治疗疗程开始时,将患者置于治疗台上。进行新的mri扫描,并与用于创建放射治疗计划的原始扫描进行比较。如果扫描上的任何东西已经改变,则放射治疗计划可以适于考虑肿瘤和器官的移动。
[0205]
3.治疗递送步骤
[0206]
一旦高度专业化的团队对放射治疗计划和靶向满意,患者将接受他的治疗。
[0207]
mr-linac上的辐射递送与mri完全集成。该技术意味着该系统可以递送治疗辐射束并同时监视靶标区域。辐射束被精确地成形以最大化对靶标的剂量,同时最小化对周围健康组织的剂量。
[0208]
当放射束打开时,mr-linac利用其mri捕获肿瘤和/或附近器官的恒定视频,并以亚秒速度作用于它们。如果肿瘤或关键器官移动超出医师定义的边界,则放射束自动暂停;当目标移回到预定边界时,治疗自动恢复。因此,正确的辐射量被递送到正确的位置。
[0209]
在用于治疗肿瘤的磁共振图像引导的放疗中使用mr-linac的方案公开于fischer-valuck et al,2017(advances in radiation oncology,2,485-493),henke le,et al.,magnetic resonance image-guided radiotherapy(mrigrt):a 4.5-year clinical experience,clinical oncology(2018),https://doi.org/10.1016/j.clon.2018.08.010。
[0210]
根据目前的实践,在每个疗程的磁共振图像引导的放疗之前施用标准mri造影剂以改进对比度增强。已经与mr-linac一起使用的这种标准造影剂的实例包括环状试剂,例如,钆贝酸(multihance)、钆特酸(dotarem)和钆布醇(gadovist)。
[0211]
在本公开的方法中,在图像引导的放疗之前向受试者施用的含高z纳米颗粒用作mr成像的造影剂或用作放射疗法的放射增敏剂,或优选地,用作mr成像的造影剂和放射增敏剂两者。
[0212]
与现有技术中使用的标准造影剂相反,本发明人事实上注意到如本文所公开的含有高z的纳米颗粒(并且更具体地aguix纳米颗粒或其它基于gd的超细纳米颗粒)具有以下优点:
[0213]
·
它们均可用作mr成像的造影剂和放射增敏剂,允许在放疗之前进行单一注射步骤。
[0214]
·
它们在肿瘤中具有数天的特别长的剩磁,允许避免在每个疗程施用这种纳米颗粒。
[0215]
·
它们具有高弛豫度,这可能是由于每个颗粒的高gd数(通常为5-50,相比之下,其它常规造影剂如dotarem为1),这允许高质量mr成像,并且使它们特别适合与mr-linac一起使用,优选为低磁场强度,例如0.5t或更低,并且典型地为0.35t。
[0216]
在优选实施方案中,考虑到在单次静脉内注射后在肿瘤中观察到的含有高z的纳米颗粒的剩磁,可以将受试者暴露于多个磁共振图像引导的放疗疗程,而不进一步施用用于mri的造影剂。典型地,所述受试者暴露于至少2个磁共振图像引导的放疗疗程,而不进一
步施用用于mri的造影剂。
[0217]
在具体实施方案中,在单次施用有效量的所述含高z纳米颗粒后,将所述受试者暴露于2,3,4,5,6或7个磁共振图像引导的放疗疗程。例如,所述受试者可以在5-7天内暴露于2个或更多个磁共振图像引导的放疗疗程。在某些实施方案中,在每个疗程之间可以观察到2或3天的最小时间线。
[0218]
mr图像引导放疗领域的普通技术人员知道如何根据疾病的性质和患者的体质确定合适的剂量和应用时间表。特别地,技术人员知道如何评估剂量限制毒性(dlt)以及如何相应测定最大耐受剂量(mtd)。
[0219]
光子放疗中使用的辐射量以gray(gy)测量,并且根据待治疗癌症的类型和阶段而变化。对于治愈性病例,实体瘤的典型总剂量范围为20-120gy,典型为25-100gy。
[0220]
放射肿瘤学家在选择剂量时会考虑许多其他因素,包括患者是否正在接受化疗、患者合并症、是否在手术之前或之后施用放疗以及手术成功的程度。
[0221]
典型地,将总剂量分次(随时间分布)。为任何疾病/解剖部位/疾病阶段的患者设置/年龄定义了数量和时间表(电离辐射的计划和递送、分次剂量、分次递送方案、单独或与其他抗癌药联合使用的总剂量等),并构成了任何特定情况下的护理标准。
[0222]
成人的典型常规分次方案可以是每天1.8-3.0gy,每周五天,例如连续2-8周。在具体实施方案中,所述放疗包括将受试者暴露于总剂量为25-80gy的电离辐射,例如30gy。
[0223]
考虑到用高剂量电离辐射获得的根据本发明方法的纳米颗粒和电离辐射的组合效果,在一个具体实施方案中,暴露于患者肿瘤的电离辐射的剂量有利地被低分割。例如,将至少3gy,例如约3gy-约20gy,或5-7gy的每次剂量暴露于患者的肿瘤,并且辐射总剂量以几次(典型地,但不必须地不超过10次,例如为1-10次)递送。
[0224]
在其中受试者患有胰腺癌的具体实施方案中,本文公开的方法应用的放疗包括用mr-linac系统将受试者暴露于6个疗程的mr-图像引导的放疗,每次疗程8gy。
[0225]
在其中受试者患有前列腺癌的其它具体实施方案中,本文公开的方法应用的放疗包括用mr-linac系统将受试者暴露于5个疗程的的mr-图像引导的放疗,其中每次疗程将9gy应用于前列腺,而无需放射增敏剂,然后进行4个额外疗程的加强,以仅使用用mr-linac系统的mr-图像引导的放疗来治疗前列腺肿瘤,典型地每次疗程10gy。含有高z的纳米颗粒(例如超细或aguix纳米颗粒)仅在最后4个疗程中施用。
[0226]
在其中受试者患有肝转移的其它具体实施方案中,本文公开的方法应用的放疗包括用mr-linac系统将受试者暴露于6个疗程的mr-图像引导的放疗,每次疗程9gy。
[0227]
在其中受试者患有淋巴结转移的其它具体实施方案中,本文公开的方法应用的放射疗法包括用mr-linac系统将受试者暴露于5个疗程的mr-图像引导的放疗,每次疗程6gy。
[0228]
在其中受试者患有骨转移的其它具体实施方案中,本文公开的方法应用的放射疗法包括用mr-linac系统将受试者暴露于6个疗程的mr-图像引导的放疗,每次疗程9gy。
[0229]
典型地,对于上述实施方案,超细钆基纳米颗粒,更优选之前章节中所述的aguix纳米颗粒用作mr成像造影剂和放射增敏剂,用于一个或多个mr引导的放疗疗程。
[0230]
进一步的非限制性细节提供于实施例中。
[0231]
使用本公开的方法的联合疗法
[0232]
如本文所公开使用的纳米颗粒可以作为唯一的活性成分施用或与例如作为佐剂
或与其他药物(例如细胞毒剂、抗增殖剂或其他抗肿瘤剂)组合或联合施用,以如上所述,例如用于治疗或预防癌症疾病。
[0233]
合适的细胞毒性剂、抗增殖剂或抗肿瘤剂可包括但不限于顺铂、阿霉素、紫杉醇(taxol)、依托泊苷、伊立替康、拓扑替康、紫杉醇、多西他赛、埃博霉素、他莫昔芬、5-氟尿嘧啶、甲氨蝶呤、替莫唑胺、环磷酰胺、替吡法尼、吉非替尼、埃罗替尼、伊马替尼、吉西他滨、尿嘧啶氮芥、氮芥、异环磷酰胺、美法仑、苯丁酸氮芥、哌泊溴烷、曲他胺、白消安、卡莫司汀、洛莫司汀、链脲霉素、达卡巴嗪、氟脲苷、阿糖胞苷、6-巯嘌呤、6-硫鸟嘌呤、磷酸氟达拉滨、奥沙利铂、亚叶酸、喷司他丁、长春碱、长春新碱、长春地辛、博来霉素、放线菌素d、柔红霉素、表阿霉素、伊达比星、光辉霉素、脱氧柯福霉素(deoxycoformycin)、丝裂霉素-c、l-天冬酰胺酶、替尼泊苷。
[0234]
在一些实施方案中,在施用本文提供的组合物的同时施用另外的治疗剂。在一些实施方案中,在施用本文提供的组合物之后施用另外的治疗剂。在一些实施方案中,在施用本文的组合物之前施用另外的治疗剂。在一些实施方案中,在外科手术过程中施用本文提供的组合物。在一些实施方案中,在外科手术过程中与另外的治疗剂联合施用本文提供的组合物。
[0235]
本文提供的另外的治疗剂可以在很宽的剂量范围内有效并且通常以有效量施用。但是,应当理解,实际施用的治疗剂的量通常由医师根据相关情况确定,包括待治疗的病症;选择的施用途径;实际施用的化合物;个体受试者的年龄体重、体重和反应;受试者症状的严重程度等。
[0236]
本公开的方法的其他方面和优点将在以下实施例中变得明显,这些实施例仅出于说明的目的而给出。
具体实施方式
[0237]
实施例1:基于gd的治疗诊断纳米颗粒的首次人体试验:在4种脑转移患者中的摄取和生物分布
[0238]
1.1材料与方法
[0239]
研究设计
[0240]
该研究是前瞻性剂量递增i-b期临床试验的一部分,旨在评估静脉施用放射增敏aguix纳米颗粒与全脑放疗联合治疗脑转移瘤的耐受性。nano-rad试验(使用基于aguix钆的纳米颗粒对多个脑转移瘤进行放射增敏)注册为nct02820454。在这里,我们报告了应用于15名招募患者的mri方案的结果。分配给这项mri辅助研究的目标是i)评估aguix纳米颗粒在脑转移瘤和周围健康组织中的分布,以及ii)测量静脉内施用aguix纳米颗粒后脑转移瘤和周围健康组织中的t1加权对比增强和纳米颗粒浓度(verry c,et al.bmj open.9:e023591(2019))。
[0241]
患者选择
[0242]
招募了不适合通过手术或立体定向放射进行局部治疗的多发性脑转移患者。纳入标准包括:i)最小年龄18岁,ii)组织学证实的实体瘤的继发性脑转移,iii)没有先前的脑部照射,iv)没有肾功能不全(肾小球滤过率》60ml/min/1.73m2),v)肝功能正常(胆红素《30μmol/l;碱性磷酸酶《400ui/l;天冬氨酸氨基转移酶(ast)《75ui/l;丙氨酸氨基转移酶
(alt)《175ui/l)。
[0243]
试验设计
[0244]
试验方案的主要步骤如下。在d0天,患者接受了第一成像环节(参见下一段中的mri协议),包括以0.2ml/kg(0.1mmol/kg)体重的剂量静脉推注dotarem(钆酸葡甲胺)。在第一成像环节后1-21天(取决于患者的可用性和放疗计划),以15、30、50、75或100mg/kg体重的剂量向患者静脉内施用aguix纳米颗粒溶液。aguix纳米颗粒施用的日期称为d1。
[0245]
aguix纳米颗粒的合成
[0246]
aguix纳米颗粒已通过六步合成获得。第一步是通过在二甘醇中的三氯化钆上添加苏打来形成氧化钆核。第二步是通过添加teos和aptes来生长聚硅氧烷壳。熟化后,添加dotaga酸酐以与无机基质表面存在的游离氨基官能团反应。转移到水中后,观察到氧化钆核溶解,并且钆在基质表面被dotaga螯合。然后,观察到超小aguix纳米颗粒中聚硅氧烷基质的碎裂。最后一步是纳米颗粒的冷冻干燥。
[0247]
治疗诊断剂由被钆环状配体包围的聚硅氧烷网络组成,dota(1,4,7,10-四氮杂环十二烷酸-1,4,7,10-四乙酸)的衍生物共价接枝到聚硅氧烷基质上。其流体动力学直径为4
±
2nm,其质量为约10kda,并由平均化学式(gdsi
3-8c24-34n5-8o15-30h40-60
,1-10h2o)n描述。平均而言,每个纳米颗粒在其表面上存在10个螯合核钆离子的dota配体。3特斯拉时的纵向弛豫r1等于每个gd
3+
离子8.9mm-1
.s-1
,导致每个aguix纳米颗粒的总r1为约89mm-1
.s-1
。在施用纳米颗粒后2小时进行相同的mri环节,没有注射钆酸葡甲胺。然后,患者接受了全脑放疗(30gy,10次3gy递送)。在施用aguix纳米颗粒后7天(d8)和4周(d28),对每位患者进行了类似的mri环节。
[0248]
mri协议
[0249]
mri采集是在3特斯拉philips扫描仪上进行的。使用了32通道philips头部线圈。患者接受了相同的成像方案,包括以下mri序列:i)3d t1加权梯度回波序列,ii)具有多个翻转角度的3d flash序列,iii)磁敏感加权成像(swi)序列,iv)流体衰减反转恢复(flair)序列,v)扩散加权成像(dwi)序列。在遵循recist(实体瘤反应评估标准)和rano(神经肿瘤学反应评估)标准评估放疗后脑转移反应时,推荐其中一些成像序列(24,25)。3d t1加权成像序列提供mri造影剂施用后健康组织和脑转移灶的高分辨率对比增强图像。3d flash序列以不同的翻转角度重复数次,以计算t1弛豫时间和造影剂浓度。swi序列用于检测出血的存在。flair序列用于监测炎症或水肿的存在。最后,dwi序列可用于检测组织或脑转移灶中的异常水扩散。总采集时间为30分钟-40分钟,具体取决于患者调整的成像参数。这些成像序列的关键特征和主要采集参数在补充材料部分中有详细说明。
[0250]
图像处理和量化管线
[0251]
mri分析是使用由gin实验室(grenoble,france)开发并在软件下运行的称为mp3(https://github.com/nifm-gin/mp3)的内部计算机程序进行的。图像分析包括转移的计数和测量、对比增强的量化、弛豫时间和纳米颗粒的浓度。根据recist和rano标准,仅最长直径超过1cm的转移被认为是可测量的,并保留在后续分析中。以百分比表示的mri增强定义为造影剂施用后的mri信号幅度与造影剂施用前的mri信号幅度之比;在3d t1加权图像数据集中测量mri信号幅度。t1弛豫时间来自在四个不同翻转角度获得的3dflash图像。脑转移瘤中纳米颗粒的浓度来自造影剂施用前后t1弛豫时间的变化以及来自纳米颗
粒的已知弛豫性。
[0252]
使用在neurospin(cea,saclay,france)开发的brainvisa/anatomist软件(http://brainvisa.info)进行3d图像渲染。为了更好地可视化不同转移灶的位置,brainvisa的morphologist pipeline用于生成每个患者的大脑和头部的网格。
[0253]
统计分析
[0254]
所有分析均使用graphpad prism(graphpad software inc.)进行。除非另有说明,否则显著性固定在5%的概率水平。除非另有说明,否则所有数据均以平均值
±
sd表示。
[0255]
1.2结果
[0256]
施用的基于aguix gd的纳米颗粒在所有四种类型的脑转移瘤中诱导mri对比增强
[0257]
患者招募导致包括四种类型的脑转移瘤,即nsclc(非小细胞肺癌)n=6、乳腺癌n=2、黑色素瘤n=6和结肠癌n=1。在施用剂量的每个递增步骤(对于15、30、50、75和100mg/kg体重,n=3)中,所有患者都成功地注射了治疗诊断纳米颗粒aguix(如材料和方法中所述)。
[0258]
在d1天,在aguix注射后两小时,观察到所有类型的脑转移瘤、所有患者和所有施用剂量的mri信号增强。在每个转移灶周围绘制的目标区域内,发现mri信号增强随着aguix纳米颗粒的施用剂量而增加(图1)。对于15、30、50、75和100mg/kg体重的aguix剂量,所有可测量的转移灶(最长直径大于1cm)的平均信号增强分别等于26.3
±
15.2%、24.8
±
16.3%、56.7
±
23.8%、64.4
±
26.7%和120.5
±
68%。发现mri增强与注射剂量呈线性相关(斜率1.08,r2=0.90)(数据未显示)。
[0259]
基于gd的纳米颗粒证实与临床使用的造影剂相当的脑转移灶的mri增强
[0260]
对于每位患者,还在d0天在注射临床批准的基于gd的造影剂(guerbet,villepinte,france)后15分钟测量mri增强。平均所有最长直径大于1cm的可测量转移灶,mri增强等于182.9
±
116.2%。注射后15分钟观察到的这种mri增强与施用aguix纳米颗粒的最高剂量后2h观察到的增强具有相同的数量级。
[0261]
对所有施用剂量的aguix纳米颗粒的检测灵敏度(定义为它们在可测量的脑转移灶中增强mri信号的能力)进行了评估,并与临床使用的造影剂的灵敏度进行了比较。以dotarem敏感性的百分比表示,对于15、30、50、75和100mg/kg体重的注射剂量,aguix纳米颗粒的敏感性分别等于12.1、19.5、34.2、31.8和61.6%。
[0262]
aguix纳米颗粒的浓度可以在脑转移瘤中进行量化
[0263]
多翻转角度3d flash采集成功地用于计算t1值的像素图(数据未显示),并能够量化目标区域的纵向弛豫时间。这些t1图中清楚地显示了由吸收aguix纳米颗粒引起的脑转移瘤中t1弛豫时间的减少。如所预期,t1值的降低与对比增强的脑转移灶共同定位。
[0264]
根据施用后t1值的变化计算对比增强转移灶中aguix纳米颗粒的浓度。对于以100mg/kg体重施用的患者,在最长直径大于1cm的转移灶中进行aguix浓度测量。在#13、#14和#15患者中,脑转移瘤中的平均aguix浓度分别测量为57.5
±
14.3、20.3
±
6.8、29.5
±
12.5mg/l。
[0265]
对最高(100mg/kg)施用剂量的患者评估mri增强与纳米颗粒浓度之间的相关性。图2中用来自患有nsclc转移的患者#13的mri数据例证了这种相关性。观察到两个mri参数之间存在强正相关,在测量值范围内具有接近线性的关系。
[0266]
对于每位患者,在没有可见转移的大脑目标区域(每位患者三个代表性的目标区域,所有患者的大小相似)中评估mri增强和t1值。在这些健康的大脑区域中没有观察到显著的mri增强和t1变化。
[0267]
施用纳米颗粒一周后观察到mri增强
[0268]
对于施用最大剂量(100mg/kg体重)的患者,在d8天,即在施用aguix纳米颗粒后长达1周,在可测量的转移灶(最长直径大于1cm)中观察到mri增强持续存在,如图3所示。患者#13、#14和#15的平均mri增强测量值分别等于32.4
±
10.8%、14
±
5.8%和26.3
±
9.7%。作为比较点,对于#13、#14和#15的患者,d1天的平均mri增强分别等于175.8
±
45.2%、58.3
±
18.4%和154.1
±
61.9%。由于t1变化低,无法计算aguix纳米颗粒的浓度。基于观察到的mri增强和纳米颗粒浓度之间的相关性,可以估计脑转移灶中d8天时aguix浓度的上限为10m。在施用aguix纳米颗粒4周后的d28天,任何患者均未观察到明显的mri增强。
[0269]
讨论
[0270]
脑转移的发生是癌症历史上的常见事件,并且对患者的预期寿命产生负面影响。对于多发脑转移的患者,全脑放疗(wbrt)仍然是标准治疗。但是,中位总生存期小于六个月,需要开发新的方法来提高对这些患者的治疗效果。因此,放射增敏剂的使用引起了人们极大的兴趣。aguix纳米颗粒的体内治疗诊断特性(放射增敏和多模态成像诊断)先前在对啮齿动物的八种肿瘤模型进行的临床前研究中得到证实(f.lux,et al.br j radiol.18:20180365(2018)),以及特别是在脑肿瘤中(g.le duc,et al.acs nano.5,9566-9574(2011),c.verry c,et al.nanomedicine 11,2405-2417(2016))。对aguix纳米颗粒对脑转移的诊断价值的临床评估是nano-rad临床试验的次要目标之一。aguix纳米颗粒在患者中的放疗应用的目标剂量为100mg/kg,因此本研究的结论和观点主要集中在该剂量上。
[0271]
向患者施用的aguix纳米颗粒的最大剂量(100mg/kg体重或100μmol/kg体重gd
3+
)对应于注射一剂临床使用的mri造影剂(诸如)中的螯合钆离子gd
3+
的量体重gd
3+
)。因此,将最大aguix剂量的转移灶中观察到的mri增强与临床常规中使用的基于gd的造影剂剂量进行比较是合适的。
[0272]
在这项研究中,纳米颗粒施用和mri采集之间存在2小时的延迟,以监测患者对注射的反应。平均纳米颗粒血浆半衰期为约1小时,这种延迟导致血浆中纳米颗粒浓度降低86%。相比之下,注射和mri采集之间只有15分钟的延迟。尽管纳米颗粒的这种显著清除和患者血液中浓度的降低,但在最高纳米颗粒剂量下的mri增强与临床造影剂观察到的接近。
[0273]
aguix纳米颗粒在增强脑转移瘤中的mri信号方面具有显著的诊断性能,这可能归因于两个独立的因素。第一个因素与纳米颗粒的固有磁性有关。与临床基于gd的造影剂相比,它们更大的直径和分子量导致更高的纵向弛豫系数r1,从而提高了修改mri信号强度的能力。具体而言,在3特斯拉的磁场下,aguix纳米颗粒和的r1值分别等于每个gd
3+
离子8.9和3.5mm-1
.s-1
(b.r.smith,s.s.gambhir.chem rev.117,901-986(2017))。
[0274]
第二个因素可能与aguix纳米颗粒在脑转移灶中被动积累的能力有关。这种被动靶向现象利用了所谓的增强渗透性和保留(epr)效应,该效应假设纳米物体在肿瘤中的积累是由于肿瘤血管有缺陷和渗漏以及缺乏有效的淋巴引流(a.bianchi,et al.magma.27,
303-316(2014))。在先前对癌症动物模型的研究中,一直观察到aguix纳米颗粒对肿瘤的被动靶向作用。在多发性脑黑色素瘤转移的小鼠模型中,报道了aguix纳米颗粒在肿瘤细胞中的内化,并且在给动物静脉内注射24小时后仍观察到脑转移中纳米颗粒的存在(kotb,a.et al.theranostics 6(3):418-427(2016))。在最高100mg/kg剂量下,所有直径大于1cm的转移灶在施用纳米颗粒后长达7天都得到了对比增强。
[0275]
施用一周后转移灶中的mri信号持续增强突显了纳米颗粒从转移灶中的这种积累和延迟清除。据发明人所知,文献中没有关于在施用临床使用的基于gd的造影剂后转移灶中的这种晚期mri增强的报道。
[0276]
该首次人体临床试验的设计中包括剂量递增,因此患者接受了五种剂量水平递增的aguix纳米颗粒。从转移灶信号增强与施用的纳米颗粒浓度之间观察到的线性相关性,可以得出结论,纳米颗粒的剂量(在所研究的剂量范围内)不是转移灶被动靶向的限制因素。重要的是,尽管参与第一项临床研究的患者数量有限,但这些初步结果表明,无论注射剂量如何,纳米颗粒的摄取和信号增强都存在于所研究的四种转移灶(nsclc、黑色素瘤、乳腺和结肠)中。
[0277]
考虑到aguix纳米颗粒的放射增敏特性,评估和可能量化在转移灶中积累的纳米颗粒的局部浓度是关键。为此,mri协议包括t1映射成像序列,从中得出纳米颗粒浓度。在本临床研究中获得的浓度值可以与在肿瘤动物模型的临床前研究中获得的浓度值相比较。注射最高剂量的三名患者的nsclc和乳腺癌转移灶中aguix纳米颗粒的计算浓度在8至63mg/l之间变化,对应于脑转移灶中gd
3+
离子的浓度范围在8至63μm之间。在上述三名患者中,%id/g介于8%和63%之间。在上述两项mri临床前研究中发现%id/g的数量级相同,分别为28%和45%id/g。有趣的是,这些浓度是通过延迟注射后(几个小时)获得的,这与放疗环节的设置相容。
[0278]
在这项研究中,我们还评估了纳米颗粒浓度与使用稳健的t1加权3dmri序列获得的mri信号增强se之间的关系。在转移灶中可测量的纳米颗粒浓度范围内,使用本研究中使用的采集协议观察到mri增强与纳米颗粒浓度之间的线性关系。因此,通过本研究中使用的特定协议,mri增强可用作评估aguix纳米颗粒浓度的稳健且简单的指标。
[0279]
虽然转移靶向对于诊断和放射增敏目的都是有益的,但希望在健康的周围组织中保持低浓度的纳米颗粒。在这方面,在施用最高剂量的aguix纳米颗粒后两小时,在无转移脑组织中未观察到mri增强。这种缺乏增强与在患者血浆中测量的纳米颗粒的快速清除一致,并且是纳米颗粒对健康大脑无害的积极迹象。
[0280]
总之,这里报道的临床试验的初步结果表明,静脉注射基于钆的纳米颗粒对于增强患者中不同类型的脑转移是有效的。
[0281]
除此之外,1期临床试验的初步结果表明,静脉注射aguix纳米颗粒具有良好的耐受性,达到本研究选择的100mg/kg剂量。
[0282]
最后,纳米颗粒在第8天在肿瘤中的持久性支持允许在第一次照射之前单次注射纳米颗粒作为造影剂和放射增敏剂的方案,例如使用如实施例2中所述的图像引导的放疗,以及在单次注射纳米颗粒后5-7天内后续的放疗疗程。
[0283]
实施例2:评估通过mr-linac系统联合使用aguix纳米颗粒作为放射增敏剂和造影剂递送低分割放疗的可行性和耐受性的概要
[0284]
2.1依据和目标患者概况
[0285]
共振成像引导的线性加速器(mr-linac)使用磁共振成像(或mri)连同放疗来治疗全身癌症,对于位于软组织内的肿瘤具有特定优势。该系统可以递送治疗辐射束并同时监视靶标区域。这些技术的联合为放射肿瘤学家提供了对放射递送的更大控制,因为他们可以看到内部解剖结构和肿瘤。他们可以微调放疗计划并个性化和适应每种治疗。然而,根据肿瘤类型或定位,在治疗期间需要使用造影剂来突出和跟踪肿瘤。
[0286]
目前使用的造影剂必须在每次rt之前注射。
[0287]
aguix np是潜在的治疗诊断剂,其具有增加肿瘤放射敏感性和增加mri扫描的肿瘤对比度的能力。此外,aguix可以在允许每周一次注射的数天期间增加该肿瘤对比度。
[0288]
2.2研究目的
[0289]
主要目的是评估使用aguix作为造影剂在每周使用单次aguix注射的每周2或3个疗程期间通过mr-linac装置的mri扫描跟踪肿瘤的用途。
[0290]
相关终点:在注射后的不同时间点(从1小时到5天)使用mr-linac进行的mri扫描的造影剂功效评估。
[0291]
次要目的:
[0292]
评估使用mr-linac和aguix组合递送低分割rt的安全性。(终点:根据ctcae-v5.0,放疗结束后3个月内的急性不良事件)。
[0293]
评估使用mr-linac和aguix组合递送的低分割rt后的无进展存活(pfs)。(终点:pfs:随机化至首次发生疾病进展的时间,由研究者根据recist v1.1或任何原因导致的死亡确定,以先发生者为准)。
[0294]
2.3资格标准/受试者特征
[0295]
纳入标准
[0296]-18岁
[0297]-ecog状态:0或1
[0298]-患有前列腺或胰腺原发性肿瘤、淋巴结复发、肝转移或原发部位、骨转移,典型是经历分次内运动的骨转移(如胸骨)的患者。
[0299]-低分割放疗适应症。
[0300]
非纳入标准
[0301]-相同靶标的既往放疗
[0302]-禁忌mri扫描
[0303]-对造影剂过敏
[0304]
2.4研究中使用的治疗
[0305]
药物/治疗名称和商品名称:aguix
[0306]
化学名称(dci):基于钆螯合聚硅氧烷的纳米颗粒
[0307]
药物形式:无菌冻干灰白色粉末,含有300mg aguix作为活性成分(300mg aguix/小瓶)。每个小瓶含有0.66mg cacl2,作为非活性成分。该药物产品装在带有溴化丁基橡胶塞的一次性10ml透明玻璃瓶中。
[0308]
制备程序:用3ml注射用水重构溶液,得到100mg/ml的aguix溶液。溶液的ph值为7.2
±
0.2。
[0309]
用注射用水重构后一小时,将重构溶液放入注射器中,然后使用注射泵注射。
[0310]
重组后最短1小时和最长24小时内施用。
[0311]
aguix溶液将在重构后半天后施用,但是,纳米颗粒必须储存在[+2℃;+8℃]并在重构后最多24小时内施用。
[0312]
使用注射泵缓慢输注(2ml/min)进行静脉内施用
[0313]
每次施用剂量:100mg/kg、1ml/kg
[0314]
2.5治疗和相关程序
[0315]
放疗:
[0316]
根据治疗位置的放疗方案:
[0317]-胰腺癌:6次,8gy
[0318]-前列腺癌:前列腺5次,9gy,随后肿瘤加强4次,10gy(aguix仅用于最后4次)
[0319]-肝转移:6次,9gy
[0320]-淋巴结转移:5次,6gy
[0321]-骨转移:5次,4gy
[0322]
无论哪种位置,放疗将以每周2或3次的速率施用。2个疗程之间的时间为2-3天。
[0323]
阶段ib:按位置纳入5名患者。独立地分析每个位置。
[0324]
步骤1:在rt开始前一周进行的生物利用度研究:
[0325]
在d1第一次注射浓度为50mg/kg的aguix。在2小时、4小时、3天和5天后使用mr-linac进行mri扫描以评估摄取肿瘤对比度。
[0326]
-如果多于1名患者在d3丧失对比度:相关位置的研究停止。
[0327]
-如果多于2名患者在d5丧失对比度:纳入5名新患者,其中5次注射浓度为50mg/kg的aguix。
[0328]
在丧失对比度的情况下,可以使用dotarem或multihance注射来使肿瘤可视化。
[0329]
步骤2:安全性研究:
[0330]-在d8进行aguix的第二次注射,随后进行第一次放疗(根据先前生物利用度研究的结果建立时间表)。
[0331]-在分次放疗之前在d15进行aguix的第三次注射。
[0332]-根据治疗的肿瘤位置在(d8、d10、d12、d15+/-d17+/-d19)进行4-6次放疗,每疗程时进行mri扫描。
[0333]-如果我们强调多于2名患者的毒性等级>2:纳入5名新患者,5次注射浓度为50mg/kg的aguix。
[0334]
实施例3:通过viewray linac mri的mri比较不同浓度下的aguix和multihance检测。
[0335]
为测定aguix纳米颗粒用作显示0.35t磁场的viewray linac mri的阳性mri造影剂的能力(mridian mr-linac,viewray inc.,oakwood,usa)(s.kl
ü
ter,clinical and translational radiation oncology,2019),将不同钆浓度的样品进行测试,并与使用torso线圈(双表面柔性6通道线圈阵列)的multihance(bracco)进行比较。样品的浓度列于下表1中。
[0336]
样品号multihance浓度([gd
3+
])浓度(aguix/[gd
3+
])
1500mm50g.l-1
/50mm2250mm25g.l-1
/25mm3100mm10g.l-1
/10mm450mm5g.l-1
/5mm525mm2.5g.l-1
/2.5mm610mm1g.l-1
/1mm75mm0.5g.l-1
/0.5mm82.5mm0.25g.l-1
/0.25mm91mm0.1g.l-1
/0.1mm100.5mm50mg.l-1
/0.05mm110.25mm25mg.l-1
/0.025mm120.1mm10mg.l-1
/0.01mm130.05mm5mg.l-1
/0.005mm140.025mm2.5mg.l-1
/0.0025mm150.01mm1mg.l-1
/0.001mm165μm0.5mg.l-1
/0.5μm172.5μm0.25mg.l-1
/0.25μm181μm0.1mg.l-1
/0.1μm190.5μm50μg.l-1
/0.05μm200.25μm25μg.l-1
/0.025μm210.1μm10μg.l-1
/0.01μm
[0337]
表1.将multihance和aguix的溶液以不同浓度置于eppendorf中,并通过来自viewray的mridian成像。
[0338]
viewray mridian系统在临床上用于外部放疗目的,因此它是专用于aguix的非常合适的装置。使用2d冠状自旋回波序列:tr=400ms,te=20ms,翻转角=90
°
,带宽=57.hz/px,矩阵=512x512,切片厚度=3mm,视野=350x350x263 mm,平均值=5。总采集时间为12:30分钟。
[0339]
通过在成像前1小时分别从0.5mol.l-1
和100g.l-1
的储备溶液在ppi水中稀释来制备multhance和aguix的溶液,并置于eppendorf中。
[0340]
两种造影剂均可以在低浓度下检测到,并且甚至在0.35t下也能作为造影剂,但是与multihance(25μm[gd
3+
])相比,aguix(5μm[gd
3+
])具有更好的灵敏度,如从图4(使用来自viewray的mridian的multihance(a)和aguix(b)的mri阳性信号)和5(使用来自viewray的mridian的multihance和aguix的信号强度)可见。
[0341]
实施例4:通过viewray linac mri的mri比较不同浓度下的aguix和bi-aguix(50/50)检测。
[0342]
已经测试了另一种超小纳米颗粒并与aguix纳米颗粒进行比较。aguix纳米颗粒是亚5nm纳米颗粒,其显示聚硅氧烷基质和在其表面共价接枝的钆螯合物(dotaga(gd
3+
))。根据专利申请wo2018/107057中描述的方法,通过在酸性条件下处理aguix纳米颗粒,除去50%的钆,然后用等量的铋代替,以获得gd/bi:50/50比例的颗粒。
[0343]
然后,将纳米颗粒在溶液中与增加浓度的琼脂混合。然后,通过mridian mr-linac量化t1加权信号(图6:aguix(a)和bi-aguix(50/50)(b)的mri信号比较和图7:使用来自viewray的mridian量化平均信号强度(c))。与bi-aguix(50/50)相比,aguix获得约高两倍的信号。即使信号较弱,在mri中仍可检测到极低浓度的bi-aguix(50/50),这强调了它们对mr-linac的吸引力。用显示较高原子序数(83对64)的铋取代钆将导致较高的放射增敏作用。
[0344]
实施例5:通过viewray linac mri的mri进行体内肿瘤检测。
[0345]
使用mridian mr-linac通过mri对患有皮下非小细胞肺癌(nsclc,a549)的小鼠成像。测试了aguix的两种施用方式:静脉内和肿瘤内使用300mg/kg的剂量,相当于每只小鼠约6mg aguix。对于两次施用,可以使用t1加权序列使肿瘤可视化(图8:静脉内施用aguix纳米颗粒后,使用来自viewray和truefisp(a)或t1加权(b)的mridian对皮下nsclc肿瘤成像(肿瘤以白色圈出)。在肿瘤内施用aguix纳米颗粒后使用来自viewray and truefisp序列(c)的mridian对皮下nsclc肿瘤成像。aguix纳米颗粒是尺寸接近5nm的超小纳米颗粒,并且它们被肾的摄取也可以在两次施用之后进行。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1