治疗毛囊相关病症的组合物和方法与流程
治疗毛囊相关病症的组合物和方法
1.本发明包括以电子格式提供的提交清单,并且该清单的内容通过引用并入。
发明领域
2.本发明涉及用于治疗毛囊相关病症的组合物。该组合物包含至少一种能够在通过角质化产生组织的过程中催化关键效应分子(例如由角质形成细胞产生的蛋白质角蛋白或角蛋白相关蛋白)水解的酶。角化允许角质形成细胞将皮肤层锚定在一起并确保功能性附属物,诸如毛囊中的毛发。在病理性角化过度期间所述角蛋白的过量产生可导致各种毛囊相关的皮肤病症或引起毛囊皮肤病的毛囊闭锁依赖性综合征。本发明涉及促进毛根组织破坏并允许通过酶催化水解毛囊蛋白(例如毛发锚定角蛋白)的组合物,相比来自同一个体毛囊的未处理毛发以显著更小的力促进整个毛干的去除,并促进毛囊中根部组织的破坏以避免角化过度症、毛干异常、闭塞和发展皮肤病。本发明还涉及这种组合物用于治疗、干预或预防毛囊相关病症和毛囊皮肤病的用途;或者用于美学和美容去除人体皮肤上不需要的毛发的用途。所述毛囊相关病症和毛囊皮肤病诸如妇女多毛症(hirsutism)、多毛症(hypertrichosis)或假性毛囊炎(pseudofolliculitis barbae);或寻常痤疮(acne vulgaris)、毛发角化病(keratosis pilaris)、dowling-degos病、hailey-hailey病、乳房瘘(mammilary fistula);或包括聚合性痤疮(acne conglobata)、藏毛窦(pilonidal sinus)病、头皮切割性蜂窝组织炎和化脓性汗腺炎(hidradenitis suppurativa)的毛囊闭锁四联综合征。
3.背景
4.人体皮肤是针对环境的保护性和调节性生物屏障,并对体内平衡和健康至关重要。其具有多种不同的附属物,包括指甲、汗腺和毛囊。皮肤的结构、功能和完整性都依赖于疏水性脂质和角质化蛋白。角质化是蛋白质角蛋白亚组和角蛋白相关蛋白通过共价和非共价相互作用配对和交联以形成细丝结构网络和抗性组织的过程。角质层是皮肤的最外层死层,主要包含角蛋白填充的、相互连接的死角质形成细胞,并且是外来分子渗透的主要屏障。它受内源性蛋白酶和抑制剂控制的脱屑水平调节。下面是由许多增殖的角质形成细胞组成的更活跃的表皮,其随着时间的推移分化成角质层细胞并角质化。一些稳定的角质形成细胞组成性地表达角蛋白诸如k1、k2、k5和k14。其他角质形成细胞是过度增殖的角质形成细胞,其响应外部应激或疾病,特征性地表达角蛋白诸如k17、k16和角蛋白6家族(https://doi.org/10.5772/intechopen.79050)。
5.在毛囊中,毛干由内根鞘(irs)和外根鞘(ors)成形并固定,允许毛发从真皮乳头生长。因此,健康的毛发生长取决于根鞘和它们的角质形成细胞。irs由henle、huxley的不同子层和角质层(cl)组成,一起包围毛干。irs通过从真皮乳头至峡部向上的表皮角化逐渐角化,在那里它被剥落以促进裸毛干通过毛囊管并通过皮肤出来。健康的毛发生长是通过irs和ors之间的双向细胞信号来协调的。虽然irs主要经历表皮角化,但是ors通过来自峡部正上方的漏斗的外毛根鞘角化而角化。由于角质化在屏障功能和完整性中的核心作用,皮肤及其附件的许多严重皮肤病是由角质化失调引起的。
6.本领域技术人员可以认识到,毛囊闭锁是由ors角质形成细胞蛋白(例如角蛋白)的角化过度和角化失调引起的。因此,通过到达所述角化不全部位的水解酶在分化的任何阶段破坏ors组织,将避免与否则将发生的所述皮肤病负担相关的主要皮肤病理学的发展。在大多数由ors角化不全引起的毛囊皮肤病中,局部酶的主要病理生理作用部位是漏斗。大多数出现毛囊相关病症的末端毛囊的漏斗平均深500-660μm(https://doi.org/10.1007/s00441-014-1999-1)。
7.由于类似的生理学,对于本领域技术人员而言,在药物和化妆品开发中广泛应用的人皮肤和毛囊模型是猪耳。可获得的角化过度的体内模型是小鼠,其中可以分别研究皮肤状况的不同要素。最后,来自人类受试者(包括患者)的皮肤活组织检查提供了最有价值和现实的组织模型,因为皮肤状况和皮肤病主要局限于皮肤。
8.毛囊通常分布在所有非粘膜皮肤上,但类型和外观取决于几个因素,包括年龄、性别和激素信号。例如众所周知,成熟的男性人类在身体的许多部位诸如面部、颈部、四肢、躯干、背部、臀部、腹股沟,大多有粗糙和色素沉着的毛发生长,而女性通常具有这些类型的毛发较小程度的分布,即使在青春期后。目前全球人口的大部分使用物理和化学方法去除不需要的毛发。物理装置能够以剃须、激光处理、拔毛/脱毛或打蜡的形式脱毛。通过溶解毛干进行脱毛是使用强化学物质进行的,通常涉及巯基乙酸盐和高碱性ph,其具有高反应性的缺点,除了不能如预期的那样除去完整的毛发及其根部之外,还可以引起严重的皮肤刺激,提供短暂的结果。剃须也会在皮肤上留下小的可见毛发,通常会引起皮肤刺激,并且有切割皮肤的风险。通过使用机械装置拔出根部的脱毛是痛苦的、不方便的并且取决于具有一定长度的新毛发再次被去除。激光应用于不可逆地损害毛囊以抑制毛发生长,但该方法需要专家进行多次昂贵的治疗,是痛苦的,并且可能导致灼烧和瘢痕环。只有50%的治疗患者对这种毛发去除方法有益,因为它不适用于所有毛发颜色、皮肤区域、皮肤颜色或皮肤类型,因为其功效直接取决于黑色素含量。
9.多种病症和疾病与功能失调的角化有关,例如过度或病理性的毛发生长,角化过度和毛囊和皮肤的闭塞,例如妇女多毛症、多毛症或假性毛囊炎;或由毛囊性角化过度或毛囊闭锁引起的皮肤疾病导致的寻常痤疮、毛发角化病、dowling-degos病、hailey-hailey病、乳房瘘或包括聚合性痤疮、藏毛窦病、头皮切割性蜂窝组织炎和化脓性汗腺炎的毛囊闭锁四联综合征。
10.全球男性和女性都患有多毛症。据估计,大约5-15%的女性患有不同程度的多毛症。它的特点是在身体的不寻常部位(例如上唇和脸部、胸部、背部、手臂、腿部、腹股沟和臀部)生长出粗糙且色素沉着的男性型毛发。在多毛症患者中,症状是由过量的男性雄激素信号刺激毛囊引起的。仅在美利坚合众国(美国),就有大约40万名女性患有严重的临床多毛症。自我报告显示,每日脱毛对于他们的正常健康是必要的,因此表明了大量未满足的医疗需求。
11.全球1%的人口患有化脓性汗腺炎。它是一种慢性、进展性和复发性毛囊疾病,伴有多种严重的并发症和非常低的生活质量。在化脓性汗腺炎和多种相关病症中,标志性疾病触发事件是毛囊漏斗中的角化过度,导致毛囊闭锁。在化脓性汗腺炎中,毛囊闭锁导致毛囊破裂,使交联的角蛋白聚集体泄漏到真皮中,引起导向深位的、化脓的强烈炎症反应和疼痛的囊性病变。这些病变通常局限于腋窝、臀部、腹股沟、皮肤褶皱如女性的超重和乳房下
方所见。四分之三的患者是女性。患者通常在青春期首次出现,终生预后为身心疤痕和残疾。疾病严重程度阶段的特征是轻度(hurley阶段1),中度(hurley阶段2)和重度(hurley阶段3),在患者人群中的分布分别为68%、28%和4%。在中度至重度患者中,皮肤囊肿进展为窦隧道和纤维化、毁容和失去性能的皮肤瘢痕。
12.在美国、日本、西班牙、意大利、法国、英国和德国,目前只有800000名患者或约10%的患者被诊断为患有化脓性汗腺炎并在不同程度的疾病严重程度上进行治疗。诊断和未诊断的患者都有大量未满足的医疗需求,因为可用的有效治疗方案非常有限,治疗反应非常个体化。治疗敏感和暴露的皮肤(可能无意中将疾病示于他人)对于患者来说尤其具有挑战性,并且不良的治疗结果容易导致患者进一步的身心困扰。此外,由于皮肤敏感,定期脱毛非常困难。一线治疗包括全身抗生素和激素的组合,一种抗肿瘤坏死因子α(tnfalpha)生物单克隆抗体药物,被美国食品和药物管理局于2015年通过孤儿药渠道批准用于中度至重度疾病。在化脓性汗腺炎中的高成本、有限的疾病控制效果,和严重甚至危及生命的不良事件和许多禁忌症的风险极大地限制了其使用。据估计,在西方国家,目前缺乏有用的治疗机会使得46%的患者对疾病控制不满意,43%的患者报告他们的疾病对他们的生活质量产生极其负面的影响,83%的患者接受了皮肤手术(https://doi.org/10.1016/j.jaad.2019.06.1301)。因此需要预防性治疗和允许更好的疾病控制的选项。毛发生长过程中的毛囊角化过度及其闭塞是多种皮肤病的核心瓶颈事件。因此,与现有疗法相比,在疾病发展的早期阶段干扰疾病将更有效。局部角质溶解化学苯-1,3-二醇也用于治疗寻常痤疮,以高剂量在化脓性汗腺炎患者的一些i i期临床试验中显示出独特但不足的疾病控制益处。局部过氧化苯甲酰仍在临床试验研究中,作为缓解化脓性汗腺炎的一种选择。
13.目前还在临床试验中研究激光脱毛以杀死毛囊干细胞,从而避免毛囊毛发生长和角化过度。最初的结果表明化脓性汗腺炎的预防效果有限。此外,欠发达国家和贫穷国家的许多患者无法获得这种治疗,因为它需要昂贵的设备、专业知识和经过认证的操作人员才能安全使用。由于疼痛和发炎的病变,特别是在通常受影响的皮肤薄、难以接近和敏感的亲密区域,所有受影响的身体部位的治疗在大多数情况下都很困难。
14.为了干预不需要的毛发生长、如前所述毛发病理如多毛症和毛囊皮肤病如化脓性汗腺炎和多种相关的毛囊相关病症,治疗或美容需要更好的针对负责任的角质形成细胞及其效应分子(例如毛干周围的根鞘蛋白角蛋白)的治疗方法,基于酶的疗法构成了一种新型干预性治疗药物,有望早期、安全、温和和用户友好地预防和控制进展。
15.发明概述
16.本发明涉及包含一种或多种能够催化角质形成细胞效应分子诸如蛋白质角蛋白水解的酶的组合物,所述角质形成细胞效应分子支持人皮肤及其附属物如毛囊的完整性,所述完整性受角质形成细胞支持以维持生物屏障、功能和结构,其中所述组合物是:
17.a.一种药物组合物,除了所述一种或多种能够催化角质形成细胞效应分子(诸如支持人皮肤及其附属物如毛囊的功能和完整性的蛋白角蛋白)水解的酶之外,还包含至少一种药学上可接受的成分;或
18.b.一种化妆品组合物,除了所述一种或多种能够催化角质形成细胞效应分子(诸如支持人皮肤及其附属物如毛囊的功能和完整性蛋白质角蛋白)水解的酶之外,还包含至
少一种美容上可接受的成分。
19.本发明还涉及包含本发明组合物的医疗装置,诸如具有例如与酶包埋一起的溶解性微针的医用贴剂;或配有坚固微针的设备,旨在穿透主要的最外层皮肤屏障,从而增强酶向作用部位的传递。
20.本发明还涉及本发明组合物或医疗装置的用途;用于治疗毛囊相关疾病。该用途可用于医疗用途以治疗诸如妇女多毛症、多毛症或假性毛囊炎等病症;或由毛囊性角化过度引起的皮肤疾病或由包括ors、irs和毛干的毛囊发鞘中的角化异常引起的过度或病理性毛发生长的其他病症,诸如假性毛囊炎,或由毛囊性角化过度和毛囊闭锁引起的皮肤病如寻常痤疮,毛发角化病,dowling-degos病,hailey-hailey病,乳房瘘或包括聚合性痤疮、藏毛窦病、头皮切割性蜂窝组织炎和化脓性汗腺炎的毛囊闭锁四联综合征,相同组织负责它们疾病的发展;或者可能用于美学或美容用途以便从人体中去除不需要的毛发。
21.本发明还涉及定义用作为药物的组合物。
附图说明
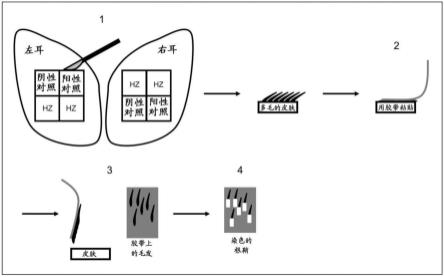
22.图1:图1显示了一种筛选试验,用于鉴定从皮肤上脱毛的酶
23.图2:图2显示了局部应用酶组合物后从皮肤上脱毛的量化
24.图3:图3显示谷氨酰内肽酶有效破坏人发ors组织
25.图4:图4显示谷氨酰内肽酶有效且选择性地水解ors衍生的角蛋白
26.图5:图5显示谷氨酰内肽酶选择性破坏健康的人类ors组织
27.图6:图6显示谷氨酰内肽酶选择性破坏病变性化脓性汗腺炎皮肤中的ors组织
28.图7:图7显示谷氨酰内肽酶促进增强的毛囊酶递送
29.发明详述
30.根据本发明,皮肤病如毛囊皮肤病可以用包含一种或多种能够催化角质形成细胞效应分子诸如蛋白质角蛋白水解的酶的组合物来治疗,所述角质形成细胞效应分子支持人体皮肤及其附属物如毛囊的生物屏障、功能和结构的完整性。
31.值得注意的是,发现能够选择性地和有效地从哺乳动物皮肤上脱毛的酶催化i型和ii型角质形成细胞蛋白如角蛋白的水解,所述角质形成细胞效应分子支持人类皮肤及其附属物如毛囊的生物屏障、功能和结构的功能和完整性,因此它们可用于治疗人体皮肤和/或去除或减少毛囊的充血以避免皮肤病和美容病症。因此,所述酶可以通过抑制皮肤病及其皮肤表现或其它不希望的结果的进展和复发来预防和/或减少和/或控制由这些蛋白质如角蛋白引发的疾病发展,以引起皮肤包括其毛囊在内的附属物中疾病状态的早期缓解,而不会造成重大的不希望的损害。
32.酶
33.一种或多种能够催化角质形成细胞效应分子(例如支持人皮肤及其附属物如毛囊的生物屏障、功能和结构的完整性的蛋白质角蛋白)水解的酶原则上可以是任何具有催化这些蛋白质(包括分类为角蛋白的蛋白质)水解的酶。通常在人发锚组织中发现介导皮肤病并支持毛发周围人毛囊组织完整性并促进毛发在其毛囊中自然生长的增殖性或过度增殖性角质形成细胞角蛋白,包括ors或irs或任何其他特定定义的皮肤的功能组织或具有附属物屏障缺口的皮肤,以及人类毛发周围的功能和结构蛋白角蛋白,这些角蛋白有助于先前
例举的病症或疾病发展。本领域技术人员可以确定所给定的酶是否具有破坏由增殖性或过度增殖性角质形成细胞蛋白产生的组织的能力,所述增殖性或过度增殖性角质形成细胞蛋白可以通过简单的常规实验(例如在实施例1-10和图1-7中公开的实验及其结果)分类为角蛋白。出于本发明的目的,当在毛猪皮上测量其活性时,在局部施用后拔毛的力量相对于阴性对照和酶对照减少超过40%、优选超过50%、优选超过60%、优选超过70%并且最优选超过80%或足够多以避免人从皮肤去除毛发时可辨别的疼痛,则酶被认为具有破坏健康毛囊的ors组织的能力。
34.优选地,所述一种或多种能够催化角质形成细胞效应分子(诸如蛋白质角蛋白,所述角质形成细胞效应分子支持人皮肤及其附属物如毛囊的生物屏障、功能和结构的功能和完整性)水解的酶选自蛋白酶包括内肽酶,特别是谷氨酰特异性蛋白酶,即具有高特异性以切割与谷氨酰残基相邻的肽键的蛋白酶;更优选地,所述一种或多种酶选自谷氨酰内肽酶,由于它们对蛋白质底物和角蛋白中的谷氨酸氨基酸的选择性,可以避免对真皮的显著附带损伤。这种酶的实例是来自灰色链霉菌(streptomyces griseus)的谷氨酰内肽酶ii spre,来自金黄色葡萄球菌(staphylococcus aureus)的v8蛋白酶,特别是来自芽孢杆菌(bacillus)的谷氨酰内肽酶,特别是来自短小芽孢杆菌(bacillus pumilus)ja16的谷氨酰内肽酶丝氨酸蛋白酶bppb是优选的,特别是来自地衣芽孢杆菌(bacillus licheniformis)的谷氨酰内肽酶blase是优选的。
35.在优选的实施方案中,所述一种或多种能够催化角质形成细胞效应分子(诸如蛋白质角蛋白,所述角质形成细胞效应分子支持人皮肤及其附属物如毛囊的生物屏障、功能和结构的功能和完整性)水解的酶选自与具有seq id no:1或seq id no:13序列的多肽具有至少60%序列同一性,例如至少70%的序列同一性;例如至少80%的序列同一性;例如至少90%的序列同一性;例如至少95%的序列同一性;例如至少96%的序列同一性;例如至少97%的序列同一性;例如至少98%的序列同一性;例如至少99%的序列同一性的蛋白酶,优选谷氨酰内肽酶。在优选的实施方案中,所述一种或多种能够催化角质形成细胞效应分子诸如蛋白质角蛋白水解的酶包含seq id no:1和/或seq id no:13序列,所述角质形成细胞效应分子支持人皮肤及其附属物如毛囊的生物屏障、功能和结构的完整性。
36.所述一种或多种能够催化角质形成细胞效应分子(诸如蛋白质角蛋白,所述角质形成细胞效应分子支持人皮肤及其附属物如毛囊的生物屏障、功能和结构的功能和完整性)水解的酶可以是包含seq id no:1和seq id no:13序列的蛋白酶变体,诸如包含一个或多个(例如1、2、3、4、5、6、7、8、9或10个)取代的变体,所述取代优选相比于seq id no:1或seq id no:13是保守取代。
37.在另一个优选实施方案中,所述一种或多种能够催化角质形成细胞效应分子(诸如蛋白质角蛋白,所述角质形成细胞效应分子支持人皮肤及其附属物如毛囊的生物屏障、功能和结构的功能和完整性)水解的酶选自与具有seq id no:12或seq id no:14序列的多肽具有至少60%序列同一性,例如至少70%的序列同一性;例如至少80%的序列同一性;例如至少90%的序列同一性;例如至少95%的序列同一性;例如至少96%的序列同一性;例如至少97%的序列同一性;例如至少98%的序列同一性;例如至少99%的序列同一性的蛋白酶,优选谷氨酰内肽酶。在优选的实施方案中,一种或多种能够催化角质形成细胞效应分子诸如蛋白质角蛋白水解的酶包含seq id no:12和/或seq id no:14序列,所述角质形成细
胞效应分子支持人皮肤及其附属物如毛囊的生物屏障、功能和结构的完整性。
38.所述一种或多种能够催化角质形成细胞效应分子(诸如蛋白质角蛋白,所述角质形成细胞效应分子支持人皮肤及其附属物如毛囊的生物屏障、功能和结构的功能和完整性)水解的酶可以是包含seq id no:12和seq id no:14序列的蛋白酶变体,诸如包含一个或多个(例如1、2、3、4、5、6、7、8、9或10个)取代的变体,所述取代优选相比于seq id no:12或seq id no:14是保守取代。
39.本领域技术人员可以确定所给定的酶是否具有破坏包含角质形成细胞及其效应蛋白的ors组织的能力,所述角质形成细胞及其效应蛋白可以通过简单的常规实验(例如在实施例3中公开的实验及其结果)分类为角蛋白。优选地,当施用酶时,当阳性对照与阴性对照显著不同时,当拔毛时,所述酶能够相对于阴性对照获得超过40%的力降低。当以小于1000ppm、优选小于100ppm和更优选小于10ppm的浓度提供酶时,则认为该酶能够破坏健康组织。特别好的浓度范围在0.01和1ppm之间,更优选的是浓度范围在0.01和0.05ppm之间。
40.对于皮肤样品分析(实施例6-9),酶组合物破坏ors组织的能力可以通过使用30-1000ppm酶或优选1-10ppm酶,优选使用小于1ppm的酶,或甚至小于0.1ppm的酶,更优选使用0.01-0.1ppm的酶但不在阴性对照缓冲液中(不添加酶),进行酶温育后在显微镜下的组织学观察,优选使用30-1000ppm酶或优选1-10ppm酶,优选使用小于1ppm的酶,或甚至小于0.1ppm的酶,更优选使用0.01-0.1ppm的酶但不在阴性对照缓冲液中,进行酶温育后,拔须毛在显微镜下可见地破环ors致使其显著溶胀,或者在酶温育(而非在阴性缓冲对照中)后在显微镜下观察到通过使用30-1000ppm的酶或优选1-10ppm的酶,优选使用小于1ppm的酶或甚至小于0.1ppm的酶,并且优选使用0.01-0.1ppm的酶但不在阴性对照缓冲液中破坏上皮明显降解ors组织,而没有显著损害ors细胞。
41.本领域技术人员可以确定所给定的酶是否具有破坏包含角质形成细胞及其效应蛋白的健康ors组织的能力,所述角质形成细胞及其效应蛋白可以通过简单的常规实验(例如在实施例6-8中公开的实验及其结果)分类为角蛋白。
42.本领域技术人员可以确定所给定的酶是否具有破坏由角质形成细胞及其效应蛋白组成的病变ors组织的能力,所述角质形成细胞及其效应蛋白可以通过简单的常规实验(例如在实施例9中公开的实验及其结果)分类为角蛋白。
43.药物组合物
44.本发明的药物组合物通过局部应用于待治疗的皮肤区域而使用。本领域技术人员可以通过简单的常规实验(例如在实施例10中公开的实验及其结果)确定局部施用后所给定的酶是否已经递送至毛囊中的作用部位,其中酶促进金纳米颗粒递送至距离皮肤表面至少300μm的毛囊。当相对于阴性对照(在相同组分中没有酶),金纳米颗粒显著更深地渗透到毛囊中作为酶活性的结果时,则认为酶在本发明中是局部递送的。
45.因此,本发明的组合物优选为以下形式:
[0046]-适用于局部应用,例如乳膏,洗液,凝胶,软膏,泡沫,薄膜,喷雾,尺寸为10至1000纳米的颗粒、细丝或球体的混悬液或它们更容易和更深入进入毛囊和皮肤的组合;或
[0047]-物理和/或化学促进成分和酶增强的皮肤渗透到活性部位的贴剂,其任选配有例如促进皮肤溶胀的闭塞措施或显微针或类似的尖端制品或容纳组合物的储库;或者
[0048]-诸如物理储存器、泵或通过诸如针的装置放置的颗粒的皮肤植入物;或已知、接
受或将来接受的其他制品或给药形式,用于靶向应用于皮肤或病变,例如局部施用组合物中的活性成分。
[0049]
该组合物还优选配制成毛囊内,皮内注射,优选病灶内注射,例如使用空心针通过将溶液注射到作用部位来治疗现有病变,其中具有潜在较低渗透性的晚期病损的致病蛋白将被水解。
[0050]
优选地,将所述一种或多种能够催化角质形成细胞效应分子(诸如蛋白质角蛋白,所述角质形成细胞效应分子支持人皮肤及其附属物如毛囊的生物屏障、功能和结构的功能和完整性)水解的酶以每平方厘米皮肤10ng至10000μg酶蛋白的量,优选每平方厘米皮肤100ng至1000μg酶蛋白,更优选每平方厘米皮肤100ng至100μg酶蛋白施用。
[0051]
优选地,所述一种或多种能够催化角质形成细胞效应分子(诸如蛋白质角蛋白,所述角质形成细胞效应分子支持人皮肤、闭塞的毛囊和皮肤病变如囊肿的生物屏障、功能和结构的功能和完整性)水解的酶以每个需要治疗的皮肤区域10ng至10.000μg酶蛋白的量注射到受影响的皮肤中,优选每个皮肤病变100ng至1000μg酶蛋白,更优选需要治疗的每个皮肤区域100ng至100μg酶蛋白。
[0052]
本发明的组合物优选以每克组合物1ng至100mg酶蛋白的量包含一种或多种能够催化角质形成细胞效应分子(诸如蛋白质角蛋白,所述角质形成细胞效应分子支持人皮肤及其附属物如毛囊的生物屏障、功能和结构的功能和完整性)水解的酶;或以ppm表示在本发明中定义的1ppm=1mg酶蛋白/l体积的本发明组合物,优选所述一种或多种能够催化角质形成细胞效应分子(诸如蛋白质角蛋白,所述角质形成细胞效应分子支持人皮肤及其附属物如毛囊的生物屏障、功能和结构的功能和完整性)水解的酶的含量为组合物的0.01ppm至1000ppm,优选组合物的1ppm至100ppm,更优选组合物的30ppm至100ppm。
[0053]
在一个实施方案中,所述组合物是药物组合物,其中成分及其浓度根据相关和当前的药物法规是或将是药学上可接受的,或者由特定组合物监管机构特别批准将在相关市场、病情或疾病范围内销售和应用的。
[0054]“药学上可接受的成分”或“是药学上可接受的成分”或语法上等同的术语在本说明书和权利要求中旨在表示具有用作药物组合物制造中的组分所需的均匀性和纯度的成分。本领域技术人员知道如何选择可接受用于这种用途的合适成分,例如通过使用公认的药典如美国药典或欧洲药典或全球同等的法律和监管机构。
[0055]
在一个实施方案中,除了至少一种药学上可接受的成分之外,还向组合物中加入另外的赋形剂。
[0056]
在一个实施方案中,所述组合物还包含其他药学活性分子。
[0057]
在一个实施方案中,所述组合物还包含减轻疼痛的药物活性分子。
[0058]
在一个实施方案中,所述组合物还包含减少炎症的药物活性分子。
[0059]
在一个实施方案中,所述组合物还包含减少毛发生长的药学活性分子。
[0060]
在一个实施方案中,所述组合物是半固体组合物,例如乳液。
[0061]
在一个实施方案中,所述组合物是包含具有分散的固体或半固体颗粒、细丝或它们的混合物的液体或半固体组合物的混悬液。优选地,所述颗粒具有10-10000nm、优选50-2000nm、特别是100-800nm的平均尺寸。
[0062]
在一个实施方案中,所述组合物还包含受益于局部递送的药物活性分子。
[0063]
其他组合物赋形剂
[0064]
本发明的组合物包含一种或多种能够催化角质形成细胞效应分子(诸如蛋白质角蛋白,所述角质形成细胞效应分子支持人皮肤、闭塞的毛囊和皮肤病变如囊肿的生物屏障、功能和结构的功能和完整性)水解的酶,以及选自以下各项的一种或多种其他成分:水,ph调节剂,防腐剂,蛋白质变性剂,如离液剂,有机盐,还原剂,稀释剂,离子强度调节剂,表面活性剂,醇,有机盐,螯合剂,ph调节化合物,酶辅因子,蜡,组合物和酶稳定剂,精油,包括油和蜡的脂质,结构和活性聚合物,并与抗炎和止痛化合物、皮肤剥脱剂、角蛋白溶解剂如健康的微生物组促进剂组合。优选地,所述一种或多种其他成分选自:酶活化剂如钙盐,ph缓冲盐,稳定剂如多元醇和糖,润湿剂如表面活性剂,渗透增强成分如离液剂和还原剂和水。
[0065]
在一个实施方案中,所述组合物具有通过以1至99%浓度、优选1至80%浓度、优选1至60%浓度、更优选1至40%浓度存在于组合物中的降低水活性的另外的赋形剂,因为它降低了可能破坏组合物的微生物生长,并且因为它增加了活性取决于水的酶如蛋白酶的稳定性。优选地,这些赋形剂选自多元醇如甘油和聚乙二醇。
[0066]
在一个实施方案中,所述组合物还包含表面活性剂。表面活性剂的亲水亲油平衡(hlb)是测量其更亲水或更亲脂的程度的量度,并且是本领域技术人员已知的。
[0067]
在一个实施方案中,所述表面活性剂是阳离子型的。
[0068]
在另一个实施方案中,所述表面活性剂是阴离子型的,例如十二烷基硫酸钠,以确保含有水的组合物的润湿并增强促进对外部化合物的分子渗透性的皮肤溶胀。
[0069]
在另一个实施方案中,所述表面活性剂是具有低hlb的非离子型表面活性剂,例如脱水山梨糖醇月桂酸酯,例如span 20,以确保润湿含水组合物并促进通过疏水屏障如毛囊皮脂的递送。优选地,非离子型表面活性剂具有介于0和20之间的hlb值,更优选hlb值介于5和12之间。优选地,非离子型表面活性剂具有介于5和18之间的hlb,例如0.001-10%的triton x-100。优选地,所述表面活性剂具有介于5和12之间的hlb,例如0.01-1%的triton x-100。另一种合适的非离子型表面活性剂是具有低hlb的非离子型表面活性剂,例如脱水山梨糖醇月桂酸酯,例如0.1-5%的span 20。优选所述表面活性剂是具有低hlb的非离子型表面活性剂,例如脱水山梨糖醇月桂酸酯,例如0.5-2%的span 20。
[0070]
在一个实施方案中,混合不同的表面活性剂以降低可能干扰蛋白质如酶的稳定性的游离单表面活性剂浓度。良好的混合物是较高的hlb 8至20的非离子型表面活性剂,诸如具有如脱水山梨糖醇月桂酸酯如0.1-5%的span 200的低hlb 0至12的非离子型表面活性剂的01-1%的triton x-100。另一种良好的混合物结合了具有低水活度的非离子型和阴离子型表面活性剂。
[0071]
在一个实施方案中,所述组合物还包含缓冲盐,例如10-1000mm tris/hcl,其确保在组合物中一种或多种酶最活跃的范围内的稳定ph。在一个优选的实施方案中,所述组合物包含缓冲盐,其允许组合物限制接近生理条件的潜在皮肤刺激,例如25-200mm tris/hcl,其确保在组合物中一种或多种酶最活跃的范围内的稳定ph。
[0072]
在一个实施方案中,所述组合物还包含允许该组合物限制接近生理条件的潜在皮肤刺激的盐如0.01-2%的nacl。在优选的实施方案中,所述组合物包含盐以将离子强度调节至生理上最佳的浓度,例如0.5-1.5%的nacl,其确保在组合物中一种或多种酶最活跃的范围内的离子强度。
[0073]
在一个实施方案中,所述组合物还包含增稠剂。
[0074]
在一个实施方案中,所述组合物还包含防腐剂如苯甲酸盐,丙酸盐或山梨酸盐,以避免可能破坏组合物的微生物生长。优选山梨酸盐,如0.001-10%山梨酸钾。在优选的实施方案中,所述组合物包含防腐剂如0.01-2%山梨酸钾。
[0075]
在一个实施方案中,所述组合物包含可溶性钙盐如0.1-100mm cacl2,因为它是活化和稳定辅因子的酶。在优选的实施方案中,所述组合物包含可溶性钙盐如1-10mm cacl2以稳定有益的酶。
[0076]
在一个实施方案中,所述组合物包含离液剂如0.01-8m尿素,因为它部分地可以溶解或促进皮肤蛋白的溶胀,从而使其更易于酶活性。在优选的实施方案中,所述组合物包含0.1-4m尿素以促进皮肤溶胀和增加的角蛋白溶解。
[0077]
在一个实施方案中,所述组合物包含还原剂如0.1-1000mm二硫苏糖醇或乙醇酸,因为它破坏通过化学还原交联蛋白质的胱氨酸桥(所述交联蛋白质可以是酶的底物),从而使它们更易于酶活性。在优选的实施方案中,所述组合物包含1-20mm二硫苏糖醇或乙醇酸以促进角蛋白中二硫桥键的还原和断裂以增加酶底物可及性。
[0078]
在一个实施方案中,所述组合物包含碱性盐如1-1000mm naoh以允许调节ph,这有利于酶活性,稳定性和底物溶解。在一个优选的实施方案中,所述组合物包含naoh以允许促进皮肤溶胀和增加角蛋白溶解的低碱性ph组合物。
[0079]
在一个实施方案中,所述组合物包含酸性盐如1-1000mm hcl以允许调节ph,这有利于酶活性,稳定性和底物溶解。在优选的实施方案中,所述组合物包含hcl以允许促进酶活性、稳定性和生理耐受性ph的酸性组合物。
[0080]
在一个实施方案中,所述组合物包含药学或美容上可接受的浓度的化学和生物制剂,所述浓度用于局部治疗毛囊相关病症,例如化脓性汗腺炎和痤疮形式,例如目前商业上使用的化学和生物制剂,例如过氧化苯甲酰,1,3-苯二醇,壬二酸,水杨酸,视黄醇激素及其衍生物,优选在药物和化妆品组合物中用于治疗化脓性汗腺炎和痤疮形式的任何化合物。
[0081]
在一个实施方案中,所述组合物包含足够的透明质酸以促进增强的酶递送至皮肤及其毛囊。
[0082]
在一个实施方案中,所述组合物包含促进增强的酶递送至皮肤及其毛囊的肽。
[0083]
化妆品组合物
[0084]
在另一个实施方案中,所述组合物是化妆品组合物,其中成分是化妆品组合物的合适标准,并且可以由监管机构批准例如通过现有或将获得的批准进入欧盟委员会化妆品成分数据库。
[0085]
化妆品可接受的成分或化妆品组合物的合适标准的成分在本说明书和权利要求中,旨在表示具有用作化妆品组合物制造中的组分所需的均匀性和纯度的成分。本领域技术人员知道如何选择可接受用于这种用途的合适成分,例如通过使用化妆品工业的公认标准及其法规,所述法规例如通过欧盟委员会或取决于立法区域的同等机构的立法。在一个实施方案中,所述化妆品组合物包含与药物组合物相同或相关但美容上可接受的成分和浓度。
[0086]
在特别适合的实施方案中,本发明涉及:
[0087]
一种包含一种或多种能够催化角质形成细胞效应分子(例如支持人皮肤及其附属
物如毛囊的完整性的蛋白质角蛋白)水解的谷氨酰内肽酶的组合物,所述完整性受角质形成细胞支持以维持生物屏障、功能和结构,其中所述组合物是:
[0088]
a.一种药物组合物,除了一种或多种能够催化角质形成细胞效应分子(诸如支持人皮肤及其附属物如毛囊的功能和完整性的蛋白角蛋白)水解的谷氨酰内肽酶之外,其包含至少一种药学上可接受的成分,所述成分选自为酶活性打开蛋白质底物的表面活性剂,酶活性增强剂和稳定剂以及使酶能够穿透皮肤外层和毛囊以及作用部位以促进组合物的使用和目的的试剂;或
[0089]
b.一种化妆品组合物,除了一种或多种能够催化角质形成细胞效应分子(诸如支持人皮肤及其附属物如毛囊的功能和完整性的蛋白角蛋白)水解的谷氨酰内肽酶之外,其包含至少一种美容上可接受的成分,所述成分选自为酶活性打开蛋白质底物的表面活性剂,酶活性增强剂和稳定剂以及使酶能够穿透皮肤外层和毛囊以及作用部位以促进组合物的使用和目的的试剂。
[0090]
上述实施方案中优选的谷氨酰内肽酶是来自芽孢杆菌的谷氨酰内肽酶,来自短小芽孢杆菌ja16的谷氨酰内肽酶丝氨酸蛋白酶bppb和来自地衣芽孢杆菌的谷氨酰内肽酶blase。
[0091]
通常对于所有实施方案,谷氨酰内肽酶是具有谷氨酰内肽酶比率(gr)》5的内肽酶,计算为gr=对suc-aape-pna的活性/对suc-aap(非)e-pna的活性(具有最高活性),其中suc-aap(非)e-pna是以下suc-aapa-pna,suc-aapd-pna,suc-aapf-pna,suc-aapi-pna,suc-aapk-pna,suc-aapl-pna,suc-aapm-pna,suc-aapr-pna或suc-aapv-pna之一。
[0092]
优选局部施用或注射到病变皮肤中的水性或乳液组合物还包含至少一种优选选自阴离子型、非离子型和它们的混合物的表面活性剂,其与酶稳定性和活性相容并促进皮肤外层的酶渗透并递送至毛囊和作用部位以促进组合物的使用和目的。
[0093]
优选局部施用或注射到病变皮肤中的混悬液组合物包含具有分散的固体或半固体颗粒、细丝或它们的混合物的液体或半固体组合物。优选地,所述颗粒对于局部毛囊递送具有200-800nm的平均尺寸,对于可注射组合物具有80-10000nm的平均尺寸。
[0094]
优选地,为酶活性打开蛋白质底物的表面活性剂选自span 20、span40、span 60、span 80和brij 72。
[0095]
优选地、酶活性增强剂和稳定剂选自甘油、糖和丙二醇、钙盐和酶抑制剂。
[0096]
优选地,使酶能够穿透皮肤外层和毛囊并进入作用部位以促进组合物的使用和目的的试剂选自还原剂,例如乙醇酸、离液剂如尿素和润湿剂如脱水山梨糖醇月桂酸酯。
[0097]
优选地,应用根据本发明的组合物:
[0098]
·
局部地,因为它可以提供安全,预防和治疗益处,商业效率效率高,并且被监管机构所熟知;或
[0099]
·
通过微针贴剂,因为它对患者/客户是友好/方便的,仅将酶限制在目标皮肤区域,不像局部用的乳膏和压按皮肤酸痛处;或
[0100]
·
通过皮下注射针头治疗孤立的可注射病灶/囊肿,因为它们可能会进一步生长或扩散。
[0101]
组合物用于治疗的用途
[0102]
本发明的组合物用于治疗需要这种治疗的人的皮肤病和毛囊相关病症。
[0103]
术语“毛囊相关病症”在本技术中是指与毛囊,其组织、细胞、细胞内和细胞外蛋白质及其修饰物和毛干及其组分(包括蛋白质,碳水化合物和脂质)相关的病症。
[0104]
在一个优选的实施方案中,根据本发明的用途包括药物治疗和/或预防诸如多毛症、假性毛囊炎、寻常痤疮或包括聚合性痤疮、藏毛窦病、头皮切割性蜂窝组织炎和化脓性汗腺炎的毛囊闭锁四联综合征。
[0105]
多种毛囊病症和疾病或毛囊相关的皮肤病适合于用本发明治疗,例如过度或病理性毛发生长,包括妇女多毛症、多毛症或假性毛囊炎;或由毛囊性角化过度和毛囊闭锁引起的皮肤病;或导致寻常痤疮、毛发角化病、dowling-degos病、hailey-hailey病、乳房瘘、福克斯-福代斯二氏病、小棘毛壅病(trichostasis spinulosa)、面部萎缩性毛周角化病(keratosis pilaris atrophicans faciei)、蠕虫样皮萎缩(atrophoderma vermiculatum)和包括聚合性痤疮、藏毛窦病、头皮切割性蜂窝组织炎和化脓性汗腺炎的毛囊闭锁四联综合征,以及炎性毛囊相关疾病,包括毛囊性牛皮癣,毛发红糠疹,盘状红斑狼疮,毛发扁平苔藓,肥厚性毛发扁平苔藓,lichen planus follicularis tumidus、lichen schlerosus、小棘苔藓,wong型皮肌炎,感染性毛囊相关疾病,包括黑热病后皮肤利什曼病,交界性结节性麻风病中的i型反应,毛囊糠疹发展的附件疾病;和其他与毛囊有关的疾病,包括黑头粉刺样痣,嗜毛囊性蕈样肉芽肿和phyrnoderma。
[0106]
在另一个优选实施方案中,根据本发明的用途包括美容治疗人体上不希望的毛发生长。
[0107]
本发明的组合物可用于通过将组合物应用于待治疗的皮肤或病变区域来治疗毛囊皮肤病和毛囊相关病症,使组合物在保持期内留在皮肤上或皮肤中以允许组合物本发明的功能。
[0108]
在治疗期间,本发明组合物中的一种或多种酶将对可归类为增殖性或过度增殖性角质形成细胞在某一点产生的角蛋白的蛋白质发挥其水解活性,导致毛发松动,并且毛发变得可以使用比从相同个体移除未经处理的毛发所需的力少得多的力去除,或者毛发甚至可能脱落。此外,由毛干周围的增殖性或过度增殖性角质形成细胞产生的毛囊组织及其根鞘特异性角蛋白的降解具有以下结果:毛囊闭锁/堵塞的频率和/或程度降低,这限制了闭塞毛囊进入感染的或疾病造成的毛囊的进展。治疗还可以减少闭塞,并可能在疾病的早期阶段完全拔下并挽救毛囊,例如化脓性汗腺炎或相关综合征,从而控制和预防早期疾病的疾病进展、复发和发展及其标志性病变,所述标志性病变后随的是更严重的疾病阶段,对患者负担更重。
[0109]
本发明的组合物甚至可以注射到或局部应用于受疾病的更严重阶段影响的身体区域,其中该区域包括被阻塞的和/或感染的毛囊或皮肤囊肿;并且可以在该实施方案中用于减少或干预疾病发展,以避免在一个或多个区域进一步的疾病推进。
[0110]
保持期应足够长以允许一种或多种能够催化角质形成细胞效应分子(例如支持人皮肤及其附属物如毛囊的生物屏障、功能和结构的完整性的蛋白质角蛋白)水解的酶并有足够的效果。通常,局部施用的组合物的保持期选择在2分钟至24小时的范围内,例如在3-60分钟的范围内,例如在5-30分钟的范围内,例如在过夜睡眠期间。在一些实施方案中,例如所述组合物是凝胶;保持期实际上将继续,直到酶变得无活性,例如对于凝胶组合物当皮肤、粘膜或毛囊组织在数小时至数天至数周后自然脱皮并推出酶和/或当皮肤外部清洁时
将发生。在一些实施方案中,例如其中所述组合物是可以通过物理剥离或洗掉而完全回收的医用贴剂或其他非液体组合物;保持期实际上将继续,直到酶变得无活性,例如对于医疗贴剂组合物可能在数小时至数天后发生。在一些实施方案中,例如在组合物是病灶内注射的情况下,保持期则不相关。
[0111]
仍然具有毛干的毛囊和病变组织的ors的完整性可以由本领域技术人员使用图2和实施例3中描述的简单技术概念来评估。去除毛发所必需的力是本领域技术人员使用图2中描述的已知技术可以使用的一种方便的功能性、定量性测量。当将去除经处理的毛发所需的力与去除未经处理的毛发所需的力进行比较时,优选对几根单独的毛发进行测量并计算平均力,以补偿由于皮肤生物学和类型、其当前状况和随着时间的推移毛发生长、脱落和再生的天然毛囊周期变化而发生的毛发到毛发的变化。因此,根据本发明,优选地应将去除经处理/未经处理的毛发所需的力计算为皮肤活组织检查中至少3根或更多根毛发的平均值。如果可用于皮肤活组织检查的较少,则优选基于活组织检查中所有可用毛发计算平均值。优选地,与未经处理的毛发相比,除去经处理的毛发所需的力减少至少10%,优选至少20%,优选至少30%,优选至少40%,优选至少50%,优选至少60%,或至少70%,或至少80%,或至少对应于减轻疼痛至无痛脱毛,或增加毛囊相关疾病的预防或控制的程度。
[0112]
实施例3中示出了用于测量去除毛发所需力的方法的实例。在用酶温育具有ors的拔下的人毛发之后,可以通过组织学成像进一步评估人皮肤中ors的完整性。本领域技术人员使用显微镜和组织和细胞组分特异性染色检查ors和周围组织的组织学完整性。本领域技术人员评估可被认为有益于本发明目的的涉及治疗毛囊皮肤病和毛囊相关病症的组合物的差异的方法的实例示于实施例1-10和图3-7。
[0113]
在一个实施方案中,本发明的组合物用于治疗妇女多毛症和多毛症。在该实施方案中,本发明提供了一种有效的治疗方法,其允许从受影响的皮肤区域去除过量的包括其根部的毛干,从而产生更持久的效果,疼痛更少或没有。
[0114]
在另一个实施方案中,本发明的组合物用于治疗假性毛囊炎。在该实施方案中,本发明提供了一种有效的治疗方法,其允许从受影响的皮肤区域特别是面部和颈部去除过多的毛发,或者减少剃毛失误和损伤皮肤的皮肤刺激,这可能是由毛发功能障碍引起的毛囊锚定组织,细胞及其蛋白质。
[0115]
在另一个实施方案中,本发明的组合物用于治疗寻常痤疮。在该实施方案中,本发明提供了一种有效的治疗方法,其允许以低皮肤刺激风险缓解粉刺、丘疹、结节、囊肿、脓疱(postules)、损伤和从受影响的皮肤区域去除过多的毛发。
[0116]
在另一个实施方案中,本发明的组合物用于治疗毛发角化病,其中闭塞的毛囊产生发痒和散布的结节。
[0117]
在另一个实施方案中,本发明的组合物用于治疗毛囊性角化过度和与闭塞相关的疾病,例如dowling-degos病、hailey-hailey病,乳房瘘。
[0118]
在另一个实施方案中,本发明的组合物用于治疗依赖于相同毛囊角蛋白相关的发展以发展病症的化脓性汗腺炎和其他毛囊四联或毛囊闭锁病。在该实施方案中,本发明特别适用于治疗病变发展的早期阶段,其中本发明的组合物用于在晚期和更严重的症状出现之前预防或减少毛囊的闭塞。由于所有患有化脓性汗腺炎和所描述的相关疾病的患者都具有由经历生长各阶段的毛囊循环而导致的复发性病变,因此本发明有益于病症或疾病严重
性的所有阶段。
[0119]
在另一个实施方案中,本发明的组合物用于治疗炎性毛囊相关病症,包括毛囊性牛皮癣、毛发红糠疹、盘状红斑狼疮、毛发扁平苔藓、肥厚性毛发扁平苔藓、lichen planus follicularis tumidus、lichen schlerosus、小棘苔藓、wong型皮肌炎,感染性毛囊相关疾病,包括黑热病后皮肤利什曼病、交界性结节性麻风病中的i型反应、毛囊糠疹;和其他与毛囊相关的疾病,包括黑头粉刺样痣、嗜毛囊性蕈样肉芽肿和phyrnoderma。
[0120]
本发明由以下提供用于说明本发明的实施例进一步描述和支持,不应被认为以任何方式受到限制。
[0121]
具体实施形式
[0122]
实施例1:通过脱毛就ors组织活性筛选内肽酶
[0123]
本实施例描述了用于筛选一组不同内肽酶从皮肤上脱毛能力的测定法,以提供蛋白质水解的催化措施,所述蛋白质例如支持毛囊功能和完整性的毛发锚定角蛋白。
[0124]
实验设计如图1所示。猪耳是多毛人体皮肤的良好生理模型,但需要控制固有的生物学变化。从一个饲养用于动物实验的长白猪的单一供应商取样死后的耳朵,用水彻底冲洗,成对放入密封的塑料袋中并立即在-20℃冷冻。耳朵在冷冻后不到一个月用于实验。对于每个酶实验,将一对冷冻的耳朵在塑料袋中的250ml生理学150mm nacl(20℃)中在约1小时的期间内解冻,以确保在解冻期间皮肤被完全解冻。弃去盐溶液,用100ml洗发剂溶液(4ml macurth温和有机洗发剂,十二烷基磺基琥珀酸二钠(阴离子型)和椰油基葡萄糖苷(非离子型)表面活性剂+96ml水)彻底洗涤耳朵两分钟以除去污垢并减少微生物群。耳朵在自来水中冲洗并在皮肤切片之前用纸巾干燥。
[0125]
为了最好地将生物学变化与酶效应分开,将每个实验所用耳朵对上的镜像位置用于参考样品和酶样品(1)。为了说明耳朵对之间绝对效应的差异,所有耳朵均包括阴性和阳性对照。阳性对照是来自地衣芽孢杆菌的谷氨酰内肽酶blase,其在测定的设计阶段显示出最大效果,允许该数据点验证生物样品在耳朵对之间是可靠且一致的。每只耳朵4个20x20mm的皮肤片=在每个实验中每对8片小心地从耳朵的背侧切下,并通过用锋利的手术刀在软骨面旁边切割,小心地从软骨上除去皮肤。
[0126]
使用25mm tris/hcl,150mm nacl,5mm cacl2,2mm山梨酸钾,1%span 20缓冲至中性ph=7.4(hz缓冲液和阴性对照),在30℃的皮肤表面温度下进行测定。分别选择这些条件以适合药物和化妆品组合物,通过钙离子稳定酶,减少实验期间的微生物生长,促进润湿和限制刺激。
[0127]
筛选的11种内肽酶列于表1中,代表了广泛多样的内肽酶类别,其具有在uniprot或merops数据库中公开注释的不同蛋白水解特异性。通过柱色谱法将它们分别纯化至其中在sds-page分离和考马斯蓝染色后可观察到单一条带的纯度。
[0128]
表1
[0129][0130][0131]
温育两个皮肤片作为阴性对照(每个皮肤片2400μl的hz缓冲液),温育两个皮肤片作为阳性对照(2400μl的hz缓冲液,每个皮肤片100ppm hz-2),并温育四个皮肤片作为内肽酶的(在(1)中的hz)温育(每个皮肤片2400μl的hz缓冲液和100ppm内肽酶)。将皮肤片在30℃下温育3小时。弃去溶液,用自来水彻底冲洗皮肤片并用纸巾干燥并将其置于通风橱下1小时。
[0132]
将50x25 mm的运动胶带(来自瑞典svea medical sports ab的sportsdoc medical pro deluxe,25mm)在与毛发方向相同方向的取向上轻轻地放置在每个皮肤片上,并牢固地按压施加足够的力以确保毛发与粘合剂之间的接触(2)。沿着与毛发(3)的自然方向相反的方向一次移动拉下胶带。运动胶带的粘合剂非常强劲以致于毛发会断裂、使毛根留在皮肤中,或者胶带会将具有根鞘的毛发完整地拉出。胶带剥离后,胶带用0.5m hcl中的1%对-二甲氨基肉桂醛(dmaca)染色,其将irs染成鲜红色(4)。红色irs的数量和它们的长
度是鉴定内肽酶催化蛋白质水解的能力的便利手段,所述蛋白质例如支持毛囊功能和完整性的毛发锚定角蛋白。拍照后,通过计算红色irs的数量并使用绘图软件(openorientering mapper)测量胶带上存在的irs总长度来评估irs,使用胶带的宽度以标准化数据。结果列于下表2。为了说明耳朵对至耳朵对的变化,irs的相对数量和irs的相对总长度计算如下:((酶-阴性对照)/(阳性对照-阴性对照))*100%。
[0133]
表2:
[0134][0135]
来自地衣芽孢杆菌的谷氨酰内肽酶blase被鉴定为11种测试的内肽酶中表现最佳的内肽酶,其最有效地催化锚定蛋白例如角蛋白的水解,所述角蛋白支持毛囊的功能和完整性。
[0136]
为了确定谷氨酰内肽酶是否特别适合催化支持毛囊功能和完整性的角蛋白,如上所述研究了来自其他生物的三种谷氨酰内肽酶(参见表3)。
[0137]
表3:
[0138][0139]
表3中列出并在上述测定中测试的另外三种谷氨酰内肽酶的结果显示在下表4中。
[0140]
表4:
[0141][0142]
从上表可以看出,谷氨酰内肽酶是最适合用于催化蛋白质(例如支持毛囊功能和完整性的毛发锚定角蛋白)水解的内肽酶。
[0143]
实施例2:谷氨酰内肽酶活性的定义。
[0144]
本实施例描述了在本发明的背景下用于评估内肽酶是否是谷氨酰内肽酶的测定法。谷氨酰内肽是在谷氨酸残基的羧基末端侧(或磷酸盐缓冲液中的天冬氨酸残基)切割的内肽酶,即它们优先选择底物p1位带负电荷的氨基酸残基。以下测定用于测试在本发明中使用的表1和表3中列出的序列1-4,7-8,10和12-14中包括的在实施例1中提供显著反应的内肽酶是否是谷氨酰内肽酶。
[0145]
用0.01%的triton x-100稀释20μl的每种内肽酶,置于25℃的微量滴定板中的孔中,并使用以下市售底物(bachem ag,bubendorf,switzerland)进行测定:suc-aapa-pna(bachem 4015680),suc-aapd-pna(bachem 4018122),suc-aape-pna(bachem 4017343),suc-aapf-pna(bachem 4002299),suc-aapi-pna(bachem 4017698),suc-aapk-pna(bachem 4017329),suc-aapl-pna(bachem 4003646),suc-aapm-pna(bachem 4006760),suc-aapr-pna(bachem 4017320),suc-aapv-pna(bachem 401767)。
[0146]
通过添加200μl的pna底物(50mg溶于1.0ml dmso中,并进一步用50mm tris/hcl,0.01%的triton x-100,ph 8.0稀释75倍)开始反应。在molecular devices的versamax微量滴定仪中读取微量滴定板,od405的初始增加是内肽酶活性的量度。如果在测量时间的4分钟内未达到线性图,则将内肽酶稀释,并重复测定。
[0147]
在上述测定中测试的十种内肽酶的结果显示在下表5中。数据对应于十种不同的suc-aapx-pna底物(x=不同氨基酸)上的每种内肽酶的相对活性,即,特定的suc-aapx-pna底物的活性除以十个suc-aapx-pna底物的suc-aapx-pna底物的活性(用最高活性)。计算中考虑了内肽酶的稀释度。
[0148]
表5:
[0149][0150]
从表5中可以观察到来自地衣芽孢杆菌(hz-2)的谷氨酰内肽酶blase,来自灰色链霉菌的谷氨酰内肽酶ii spre(hz-13),来自短小芽孢杆菌ja16(hz-15)的丝氨酸蛋白酶bppb和来自金黄色葡萄球菌(hz-35)的v8蛋白酶对suc-aape-pna底物具有最高活性,而它们对其他底物的相对活性较低。因此,这些内肽酶被认为是谷氨酰内肽酶。为了确定内肽酶是否是谷氨酰内肽酶,我们定义了谷氨酰内肽酶比率(gr),计算如下:gr=对suc-aape-pna的活性/对suc-aap(非)e-pna的活性(用最高活性)。
[0151]
根据本发明的谷氨酰内肽酶被定义为谷氨酰内肽酶比率(gr)》5的内肽酶。
[0152]
实施例3:通过用内肽酶局部治疗的脱毛效果的定量
[0153]
本实施例描述了通过在毛猪皮上局部施用酶组合物后测量拔出毛发的力来定量所选内肽酶的脱毛效果的测定法。
[0154]
为了将皮肤样品之间的生物学差异与酶效应分开,与实施例1中所述相同的考虑适用于本实施例,并具有以下额外考虑;外皮肤层被穿孔(5),使用不同的耳朵位置(6),并将模具粘在皮肤上以确保严格的局部相互作用。
[0155]
图2提供了实验设计的示意图。为了说明猪耳皮肤最外层厚度的变化,并增加深层皮肤侧毛囊内肽酶的递送,耳朵的背侧用derma辊(来自rohs的argador derma辊系统,具有在欧盟批准用于化妆品用途的540x1.5mm微针)处理,通过使用derma辊在皮肤上垂直、水平和两个对角线滚动皮肤4次,在辊上使用可靠压力以确保皮肤均匀穿孔。为了定义用于酶处理的限定的18x18mm皮肤区域,使用氰基丙烯酸乙酯胶水将三个聚甲基丙烯酸甲酯(pmma)方形模具粘在每只耳朵背侧的镜像位置上。
[0156]
组合物的生理温度、ph和盐浓度与实施例1相同加上10mm dtt(hz缓冲液dtt)。耳朵对上的六个pmma方块用于三种不同类型的处理:阴性对照、阳性对照和内肽酶样品((6)中的hz)。在本实施例中包括表1和3中列出的在实施例1中给出阳性应答的九种内肽酶,包括seq idno:1,3,6-8,10和seq id no:12-14。
[0157]
两个方块是阴性对照(每块600μl的hz缓冲液dtt),两个方块是阳性对照(每块600μl的hz缓冲液dtt和100ppm hz-2),两个方块是内肽酶样品的处理(每块600μl的hz缓冲液dtt和30ppm至100ppm内肽酶)。将具有正块和酶的皮肤片在4℃下水平储存约20小时,使耳朵保持完整。随后,将皮肤片在30℃下温育4小时,等于皮肤表面温度。
[0158]
丢弃所述方块的溶液,并通过沿着所述方块的内侧用手术刀切割从皮肤上移除所述方块从而从胶水粘合剂中放松毛发。将处理过的皮肤区域在去离子水中小心洗涤,并用纸巾小心地干燥皮肤片。最后,在酶温育后从每个皮肤片拉出单个毛发所需的力通过将它们固定到用线和垂直移动的夹具(7)与主轴电动机连接的sauter fk 10数字测力计来测量。
[0159]
结果:
[0160]
结果概述如下表6所示。相对于阴性对照的力降低计算如下:((阴性对照-酶)/(阴性对照))*100%。与阳性对照相比,力降低计算如下:((阴性对照-酶)/(阴性对照-阳性对照))*100%。对于每个皮肤样品,测量每个样品至少7根和最多10根单独毛发的力,并计算耳朵对内每个处理的重复样品的平均值。由于耳朵对至耳朵对的变化,与阳性对照相比,力减小的数据才被接受并示于下表,如果阳性对照(100ppm hz-2)被认为显著低于阴性对照,使用学生t检验,p值小于或等于0.05。
[0161]
表6:
[0162][0163]
从表6中可以看出,在100ppm时,来自地衣芽孢杆菌hz-2(阳性对照)的谷氨酰内肽酶blase相对于阴性对照降低的力最大,而在100ppm时hz-10、hz-11、hz-15和hz-35只能将力减小到100ppm时hz-2的79-86%,其相当于在30ppm时的hz-2(85%)。hz-13在实例1中的性能表现出低于预期的性能,但实施例4显示其在本实施例中测试的特定条件下不稳定。
[0164]
实施例4:内肽酶活性的稳定性。
[0165]
本实施例描述了评估内肽酶在本发明测试的皮肤应用条件内是否稳定的测定法。一种相关的皮肤应用是实施例1中描述的筛选测定。另一种相关的皮肤应用是实施例3中描述的皮肤侧测定。
[0166]
两种温育缓冲液用于本稳定性测定。温育缓冲液a:25mm tris/hcl,150mm nacl,5mm cacl2,2mm山梨酸钾,1%span 20,ph 7.4(用于实施例1)和温育缓冲液b:25mm tris/hcl,150mm nacl,5mm cacl2,2mm山梨酸钾,10mm dtt,1%span 20,ph 7.4(用于实施例3)。
[0167]
通过稀释至0.10mg/ml(至少20倍稀释)将每种内肽酶转移至两个温育缓冲液a和b中,并将一小份等分试样保存在冰上直至活性分析。温育缓冲液a稀释液的主要部分在30℃温育3小时(与实施例1中皮肤碎片的温育相同)。温育后,测定30℃温育的稀释液a和保持在
冰上(0℃)的相应稀释液的内肽酶的残留活性。实施例1稳定性测定为30℃温育稀释液a的活性除以0℃温育稀释液a的活性。
[0168]
温育缓冲液b稀释液的主要部分在30℃温育4小时。由于在诸如4℃的低温下酶失活是最小的,所以实施例3中在4℃下额外的过夜储存对残余活性的影响可以忽略不计。温育后,测定内肽酶的残留活性。实施例3稳定性被确定为30℃温育的稀释液b的活性除以0℃温育的稀释液a的活性。这样,我们既考虑了由于缓冲液中的dtt导致的较低稳定性,又考虑了由于较长的温育时间导致的较低稳定性。
[0169]
表7:
[0170]
酶seq id no:底物hz-21suc-aape-pnahz-32suc-aapf-pnahz-43suc-aapk-pnahz-64suc-aapf-pnahz-85protazyme akhz-96protazyme akhz-107suc-aapf-pnahz-118suc-aapf-pnahz-1312suc-aape-pnahz-1513suc-aape-pnahz-189protazyme akhz-1910suc-aapk-pnahz-3211protazyme akhz-3514suc-aape-pna
[0171]
使用suc-aapx-pna(其中x代表不同底物中的不同氨基酸)或protazyme-ak在表7中列出了每种内肽酶的合适底物。对于suc-aapx-pna底物,通过与本发明实施例2中所述的活性测定相同的测定来确定残留活性。对于protazyme ak,通过将20μl内肽酶溶液(在0.01%的triton x-100中稀释)加入到500μl protazyme ak混悬液(来自megazyme ltd.,wicklow,ireland的1个protazyme ak片剂悬浮于2.0ml 0.01%的triton x-100中)与500μl 5mm mops/naoh,0.01%的triton x-100,ph7.0于1.5ml eppendorf管中的冰冷混合物中来测定残留活性。通过将管转移至设定为37℃的预热eppendorf热混合器开始protazyme ak测定。然后将管在热混合器上以1100rpm温育15分钟。将管转移回冰浴中。将200μl冷却的上清液转移至微量滴定板,并在来自molecular devices的versamax微量滴定读数器中读取od405。内肽酶样品的od405减去缓冲液空白的od405是内肽酶样品残留活性的量度。如果od405测量值高于1.5od405单位,则将内肽酶进一步稀释,并重复测定。
[0172]
考虑到稀释倍数的情况下,数据对应于如上所述计算并在表8中列出的每种内肽酶的相对活性。
[0173]
表8:
[0174]
酶实施例1稳定性实施例3稳定性hz-20.960.98
hz-31.051.09hz-40.970.76hz-60.990.75hz-81.060.03hz-90.980.84hz-101.001.02hz-110.930.19hz-130.970.17hz-150.961.09hz-181.070.05hz-191.010.87hz-321.070.97hz-351.041.03
[0175]
可以看出,所有酶在与实施例1相当的条件下都是稳定的。因此,酶在整个温育期间都是有活性的。
[0176]
可以看出,并非所有酶在等同于实施例3的条件下都是稳定的。这是因为在30℃下在温育缓冲液b中4小时后hz-8,hz-11,hz-13和hz-18具有降低的活性,表明这些内肽酶在整个温育期间不是100%活性的。这些数据解释了为什么在实施例3中hz-13作为谷氨酰内肽酶表现不佳。
[0177]
实施例4:内肽酶活性的稳定性。
[0178]
本实施例描述了评估内肽酶在本发明测试的皮肤应用条件内是否稳定的测定法。一种相关的皮肤应用是实施例1中描述的筛选测定。另一种相关的皮肤应用是实施例3中描述的皮肤侧测定。
[0179]
表9:
[0180]
酶seq id no:底物hz-21suc-aape-pnahz-32suc-aapf-pnahz-43suc-aapk-pnahz-64suc-aapf-pnahz-85protazyme akhz-96protazyme akhz-107suc-aapf-pnahz-118suc-aapf-pnahz-1312suc-aape-pnahz-1513suc-aape-pnahz-189protazyme akhz-1910suc-aapk-pnahz-3211protazyme akhz-3514suc-aape-pna
[0181]
两种温育缓冲液用于本稳定性测定。温育缓冲液a:25mm tris/hcl,150mm nacl,5mm cacl2,2mm山梨酸钾,1%span 20,ph 7.4(用于实施例1)和温育缓冲液b:25mm tris/hcl,150mm nacl,5mm cacl2,2mm山梨酸钾,10mm dtt,1%span 20,ph 7.4(用于实施例3)。
[0182]
通过稀释至0.10mg/ml(至少20倍稀释)将每种内肽酶转移至两个温育缓冲液a和b中,并将一小份等分试样保存在冰上直至活性分析。温育缓冲液a稀释液的主要部分在30℃温育3小时(与实施例1中皮肤碎片的温育相同)。温育后,测定30℃温育的稀释液a和保持在冰上(0℃)的相应稀释液的内肽酶的残留活性。实施例1稳定性测定为30℃温育稀释液a的活性除以0℃温育稀释液a的活性。
[0183]
温育缓冲液b稀释液的主要部分在30℃温育4小时。由于在诸如4℃的低温下酶失活是最小的,所以实施例3中在4℃下额外的过夜储存对残余活性的影响可以忽略不计。温育后,测定内肽酶的残留活性。实施例3稳定性被确定为30℃温育的稀释液b的活性除以0℃温育的稀释液a的活性。这样,我们既考虑了由于缓冲液中的dtt导致的较低稳定性,又考虑了由于较长的温育时间导致的较低稳定性。
[0184]
使用suc-aapx-pna(其中x代表不同底物中的不同氨基酸)或protazyme-ak在表9中列出了每种内肽酶的合适底物。对于suc-aapx-pna底物,通过与本发明实施例2中所述的活性测定相同的测定来确定残留活性。对于protazyme ak,通过将20μl内肽酶溶液(在0.01%的triton x-100中稀释)加入到500μl protazyme ak混悬液(来自megazyme ltd.,wicklow,ireland的1个protazyme ak片剂悬浮于2.0ml 0.01%的triton x-100中)与500μl 5mm mops/naoh,0.01%的triton x-100,ph7.0于1.5ml eppendorf管中的冰冷混合物中来测定残留活性。通过将管转移至设定为37℃的预热eppendorf热混合器开始protazyme ak测定。然后将管在热混合器上以1100rpm温育15分钟。将管转移回冰浴中。将200μl冷却的上清液转移至微量滴定板,并在来自molecular devices的versamax微量滴定读数器中读取od405。内肽酶样品的od405减去缓冲液空白的od405是内肽酶样品残留活性的量度。如果od405测量值高于1.5od405单位,则将内肽酶进一步稀释,并重复测定。
[0185]
结果:
[0186]
考虑到稀释倍数的情况下,数据对应于如上所述计算并在表10中列出的每种内肽酶的相对活性。
[0187]
表10:
[0188]
酶实施例1稳定性实施例3稳定性hz-20.960.98hz-31.051.09hz-40.970.76hz-60.990.75hz-81.060.03hz-90.980.84hz-101.001.02hz-110.930.19hz-130.970.17hz-150.961.09
hz-181.070.05hz-191.010.87hz-321.070.97hz-351.041.03
[0189]
可以看出,所有酶在与实施例1相当的条件下都是稳定的。因此,酶在整个温育期间都是有活性的。
[0190]
可以看出,并非所有酶在等同于实施例3的条件下都是稳定的。这是因为在30℃下在温育缓冲液b中4小时后hz-8,hz-11,hz-13和hz-18具有降低的活性,表明这些内肽酶在整个温育期间不是100%活性的。这些数据解释了为什么在实施例3中hz-13作为谷氨酰内肽酶表现不佳。
[0191]
实施例5:谷氨酰内肽酶对外部人皮肤层蛋白具有较小活性
[0192]
本实施例描述了用于评估内肽酶对身体最外皮肤层的侵袭性的测定法,所述皮肤层包含针对酶或其他药物化合物递送至皮肤和毛囊的主要生物屏障。
[0193]
在本实施例中分析表1和表3中列出的显示对实施例1中的ors组织具有靶向活性的seq id no:1,3,6-8,10和12-14的九种内肽酶以量化每种酶的角质层蛋白水解的程度。
[0194]
长老茧且厚的皮肤由皮肤最外层角质层中增加的死亡角化细胞层组成。就健康而言,它是通常在手掌和脚底上发现的保护性反应,或者它可能是皮肤病学病症中病理学的原因。使用金属刮刀在来自健康人志愿者的干脚底上制备粒状或粉状硬皮基质。通过用0.01%的triton x-100洗涤两次除去可溶性蛋白质来制备底物。制备在0.01%的triton x-100中的25mg/ml混悬液,并将200μl混悬液移液到1.5ml eppendorf管中。通过短时间离心沉淀底物,弃去上清液。通过在eppendorf热混合器上搅拌(2000rpm,2分钟)将沉淀重悬于200μl 0.01%的triton x-100中,并将混悬液再次离心,弃去上清液。通过eppendorf混合将第二种沉淀物重悬于180μl的hz缓冲液中以制备190μl混悬液,将其置于冰上。将内肽酶在0.01%的triton x-100中稀释至500ppm,并将10μl各稀释液加入具有悬浮皮肤底物的eppendorf管中,得到25ppm内肽酶的终浓度,用于一式两份的测定。将eppendorf管在预热的eppendorf热混合器(30分钟,30℃,2000rpm)上温育,温育后将管转移回冰中冷却几分钟。将管离心,将上清液在0.01%的triton x-100中稀释10倍。
[0195]
将每种内肽酶的稀释上清液中的水解度表达为通过使用pierce bca蛋白质测定试剂盒(来自thermo scientific的23227)于562nm处的吸光度测量溶解的蛋白质浓度。结果如下表11所示。
[0196]
表11:
[0197][0198]
在表11中可以观察到,hz-10,hz-11和hz-19水解了大部分外皮肤层。太多的非特异性水解是不希望的,因为它可能破坏生物屏障而不是治疗性酶。在目前条件下,谷氨酰内肽酶对皮肤蛋白具有4-5倍较低水平(hz-2,hz-15,hz-13)和几乎没有(hz-35)水解活性。可能的优点是,本发明中包含的酶具有有限的外皮肤层活性,因为它们不仅希望破坏ors以促进脱毛,还希望一些选定的活性以促进酶递送至毛囊、具有角质层细胞和角蛋白碎片的闭塞毛囊或递送至毛囊相关病灶。
[0199]
实施例6:谷氨酰内肽酶有效破坏人类胡须毛的人类ors组织
[0200]
本实施例说明了谷氨酰内肽酶的独特选择性如何转化为人ors组织及其角蛋白组分的降解,其负责引起毛囊相关疾病。表1中列出的在实施例1和实施例3中显示活性并且在实施例4中稳定的seq id no:1(hz-2)和seq id no:7(hz-10)的两种内肽酶被选择用于在本实施例中通过显微镜分析,以评估它们在酶温育后的组织学活性。
[0201]
将新鲜拔出的胡须毛收集在10个样品中并固定在载玻片上(图3)。总共制备了6个样品。一个样品未经处理并直接染色并成像(8)。将其他毛发样品在以下溶液中温育。一个样品是阴性对照(200μl 50mm tris ph 8,2mm cacl2缓冲液(9)),两个样品用hz-2(200μl 1ppm hz-2(10)或200μl 30ppm hz-2(11)在相同的缓冲液中)温育,两个样品用hz-10(200μl 1ppm hz-10(12)或200μl 30ppm hz-10(13)在相同的缓冲液中)处理。为了避免蒸发,载玻片被覆盖,并在30℃下温育3小时。毛发用0.5m hcl irs染色剂中的红色1%dmaca和紫色/蓝色ors染色剂染色,所述紫色/蓝色ors染色剂包含在mci lvane缓冲液ph=3.6中的2.5mg/ml甲苯胺蓝与在walpoles缓冲液ph=4.4中的0.1%rho-damine b的1:1混合物,并且立即使用光学显微镜和40倍放大率成像。从图3的每个样品中的2-3个代表性毛发可以观察到,阴性对照(9)的ors相对于未处理的对照(8)没有变化。对于30ppm hz-10温育(13),温育后仅留下完全角化的毛干,对于1ppm hz-10温育(12),可以看到较少的抗性但仍然角化的irs。对于30ppm hz-2温育(11),在温育后观察到ors的内部,对于1ppm hz-2温育(10),显然ors组织仅水解到足以溶胀至阴性对照的两倍大小。数据表明,与hz-10相比,尽管特异性较窄,但从细胞和组织破坏的角度来看,hz-2有效地以较不积极的方式破坏or。选择性组织破坏对于本发明而言是优选的,因为它限制了不希望的副反应以确保更安全的治疗。
[0202]
实施例7:谷氨酰内肽酶有效水解人ors组织中的i型和i i型角蛋白
[0203]
本实施例记录了人ors组织的谷氨酰内肽酶蛋白底物。表1中列出的seq id no:1(hz-2)的内肽酶在实施例1和实施例3中给出阳性反应并且在实施例4中稳定并且在实施例5和实施例6中显示出显著活性,使用sds-page分析其特异性水解ors组织蛋白的能力。
[0204]
在eppendorf管中的5个样品中收集新拔出的胡须毛。总共制备了3个样品(图4)。将样品在30℃下在缓冲液中温育30分钟。一个样品是阴性对照(50mm tris/hcl,ph 8,0.1%的triton x-100和2mm cacl2缓冲液),一个样品与hz-2(200μl 1ppm在相同缓冲液中)一起温育,一个样品与hz-2(200μl 5ppm在相同缓冲液中)一起温育。温育后,小心地除去上清液,剩余的组织在30℃下在8m尿素、2%sds、100mm dtt和100mm tris/hcl、ph8中裂解30分钟。由于irs和毛干的溶解性较差,提取的绝大部分蛋白质来源于ors,这通过在裂解前后在显微镜下观察ors的缺乏来证实(数据未显示)。使用10kda分子截止旋转过滤器浓缩蛋白质,并使用用考马斯蓝染色的sds-page分离以显现蛋白质组。使用mes缓冲液和10%bolt bis-tris plus凝胶。结果显示在图4中。使用pageruler plus预染蛋白质梯(14)(thermofischer scientific)鉴定对应于凝胶中条带的近似绝对大小。阴性对照(15),1ppm hz-2(16)和5ppm hz-2(17)被均等地加载。可以观察到,本领域技术人员将得出的两个强烈染色的条带组主要对应于ors的i型(50-60kda)和ii型(60-70kda)角蛋白。在所述条件下,只有1ppm hz-2降解了i型角蛋白,而5ppm hz-2在实验过程中完全降解了i型和ii型,两者都使多重带完好无损。结果表明,hz-2是一种有效的选择性ors角蛋白酶。由于or的i型和ii型角蛋白是毛发锚定所需要的,是毛囊性角化过度和闭塞的效应分子,并支持毛囊的功能和完整性,它们通过hz-2的选择性水解解释了实施例1和3中观察到的脱毛以及谷氨酰内肽酶如hz-2的组合物如何用于治疗毛囊相关病症和毛囊皮肤病。
[0205]
实施例8:谷氨酰内肽酶选择性破坏健康人皮肤中的ors组织
[0206]
该实施例说明了人皮肤中谷氨酰内肽酶对ors组织的选择性破坏。表1中列出的能够在实施例1和实施例3中脱毛并且在实施例4中稳定并且在酶温育后通过组织学评估分析实施例5和6中显示出显著活性的两种内肽酶seq id no:1(hz-2)和seq id no:7(hz-10)。
[0207]
来自一个健康的女性志愿者的一个6毫米穿孔腋窝皮肤活检使用切片机冷冻切片成10μm切片。将皮肤切片置于载玻片上进行显微镜检查。制备了横向穿过毛囊切割的三个代表性的相邻皮肤切片,并且在图5(18)中以40x放大率显示了概况。将组织切片在载玻片上的一滴缓冲溶液中(并覆盖以防止蒸发)在30℃下温育30分钟,并从毛干和ors周围(18)中的圆圈区域使用光学显微镜以400x放大率观察。一个切片是阴性对照(50mm tris/hcl ph 8和2mm cacl2缓冲液(19)),下一个切片与hz-2(100ppm hz-2在相同缓冲液(20)中)一起温育,并且下一个切片与hz-10(在相同缓冲液(21)中100ppm hz-10)一起温育。温育后,切片用苏木精和曙红(18-21)或2.5mg/ml甲苯胺蓝(在mcilvane缓冲液ph=3.6中)和0.1%罗丹明b(在walpoles缓冲液ph=4.4中)染色10分钟,然后用1%罗丹明b(在walpoles缓冲液ph=4.4中)染色1分钟(22-24)。从图5中显示的数据可以观察到,hz-2(20)选择性地将ors组织破坏成细胞团块(黑色箭头),表明与阴性对照相比主要是细胞间ors效应,同时使真皮保持完整并且与阴性对照可比(灰色箭头)。然而,hz-10(21)破坏了ors细胞内容物,同时明显保持ors组织完整,表明主要是细胞内ors效应(黑色箭头),同时明显消除了真皮胶原蛋白中存在的细胞核(灰色箭头)。使用200x放大倍数的荧光显微镜,用绿光激发罗丹明b染色,提供改善的对比度,并显示相比阴性对照(22,黑色箭头中的ors)的hz-2(23,白色箭
头中的ors)和在所述条件下,hz-10(24,白色箭头中的ors)也没有显著破坏经历表皮角质化的非ors组织(在(22,23)中比(24)中更多的白色组织),例如irs(在(23,24)中的白色箭头)和表皮(未显示)。这表明hz-2的脱靶活性明显低于hz-10,同时有效破坏了ors组织。如本发明的组合物和用途所述,hz-2所见的效果对于有效和安全地治疗毛囊相关病症和皮肤皮肤病是最需要的。
[0208]
实施例9:谷氨酰内肽酶选择性破坏病变性化脓性汗腺炎皮肤中的ors组织
[0209]
该实施例说明了化脓性汗腺炎患者皮肤中谷氨酰内肽酶对ors组织的选择性破坏。表1中列出的在实施例1和实施例3中给出阳性反应并且在实施例4中稳定并在实施例5-6和实施例8中显示显著活性的两种内肽酶seq id no:1(hz-2)和seq id no:7(hz-10)用于治疗患者组织,随后在酶温育后通过组织学评估进行分析。
[0210]
将来自患有中度化脓性汗腺炎且具有明显炎症特征的女性志愿者的10x10x8mm腋窝病变皮肤切除活组织检查(图6,(25))完全悬浮于阴性对照(125mm tris/hcl ph 8,0.25%的triton x-100和5mm cacl2缓冲液)或hz-2(在相同缓冲液中的500ppm hz-2)在30℃下温育3小时。将样品在10%福尔马林中固定一周,然后使用真空干燥并包埋在石蜡中。在将皮肤附属物定位到载玻片上后,使用切片机将样品切成4μm切片,通过在60℃下熔化1小时使样品脱石蜡,在tissue clear、99%乙醇、70%乙醇和去离子水中洗涤。将组织在boin固定剂中重新固定过夜后将样品染色,用去离子水彻底洗涤,用新鲜weigert's铁苏木精染色10分钟,用去离子水洗涤,用苦味酸10%sirius red复染15分钟并在99%乙醇中脱水2次。
[0211]
在图6中所示的激发sirius red后的200倍变焦荧光显微镜图像中可以观察到,每个处理条件下有两个不同的代表性切片,具有角质化迹象阴性对照病变前(prelesional)毛囊(26),闭塞的毛囊囊肿(27),而hz-2选择性地破坏了两个病变前毛囊中的ors组织(28),使ors细胞在毛干周围分离,并使周围的真皮保持完整。hz-2也似乎通过使囊肿空置而降解早期毛囊囊肿(29)。总之,就像实施例8中健康患者的ors一样,hz-2对来自化脓性汗腺炎患者的病变的和可能前囊性的ors组织具有活性,因此也可能对患有多种毛囊相关病症和针对治疗的毛囊皮肤病的患者的定向通过本发明的组合物和用途治疗的组织具有相同的作用。
[0212]
实施例10:谷氨酰内肽酶促进蛋白质的局部毛囊递送
[0213]
该实施例显示具有hz-2的组合物促进高分子量化合物如蛋白质(此处为酶本身)的毛囊递送,如反射纳米颗粒在毛猪皮毛囊内的渗透增加所示。表1中列出的在实施例1和实施例3中给出阳性响应并且在实施例4中稳定并且在实施例5-6和实施例8-9中显示出显著的活性的两种内肽酶seq id no:1(hz-2)和7(hz-10)和组织通过反射共聚焦激光显微镜分析。
[0214]
在图7中,使用包含25mm tris/hcl、ph 8、150mm nacl、1%span20表面活性剂、2mm山梨酸钾、5mm cacl2的缓冲液作为阴性对照。缓冲液与实施例3的局部实验中使用的组合物非常相似,仅缺乏dtt。如图2和实施例3所示,将阴性对照,hz-2(在相同缓冲液中500ppm hz-2)和hz-10(在相同缓冲液中500ppm hz-10)严格局部添加到猪耳背侧(6),但是没有先前的微针穿孔。将皮肤切片在4℃下温育20小时,然后在30℃下胶合在pmma方块上温育5小时。弃去缓冲液并除去pmma方块后,将得到的酶处理的猪皮样品在冰上保持长达2小时直至
分析开始。
[0215]
将毛发修剪至3mm长,并使用戴手套的手指将在800nm处具有峰值吸收的120nm二氧化硅芯金纳米颗粒(gnp)(ce 612960,seb-250,sebacia inc.)按摩到皮肤中2分钟。通过使用830nm反射共聚焦激光显微镜进行面部分析,将gnp渗透用作皮肤和毛囊ors酶活性的报告因子(图7)。gnp通过在穿透毛囊时在图像中的毛发周围具有增加的反射率来增强显微镜图像的对比度。在没有(30)和添加gnp(31)之后以0μm进行扫描。在实验期间,测量皮肤表面下188μm(32)和300μm(33)处的反射率以评估每个样品的gnp穿透深度。
[0216]
发现gnp仅渗透到188μm(34)的深度,但没有渗透到阴性对照(37)300μm的深度。值得注意的是,hz-2允许gnp穿透到300μm的深度(35,38),这相当于毛囊漏斗的大部分和酶需要被递送以治疗毛囊性皮肤病(如化脓性汗腺炎)的毛囊相关作用部位。然而,非特异性hz-10未能超过188μm(36),在300μm深度(39)没有留下gnp痕迹。300μm是共聚焦激光显微镜的技术极限,表明hz-2更深。该实施例进一步说明了hz-2增加向毛囊递送纳米颗粒的能力,这是配制基于酶和其他药物的期望方式,通过毛囊或在某些情况下经毛囊递送来治疗疾病。本实施例进一步说明了使用hz-2增强其他小和大化合物对毛囊的渗透性的可能性,包括蛋白质如hz-2酶本身或在谷氨酸特异性hz-2存在下稳定的任何其他蛋白质或任何从局部递送中工业受益的药物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1